胞磷胆碱又称胞嘧啶核苷二磷酸胆碱,属于核苷酸衍生物,相对分子质量为489.33,在水中溶解度较大。胞磷胆碱主要以钠盐形式存在,其分子质量为510.3,为无臭白色结晶。胞磷胆碱在生物体的生理生化过程中起重要作用,是卵磷脂合成的重要前体物[1]。在医药方面,胞磷胆碱对抑郁性疾病以及脑外伤导致的意识障碍有很好的治疗效果[2],可改善阿尔兹海默症、帕金森综合征,恢复耳鸣、头昏等[3]。除此之外,随着我国老龄化人口愈发严重,胞磷胆碱也作为一种治疗脑类相关疾病的药物被广泛使用,胞磷胆碱的市场需求量也越来越大[4]。
目前生产胞磷胆碱的主要方法为化学合成法和微生物发酵法,化学合成法是以胞嘧啶核苷磷酸吗啉和磷酸胆碱盐酸盐在乙腈或吡啶中缩合形成胞二磷胆碱[5],但此方法生产成本较高,原料大多为有毒试剂。微生物发酵法是目前生产胞磷胆碱的最优方法,通过微生物细胞内嘧啶核苷从头合成途径来积累前体物CTP,在发酵过程中添加前体物氯化胆碱和磷酸盐,通过细胞中的酶来合成胞磷胆碱[6],具体合成途径由图1所示。生物发酵法成本低,副产物少,反应速度快,但也存在转化率低等问题。
由图1可知,胞磷胆碱是以氯化胆碱和磷酸盐作为底物生成,传统发酵以氯化胆碱、磷酸二氢钾和磷酸二氢钠作为底物供体,大量的K+、Na+使菌体长期处于高渗透压的环境下,破坏了微生物的细胞膜和菌体内的酶[7],因此在发酵后期菌体活力大幅下降,产酸停滞。大量Cl-存在对不锈钢有腐蚀作用,损害发酵罐罐体,造成一定的经济损失[8]。磷酸胆碱作为中间产物,可直接与CTP反应生成胞磷胆碱,采用磷酸胆碱作为底物直接发酵法生产胞磷胆碱工艺简单,消除了Cl-、K+、Na+的影响,但由于磷酸胆碱成本太高,不适合大规模生产。因此在不影响成本的前提下,为了消除底物对发酵的影响,本研究首先采用电渗析法对氯化胆碱溶液中的Cl-分离,电渗析(electrodialysis,ED)技术是将溶液中带电电场和离子交换膜选择性的共同作用下进行分离的一种电化学过程。电渗析膜浓缩系统的原理是利用电渗析膜对离子选择透过性而使不同的物质得到分离,它具有无相变、分离效率高、可在常温下进行、无化学变化、节能、设备简单、卫生程度高、操作方便和自动化程度高等优点[9]。但由于电渗析法安装较为复杂且脱盐效果不太彻底。本研究还采用了离子交换树脂,除去氯化胆碱中的氯离子,将所得的胆碱溶液使用磷酸中和,制得磷酸胆碱溶液,用于胞磷胆碱后续发酵生产,解决了高盐离子导致的发酵问题。交换树脂分为阳离子和阴离子交换树脂,强碱性阴离子交换树脂是一种广泛应用的高效阴离子交换树脂,因其具有比表面积大、含有季胺基官能团、运行简单等优点,被广泛应用于吸附硝酸盐、磷酸盐、活性染料和其他阴离子污染物[10],实际上,市面上交换树脂型号众多,分离工艺复杂,因此对离子交换树脂的选型与分离工艺优化同样重要。
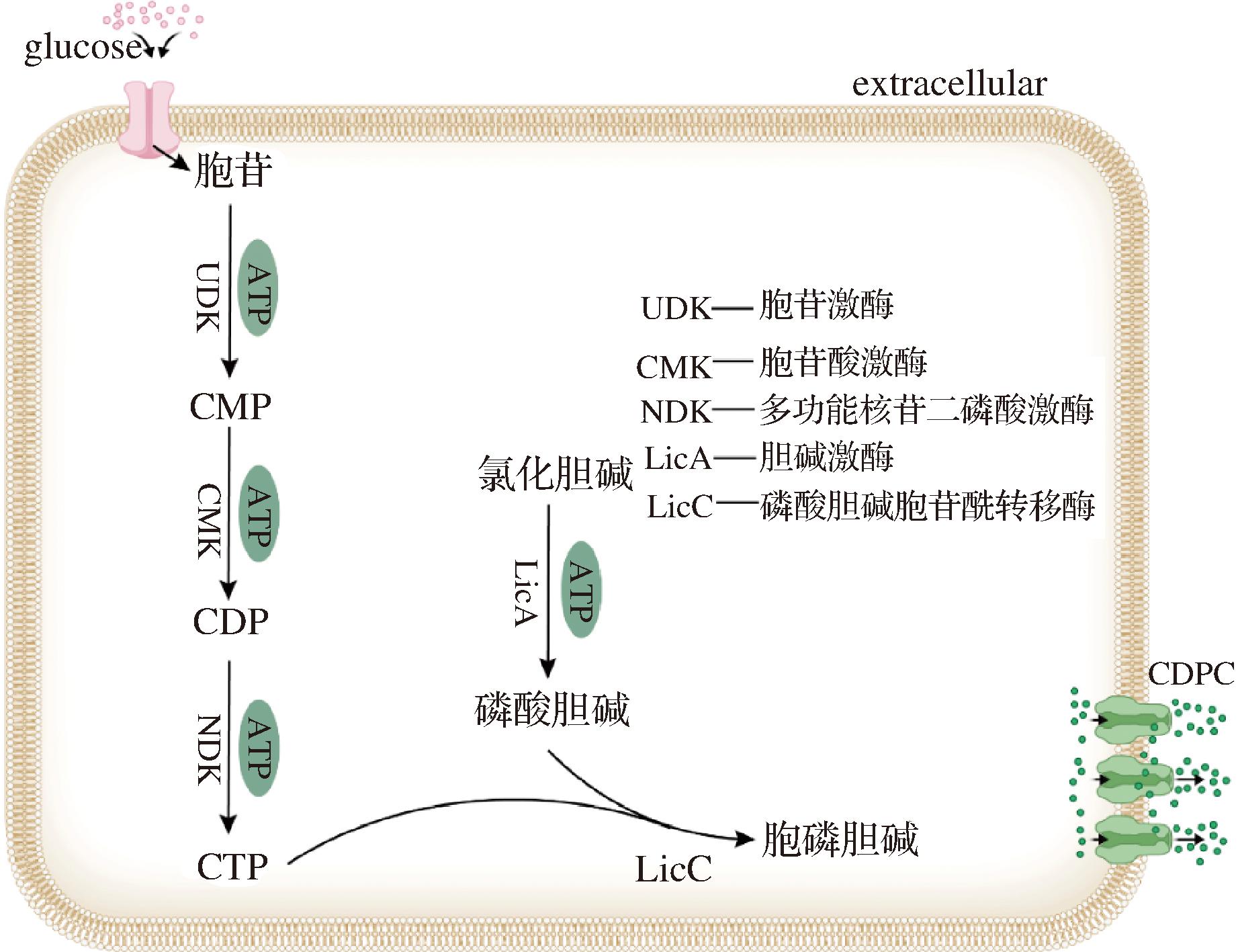
图1 胞磷胆碱合成示意图
Fig.1 Schematic diagram of cytarabine synthesis
因此本研究以胞磷胆碱产量以及生物量为指标,首先探究了4种不同的发酵工艺以及底物对胞磷胆碱发酵的影响。为了消除Cl-、K+、Na+对发酵的影响,采用电渗析法和离子交换树脂分别对底物氯化胆碱进行预处理,并向得到的胆碱溶液中加入磷酸。其中,2种底物预处理方法均提高了发酵后期菌体活力以及胞磷胆碱产量。但离子交换树脂吸附效率较高且使用成本低,因此对离子交换树脂进行深入探究,利用单因素试验,对不同树脂型号、洗脱液浓度、再生液种类以及树脂稳定性进行研究,最终确定了最适的树脂型号与氯离子吸附、洗脱工艺。与直接使用磷酸胆碱作为底物发酵[11]进行对比,胞磷胆碱产率与生产强度相近,但本研究采用交换树脂,极大地降低了生产成本,对于后期胞磷胆碱工业化生产更具有指导意义。
1 材料与方法
1.1 菌种
CDPC-01,天津科技大学代谢工程实验室提供。
1.2 培养基
1.2.1 种子培养基
葡萄糖30 g/L,柠檬酸1 g/L,酵母粉5 g/L,蛋白胨2 g/L,磷酸二氢钾2 g/L,(NH4)2SO4 2 g/L,MgSO4·7H2O 0.5 g/L,维生素B1、维生素B3、维生素B5、维生素B12 2 mg/L,微混1 mL/L,维生素H 1 mg/L,齐霉素50 mg/L。
1.2.2 发酵培养基
葡萄糖20 g/L,柠檬酸1 g/L,酵母粉4 g/L,(NH4)2 SO4 2 g/L,MgSO4·7H2O 2 g/L,蛋白胨2 g/L,磷酸二氢钾7 g/L,磷酸二氢钠2 g/L,氯化胆碱3 g/L,维生素B1、维生素B3、维生素B5、维生素B12 2 mg/L,微混1 mL/L,维生素H 0.5 mg/L,蛋氨酸0.3 g/L,FeSO4 20 mg/L,齐霉素50 mg/L,IPTG 0.25 mmol/L。
1.3 仪器与设备
722G紫外分光光度计,上海菁华科技仪器有限公司;5 L自动控制发酵罐,上海保兴生物设备工程有限公司;Agilent1200高效液相色谱仪、SBA-40ES生物传感分析仪,济南延和生物科技有限公司;PHSJ-4F型实验室pH计,上海仪电科学仪器股份有限公司。
1.4 培养方法
1.4.1 菌种活化
二代活化:a)将菌种从甘油管中接到斜面培养基中活化培养12 h;b)将斜面培养基上的菌株接入到茄形瓶中进行二次传代培养12 h[12]。
1.4.2 摇瓶发酵培养
采用500 mL挡板瓶,总发酵体系为30 mL,接种量为总发酵体系的10%,以苯酚红作酸碱指示剂,过程使用注射器注射氨水调节pH,培养36 h[13]。
1.4.3 5 L发酵罐培养
1.4.3.1 种子培养
种子罐发酵液体积为2 L,发酵温度为37 ℃,搅拌转速为200 r/min,溶氧保持在40%~50%,通过流加氨水溶液维持发酵液pH值为7.0左右,当OD600 nm=25时接种发酵[14]。
1.4.3.2 发酵培养
发酵罐发酵液体积为2 L,接种量为体系的20%,发酵温度为37 ℃,搅拌转速为200 r/min,溶氧保持在40%~50%,通过流加25%氨水维持发酵液pH值为7.0左右。
1.5 检测与分析方法
1.5.1 pH、溶氧、温度值测定
发酵过程中的pH、溶氧、温度通过发酵罐的智能检测系统实时检测,并通过pH计进行实测,以实现更为精准的发酵过程控制[13]。
1.5.2 菌体量测定方法
发酵过程中每2 h取1次样,取样稀释一定倍数之后,分光光度计(600 nm处)测定菌体量。
1.5.3 胞磷胆碱及副产物测定
发酵液胞磷胆碱产量采用LC20AT高效液相色谱仪测定,残糖及谷氨酸检测采用SBA生物传感分析仪测定。
1.6 糖酸转化率计算公式
糖酸转化率的计算如公式(1)所示:
糖酸转化率![]()
(1)
式中:m为产物质量浓度,g/L;V为发酵液体积,L;M为添加糖的总量,g。
为保证数据的准确性,每个数据取3次平行实验的平均值。
1.7 实验方法
1.7.1 电渗析法
电渗析法包括膜的准备、电荷层的建立、应用电场、清洗与回收样品4步。
1.7.1.1 膜的准备
选择正确的膜材料以及适合的孔径大小,以实现分离和过滤功能。
1.7.1.2 电荷层的建立
膜浸泡在电解液溶液中,此时电解液中的正负离子会吸附至膜表面,形成电荷层。
1.7.1.3 应用电场
将阴极与阳极分别插入电解液中,电场建立,此时正负离子在电场吸引的作用下通过膜实现物质的分离。
1.7.1.4 清洗与回收样品
随着时间的推移,物质被分离到阴极和阳极上,将产物暴露在电解液中,允许其中的物质重新散布回溶液中,以便以后再次分离使用。
1.7.2 离子交换树脂
离子交换包括树脂选型、预处理、装柱、上样、样品、再生6步。其操作流程如图2所示。
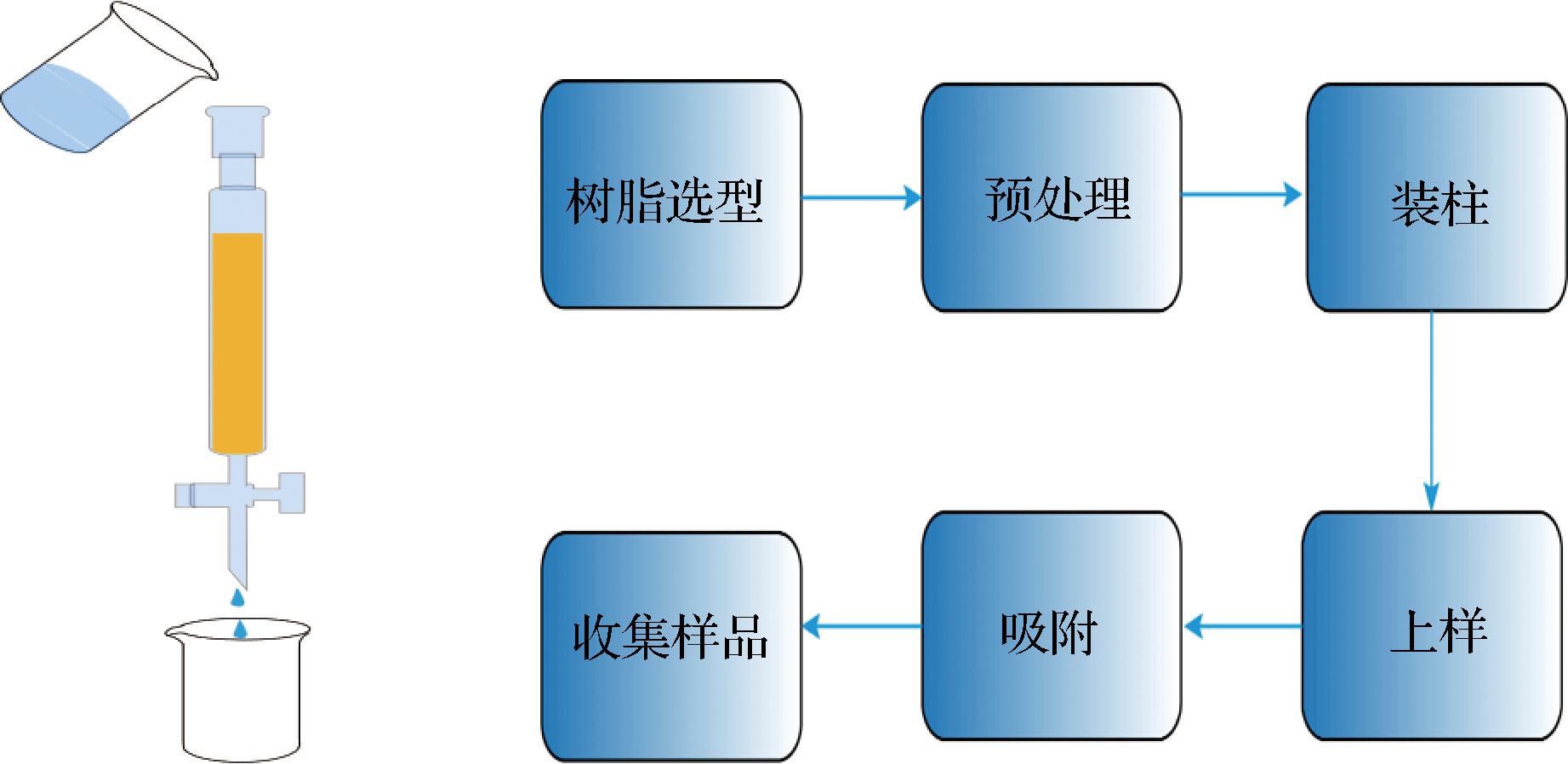
图2 离子交换树脂及其操作流程
Fig.2 Ion exchange resin and its operation process
1.7.2.1 树脂的选型
本研究选取3种弱碱性阴离子交换树脂,分别为A100、A103、A105,3种强碱性阴离子交换树脂,分别为A201、A400、A600,研究不同强度的树脂对吸附能力的影响。
1.7.2.2 树脂预处理与装柱
将树脂溶于去离子水倒入干净容器内并浸泡12~24 h,使树脂充分膨胀[15]。将交换柱清洗干净,然后把提前处理好的树脂倒入柱中,注意不能形成气泡,否则会影响吸附能力。洗脱液中氢氧化钠浓度越高,离子交换柱的交换速率也就越快,因此为了确定最适的氢氧化钠浓度,实验采用不同浓度的氢氧化钠溶液测定洗脱收率。
1.7.2.3 上样与再生
将配制好的氯化胆碱溶液以一定流速倒入离子交换柱,上进下出流向进行,开始运行后,待流出液pH≥8时,在取样口收集流出液。吸附完成以后,采用氢氧化钠溶液和氨水分别进行再生,比较产品收率的不同。
2 结果与分析
2.1 底物对胞磷胆碱发酵的影响
为了探究不同底物对胞磷胆碱发酵的影响,本研究选取5种发酵工艺,以胞磷胆碱产量和菌体生物量作为指标结果如图3所示。
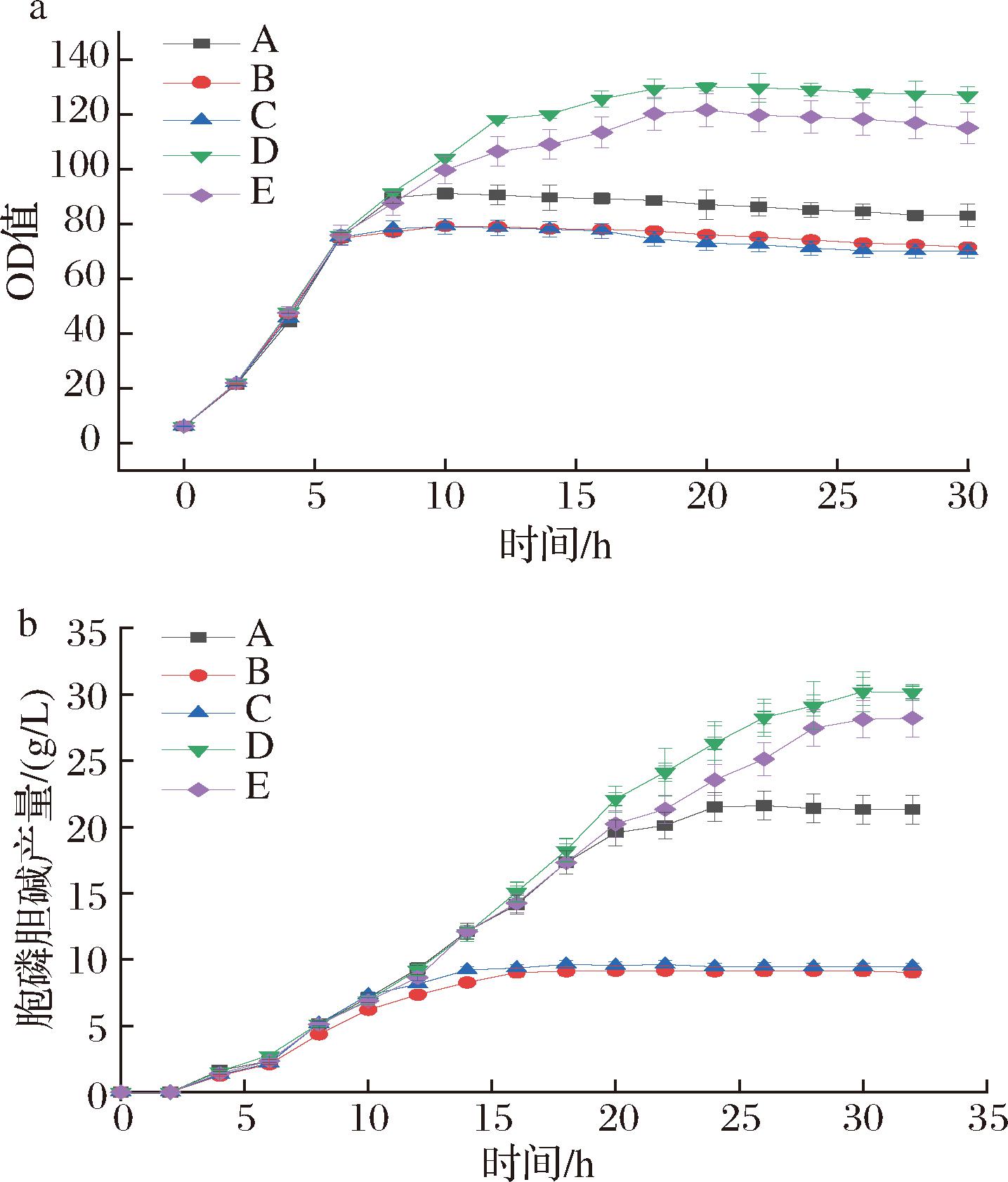
a-菌体生物量;b-胞磷胆碱产量
图3 不同底物对胞磷胆碱发酵的影响
Fig.3 Effect of different substrates on the fermentation of cytosolic choline
注:A工艺以氯化胆碱、磷酸二氢钾、磷酸二氢钠为底物发酵;B工艺以氯化胆碱、磷酸二氢钾为底物发酵;C工艺以氯化胆碱、磷酸二氢钠为底物发酵;D工艺以磷酸胆碱为底物发酵;E工艺以氯化胆碱、磷酸溶液为底物发酵。
由图3可知,D组生物量和胞磷胆碱产量最高,分别为130.1 g/L和30.21 g/L。而其他3组以氯化胆碱作为底物,在发酵中后期,菌体活力受到Cl-的影响,菌体生物量大幅下降;K+、Na+的大量添加,细菌细胞脱水,提前进入衰亡期。其中,B、C组缺少了K+、Na+离子泵[16]的调节,细胞膜的渗透失衡,细胞体态被破坏,不能支持细菌自身基本的生理活动,生物量和胞磷胆碱产量为4组中最低。而D组中磷酸胆碱作为底物,消除了上述的不利因素,但由于磷酸胆碱成本过高,对于胞磷胆碱大规模生产没有意义,不利于大规模的工业化生产。E组使用氯化胆碱和磷酸溶液作为底物,OD和胞磷胆碱产量均高于A、B、C组,使用磷酸溶液虽去除了高渗透压环境带来的危害,但大量氯化胆碱的添加依旧对菌体活力产生不利影响。
因此针对2.1节中出现的实现问题,本研究拟通过电渗法和离子交换树脂除去氯化胆碱中的氯离子,并将所得胆碱溶液使用磷酸中和,得到磷酸胆碱溶液,作为底物用于胞磷胆碱的发酵生产,本研究进一步探究了影响氯离子吸附能力的关键影响因素,提高胆碱收率并降低生产成本。
2.2 不同底物处理方法对发酵的影响
2.2.1 电渗析法消除Cl-对发酵影响研究
本研究针对底物氯化胆碱中氯离子对菌体的伤害,采用电渗析法,在直流电场的驱动下,使氯离子透过阴离子交换膜进入阳极液中,实现纯胆碱溶液的回收,再向得到的胆碱溶液中加入磷酸溶液,得到磷酸胆碱。之后在5 L发酵罐中进行发酵验证,以菌体量和胞磷胆碱产量为指标,探究底物的预处理对发酵的影响。其中底物未处理为对照组,底物经电渗析法处理后加入磷酸溶液为实验组,结果如图4所示。
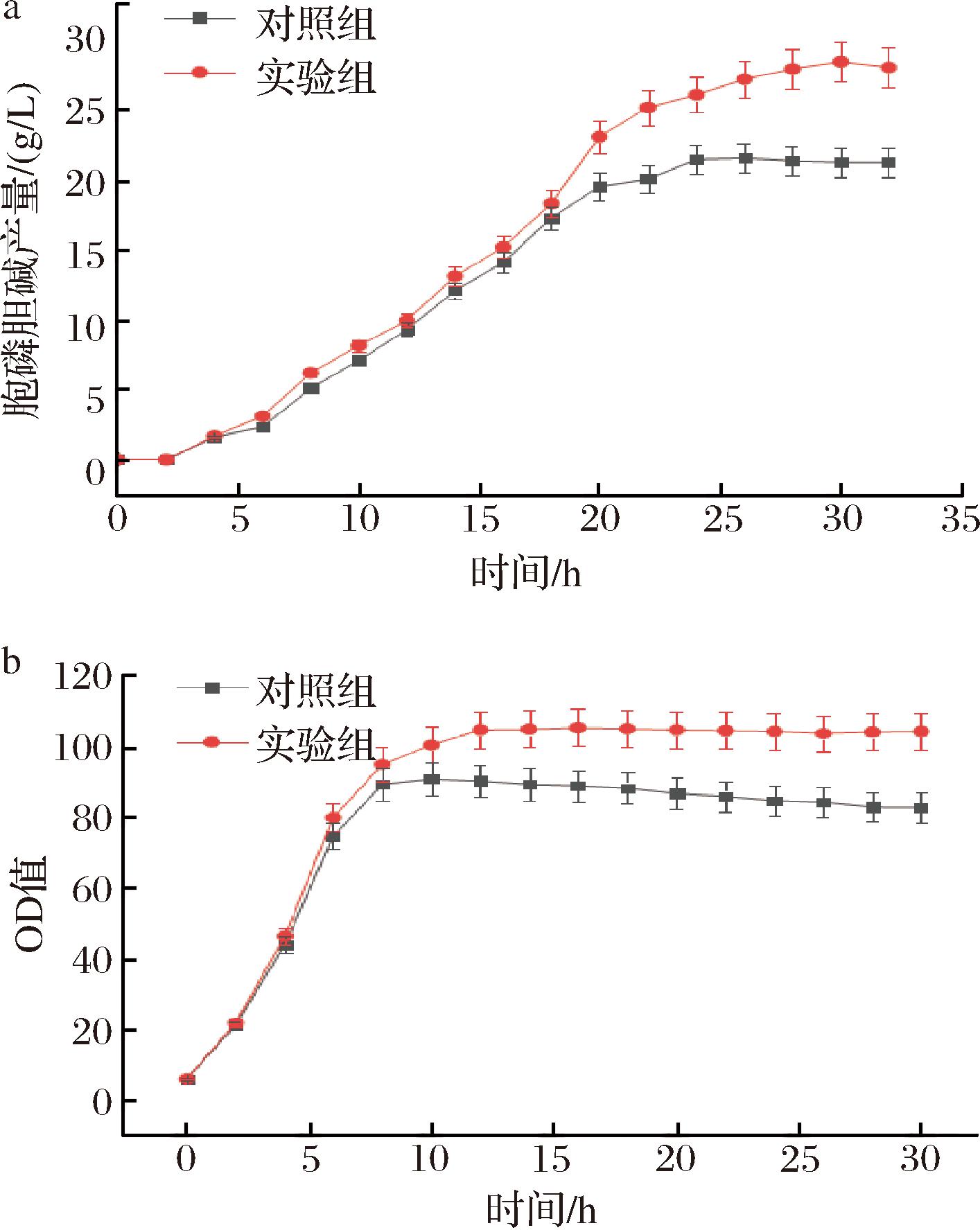
a-胞磷胆碱产量;b-菌体生物量
图4 电渗析法处理底物前后菌体量、产量对比
Fig.4 Comparison of bacterial volume and yield before and after substrate treatment by electrodialysis
由图4可知,底物经电渗析法处理后,消除了Cl-的影响,其菌体量和胞磷胆碱产量均高于对照组,较对照组分别提高了13.7%和24.2%,发酵中后期菌体活力及产酸能力得到提升。但对于胞磷胆碱工业化生产来说,电渗析法能耗较大,脱盐效果不太彻底,且设备组成大多为塑料,易结垢,浓缩分离膜寿命短,后期设备维修费用较大[17],这无疑违背了本研究的初衷。而离子交换树脂具有成本低、吸附效率高、还能再生重复利用等特点,因此,本实验采用离子交换树脂对底物氯化胆碱进行预处理,研究离子交换树脂的吸附效率以及对发酵的影响。
2.2.2 离子交换树脂消除氯离子对发酵的影响
2.2.2.1 不同树脂吸附能力的研究
首先进行树脂选型,不同类型的离子交换树脂对离子的体积交换容量、洗脱时间以及洗脱收率也有很大区别,本研究选用A100、A103、A105、A201、A400、A600六种不同强度的阴离子交换树脂,探究对胞磷胆碱发酵的影响,其结果如图5所示。
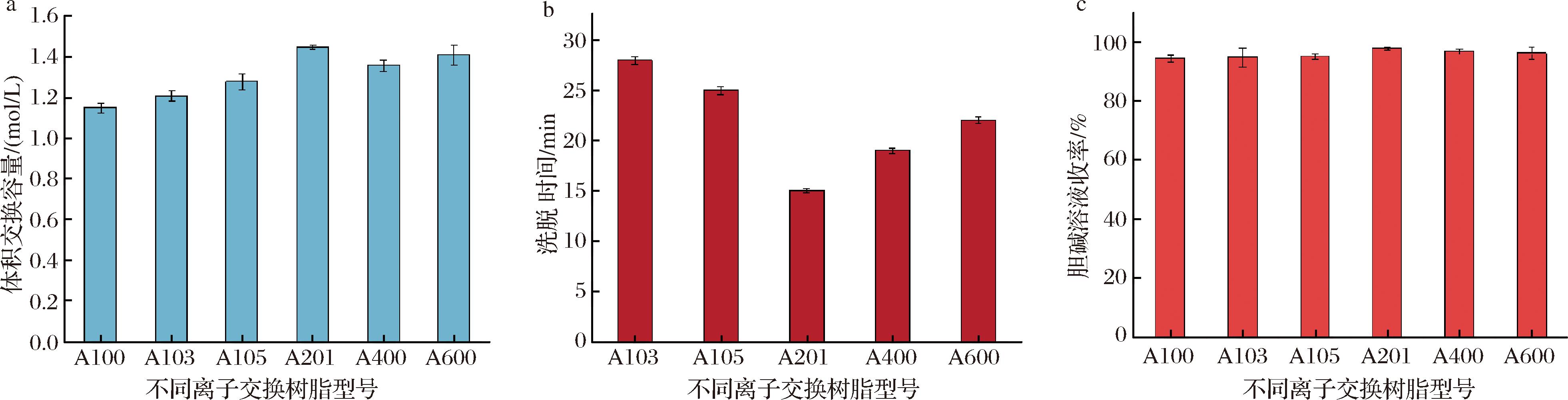
a-体积交换容量;b-洗脱时间;c-胆碱溶液收率
图5 不同离子交换树脂的体积交换容量、洗脱时间、产品收率
Fig.5 Volumetric exchange capacity, elution time, and product yield of different ion exchange resins
图5显示的是不同树脂的体积交换容量、洗脱时间以及洗脱收率,显而易见实验所选取的强碱性阴离子交换树脂吸附强度均高于弱碱性阴离子交换树脂,这是由于吸附强度是由离子交换的亲和力决定的,这种亲和力与水合离子半径、电荷及离子的极化程度有关。由图可知,A201树脂体积交换容量最大,达到了1.45 mol/L,节省了交换批次与树脂用量[18]。实验上柱500 mL氯化胆碱溶液,根据洗脱时间和胆碱溶液的收集率,由图5可知,胆碱溶液收集率最高的为A201强碱性阴离子交换树脂。综上所述,比较上柱前后溶液中的胆碱浓度,得知A201阴离子交换树脂收集效率最高,达到了98.2%。最终选用A201作为实验用离子交换柱。
2.2.2.2 不同上柱的胆碱溶液浓度以及体积对吸附能力的影响
确定最适树脂型号后,在上样之前,为了确定最适的氯化胆碱浓度以及体积,以达到最高收率。本研究利用单因素试验分别以100、120、140、160 g/L确定最适的交换浓度,以200 mL/kg树脂、500 mL/kg树脂、800 mL/kg树脂、1 100 mL/kg树脂确定最适交换体积。结果如图6所示。
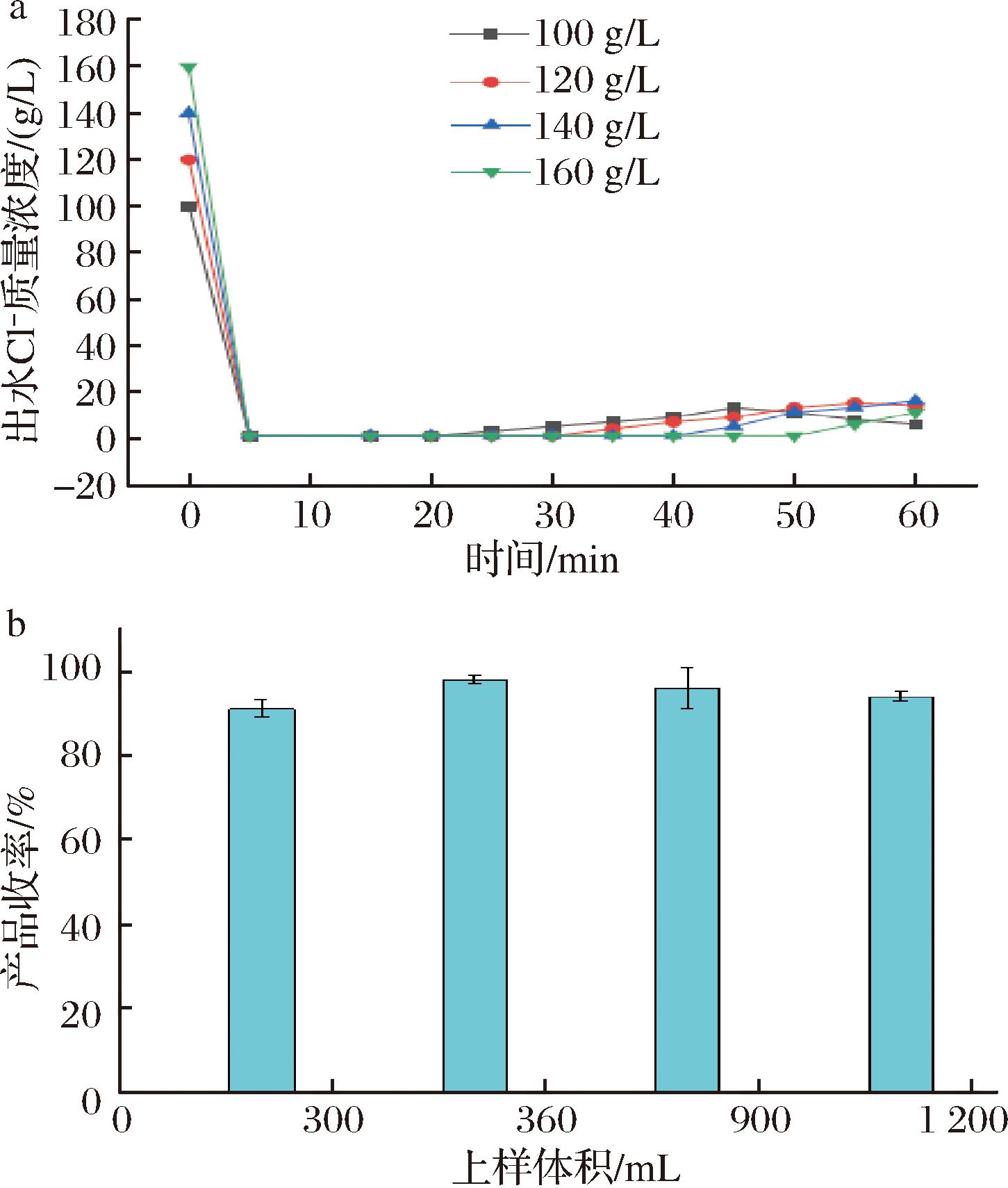
a-出水Cl-质量浓度;b-产品收率
图6 不同上柱的胆碱溶液浓度以及体积对吸附能力的影响
Fig.6 Effect of choline solution concentration and volume on the adsorption capacity of different upper columns
注:出水Cl-质量浓度为离子交换柱流出液Cl-质量浓度的简称。
由图6可知,当上样胆碱质量浓度为100 g/L时,其吸附周期为20 min,出水Cl-质量浓度仍小于1 g/L。当上柱胆碱质量浓度为120 g/L时,吸附周期为30 min,可保证出水Cl-质量浓度<1 g/L。当上柱胆碱质量浓度为140 g/L时,吸附周期为40 min,可保证出水Cl-质量浓度<1 g/L。当上柱胆碱质量浓度为160 g/L时,吸附周期为50 min,可保证出水Cl-质量浓度<1 g/L。因本研究采用的树脂型号相同,吸附容量基本一致,运行周期随上柱体积的变化而变化。因考虑到氯化胆碱溶解度以及发酵周期所需胆碱总量,最终选定上柱质量浓度为120 g/L。而由图5可知,当上柱体积为500 mL/kg树脂时,胆碱溶液收率最高,达到了98%,最终选用上柱体积为500 mL/kg树脂。
2.2.2.3 不同氢氧化钠浓度对吸附能力的影响以及再生后树脂稳定性研究
本次实验选用氢氧化钠溶液作为洗脱液,在离子交换柱中,决定洗脱顺序的关键因素为离子间的静电吸引[19],即氢氧化钠的浓度决定了离子交换的强度。因此为了确定最适的洗脱液浓度,本研究选取0.1、0.2、0.3、0.4、0.5 mol/L浓度的氢氧化钠溶液进行洗脱,分别观察胆碱溶液的收集效率。
树脂是可重复利用的,当吸附完成后,需要对树脂进行再生,以便下次使用[20]。本研究选用2种常用的再生剂对树脂进行再生,分别为氨水与氢氧化钠,再生效果根据吸附能力而定,2种再生剂的吸附效果如图所示。在前期本研究以确定最适树脂型号为A201,最适上柱氯化胆碱质量浓度为120 g/L,在其他条件均不变的情况下,对树脂的稳定性进行考察,即连续进行三批次的离子交换——再生——交换——再生实验[21],其稳定性如图7所示。
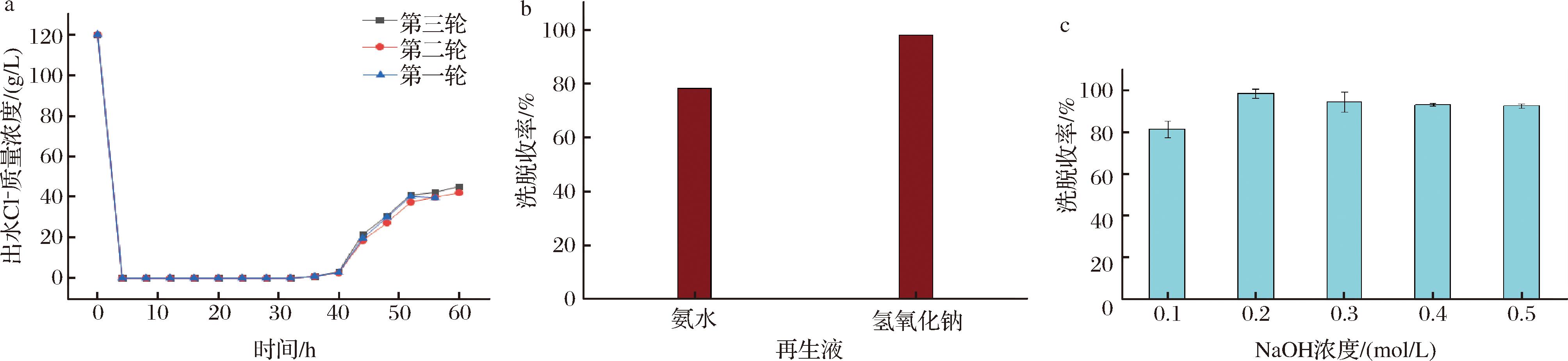
a-树脂稳定性;b-再生液洗脱收率;c-洗脱液洗脱收率
图7 不同洗脱液、再生液的洗脱效率以及树脂的稳定性
Fig.7 Elution efficiency of different eluent and regeneration solutions and stability of resin
由图7可知,使用0.2 mol/L浓度氢氧化钠作为洗脱液洗脱时分层较为明显且产品收率最高,达到了98.5%,最终选用0.2 mol/L浓度的氢氧化钠溶液作为洗脱液。
由图7可知,氨水作为弱碱,树脂再生后对Cl-的吸附效果低于氢氧化钠溶液,最终选用氢氧化钠溶液对树脂进行再生。由图可知,在氯化胆碱质量浓度为120 g/L左右时,连续运行36 h可保证出水Cl-质量浓度<1 g/L。进行3轮连续离子交换——再生后,运行周期较为稳定,说明此树脂稳定性较好。
综上实验所述,本研究最终选用A201强碱性阴离子交换树脂,上柱氯化胆碱浓度为120 g/L,上柱体积为500 mL/kg树脂,洗脱液氢氧化钠浓度为0.2 mol/L,再生溶液选用氢氧化钠溶液,在此情况下树脂吸附能力最强,产品收率最高。而此树脂的稳定性也得到了证实,因此本实验以A201离子交换树脂处理底物氯化胆碱并在5 L发酵罐中验证。
2.3 5 L发酵罐验证
常规胞磷胆碱发酵法是以氯化胆碱、磷酸二氢钾、磷酸二氢钠作为底物,ATP供能,在胞内进行催化反应生成。但随着底物氯化胆碱的持续添加,大量钾钠离子存在下使细胞处于高渗透压的环境,菌体生长受到抑制,导致菌体后期活力严重下降,产酸停滞,且后期发酵液变黑变黏稠,给下游产品的提取也带来一定的困难。而大量氯离子存在对不锈钢发酵罐有一定腐蚀伤害[22],且对菌体产生细胞毒性[23],不利于菌体生长。因此本研究采用强碱性阴离子交换树脂将氯化胆碱溶液中的Cl-吸附,得到纯胆碱溶液,再向溶液中加入磷酸溶液,将pH值调至4,得到磷酸胆碱溶液。在5 L发酵罐验证后发现发酵液颜色正常,偏暗黄色,解决了之前发酵液黏稠发黑的问题。本实验以常规发酵法为对照组,以实验所得磷酸胆碱溶液为实验组,在5 L发酵罐中进行发酵验证实验,实验结果如图8所示。
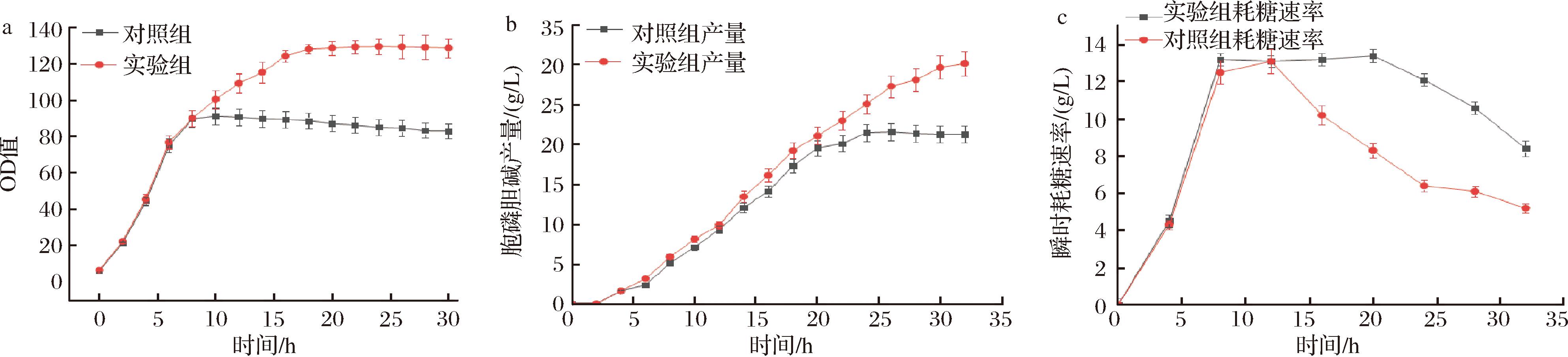
a-菌体生物量;b-胞磷胆碱产量;c-瞬时耗糖速率
图8 离子交换柱处理氯化胆碱前后生物量、产酸量、耗糖速率的对比
Fig.8 Comparison of biomass, acid production, and rate of sugar consumption before and after treatment of choline chloride with ion exchange columns
图8显示了离子交换柱处理氯化胆碱前后菌体生物量、产酸量以及耗糖速率的对比情况,2组在最高生物量上差距明显,且对照组在发酵后期菌体生物量骤降。这是因为长期向罐内添加磷酸二氢钾和磷酸二氢钠,高渗透压高盐的环境下会使细菌细胞脱水,极限状态下甚至导致细胞破裂,破坏生物体内正常的生理活动,菌体衰亡期提前。实验组在发酵后期菌体依然保持较高的活性,稳定期持续时间明显高于对照组,这无疑提高了发酵后期的产酸效率。由图8可知,实验组消除了Cl-的影响,最高产量为30.2 g/L,远远高于对照组,发酵后期瞬时耗糖速率高于对照组,分析原因是大量的Cl-对细菌细胞膜产生抑制作用,影响细胞膜合成,除此之外,Cl-过量还会透过细胞膜在胞内产生氯化作用[24],对细菌代谢过程中众多的酶系统,比如三羧酸循环、糖酵解过程产生抑制作用,这也是对照组发酵后期耗糖速率下降的原因,菌体生长受到抑制,耗糖速率下降,不能满足自身生长的需求,产酸自然也就停滞。因此消除Cl-对菌体的影响,才能保证菌体的生长和生产性能达到最高。
2.4 发酵成本对比
本研究选用氯化胆碱、磷酸二氢钾、磷酸二氢钠作为底物直接发酵法生产胞磷胆碱,而A201强碱性阴离子交换树脂消除了氯离子的影响,并向溶液中加入磷酸,对胞磷胆碱大规模生产有一定指导意义。氯化胆碱与磷酸盐在胆碱激酶的作用下可生成磷酸胆碱,直接进行下一步的反应。因此,本研究将2种发酵方法进行5 L发酵罐的实验对比,探究本实验的可行性,实验结果如图9所示。其中采用磷酸胆碱作为对照组,本研究所用方法为实验组。

a-菌体生物量;b-胞磷胆碱产量
图9 对照组与实验组OD、产量对比
Fig.9 Comparison of OD and yield between control and experimental groups
由图9可知,直接采用磷酸胆碱发酵法生产,其菌体生物量与产酸情况与本研究方法基本一致,使用磷酸胆碱作为底物同样消除了氯离子与磷酸盐给菌体带来的伤害,且使用磷酸胆碱直接发酵,工艺简单[25]。但为了实现胞磷胆碱大规模生产,本研究对比了2种方法的成本问题。得知工业级磷酸胆碱单价约3万元/t(食品级磷酸胆碱不能被菌体利用),在其他情况一致的条件下,氯化胆碱、磷酸二氢钾、磷酸二氢钠单价分别为1 000元/t、40元/t、15元/t,而本研究采用离子交换柱处理,且树脂可重复利用,相对于使用磷酸胆碱成本节省了85%,证明了此次实验的可行性,使廉价原料高效生产胞磷胆碱成为可能,同时对胞磷胆碱大规模工业化生产具有参考意义。
3 结论
氯化胆碱、磷酸二氢钾和磷酸二氢钠是发酵法生产胞磷胆碱的底物,但底物的大量添加使菌体处于高渗透压的环境下,发酵后期菌体活力下降,产酸停滞,同时对菌体也产生细胞毒性。本研究首先通过4种不同发酵工艺的对比,得知底物中影响胞磷胆碱发酵的关键因素为Cl-、K+、Na+。为了消除发酵中氯离子和钾钠离子对生产的影响,研究通过电渗析法和离子交换树脂对底物氯化胆碱进行预处理,但由于电渗析法分离效率较低且维修成本高,为了实现胞磷胆碱大规模生产,对离子交换树脂进行深层次的研究。选用不同强度的阴离子交换树脂,通过单因素试验,最终确定了最适树脂型号、洗脱液浓度、再生溶液以及树脂的稳定性,通过离子交换树脂得到胆碱溶液,再向溶液中加入磷酸,在5 L发酵罐中验证。研究发现,没有Cl-、Ka+、Na+的影响,菌体在发酵中后期仍然保持较高的菌体活力,稳定产酸。除此之外,本研究还与磷酸胆碱作为底物直接发酵生产胞磷胆碱进行成本比对,发现本研究在成本上节省了85%,证明了本次实验的可行性,对胞磷胆碱工业化生产有一定的指导意义。
[1] GIBELLINI F, SMITH T K.The Kennedy pathway: De novo synthesis of phosphatidylethanolamine and phosphatidylcholine[J].IUBMB Life, 2010, 62(6):414-428.
[2] SALVADORINI F, GALEONE F, NICOTERA M, et al.Clinical evaluation of CDP-choline (Nicholin):efficacy as antidepressant treatment[J].Current Therapeutic Research, Clinical and Experimental,1975, 18(3):513-520.
[3] TSUBAKI T, KASE M, ANDO K, et al.Therapeutic effects of Nicholin (CDP-choline):Parkinson’s syndrome: A double-blind study[J].Nihon Rinsho.Japanese Journal of Clinical Medicine, 1974, 32(11):3435-3450.
[4] MIYAKE H, HAYAKAWA I, TAKAKURA K.Treatment of head injuries with intermediate substances of the metabolic cycle of the brain.1.the use of Cdp-choline[J].Roczniki Akademii Medycznej im.Juliana Marchlewskiego w Bia ymstoku, 1964, 16:873-878.
ymstoku, 1964, 16:873-878.
[5] WATANABE S, SHIROTA S, HANEDA K, et al.Effects of cultural conditions on CDP-choline production by hydrocarbon assimilating yeasts:Enzymatic studies on nucleic acid related compounds of microorganisms (IV)[J].Journal of Fermentation Technology, 1981, 59:191-195.
[6] 胡晨龙. 代谢工程改造大肠杆菌制备胞二磷胆碱[D].天津:天津科技大学, 2021.HU C L.Metabolic engineering of Escherichia coli for CDP-choline production[D].Tianjin:Tianjin University of Science and Technology, 2021.
[7] 陈燕飞. 渗透压对细菌的影响[J].太原师范学院学报(自然科学版), 2012, 11(1):136-139.CHEN Y F.Osmosis for the influence of bacteria[J].Journal of Taiyuan Normal University (Natural Science Edition), 2012, 11(1):136-139.
[8] 郭勤, 韩文艳, 李江, 等.氯离子对氧化亚铁硫杆菌和氧化亚铁钩端微螺菌活性的影响[J].有色金属(冶炼部分), 2015(1):42-45;53.GUO Q, HAN W Y, LI J, et al.Effect of chloride ions on activity of Acidimicrobium ferrooxidans and Leptospirillum ferriphilum ferrous[J].Nonferrous Metals(Extractive Metallurgy), 2015(1):42-45;53.
[9] 张亚南, 马来波, 高春娟, 等.不同电流和电压对电渗析分离深层海水的影响[J].盐科学与化工, 2023, 52(1):26-29.ZHANG Y N, MA L B, GAO C J, et al.Effect of different current and voltage on electrodialysis separation of deep sea water[J].Journal of Salt Science and Chemical Industry, 2023, 52(1):26-29.
[10] 熊海波. L-异亮氨酸发酵过程控制优化及分离提取工艺研究[D].天津:天津科技大学, 2021.XIONG H B.Optimization of L-isoleucine fermentation process and study on separation and extraction technology[D].Tianjin:Tianjin University of Science and Technology, 2021.
[11] 易凤炎, 陈燕妮, 邱蔚然, 等.酿酒酵母生物合成胞磷胆碱的条件优化[J].工业微生物, 2016, 46(3):36-41.YI F Y, CHEN Y N, QIU W R, et al.Optimization of fermentation conditions for citicoline biosynthesis by Saccharomyces cerevisiae[J].Industrial Microbiology, 2016, 46(3):36-41.
[12] 陈志超, 王金多, 徐庆阳.微量元素与生长因子对L-苯丙氨酸发酵的影响[J].食品与发酵工业, 2022, 48(8):82-89.CHEN Z C, WANG J D, XU Q Y.Effects of trace elements and growth factors on L-phenylalanine fermentation[J].Food and Fermentation Industries, 2022, 48(8):82-89.
[13] 李澜潇, 王硕, 徐庆阳.金属离子及生长因子对核黄素发酵影响的研究[J].食品与发酵工业, 2023, 49(10):177-184.LI L X, WANG S, XU Q Y.Effects of metal ions and growth factors on riboflavin fermentation[J].Food and Fermentation Industries, 2023, 49(10):177-184.
[14] 陈志超, 李澜潇, 徐庆阳.大肠杆菌发酵生产L-苯丙氨酸新工艺研究[J].中国调味品, 2022, 47(12):84-89.CHEN Z C, LI L X, XU Q Y.Study on new technology of producing L-phenylalanine by fermentation of Escherichia coli[J].China Condiment, 2022, 47(12):84-89.
[15] 王娇, 代新英, 赵博雅, 等.离子交换树脂脱除氢氧化胆碱中Sb2+、Fe3+的研究[J].应用化工, 2023,52(5):1410-1413;1419.WANG J, DAI X Y, ZHAO B Y, et al.Study on the removal of Sb2+ and Fe3+ in choline hydroxide by ion exchange resin[J].Applied Chemical Industry, 2023, 52(5):1410-1413;1419.
[16] 郭继鸿. 离子泵(210)[J].临床心电学杂志, 2022, 31(1):75.GUO J H.Ion pump(210)[J].Journal of Clinical Electrocardiology, 2022, 31(1):75.
[17] 李世霖, 胡景泽, 王毅霖, 等.电渗析分离提取高值组分的研究进展[J].化工进展, 2023, 42(S1):420-429.LI S L, HU J Z, WANG Y L, et al.Research progress in separation and extraction of high value components by electrodialysis[J].Chemical Industry and Engineering Progress, 2023, 42(S1):420-429.
[18] 白亚磊, 冯宁, 孙家凯, 等.发酵液中L-异亮氨酸提取工艺研究[J].发酵科技通讯, 2010, 39(4):13-15.BAI Y L, FENG N, SUN J K, et al.Study on the extraction technology of L-isoleucine from fermentation broth[J].Bulletin of Fermentation Science and Technology, 2010, 39(4):13-15.
[19] 高健. 探讨离子交换树脂在水处理中的应用[J].皮革制作与环保科技, 2022, 3(2):10-12.GAO J.Discuss the application of ion exchange resin in water treatment[J].Leather Manufacture and Environmental Technology, 2022, 3(2):10-12.
[20] 吴欣森, 杨晔, 张杨, 等.离子交换树脂脱除高盐废水中Ca2+的特性研究[J].中国胶粘剂, 2023, 32(1):39-43;54.WU X S, YANG Y, ZHANG Y, et al.Study on characteristics of removing Ca2+from high-salt wastewater by ion exchange resin[J].China Adhesives, 2023, 32(1):39-43;54.
[21] 李雅, 张盈, 王美娇, 等.离子交换树脂除废水中Ni技术研究[J].有色金属(冶炼部分), 2021(10):121-125.LI Y, ZHANG Y, WANG M J, et al.Study on removal of Ni in wastewater by ion exchange resin[J].Nonferrous Metals(Extractive Metallurgy), 2021(10):121-125.
[22] 许航, 彭人民.奥氏体不锈钢发酵罐应力腐蚀裂纹探讨[J].机电技术, 2003, 26(2):36-39.XU H, PENG R M.Discussion on stress corrosion cracks in austenitic stainless steel fermentation tank[J].Mechanical &Electrical Technology, 2003, 26(2):36-39.
[23] 王卉. 氯离子对肝细胞癌细胞生物学行为的影响及机制的研究[D].遵义:遵义医科大学, 2022.WANG H.Study on the effect of chloride ion on biological behavior of hepatocellular carcinoma cells and its mechanisms[D].Zunyi:Zunyi Medical University, 2022.
[24] 韩彦飞. 三氯化铝对体外培养大鼠成骨细胞的毒性作用[D].哈尔滨:东北农业大学,2013.HAN Y F.Toxicity of AlCl3 on osteoblast of rats cultured in vitro[D].Harbin:Northeast Agricultural University, 2013.
[25] 李晓丹, 夏冰, 汪仁.酿酒酵母磷酸胆碱胞苷转移酶基因(cct)的克隆表达及活性测定[J].药物生物技术, 2014, 21(2):99-102. LI X D, XIA B, WANG R.Cloning, expression of cholinephosphate cytidylyltransferase of Saccharomyces cerevisiae in Escherichia coli and evaluation of the expressed product[J].Chinese Journal of Pharmaceutical Biotechnology, 2014, 21(2):99-102.