饮料酒中的高级醇是酿酒酵母发酵的副产物,是饮料酒酒体和风味的重要成分,对各种酒类典型风味的形成至关重要[1]。饮料酒中高级醇主要包括正丙醇、异丁醇、活性戊醇、异戊醇、苯乙醇等[2]。适量异戊醇可使酒体醇厚,香味幽雅;但异戊醇含量过高会使酒体口感苦涩[3]。异丁醇具有轻微的脂肪香和苦味感;正丙醇与乙醇有相似的香味,带有苦涩味;苯乙醇具有清甜的玫瑰花香,令人愉悦。因此,高级醇含量过低时会使饮料酒酒味淡薄,含量过高则产生令人不悦的异味。适量的高级醇可以增加饮料酒的协调感和饱满感,赋予饮料酒特殊的香气[4]。在发酵过程中,酿酒酵母可通过2种途径产生高级醇:氨基酸的分解代谢途径(Ehrlich途径)和糖的从头合成途径(Harris途径)。分解代谢途径中,氨基酸经转氨酶转化为α-酮酸;从头合成途径中,葡萄糖经糖酵解途径生成丙酮酸,进入线粒体后转化为α-酮酸。由这2种不同代谢途径生成的α-酮酸经脱羧、脱氢形成高级醇。因此,当氮源充足时,氨基酸通过Ehrlich途径转化为高级醇;氮源不足时,高级醇主要由糖的从头合成途径生成。根据高级醇的生成机理,培养基中氮源的氨基酸组成和浓度对酿酒酵母高级醇的代谢具有重要影响。氮源也是酵母细胞生长和代谢的关键因子,能够被酵母用于生长和代谢的含氮物质称为可同化氮(yeast assimilable nitrogen, YAN)。YAN由铵离子和游离α-氨基酸态氮组成,其中游离α-氨基酸态氮是YAN的最大组分,因此氨基酸的浓度和组成都会影响到酿酒酵母的发酵性能和高级醇代谢[5-6]。氨基酸是发酵过程中非常重要的参数,是酵母吸收的主要营养物质(仅次于碳源),氨基酸本身在发酵后也会赋予饮料酒各种味道,包括鲜味、甜味、苦味、酸味和咸味[7]。同时氨基酸也是多种高级醇合成的前体,对饮料酒的风味有重要贡献[8]。
许多文献报道了发酵体系中的氨基酸谱影响酵母发酵动力学和香气物质的产生,并且酵母的氨基酸代谢与其他代谢途径紧密相连,如碳代谢途径,这让氮代谢变得高度复杂[9]。早期研究以各种氨基酸作为单一氮源,根据酿酒酵母对它们的利用程度不同将氨基酸分类[10]。近年来,许多研究者关于氮素管理对酿酒酵母高级醇生成的影响也进行了广泛的研究[11-12]。然而,这些研究大多是在合成培养基的实验条件下进行,与传统的酿造过程有所差异。随着实际生产中氮源复杂性的增加,氮源对香气的影响也变得难以预测。氨基酸如何影响复杂原料发酵体系中酿酒酵母的代谢特性仍不清晰,有时甚至会出现相悖的结论。
到目前为止,还没有明确的结论来阐明自然发酵过程中氮源波动影响微生物高级醇的代谢机理,酿酒酵母的高级醇代谢随氮源变化的机理尚不清楚,值得进一步研究。本研究以液态发酵为例,选择在天然高粱水解液中加入关键氨基酸来研究其对酿酒酵母高级醇代谢的影响。本文旨在强调氮源管理在发酵体系中的重要性,以期对酿造工业上的氮源管理及原料选择进行指导。
1 材料与方法
1.1 实验材料
1.1.1 实验菌株
酿酒酵母(Saccharomyces cerevisiae)AY15 CICC32315的α型单倍体α5,由本实验室选育和保藏。
1.1.2 主要试剂
葡萄糖,天津市北方天医化学试剂厂;酸性蛋白酶,诺维信(中国)生物技术有限公司;甘氨酸、甲硫氨酸、亮氨酸、缬氨酸、异亮氨酸、色氨酸、苏氨酸,上海阿拉丁生化科技股份有限公司;乙醇(色谱纯),天津市江天化工技术有限公司。
1.1.3 培养基
YPD培养基:2%葡萄糖,2%蛋白胨,1%酵母浸粉,于115 ℃、0.1 MPa高压蒸汽灭菌20 min。固体YPD培养基需另加2%琼脂。
种子培养基:一级种子培养基和二级种子培养基是液态YPD,115 ℃高温灭菌20 min,备用。
液态发酵培养基(高粱水解液):以高粱为原料,经过20目孔筛,将高粱粉与水按照1∶3(g∶mL)混合,60 ℃水糊化30 min;然后置于90 ℃水浴下,加热至90 ℃后加α-淀粉酶(1.8×104 U/mL)搅拌均匀,液化1 h。冷却后再加入糖化酶(8×104 U/mL)置于60 ℃水浴锅中,糖化4 h,期间多次充分搅拌。糖化结束后,加入过量的酸性蛋白酶,继续置于60 ℃水浴锅反应2 h。冷却至室温并使用4层纱布过滤水解液,过滤后加蒸馏水将糖度调整至16 °Brix,于105 ℃灭菌锅中灭菌20 min,冷却备用。
1.2 仪器与设备
MS204S电子分析天平、pH计,梅特勒托利多仪器有限公司;HNY-2102C振荡培养箱,天津欧诺有限公司;UV-5100B紫外分光光度计,上海元析仪器有限公司;5430R高速冷冻离心机,Eppendorf AG Germany;1200SL液相色谱仪、Agilent 7890B气相色谱仪、ZORBAX Eclipse Plus C18色谱柱、CP-Wax 57CB柱(50 m×250 μm×0.2 μm),美国安捷伦科技有限公司。
1.3 实验方法
1.3.1 发酵方法
一级种子培养:从固体YPD培养基上刮一环菌体至装有一级种子培养基的试管中,装液量5 mL,30 ℃静置培养24 h。
二级种子培养:将一级种子液按照10%的比例接种至二级种子培养基,装液量50 mL,30 ℃静置培养16 h。
高粱水解液发酵:将二级种子液4 ℃离心得到菌体沉淀,用生理盐水重悬,接种于高粱水解液发酵培养基中(接种量为5×106 CFU/mL)。于30 ℃培养箱中静置发酵,每12 h称重,当失重<0.2 g时,视为发酵结束。将发酵液进行蒸馏,取100 mL发酵液与100 mL水混匀,蒸出100 mL馏出液。
梯度氨基氮高粱发酵液的制备方法:按照1.1.3节的方法制备了高浓度α-氨基氮的高粱发酵液,采用相同的方法,在不添加酸性蛋白酶的情况下得到低浓度α-氨基氮的高粱发酵液。最后通过不同比例混合得到所需不同α-氨基氮浓度的高粱发酵液培养基。
1.3.2 分析方法
CO2释放量测定:充分晃动锥形瓶,使CO2充分释放,用电子天平称重。CO2释放量可用来评估发酵过程中酿酒酵母的发酵速率。
总α-氨基氮含量测定:发酵液中的氨基氮含量采用茚三酮显色法检测,具体方法参考王亚平[13]的方法。
乙醇和葡萄糖含量测定:采用示差高效液相色谱法测定发酵液中乙醇和葡萄糖的含量。其色谱条件为:GH0830078H色谱柱(300 mm×7.8 mm),检测器为示差折光检测器(refractive index detector, RID),流动相为5 mmol/L的稀硫酸,流速0.6 mL/min,进样量20 μL,检测器温度45 ℃,柱温65 ℃。
高级醇含量测定方法:将馏出液用0.22 μm滤膜过滤后进行气相色谱检测。其检测条件为:使用CP-Wax 57CB色谱柱(50 m×250 μm×0.2 μm),载气为高纯N2,进样量1 μL,流速1 mL/min;升温程序:35 ℃保持1 min,以3 ℃/min升温到70 ℃,再以3.5 ℃/min升温到190 ℃,保持22 min。
高级醇定量分析方法:采用外标法对高级醇进行定量。
氨基酸含量测定方法:将发酵的上清液进行衍生处理,取样品200 μL、NaHCO3溶液450 μL、1% 2,4-二硝基氟苯溶液450 μL、磷酸缓冲液900 μL,60 ℃避光反应1 h。采用紫外高效液相色谱法测定衍生后样品中的氨基酸含量。其色谱条件为:使用ZORBAX Eclipse Plus C18色谱柱(250 mm×4.6 mm),检测波长为360 nm,流动相A为乙酸钠溶液,流动相B为50%乙腈,流速1 mL/min,柱温40 ℃,进样量10 μL;洗脱程序:73%流动相A、27%流动相B保持25 min,50%流动相A、50%流动相B保持5 min,25%流动相A、75%流动相B保持10 min,15%流动相A、85%流动相B保持5 min,5%流动相A、95%流动相B保持3 min,73%流动相A、27%流动相B保持7 min。
氨基酸定量分析方法:采用外标法对氨基酸进行定量。
2 结果与分析
2.1 不同α-氨基氮浓度对发酵速率、高级醇生成量的影响
当发酵体系中氮源缺乏时,高级醇的生成以Harris途径为主,糖代谢合成的α-酮酸进一步生成高级醇。当发酵体系中氮源充足时,糖的合成代谢途径可能受到了一定的抑制,大量氨基酸经转氨作用生成α-酮酸,促进了高级醇的生成[1]。实验设计了不同α-氨基氮质量浓度(40、90、120、150、200、270 mg/L)的高粱水解液,以酿酒酵母α5为发酵菌株,研究酿酒酵母α5的发酵速率和高级醇生成量随发酵液α-氨基氮浓度的变化规律。由图1可知,在发酵前期(0~12 h),发酵速率与α-氨基氮浓度呈现正相关。α-氨基氮浓度越高,发酵的起始速率越快。虽然40 mg/L α-氨基氮质量浓度时发酵速率较慢,但随着发酵的结束,其总失重与其他5个较高的α-氨基氮浓度发酵组的总失重无明显差异,表明较低的α-氨基氮浓度可能不利于发酵的快速开始。
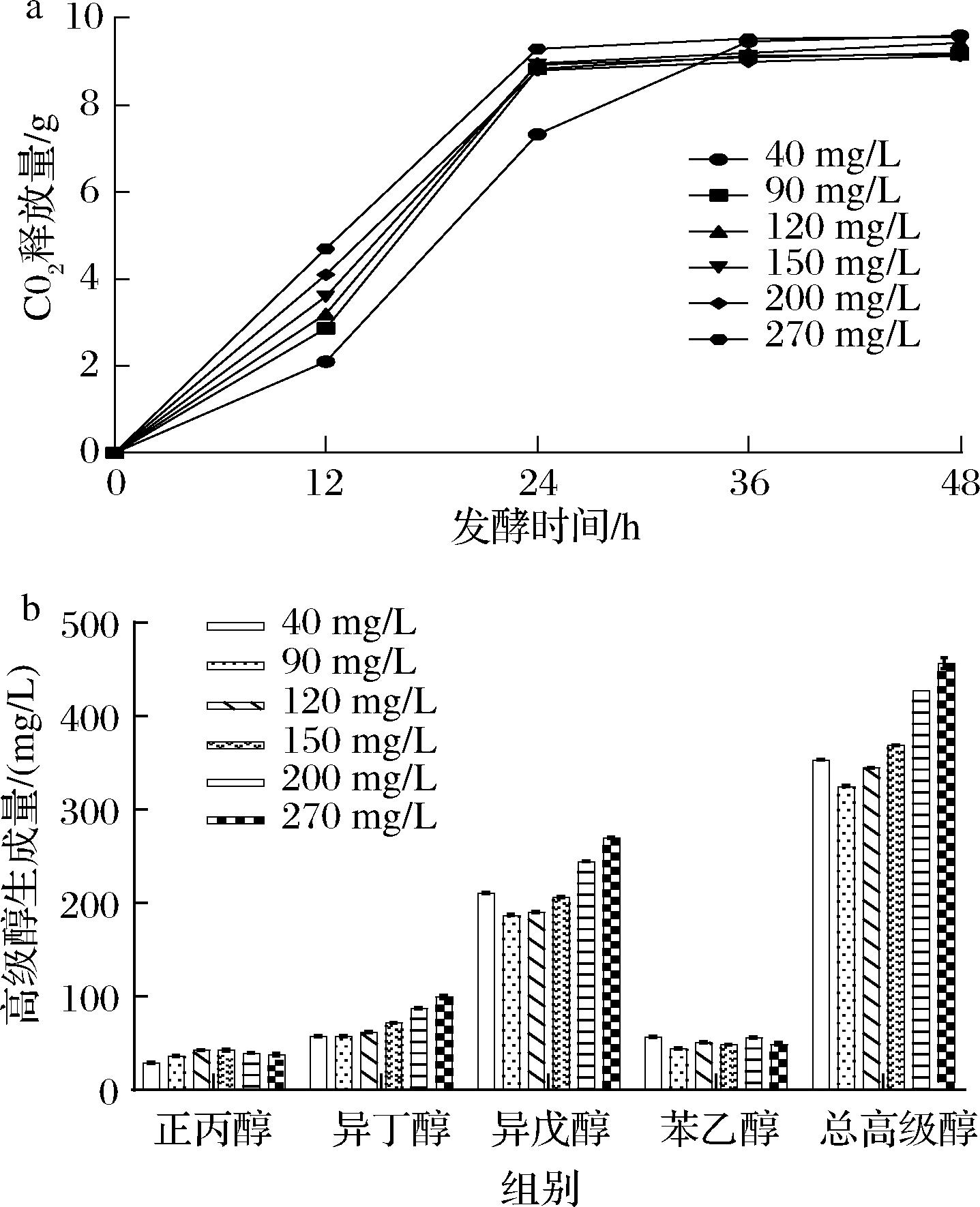
a-CO2释放量;b-高级醇生成量
图1 不同α-氨基氮浓度下的发酵速率和高级醇生成量
Fig.1 Fermentation rate and higher alcohol production at different α-amino nitrogen concentrations
由图1可知,随着氨基氮浓度的不断增加,总高级醇生成量出现先降低后增加的规律,其中总高级醇生成量最低点对应的α-氨基氮质量浓度为90 mg/L,这与前人研究的结果[13]一致。进一步分析酿酒酵母高级醇的生成情况,发现异戊醇、异丁醇的生成量最多,其含量都随α-氨基氮浓度的增加先降低后增加,这与总高级醇含量的变化趋势一致。而正丙醇、苯乙醇的生成量较少,且无明显变化规律。这是由于不同高级醇的代谢途径不同,导致不同α-氨基氮浓度对其生成量的影响也有所差异。
2.2 添加关键氨基酸种类及含量的确定
为了探究关键氨基酸对高级醇代谢的影响,本研究选择在高级醇生成量最低时对应的α-氨基氮质量浓度(90 mg/L)下向高粱发酵培养基中单添加关键氨基酸,再分析高级醇的生成情况。以往的研究表明,除了理性代谢途径上已明确的前体氨基酸(异亮氨酸、亮氨酸、缬氨酸、苏氨酸等),其他氨基酸对酒体香气也有较大影响。甲硫氨酸和色氨酸是葡萄酒发酵中香气物质的主要前体物质,在酵母细胞中通过Ehrlich途径转化为高级醇[14]。XU等[15]在苹果酒的发酵过程中也发现甲硫氨酸也是芳香物质的前体;色氨酸是一种生长调节剂,刘苹等[16]、VALERA等[17]将其添加酿酒酵母的发酵中,发现其添加影响了酵母的香气化合物的生成量,随后谢克英等[5]在桑葚酒发酵过程中发现添加色氨酸后异丁醇和异戊醇生成量有显著变化。张文叶等[18]在研究氨基酸种类对山楂酒中高级醇生成量的影响时,发现甘氨酸的添加使异戊醇含量升高。综上所述,本研究选择了4个高级醇合成代谢途径上的前体氨基酸(苏氨酸、亮氨酸、异亮氨酸、缬氨酸)以及以往研究中对香气化合物有明显影响的3个氨基酸(甲硫氨酸、色氨酸、甘氨酸)作为关键氨基酸进行下一步研究。
表1根据氨基酸与α-氨基氮的浓度换算关系计算出100 mg/L α-氨基氮质量浓度中对应的单个氨基酸浓度[19],然后分别单一添加了甘氨酸、甲硫氨酸、异亮氨酸、苏氨酸、缬氨酸、亮氨酸、色氨酸这7个氨基酸到90 mg/L α-氨基氮质量浓度的高粱水解液中发酵。
表1 每种氨基酸分别在发酵培养基中的添加量
Table 1 The amount of each amino acid added to the fermentation medium
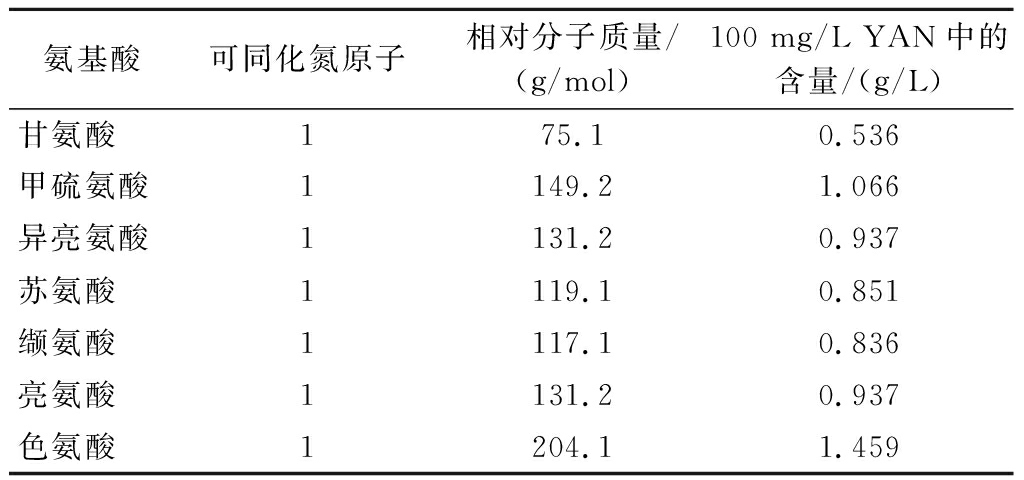
氨基酸可同化氮原子相对分子质量/(g/mol)100 mg/L YAN中的含量/(g/L)甘氨酸175.10.536甲硫氨酸1149.21.066异亮氨酸1131.20.937苏氨酸1119.10.851缬氨酸1117.10.836亮氨酸1131.20.937色氨酸1204.11.459
2.3 添加关键氨基酸后对酿酒酵母发酵速率、乙醇生成、葡萄糖消耗的影响
以往研究根据氨基酸在酵母代谢中的重要性将它们分为三类,苏氨酸、甲硫氨酸属于第一类,其浓度对酵母氮代谢影响较小;异亮氨酸、缬氨酸、甘氨酸属于第二类,这类氨基酸在发酵体系中的浓度相对重要;亮氨酸属于第三类,这类氨基酸对酵母的氮代谢有重要影响,最终影响酵母的发酵性能和产品品质[20]。由图2-a可知,单一添加了甘氨酸、甲硫氨酸、异亮氨酸、苏氨酸、缬氨酸、亮氨酸、色氨酸这7个关键氨基酸对发酵速率无明显影响。
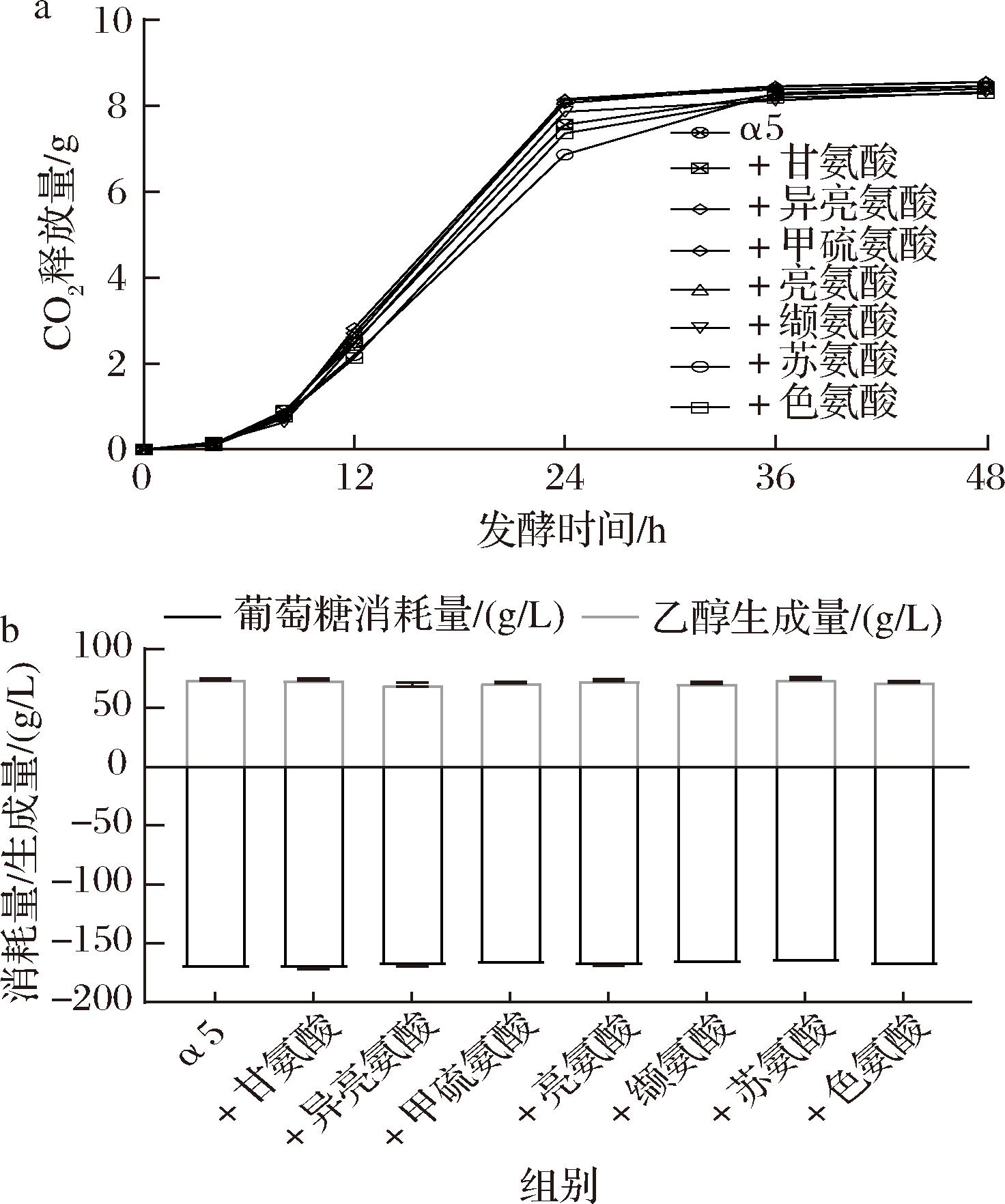
a-CO2释放量;b-乙醇生成量和葡萄糖消耗量
图2 分别添加7种氨基酸后酿酒酵母的发酵速率、乙醇生成和葡萄糖消耗情况
Fig.2 Fermentation rate, ethanol production and glucose consumption of Saccharomyces cerevisiae after adding seven amino acids
葡萄糖经过糖酵解途径生成丙酮酸,丙酮酸经脱羧和还原生成乙醇,乙醇是白酒的主要成分,酒中的微量风味物质大多以乙醇为溶剂,因此乙醇可起到固定香气的作用[21]。由图2-b可看出,7种氨基酸的补充并未对乙醇的最终含量产生显著影响。葡萄糖是发酵体系中重要碳源,据文献报道葡萄糖与氨基酸或铵等营养素之间的相互作用对调节细胞生长有重要作用[22]。本研究中7种氨基酸是在最适α-氨基氮浓度条件下进行单添加,因此对葡萄糖的消耗和乙醇的生成没有明显的影响。该现象符合实验的预期,说明在最适α-氨基氮浓度下发酵液中的氨基酸已经足够维持酿酒酵母的基本发酵性能,额外添加单个氨基酸并未对发酵性能产生显著影响。
2.4 添加关键氨基酸对酿酒酵母高级醇生成的影响
2.4.1 添加关键氨基酸对酿酒酵母总高级醇生成量的影响
氮源中的氨基酸既作为酿酒酵母发酵时的营养组分,影响酿造过程中发酵速率、耗糖速率等发酵性能指标,同时作为高级醇的前体物参与风味物质的形成,影响产品风味。氨基酸的单添加对发酵结束后高级醇的生成影响显著,并且不同氨基酸对不同高级醇生成量的影响也不同。由图3可知,在本研究中添加异亮氨酸、亮氨酸、缬氨酸、色氨酸显著提高了总高级醇的生成量,添加甲硫氨酸、苏氨酸显著降低了总高级醇生成量,而添加甘氨酸对总高级醇的生成没有明显的促进或抑制作用。其中,异亮氨酸、亮氨酸、缬氨酸的添加能显著提高总高级醇生成量的主要原因是促进了相关代谢途径上的异丁醇、活性戊醇、异戊醇的生成(图3-a),表明添加高级醇合成代谢途径上的前体氨基酸能显著提高相应高级醇的生成量,因此在发酵液中单添加异亮氨酸、亮氨酸、缬氨酸促进酿酒酵母高级醇生成符合多余氨基酸转化为相应高级醇的代谢规律。
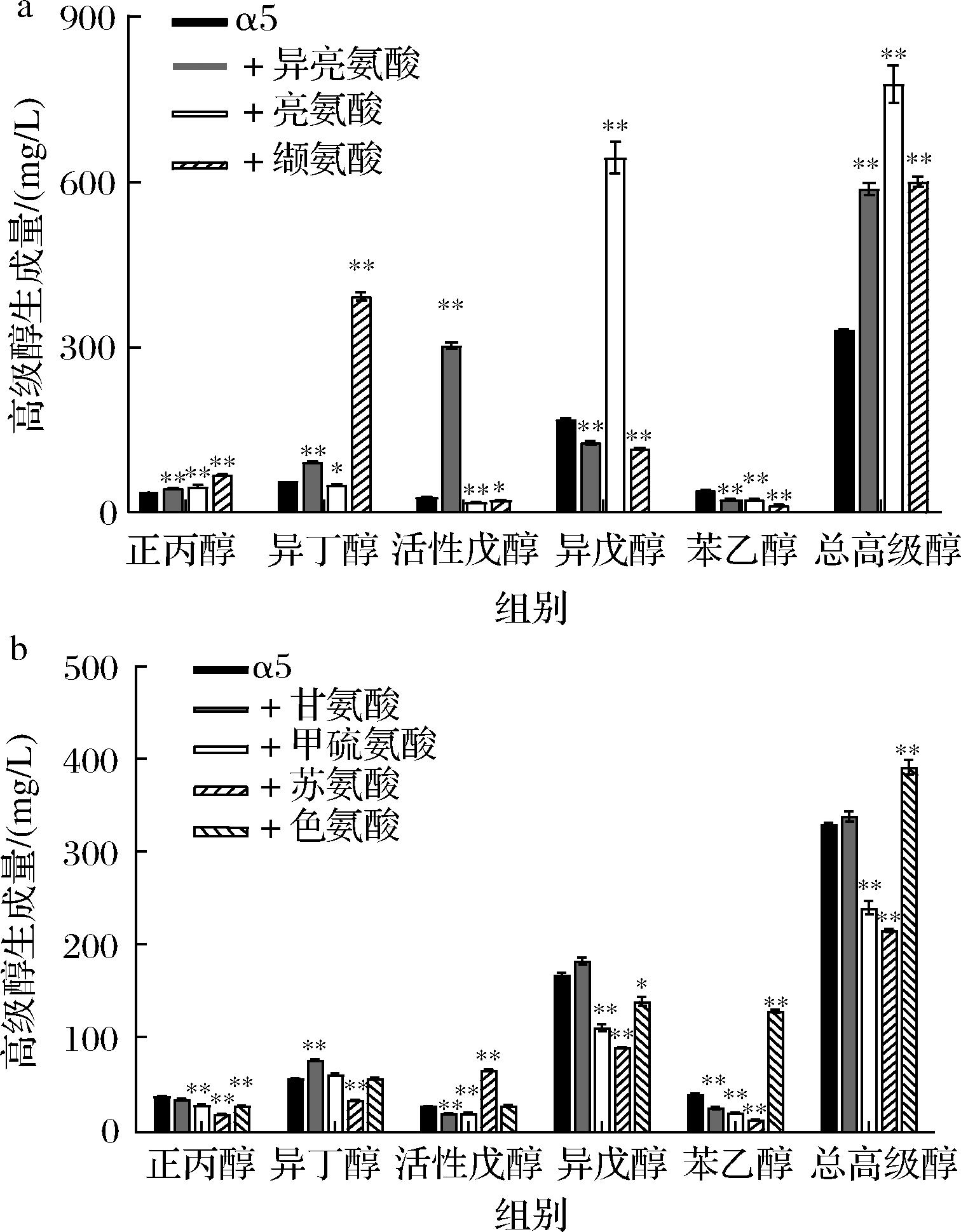
a-添加异亮氨酸、亮氨酸、缬氨酸后高级醇生成量;b-添加甘氨酸、甲硫氨酸、苏氨酸、色氨酸后高级醇生成量
图3 单添加7种氨基酸后酿酒酵母α5的高级醇生成量
Fig.3 Higher alcohol production of Saccharomyces cerevisiae α5 after adding seven amino acids alone
2.4.2 甘氨酸对高级醇生成的影响
以往通过添加甘氨酸来探究α-氨基氮对酵母菌高级醇代谢影响的研究,其高级醇生成量大多明显增加。然而,本实验条件下添加甘氨酸后酿酒酵母总高级醇生成量无明显变化(图3-b),对比分析发现之前的研究是在较高α-氨基氮浓度下添加的甘氨酸,推测甘氨酸需要在较高氨基氮浓度下添加才能促进高级醇的生成,可以进一步提高发酵液α-氨基氮浓度以验证猜想(图4)。由图4可知,将原发酵液的α-氨基氮质量浓度从90 mg/L提高到160 mg/L后,添加甘氨酸后其总高级醇生成量提高了11%,其中异丁醇和异戊醇的生成量分别提高了41%和17%。这一现象验证了前面的推测,在较高α-氨基氮浓度下单添加甘氨酸促进酿酒酵母高级醇生成的效果更显著。
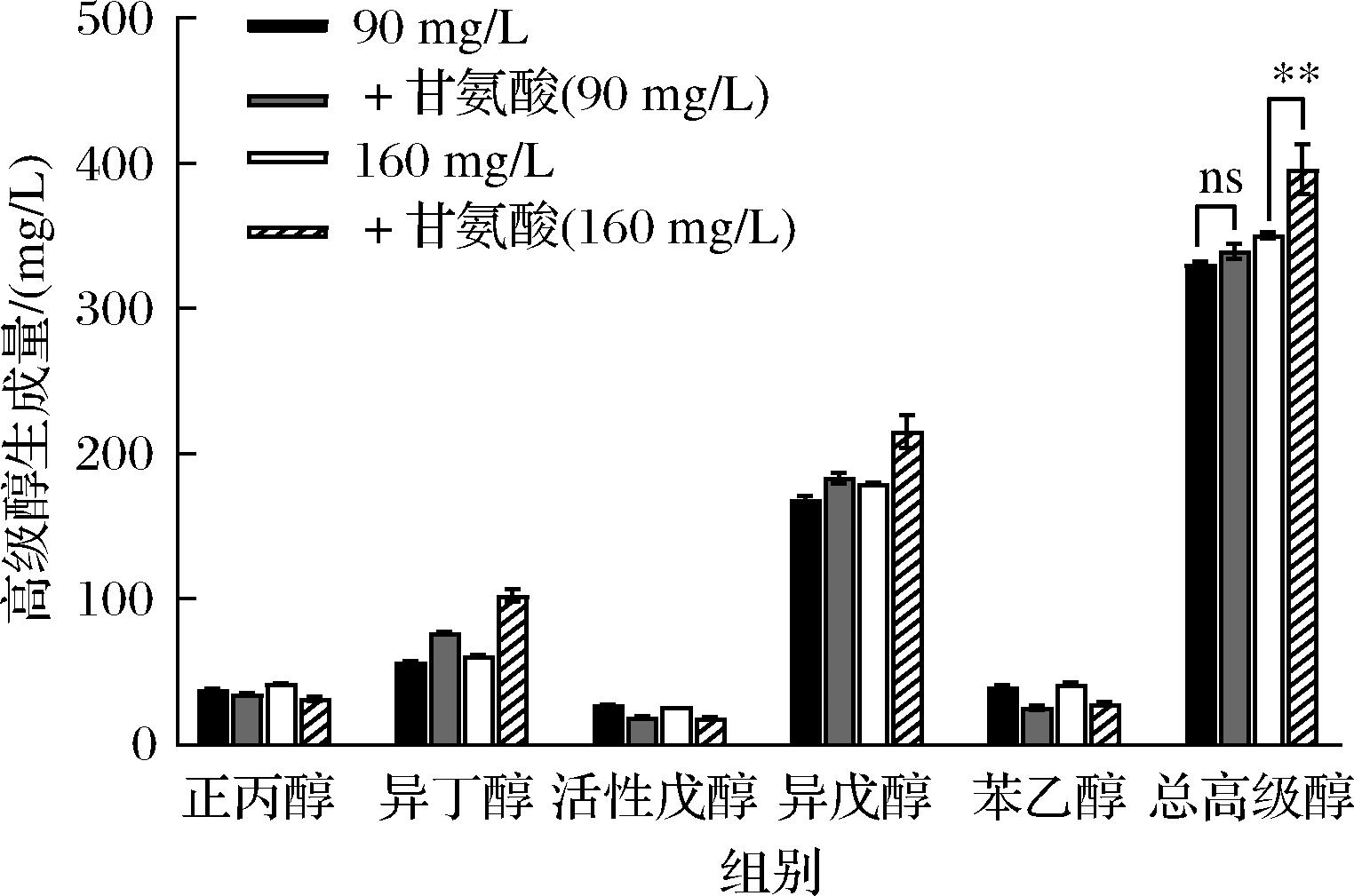
图4 不同氨基氮浓度下添加甘氨酸后的高级醇生成量
Fig.4 Higher alcohols produced by adding glycine at different amino nitrogen concentrations
2.4.3 甲硫氨酸、苏氨酸、色氨酸对高级醇生成的影响
进一步分析图3-b得,添加甲硫氨酸后各个高级醇的生成量均出现降低。我们推测在发酵体系中添加甲硫氨酸后可能影响了酿酒酵母中相关氨基酸分解代谢途径,从而抑制了各个高级醇的生成。苏氨酸通过苏氨酸途径生成2-酮丁酸,2-酮丁酸经脱羧、脱氢反应生成正丙醇[23]。苏氨酸是理性代谢途径上正丙醇的前体氨基酸,但与原高粱发酵液相比,单添加苏氨酸发酵组中的正丙醇生成量显著减少,异丁醇、异戊醇和苯乙醇的生成量也显著降低,但活性戊醇的生成量显著提高。添加色氨酸后苯乙醇生成的大幅度提高,致使总高级醇的生成量也得到了显著增加。这可能是因为色氨酸的添加影响了苯乙醇前体氨基酸苯丙氨酸或者其他相关氨基酸的代谢,导致酿酒酵母α5生成苯乙醇的能力显著增强,该现象有待进一步探究。
在本文2.1节不同α-氨基氮浓度对酿酒酵母高级醇生成量的影响实验中分析得出,在一定范围内提高发酵液中α-氨基氮浓度有利于促进高级醇的生成。单添加甘氨酸、甲硫氨酸、苏氨酸后将发酵液中的总α-氨基氮质量浓度从90 mg/L提高到了190 mg/L,但总高级醇生成量并没有增加。这表明α-氨基氮的含量和种类对酿酒酵母的高级醇生成都起着至关重要的作用。因此在实际生产中,若仅考虑氨基氮的浓度,而不考虑发酵体系氨基酸谱的话,可能会造成与预期相悖的结果。
2.5 单添加甘氨酸、甲硫氨酸、苏氨酸和色氨酸发酵液中氨基酸谱的测定
由于甘氨酸、甲硫氨酸、苏氨酸和色氨酸对高级醇的影响并不符合理性代谢规律,实验进一步分析了单添加这4种氨基酸后发酵体系中的氨基酸谱。在最适氨基氮质量浓度(90 mg/L)下添加关键氨基酸,并控制在相同α-氨基氮质量浓度水平(190 mg/L)下进行液态发酵(表2)。添加单一氨基酸后,甘氨酸质量浓度从12 mg/L增加至612 mg/L;甲硫氨酸质量浓度从44 mg/L增加至955 mg/L;苏氨酸质量浓度从12 mg/L增加至1 148 mg/L;色氨酸质量浓度从7 mg/L增加至1 620 mg/L(表3)。由表3可知,本实验保证了单添加氨基酸后高粱发酵液中的其他氨基酸含量并未受到影响,与原高粱水解液里的氨基酸含量保持一致。本实验同时控制了单添加氨基酸后的发酵液总α-氨基氮浓度和其他氨基酸含量,排除了发酵体系中α-氨基氮浓度和其他氨基酸的干扰因素。单个氨基酸的添加导致发酵液氨基酸谱中该氨基酸占比变大,从而该氨基酸对酿酒酵母代谢高级醇产生了影响。在此研究结论上,未来研究可以通过高级醇代谢网络相关基因的转录水平测定,深入解析这些氨基酸对酿酒酵母高级醇代谢的调控机理。同时阐明哪些氨基酸仅提供氮源但不会影响高级醇生成、以及除了理性代谢途径上的氨基酸还有哪些氨基酸对高级醇有明显作用,实现对发酵产品风味的精准调控。
表2 单添加甘氨酸、甲硫氨酸、苏氨酸、色氨酸的α-氨基氮浓度变化 单位:mg/L
Table 2 The α-amino nitrogen concentration of glycine, methionine, threonine, and tryptophan was changed by single addition

α-氨基氮原高粱发酵液+甘氨酸+甲硫氨酸+苏氨酸+色氨酸发酵前90.00±0.17190.0±0.78190.0±0.91190.0±0.68190.0±0.36发酵末21.56±0.5633.1 6±1.8626.5 8±0.7133.2 8±0.3121.93±0.79
表3 单添加甘氨酸、甲硫氨酸、苏氨酸、色氨酸的发酵液初始氨基酸谱 单位:mg/L
Table 3 Initial amino acid spectrum of fermentation solution with glycine, methionine, threonine, and tryptophan added alone
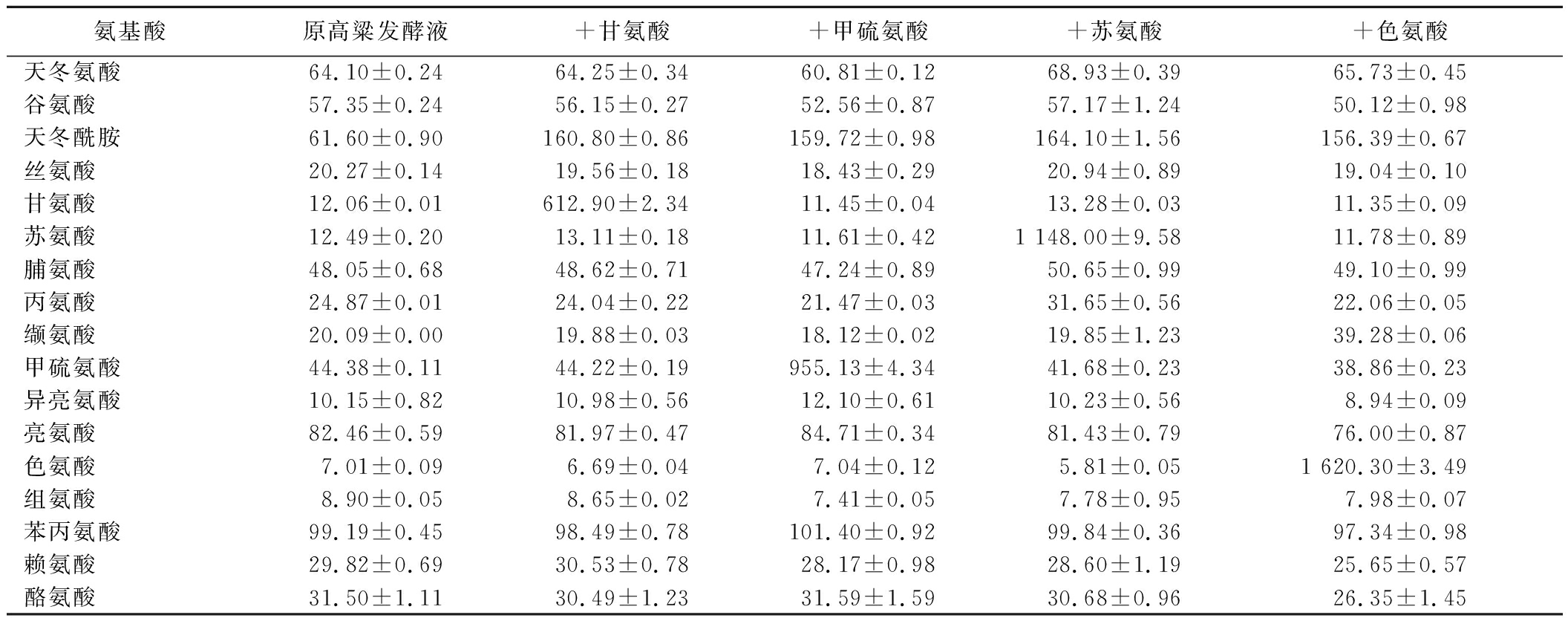
氨基酸原高粱发酵液+甘氨酸+甲硫氨酸+苏氨酸+色氨酸天冬氨酸64.10±0.2464.25±0.3460.81±0.1268.93±0.3965.73±0.45谷氨酸57.35±0.2456.15±0.2752.56±0.8757.17±1.2450.12±0.98天冬酰胺61.60±0.90160.80±0.86159.72±0.98164.10±1.56156.39±0.67丝氨酸20.27±0.1419.56±0.1818.43±0.2920.94±0.8919.04±0.10甘氨酸12.06±0.01612.90±2.3411.45±0.0413.28±0.0311.35±0.09苏氨酸12.49±0.2013.11±0.1811.61±0.421 148.00±9.5811.78±0.89脯氨酸48.05±0.6848.62±0.7147.24±0.8950.65±0.9949.10±0.99丙氨酸24.87±0.0124.04±0.2221.47±0.0331.65±0.5622.06±0.05缬氨酸20.09±0.0019.88±0.0318.12±0.0219.85±1.2339.28±0.06甲硫氨酸44.38±0.1144.22±0.19955.13±4.3441.68±0.2338.86±0.23异亮氨酸10.15±0.8210.98±0.5612.10±0.6110.23±0.568.94±0.09亮氨酸82.46±0.5981.97±0.4784.71±0.3481.43±0.7976.00±0.87色氨酸7.01±0.096.69±0.047.04±0.125.81±0.051 620.30±3.49组氨酸8.90±0.058.65±0.027.41±0.057.78±0.957.98±0.07苯丙氨酸99.19±0.4598.49±0.78101.40±0.9299.84±0.3697.34±0.98赖氨酸29.82±0.6930.53±0.7828.17±0.9828.60±1.1925.65±0.57酪氨酸31.50±1.1130.49±1.2331.59±1.5930.68±0.9626.35±1.45
3 结论
本研究通过梯度α-氨基氮浓度的高粱水解液发酵,确定了总高级醇生成量最低时对应的α-氨基氮质量浓度(90 mg/L)作为最适氨基氮浓度。在最适α-氨基氮浓度下单添加7种关键氨基酸,对不同氨基酸的添加对酿酒酵母的发酵性能以及最终高级醇含量的影响进行探究。异亮氨酸、亮氨酸、缬氨酸是活性戊醇、异戊醇、异丁醇合成途径上的前体氨基酸。这3种氨基酸的添加分别显著提高了对应高级醇的生成量,也不同程度地影响了其他高级醇的生成量。苏氨酸是正丙醇合成途径上的前体氨基酸,然而添加苏氨酸却抑制了正丙醇的生成。甘氨酸的添加需要在较高α-氨基氮浓度下才能显著促进酿酒酵母高级醇的生成。另外单添加甲硫氨酸对各个高级醇生成的抑制作用和单添加色氨酸对苯乙醇生成的促进作用有待进一步研究。由于不同的氨基酸参与酿酒酵母中不同高级醇的代谢,相关氨基酸的存在又有可能影响某个氨基酸的代谢,下一步将结合相关代谢途径上基因表达水平进一步揭示其影响机理。该研究结果对酿造过程中的高级醇调控以及原料类型选择具有重要指导意义。
[1] ZHONG X F, WANG A L, ZHANG Y B, et al.Reducing higher alcohols by nitrogen compensation during fermentation of Chinese rice wine[J].Food Science and Biotechnology, 2019, 29(6):805-816.
[2] 马晓焉, 王雪芹,马炼杰, 等.高级醇的微生物绿色制造[J].生物工程学报, 2021, 37(5):1721-1736.MA X Y, WANG X Q, MA L J, et al.Microbial green manufacturing of higher alcohols[J].Chinese Journal of Biotechnology, 2021, 37(5):1721-1736.
[3] 樊静雅, 谷欣哲, 梁清文, 等.白酒发酵过程中异戊醇合成机制与减控研究进展[J].中国酿造, 2023, 42(5):1-8.FAN J Y, GU X Z, LIANG Q W, et al.Research progress in mechanism of isoamyl alcohol synthesis and its reduction control during Baijiu fermentation[J].China Brewing, 2023, 42(5):1-8.
[4] 赵蒙, 孙安, 陈龙.发酵酒中高级醇的研究进展[J].中国酿造, 2023, 42(5):9-14.ZHAO M, SUN A, CHEN L.Research progress of higher alcohols in fermented alcoholic drink[J].China Brewing, 2023, 42(5):9-14.
[5] 谢克英, 刘冠慧, 钱志伟, 等.酵母可同化氮类型对桑葚酒发酵的影响[J].食品工业, 2022, 43(3):18-22.XIE K Y, LIU G H, QIAN Z W, et al.Effect of yeast assimilable nitrogen type on mulberry wine fermentation[J].The Food Industry, 2022, 43(3):18-22.
[6] BOUDREAU T F, PECK G M, O′KEEFE S F, et al.Free amino nitrogen concentration correlates to total yeast assimilable nitrogen concentration in apple juice[J].Food Science &Nutrition, 2018, 6(1):119-123.
[7] LIANG Z C, LIN X Z, HE Z G, et al.Amino acid and microbial community dynamics during the fermentation of Hong Qu glutinous rice wine[J].Food Microbiology, 2020, 90:103467.
[8] WEI J L, LU J, NIE Y, et al.Amino acids drive the deterministic assembly process of fungal community and affect the flavor metabolites in Baijiu fermentation[J].Microbiology Spectrum, 2023, 11(2):e0264022.
[9] FAIRBAIRN S, MCKINNON A, MUSARURWA H T, et al.The impact of single amino acids on growth and volatile aroma production by Saccharomyces cerevisiae strains[J].Frontiers in Microbiology, 2017, 8:2554.
[10] LJUNGDAHL P O, DAIGNAN-FORNIER B.Regulation of amino acid, nucleotide, and phosphate metabolism in Saccharomyces cerevisiae[J].Genetics, 2012, 190(3):885-929.
[11] SEGUINOT P, ROLLERO S, SANCHEZ I, et al.Impact of the timing and the nature of nitrogen additions on the production kinetics of fermentative aromas by Saccharomyces cerevisiae during winemaking fermentation in synthetic media[J].Food Microbiology, 2018, 76:29-39.
[12] YIN H, HE Y, DENG Y, et al.Application of Plackett-Burman experimental design for investigating the effect of wort amino acids on flavour-active compounds production during lager yeast fermentation[J].Journal of the Institute of Brewing, 2017, 123(3):300-311.
[13] 王亚平. α-氨基对酿酒酵母高级醇代谢的影响及调控机理的研究[D].天津:天津科技大学, 2021.WANG Y P.Effects of α-amino nitrogen on higher alcohol metabolism and regulatory mechanism in yeast[D].Tianjin:Tianjin University of Science and Technology, 2021.
[14] HAZELWOOD L A, DARAN J M, VAN MARIS A J A, et al.The Ehrlich pathway for fusel alcohol production:A century of research on Saccharomyces cerevisiae metabolism[J].Applied and Environmental Microbiology, 2008, 74(8):2259-2266.
[15] XU J N, GUO L, WANG T R, et al.Effect of inorganic and organic nitrogen supplementation on volatile components and aroma profile of cider[J].Food Research International, 2022, 161:111765.
[16] 刘苹, 苏卫卫.芳香族氨基酸及其衍生物的研究进展[J].廊坊师范学院学报(自然科学版), 2021, 21(2):27-34.LIU P, SU W W.Advances in the study of aromatic amino acids and their derivatives[J].Journal of Langfang Normal University (Natural Science Edition), 2021, 21(2):27-34.
[17] VALERA M J,  NGELES MORCILLO-PARRA M, ZAG
NGELES MORCILLO-PARRA M, ZAG RSKA I, et al.Effects of melatonin and tryptophol addition on fermentations carried out by Saccharomyces cerevisiae and non-Saccharomyces yeast species under different nitrogen conditions[J].International Journal of Food Microbiology, 2019, 289:174-181.
RSKA I, et al.Effects of melatonin and tryptophol addition on fermentations carried out by Saccharomyces cerevisiae and non-Saccharomyces yeast species under different nitrogen conditions[J].International Journal of Food Microbiology, 2019, 289:174-181.
[18] 张文叶, 吴庆伟, 吴刚, 等.氨基酸种类与添加量对山楂酒中主要高级醇生成量的影响[J].轻工学报, 2017, 32(3):1-7.ZHANG W Y, WU Q W, WU G, et al.Effects of amino acid variety and addition amount on the formation of main higher alcohols in hawthorn wine[J].Journal of Light Industry, 2017, 32(3):1-7.
[19] SU Y, SEGUINOT P, SANCHEZ I, et al.Nitrogen sources preferences of non-Saccharomyces yeasts to sustain growth and fermentation under winemaking conditions[J].Food Microbiology, 2020, 85:103287.
[20] INGLEDEW W.Utilisation of wort cbolydrates and niogen by Sacchanomyces cererisiae[J].Master Brewers Association of the Americas, 1975, 12(3):146-150.
[21] 侯阳阳, 杨哲皓,张梦瑶, 等.不同氨基酸对模拟葡萄汁发酵的影响[J].中国酿造, 2021, 40(10):95-101.HOU Y Y, YANG Z H, ZHANG M Y, et al.Effects of different amino acids on simulated grape juice fermentation[J].China Brewing, 2021, 40(10):95-101.
[22] SANTOS J, LEIT O-CORREIA F, SOUSA M J, et al.Nitrogen and carbon source balance determines longevity, independently of fermentative or respiratory metabolism in the yeast Saccharomyces cerevisiae[J].Oncotarget, 2016, 7(17):23033-23042.
O-CORREIA F, SOUSA M J, et al.Nitrogen and carbon source balance determines longevity, independently of fermentative or respiratory metabolism in the yeast Saccharomyces cerevisiae[J].Oncotarget, 2016, 7(17):23033-23042.
[23] 卢建军, 杨帆,杨婧, 等.白酒酿造中产正丙醇的微生物溯源研究[J].中国酿造, 2019, 38(7):151-155.LU J J, YANG F, YANG J, et al.Source tracing of 1-propanol-producing microorganisms during Baijiu fermentation[J].China Brewing, 2019, 38(7):151-155.