柚子(Citrus grandis L.Osbeck)属芸香科柑橘属,因其风味独特和营养价值高而成为全球最重要的柑橘类水果之一。柚子不仅能够直接食用,还经常被深加工和高值化利用制造相关产品。然而,在柚子被食用或加工过程中,会产生不可食用的物质,如富含天然膳食纤维成分的果皮和果渣通常被当作动物饲料,甚至直接被丢弃,利用率极低。有研究表明,柚皮海绵层含有多糖和黄酮类化合物,可作为天然安全的膳食纤维来源。膳食纤维进入胃肠道后具有良好的水合性能和膨胀能力,增强饱腹感,促进胃肠蠕动,具有通便、排毒、降血糖和降血脂等保健功能[1]。膳食纤维根据其溶解性可以分为可溶性膳食纤维(soluble dietary fiber,SDF)和不溶性膳食纤维(insoluble dietary fiber,IDF)[2]。SDF是膳食纤维生理功能的主要贡献者,是评价膳食纤维性能的重要指标。然而膳食纤维中IDF含量过多,且IDF表面含有大量的活性基团,对脂质和胆固醇有一定的吸附作用,在预防和缓解便秘、糖尿病、结肠癌、肥胖、高血压等方面发挥了重要的作用[3]。但是,由于IDF的主要成分纤维素和半纤维素溶解性差而难以降解,限制了它们在食品领域的加工和应用,因此采用改性方法来改善IDF理化性质和功能特性,增加SDF的含量,已成为膳食纤维改性研究的热点。
目前IDF的改性方法较多,主要包括化学法、生物法和物理法。虽然化学法可以在室温下用较低成本的试剂进行,但对反应溶剂有较高的要求并且有化学残留。生物法以其高效率、高特异性和温和的加工条件而闻名,其缺点是耗时长、易污染、菌株优化难度大[4]。物理法具有成本低、速度快、操作简单、化学残留少等优点,是目前应用最为广泛的改性方法。超高压(ultra-high pressure, UHP)处理是一种物理加工技术,以水或油作为介质,在室温或较低温度下传递压力(高于100 MPa)对材料进行改性[5]。与传统方法相比,超高压技术反应条件温和、无污染,受到了众多学者的关注。XIE等[6]研究了超高压处理对紫薯膳食纤维性质的影响,结果表明超高压处理增加了其SDF含量,并提高了其持油和膨胀能力以及抗氧化活性。此外,膳食纤维经超高压处理后,其总酚类化合物含量和抗氧化活性得到提高,表明高压处理可以影响膳食纤维基质,从而诱发酚类物质的释放,进而增加其抗氧化活性[7]。SANG等[8]研究了超高压处理对沙田柚皮IDF的影响,研究发现超高压处理能增加IDF的持水力(water holding capacity,WHC)、持油力(oil holding capacity,OHC)和溶胀力(swelling power,WSC),并且处理后的IDF具有更好的降血糖和降血脂活性。总的来说,超高压改性是一种获得具有更好理化和功能特性膳食纤维的策略,但原料类型与其改性效果之间也有密切的联系。因此,本研究通过对3种不同柚皮(琯溪蜜柚、文旦柚、坪山柚)海绵层IDF进行超高压处理,解析超高压处理对柚皮海绵层IDF的理化性质、结构特性及其抗氧化活性的影响规律,为柚皮海绵层IDF的改性提供理论依据。
1 材料与方法
1.1 材料与试剂
琯溪蜜柚、坪山柚,中国福建省漳州市;文旦柚,中国浙江省;蔗糖,广州市沃尔玛超市;阿拉伯糖、果糖、岩藻糖、半乳糖、半乳糖醛酸、甘露糖、鼠李糖和木糖,J&K科学技术有限公司(北京);糖基酶(100 KU/g)、中性蛋白酶(100 KU/g)、α-淀粉酶(4 000 U/g)、纤维素酶(400 U/mg),上海源叶生物技术有限公司。所有其他试剂均为分析纯。
1.2 仪器与设备
ME204万分之一电子分析天平,梅特勒-托利多仪器上海有限公司;LC-20AT高效液相色谱仪,日本Shimadzu Corp公司;EVO18扫描电子显微镜,德国ZEISS公司;D8 Advance X射线衍射仪,德国Bruker公司;Vertex 33傅里叶红外光谱仪,德国Bruker有限公司。
1.3 实验方法
1.3.1 柚皮海绵层IDF的提取
采用超声辅助酶法提取柚皮海绵层的IDF,并进行一些修改[9]。选取3种柚皮海绵层,洗净切片,在55 ℃的鼓风机中干燥24 h,然后打粉过40目筛得到柚皮海绵层粉。将10 g粉末悬浮于水中,料液比为1∶20(g∶mL),pH值调至7.0。然后在40 ℃和400 W下用超声波处理混合物30 min。向混合物中加入质量分数1.5%的混合酶(α-淀粉酶与糖基酶质量比1∶1)溶液,然后在70 ℃水浴中培养1 h。所得的浆液在100 ℃下加热10 min以终止酶反应,然后冷却至室温。然后,在40 ℃水浴中将溶液与500 μL蛋白酶混合1 h,将得到的浆液在100 ℃下加热5 min以终止酶反应,冷却至室温并离心10 min。残留物用蒸馏水洗涤至中性,然后冻干。干燥后的粉末贮存在4 ℃下,直到下一步使用。最后,将得到的IDF粉末分别命名为琯溪蜜柚柚皮海绵层IDF(GIDF)、文旦柚柚皮海绵层IDF(WIDF)、坪山柚柚皮海绵层IDF(PIDF)。
1.3.2 超高压改性处理
将3种IDF样品与蒸馏水混合(料液比1∶20,g∶mL),在600 MPa、15 min下进行超高压处理。然后,将抽滤得到的液体进行冷冻干燥,得到超高压处理后的IDF样品。
1.3.3 柚皮海绵层IDF理化性质分析
1.3.3.1 持水力的测定
参考XUE等[10]的方法并加以修改,将0.5 g(W1)样品置于含有25 mL蒸馏水的试管中,室温放置2 h,并以4 000 r/min离心10 min除去上清液,取沉淀称重(W2)。WHC的计算如公式(1)所示:
(1)
1.3.3.2 溶胀力的测定
参考CUI等[11]的方法并稍加修改,将0.05 g(M0)样品置于含有15 mL蒸馏水的试管中,测定体积(V1),室温放置18 h,记录吸水膨胀后的体积(V2)。WSC的计算如公式(2)所示:
(2)
1.3.3.3 持油力的测定
参考ZHANG等[12]的方法,将0.5 g(W1)IDF与12.5 mL大豆油混合,静置2 h,并以4 000 r/min离心10 min除去上清液,收集沉淀物并称重(W2)。OHC的计算如公式(3)所示:
(3)
1.3.4 柚皮海绵层IDF结构分析
1.3.4.1 单糖组成分析
根据以往的研究方法稍作修改[13],通过HPLC测定超高压处理的柚皮海绵层IDF的组成。将0.01 g待测样品于2 mol/L三氟乙酸中在100 ℃下水解5 h。然后将水解产物蒸发至干,将干燥的水解产物溶解在3 mL蒸馏水中。将100 μL的样品液与200 μL 0.5 mol/L 3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolinone,PMP)甲醇溶液和300 μL 0.3 mol/L NaOH溶液混合,混合物在70 ℃下水浴1 h。冷却后,样品用300 μL 0.3 mol/L盐酸中和,所得溶液用1 mL氯仿萃取3次。通过0.22 μm微孔膜过滤水层用于HPLC分析。HPLC的测定条件如下:使用W0 NDASIL C18(4.6 mm×250 mm,5 μm)分析柱,以V(乙腈)∶V(磷酸盐缓冲液)=15∶85(pH=6.8)作为流动相A和流动相C,流速为1 mL/min,柱温为30 ℃,检测波长为250 nm,进样量为20 μL。
1.3.4.2 扫描电子显微镜分析
使用扫描电镜(scanning electron microscope,SEM)分析纤维样品的表面形貌和断裂特征[14],用双面导电胶将样品固定在样品台上,喷金后置于SEM观察台上进行微观结构观察。放大倍率为300倍,电压为3 kV。
1.3.4.3 傅里叶红外变换光谱分析
根据ZHANG等[15]描述的方法并稍作修改,用傅里叶变换红外光谱(Fourier transform-infrared spectroscopy,FT-IR)分析仪对IDF样品的官能团和化学键进行了表征。取干燥的样品2 mg,加入提前烘干研磨好的KBr粉末100 mg,混匀后压片,以200 mg KBr为背景,在4 000~400 cm-1波数下进行扫描。
1.3.4.4 X-射线衍射(X-ray diffraction,XRD)分析
使用X-射线衍射仪,在40 kV电压下对IDF样品的晶体结构进行表征[16]。入射电流和铜辐射分别为40 mA和40 kV。扫描速度为12 °/min,步长为0.013°,衍射角(2θ)为5°~60°。结晶度(degree of crystallinity,DC,%)的计算如公式(4)所示:
(4)
式中:Ac和Aa分别表示XRD图上的结晶和非结晶区域。
1.3.5 柚皮海绵层IDF抗氧化活性测定
1.3.5.1 柚皮海绵层IDF ABTS阳离子自由基清除能力的测定
取0.1 mL样品与3.6 mL ABTS溶液混合室温避光反应30 min,以等浓度的ABTS溶液作为空白对照,在734 nm处测量吸光度值,重复3次。ABTS阳离子自由基清除率的计算如公式(5)所示:
清除率![]()
(5)
式中:Ai为ABTS吸光度;Aj为ABTS与样品混合液吸光度。
1.3.5.2 柚皮海绵层IDF DPPH自由基清除能力的测定
将1 mL样品溶液与5 mL DPPH溶液混合,混合物在黑暗中反应30 min,以等浓度稀释后的DPPH溶液作为空白对照,在517 nm处测量吸光度值,重复3次。对DPPH自由基清除率的计算如公式(6)所示:
清除率![]()
(6)
式中:A1为稀释DPPH吸光度;A2为稀释样品吸光度。
1.4 数据处理
所有实验平行测定3次,数据结果以平均值(Mean)±标准偏差(SD)表示;采用SPSS 19.0软件通过多极差检验分析不同数据组间的统计显著性,显著性阈值设定为0.05;绘图采用软件Origin 2021。
2 结果与分析
2.1 超高压处理对柚皮海绵层IDF持水力、持油力和溶胀力的影响
膳食纤维的WHC是指膳食纤维在受到外部压力时保持水分的能力。以往研究发现,具有较高WHC的膳食纤维可促进人体排泄量和排便速度,缩短食物残渣在体内停留的时间,对预防肠道疾病有一定的效果。膳食纤维的OHC在食品加工和维护人类健康方面具有重要意义,如防止烹饪过程中脂肪的流失、吸附食物中的脂肪和减少高脂血症的形成等[17]。研究结果表明,经超高压处理后3种柚皮海绵层IDF的WHC和OHC出现显著下降(P<0.05)(图1),这可能是因为处理压力过高,严重破坏膳食纤维的内部结构,导致其WHC和OHC的下降,在超高压处理柚子膳食纤维中也观察到类似的结果[18]。其中,PIDF的WHC和OHC较未处理前下降幅度最大,分别下降了52%和34%。WSC是指膳食纤维在水中浸泡一定时间后发生变化的总体积。WSC取决于成分的特性和纤维基质的物理结构(孔隙度、结晶度),具有较高WSC的膳食纤维可以增加粪便排泄量,缓解肠道压力,减轻身体负担,对改善现代社会的亚健康状态起到积极作用[19]。如图1-C所示,与未经处理的IDF样品相比,超高压处理后的IDF样品的WSC升高,其中GIDF的WSC最高,为78.03 mL/g,较未处理的样品升高2.5倍。WSC的升高可能是因为超高压处理使IDF物理结构纤维基质断裂,从而为水的吸收提供更大的表面积[20]。因此,适当的超高压处理可以增加膳食纤维的疏松多孔结构,从而可能提高WHC、OHC和WSC,但是过高的压力会严重破坏膳食纤维的内部结构,从而降低其水合特性。

A-WHC;B-OHC;C-WSC
图1 超高压处理对3种柚皮海绵层IDF WHC、OHC和WSC的影响
Fig.1 Effect of UHP treatment on the pomelo peel sponge layers IDF WHC, OHC, and WSC
注:误差条表示3次重复实验的标准偏差,字母(a、b、c、d、e)不同代表组间差异显著(P<0.05)(下同)。
2.2 结构分析
2.2.1 柚皮海绵层IDF结构分析
为了进一步研究超高压处理对不同种柚皮海绵层IDF性能的影响,测定了不同品种柚皮海绵层IDF经超高压处理前后的单糖组成。由表1可知,3种柚子柚皮海绵层的IDF均由葡萄糖、半乳糖、阿拉伯糖和木糖组成,其中葡萄糖和阿拉伯糖的含量较高,这表明葡萄糖和阿拉伯糖是柚皮海绵层IDF的主要单糖。经超高压处理后,在GIDF和WIDF样品中检测到了鼠李糖,而在PIDF样品中未检测出该单糖。木糖、半乳糖醛酸、甘露糖和阿拉伯糖是半纤维素的主要成分,葡萄糖是纤维素的主要成分[21]。经600 MPa超高压处理后,所有IDF样品中的葡萄糖、木糖和阿拉伯糖的含量均呈现显著提升,这可能是因为含有纤维素和半纤维素的IDF经超高压处理后被降解,从而增加了这几种单糖的含量[22]。此外,经超高压处理后,PIDF中阿拉伯糖、葡萄糖、半乳糖和甘露糖的含量显著升高,并且PIDF的葡萄糖[(9.53±0.38) mg/g]、半乳糖[(1.41±0.07) mg/g]和甘露糖[(0.44±0.03) mg/g]含量也是所有样品中最高的。这可能与超高压处理后部分IDF转化为可溶性膳食纤维有关,在豆渣膳食纤维单糖组成的测定中也发现高温高压处理所导致的IDF向SDF转变可能是由于其结构组成中阿拉伯糖、葡萄糖、甘露糖以及半乳糖含量的增加[23]。单糖组成的变化会导致IDF样品的微观结构和理化性质发生变化,因此分析IDF的单糖组成有助于解析超高压处理对柚皮海绵层IDF微观结构和理化性质的影响。
表1 三种柚皮海绵层IDF超高压处理前后的单糖组成 单位:mg/g
Table 1 Monosaccharide composition of pomelo peel sponge layers IDF before and after UHP treatment
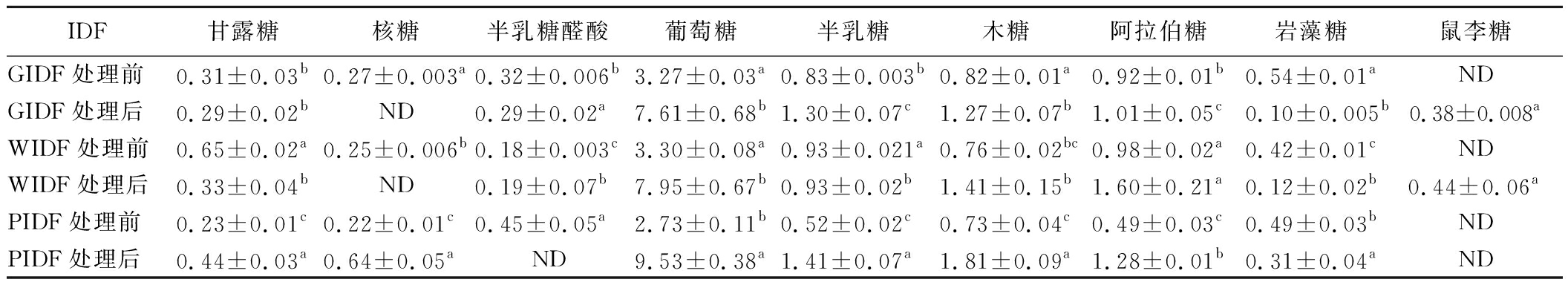
IDF甘露糖核糖半乳糖醛酸葡萄糖半乳糖木糖阿拉伯糖岩藻糖鼠李糖GIDF处理前0.31±0.03b0.27±0.003a0.32±0.006b3.27±0.03a0.83±0.003b0.82±0.01a0.92±0.01b0.54±0.01aNDGIDF处理后0.29±0.02bND0.29±0.02a7.61±0.68b1.30±0.07c1.27±0.07b1.01±0.05c0.10±0.005b0.38±0.008aWIDF处理前0.65±0.02a0.25±0.006b0.18±0.003c3.30±0.08a0.93±0.021a0.76±0.02bc0.98±0.02a0.42±0.01cNDWIDF处理后0.33±0.04bND0.19±0.07b7.95±0.67b0.93±0.02b1.41±0.15b1.60±0.21a0.12±0.02b0.44±0.06aPIDF处理前0.23±0.01c0.22±0.01c0.45±0.05a2.73±0.11b0.52±0.02c0.73±0.04c0.49±0.03c0.49±0.03bNDPIDF处理后0.44±0.03a0.64±0.05aND9.53±0.38a1.41±0.07a1.81±0.09a1.28±0.01b0.31±0.04aND
注:同一列中不同字母(a、b、c)肩标表示显著差异(P<0.05),ND表示未检测出。
2.2.2 扫描电镜分析
图2显示了不同IDF样品的表面形貌。有研究表明,纤维素、半纤维素和木质素交错形成几个薄层,共同构成膳食纤维的细胞壁[24]。在未经处理的IDF样品中,纤维片状结构清晰可见、紧密结合,表面呈蜂窝状结构。超高压处理往往会破坏柚皮海绵层IDF的层次结构,使其表面形成更深的空腔、质地更加疏松,组织出现明显的破碎和断裂。出现这种情况的原因可能是在超高压的作用下,IDF经剪切和膨化导致内部结构发生破碎、断裂,使其表面积增大,可通过氢键和偶极子的形成为水分子提供更多的容纳空间,会大大影响IDF与水的结合能力[25],这也是超高压处理后柚皮海绵层IDF的WSC上升的关键因素之一。然而,图2-D~图2-F表明3种IDF样品经600 MPa超高压处理后网络结构明显受到外力的破坏,呈现出更多不规则的脊状表面和碎裂结构,其中GIDF和PIDF碎裂得更为严重,这表明过高的压力可能会导致柚皮海绵层IDF细胞壁结构被破坏,从而使其持水力和持油力下降,在高温高压改性竹笋IDF中也观察到了细胞壁破碎的现象[26]。
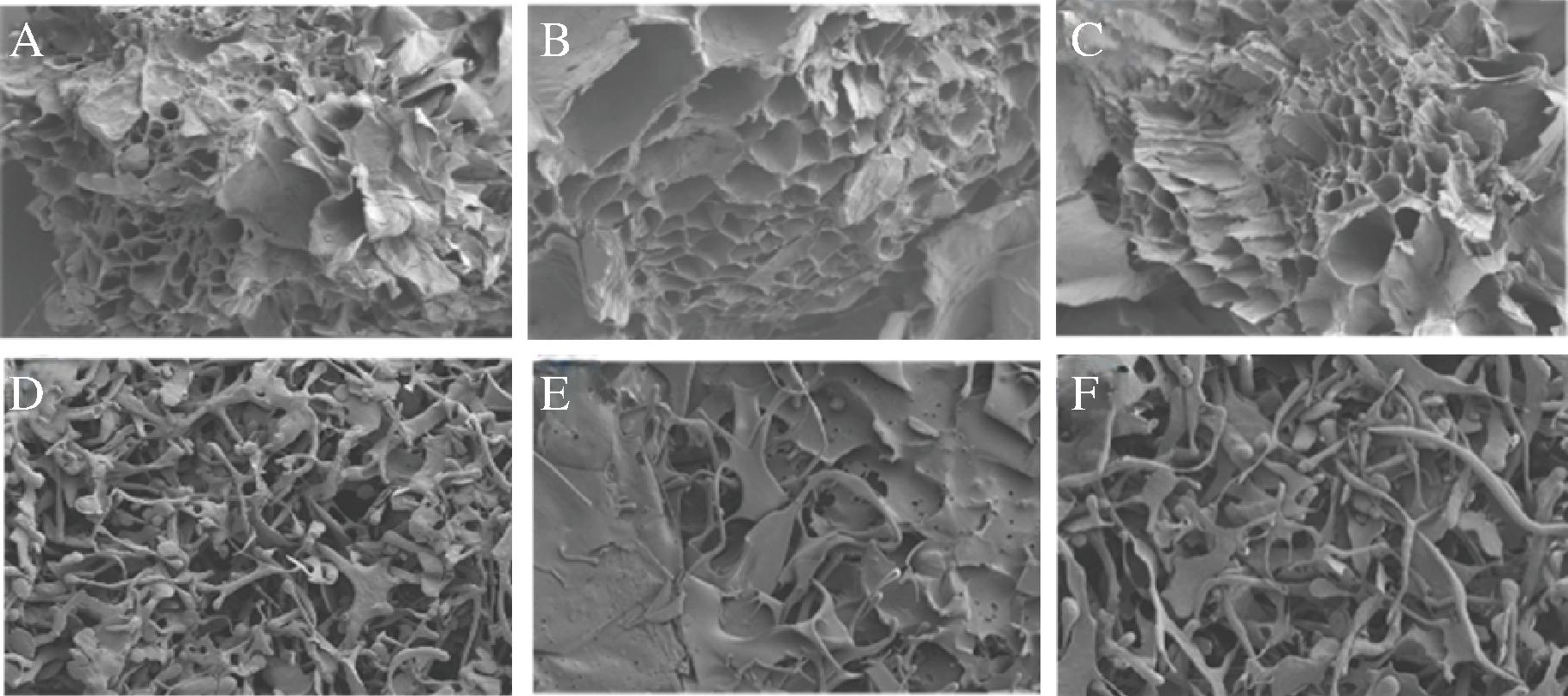
A-处理前琯溪蜜柚;B-处理前文旦柚;C-处理前坪山柚;D-处理后琯溪蜜柚;E-处理后文旦柚;F-处理后坪山柚
图2 三种柚皮海绵层超高压处理前后IDF微观结构图
Fig.2 Microstructure of pomelo peel sponge layers IDF before and after UHP treatment
2.2.3 傅里叶变换红外光谱分析
利用FT-IR分析了超高压处理前后IDF样品活性基团的变化。如图3所示,5种柚皮海绵层IDF超高压处理前后的FT-IR光谱图相似,只是在相应的波长上表现出吸收强度的变化。3 400 cm-1处的吸收峰是由纤维素和半纤维素的O—H拉伸振动引起的,2 926 cm-1处的特征吸收峰代表甲基或亚甲基化学基团的C—H振动,所有IDF样品均有这2个吸收峰,表明柚皮海绵层IDF具有典型的多糖化合物结构[27]。然而,与未经超高压处理的IDF相比,经超高压处理的IDF在3 400 cm-1和2 926 cm-1处吸收峰强度均出现下降,表明超高压处理可能破坏了IDF分子内部和分子链之间的氢键,增强无序结构,并诱导膳食纤维形成粗糙多孔的结构,使吸水力增强,进而使WSC增大[28]。1 748 cm-1处的吸收峰是羰基C![]() O 的拉伸振动,这是半纤维素的特征吸收峰,1 633 cm-1的吸收峰是酯类C
O 的拉伸振动,这是半纤维素的特征吸收峰,1 633 cm-1的吸收峰是酯类C![]() O的不对称拉伸振动特征峰,1 247 cm-1处的吸收峰是由于木质素组分拉伸振动引起,超高压处理后导致IDF样品的1 247 cm-1处吸收峰的强度降低归因于木质素的降解[29]。1 057 cm-1的吸收峰是半纤维素中醚键(C—O—C)的特征吸收峰,835 cm-1和735 cm-1的峰值分别代表多糖中的α-糖苷键和D-葡萄糖环[30]。以上研究表明,超高压处理对柚皮海绵层IDF活性基团种类影响较小,但对其特征峰的吸收强度影响较大,从而影响其表面纤维素组分的分布。
O的不对称拉伸振动特征峰,1 247 cm-1处的吸收峰是由于木质素组分拉伸振动引起,超高压处理后导致IDF样品的1 247 cm-1处吸收峰的强度降低归因于木质素的降解[29]。1 057 cm-1的吸收峰是半纤维素中醚键(C—O—C)的特征吸收峰,835 cm-1和735 cm-1的峰值分别代表多糖中的α-糖苷键和D-葡萄糖环[30]。以上研究表明,超高压处理对柚皮海绵层IDF活性基团种类影响较小,但对其特征峰的吸收强度影响较大,从而影响其表面纤维素组分的分布。

A-超高压处理前;B-超高压处理后
图3 三种柚皮海绵层IDF超高压处理前和超高压处理后的傅里叶红外光谱图
Fig.3 Fourier infrared spectra of pomelo peel sponge layers IDF before and after UHP treatment
2.2.4 柚皮海绵层IDF的X射线衍射分析
X射线衍射分析可反映样品的结晶类型和结晶指数(crystallization index,CI),本研究使用XRD进一步评估了柚皮海绵层IDF经超高压处理前后的结构特性,图4显示了不同品种柚皮海绵层IDF经超高压处理前后的XRD图谱。未经超高压处理的IDF样品在15 °(2θ)和21 °(2θ)附近均显示出明显的结晶衍射峰,而在35 °(2θ)处显示出微弱的衍射峰,这表明所有的柚皮海绵层IDF样品存在具有双螺旋结构的Ⅰ型纤维素[31]。然而,经超高压处理后,3种柚皮海绵层IDF在21 °(2θ)处的衍射峰变弱,峰形变宽、高度下降,在15 °(2θ)处和35 °(2θ)处的结晶衍射峰消失,这表明超高压处理可能改变了柚皮海绵层IDF的晶体构象。经计算发现超高压处理前GIDF、WIDF和PIDF的相对结晶度分别为19.81%、27.54%和19.85%,600 MPa超高压处理后其相对结晶度分别为10.95%、11.25%、19.03%,表明超高压处理会导致柚皮海绵层IDF相对结晶度的降低。造成这种现象的原因可能是在外力的作用下,柚皮海绵层IDF经剪切膨化使其内部结构发生断裂,分子间氢键减少,导致纤维素和半纤维素的定型结构被破坏,从而将结晶纤维素降解为无定形纤维素,分子排列无序的非结晶区所占比例升高,结晶度降低[32]。根据以往研究结果,纤维的化学性质受结晶度的影响,纤维素类物质主要由结晶部分和非结晶部分组成,半纤维素一般与纤维素相连,但具有随机无定形结构,强度小,易水解;结晶区的致密晶体结构主要由分子间氢键形成,高度有序,难以被与化学物质或生物酶反应,使得纤维素难以被有效利用[33]。因此,超高压处理后可以使得柚皮海绵层IDF样品的结晶度降低,功能特性发生改变,为其在食品领域的广泛应用奠定基础。
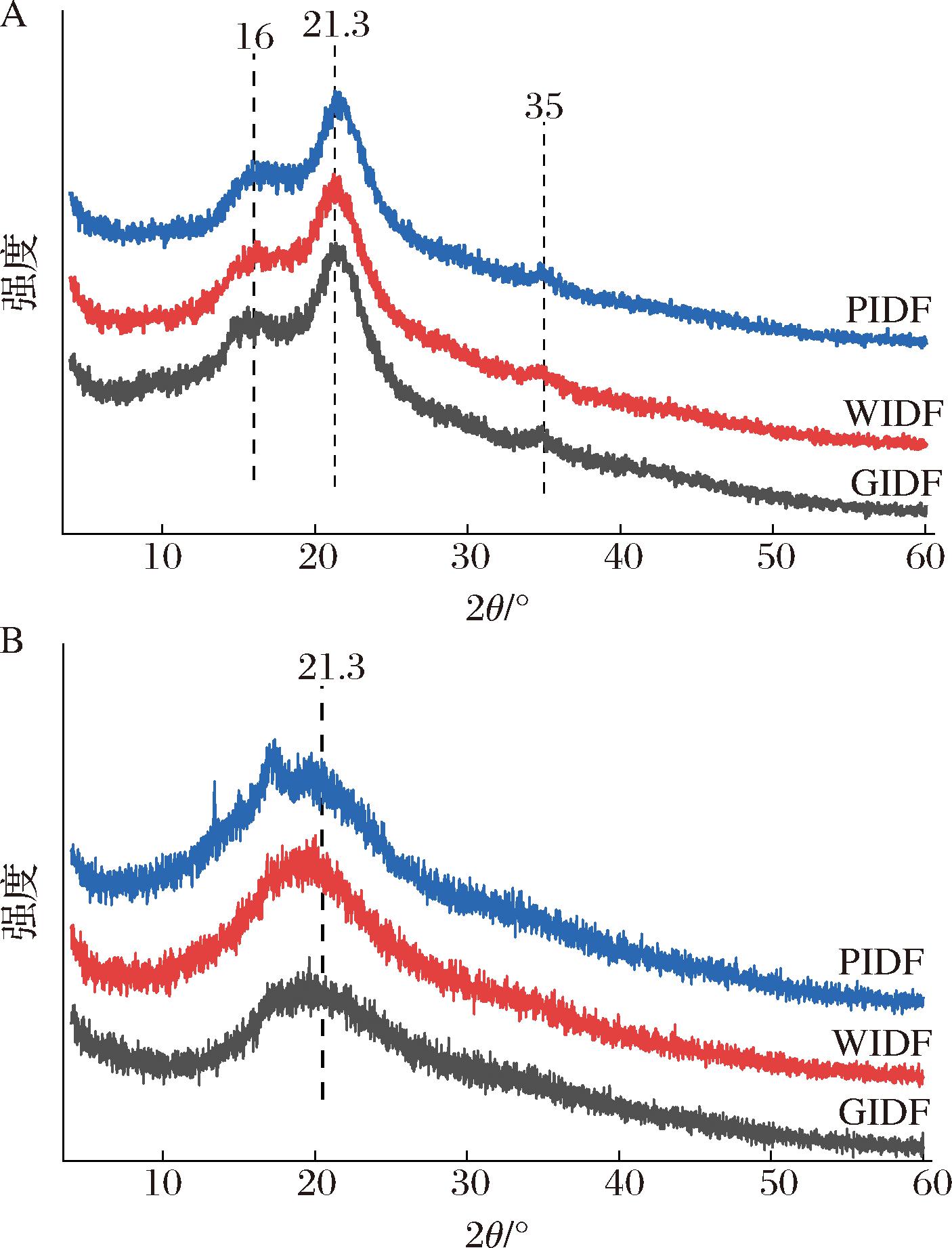
A-超高压处理前;B-超高压处理后
图4 三种柚皮海绵层IDF超高压处理前和超高压处理后的X射线衍射图谱
Fig.4 X-ray diffraction patterns of pomelo peel sponge layers IDF before and after UHP treatment
2.3 超高压处理对柚皮海绵层IDF抗氧化活性的影响
通过ABTS阳离子自由基和DPPH自由基清除能力的测定对比了3种不同柚皮海绵层IDF经超高压处理前后抗氧化活性的差异。由图5可知,超高压处理对GIDF和WIDF的ABTS阳离子自由基清除能力无显著差异(P>0.05),而PIDF的ABTS阳离子自由基清除能力经超高压处理后出现显著下降(P<0.05),在高压处理鲜食玉米苞叶IDF中也观察到ABTS阳离子自由基清除率下降的现象[34]。与未经超高压处理的柚皮海绵层IDF样品相比,GIDF、WIDF和PIDF的DPPH自由基清除率均出现显著下降,其中PIDF的DPPH自由基清除率下降最为显著,较未处理的样品下降了8.5%。有研究表明,植物膳食纤维富含黄酮类、酚酸和缩合单宁等抗氧化活性物质,活性物质能与自由基反应,从而达到猝灭自由基的效果[35]。因此,对不同柚皮海绵层IDF超高压处理前后的总酚和总黄酮的含量进行了检测(附图1,https://doi.org/10.13995/j.cnki.11-1802/ts.037121)。经超高压处理后,3种不同柚皮海绵层IDF超高压处理后的总酚和总黄酮均出现显著下降。基于此,可以推断600 MPa超高压处理破坏了柚皮海绵层IDF的黄酮和多酚等抗氧化活性物质,从而使其ABTS阳离子自由基和DPPH自由基清除能力减弱,导致抗氧化活性的下降。在鳄梨酱中也报道了相似的结果,600 MPa超高压处理使鳄梨酱的抗氧化活性下降了10.4%[36]。
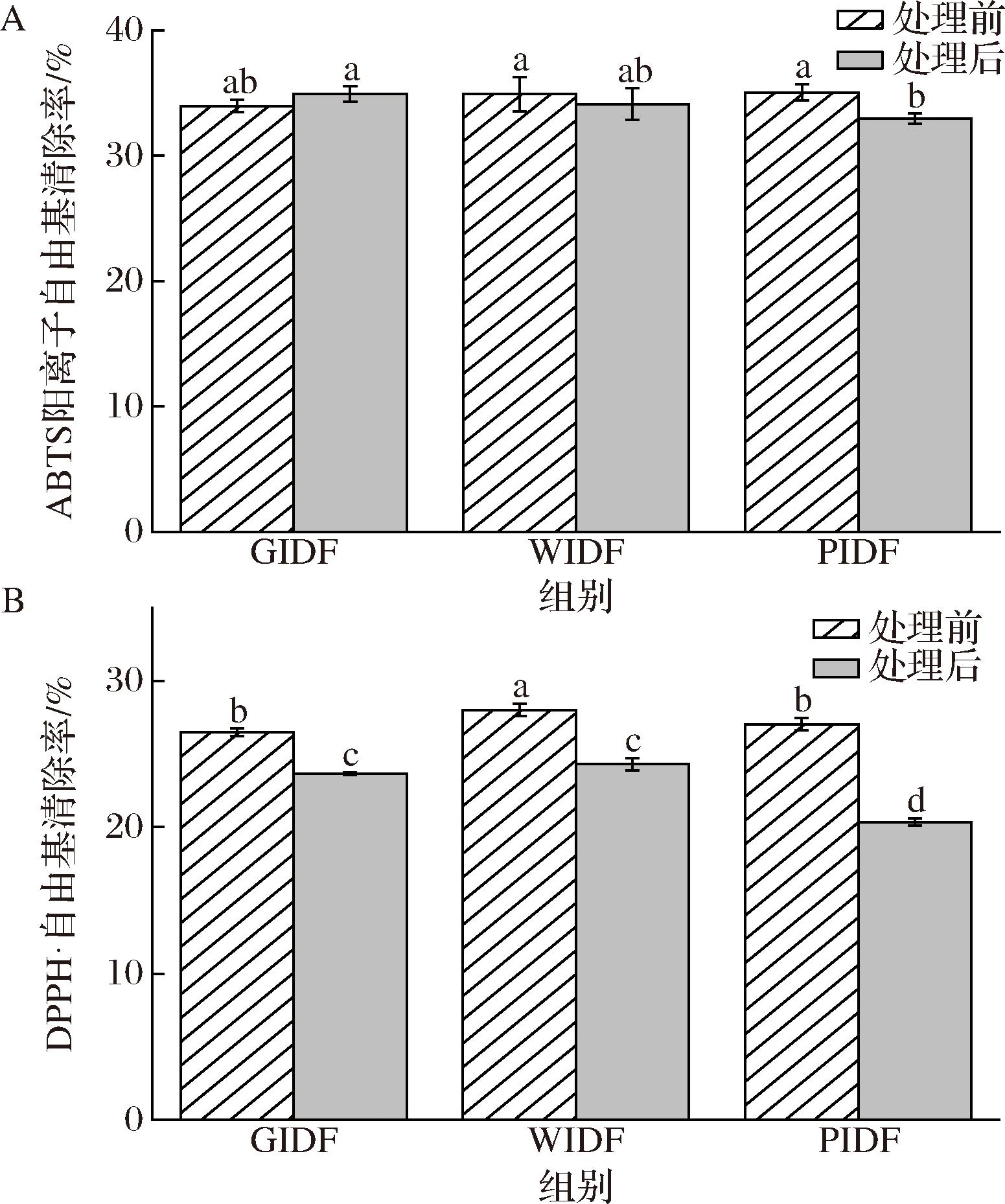
A-ABTS阳离子自由基清除率;B-DPPH自由基清除率
图5 三种柚皮海绵层IDF超高压处理前后的抗氧化能力
Fig.5 Antioxidant capacity of pomelo peel sponge layers IDF before and after UHP treatment

附图1 三种柚皮海绵层IDF超高压处理前后总酚(A)和总黄酮(B)含量
Fig.S1 Total phenolics (A) and total flavonoid (B) contents of pomelo peel sponge layer IDF before and after UHP treatment
注:误差条表示三次重复实验的标准偏差,字母(a、b、c、d)不同代表组间差异显著,(P<0.05)
3 结论
本研究以琯溪蜜柚、文旦柚、坪山柚为原料,采用超声辅助酶法制备柚皮海绵层IDF,并分析了超高压处理对柚皮海绵层IDF理化性质、结构以及抗氧化活性的影响。结果表明,超高压处理显著提高了柚皮海绵层IDF葡萄糖、木糖、阿拉伯糖和半乳糖的含量(P<0.05);XRD分析结果表明,超高压处理使 GIDF、WIDF和PIDF的相对结晶度降低;扫描电镜的结果表明,超高压处理破坏了柚皮海绵层IDF的层次结构,使其表面形成更深的空腔、质地更加疏松,组织出现明显的破碎和断裂,这也是柚皮海绵层IDF的溶胀力升高的关键因素之一。FT-IR光谱显示,超高压处理后,柚皮海绵层IDF纤维素分子内和分子间的氢键断裂,暴露更多的基团,从而使其溶胀力显著升高,其中GIDF的溶胀力最高。此外,超高压处理对柚皮海绵层IDF的ABTS阳离子自由基清除能力的影响较小,仅有PIDF的ABTS阳离子自由基清除能力出现了显著下降(P<0.05),而柚皮海绵层IDF的DPPH自由基清除率经超高压处理后均出现显著下降(P<0.05),这表明超高压处理会导致柚皮海绵层抗氧化活性下降。因此,超高压处理是对柚皮海绵层IDF进行改性的一种有效手段,但在未来的研究中还要进一步探索超高压的改性机制,优化其相关参数,使超高压处理后的IDF能够具有更好的性能。
[1] DENG M, LIN Y S, DONG L H, et al.Physicochemical and functional properties of dietary fiber from pummelo (Citrus grandis L.Osbeck) and grapefruit (Citrus paradisi Mcfad) cultivars[J].Food Bioscience, 2021, 40:100890.
[2] JIA M Y, CHEN J J, LIU X Z, et al.Structural characteristics and functional properties of soluble dietary fiber from defatted rice bran obtained through Trichoderma viride fermentation[J].Food Hydrocolloids, 2019, 94:468-474.
[3] MA Q Y, MA Z Y, WANG W X, et al.The effects of enzymatic modification on the functional ingredient-dietary fiber extracted from potato residue[J].LWT, 2022, 153:112511.
[4] WANG C F, SONG R Z, WEI S Q, et al.Modification of insoluble dietary fiber from ginger residue through enzymatic treatments to improve its bioactive properties[J].LWT-Food Science and Technology, 2020, 125:109220.
[5] SPOTTI M J, CAMPANELLA O H.Functional modifications by physical treatments of dietary fibers used in food formulations[J].Current Opinion in Food Science, 2017, 15:70-78.
[6] XIE F, LI M, LAN X H, et al.Modification of dietary fibers from purple-fleshed potatoes (Heimeiren) with high hydrostatic pressure and high pressure homogenization processing:A comparative study[J].Innovative Food Science &Emerging Technologies, 2017, 42:157-164.
[7] BRIONES-LABARCA V, MU OZ C, MAUREIRA H.Effect of high hydrostatic pressure on antioxidant capacity, mineral and starch bioaccessibility of a non conventional food:Prosopis chilensis seed[J].Food Research International, 2011, 44(4):875-883.
OZ C, MAUREIRA H.Effect of high hydrostatic pressure on antioxidant capacity, mineral and starch bioaccessibility of a non conventional food:Prosopis chilensis seed[J].Food Research International, 2011, 44(4):875-883.
[8] SANG J Q, LI L, WEN J, et al.Chemical composition, structural and functional properties of insoluble dietary fiber obtained from the Shatian pomelo peel sponge layer using different modification methods[J].LWT, 2022, 165:113737.
[9] LIU H F, ZENG X Y, HUANG J Y, et al.Dietary fiber extracted from pomelo fruitlets promotes intestinal functions, both in vitro and in vivo[J].Carbohydrate Polymers, 2021, 252:117186.
[10] XUE Z H, MA Q Q, GUO Q W, et al.Physicochemical and functional properties of extruded dietary fiber from mushroom Lentinula edodes residues[J].Food Bioscience, 2019, 32:100452.
[11] CUI J F, LIAN Y H, ZHAO C Y, et al.Dietary fibers from fruits and vegetables and their health benefits via modulation of gut microbiota[J].Comprehensive Reviews in Food Science and Food Safety, 2019, 18(5):1514-1532.
[12] ZHANG M Y, LIAO A M, THAKUR K, et al.Modification of wheat bran insoluble dietary fiber with carboxymethylation, complex enzymatic hydrolysis and ultrafine comminution[J].Food Chemistry, 2019, 297:124983.
[13] PENG J, BU Z B, REN H Y, et al.Physicochemical, structural, and functional properties of wampee (Clausena lansium (Lour.) Skeels) fruit peel pectin extracted with different organic acids[J].Food Chemistry, 2022, 386:132834.
[14] 田玉荣, 孙元琳.小麦麸皮膳食纤维改性技术研究进展[J].食品工程, 2022(2):4-7;60.TIAN Y R, SUN Y L.Recent advances on modification of dietary fiber in wheat bran[J].Food Engineering, 2022(2):4-7;60.
[15] ZHANG Y, QI J R, ZENG W Q, et al.Properties of dietary fiber from citrus obtained through alkaline hydrogen peroxide treatment and homogenization treatment[J].Food Chemistry, 2020, 311:125873.
[16] ZHANG W, WEN J, LI L, et al.Physicochemical, structural and functional properties of pomelo spongy tissue pectin modified by different green physical methods:A comparison[J].International Journal of Biological Macromolecules, 2022, 222:3195-3202.
[17] XIAO Z Q, YANG X Y, ZHAO W W, et al.Physicochemical properties of insoluble dietary fiber from pomelo (Citrus grandis) peel modified by ball milling[J].Journal of Food Processing and Preservation, 2022, 46(2):e16242.
[18] OUYANG H, GUO B L, HU Y, et al.Effect of ultra-high pressure treatment on structural and functional properties of dietary fiber from pomelo fruitlets[J].Food Bioscience, 2023, 52:102436.
[19] 陈思妤, 焦叶, 崔波, 等.膳食纤维理化特性及其改性方法研究进展[J].食品与机械, 2022, 38(5):234-240.CHEN S Y, JIAO Y, CUI B, et al.Research progress in physicochemical properties and modification methods of dietary fiber[J].Food and Machinery, 2022, 38(5):234-240.
[20] RAGHAVENDRA S N, RAMACHANDRA SWAMY S R, RASTOGI N K, et al.Grinding characteristics and hydration properties of coconut residue:A source of dietary fiber[J].Journal of Food Engineering, 2006, 72(3):281-286.
[21] LIU M, ZHOU S H, LI Y X, et al.Structure, physicochemical properties and effects on nutrients digestion of modified soluble dietary fiber extracted from sweet potato residue[J].Food Research International, 2021, 150:110761.
[22] ZHENG Y J, LI Y.Physicochemical and functional properties of coconut (Cocos nucifera L) cake dietary fibres:Effects of cellulase hydrolysis, acid treatment and particle size distribution[J].Food Chemistry, 2018, 257:135-142.
[23] MATEOS-APARICIO I, MATEOS-PEINADO C, RUPÉREZ P.High hydrostatic pressure improves the functionality of dietary fibre in okara by-product from soybean[J].Innovative Food Science &Emerging Technologies, 2010, 11(3):445-450.
[24] MA M M, MU T H.Modification of deoiled cumin dietary fiber with laccase and cellulase under high hydrostatic pressure[J].Carbohydrate Polymers, 2016, 136:87-94.
[25] HUANG J Y, LIAO J S, QI J R, et al.Structural and physicochemical properties of pectin-rich dietary fiber prepared from citrus peel[J].Food Hydrocolloids, 2021, 110:106140.
[26] LUO X L, WANG Q, FANG D Y, et al.Modification of insoluble dietary fibers from bamboo shoot shell:Structural characterization and functional properties[J].International Journal of Biological Macromolecules, 2018, 120:1 461-1 467.
[27] LI S, HU N N, ZHU J Y, et al.Influence of modification methods on physicochemical and structural properties of soluble dietary fiber from corn bran[J].Food Chemistry:X, 2022, 14:100298.
[28] MA M M, MU T H.Effects of extraction methods and particle size distribution on the structural, physicochemical, and functional properties of dietary fiber from deoiled cumin[J].Food Chemistry, 2016, 194:237-246.
[29] JIANG G H, RAMACHANDRAIAH K, TAN C Y, et al.Modification of ginseng insoluble dietary fiber by enzymatic method:Structural, rheological, thermal and functional properties[J].Foods, 2023, 12(14):2809.
[30] ZHAO X Y, CHEN J, CHEN F L, et al.Surface characterization of corn stalk superfine powder studied by FTIR and XRD[J].Colloids and Surfaces B:Biointerfaces, 2013, 104:207-212.
[31] HUA M, LU J X, QU D, et al.Structure, physicochemical properties and adsorption function of insoluble dietary fiber from ginseng residue:A potential functional ingredient[J].Food Chemistry, 2019, 286:522-529.
[32] 杨莫愁. 不同结晶度纤维素的燃烧热解特性研究[D].合肥:中国科学技术大学, 2019.YANG M C.Study on combustion and pyrolysis characteristics of cellulose with different crystallinity[D].Hefei:University of Science and Technology of China, 2019.
[33] LIU Y L, ZHANG H B, YI C P, et al.Chemical composition, structure, physicochemical and functional properties of rice bran dietary fiber modified by cellulase treatment[J].Food Chemistry, 2021, 342:128352.
[34] 耿宁宁. 鲜食玉米苞叶不溶性膳食纤维改性及功能性质[D].镇江:江苏大学, 2022.GENG N N.Modification and functional properties of insoluble dietary fiber from fresh corn bracts[D].Zhenjiang:Jiangsu University, 2022.
[35] 黄素雅, 何亚雯, 钱炳俊, 等.高静压和高压均质对豆渣水不溶膳食纤维的改性及其功能的影响[J].食品科学, 2015, 36(15):81-85.HUANG S Y, HE Y W, QIAN B J, et al.Modification of insoluble dietary fiber in okara by high pressure homogenization and high hydrostatic pressure and functional properties of the modified product[J].Food Science, 2015, 36(15):81-85.
[36] JACOBO-VEL ZQUEZ D A, HERN
ZQUEZ D A, HERN NDEZ-BRENES C.Stability of avocado paste carotenoids as affected by high hydrostatic pressure processing and storage[J].Innovative Food Science &Emerging Technologies, 2012, 16:121-128.
NDEZ-BRENES C.Stability of avocado paste carotenoids as affected by high hydrostatic pressure processing and storage[J].Innovative Food Science &Emerging Technologies, 2012, 16:121-128.