中国的兔肉生产量世界排名第一,2022年兔肉年产量51.8万t,兔产业产值约339.23亿元,在中国畜牧业产值中的占比为0.90%左右[1]。随着兔肉产量的上升,屠宰副产物产量也逐年上升,然而这些副产品很大一部分被用作低价值的饲料、肥料或被屠宰场焚烧、掩埋等。在当前节约资源、保护环境的背景下,人们对可持续和可再生蛋白质来源的需求日益增加,因此,屠宰副产物的深加工变得越来越重要。深加工可以提高副产物的附加值,减少资源浪费,同时也有助于降低环境污染。
兔胃,又称为兔肚、口口脆,是中国西南地区特色的食材,来自兔屠宰过程中的可食用部分,具有丰富的胶原蛋白。平滑肌是兔胃的主要组成结构,相较于骨骼肌,其肌内结缔组织含量较高,加热后失水严重、嫩度差,韧性强。肌内结缔组织是影响肌肉“背景硬度”的重要因素,一般来说肌肉中结缔组织含量越少,肉质越嫩,含量越高,肉质越硬[2]。近年来改善肉质的方法大致可分为三类,一是改进饲料组成及改善屠宰条件[3];二是在屠宰后对肌肉进行嫩化处理[4],包括:高压处理、添加外源酶、脉冲电场处理、冲击波处理以及滚揉等;三是采取不同的蒸煮方式软化肌内结缔组织,如长时低温蒸煮或真空低温蒸煮等[5]。然而这些研究多集中在骨骼肌,对于平滑肌嫩化的应用研究较少。
因此,本实验采用猕猴桃蛋白酶、食品级NaOH以及酶-碱联用的方法处理兔胃平滑肌(rabbits stomach smooth muscle,RSM),研究不同嫩化方式对平滑肌加工特性及胶原蛋白特性的影响,探究肌内结缔组织变化与平滑肌嫩度的关系,以期为兔副产物的深加工以及平滑肌产品的开发提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
兔胃由山东青岛康大食品股份有限公司提供,于-18 ℃的环境下贮藏。
1.1.2 实验试剂
食品级NaOH,山东滨化集团有限公司;猕猴桃蛋白酶(3 000 U/g),河北万邦实业有限公司;NaOH、无水柠檬酸、硫酸铜、氯氨T、乙酸钠,分析纯,重庆跃翔化工有限公司;无水乙醇、二甲苯、多聚甲醛、羟脯氨酸、酒石酸钾钠、乙二胺四乙酸二钠、对二甲氨基苯甲醛,分析纯,重庆阿米达试剂公司;戊二醛、异丙醇、正丙醇、硫酸、叠氮化钠,分析纯,重庆市钛新化工有限公司;天狼猩红染液,北京金克隆生物试剂公司。
1.2 仪器与设备
FA214A型分析天平,上海豪晟科学仪器有限公司;C-LM3B型数显式肌肉嫩度仪,北京天翔飞域仪器设备有限公司;Ultra-Scan PRO型测色仪,美国Hunter Lab公司;UB-7型pH计,德国Sartorius公司;TA.Plus型质构仪,英国Stable Micro System公司;Avanti J-301型冷冻离心机,美国贝克曼库尔特公司;XHF-D型内切式匀质机,新芝生物科技股份有限公司;TM4000Plus型扫描电镜,日立高新公司。
1.3 实验方法
1.3.1 样品制备
1.3.1.1 样品处理
将兔胃置于4 ℃冰箱中解冻16 h,去除胃容物及表面脂肪后清洗干净。每组3个样品对照,按照不同的嫩化工艺流程进行处理。
1.3.1.2 嫩化工艺设计
空白组:兔胃解冻→清洗处理;
酶处理组:兔胃解冻→清洗处理→2 g/L猕猴桃蛋白酶处理(35 ℃、80 min)→清水漂洗30 min;
碱处理组:兔胃解冻→清洗处理→1.5 g/L食品级NaOH处理(25 ℃、25 min)→清水漂洗30 min;
酶-碱处理组;兔胃解冻→清洗处理→2 g/L猕猴桃蛋白酶处理(35 ℃、80 min)→清水漂洗30 min→0.15%食品级NaOH处理(25 ℃、25 min)→清水漂洗30 min。
以上嫩化处理中,料液比为1∶2(g∶mL)。
1.3.2 pH测定
按照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》方法测定。
1.3.3 色泽测定
使用测色仪测定色泽。先用标准黑、白板对测色仪进行校准,再用测色仪测定样品的L*、a*、b*值,每个样品选择3个位置测定。
1.3.4 剪切力测定
参考程成鹏等[6]的方法略作修改。将处理后的样品置于蒸煮袋中,在90 ℃条件下加热。20 min后取出,冷却至室温后切成0.5 cm×1 cm×2 cm的长方体,用嫩度仪进行测试,每个样品测3次取平均值。测定结果用牛顿(N)表示。
1.3.5 蒸煮损失测定
参考LI等[7]的方法略作修改。样品嫩化处理后,擦除表面水分并精确称质量,记为m1,置于蒸煮袋中于90 ℃水浴锅中加热10 min后取出。在流水中冷却至室温,擦除表面水分后精确称量并记录加热后质量m2。蒸煮损失率的计算如公式(1)所示:
蒸煮损失率![]()
(1)
式中:m1加热前质量,g;m2为加热后质量,g。
1.3.6 质构测定
用质构仪测定样品的质地。将样品切分为1 cm×1 cm的正方形,堆叠至高度为2 cm后测定。测定参数:P36R探头,测前、测中以及测后速度分别为3、1、3 mm/s;停留间隔5 s;触发值10 g;压缩比40%。测定指标包括硬度、弹性和咀嚼性。
1.3.7 肌原纤维小片化指数(myofibril fragmentation index, MFI)测定
参考李明奇等[8]的方法并适当修改。准确称取2.00 g肉样并绞碎,加入10倍体积提取液(0.1 mol/L KCl,0.018 mol/L K2HPO4,0.007 mol/L KH2PO4,0.001 mol/L EDTA-2 Na,0.001 mol/L MgCl2,pH 7.0,4 ℃),冰浴条件下3 000×g均质1 min、4 ℃下7 680×g离心30 min,弃上清液留沉淀,重复上述操作2次。在沉淀中加入15 mL MFI提取液并均质30 s,用双层纱布过滤,所得滤液即为肌原纤维蛋白提取液。用双缩脲法测定提取液中蛋白质量浓度,再用上述MFI提取液调整蛋白质量浓度至0.5 mg/mL,在540 nm波长处测定吸光度,MFI的计算如公式(2)所示:
MFI=A540 nm×200
(2)
式中:A540 nm为540 nm波长处测定吸光度;200为吸光系数。
1.3.8 胶原蛋白含量及溶解度测定
1.3.8.1 胶原蛋白含量测定
参照GB/T 9695.23—2008《肉与肉制品 羟脯氨酸含量测定》测定样品羟脯氨酸含量,结果乘以7.25即为总胶原蛋白含量(total collagen content,TCC)。
参考常海军[9]的方法并适当修改。精确称取样品4.00 g,加入8 mL Ringer’s试剂(1.8 g NaCl,重复此操作2次。上清液加入30 mL 3 mol/L H2SO4,在110 ℃下水解16 h。再参照GB/T 9695.23—2008《肉与肉制品 羟脯氨酸含量测定》测定样品羟脯氨酸含量,结果乘以7.25即为可溶性胶原蛋白含量(soluble collagen content,SCC)。
1.3.8.2 胶原蛋白溶解度测定
胶原蛋白溶解度(collagen solubility,CS)的计算如公式(3)所示:
(3)
式中:CS为胶原蛋白溶解度,%;SCC为可溶性胶原蛋白含量,mg/g;TCC为总胶原蛋白含量,mg/g。
1.3.9 天狼猩红染色
参考佘炜等[10]的方法对RSM进行染色。先用多聚甲醛液固定样品,石蜡包埋切片;切片经二甲苯脱蜡、梯度乙醇复水,再用天狼星红饱和苦味酸染20 min,无水乙醇分化和脱水;最后利用二甲苯透明,中性树胶封固。染色结果胶原纤维呈红色,肌原纤维呈黄色。最后将标本置于光学显微镜下观察拍照(×40),并利用Image-pro软件对胶原纤维占比进行计算。
1.3.10 扫描电镜观察
参考陈婷婷等[11]的方法略作修改。取不同处理的样品,2.5%戊二醛溶液4 ℃固定24 h,弃固定液、用磷酸缓冲液(pH 7.2)漂洗、蒸馏水漂洗、乙醇溶液梯度脱水,最后真空冷冻干燥并喷金,扫描电镜(×1 000)下观察其纵切面。
2 结果与分析
2.1 不同嫩化工艺对兔胃平滑肌pH及色泽的影响
pH与生鲜肉的持水力、嫩度、颜色等指标息息相关。由表1可知,与空白组相比,3个处理组pH值均显著升高(P<0.05),其中酶-碱处理组pH变化最为显著,由6.71增加至8.25。这与LEMASTER等[12]和RIBEIRO等[13]的研究结果相一致,猕猴桃蛋白酶会水解RSM肌纤维蛋白、释放氨基酸残基引起pH变化。同时,碱处理后,NaOH溶液会进入到肌肉中进一步引起平滑肌pH的升高。
表1 不同嫩化工艺对RSM pH及色泽的影响
Table 1 The effects of different tenderization methods on the pH and color of RSM
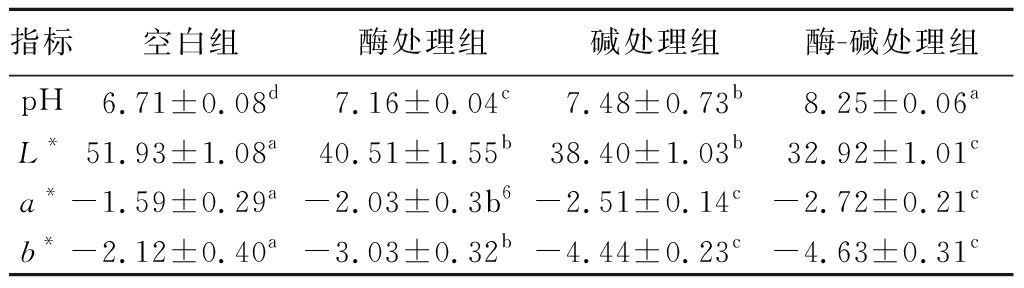
指标空白组酶处理组碱处理组酶-碱处理组pH6.71±0.08d7.16±0.04c7.48±0.73b8.25±0.06aL*51.93±1.08a40.51±1.55b38.40±1.03b32.92±1.01ca*-1.59±0.29a-2.03±0.3b6-2.51±0.14c-2.72±0.21cb*-2.12±0.40a-3.03±0.32b-4.44±0.23c-4.63±0.31c
注:不同小写字母代表组间显著性差异(P<0.05)(下同)。
肉色与肌红蛋白含量、肉品表面光学特性以及肌纤维品质相关。由表1可知,与空白组相比,酶、碱、酶-碱联合处理均显著降低了平滑肌的亮度(L*)、红度(a*)以及黄度(b*)(P<0.05)。兔胃平滑肌颜色变深,深色肉(低L*、a*、b*)和浅色肉(高L*、a*、b*)的结构和光散射特性存在显著差异。HUGHES等[14]的研究表明,与浅色牛肉相比,深色牛肉有更长的晶格间距、更短的肌节和更宽的肌纤维直径,这可能会影响光密度并有助于降低光散射。而酶处理与碱处理均会改变RSM的持水力与pH,使得肌纤维吸水溶胀,最终导致肉色由浅变深。
2.2 不同嫩化工艺对兔胃平滑肌剪切力及蒸煮损失的影响
剪切力可以直观反映肌肉的嫩度,剪切力越小,肉嫩度越高。由图1可知,经过处理后兔胃平滑肌剪切力显著降低(P<0.05)。其中未处理的平滑肌剪切力为30.1 N,酶处理后剪切力降低26.6%,碱处理后降低30.2%,酶-碱联合处理后降低45.2%。研究结果表明,猕猴桃蛋白酶与NaOH均可有效改善平滑肌的嫩度。但它们的作用机理不同,猕猴桃蛋白酶属于硫醇蛋白酶,可特异性地降解肌纤维和结缔组织来改善肌肉嫩度;而氢氧化钠则可能是通过改变肌肉pH环境,增加肌纤维蛋白与胶原蛋白中净负电荷量,使得胶原纤维溶胀来改善嫩度[15-16]。
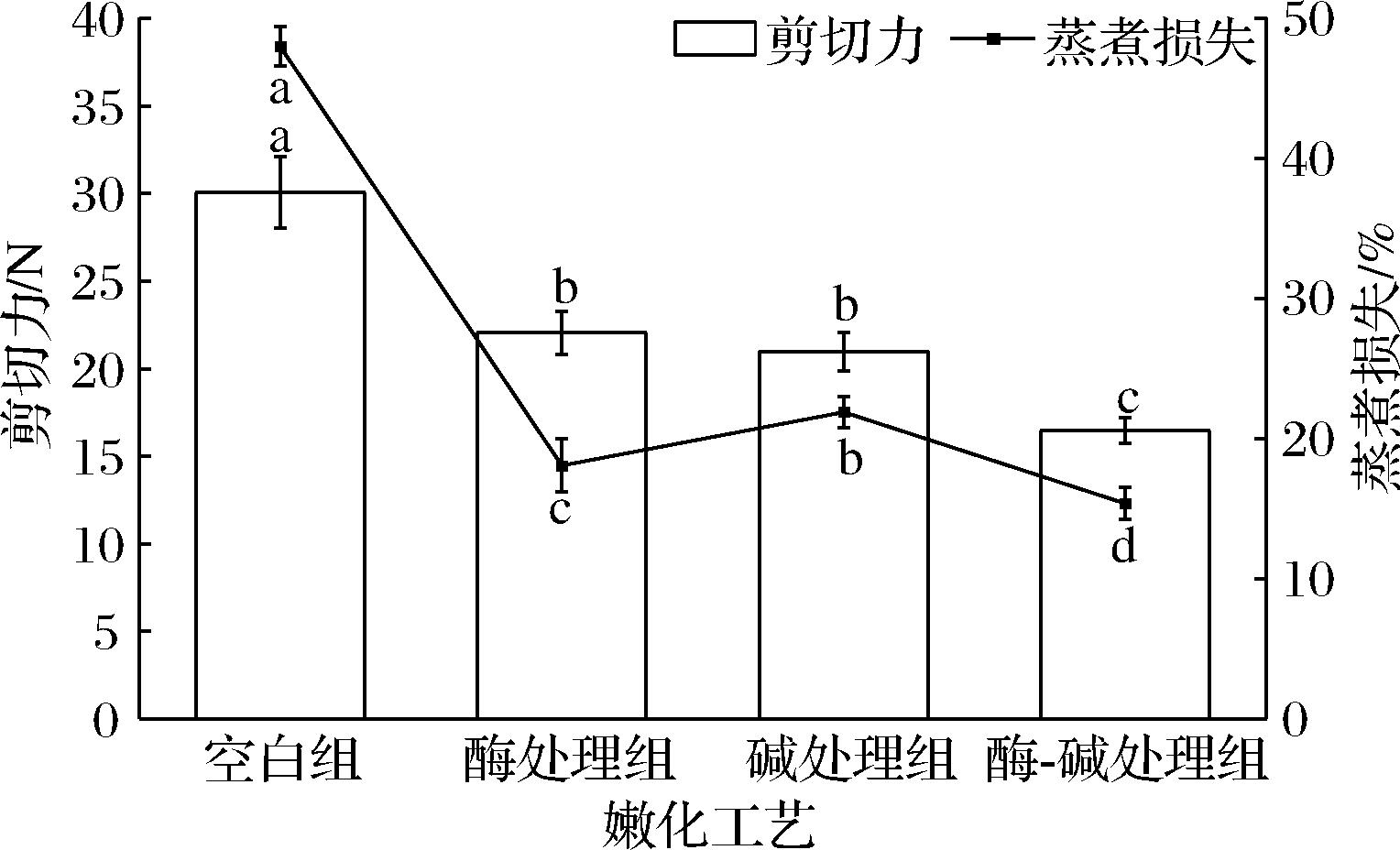
图1 不同嫩化工艺对RSM剪切力及蒸煮损失的影响
Fig.1 The effects of different tenderization methods on the shear force and cooking loss of RSM
注:不同小写字母代表组间存在显著性差异(P<0.05)(下同)。
蒸煮损失是反映肉制品持水力的重要指标,蒸煮损失越小,肉制品保水力越强。由图1可知,与空白组相比,各组蒸煮损失均显著降低(P<0.05),且联合处理组蒸煮损失降低幅度最大,从49.9%降至15.6%。平滑肌蒸煮损失通常高于骨骼肌,是因为平滑肌为非横纹肌,其肌纤维中的粗丝与细丝杂乱分布,缺乏骨骼肌中并行排列的肌原纤维结构,无法束缚水分。而经过酶-碱联合处理后的平滑肌,一方面结缔组织降解,肌纤维间斥力增强,间隙变大;另一方面肌纤维蛋白亲水基团暴露,溶解度上升,蛋白质持水性增强,从而降低了蒸煮损失[17]。
2.3 不同嫩化工艺对兔胃平滑肌质构特性的影响
硬度、咀嚼性与弹性是评价平滑肌质构特性的重要指标。不同嫩化方式对RSM质构特性的影响如图2所示。与空白组相比,平滑肌在不同处理下的硬度与咀嚼性显著降低,弹性显著上升(P<0.05)。其中,空白组硬度、咀嚼性、弹性分别为3 451.87 N、5 020.81 mJ、1.57 mm,酶处理后硬度降低47%、咀嚼性降低40%、弹性上升14%;碱处理硬度降低54%、咀嚼性降低39%、弹性上升28%;酶-碱处理后硬度降低62%、咀嚼性降低51%、弹性上升30%。实验结果表明,相较于单一处理,酶-碱联合处理改善RSM质构特性的能力更强。这与ZHANG等[18]的研究结果相似,经酶-碱处理后的RSM肌纤维与结缔组织降解,持水力增强,有助于改善弹性、降低硬度和咀嚼性。

图2 不同嫩化工艺对RSM质构特性的影响
Fig.2 The effects of different tenderization methods on the texture of RSM
2.4 不同嫩化工艺对兔胃平滑肌胶原蛋白含量及溶解性的影响
胶原蛋白是肌内结缔组织的主要成分之一,存在于肌肉中的肌外膜、肌束膜以及肌内膜中,胶原蛋白的含量、溶解性以及交联度都是影响肌肉“背景硬度”的重要因素[19]。如图3-a所示,与空白组相比,酶处理组、碱处理组以及酶-碱联合处理组总胶原蛋白含量较空白组均显著下降(P<0.05),分别降低22%、29%以及40%。这与剪切力的变化趋势一致。由图3-b及图3-c可知,与空白组相比不同处理组TCC和SCC显著上升(P<0.05),且酶-碱联合组上升程度较单一处理更大。这与赵鸾[20]和CHRISTENSEN等[21]的研究结果相似。
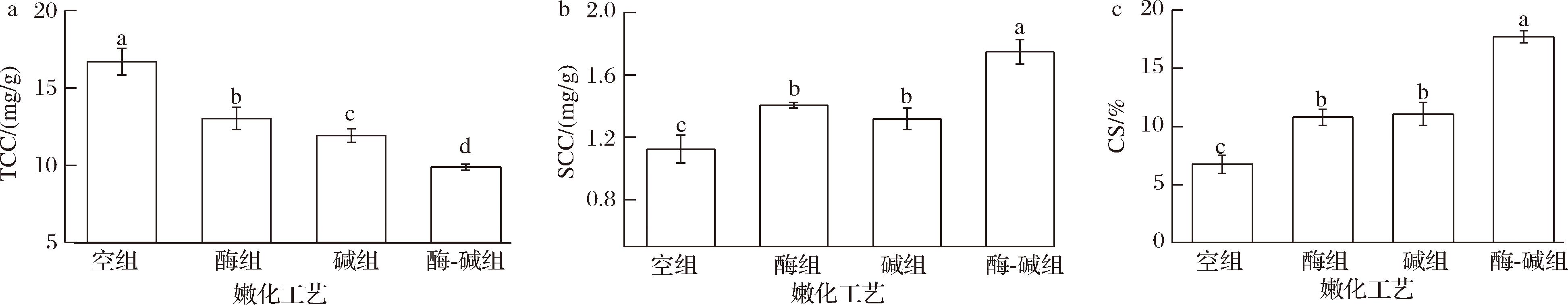
a-TCC;b-SCC;c-CS
图3 不同嫩化工艺对RSM胶原蛋白含量和溶解度的影响
Fig.3 The effects of different tenderization methods on the collagen content and solubility of RSM
胶原纤维是肌肉组织中的主要结构蛋白,对肌肉的质地和口感有重要影响。胶原蛋白的含量降低以及溶解度的上升代表了肌束膜等结缔组织的降解,而结缔组织的弱化又是平滑肌嫩度改善的重要因素。研究结果表明,猕猴桃蛋白酶协同NaOH对兔胃平滑肌结缔组织的降解优于单一处理。其原因可能是,NaOH在猕猴桃蛋白酶降解平滑肌肌内膜的基础上进一步改变胶原蛋白氨基酸残基的“微环境”,引起其微观结构改变,最终导致结缔组织结构弱化程度加深,平滑肌嫩度改善[20]。
2.5 不同嫩化工艺对兔胃平滑肌MFI的影响
MFI指小片段肌原纤维在总肌原纤维片段中占有的比例,是反映肌原纤维蛋白和骨架蛋白降解程度的重要指标,同时也是表征肉嫩度的主要指标之一,其值越大,说明鲜肉嫩度越好[22]。不同加工工艺对平滑肌肌原纤维小片化的影响如图4所示,与空白组相比,其余3组MFI显著增加(P<0.05),其中酶组增加59%、碱组增加49%、酶-碱组增加133%。说明猕猴桃蛋白酶与NaOH处理都能够显著降解肌纤维,且其联合处理改善平滑肌嫩度效果更好。其原因一方面是蛋白酶驱动肌动蛋白和肌球蛋白水解,肌丝被分解,导致肌纤维长度缩短,另一方面NaOH溶液的pH值远离肌原纤维蛋白的等电点,导致蛋白质溶解度增加,肌纤维进一步解离[18,23]。
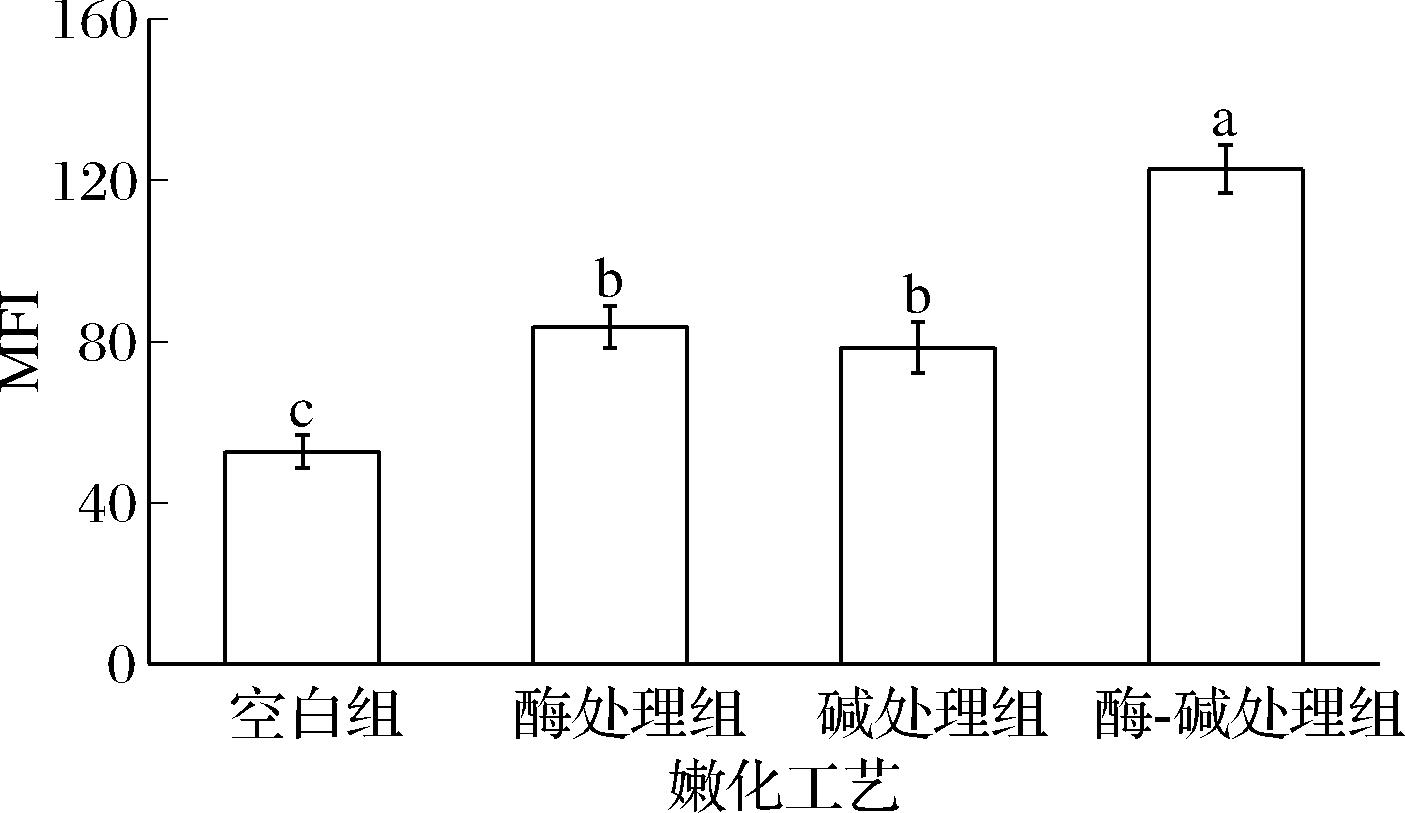
图4 不同嫩化方式对RSM肌原纤维小片化指数的影响
Fig.4 The effects of different tenderization methods on the MFI of RSM
2.6 不同加工方式兔胃平滑肌天狼猩红染色结果
天狼猩红-苦味酸染料可与富含碱性氨基酸的胶原分子反应,是观察动物组织中胶原蛋白最有效的方式。在光镜下,平滑肌经染色后结缔组织呈红色,肌纤维呈黄色。兔胃平滑肌天狼猩红染色结果及胶原纤维占比如图5所示。空白组图5-a结缔组织色深为深红色、胶原纤维完整、粗大且结合紧密;酶处理组图5-b与碱处理组图5-c结缔组织色稍浅为亮红色、胶原纤维部分断裂、溶胀且初步分散;酶-碱处理组图5-d结缔组织色淡化为浅红色、胶原纤维断裂、溶胀且解离松散。肌原纤维间隙也呈现增大趋势,这与兔胃平滑肌剪切力、MFI降低的趋势一致。如图5-e所示,对胶原纤维占比进一步分析,经处理后胶原蛋白占比均降低,其中空白组占比36.32%、酶组占比23.49%、碱组占比19.69%、酶-碱组为17.15%。这与总胶原蛋白含量降低趋势一致。
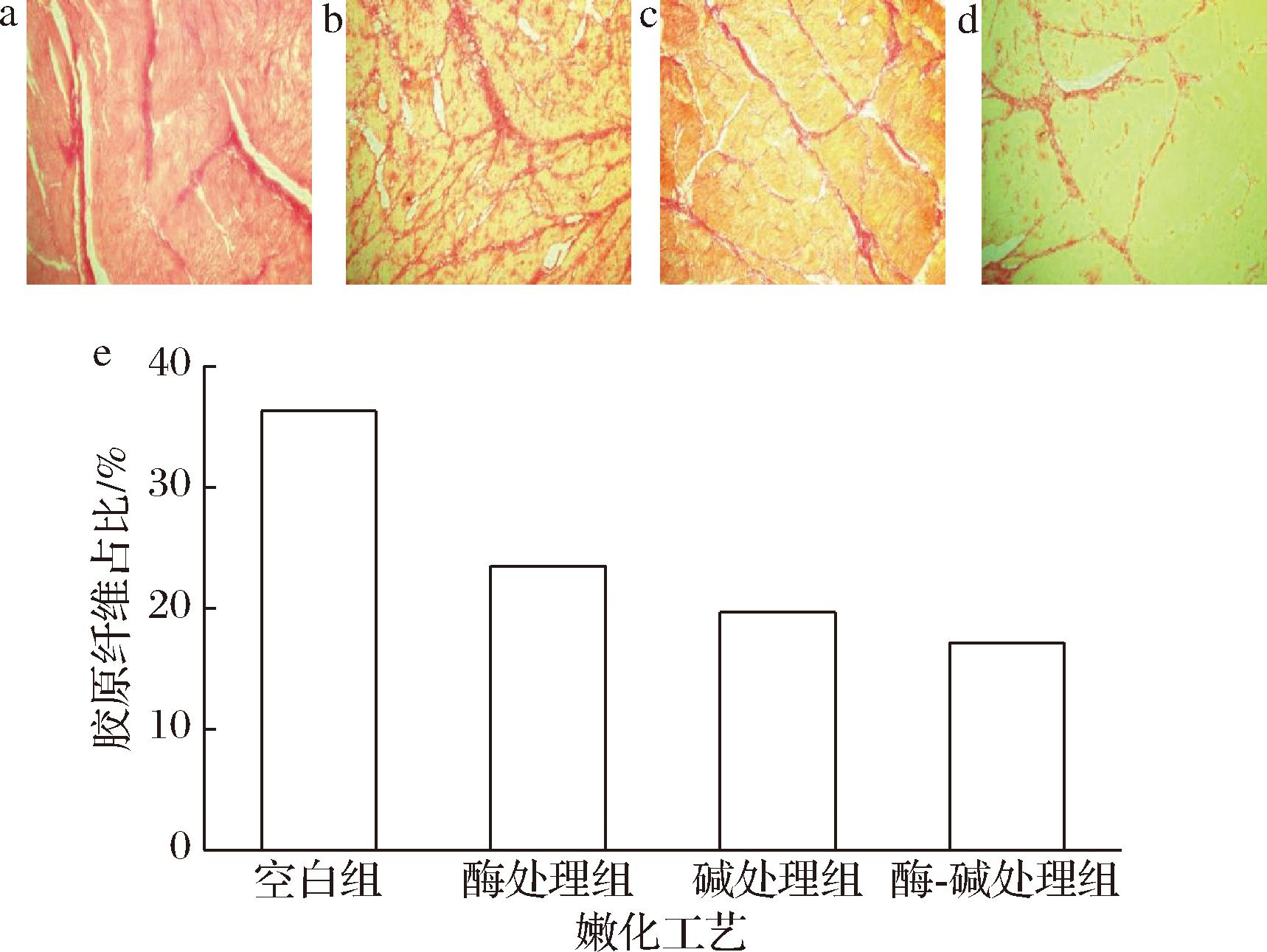
a-空白组;b-酶处理组;c-碱处理组;d-酶-碱处理组;e-胶原纤维占比
图5 不同嫩化工艺对兔胃平滑肌天狼猩红染色结果的影响
Fig.5 The effects of different tenderizing methods on the sirius red staining of RSM
2.7 不同嫩化工艺兔胃平滑肌微观结构
图6-a是未处理组兔胃平滑肌扫描电镜图,可以看出平滑肌肌纤维与肌内膜紧密贴合,结缔组织结构完整且规整有序。图6-b为酶组平滑肌扫描电镜图,与空白组相比,酶处理后的结缔组织整体呈现膨大现象,肌内膜溶解出现少量空洞。这是因为猕猴桃蛋白酶水解肌原纤维与结缔组织中的胶原纤维,使得平滑肌持水力增强,肌内不易流动水增加。图6-c为碱处理组扫描电镜图,可以观察到肌内膜吸水溶胀,溶解程度加剧且表面出现较大孔洞。与酶组、碱组相比,酶-碱联合处理对平滑肌结构的破坏更为彻底。由图6-d可知:肌内膜进一步溶解,表面孔洞数量增多、直径增大,胶原纤维分布松散无序程度上升。这可能是因为猕猴桃蛋白酶先分解肌束膜与肌内膜,使得肌胶原纤维与碱液更充分接触,有利于胶原纤维进一步吸水溶胀。平滑肌微观结构的变化与猩红染色的结果相一致,且与剪切力、MFI以及胶原蛋白变化趋势一致。
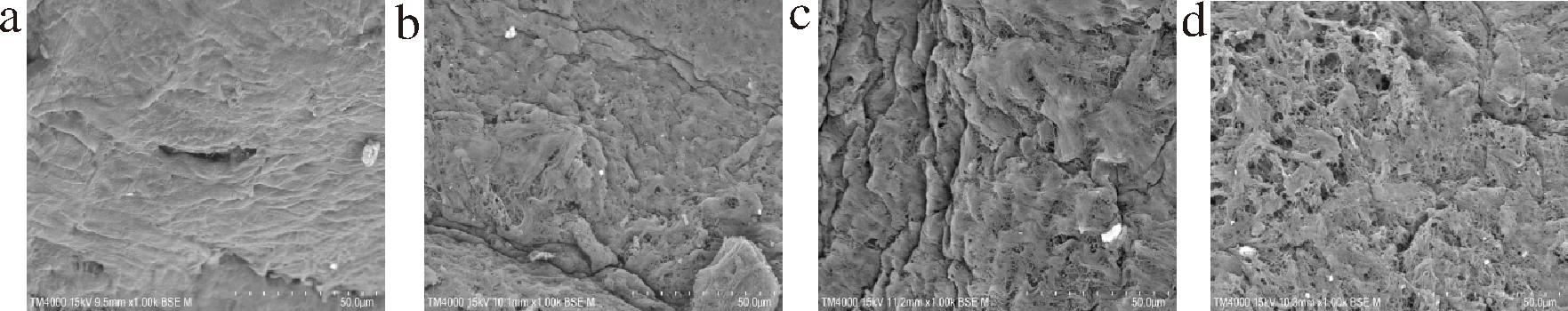
a-空白组;b-酶处理组;c-碱处理组;d-酶-碱处理组
图6 不同的嫩化工艺对RSM微观结构的影响
Fig.6 The effects of different tenderizing methods on the microstructure of RSM
2.8 相关性分析
对嫩化过程中兔胃平滑肌的剪切力、蒸煮损失、质构特性、MFI、胶原蛋白含量及溶解度进行了相关性分析,结果如图7所示。剪切力与蒸煮损失、硬度、咀嚼性、总胶原蛋白含量呈极显著正相关,与弹性、MFI、可溶性胶原蛋白含量、胶原蛋白溶解度呈极显著负相关。蒸煮损失与硬度、咀嚼性、总胶原蛋白含量呈极显著负相关;与MFI、可溶性胶原蛋白含量呈极显著正相关,与胶原蛋白溶解度呈显著正相关。从相关性系数的大小来看,总胶原蛋白含量是影响平滑肌嫩度、保水力以及质构特性的最主要因素,其与剪切力、蒸煮损失、硬度、弹性、咀嚼性的相关性系数分别为0.95、9.91、0.94、-0.9、0.93。研究表明,结缔组织是连接肌肉组织的重要结构,通常肌内结缔组织越多,胶原蛋白含量越高,肌肉在加热后形变程度越深,水分流失越多,嫩度、保水性以及质构特性劣变越严重[24]。
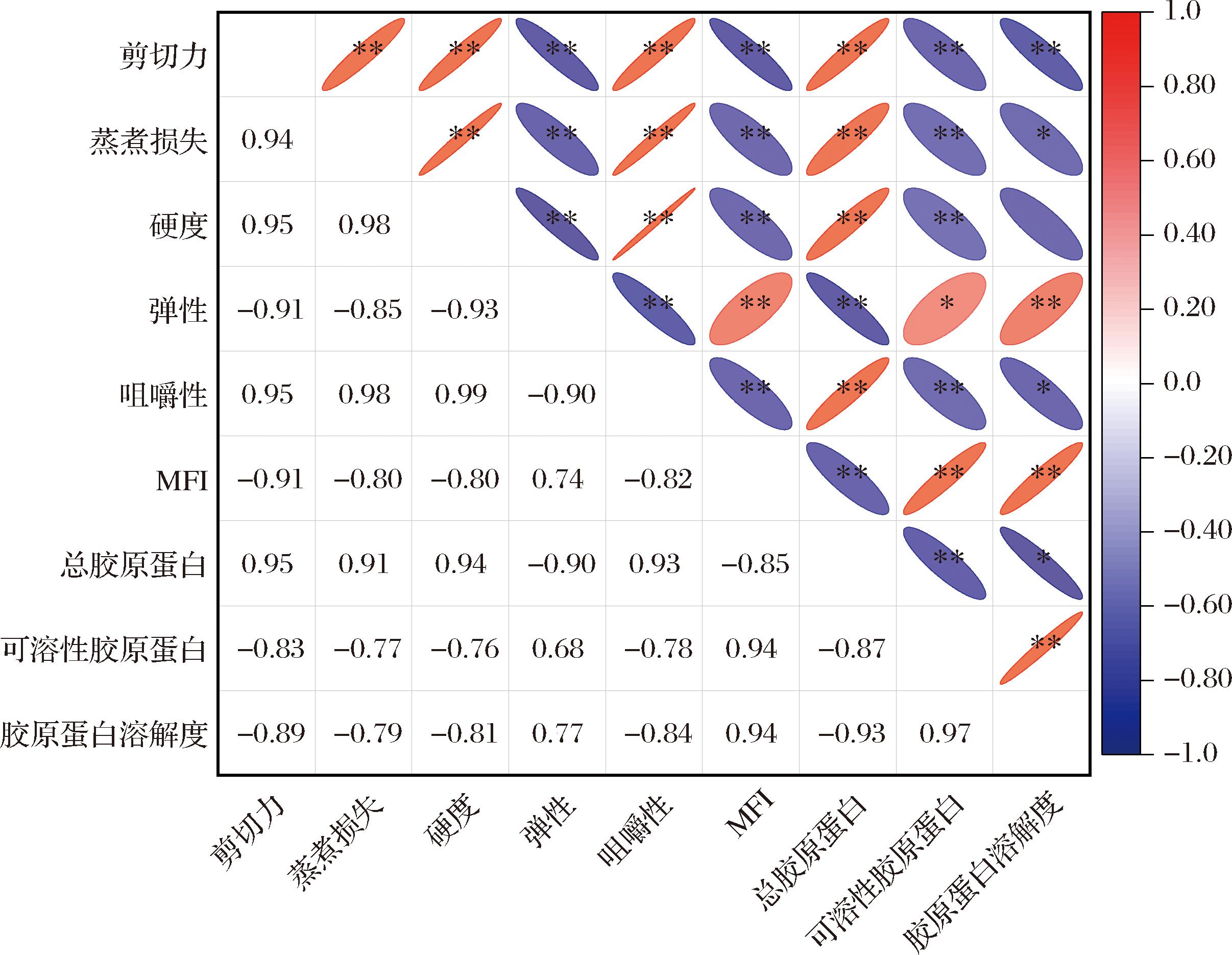
图7 嫩化过程中兔胃平滑肌的加工特性、MFI和胶原蛋白变化的相关性分析
Fig.7 Correlation analysis of processing characteristics, MFI, and collagen changes in RSM during processing
注:*代表在0.05的水平上相关关系显著;**代表在0.01水平上相关关系显著。
3 结论与讨论
兔胃平滑肌经猕猴桃蛋白酶以及NaOH处理后,总胶原蛋白含量显著降低、MFI以及胶原蛋白溶解度显著提高,其保水性及食用品质得到改善,包括弹性增加、嫩度提升、咀嚼性下降等。酶-碱联合处理对平滑肌品质改善效果优于单一处理。微观结构及相关性分析表明,总胶原蛋白含量是影响平滑肌品质的重要因素,而酶-碱联合处理可通过降解肌纤维、削弱结缔组织,从而改善兔肚的嫩度。总体来说,通过猕猴桃蛋白酶和NaOH的酶-碱联合处理,可以有效改善兔胃平滑肌的食用品质,为平滑肌加工提供了一种新的方法。
[1] 武拉平, 王建勋, 秦应和. 2022年兔产业生产概况、2023年发展趋势及政策建议[J]. 中国畜牧杂志, 2023, 59(3):348-352.WU L P, WANG J X, QIN Y H. General situation of rabbit industry production in 2022, development trend in 2023 and policy suggestions[J]. Chinese Journal of Animal Science, 2023, 59(3):348-352.
[2] G RSKA M, WOJTYSIAK D. Importance of intramuscular connective tissue for meat quality[J]. Medycyna Weterynaryjna, 2016, 72(10):600-603.
RSKA M, WOJTYSIAK D. Importance of intramuscular connective tissue for meat quality[J]. Medycyna Weterynaryjna, 2016, 72(10):600-603.
[3] PURSLOW P P, ARCHILE-CONTRERAS A C, CHA M C. Meat science and muscle biology symposium: Manipulating meat tenderness by increasing the turnover of intramuscular connective tissue[J]. Journal of Animal Science, 2012, 90(3):950-959.
[4] 汪洋, 王稳航.肌内结缔组织与肉嫩度的关联机制及相关肉嫩化技术的研究进展[J].食品科学, 2021, 42(11):332-340.WANG Y, WANG W H.A review of the mechanism of the association between intramuscular connective tissue and meat tenderness and related meat tenderization technologies[J].Food Science, 2021, 42(11):332-340.
[5] LATORRE M E, PALACIO M I, VELáZQUEZ D E, et al.Specific effects on strength and heat stability of intramuscular connective tissue during long time low temperature cooking[J].Meat Science, 2019, 153:109-116.
[6] 程成鹏, 贺稚非, 唐春, 等.不同嫩化剂改善猪大肠嫩度的工艺优化[J].食品与发酵工业, 2022, 48(15):249-256.CHENG C P, HE Z F, TANG C, et al.Process optimization for the improvement of pig large intestine tenderness with different tenderizing agents[J].Food and Fermentation Industries, 2022, 48(15):249-256.
[7] LI S J, MA R C, PAN J F, et al.Combined effects of aging and low temperature, long time heating on pork toughness[J].Meat Science, 2019, 150:33-39.
[8] 李明奇, 贺稚非, 李少博, 等.氯化钙-无花果蛋白酶-猕猴桃蛋白酶体系对兔肉肌原纤维蛋白结构的协同作用[J].食品科学, 2021, 42(4):8-14.LI M Q, HE Z F, LI S B, et al.Synergistic effect of calcium chloride-fig protease-kiwifruit protease blend as meat tenderizer on myofibrillar protein structure of rabbit meat[J].Food Science, 2021, 42(4):8-14.
[9] 常海军. 不同加工条件下牛肉肌内胶原蛋白特性变化及其对品质影响研究[D].南京:南京农业大学, 2010.CHANG H J.Studies on effects of different processing conditions on characteristics changes of collagen and meat quality of beef muscle[D].Nanjing:Nanjing Agricultural University, 2010.
[10] 佘炜, 魏江, 董丹丹, 等.NRP1调控M2型巨噬细胞极化介导电离辐射肺纤维化的作用研究[J].中国免疫学杂志, 2023, 39(2):252-256.SHE W, WEI J, DONG D D, et al.NRP1 regulates polarization-mediated ionizing radiation pulmonary fibrosis of M2 macrophages[J].Chinese Journal of Immunology, 2023, 39(2):252-256.
[11] 陈婷婷, 崔泽恒, 包海蓉, 等.两种鱿鱼胴体肉热加工特性的研究[J].食品与发酵工业, 2023, 49(8):51-59.CHEN T T, CUI Z H, BAO H R, et al.Study on thermal processing characteristics of two kinds of squid carcass meat[J].Food and Fermentation Industries, 2023, 49(8):51-59.
[12] LEMASTER M N, CHAUHAN S S, WICK M P, et al.Potassium carbonate improves fresh pork quality characteristics[J].Meat Science, 2019, 156:222-230.
[13] RIBEIRO W O, OZAKI M M, DOS SANTOS M, et al.Evaluating different levels of papain as texture modifying agent in bovine meat loaf containing transglutaminase[J].Meat Science, 2023, 198:109112.
[14] HUGHES J, CLARKE F, LI Y, et al.Differences in light scattering between pale and dark beef longissimus thoracis muscles are primarily caused by differences in the myofilament lattice, myofibril and muscle fibre transverse spacings[J].Meat Science, 2019, 149:96-106.
[15] BAGHERI KAKASH S, HOJJATOLESLAMY M, BABAEI G, et al.Kinetic study of the effect of kiwi fruit actinidin on various proteins of chicken meat[J].Food Science and Technology, 2019, 39(4):980-992.
[16] KANG Z L, ZHANG X H, LI K P, et al.Effects of sodium bicarbonate on the gel properties, water distribution and mobility of low-salt pork batters[J].LWT, 2021, 139:110567.
[17] 余青青, 刘娇, 洪惠, 等.生鲜肉持水性机理研究进展[J].食品科学, 2023, 44(5):241-247.YU Q Q, LIU J, HONG H, et al.Research progress on the mechanism of water-holding capacity of fresh meat[J].Food Science, 2023, 44(5):241-247.
[18] ZHANG S S, ZHANG L, WANG S J, et al.Comparison of plant-origin proteases and ginger extract on quality properties of beef rump steaks[J].Food Science and Technology Research, 2019, 25(4):529-538.
[19] ROY B C, BRUCE H L.Contribution of intramuscular connective tissue and its structural components on meat tenderness-revisited:A review[J].Critical Reviews in Food Science and Nutrition, 2023: 1-31.
[20] 赵鸾. 毛肚碱发过程中理化性质的研究[D].重庆:西南大学, 2021.ZHAO L.Study on the physicochemical properties during the lye macerating of tripe[D].Chongqing:Southwest University, 2021.
[21] CHRISTENSEN M, TØRNGREN M A, GUNVIG A, et al.Injection of marinade with actinidin increases tenderness of porcine M.biceps femoris and affects myofibrils and connective tissue[J].Journal of the Science of Food and Agriculture, 2009, 89(9):1607-1614.
[22] HUANG C Y, IJAZ M, CHEN L, et al.Effect of chilling rate on heat shock proteins abundance, myofibrils degradation and caspase-3 activity in postmortem muscles[J].International Journal of Food Science and Technology, 2022, 57(10):6492-6502.
[23] ZOU Y, SHI H B, XU P P, et al.Combined effect of ultrasound and sodium bicarbonate marination on chicken breast tenderness and its molecular mechanism[J].Ultrasonics-Sonochemistry, 2019, 59:104735.
[24] WANG J F, YANG P, HAN D, et al.Role of intramuscular connective tissue in water holding capacity of porcine muscles[J].Foods, 2022, 11(23):3835.