副溶血性弧菌(Vibrio parahaemolyticus, Vp)是一种革兰氏阴性嗜盐致病菌,广泛存在于海洋和海产品中[1]。食用被致病性Vp污染的食物可引起腹泻、急性肠胃炎和败血症,重症患者可表现为脱水、休克昏迷甚至死亡[2]。Vp导致的食物中毒多发生在沿海地区,其已成为我国食物中毒的主要病原菌[3]。近年来,有调查研究发现,内陆淡水产品中检出的致病性弧菌种类在不断增多,而且由淡水产品中致病性弧菌引起的食物中毒时有发生[4]。2021年重庆市万州区报道2起Vp食物中毒事件[5]。对该地区水产品中Vp的监测尤为重要。
本研究于2022年3月—2023年2月对万州区零售淡水鱼中Vp的污染情况进行了监测,初步了解Vp的污染状况及血清型、耐药情况及分子分型,为淡水鱼养殖、消费和临床治疗Vp导致的食源性疾病提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
于2022年3月—2023年2月从重庆市万州区零售环节的各大型超市采购,按随机采样原则采集鲜活淡水鱼,包括草鱼、花鲢、鲫鱼、黄辣丁、武昌鱼,共计141份。覆盖本区居民餐桌上主要食用淡水鱼品种,具有一定的代表性,样品置于4 ℃采样箱运回实验室,当天进行处理。
1.1.2 主要实验试剂
3% NaCl碱性蛋白胨水(alkaline peptone water,APW)、6×DNA Loading Buffer,北京索莱宝科技有限公司;TCBS培养基、胰蛋白胨大豆琼脂(tryptose soya agar,TSA),青岛海博生物技术有限公司;GeneGreen核酸染料、D2000 DNA Maker、Taq DNA Poiymerase,天根生化科技(北京)有限公司;琼脂糖、50×TAE Buffer,生工生物工程(上海)股份有限公司;2×Taq Master Mix,近岸蛋白质科技有限公司;引物由华大基因合成;成套药敏纸片(20种),杭州微生物试剂有限公司。
1.2 仪器与设备
Biometra Tone 96 热循环仪、Centrifuge 5430R 高速冷冻离心机、移液枪,德国耶拿分析仪器股份公司;Bio Photometerplus核酸蛋白快速检测仪,艾本德公司;UV-1200型紫外可见分光光度计,上海美谱达仪器有限公司;DYY-7C型电泳仪、WD-9413B凝胶成像分析仪,北京六一生物科技有限公司。
1.3 实验方法
1.3.1 副溶血性弧菌的定量检测
最大可能数(most probable number, MPN)按照国标GB 4789.7—2013《食品安全国家标准 食品微生物学检验副溶血性弧菌检验》定量检测方法,根据证实为Vp阳性的试管管数,查询《副溶血性弧菌最可能数(MPN)检索表》获得样品中Vp的MPN数值。
1.3.2 副溶血性弧菌的分离与鉴定
参照GB 4789.7—2013中的方法对对采集到的样品Vp进行分离检测。疑似菌株通过PCR扩增Vp种特异性基因tlh鉴定[6],扩增结束后,取5 μL PCR扩增产物在1%的琼脂糖凝胶中采用120 V电泳30 min后,用凝胶成像分析仪分析,阳性PCR产物测序后,上传到数据库比对确认。阳性Vp使用20%甘油保存于-80 ℃冰箱。实验中所使用的引物序列、退火温度、片段大小如表1所示。
表1 实验中所用引物
Table 1 Primers for the experiment

引物名称序列5'-3',L/R退火温度/℃片段大小/bp参考文献tlhAAAGCGGATTATGCAGAAGCACTGGCTACTTTCTAGCATTTTCTCTGC56450[6]tdhGTAAAGGTCTCTGACTTTTGGACTGGAATAGAACCTTCATCTTCACC58269[6]trhTTGGCTTCGATATTTTCAGTATCTCATAACAAACATATGCCCATTTCCG58500[6]toxRGTCTTCTGACGCAATCGTTGATACGAGTGGTTGCTGTCATG63368[7]pirAATGAGTAACAATATAAAACATGAAACGTGGTAATAGATTGTACAGAA53336[8]T3SS1ACCGAGTTGCCAACGTGGATTGTTCCGCGATTTCTTG60300[9]T3SS2αGGCTCTGATCTTCGTGAAGATGTTTCAGGCAACTCTC60393[9]T3SS2βGCTCTCCTTGGTACCAATCACCTGGGATCTTGATGTCAAGGT501 067[10]O1CAACATAACCACGTCTGAACCTCGTGTATTTCATTAGTTCGG60474[11]O2TCCGAGGGATATTGAAGGGTAATCGTCCGATAGGCTTGC60238[11]O4TCTTCCGCCAACTCAGCATCAGTTGGAGACTCGCCTTC60671[11]O5ATGCGATGACTAAAAAAGGGTATTTATTGATCGGCAAGAAGTC60852[11]O6GCACTCGGAAACCAGAGATTAGCTAACTCCTCGCCTATCAG601 409[11]O10GTAACCTCGCCTTTCCTCGCGGACTCTGCGAAAGTAAAG60343[11]O3/O13CAAATGCGTAACGGTAACATGACCATCAGGACCGTAAGT60868[11]O7GCGGCATTGAACCAGACTATTTTCGAGTGTGTACGGC60385[11]O8ATTGGTGGAATGGACGAGTTGGCAACTCACAGAGCTCAT60680[11]O9TAATGAAATAGAAGTCGTGGCGTATTCCCTGAACTGGCTC60419[11]O11TGGTCTTTGGCTTGCTCACGATTTCCATACAGGCTAACG60524[11]O12TGACGGTCAAAGAGCTACGCACGGACTCTGCGAAAGTAAAG60256[11]
1.3.3 副溶血性弧菌毒力基因检测
将冻存于-80 ℃冰箱的Vp放在冰上缓慢解冻后,接种至3% NaCl的TSA平板上,置于(36±1) ℃恒温培养箱内培养18~24 h。将纯培养后的菌株使用100 ℃煮沸裂解法提取DNA[1]。通过PCR方法检测Vp的tdh、trh、toxR、pirA、T3SS1、T3SS2α和T3SS2β基因。PCR反应体系(25 μL):2×Taq Master Mix 12.5 μL、10 μmol/L上下引物各1 μL、DNA模板1 μL、ddH2O 9.5 μL。反应条件参照文献所述[6-10]。
1.3.4 副溶血性弧菌血清型检测
采用多重PCR方法检测Vp的O群血清型,参考CHEN等[11]方法。将多重PCR分为2组,组1为:O1、O2、O4、O5、O6、O10;组2为:O3/O13、O7、O8、O9、O11、O12;PCR反应体系(25 μL):2×Taq Master Mix 10 μL、10 μmol/L上下引物各0.5 μL、100 ng DNA模板0.8 μL、添加ddH2O补足25 μL反应体系。优化后PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火45 s,72 ℃延伸1 min,循环25次;72 ℃延伸1 min。最后将PCR扩增产物置于2%的琼脂糖凝胶中电泳(120 V,30 min)后观察。
1.3.5 副溶血性弧菌药物敏感性实验
按照世界卫生组织(World Health Organization,WHO)推荐的纸片扩散法进行药敏试验,结合美国临床和实验室标准化协会(Clinical and Laboratory Standards Institute, CLSI)的标准判定[12]。药敏结果分为敏感(S)、中介(I)和耐药(R)。测试六类20种抗生素的耐药性,包括青霉素类:青霉素(10 U)、苯唑西林(1 μg)、氨苄西林(10 μg)、羧苄西林(100 μg)、哌拉西林(100 μg);四环素类:四环素(30 μg)、多西环素(30 μg)、米诺环素(30 μg);氨基糖疳类:新霉素(30 μg)、庆大霉素(10 μg)、卡那霉素(30 μg)、丁胺卡拉(30 μg);头孢类:头孢哌酮(75 μg)、头孢拉定(30 μg)、头孢唑林(30 μg)、头孢氨苄(30 μg)、头孢曲松(30 μg)、头孢呋辛(30 μg)、头孢他啶(30 μg);大环内酯类:红霉素(15 μg)。每种抗生素3个平行,以标准敏感菌株大肠杆菌ATCC25922为质控菌。
1.3.6 肠杆菌科基因间重复序列(enterobacterial repetitive intergenic consensus, ERIC)-PCR分型分析
参考ALI等[13]的方法,检测分离株间的克隆相关性,2个引物序列为ERIC-1:5′-ATGTAAGCTCCTGGGGATTCAC-3′和ERIC-2:5′-AAGTAAGTGACTGGGGTGAGCG-3′。PCR反应体系为25 μL,包括2×Taq Master Mix 12.5 μL、10 μmol/L上下引物各1 μL、50~100 ng DNA模板1 μL、ddH2O 9.5 μL。反应条件为:94 ℃,5 min,进入循环;94 ℃变性45 s、52 ℃退火1 min、72 ℃延伸1 min,30个循环;最后72 ℃ 延伸10 min。取5 μL PCR产物在1.5%琼脂糖凝胶中电泳(120 V,90 min),通过凝胶成像系统观察分析,将有条带的记为1,无带记为0,在Excel构成矩阵,导入NTSYS软件,使用非加权组平均法(unweighted pair-group method with arithmetic means, UPGMA)进行分型分析。
1.4 数据处理
当MPN值<3.0或30 MPN/g,分别估算为1.5或15 MPN/g[14];当MPN值>1 100或11 000 MPN/g,假定往后一个稀释梯度的阳性管数3.3.0估算为2 400或24 000 MPN/g[15]。
用Excel 2016对数据进行录入和处理,使用SPSS 27.0软件进行统计学分析,用χ2检验比较各组之间差异,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 副溶血性弧菌污染状况
于2022年3月—2023年2月采集5种淡水鱼141份进行Vp定性和定量检测,PCR扩增结果显示,141份淡水鱼样品扩增出54份tlh基因为阳性,总检出率为38.3%。如表2所示,从品种上看,5种淡水鱼中均检出Vp,但不同品种淡水鱼污染程度不相同,其中花鲢污染率最高,为66.7%,黄辣丁次之,为44.1%,草鱼污染率最低,为25.0%。定量检测结果表明,5种淡水鱼定量检测均值为20.8 MPN/g,鲫鱼定量均值最大,为47.5 MPN/g,武昌鱼定量均值最小,为2.6 MPN/g,不同品种淡水鱼中Vp检出率之间存在显著性差异(χ2=12.705,P<0.05)。
表2 不同淡水鱼中副溶血性弧菌污染情况
Table 2 Pollution of Vp in different freshwater fish
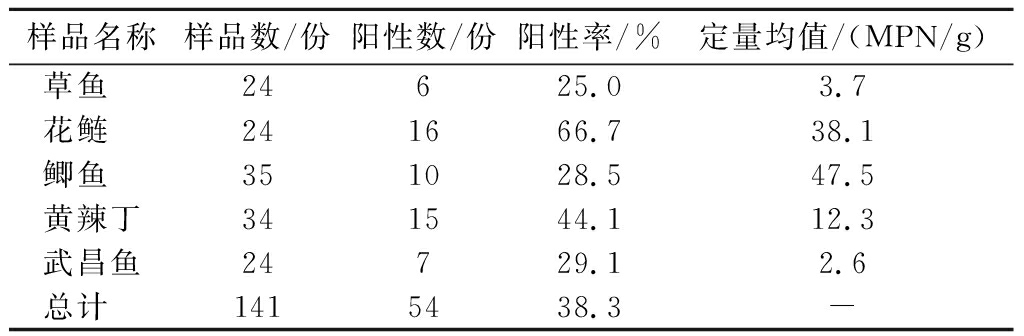
样品名称样品数/份阳性数/份阳性率/%定量均值/(MPN/g)草鱼 24625.03.7花鲢 241666.738.1鲫鱼 351028.547.5黄辣丁341544.112.3武昌鱼24729.12.6总计 1415438.3-
注:-表示无数据。
按不同季节分析,夏、秋两季淡水鱼中Vp检出率较高,分别为57.1%、50.0%,无显著性差异(P>0.05)。冬季Vp检出率最低,为10%。定量检测均值夏季最高,为53.8 MPN/g,其次是秋季,为19.8 MPN/g。表明Vp的检出情况与季节相关性明显,温度是影响Vp污染的主要因素,夏、秋季温度较高,是适宜Vp生长的季节(表3)。不同季节淡水鱼中Vp检出率之间存在极显著差异(χ2=19.152,P<0.01)。
表3不同季节淡水鱼中副溶血性弧菌检出情况
Table 3 Detection of Vp in freshwater fish in different seasons
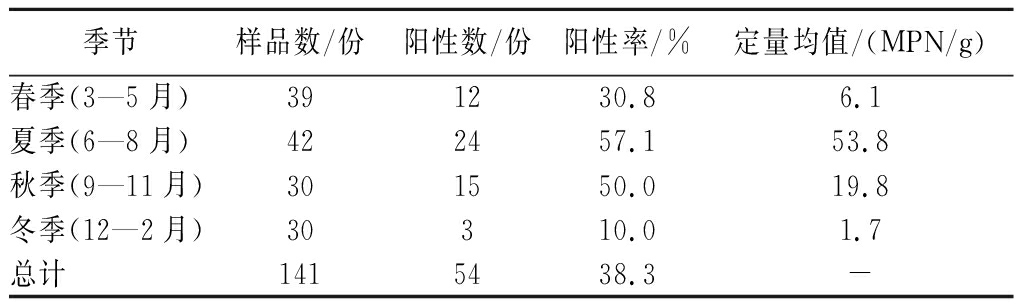
季节样品数/份阳性数/份阳性率/%定量均值/(MPN/g)春季(3—5月)391230.86.1夏季(6—8月)422457.153.8秋季(9—11月)301550.019.8冬季(12—2月)30310.01.7总计1415438.3-
2.2 副溶血性弧菌毒力基因结果分析
通常认为具有溶血活性的tdh和trh是Vp致病的主要毒力基因,采用PCR方法检测54株Vp的tdh、trh、toxR、pirA、T3SS1、T3SS2α和T3SS2β毒力基因。PCR结果显示,所有分离株均携带toxR和T3SS1基因,携带率为100%。秋季在黄辣丁样品中检出1株Vp(编号:VP42)同时携带4种毒力基因(tdh、toxR、T3SS1和T3SS2α基因),主要毒力基因tdh携带率为1.8%,未检测到携带trh、pirA和T3SS2β基因的菌株。
2.3 副溶血性弧菌血清型结果分析
为了解淡水鱼中Vp的血清分布情况,采用多重PCR检测分离株血清型。血清分型结果如表4所示,54株Vp中有1株无法区分血清型,其他53株共分为9个O群血清型,O1群菌株数最多,占分离菌株总数的33.3%,其次是O2、O3/O13和O11,各占14.8%,O6和O10最少,各占1.9%。不同淡水鱼分离的Vp血清分布不同,草鱼和武昌鱼中各检出3种不同血清型,黄辣丁血清多样性高,共检出8种不同血清型。
表4 淡水鱼中副溶血性弧菌血清型分布情况
Table 4 Distribution of Vp serotypes in freshwater fish
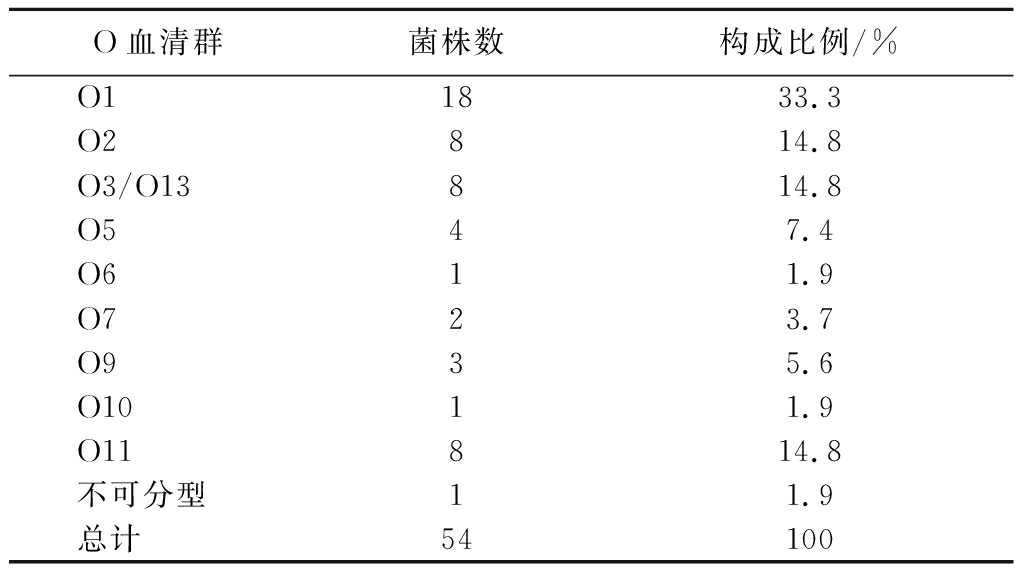
O血清群菌株数构成比例/%O11833.3O2814.8O3/O13814.8O547.4O611.9O723.7O935.6O1011.9O11814.8不可分型11.9总计54100
2.4 副溶血性弧菌药敏实验结果分析
54株Vp对20种抗生素整体耐药情况结果如表5所示,所有分离株对头孢他啶、头孢曲松、庆大霉素、四环素、多西环素和米诺环素敏感,耐药率较高的抗生素依次是青霉素类的OX(100%)、P(98.1%)和AMP(90.7%),此外81.5%(44/54)的分离株对大环内酯类红霉素可产生中介耐药。耐一类抗生素的分离株占64.8%(35/54),耐二类抗生素及以上的分离株占35.2%(19/54),其中仅有1株耐四类7种抗生素,提示分离株中有多重耐药现象存在。
表5 副溶血性弧菌药敏实验结果
Table 5 Antimicrobial resistance of Vp isolates

抗生素类别抗生素耐药(R)中介(I)敏感(S)菌株数比率/%菌株数比率/%菌株数比率/%青霉素类苯唑西林OX54100.000.000.0青霉素P5398.111.900.0氨苄西林AMP4990.747.411.9羧苄西林CB4685.247.447.4头孢类 头孢氨苄CA1018.53055.61425.9头孢拉定RAD59.31731.53259.3头孢呋辛CXM23.723.75092.6头孢他啶CAZ00.000.054100.0头孢唑林CZ11.9916.74481.5头孢曲松CTR00.000.054100.0头孢哌酮CFP00.023.75296.3大环内酯类红霉素E814.84481.523.7β-内酰胺类哌拉西林PIP47.41222.23870.4氨基糖疳类新霉素N23.71527.83768.5卡那霉素K00.035.65194.4丁胺卡拉AK00.011.95398.1庆大霉素GM00.000.054100.0四环素类 四环素TE00.000.054100.0多西环素DX00.000.054100.0米诺环素MI00.000.054100.0
2.5 ERIC-PCR分型结果
聚类分析如图1所示,54株Vp均能进行ERIC-PCR分型,能扩增出2~10条在100~1 500 bp的条带,大多数分离株都可扩增出500 bp的条带,分离株相似度为53%~100%。设置相似系数为75%时,分离株可分为8个类群(E1~E8),其中,E1聚类最大,含26个环境分离株和1个临床分离株(178)。设置相似系数为94%时,环境分离株(VP42)和临床分离株(178)可被聚类在一个分支中,亲缘关系近,同时它们都携带tdh毒力基因。

图1 副溶血性弧菌ERIC-PCR聚类指纹图谱
Fig.1 ERIC-PCR clustering fingerprints of Vp
3 讨论与结论
近年来,中国内陆城市中由Vp引起的食源性疾病发病率有上升趋势,可能是Vp污染淡水产品所致[16]。本研究结果显示,5种淡水鱼141份样品中分离出54株Vp,总检出率为38.3%,表明万州零售淡水鱼中存在Vp污染,与其他研究对比分析:低于LI等[17]对江苏省淡水鱼的检出率(50%)和吴斌等[18]对金华市淡水鱼的检出率(43.8%),高于CHEN等[19]对浙江省淡水鱼的检出率(16.2%)。可能是在运输和销售过程中海产品与淡水产品交叉污染或Vp的适应性生长有关。不同季节Vp检出率不同,夏季高于其他季节,Vp的生长与温度有关,这与其他研究结论一致[20]。同时,高检出率并不能说明危害程度高,需要进一步分析其毒力基因携带情况。
不是所有的Vp都能致病,溶血素是Vp致病的主要因素,即由tlh、tdh和trh基因编辑的不耐热溶血素(thermolabile hemolisin,TLH)、耐热直接溶血素(thermostable direct hemolysin,TDH)和耐热直接相关溶血素(thermostable direct hemolysin-related hemolysin,TRH)[6]。除此之外,Ⅲ型分泌系统(type Ⅲ secretion systems, T3SS)也与致病密切相关,大多数Vp含有2个非冗余的T3SS(T3SS1和T3SS2),它们在感染过程中都发挥着不同的作用,T3SS1引起细胞毒性,T3SS2主要与肠道毒性有关[21],同时T3SS2包含2个不同谱系:T3SS2α和T3SS2β,T3SS2α只存在于含tdh的Vp中,T3SS2β存在于含trh的Vp中[9-10]。本研究中分离出的54株Vp均检出toxR和T3SS1基因,这证实了先前的研究,即toxR和T3SS1在Vp中普遍存在[9,22]。引起Vp感染的主要毒力基因是tdh和trh。54株Vp有1株携带tdh基因,同时携带T3SS2α基因,未检测到trh基因,表明万州零售淡水鱼中tdh基因和trh基因携带率低。从环境和水产品中分离的菌株tdh和trh检出率低,与周倩等[23]、王小龙等[24]报道一致。但1株tdh基因的存在,提示万州零售淡水鱼中存在一定的食品安全风险。
Vp的血清型同致病性存在密切关系,自1996年以来,O3∶K6血清型在全球范围内成为Vp引起食源性疾病的的主要类群。本研究从万州淡水鱼中分离的Vp血清型分布呈多样性,血清分型率高,其中以O1为最主要的血清群,其次是O2、O3/O13和O11血清群,有1株无法区分血清型,提示可能存在新的血清型。本研究分离的携带tdh基因菌株(VP42)血清群为O3,同时其分子分型结果同实验保存的另1株携带tdh基因的临床分离株178(血清型为O3∶K6)一致,同属一个克隆群,提示在万州淡水产品中,O3∶K6克隆群可能仍是主要的致病类群。但个别地区也偶有其他血清型出现。2021年浙江省食源性疾病监测结果显示最多的血清型是O10∶K4,而非之前最常见的O3∶K6[25]。本研究仅分离出1株O10血清型,但O10血清群是否会在该地区流行或成为优势血清型,需要相关部门加强对淡水产品的监测。
抗生素的选择和合理使用对预防和治疗Vp食物中毒尤为关键,因此监测抗生素抗性对保障消费者健康至关重要。本研究中,分离株的耐药性主要集中在OX、P、AMP和CB等早期使用的青霉素类药物。对青霉素表现出较高的耐药性,可能与CHIOU等[26]研究发现新的β-内酰胺酶基因—blaCARB-17所介导的Vp对青霉素的固有耐药性有关,结果表明在临床治疗中应避免选择此类抗生素来治疗Vp导致的感染。本研究中,所有Vp对CTR、CAZ、GM、TE等敏感,与孔令汉等[5]、强鑫华等[27]研究结果相近,建议将该类抗菌药作为临床上治疗Vp引起感染的首选药物。值得注意的是,81.5%的分离株对红霉素E产生中介耐药,说明分离株正在适应红霉素,需要引起重视,也为抗生素在临床上的使用增加了难度。多重耐药现象不突出,但相关部门应加强淡水鱼在运输、销售和养殖环节抗生素使用的监管,警惕多重耐药株引起食源性疾病。
已有脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)和ERIC-PCR等具有高辨别度的分子分型方法来区分致病菌。ERIC-PCR通常被用于分析Vp的遗传多样性,与PFGE相比,它操作简单、辨别度高和快速分型能力强,方便对大量菌株分析[13]。同时,对环境分离株与已知临床菌株进行比较分型有助于识别环境中存在的潜在致病菌[28]。本研究通过分析ERIC-PCR指纹图谱,发现淡水鱼中分离的VP42与临床分离株178聚在一起,说明与临床菌株聚集在一起的分离株在遗传特征上具有相似性,当通过食物传播时,可能具有引起食源性疾病暴发的潜力。本研究中,聚类分型结果与季节、品种、血清型和耐药性之间无明显相关性。ERIC-PCR的聚类分型不依赖于分离株来源、抗生素耐药性和血清分型[13],本研究结果与该结论一致,证实了Vp的遗传多样性。
综上所述,通过对万州零售淡水鱼中Vp的污染状况、血清型、耐药性和分子分型进行分析,发现Vp已经从海水产品迁染到淡水产品中,并占据一定比例,为38.3%,但浓度不高且仅有1株鉴定为致病性Vp,属于O血清群;抗生素抗性存在一定的风险,显示风险较小;存在与临床分离株有遗传相似的致病菌株;仍需引起重视。
[1] ZHOU H B, LIU X M, HU W Y, et al.Prevalence, antimicrobial resistance and genetic characterization of Vibrio parahaemolyticus isolated from retail aquatic products in Nanjing, China[J].Food Research International, 2022, 162:112026.
[2] RYU A R, MOK J S, LEE D E, et al.Occurrence, virulence, and antimicrobial resistance of Vibrio parahaemolyticus isolated from bivalve shellfish farms along the southern coast of Korea[J].Environmental Science and Pollution Research International, 2019, 26(20):21 034-21 043.
[3] 毛雪丹, 胡俊峰, 刘秀梅.用文献综述法估计我国食源性副溶血性弧菌病发病率[J].中华疾病控制杂志, 2013, 17(3):265-267. MAO X D, HU J F, LIU X M.Study on incidence of foodborne disease caused by Vibrio parahaemolyticus by literature review method[J].Chinese Journal of Disease Control and Prevention, 2013, 17(3):265-267.
[4] 卢俊, 袁冬梅.一起致病性弧菌引起的食物中毒的调查[J].现代预防医学, 2013, 40(7):1216-1217.LU J, YUAN D M.Investigation and analysis of a food poisoning caused by pathogenic Vibrio[J].Modern Preventive Medicine, 2013, 40(7):1216-1217.
[5] 孔令汉, 贺良, 唐敏, 等.2021年重庆市万州区两起食物中毒事件副溶血性弧菌溯源和耐药性分析[J].中国预防医学杂志, 2023, 24(7):643-647.KONG L H, HE L, TANG M, et al.The origins and antibiotic resistance of Vibrio parahaemolyticus isolated from two food poisoning incidents in Wanzhou District of Chongqing[J].Chinese Preventive Medicine, 2023, 24(7):643-647.
[6] BEJ A K, PATTERSON D P, BRASHER C W, et al.Detection of total and hemolysin-producing Vibrio parahaemolyticus in shellfish using multiplex PCR amplification of tl, tdh and trh[J].Journal of Microbiological Methods, 1999, 36(3):215-225.
[7] KIM Y B, OKUDA J, MATSUMOTO C, et al.Identification of Vibrio parahaemolyticus strains at the species level by PCR targeted to the toxR gene[J].Journal of Clinical Microbiology, 1999, 37(4):1173-1177.
[8] 郭书林, 陈信忠, 尤颖哲, 等.福建省南美白对虾幼体急性肝胰腺坏死病病原分离与PCR检测[J].中国动物检疫, 2019, 36(6):96-99.GUO S L, CHEN X Z, YOU Y Z, et al.Pathogen isolation and PCR detection of AHPND in Penaeus vannamei larvae in Fujian Province[J].China Animal Health Inspection, 2019, 36(6):96-99.
[9] MORIEA N F 3rd, JOHNSON C N, GRIFFITT K J, et al.Distribution of type III secretion systems in Vibrio parahaemolyticus from the northern Gulf of Mexico[J].Journal of Applied Microbiology, 2010, 109(3):953-962.
[10] CABURLOTTO G, GENNARI M, GHIDINI V, et al.Presence of T3SS2 and other virulence-related genes in tdh-negative Vibrio parahaemolyticus environmental strains isolated from marine samples in the area of the Venetian Lagoon, Italy[J].FEMS Microbiology Ecology, 2009, 70(3):506-514.
[11] CHEN M, GUO D, WONG H C, et al.Development of O-serogroup specific PCR assay for detection and identification of Vibrio parahaemolyticus[J].International Journal of Food Microbiology, 2012, 159(2):122-129.
[12] Clinical and Laboratory Standards Institute.M45 Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria;approved guideline[S].Wayne:CLSI, 2016.
[13] ALI S, HOSSAIN M, AZAD A B, et al.Diversity of Vibrio parahaemolyticus in marine fishes of Bangladesh[J].Journal of Applied Microbiology, 2021, 131(5):2539-2551.
[14] WARD L N, BEJ A K.Detection of Vibrio parahaemolyticus in shellfish by use of multiplexed real-time PCR with TaqMan fluorescent probes[J].Applied and Environmental Microbiology, 2006, 72(3):2031-2042.
[15] 徐秋琼, 彭明益, 单桂花, 等.网售生鲜海产品中副溶血性弧菌定量污染状况调查分析[J].热带医学杂志, 2021, 21(3):385-388.XU Q Q, PENG M Y, SHAN G H, et al.Investigation and analysis on quantitative contamination of Vibrio parahaemolyticus in fresh seafood sold online[J].Journal of Tropical Medicine, 2021, 21(3):385-388.
[16] LEI T, JIANG F F, HE M, et al.Prevalence, virulence, antimicrobial resistance, and molecular characterization of fluoroquinolone resistance of Vibrio parahaemolyticus from different types of food samples in China[J].International Journal of Food Microbiology, 2020, 317:108461.
[17] LI M Z, XU H Y, TIAN Y Q, et al.Comparative genomic analysis reveals the potential transmission of Vibrio parahaemolyticus from freshwater food to humans[J].Food Microbiology, 2023, 113:104277.
[18] 吴斌, 胡元玮, 方琼楼, 等.金华市淡水产品中副溶血性弧菌污染状况及PFGE分型研究[J].中国卫生检验杂志, 2022, 32(15):1829-1831.WU B, HU Y W, FANG Q L, et al.A study on the pollution and pulse field gel electrophoresis typing of Vibrio parahaemolyticus in fresh water products in Jinhua city[J].Chinese Journal of Health Laboratory Technology, 2022, 32(15):1829-1831.
[19] CHEN H H, DONG S L, YAN Y, et al.Prevalence and population analysis of Vibrio parahaemolyticus isolated from freshwater fish in Zhejiang province, China[J].Foodborne Pathogens and Disease, 2021, 18(2):139-146.
[20] ALABOUDI A R, ABABNEH M, OSAILI T M, et al.Detection, identification, and prevalence of pathogenic Vibrio parahaemolyticus in fish and coastal environment in Jordan[J].Journal of Food Science, 2016, 81(1):M130-M134.
[21] HAM H, ORTH K.The role of type III secretion system 2 in Vibrio parahaemolyticus pathogenicity[J].Journal of Microbiology (Seoul, Korea), 2012, 50(5):719-725.
[22] STRATEV D, FASULKOVA R, KRUMOVA-VALCHEVA G.Incidence, virulence genes and antimicrobial resistance of Vibrio parahaemolyticus isolated from seafood[J].Microbial Pathogenesis, 2023, 177:106050.
[23] 周倩, 向婧姝, 黄靖宇, 等.贵阳市淡水产品及养殖环境致病性弧菌监测结果分析[J].应用预防医学, 2022, 28(4):352-354;396.ZHOU Q, XIANG J S, HUANG J Y, et al.Analysis of monitoring results of pathogenic Vibrio in freshwater products and culture environment in Guiyang City[J].Applied Preventive Medicine, 2022, 28(4):352-354;396.
[24] 王小龙, 张梦寒, 朱莉勤, 等.2016—2019苏州市副溶血性弧菌的毒力基因和耐药性及分子分型研究[J].现代预防医学, 2020, 47(21):3975-3980.WANG X L, ZHANG M H, ZHU L Q, et al.Virulence gene, drug resistance,molecular typing of Vibrio parahaemolyticus in Suzhou, 2016—2019[J].Modern Preventive Medicine, 2020, 47(21):3975-3980.
[25] 贺悦, 齐小娟, 王绩凯, 等.浙江省2021年食源性疾病监测结果分析[J].中国卫生检验杂志, 2023, 33(4):504-508.HE Y, QI X J, WANG J K, et al.Analysis of surveillance results of foodborne diseases in Zhejiang Province in 2021[J].Chinese Journal of Health Laboratory Technology, 2023, 33(4):504-508.
[26] CHIOU J C, LI R C, CHEN S.CARB-17 family of β-lactamases mediates intrinsic resistance to penicillins in Vibrio parahaemolyticus[J].Antimicrobial Agents and Chemotherapy, 2015, 59(6):3593-3595.
[27] 强鑫华, 蔡云祥.食源性腹泻患者分离副溶血性弧菌毒力基因及药敏分析[J].中国卫生检验杂志, 2021, 31(2):155-158.QIANG X H, CAI Y X.Virulence and antimicrobial susceptibility of Vibrio Parahaemolyticus in patients with foodborne diarrhea[J].Chinese Journal of Health Laboratory Technology, 2021, 31(2):155-158.
[28] VAN BELKUM A, TASSIOS P T, DIJKSHOORN L, et al.Guidelines for the validation and application of typing methods for use in bacterial epidemiology[J].Clinical Microbiology and Infection, 2007, 13:1-46.