天然多糖可来源于动物、植物和微生物,其中微生物发酵提取的多糖具有更短更简单的提取过程、更高的生产率和更低的环境影响等,其良好的生物相容性和生物降解性使其在食品、化妆品、药品等领域广泛研究和应用[1-4]。多糖具备的生物活性与其化学结构是紧密相关的[5],许多天然多糖并不能表现出较理想的生物活性。因此许多研究通过分子修饰,例如羧甲基化[6]、硫酸化[7]、磷酸化[8]、硒化[9]等,对多糖的分子质量、取代基团和维度结构进行改变,以期获得新的生物学特性。
凝胶多糖(curdlan,CUR)是一种由β-1,3糖苷键链接的微生物胞外多糖[10],具有独特的三螺旋分子结构,在流变性能和热凝胶性能上表现突出,已被列入食品添加剂范围,且广泛应用于食品医药行业。然而凝胶多糖的疏水性会影响其进一步膨胀[11],对凝胶多糖的使用范围有一定的影响,因此学者们会采用对微生物修饰合成途径或对凝胶多糖分子修饰来进一步改性其水溶性和生物活性,其中羧甲基化和磷酸化是目前已广泛应用于多糖水溶性和生物活性改善的化学修饰方法[8,12],这2种方法简便易得,其修饰后的产物可以作为现代食品加工的有效组分。
多糖的分子结构会影响其理化特性,改善凝胶多糖的水溶性和生物活性有助于拓宽开发其应用范围。本文将借助羧甲基化和磷酸化2种化学修饰,对凝胶多糖的分子结构进行差异分析,对比其化学修饰前后的溶解性和生物活性,以期为凝胶多糖的开发与利用提供理论参考。
1 材料与方法
1.1 材料与试剂
凝胶多糖,上海源叶生物有限公司;氢氧化钠、三偏磷酸钠、三聚磷酸钠、硫酸钠、碳酸氢钠、乙酸铵、溴化钾、氯乙酸等试剂,国药集团化学试剂有限公司;刚果红、变色酸、抗坏血酸、DPPH、ABTS等试剂、透析袋(截留量3 500 Da/8 000~14 000 Da),索莱宝生物科技有限公司;重水(带内标),麦可瑞生物技术有限公司。
1.2 仪器与设备
TENSOR II傅里叶变换红外光谱仪,AVANCE Ⅲ HD500 Hz核磁共振波谱仪,德国Bruker有限公司;2695e高效液相色谱仪,美国Waters有限公司;F16502扫描电子显微镜,荷兰Phenom有限公司;Infinite E Plex酶标仪,奥地利帝肯奥地利有限公司。
1.3 实验方法
1.3.1 羧甲基化和磷酸化凝胶多糖的制备
按照CAI等[13]制备羧甲基化凝胶多糖的方法稍加修改:将1.5 g凝胶多糖分散到50 mL异丙醇中,常温搅拌30 min后,加入4 mL的30%的氢氧化钠溶液,之后在搅拌的90 min内分3次加入共1.5 g的氯乙酸,之后转移到60 ℃的水浴锅内搅拌2 h。再用无水甲醇、无水乙醇和丙酮多次淋洗,离心后的沉淀物加蒸馏水溶解透析(8 000~14 000 Da)4 d,冷冻干燥48 h即可制得羧甲基化凝胶多糖(carboxymethylated curdlan,C-CUR)。
参考陈玥彤等[14]的制备方法稍加修改:先将5 g三聚磷酸钠和2 g三偏磷酸钠溶于100 mL蒸馏水中得到磷酸液,再依次加入1 g凝胶多糖和5 g硫酸钠,用碳酸氢钠调节溶液pH至9,于90 ℃下恒温搅拌反应5 h,再加入3倍体积的95%乙醇,醇沉24 h,加蒸馏水溶解透析(3 500 Da)2 d,冷冻干燥48 h即可制得磷酸化凝胶多糖(phosphorylated curdlan,P-CUR)。
1.3.2 羧甲基化和磷酸化凝胶多糖取代度的测定
参考王玉蓉等[15]的方法,先制备计算得羟基乙酸的标曲y=0.585 1x+0.051 8(R2=0.991 2),再取1 mL 0.4 mg/mL的样品溶液,依次加入5 mL 0.1%变色酸溶液、1 mL浓硫酸,水浴煮沸加热0.5 h,冷却至室温后加30%乙酸铵溶液至25 mL具塞试管刻度线,取适量样液,测其在570 nm下的吸光度,通过标曲计算出样液的质量浓度后带入公式(1)求得羧甲基化取代度(degree of substitution,DS):
(1)
式中:m为每克羧甲基多糖样品中羟基乙酸的相当含量,g;162为多糖的失水葡萄糖单元的摩尔质量,g/mol;76为羟基乙酸的摩尔质量,g/mol;81为CH2COONa的摩尔质量,g/mol。
根据钼蓝比色法[16]绘制计算得磷酸根含量标准曲线y=0.414 4x+0.043 2,(R2=0.995 3),取0.5 g样品于坩埚中,600 ℃下充分灰化2 h,加入0.5 mL浓HCl,再加入同体积的蒸馏水溶解残渣,将灰化后的样品定容于10 mL容量瓶,测定容后的样液在660 nm下的吸光度,通过标曲计算出样液的质量浓度后带入公式(2)求得磷酸根含量:
磷酸根含量![]()
(2)
式中:A是样品在660 nm处的吸光度;M是样品的质量。
1.3.3 多糖的分子质量及其分布测定
GPC具体参数如下:选择Waters Ultrahydrogel Linear 7.8×300的色谱柱,搭配Waters RI检测器,流动相为0.1 mol/L NaNO3溶液,流速为0.3 mL/min,样品配制成2 mg/mL的溶液,并用0.45 μm滤膜过滤后进样,进样量为20 μL,检测温度为30 ℃,检测的分子质量标品是Waters的多糖套标。
1.3.4 多糖的溶解性测定
称取w1的3种多糖样品,配制成10 g/L的样品溶液,30 ℃水浴静置30 min,在800×g,15 min的条件下离心取上清液,在120 ℃烘箱中干燥至恒重,记录此时的质量w2,溶解性的计算如公式(3)所示:
溶解性![]()
(3)
式中:w1是起始多糖样品质量;w2是干物质质量。
1.3.5 多糖的刚果红测定
分别配制1 mg/mL的3种多糖样品溶液和80 μmol/L的刚果红溶液,室温下等体积混合2种溶液,随后添加不同量的4 mol/L NaOH溶液,使得NaOH溶液的终浓度为0.00~2.00 mol/L,室温静置反应10 min后用紫外-可见分光光度计扫描其在400~600 nm的吸收光谱。
1.3.6 傅里叶变换红外光谱分析
采用溴化钾压片法制备样品。具体方法:称取1 mg 冷冻干燥后的样品粉末和100 mg的干燥溴化钾,在玛瑙研钵中充分研磨,通过压膜器压制成均匀的薄片。测试条件:扫描波长400~4 000 cm-1,扫描分辨率4 cm-1,扫描次数32次。
1.3.7 核磁共振波谱分析
取15 mg样品溶于600 μL D2O中,冻干,再次用D2O溶解,冻干,反复操作3次确保样品完全溶解,转移至核磁管中进行1H的图谱扫描。
1.3.8 固体形貌分析
粘取少量冷冻干燥的样品粉末,均匀分散在贴有导电胶的铜柱表面,先用N2吹气确保样品都已黏附在导电胶上,再进行喷金处理。在加速电压为5.00 kV的扫描电子显微镜下观察样品的微观形态特征。
1.3.9 体外抗氧化活性的测定
分别配制0.25~5 mg/mL的凝胶多糖、羧甲基化凝胶多糖和磷酸化凝胶多糖水溶液用于体外抗氧化活性的试验,同等浓度的维生素C做阳性对照。
1.3.9.1 DPPH自由基清除能力的测定
参考XIE等[17]的方法,用无水乙醇配制0.1 mmol/L的DPPH溶液,再将不同浓度的样品多糖溶液和配好的DPPH溶液按1∶1等体积混匀,室温下暗处静置30 min反应,在517 nm处测定其吸光值。DPPH自由基清除能力的计算如公式(4)所示:
DPPH自由基清除能力![]()
(4)
式中:A1是加了不同浓度的样品多糖溶液的吸光值;A2是用蒸馏水代替DPPH溶液的吸光值;A0是用蒸馏水代替不同浓度的样品多糖溶液的吸光值。
1.3.9.2 ABTS阳离子自由基清除能力的测定
参考SHI等[5]的方法,先配制ABTS阳离子自由基贮备液,将配好的7 mmol/L ABTS溶液和2.45 mmol/L的过硫酸钾溶液,以1∶1的体积比混合均匀,在室温黑暗处静置16 h,得到ABTS阳离子自由基贮备液。用pH 7.4的0.2 mol/L的PBS缓冲液对贮备液进行稀释,使ABTS阳离子自由基贮备液最终在734 nm波长下的吸光度为0.70±0.02即可。将0.4 mL的不同浓度的多糖溶液加入到3 mL稀释后的ABTS溶液中,摇晃均匀使反应完全,暗处静置6 min后于734 nm处测其吸光值。ABTS阳离子自由基清除能力的计算如公式(5)所示:
ABTS阳离子自由基清除能力![]()
(5)
式中:A1是不同浓度的多糖溶液和ABTS溶液的吸光值;A2是用蒸馏水代替ABTS溶液的吸光值;A0是用蒸馏水代替不同浓度的样品多糖溶液的吸光值。
1.3.9.3 羟自由基清除能力的测定
根据计宇航[18]的方法稍作修改,具体方法为:在试管内分别加入1 mL的不同浓度的样品多糖溶液、1 mL 9 mmol/L的硫酸亚铁溶液、1 mL 9 mmol/L的水杨酸-乙醇溶液、1 mL 8.8 mmol/L过氧化氢溶液,充分混合均匀后,在37 ℃水浴锅中反应30 min,在510 nm处测定其吸光值。羟自由基清除能力的计算如公式(6)所示:
羟自由基清除能力![]()
(6)
式中:A1是加了不同浓度的样品多糖溶液的吸光值;A2是用蒸馏水代替过氧化氢溶液的吸光值;A0是用蒸馏水代替不同浓度的样品多糖溶液的吸光值。
2 结果与分析
2.1 凝胶多糖及其衍生物的取代度、溶解度和分子质量结果
由表1可知,通过1.3.1节的化学修饰,成功制备了取代度为0.375的羧甲基化凝胶多糖(C-CUR)和磷酸根含量为6.77%的磷酸化凝胶多糖(P-CUR),经过羧甲基化修饰后的凝胶多糖水溶性提高了5.48倍,经过磷酸化修饰后的凝胶多糖水溶性提高了6.75倍。溶解度的大小反映了多糖和水之间的联系,多糖的分子结构和分子质量大小相关[19],经过2种化学修饰后的凝胶多糖分子质量显著下降,羧甲基化后亲水性的羧基取代破坏了凝胶多糖中原有的氢键作用[20-21],磷酸化修饰可以使磷酸根基团取代多糖支链上的羟基增强多糖的水溶胀能力[22],这些凝胶多糖分子结构上的改变改善了其水溶性。本文实验选用的凝胶多糖原糖的分子质量分布为1 823~2 199 663 Da,经过羧甲基化和磷酸化修饰后的C-CUR和P-CUR的分子质量都明显小于原糖,分别为 26 787 Da和11 451 Da,且出现的峰值都是单一较窄的,这表明经过修饰改性的2种凝胶多糖的分子构象发生了变化,获得了组分比较均一的2种凝胶多糖。
表1 凝胶多糖及其衍生物的取代度、溶解性和分子质量
Table 1 Degree of substitution、solubility and molecular weight of curdlans and their derivatives
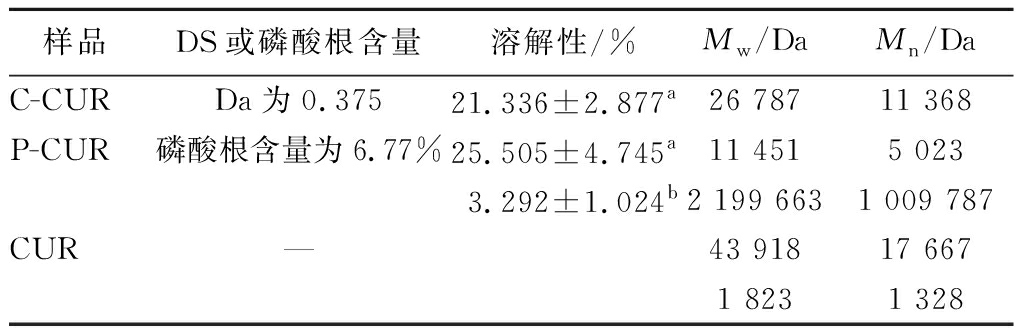
样品DS或磷酸根含量溶解性/%Mw/DaMn/DaC-CURDa为0.37521.336±2.877a26 78711 368P-CUR磷酸根含量为6.77%25.505±4.745a11 4515 0233.292±1.024b2 199 6631 009 787CUR—43 91817 6671 8231 328
注:—表示未经任何化学修饰的凝胶多糖原糖;小写字母a、b表示差异显著(P<0.05)。
2.2 刚果红试验分析
刚果红可以与拥有三螺旋结构的多糖在水溶液中形成络合物,且该络合物的最大吸收波长会根据NaOH溶液的浓度产生变化:当NaOH浓度较低时,λmax会向长波的方向移动,随着浓度增大,多糖的三螺旋结构中的氢键被破坏,伴随着可能会发生的解旋、无规则卷曲等构象改变,此时λmax下降,即产生红移现象[23]。凝胶多糖本身是一类与香菇多糖类似结构的三螺旋多糖,在低碱液浓度下会产生三螺旋↔单螺旋↔无规则卷曲的结构变化[24]。由图2和图3可知,相较于凝胶多糖,羧甲基化后的凝胶多糖在随着NaOH浓度增大的时候,λmax的变化趋势保持一致,而磷酸化后的凝胶多糖在0.1~0.4 mol/L的变化趋势却是相反的,这可能是由于磷酸根基团在水溶液中呈碱性,与NaOH中的氢氧根离子存在竞争关系,造成磷酸化凝胶多糖的水解程度不同,对于水溶液中的多糖分子构象产生了变化;在NaOH浓度低于0.1 mol/L时,3种凝胶多糖与刚果红溶液刚开始发生络合,此时三螺旋结构的氢键可能被破坏程度不大,λmax上升;在0.1~0.3 mol/L,3种凝胶多糖的λmax都有变化波动,说明此时3种凝胶多糖可能都在经历三螺旋→单螺旋→无规则卷曲的构象变化,导致λmax并不是稳定变化;在0.3~0.5 mol/L,CUR和C-CUR的λmax起伏波动范围不大,推断此时多糖中的三股螺旋结构已基本和刚果红全部形成了络合物,而P-CUR在0.4~0.5 mol/L时λmax明显下降,可能是碱液的浓度增大加快了反应速率;参考空白对照组,凝胶多糖及其2种修饰后的产物均发生了明显的红移现象,也有报道指出化学修饰虽然会降低β-葡聚糖的分子质量,但是由于对三股螺旋解旋为单链的反应进程的控制,其糖链结构仍以β-1,3糖苷键链接[25],因此可以初步证明凝胶多糖及修饰后的2种凝胶多糖都具有三螺旋结构。
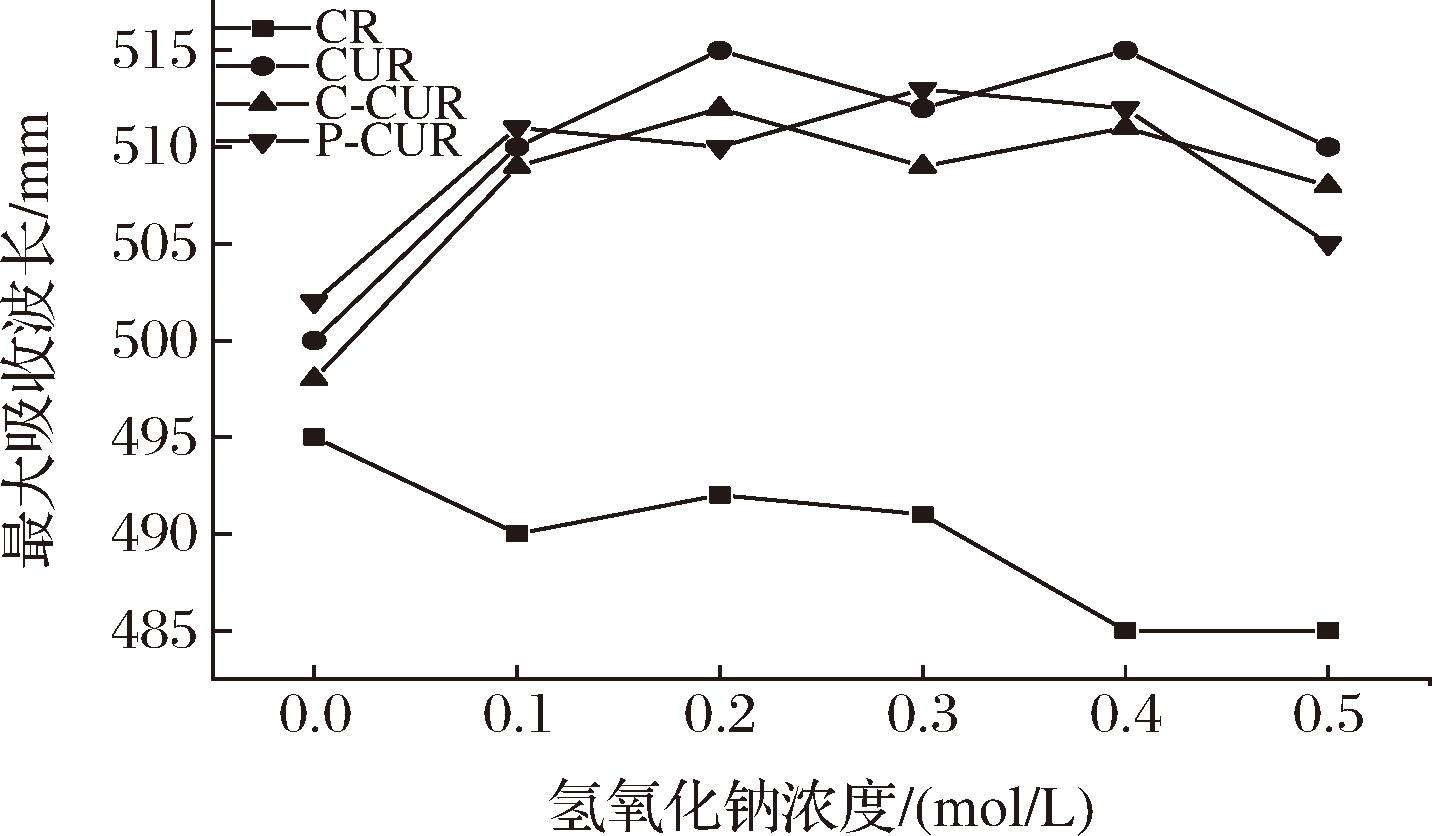
图1 不同浓度的NaOH对多糖-刚果红复合物溶液的最大吸收波长变化
Fig.1 The change of NaOH on the maximum absorption wavelength of the polysaccharides- Congo red complex solution
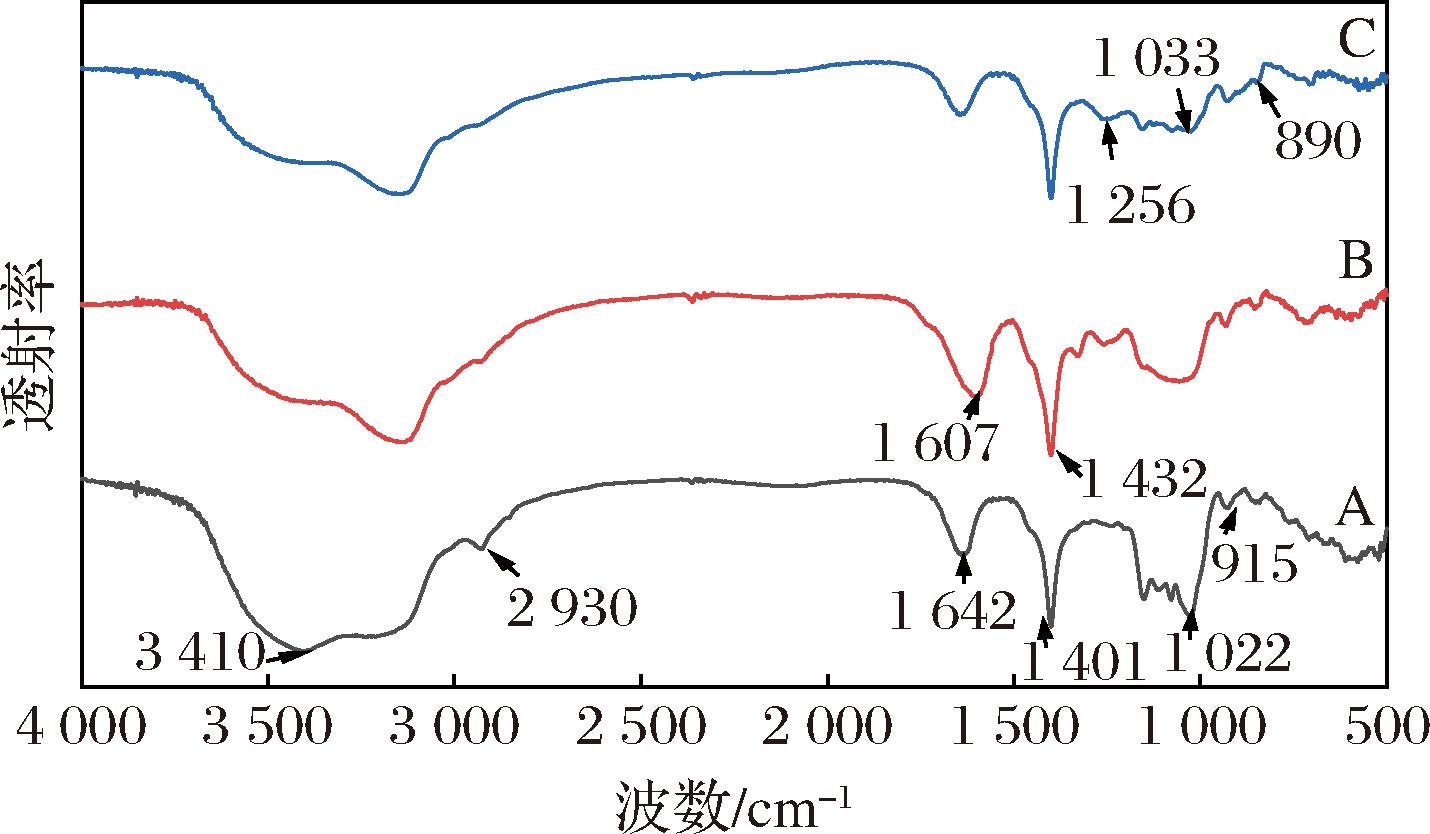
A-CUR;B-C-CUR;C-P-CUR
图2 凝胶多糖及其衍生物的红外谱图
Fig.2 FT-IR spectra of curdlan and their derivatives
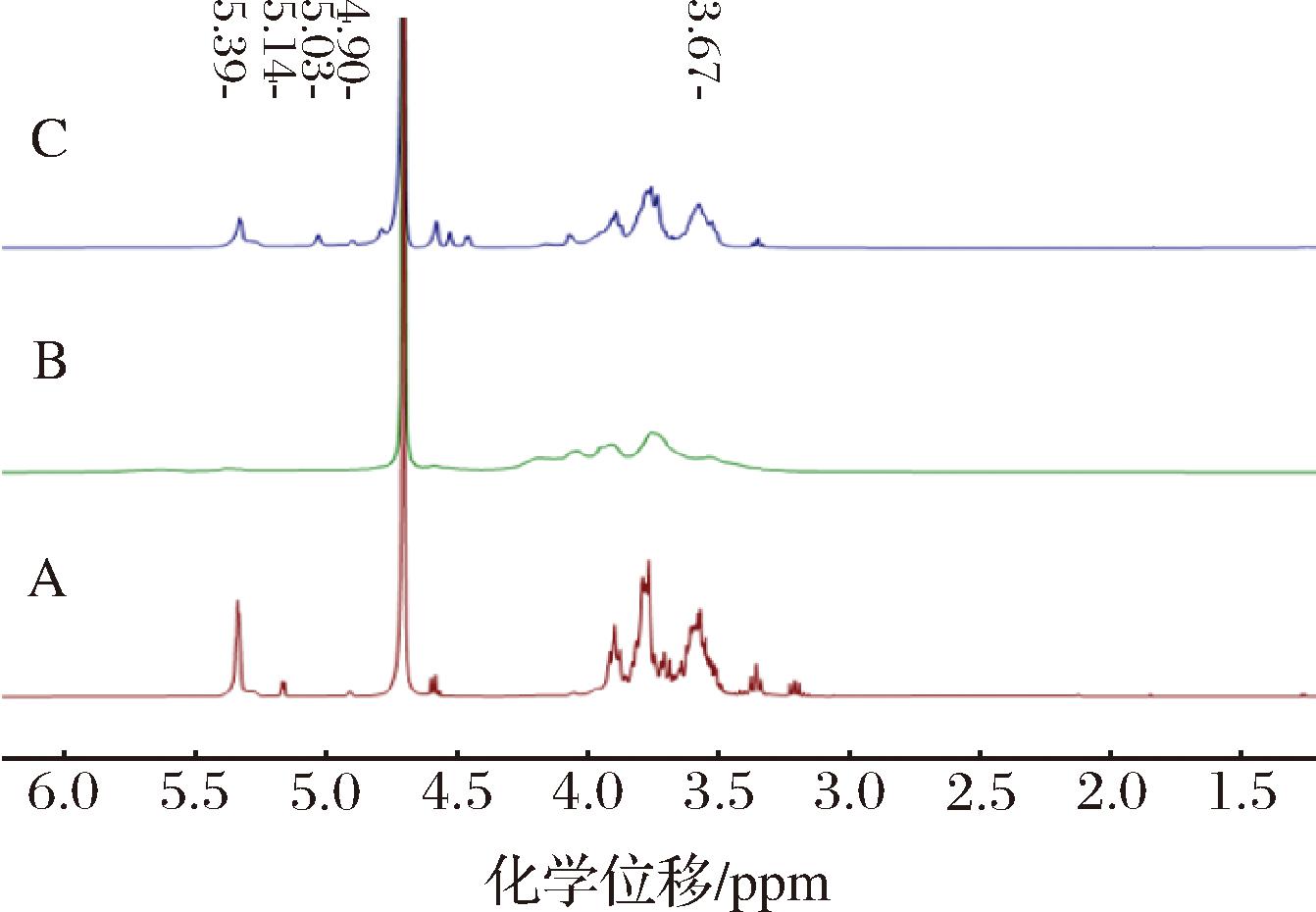
A-CUR;B-C-CUR;C-P-CUR
图3 凝胶多糖及其衍生物的1H NMR谱图
Fig.3 1H NMR spectra of curdlan and their derivatives
2.3 凝胶多糖及其衍生物的红外光谱分析
如图2所示,谱图在3 410 cm-1附近存在很宽的吸收峰,这是CUR分子链上大量—OH基团的伸缩振动的特征峰,2 930 cm-1是C—H的特征峰,1 642 cm-1处的吸收峰对应于CUR多糖分子中的结合水O—H[26],这些水分不能完全除去,这种现象在大多多糖中都会存在。915 cm-1和1 022 cm-1处是由(1→3)-β-D-糖苷键链接的葡聚糖的特征吸收峰[27]。1 401 cm-1是C—H或O—H的弯曲振动峰。凝胶多糖经过羧甲基取代之后,在1 607 cm-1和1 432 cm-1处发现了对应于羧基的不对称伸缩振动峰和对称伸缩振动峰[28];经过磷酸化修饰后在1 256 cm-1处出现特征性的P![]() O伸缩振动吸收峰[29],在1 033 cm-1和890 cm-1处出现P—OH和P—O—C 键的吸收峰,当取代度或磷酸根含量增大时,这3个特征峰会更明显,说明红外光谱可以定性判断羧甲基化和磷酸化程度的大小,这表明已成功制备C-CUR和P-CUR。
O伸缩振动吸收峰[29],在1 033 cm-1和890 cm-1处出现P—OH和P—O—C 键的吸收峰,当取代度或磷酸根含量增大时,这3个特征峰会更明显,说明红外光谱可以定性判断羧甲基化和磷酸化程度的大小,这表明已成功制备C-CUR和P-CUR。
2.4 凝胶多糖及其衍生物的核磁共振分析
对凝胶多糖及其衍生物进行了一维核磁(1H NMR)分析,得到的谱图如图3所示。通过1H NMR可知,在δ=3~6时出现的信号,是多糖存在的特征。在δ=3.0~4.6时的信号是由H-2和H-6质子引起的。δ=4.3~5.4是异头区域,该范围内出现的信号是多糖异头氢引起的,并且在δ=4.3~4.8出现的信号说明多糖存在β构型[30]。在δ=3.5左右出现的特征峰来自于甲氧基(—OCH3)中的氢,C-CUR在此处没有信号,可能是羧甲基(—OCH2COO)取代了该位置上的H[31]。同样对比于CUR的信号,2种修饰后的凝胶多糖衍生物在δ=4.9和δ=5.14都有信号峰的消失,也可以猜测是新的官能团的链接部位。P-CUR在δ=5.03处出现了一个新的信号,而在羟基处H质子的信号消失,说明凝胶多糖在O-2(δ=3.67)处发生过磷酸化。C-CUR的谱图在δ=4.1~4.3的化学位移是由羧甲基导致的。CUR、C-CUR和P-CUR在同一信号峰具有不同的强度,说明三者之间存在一定的差异。
2.5 凝胶多糖及其衍生物的扫描电镜(scanning electron microscope,SEM)形貌观测
3种凝胶多糖分别放大500倍、1 000倍和2 000倍的SEM观察结果如图4所示。由图4可以明显看到,经过羧甲基化和磷酸化修饰的凝胶多糖的表面形貌更加光滑,结构更加紧密。基于原始的凝胶多糖表面结构分布散乱无规律,表面凹凸不平,表面褶皱较为密集;而化学修饰后的凝胶多糖表面较为光滑,整体呈卷曲有规律的片状折叠或缠绕分布,结构之间更为紧密,放大2 000倍的表面也没有观察到裂缝,这些差异表明羧甲基化和磷酸化的化学修饰改变了凝胶多糖的表面形貌,可能改变了凝胶多糖的水溶性,也影响了其生物活性[32]。

图4 凝胶多糖及其衍生物表面微观结构的SEM显微照片
Fig.4 SEM micrographs of the surface microstructure of curdlan and their derivatives
2.6 抗氧化活性评价
由图5-a可知,C-CUR和P-CUR的DPPH自由基清除效果明显高于CUR,C-CUR在质量浓度为5 mg/mL时的清除率为32.33%,P-CUR在质量浓度为5 mg/mL时的清除率为22.59%,而CUR在同样的浓度时的清除率只有17.92%,同时3种多糖对DPPH自由基的清除能力远小于维生素C。整体来说,CUR、C-CUR和P-CUR的DPPH自由基清除能力都随着浓度的增加而增加,但是CUR的增速小于后2种。

a-DPPH自由基清除能力;b-ABTS阳离子自由基清除能力;c-羟自由基清除能力
图5 凝胶多糖及其衍生物在不同浓度下的DPPH自由基、ABTS阳离子自由基和羟自由基清除能力
Fig.5 DPPH, ABTS, and hydroxyl radical′s scavenging ability of curdlan and their derivates at different concentrations
如图5-b所示,3种凝胶多糖均表现出较好的ABTS阳离子自由基清除能力,其清除能力随着多糖溶液质量浓度的增加而增加,但是在达到4 mg/mL后都出现了减弱的趋势。3种凝胶多糖均在 4 mg/mL的质量浓度下表现出最大的清除能力,CUR是64.63%,C-CUR 是73.73%,P-CUR是52.82%,三者中表现最为突出的是C-CUR。虽然3种凝胶多糖的自由基清除能力都比较好,但是在0.25 mg/mL的低质量浓度时,CUR只有11.39%,而C-CUR和P-CUR达到了22.22%和21.04%,分别是改性前的1.95倍和1.84倍。
由图5-c可知,CUR具有一定的羟自由基清除能力,羧甲基化和磷酸化改性修饰的凝胶多糖羟自由基清除能力显著提高。CUR在3 mg/mL时得到最大的羟自由基清除率为34.96%,而C-CUR在5 mg/mL的最大清除率为78.69%,P-CUR则是在4 mg/mL时有85.83%的清除率,同时C-CUR和P-CUR在质量浓度1 mg/mL时对羟自由基清除率就可达到CUR的最大值。三者中P-CUR的清除能力是最强的,除了最高清除率更高外,其质量浓度为0.25 mg/mL时就有27.36%的清除率,CUR和C-CUR在同等浓度下只有18.87%和11.36%。
多糖的抗氧化活性是和分子结构相关联的,不同的化学修饰带来的结构改变对抗氧化活性的影响是不同的。羧甲基化修饰引入的羧甲基破坏了糖链分子间的氢键,羧甲基凝胶多糖可能具有一定的抗电子能力,从而使其对超氧化物的清除能力增强[33-34]。磷酸化修饰引入的磷酸基团会活化多糖异端碳链上的氢原子,成为良好的氢原子供体,稳定游离的自由基[35],来提高磷酸化凝胶多糖的抗氧化性能。综上,羧甲基化和磷酸化修饰引入了新的基团,对于提高凝胶多糖的抗氧化性,尤其是对羟自由基清除能力是很有帮助的。
3 结论
本文以凝胶多糖为原料,通过溶剂法和磷酸盐法分别制备了取代度0.375的羧甲基化凝胶多糖和磷酸根含量6.77%的磷酸化凝胶多糖,成功将凝胶多糖的水溶性提高了5~6倍,羧甲基和磷酸基团成功链接在糖链上。在体外抗氧化试验中,由于化学修饰后的凝胶多糖的水溶性的提高和新基团的链接,使凝胶多糖衍生物的抗氧化活性有显著提高,尤其在对羟自由基的清除能力上。本研究发现,经过羧甲基化和磷酸化修饰改性的凝胶多糖,不仅水溶性能得到改善,抗氧化活性也有显著提高,研究结果可以为凝胶多糖的改性修饰及开发应用提供一定的理论基础。同时还需再进一步探究凝胶多糖及其衍生物的结构和抗氧化活性之间的量效关系,以期获得更加完善的理论模型。
[1] WANG J H, XU J L, ZHANG J C, et al.Physicochemical properties and antioxidant activities of polysaccharide from floral mushroom cultivated in Huangshan Mountain[J].Carbohydrate Polymers, 2015, 131:240-247.
[2] CHEN Y, XIE M Y, NIE S P, et al.Purification, composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies of Ganoderma atrum[J].Food Chemistry, 2008, 107(1):231-241.
[3] CHEN C, WU W H, XU X J, et al.Chain conformation and anti-tumor activity of derivatives of polysaccharide from Rhizoma Panacis Japonici[J].Carbohydrate Polymers, 2014, 105(1):308-316.
[4] XIE M H, HU B, WANG Y, et al.Grafting of gallic acid onto chitosan enhances antioxidant activities and alters rheological properties of the copolymer [J].Journal of Agricultural and Food Chemistry, 2014, 62(37):9128-9136.
[5] SHI J J, ZHANG J G, SUN Y H, et al.Physicochemical properties and antioxidant activities of polysaccharides sequentially extracted from peony seed dreg[J].International Journal of Biological Macromolecules, 2016, 91:23-30.
[6] 陈栅, 冯润芳, 袁野, 等.酸枣多糖羧甲基化修饰及活性研究[J].中国食品学报, 2022, 22(4):55-66.CHEN S, FENG R F, YUAN Y, et al.Studies on carboxy methylation modification and activity of wild jujube polysaccharide[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(4):55-66.
[7] LI X C.Improved pyrogallol autoxidation method:A reliable and cheap superoxide-scavenging assay suitable for all antioxidants[J].Journal of Agricultural and Food Chemistry, 2012, 60(25):6418-6424.
[8] BAI L L, ZHU P L, WANG W B, et al.The influence of extraction pH on the chemical compositions, macromolecular characteristics, and rheological properties of polysaccharide:The case of okra polysaccharide[J].Food Hydrocolloids, 2020, 102:105586.
[9] XU J L, ZHANG J C, LIU Y, et al.Rheological properties of a polysaccharide from floral mushrooms cultivated in Huangshan mountain[J].Carbohydrate Polymers, 2016, 139:43-49.
[10] FENG X, LI F, DING M M, et al.Molecular dynamic simulation:Structural insights of multi-stranded curdlan in aqueous solution[J].Carbohydrate Polymers, 2021, 261:117844.
[11] YUAN M, FU G, SUN Y M, et al.Biosynthesis and applications of curdlan[J].Carbohydrate Polymers, 2021, 273:118597.
[12] SAH B N P, VASILJEVIC T, MCKECHNIE S, et al.Effect of refrigerated storage on probiotic viability and the production and stability of antimutagenic and antioxidant peptides in yogurt supplemented with pineapple peel[J].Journal of Dairy Science, 2015, 98(9):5 905-5 916.
[13] CAI Z X, ZHANG H B.The effect of carboxymethylation on the macromolecular conformation of the (1 → 3)-β-D-glucan of curdlan in water[J].Carbohydrate Polymers, 2021, 272:118456.
[14] 陈玥彤, 张闪闪, 李文意, 等.黑木耳多糖的磷酸化修饰、结构表征及体外降糖活性[J].食品科学, 2022, 43(8):29-35.CHEN Y T, ZHANG S S, LI W Y, et al.Structural characterization and hypoglycemic effect in vitro of phosphorylated Auricularia auriculata polysaccharide[J].Food Science,2022, 43(8):29-35.
[15] 王玉蓉, 冯斌, 巨佳, 等.羧甲基化白及多糖-壳聚糖载姜黄素聚电解质复合膜的制备及其表征[J].中草药, 2020, 51(4):978-985.WANG Y R, FENG B, JU J, et al.Carboxymethyl Bletilla striata polysaccharide-chitosan@curcumin polyelectrolyte complex films:Preparation and characterization[J].Chinese Traditional and Herbal Drugs, 2020, 51(4):978-985.
[16] 季舒婷, 谢静茹, 赵培, 等.松树蕈多糖磷酸化修饰工艺及其抗氧化活性[J].常熟理工学院学报, 2018, 32(5):106-114.JI S T, XIE J R, ZHAO P, et al.The phosphorylation modification and antioxidation activity of polysaccharides from tricholoma matsutake[J].Journal of Changshu Institute of Technology, 2018, 32(5):106-114.
[17] XIE M H, HU B, WANG Y, et al.Grafting of gallic acid onto chitosan enes antioxidant activities and alters rheological properties of the copolymer[J].Journal of Agricultural and Food Chemistry, 2014, 62(37):9128-9136.
[18] 计宇航. 迎春草多糖及其化学修饰产物理化性质及抗氧化性的研究[D].合肥:合肥工业大学, 2021.JI Y H.Physicochemical properties and antioxidant activities of polysaccharides and chemical modifications from Amana edulis[D].Hefei:Hefei University of Technology, 2021.
[19] YANG L Q, ZHAO T, WEI H, et al.Carboxymethylation of polysaccharides from Auricularia auricula and their antioxidant activities in vitro[J].International Journal of Biological Macromolecules, 2011, 49(5):1124-1130.
[20] 廖振胜, 张娜, 杨宇成, 等.多糖溶解性改善方法研究进展[J].食品与发酵工业, 2020, 46(24):292-299.LIAO Z S, ZHANG N, YANG Y C, et al.Methods to enhance the solubility of polysaccharides[J].Food and Fermentation Industries, 2020, 46(24):292-299.
[21] 魏红. 黑木耳多糖的羧甲基化修饰及抗氧化活性研究[D].镇江:江苏大学, 2010.WEI H.Carboxymethylated derivative and their antioxidant activities of polysaccharides from Auricularia auricula[D].Zhenjiang:Jiangsu University, 2010.
[22] LAFFARGUE T, MOULIS C, REMAUD-SIMÉON M.Phosphorylated polysaccharides:Applications, natural abundance, and new-to-nature structures generated by chemical and enzymatic functionalisation[J].Biotechnology Advances, 2023(65):108140.
[23] GUO X Y, KANG J, XU Z Y, et al.Triple-helix polysaccharides:Formation mechanisms and analytical methods[J].Carbohydrate Polymers, 2021, 262:117 962-117962.
[24] ZHANG Y Y, LI S, WANG X H, et al.Advances in lentinan:isolation, structure, chain conformation and bioactivities[J].Food Hydrocolloids, 2011, 25(2):196-206.
[25] 范红梅. 酵母β-葡聚糖酶解改性及其应用[D].天津:天津科技大学, 2018.FAN H M.Enzyme modification of yeast β-glucan and its application[D].Tianjin:Tianjin University of Science and Technology, 2018.
[26] CHEN X M, JIN J, TANG J, et al.Extraction, purification, characterization and hypoglycemic activity of a polysaccharide isolated from the root of Ophiopogon japonicus[J].Carbohydrate Polymers, 2011, 83(2):749-754.
[27] PAN D, WANG L Q, CHEN C H, et al.Structure characterization of a novel neutral polysaccharide isolated from Ganoderma lucidum fruiting bodies[J].Food Chemistry, 2012, 135(3):1097-1103.
[28] LI L Y, ZHANG F J, ZHU L, et al.Carboxymethylation modification, characterization of dandelion root polysaccharide and its effects on gel properties and microstructure of whey protein isolate[J].International Journal of Biological Macromolecules, 2023, 242(Part 2):124781.
[29] LIU Y, HUANG G L.Extraction and derivatisation of active polysaccharides(Review)[J].Journal of Enzyme Inhibition and Medicinal Chemistry, 2019, 34(1):1690-1696.
[30] XU Y Q, LIU G J, YU Z Y, et al.Purification, characterization and antiglycation activity of a novel polysaccharide from black currant[J].Food Chemistry, 2016, 199:694-701.
[31] ZHU W L, XUE X P, ZHANG Z J.Structural, physicochemical, antioxidant and antitumor property of an acidic polysaccharide from Polygonum multiflorum[J].International Journal of Biological Macromolecules, 2017, 96:494-500.
[32] DUAN S Y, ZHAO M M, WU B Y, et al.Preparation, characteristics, and antioxidant activities of carboxymethylated polysaccharides from blackcurrant fruits[J].International Journal of Biological Macromolecules, 2020, 155:1114-1122.
[33] 牛庆川, 李银莉, 李玉萍.天然多糖羧甲基化对其生物活性影响的研究进展[J].天然产物研究与开发, 2019, 31(1):170-174;183.NIU Q C, LI Y L, LI Y P.Research progress on their biological activities of carboxymethylation of natural polysaccharides[J].Natural Product Research and Development, 2019, 31(1):170-174;183.
[34] XU J, LIU W, YAO W B, et al.Carboxymethylation of a polysaccharide extracted from Ganoderma lucidum enhances its antioxidant activities in vitro[J].Carbohydrate Polymers, 2009, 78(2):227-234.
[35] 张亚坤, 王金荣, 黄进, 等.多糖的磷酸化修饰及其生物活性研究进展[J].食品安全质量检测学报, 2021, 12(20):8172-8177. ZHANG Y K, WANG J R, HUANG J, et al.Research progress on phosphorylation modification and biological activity of polysaccharides[J].Journal of Food Safety &Quality, 2021, 12(20):8172-8177.