陈皮又名橘皮、贵皮,是芸香科植物橘(Citrus Reticulata Blanco)及其变种果实的干燥果皮,具有理气健脾、燥湿化痰等功效,能有效缓解积食、胸闷、咳嗽等症状,是一种药食两用的天然活性物质[1]。按照产地划分,陈皮可分为“陈皮”和“广陈皮”两类,其中陈皮主要产于江西、浙江、四川等省份,而广陈皮则主要产自广东省江门市的新会区。很多古代医学著作认为陈皮具有“陈久者良”的特性,市场上陈皮的价格也随其贮藏年份的延长而增长[2]。陈皮中富含黄酮、挥发油、生物碱等多种活性成分,贮藏年份一定程度上影响着这些化学成分含量的变化,但由于样品采集时间、品种和贮藏条件差异等原因,年份与活性成分关系的研究结果不尽一致,迄今为止仍无法科学解释陈皮贮藏年份与其功效之间的关系[3]。
多糖是陈皮水提物中含量最多的一类生物大分子,研究发现陈皮多糖不仅是一类结构分子,同时具有诸多生物活性,如免疫调节[4]、抗氧化[5]和抗肿瘤[6]。在植物成熟过程中,其中的多糖会通过共价键或非共价键与酚类(聚酚)结合,形成多糖-酚结合物(polysaccharide-phenol conjugates, PPC),形成的结合物同时具备多糖的生理活性和酚类的抗氧化性,是一种颇具开发价值的功能性食品添加剂[7]。研究表明多糖-酚结合物的形成受陈皮贮藏时间、温度等条件的影响[8],可能与陈皮活性变化存在关联。
本研究以1年、5年和10年陈皮的水溶性多糖为研究对象,着重分析了不同年份陈皮中多糖-酚结合物的形式和含量,比较了多糖-酚结合物在清除自由基、抑制脂质过氧化和保护DNA损伤等方面的生物活性。本研究冀望明确陈皮多糖-酚结合物的形成与陈皮功效之间的关系,阐释陈皮陈化的机理,为陈皮的进一步开发利用提供基础依据。
1 材料与方法
1.1 材料与试剂
1年、5年和10年的广陈皮(茶枝柑果皮),江门市新会区新宝堂茶叶有限公司;DPPH,合肥千盛生物科技有限公司;三氯乙酸和偶氮二异丁脒盐酸盐(2,2′-azobis[2-methylpropionamidine], AAPH),上海麦克林生化科技股份有限公司;2-硫代巴比妥酸、铁氰化钾和抗坏血酸,国药基团化学试剂有限公司;三羟甲基氨基甲烷,北京索莱宝科技有限公司;核酸电泳试剂盒,北京全式金生物技术股份有限公司;其他试剂均为分析纯。
1.2 仪器与设备
Waters, 1525高效液相色谱仪,美国Waters科技有限公司;L系列紫外可见分光光度计,上海佑科仪器仪表有限公司;JSM-6490扫描电子显微镜,日本电子株式会社;FD-1-50冷冻干燥机,北京博医康实验仪器有限公司;Mini-PROTEAN Tetra System电泳仪,美国BIO-BAD公司;Vanquish Q Exactive Plus液相-质谱联用,赛默飞世尔。
1.3 实验方法
1.3.1 陈皮中多糖-酚结合物的提取
多糖-酚结合物的提取参照TIAN等[9]的方法,略有修改,大致流程如下:陈皮在50 ℃下干燥6 h,粉碎后过80目筛,分别用甲醇和丙酮索氏抽提6 h,去除其中的色素、酯类等物质。干燥后,按料液比1∶30(g∶mL)加入超纯水,90~100 ℃下磁力搅拌提取2 h,用8层纱布过滤,得提取液,重复提取1次,合并滤液,60 ℃下真空旋转蒸发浓缩;浓缩液在10 000 r/min条件下离心20 min,倾出上清液,按1∶4(体积比)加入无水乙醇,静置过夜,收集沉淀。沉淀物置于60 ℃烘箱中,去除乙醇。加入适量超纯水溶解,加入20%提取液体积的Sevage试剂[V(氯仿)∶V(正丁醇)=1∶4],剧烈振荡2 min,6 000 r/min离心10 min,重复4~6次,去除提取液中的蛋白质。提取液装入透析袋(3 500 Da)中,置入超纯水中透析24 h(中间换水2~3次),适当浓缩后,冷冻干燥成粉末,得到陈皮多糖-酚结合物。
1.3.2 陈皮多糖-酚结合物的扫描电子显微镜(scanning electron microscope, SEM)观察
样品用超纯水溶解,配制成2.0 mg/mL的溶液,冷冻干燥后的多糖粉末送至合肥工业大学分析测试中心进行SEM观察。
1.3.3 陈皮多糖中不同形式结合酚的测定
1.3.3.1 陈皮多糖中不同形式结合酚的提取
陈皮多糖中多酚的分离方法参照文献[10],稍作修改:精确称取0.5 g的多糖样品,用10 mL的混合溶剂[V(甲醇)∶V(丙酮)∶V(水)=7∶7∶6]磁力搅拌萃取,每次2 h。在6 000 r/min条件下离心20 min,倾出上清液;重复上述操作,合并上清液,残渣备用。60 ℃ 下真空旋转浓缩上清液至初始体积的四分之一,用6.0 mol/L的HCl溶液调pH至2.0后,用等体积的乙醚-乙酸乙酯(1∶1,体积比)混合溶剂萃取3次,合并轻相,浓缩至干,得到游离酚;萃取余相(水相)加入3倍体积的NaOH(4.0 mol/L),在通入N2的情况下室温水解4 h,然后用6.0 mol/L的盐酸调节pH值至2.0,用等体积的乙醚-乙酸乙酯(1∶1,体积比)萃取3次,合并有机相,真空浓缩至干即得可溶性结合酚;采用上述可溶性结合酚的提取方法处理残渣可得不溶性结合酚。
1.3.3.2 Folin-Ciocalteu法测定总酚含量
参考WANG等[11]的方法,以没食子酸为标准品,测定了不同样品中3种结合形式酚的含量。
1.3.3.3 高效液相色谱法比较总酚含量
3种酚类样品分别用1.0 mL的甲醇充分溶解,过0.45 μm的滤膜,进行液相色谱分析,色谱条件如下:色谱柱为Ecosil C18色谱柱(250 mm×4.6 mm,5 μL),流动相为甲醇-0.1%磷酸溶液(45∶55,体积比);流速:1.0 mL/min,柱温:25 ℃;进样量:10 μL,测定波长:280 nm,以吸收峰的面积表征酚类物质的浓度。
1.3.4 不同年份陈皮多糖-酚结合物的抗氧化性
1.3.4.1 DPPH自由基清除能力
参考常超等[12]的方法,略作修改:样品管中依次加入0.5 mL不同浓度的样品溶液和60 mmol/L的DPPH 1.5 mL,涡轮混合均匀,25 ℃下避光反应30 min,在517 nm处测定吸光度(A1);空白管用蒸馏水替代多糖溶液(A0),对照管用95%的乙醇替代DPPH溶液(A2)。以抗坏血酸作为阳性对照,按公式(1)计算清除率:
DPPH自由基清除率![]()
(1)
1.3.4.2 羟自由基清除能力
参考了商佳琦等[13]的方法,略有修改:样品管依次加入1.0 mL 9.0 mmol/L FeSO4和1.0 mL 9.0 mmol/L的H2O2溶液,涡轮混合均匀;随后依次加入1.0 mL不同浓度的样品溶液和1.0 mL 9.0 mmol/L的水杨酸溶液(醇溶),混合均匀,37 ℃下反应30 min,在510 nm处测定吸光度(A1)。空白管用蒸馏水替代多糖溶液(A0),对照管用蒸馏水替代水杨酸溶液(A2)。以抗坏血酸作为阳性对照,按公式(2)计算羟自由基的清除率:
羟自由基清除率![]()
(2)
1.3.4.3 抗脂质过氧化能力
参考陈思南等[14]的方法,略作修改:用颈椎脱臼法处死小鼠,取出小鼠肝脏,用冷生理盐水洗涤后滤纸吸干、称重。按1∶9(g∶mL)加入蒸馏水,冰浴下研磨制成10%的悬浮液,3 000 r/min离心15.0 min分钟,取上清液稀释10倍制成1%的肝组织匀浆液,冷藏备用。
样品管中依次加入1.0 mL的肝匀浆液、720 μL不同浓度的样品溶液,混匀;随后依次加入200 μL 6.0 mmol/L的FeSO4和80 μL 60.0 mmol/L的H2O2,混合均匀,37 ℃下反应1 h,每10 min振荡1次。反应结束后冰浴10 min终止反应,向试管中加入1.0 mL的FeCl3(1.0%)和1.0 mL的硫代巴比妥酸(0.8%),混匀后沸水浴反应15 min立即冷却至室温;6 000 r/min下离心10 min,取上清液在532 nm处测吸光度(A1)。模型管中用蒸馏水替代样品溶液(A2),空白管中用蒸馏水替代FeSO4和H2O2溶液(A0),其他步骤同上述步骤。以抗坏血酸为阳性对照,按公式(3)计算抑制率:
抑制率![]()
(3)
1.3.4.4 还原力测定
测定方法参考袁晓擘等[15]的方法,稍作修改:样品管中依次加入1.0 mL的样品溶液、0.2 mL的Na2HPO4缓冲液(0.2 mol/L, pH 6.6)和0.5 mL 1%的K3[Fe(CN)6]溶液,充分混匀,50 ℃下水浴加热20 min后置于冰水浴中迅速冷却,加入1.0 mL 1.0%的FeCl3,充分混匀,在700 nm处测定吸光度(A1)。对照管(A2)用蒸馏水替代K3[Fe(CN)6],空白管(A0)用蒸馏水替代多糖溶液。以抗坏血酸为阳性对照,按公式(4)计算还原力:
还原力=(A1-A2)-A0
(4)
1.3.4.5 DNA损伤的保护
参考韩溹仪等[16]的方法,评价了陈皮多糖-酚对于过氧自由基介导的DNA损伤的保护作用。样品管中依次加入5.0 μL的样品溶液、1.0 μL质粒(pET28α)、11.0 μL PBS(10 mmol/L, pH 7.4)、3.0 μL的AAPH(50 mmol/L),37 ℃下避光加热45 min。空白组用PBS替代AAPH和多糖溶液,对照组用PBS代替样品溶液。琼脂糖凝胶电泳进行检测。反应结束后,利用琼脂糖凝胶电泳进行检测(90 V,50 min),在凝胶成像仪下进行观察。
1.4 数据分析
每个试验重复3次,结果以平均值±标准差表示。采用Origin 2018软件对数据进行分析,P<0.05时表示差异显著。
2 结果与分析
2.1 不同年份陈皮多糖的SEM观察
从外观上观察,冷冻干燥后的PPC-1呈白色或微黄色,而PPC-5和PPC-10则呈红褐色,这种颜色上的巨大差异一方面是由于陈皮多糖结构上的改变,如酯化度降低、相对分子质量变小等[17];另一方面则是由于陈皮多糖与其他小分子相结合,形成了多种多样的衍生物。采用SEM对3种PPC的微观形态进行了观察和比较,如图1所示,PPC-1表面为平整光滑的片状结构,分子排列十分紧密,且大小不一。这种片状、光滑的分子聚集结构在天然植物多糖中较为常见,如玉米须多糖[18]等。然而,PPC-5和PPC-10的微观结构则表现为一种镂空的网状结构,与PPC-1的结构差异较为显著。之前的研究表明,5年和10年的陈皮多糖在单糖组成、酯化度方面较为接近,而与1年陈皮多糖差距较显著[9],这可能是导致多糖微观形态存在差异的原因之一。

A-PPC-1;B-PPC-5;C-PPC-10
图1 不同年份陈皮多糖-酚结合物的扫描电镜图
Fig.1 SEM images of polysaccharide- phenol conjugates from Citri Reticulatae Pericarpium with different storage time
2.2 不同年份陈皮多糖中酚类物质含量的测定
酚类物质是植物细胞中的一类重要次级代谢产物,根据芳香环上羟基的个数可以大致分为简单酚(酚酸、香豆素等)和多酚(花青素、原花色素等)。酚类物质可以游离的形式存在,也能以共价形式结合在植物细胞壁中的多糖分子上,形成多糖-酚结合物,极大地提升多糖的功能活性[19]。其中,可溶性结合酚和不溶性结合酚多以共价键(酯键、醚键、碳碳键等)的形成与陈皮中的多糖相结合,在酸、碱或酶的催化下才能释放出来[20-21]。
采用Folin-Ciocalteu法测定了3种年份陈皮多糖中游离酚、可溶性结合酚和不可溶结合酚的含量,其中PPC-1、PPC-5和PPC-10中游离酚含量依次为15.4、2.3和1.9 mg/g,可溶性结合酚分别为10.5、58.3和37.7 mg/g,不可溶结合酚依次为3.5、25.8和36.2 mg/g。以高效液相色谱法比较了3种年份同一形式结合酚的含量(以峰面积表征酚的浓度),如图2所示。结果显示3种年份陈皮多糖中游离酚的出峰时间为3.788 min,PPC-1、PPC-5和PPC-10峰面积的比值为6.06∶1.18∶1.0;可溶性结合酚的出峰时间为8.955 min和9.307 min,PPC-1、PPC-5和PPC-10两个峰面积和的比值为1.0∶6.33∶2.67;不溶性结合酚的种类相对较多,其出峰时间为4.513、4.812、4.892、8.974、9.293、14.219 min,PPC-1、PPC-5和PPC-10出峰面积和的比值为1.0∶19.07∶19.68。2种结果均表明,可溶性结合酚和不溶性结合酚在PPC-5和PPC-10中的含量较高,而在PPC-1中的含量较低,即随着贮藏年份的延长,陈皮中存在的游离酚会逐渐以共价键的形式与多糖相结合,形成多糖-酚结合的衍生物。

A-游离酚;B-可溶性结合酚;C-不溶性结合酚
图2 三种年份陈皮多糖-酚结合物中游离、结合酚和不溶酚的组成
Fig.2 Composition of free, conjugated and insoluble phenolic acids from three PPCs
2.3 陈皮多糖-酚结合物的抗氧化活性
2.3.1 DPPH自由基清除能力
DPPH是一种含有稳定氮自由基的物质,其醇溶液呈深紫色,在517 nm处有强烈吸收峰,抗氧化物质可与其单电子配对,吸光度值的下降与抗氧化物的自由基清除能力呈正相关。如图3所示,3种年份陈皮多糖-酚结合物清除DPPH自由基的效果与其浓度均呈现出一定的正相关,其中PPC-5的清除能力要显著高于另外2种样品,当浓度为2.0 mg/mL时,PPC-5对DPPH自由基的清除率为28.68%。
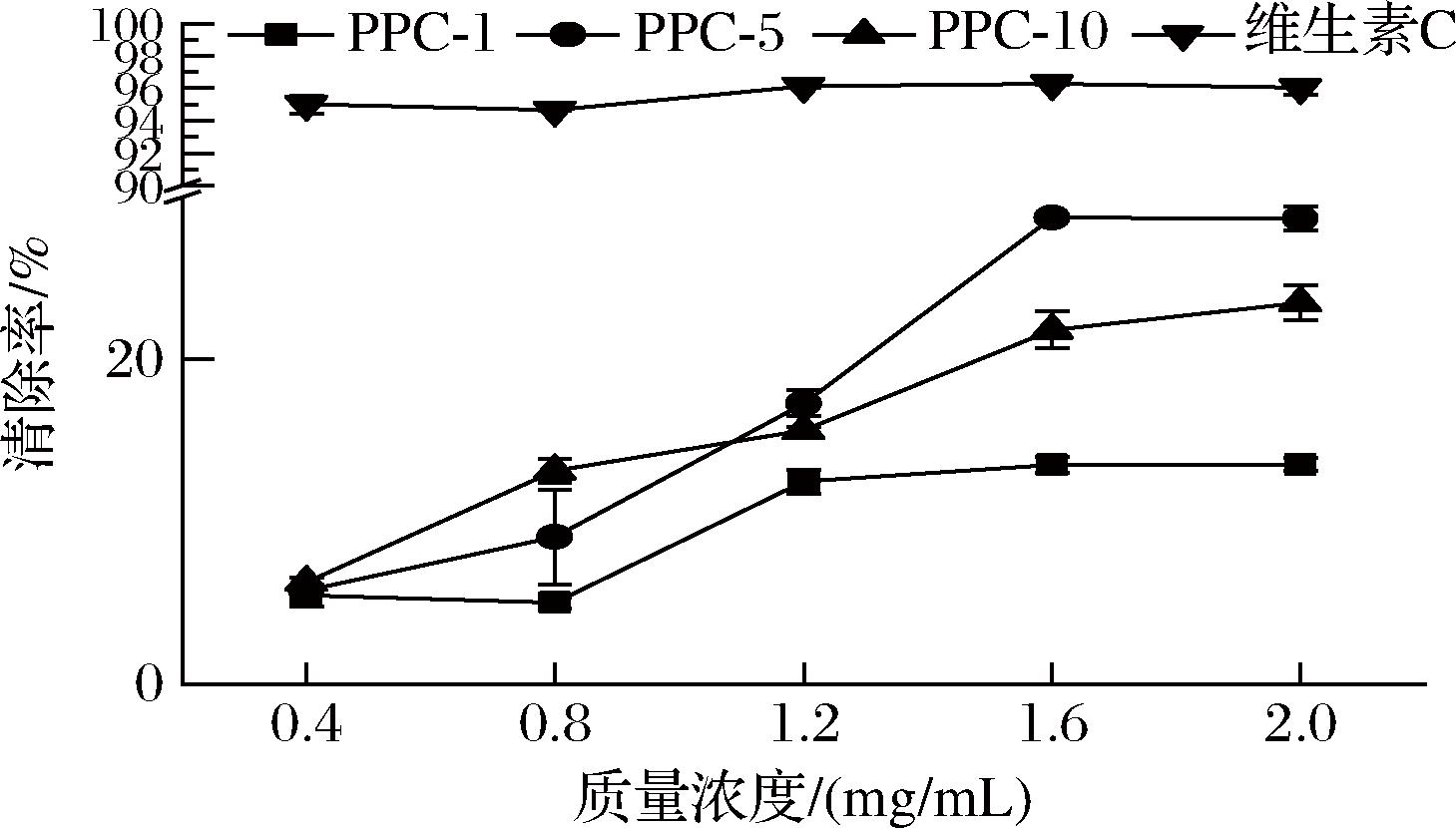
图3 三种陈皮多糖清除DPPH自由基的能力
Fig.3 Scavenging effects of three CCPs on DPPH free radical
2.3.2 羟自由基清除能力
由图4可见,PPC-10和PPC-5对羟自由基均表现出一定的清除能力,且随着浓度的升高,清除能力逐渐增强。PPC-1清除羟自由基的能力要弱于PPC-5和PPC-10,特别是在高浓度情况下,清除羟自由基能力反而有所下降。
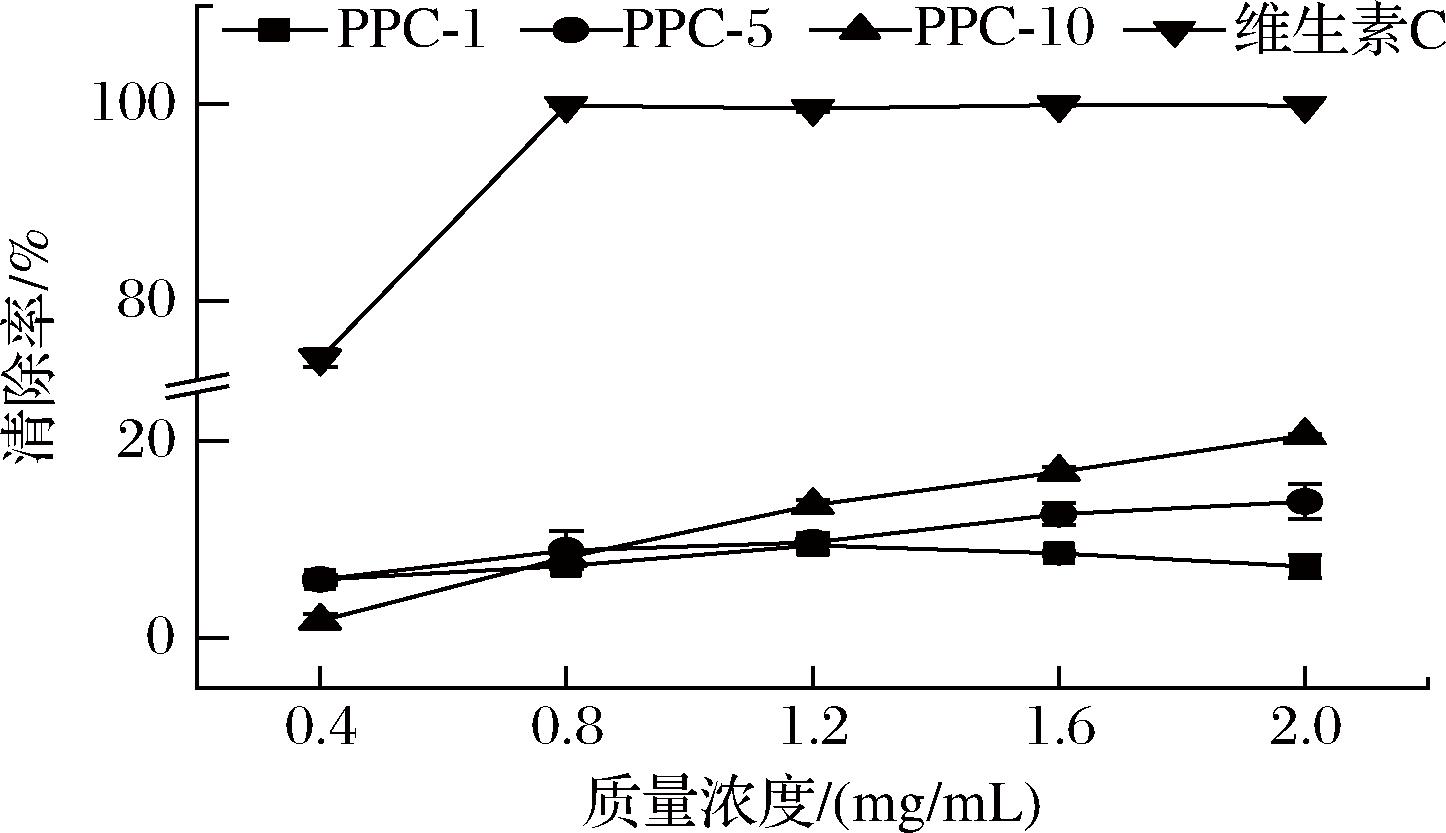
图4 三种陈皮多糖-酚结合物对羟自由基的清除能力
Fig.4 Scavenging effect of three PPCs on hydroxyl free radicals
2.3.3 抗脂质过氧化能力
研究表明,多糖可以直接与脂质过氧化链中产生的活性氧反应,阻断或延缓脂质过氧化的过程[22]。由图5可见,3种年份陈皮多糖-酚结合物均有着较强的抗脂质过氧化作用,其中PPC-5和PPC-10的清除效果尤为显著,当质量浓度为0.2 mg/mL时,其清除率分别为62.8%和65.3%。
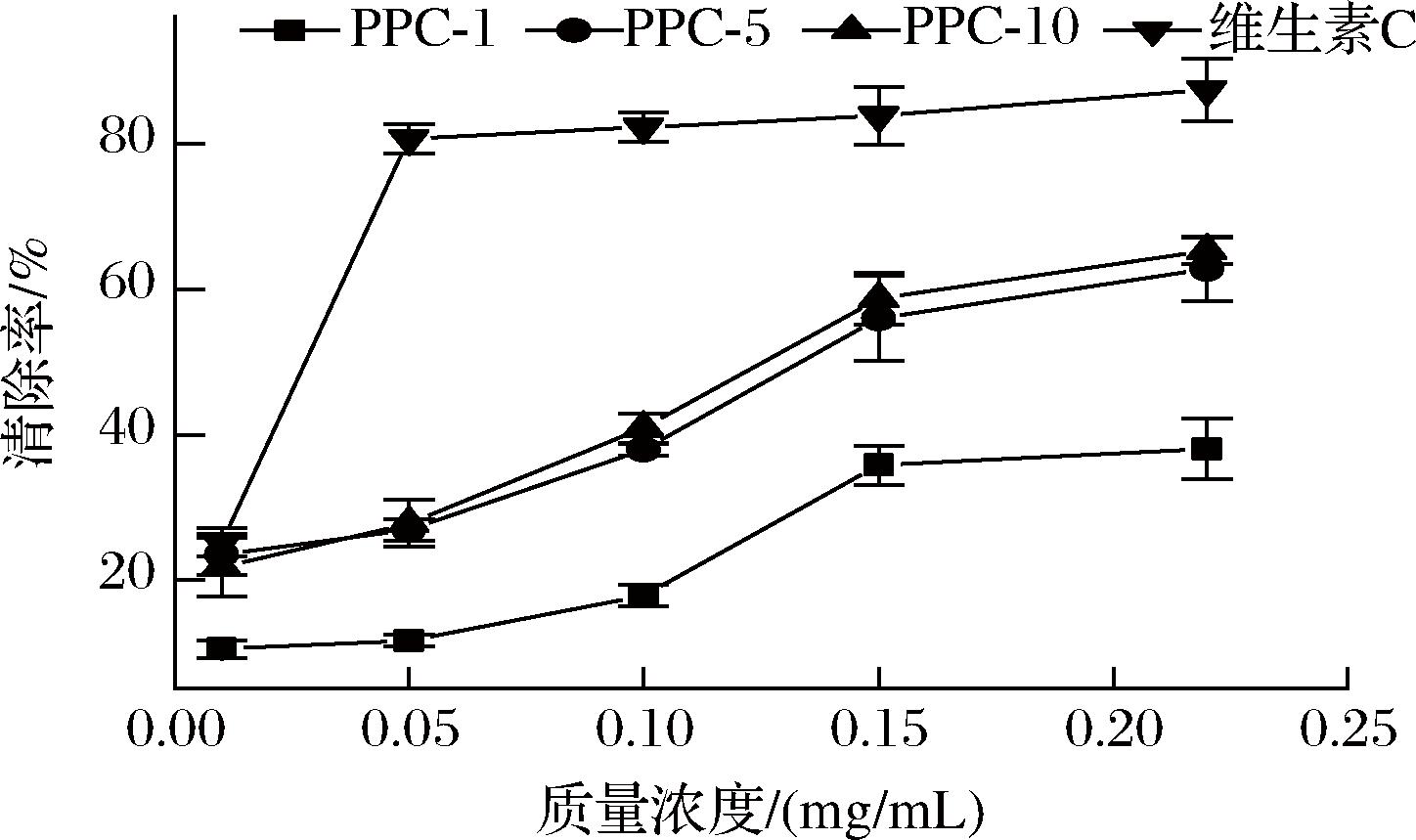
图5 三种陈皮多糖的脂质过氧化清除能力
Fig.5 Scavenging ability of three PPCs against lipid peroxide
2.3.4 还原力的比较
抗氧化性物质通常具有一定的还原力,通过提供电子来清除反应体系中的自由基或高价离子。如图6所示,在测定浓度范围内,3种PPC的还原能力与浓度呈现显著的正相关。相比之下,PPC-5的还原力要明显高于其他2种陈皮多糖,当质量浓度为2.0 mg/mL时,PPC-5的还原力达到0.387。
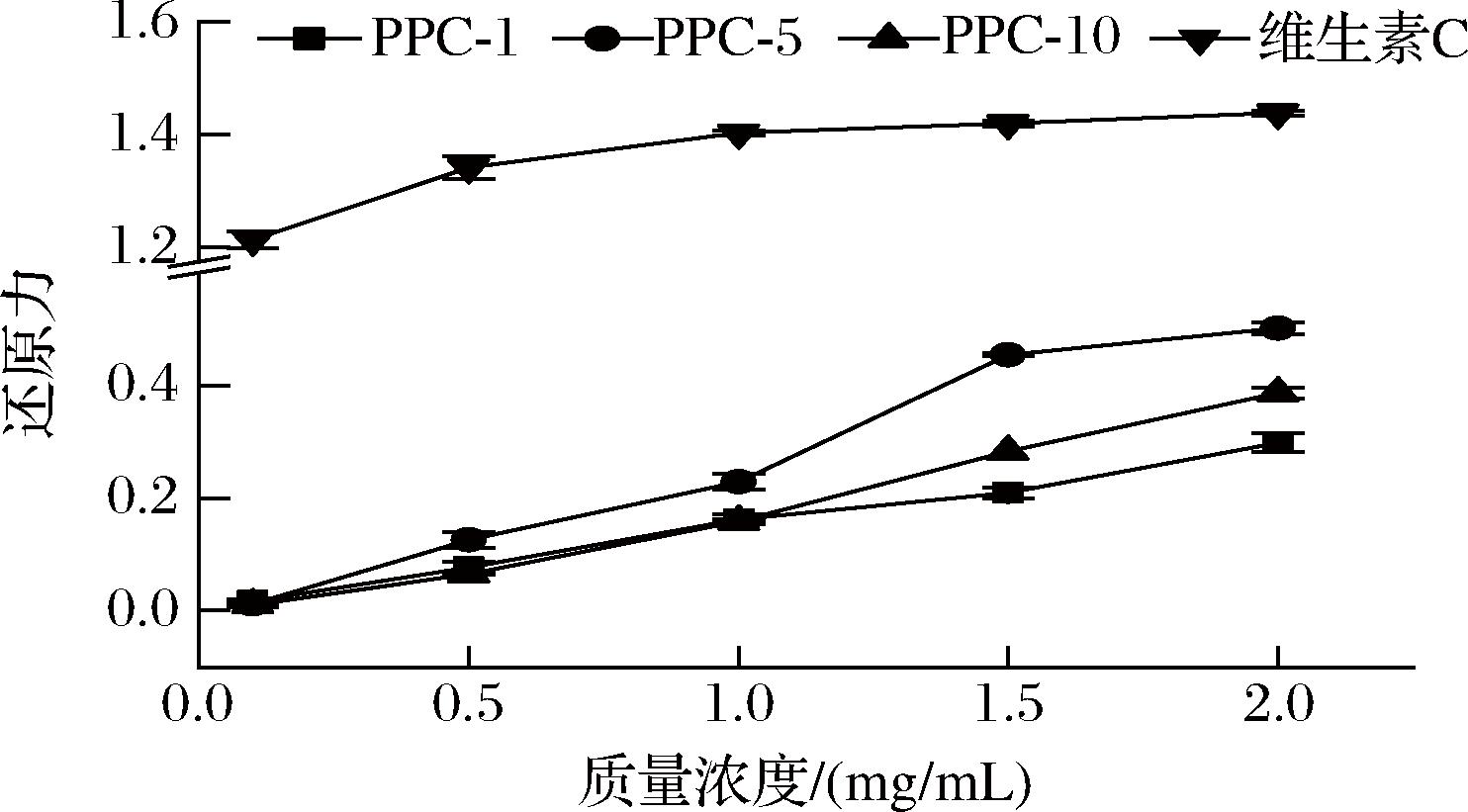
图6 三种陈皮多糖-酚结合物的还原力
Fig.6 Reducing power of three PPCs
2.3.5 DNA损伤的保护作用
过量自由基的存在会导致DNA链的断裂、碱基修饰、DNA位点突变以及双链畸变等形式的DNA损伤,产生不利于生物体生长的遗传毒性[23]。如图7所示,正常的pET28α质粒以一种超螺旋结构存在,其分子质量大,电泳时迁移距离较大。当添加AAPH后,pET28α质粒发生解螺旋,形成开环结构,电泳迁移距离变小。当反应体系中添加1.0 mg/mL的PPC-5或PPC-10时,部分pET28α质粒仍以超螺旋结构存在,表明PPC-5和PPC-10对AAPH造成的DNA损伤均有着一定的干预和保护作用。

图7 三种陈皮多糖-酚结合物对烷氧自由基诱导DNA氧化损伤的保护作用
Fig.7 Protective effects of three PPCs on alkoxyl radical-induced DNA oxidative damage
注:1:模型组;2:空白组;3:PPC-1(1.0 mg/mL);4:PPC-1(0.1 mg/mL);5:PPC-5(1.0 mg/mL);6:PPC-5(0.1 mg/mL);7:PPC-10 (1.0 mg/mL);8:PPC-10(0.1 mg/mL);9:维生素C(1.0 mg/mL);10:维生素C(0.1 mg/mL)。
3 结论
本研究发现,PPC-5和PPC-10中含有大量的结合酚(可溶和不可溶),而PPC-1中含有较多的游离酚,该现象表明在陈皮漫长的晾晒、贮藏加工过程中,酚类物质会逐渐与多糖发生共价反应,形成可溶或不可溶的多糖-酚结合物。抗氧化实验显示,PPC-5和PPC-10在清除DPPH自由基、抑制脂质过氧化和预防DNA损伤能力上要显著强于PPC-1,该现象可能与陈皮中多糖-酚结合物的形成相关联。3种年份陈皮多糖中可溶性结合酚的含量为PPC-5>PPC-10>PPC-1,与其表现出的DPPH清除能力和还原力呈正相关,说明陈皮多糖中的可溶性结合酚具有较强的供电子能力,在清除部分自由基中发挥着重要作用。本研究阐述了陈皮中多糖-酚结合物与其抗氧化性间的联系,对陈皮“陈久者良”的中医药学观点做了部分药理学阐释,冀望为陈皮的质量评价和生产加工提供些许理论依据。
[1] 徐健, 王晓东, 陈亮, 等.陈皮挥发油GC-MS分析与橙皮苷含量测定[J].中国野生植物资源, 2023, 42(4):39-42.XU J, WANG X D, CHEN L, et al.GC-MS analysis of volatile oil in tangerine peel and determination of hesperidin content[J].Chinese Wild Plant Resources, 2023, 42(4):39-42.
[2] 王智磊, 张鑫, 刘素娟, 等.陈皮“陈久者良”历史沿革和研究现状[J].中华中医药学刊, 2017, 35(10):2580-2584.WANG Z L, ZHANG X, LIU S J, et al.Historical evolution and research Ztatus of Citri Reticulatae Pericarpium[J].Chinese Archives of Traditional Chinese Medicine, 2017, 35(10):2580-2584.
[3] 曾鸿莲, 曾林燕, 陈佳美, 等.不同贮藏年限陈皮化学成分的差异性研究进展[J] 亚太传统医学, 2023, 19(7):221-225.ZENG H L, ZENG L Y, CHEN J M, et al.Research progress on chemical constituents difference of Citri Reticulatae Pericarpium with different storage years[J].Asia-Pacific Traditional Medicine, 2023, 19(7):221-225.
[4] ZHOU T, JIANG Y M, WEN L R, et al.Characterization of polysaccharide structure in Citrus Reticulate ‘Chachi’ peel during storage and their bioactivity[J].Carbohydrate Research, 2021, 508:108398.
[5] CHEN R Z, JIN C G, TONG Z G, et al.Optimization extraction, characterization and antioxidant activities of pectic polysaccharide from tangerine peels[J].Carbohydrate Polymers, 2016, 136:187-197.
[6] PARK H R, PARK S B, HONG H D, et al.Structural elucidation of anti-metastatic rhamnogalacturonan Ⅱfrom the pectinase digest of citrus peels (Citrus unshum)[J].International Journal of Biological Macromolecules, 2017, 94:161-169.
[7] CAMPOS F, PEIXOTO A F, FERNANDES P A R, et al.The antidiabetic effect of grape pomace polysaccharide-polyphenol complexes[J].Nutrients, 2021, 13(12):4495.
[8] CHOI M Y, CHAI C, PARK J H, et al.Effects of storage period and heat treatment on phenolic compound composition in dried Citrus peels (Chenpi) and discrimination of Chenpi with different storage periods through targeted metabolomic study using HPLC-DAD analysis[J].Journal of Pharmaceutical and Biomedical Analysis, 2011, 54(4):638-645.
[9] TIAN C C, XU H, LI J, et al.Characteristics and intestinal immunomodulating activities of water-soluble pectic polysaccharides from Chenpi with different storage periods[J].Journal of the Science of Food and Agriculture, 2018, 98(10):3752-3757.
[10] HARISH NAYAKA M A, SATHISHA U V, DHARMESH S M.Cytoprotective and antioxidant activity of free, conjugated and insoluble-bound phenolic acids from swallow root (Decalepis hamiltonii)[J].Food Chemistry, 2010, 119(4):1307-1312.
[11] WANG X, XIE K L, ZHUANG H N, et al.Volatile flavor compounds, total polyphenolic contents and antioxidant activities of a China gingko wine[J].Food Chemistry, 2015,182:41-46.
[12] 常超, 蔡海莺, 陈瑞达, 等.超声辅助提取日本荚蒾果实总三萜工艺优化及其抗氧化活性[J].食品研究与开发, 2023, 44 (15):90-97.CHANG C, CAI H Y, CHEN R D, et al.Optimization of ultrasonic-assisted extraction and antioxidant analysis of total triterpenes from Viburnum japonicum fruit[J].Food Research and Development, 2023, 44(15):90-97.
[13] 商佳琦, 邹丹阳, 滕翔宇, 等.5种食用菌多糖的结构特征及抗氧化活性对比[J].食品工业科技, 2020, 41 (15):77-83;89.SHANG J Q, ZOU D Y, TENG X Y, et al.Structural characterization and antioxidant activity of five kinds of edible fungus polysaccharides[J].Science and Technology of Food Industry, 2020, 41(15):77-83;89.
[14] 陈思南, 王心怡, 李梦婷, 等.五味子蜂花粉不同萃取物对小鼠肝脏脂质过氧化及DNA氧化损伤的作用[J].食品科学, 2019, 40 (11):146-151.CHEN S N, WANG X Y, LI M T, et al.Effects of different solvent extracts from Schisandra chinensis bee pollen on hepatic lipid peroxidation and DNA oxidative damage[J].Food Science, 2019, 40(11):146-151.
[15] 袁晓擘, 李世刚, 张宏岐, 等.五峰绿茶的体外抗氧化活性研究[J].食品研究与开发, 2019, 40(3):51-55.YUAN X B, LI S G, ZHANG H Q, et al.Study on antioxidative activity of total extracted from Wu-feng green tea in vitro[J].Food Research and Development, 2019, 40(3):51-55.
[16] 韩潆仪, 任虹, 王丹丹, 等.芫荽对生物大分子氧化损伤的保护作用及自由基清除能力[J].食品科学技术学报, 2017, 35(1):64-69;94.HAN Y Y, REN H, WANG D D, et al.Bio-molecules damage protective effect and free radical scavenging capacity of Coriandrum sativum L.[J].Journal of Food Science and Technology, 2017, 35(1):64-69;94.
[17] EINHORN-STOLL U, KASTNER H, DRUSCH S.Thermally induced degradation of citrus pectins during storage-Alterations in molecular structure, colour and thermal analysis[J].Food Hydrocolloids, 2014, 35:565-575.
[18] 宫春宇, 徐硕, 徐先梅, 等.超滤分离制备玉米须粗多糖及其促益生菌增殖活性研究[J].食品与发酵工业, 2021, 47 (17):166-171.GONG C Y, XU S, XU X M, et al.Structure and components of crude polysaccharide separated by ultrafiltration from Stigma maydis and its activity for promoting probiotics proliferation[J].Food and Fermentation Industries, 2021, 47(17):166-171.
[19] LIU J, BAI R Y, LIU Y P, et al.Isolation, structural characterization and bioactivities of naturally occurring polysaccharide-polyphenolic conjugates from medicinal plants-A review[J].International Journal of Biological Macromolecules, 2018, 107(Pt B):2242-2250.
[20] KOLODZIEJCZYK-CZEPAS J, BIJAK M, SALUK J, et al.Radical scavenging and antioxidant effects of Matricaria chamomilla polyphenolic-polysaccharide conjugates[J].International Journal of Biological Macromolecules, 2015, 72:1152-1158.
[21] LI Q, YANG S H, LI Y Q, et al.Antioxidant activity of free and hydrolyzed phenolic compounds in soluble and insoluble dietary fibres derived from hulless barley[J].LWT, 2019, 111:534-540.
[22] HUANG G L, MEI X Y, HU J C.The antioxidant activities of natural polysaccharides[J].Current Drug Targets, 2017, 18(11):1296-1300.
[23] 马娜, 赵海霞, 陈茜, 等.五子衍宗方对自然衰老大鼠睾丸生殖细胞DNA氧化损伤的保护作用研究[J].中国中药杂志, 2018, 43 (14):2985-2990.MA N, ZHAO H X, CHEN Q, et al.Protective effect of Wuzi Yanzong recipe on testicular DNA oxidative damage in natural ageing rats[J].China Journal of Chinese Materia Medica, 2018, 43(14):2985-2990.