肠道菌群数量及种类繁多,通过生物拮抗、免疫反应和调节机体代谢等方式影响机体健康,它们与肠道系统共同构成肠道微生态,是维持肠道正常功能的基本保障[1]。肠道菌群包括有益菌群、中间菌群和有害菌群。它们相互制约,相互依赖,维持肠道内微生态平衡,保持机体健康[2]。人类许多疾病与肠道菌群失调相关,肠道菌群作为饮食与宿主之间的桥梁,改变饮食结构可调节肠道菌群构成,进而改变代谢产物,影响营养代谢[3]。ω-3脂肪酸可促进肠道微生物群体健康生长,降低炎症等相关疾病[4-6]。
紫苏籽油由紫苏籽制得,其营养成分丰富,不饱和脂肪酸达90%以上[7],其中α-亚麻酸最多,含50%~64%[8]。此外,含有丰富多酚、黄酮、生育酚以及植物甾醇等生物活性成分[7]。α-亚麻酸为ω-3长链多不饱和脂肪酸,可改善国人因传统饮食导致的ω-6与ω-3脂肪酸比例失衡问题。同时α-亚麻酸作为前体物质,在体内可合成二十碳五烯酸(eicosapentaenoic acid, EPA)和二十二碳六烯酸(docosahexaenoic acid, DHA),具有提高记忆力[9]、降血脂[10]、抗氧化[11]、抗炎[12]、抗癌[13]、抗抑郁[14]以及增强认知、防止精神衰退等功效[15]。目前关于紫苏籽油的功效研究主要集中在降脂抗炎方面,对体内抗氧化的功能评价研究较少。自由基增多是人体衰老的重要因素之一,超氧化物歧化酶(superoxide dismutase, SOD)可清除过量的自由基。还原性谷胱甘肽(glutathione, GSH)是体内的重要抗氧化物质,可拮抗氧自由基损伤[16]。研究表明,紫苏籽油可提高机体中SOD和GSH含量、降低丙二醛(malondialdehyde, MDA)含量,从而起到抗氧化延缓衰老的功效[17],抗氧化功效受到越来越多人关注,但系统研究体内抗氧化作用及菌群变化的研究甚少。因此,本研究以富含ω-3脂肪酸的紫苏籽油为研究对象,通过探究其对小鼠肠道微生物、生长性能以及抗氧化能力的影响,为紫苏籽油在功能性食品领域的应用提供更多的理论依据。
1 材料与方法
1.1 材料与设备
紫苏籽油(脂肪含量100%,含68.5% α-亚麻酸),桦南农盛园食品有限公司,4 ℃低温保存。
丙二醛测试盒、超氧化物歧化酶测定试剂盒、微量还原型谷胱甘肽测试盒、BCA法蛋白定量测试盒、蛋白质羰基(protein carbonyl, PCO)含量测试盒,南京森贝伽生物科技有限公司。
BS420全自动生化分析仪,深圳迈瑞医疗器械公司;1510全波长酶标仪,美国赛默飞世尔科技公司。
1.2 实验动物
SPF级健康雄性KM小鼠(18~22 g),由斯贝福(苏州)生物技术有限公司提供(许可证号为SCXK(京)2022-0006),动物质量合格证编号:2022255971。
1.3 试验设计
将50只小鼠随机分为5组,即空白组(BL)、模型组(M)、紫苏油低(ZS-L)、中(ZS-M)、高(ZS-H)3个剂量组,每组10只。其中BL和M组每天灌胃蒸馏水,低、中、高剂量组每天灌胃10 mL/kg BW(body weight)紫苏籽油水混悬液,分别含1.25、2.5、5 mL紫苏籽油,试验周期为30 d。饲养期间小鼠自由采食和饮水。
1.4 模型构建
参照食药监保化[2012]107号附件1抗氧化功能评价方法,一次性灌胃给予50%乙醇12 mL/kg BW构建乙醇氧化损伤模型,乙醇大量摄入,激活氧分子产生自由基,导致组织细胞过氧化效应及体内GSH耗竭。通过测定脂质氧化产物、蛋白质羰基、抗氧化酶活力以及还原性谷胱甘肽的含量,与空白组相比,脂质氧化产物显著升高、蛋白质羰基显著升高、抗氧化酶活力显著降低以及还原性谷胱甘肽显著降低则说明模型构建成功。
1.5 样品采集
末次灌胃后,灌胃50%乙醇前,采集BL、ZS-L、ZS-M、ZS-H 4组小鼠粪便于灭菌离心管中,经液氮速冻后于-80 ℃冰箱存放以备小鼠肠道菌群测序。
末次灌胃后禁食16 h(过夜),除BL组外,其余4组一次性灌胃给予50%乙醇12 mL/kg BW,6 h后眼眶采血,静置30 min后离心(3 000 r/min,15 min),血清备测。
1.6 指标测定与方法
1.6.1 小鼠粪便肠道菌群检测
收集的小鼠粪便采用16S rDNA高通量测序的方法分析小鼠粪便重的细菌组成。测序完成后,优化序列信息统计,以97%相似度为阈值进行OTU聚类,以Silva为比对数据库进行数据处理与分析。通过ACE指数、Chao指数、Shannon指数、Simpson指数以及Coverage指数分析表示菌群α多样性;通过PCoA分析以及偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA)分析表示β多样性。通过Wilcox秩和检验分析物种差异。
1.6.2 小鼠生长性能指标测定
每周称量小鼠体重和饲料的消耗量,计算平均日增重、平均日采食量、料体比,如公式(1)~公式(3)所示。
平均日增重=(第(N+1)周体重-第N周体重)/7
(1)
平均日采食量=(第N周饲料重量-第(N+1)周饲料重量)/7/5
(2)
料体比=平均日采食量/平均日增重
(3)
1.6.3 小鼠器官指数测定
称量小鼠心脏、肝脏、肾脏、脾脏质量与体重计算各脏器指数,如公式(4)所示:
脏器指数![]()
(4)
1.6.4 小鼠血清抗氧化指标测定
用试剂盒法测定小鼠血清中脂质氧化产物MDA、PCO、GSH含量和SOD活力。
1.7 数据统计与分析
数据采用平均值±标准差进行表示,试验数据结果用SPSS23.0软件进行单因素方法分析,P<0.05表示为具有显著性差异。
2 结果与分析
2.1 紫苏籽油对小鼠肠道菌群的影响
2.1.1 紫苏籽油对肠道菌群α-多样性的影响
α多样性主要关注局域均匀生境下的物种数目,有多个度量指数,可通过一系列的α指数分析群落物种的丰富度和多样性。由表1可知,从测序深度上看,各组的Coverage指数均高于0.99,说明测序深度基本足够。相比空白组,高剂量组小鼠肠道菌群的ACE指数显著升高(P<0.05),Coverage指数显著降低(P<0.05),其余指数均无显著差异(P>0.05)。由此可知,通过紫苏籽油的干预,小鼠肠道菌群的物种总数显著增加,而物种的多样性并没有显著变化。
表1 小鼠肠道菌群的Alpha多样性指数
Table 1 Alpha-diversity indexes of gut microbiotas in mice
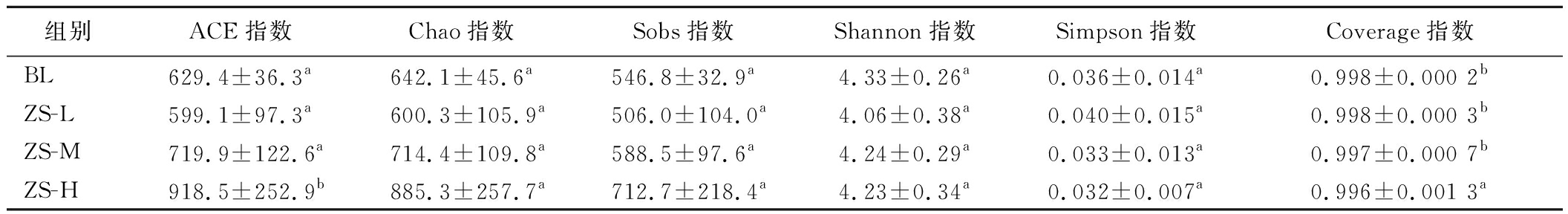
组别ACE指数Chao指数Sobs指数Shannon指数Simpson指数Coverage指数BL629.4±36.3a642.1±45.6a546.8±32.9a4.33±0.26a0.036±0.014a0.998±0.000 2bZS-L599.1±97.3a600.3±105.9a506.0±104.0a4.06±0.38a0.040±0.015a0.998±0.000 3bZS-M719.9±122.6a714.4±109.8a588.5±97.6a4.24±0.29a0.033±0.013a0.997±0.000 7bZS-H918.5±252.9b885.3±257.7a712.7±218.4a4.23±0.34a0.032±0.007a0.996±0.001 3a
注:数据表示为means±SD,同列不同小写字母表示显著差异(P<0.05)(下同)。
由图1-A可知,相比空白组,在门水平上,共聚类得到33个门,空白组、紫苏籽油低、中、高剂量组分别聚类获得11、13、25、32个门,4组样本共有11个门,分别独有0、0、1、7个门。由图1-B可知,在属水平上,共聚类得到471个物种,空白组、紫苏籽油低、中、高剂量组分别聚类获得163、153、284、442个属,4组样本共有132个属,分别独有11、3、8、159个属。由此可知,经过紫苏籽油干预的小鼠,尤其是中、高剂量组小鼠肠道菌群的物种数明显增加,且剂量越高,物种越丰富。
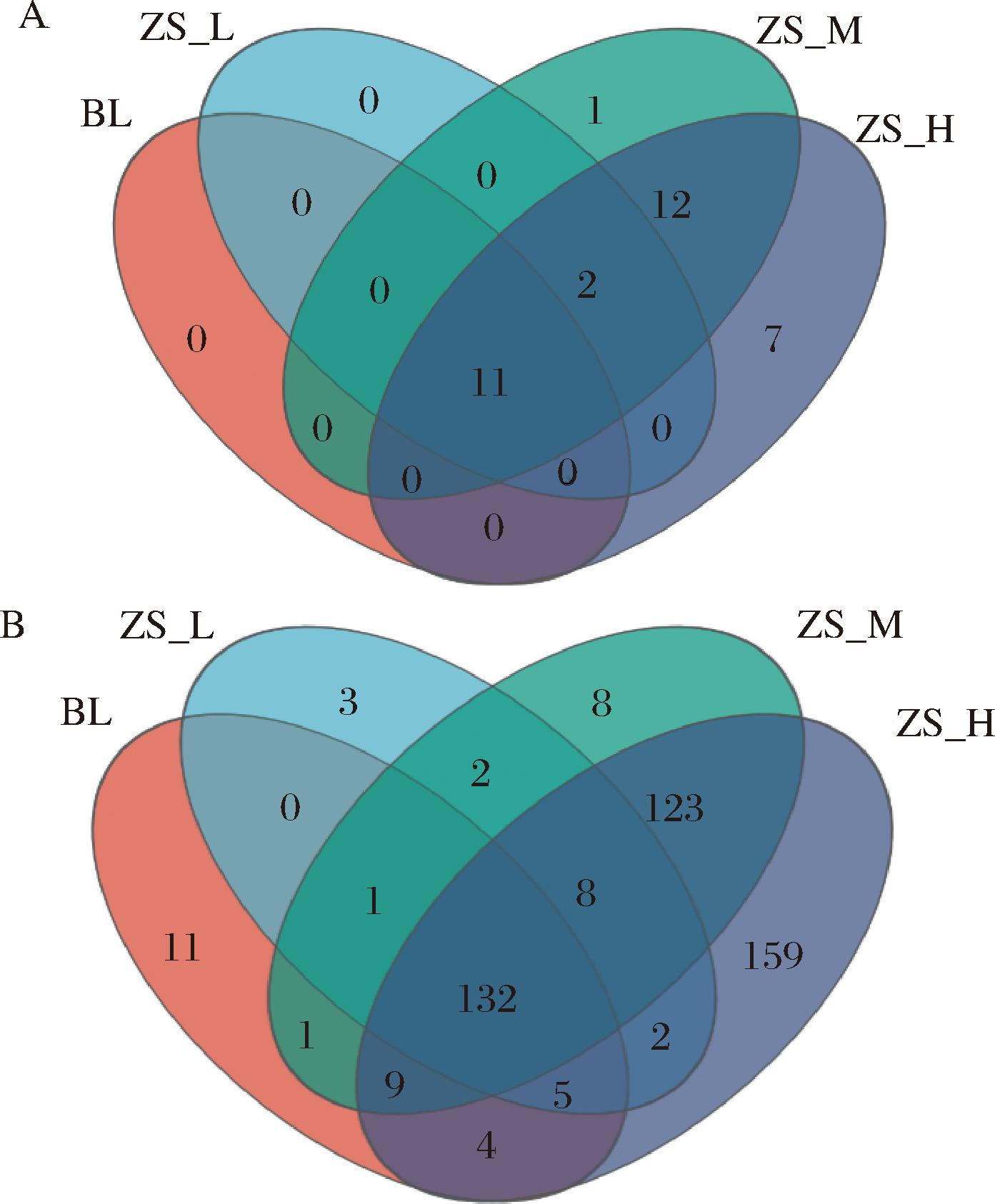
A-门水平venn图;B-属水平venn图
图1 小鼠肠道菌群组成venn图
Fig.1 Venn diagram of gut microbiotas in mice
2.1.2 紫苏籽油对小鼠肠道菌群β-多样性的影响
由图2-A和图2-B可知,经过紫苏籽油干预,小鼠肠道菌群主要向PC1正坐标方向偏移,且随着剂量的增加,偏移的距离增加。由此说明,紫苏籽油会使小鼠肠道菌群结构发生变化,且有一定的剂量效应。由图2-C可知,各组均能较好聚集在一起,且紫苏籽油干预组与空白组能明显分开,不同剂量紫苏籽油干预组有不同程度的交叉。相比空白组,低中剂量组肠道菌群向第2主成分正坐标偏移,随着剂量的增加,高剂量开始向第1主成分正坐标偏移。由此说明,经过紫苏籽油干预后的小鼠肠道菌群物种发生明显变化,而因紫苏籽油灌胃剂量的不同,肠道菌群发生不同程度的变化,当剂量达到5 mL/kg时,肠道菌群的组成结构变化最大,这与PCoA的分析结果一致。
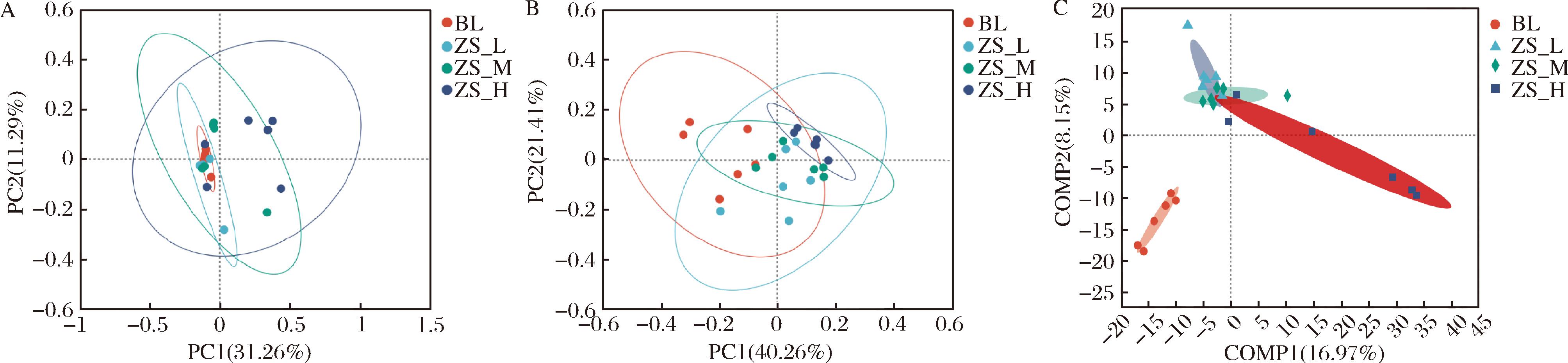
A-PCoA分析(unweighted unifrac);B-PCoA分析(weighted unifrac);C-PLS-DA分析
图2 小鼠肠道菌群的Beta多样性分析
Fig.2 Beta-diversity indexes of gut microbiotas in mice
2.1.3 紫苏籽油对小鼠肠道菌群物种丰度构成及差异分析
由图3-A可知,在门水平上,小鼠肠道菌群主要由拟杆菌门(Bacteroidota)和厚壁菌门(Firmicutes)构成,另外还有弯曲菌门(Campilobacterota)、脱硫杆菌门(Desulfobacterota)、髌骨细菌门(Patescibacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)等。相比空白组,菌群中的拟杆菌门(Bacteroidota)丰度随着剂量的增加而增加,厚壁菌门(Firmicutes)丰度随着剂量的增加而减少,弯曲菌门(Campilobacterota)显著减少。
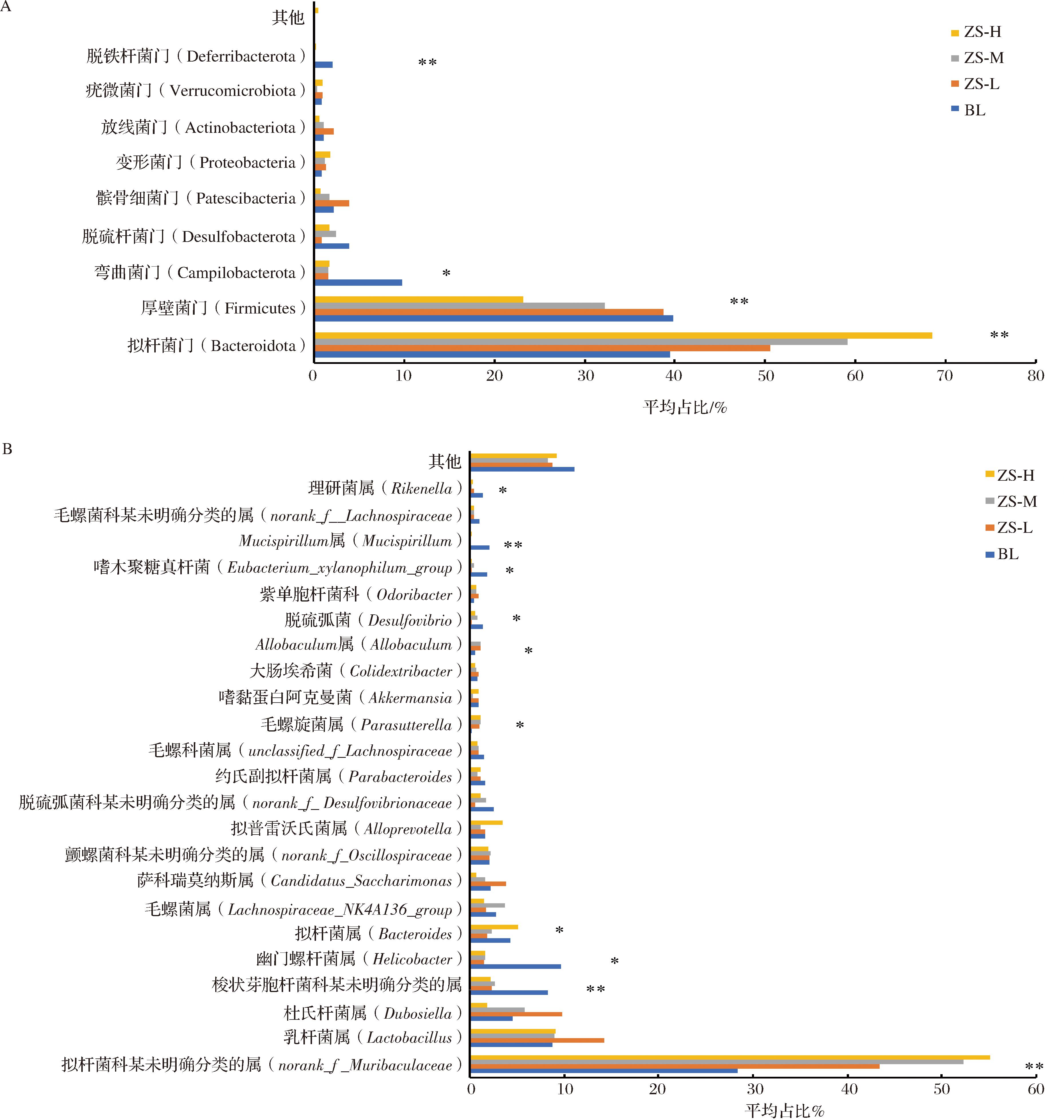
A-门水平物种丰度构成及差异性;B-属水平物种丰度构成及差异性
图3 小鼠肠道菌群的物种构成及差异分析
Fig.3 Beta-diversity indexes of gut microbiotas in mice
由图3-B可知,在属水平上,小鼠肠道菌群的重要组成部分为拟杆菌科某未明确分类的属(norank_f__Muribaculaceae),其丰度占比25%~50%、其次为乳杆菌属(Lactobacillus)、杜氏杆菌属(Dubosiella)、梭状芽胞杆菌科某未明确分类的属(norank_f_norank_o_Clostridia_UCG-014)、幽门螺杆菌属(Helicobacter)以及拟杆菌属(Bacteroides)等。相比空白组,经过紫苏籽油干预后的小鼠肠道,拟杆菌科某未明确分类的属(norank_f_Muribaculaceae)、约氏副拟杆菌属(Parasutterella)丰度显著升高,梭状芽胞杆菌科某未明确分类的属(norank_f_norank_o_Clostridia_UCG-014)、幽门螺杆菌属(Helicobacter)以及脱硫弧菌(Desulfovibrio)显著降低。
2.2 紫苏籽油对小鼠抗氧化能力的影响
2.2.1 紫苏籽油对小鼠生长性能的影响
由表2可知,与空白组相比,各组小鼠初始体重无显著差异,灌胃5 mL/kg BW紫苏籽油,小鼠第1周和第4周的体重显著降低。
表2 各组小鼠体重变化 单位:g
Table 2 The body weight in mice
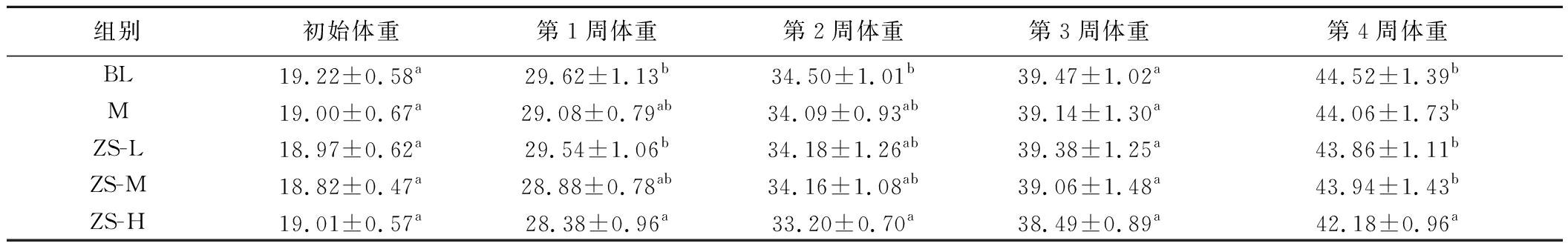
组别初始体重第1周体重第2周体重第3周体重第4周体重BL19.22±0.58a29.62±1.13b34.50±1.01b39.47±1.02a44.52±1.39bM19.00±0.67a29.08±0.79ab34.09±0.93ab39.14±1.30a44.06±1.73bZS-L18.97±0.62a29.54±1.06b34.18±1.26ab39.38±1.25a43.86±1.11bZS-M18.82±0.47a28.88±0.78ab34.16±1.08ab39.06±1.48a43.94±1.43bZS-H19.01±0.57a28.38±0.96a33.20±0.70a38.49±0.89a42.18±0.96a
由表3可知,与空白组相比,灌胃2.5 mL/kg BW紫苏籽油的小鼠,第2周的平均采食量显著增加,第1周、第4周的平均日增重显著降低。紫苏籽油干预组第2周、第4周的料体比增高。
表3 小鼠平均日增重、平均日采食量、平均料体比
Table 3 The average daily gain, daily feed intake, body weight of mice, ratio of feed and body weight in mice

组别平均日采食量/[g/(只·d)]平均日增重/[g/(只·d)]料体比第1周第2周第3周第4周第1周第2周第3周第4周第1周第2周第3周第4周BL4.12±0.08a3.28±0.01a3.70±0.10a3.93±0.06ab1.49±0.11b0.70±0.08ab0.71±0.08a0.72±0.11b2.764.695.215.46M3.93±0.05a3.57±0.25ab3.74±0.04a3.39±0.16a1.44±0.12ab0.72±0.07ab0.72±0.10a0.70±0.10b2.734.965.194.84ZS-L3.87±0.46a3.87±0.20ab3.64±0.59a3.54±0.54ab1.51±0.13b0.66±0.05a0.74±0.10a0.64±0.08b2.565.864.925.53ZS-M4.19±0.04a4.05±0.33b3.70±0.22a4.18±0.12b1.44±0.08ab0.75±0.09b0.70±0.08a0.70±0.09b2.915.405.285.97ZS-H4.08±0.06a3.53±0.24ab3.48±0.36a3.60±0.22ab1.34±0.12a0.70±0.14ab0.76±0.10a0.53±0.10a3.045.044.586.79
2.2.2 紫苏籽油对小鼠脏体比的影响
由表4可知,相比空白组,仅高剂量组小鼠心脏及肾脏的脏体比显著增加(P<0.05)。
表4 小鼠的脏体比 单位:%
Table 4 The visceral-body ratio in mice
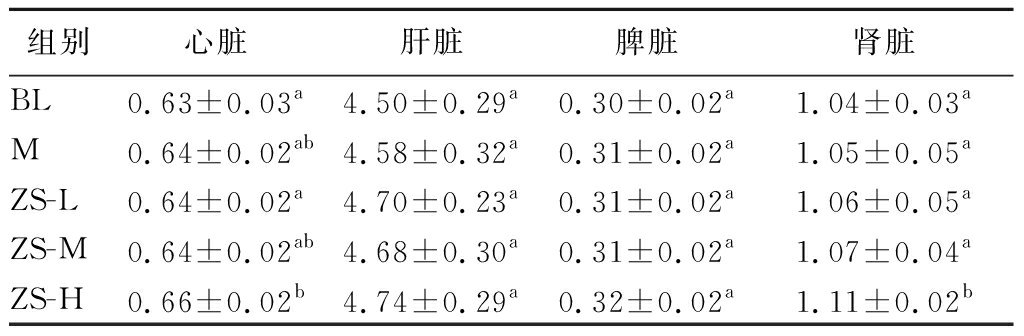
组别心脏肝脏脾脏肾脏BL0.63±0.03a4.50±0.29a0.30±0.02a1.04±0.03aM0.64±0.02ab4.58±0.32a0.31±0.02a1.05±0.05aZS-L0.64±0.02a4.70±0.23a0.31±0.02a1.06±0.05aZS-M0.64±0.02ab4.68±0.30a0.31±0.02a1.07±0.04aZS-H0.66±0.02b4.74±0.29a0.32±0.02a1.11±0.02b
2.2.3 紫苏籽油对小鼠抗氧化指标的影响
由表5可知,相比空白组,模型组血清中的MDA和PCO含量显著升高(P<0.05),GSH和SOD含量显著降低(P<0.05),模型成立。相比模型组,紫苏籽油低、中、高剂量组PCO、MDA含量显著降低(P<0.05),中、高剂量组SOD含量可显著升高(P<0.05),仅高剂量组GSH含量显著升高(P<0.05)。根据抗氧化评价方法,可判定紫苏籽油具有抗氧化功能。
表5 小鼠血清中MDA、PCO、GSH和SOD的浓度
Table 5 The contents of MDA, PCO, GSH, and SOD in mice′ serum
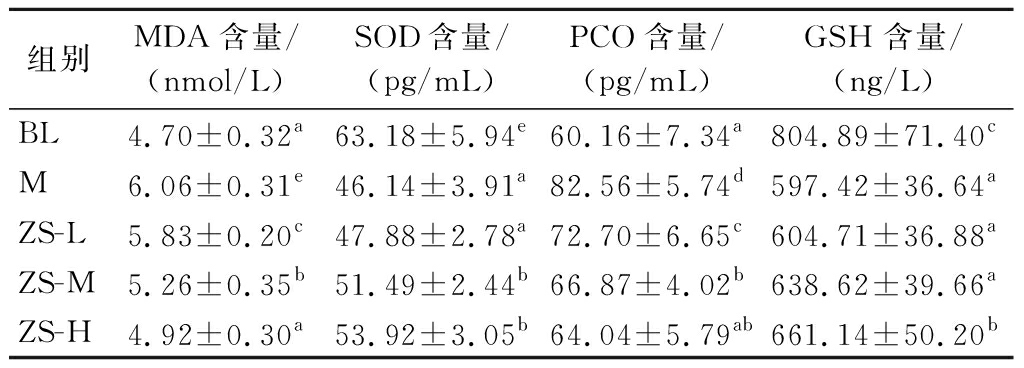
组别MDA含量/(nmol/L)SOD含量/(pg/mL)PCO含量/(pg/mL)GSH含量/(ng/L)BL4.70±0.32a63.18±5.94e60.16±7.34a804.89±71.40cM6.06±0.31e46.14±3.91a82.56±5.74d597.42±36.64aZS-L5.83±0.20c47.88±2.78a72.70±6.65c604.71±36.88aZS-M5.26±0.35b51.49±2.44b66.87±4.02b638.62±39.66aZS-H4.92±0.30a53.92±3.05b64.04±5.79ab661.14±50.20b
3 讨论
3.1 紫苏籽油对小鼠肠道微生物的影响
肠道菌群是一个复杂生态系统,与宿主互利共生。本研究发现小鼠经过紫苏籽油的干预,肠道微生物发现显著变化,厚壁菌门与拟杆菌门比率(F/B)显著降低,拟杆菌科未明确分类的属(norank_f_Muribaculaceae)以及毛螺旋菌(Parasutterella)显著增加,脱硫弧菌显著降低。菌群结构类型多样,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)为优势菌群[18]。有研究表明拟杆菌门和厚壁菌门在肥胖中起着关键作用,F/B越高越容易引起肥胖[19]。王睿等[20]在研究黄芩素对肠道影响的报道中发现拟杆菌科未明确分类的属可以减轻炎症,抑制有害菌和氧化应激,并改善肠黏膜炎症。毛螺旋菌属是人和老鼠肠道菌群的核心成员,研究表明低脂饮食小鼠中的毛螺旋菌属显著高于肥胖模型小鼠[21-22]。WANG等[23]发现脱硫弧菌(Desulfovibrio)通常与肥胖相关,高脂饮食可导致脱硫弧菌增多。冯涵[24]研究发现紫苏油可缓解小鼠因高脂饮食引起的肠道紊乱。WANG等[25]在其研究中指出紫苏油干预可使糖尿病模型小鼠中脱硫弧菌显著降低。TIAN等[26]在其研究中指出SD大鼠经紫苏油干预后拟杆菌门显著增多,厚壁菌门显著减少。刘树兴等[27]通过体外培养发现紫苏籽油对嗜酸乳杆菌、双歧杆菌等益生菌具有增值作用。KAWAMURA等[28]研究发现富含ω-3脂肪酸的紫苏油可显著减少变形菌。本研究结果与上述研究报道基本一致,且提示紫苏籽油所引起的肠道变化可能具有减肥、抗氧化应激的功能。
3.2 紫苏籽油对小鼠抗氧化能力的影响
抗氧化能力一直受到研究者的关注,氧化应激反映了机体抗氧化和氧化之间的失衡,是多种慢性疾病的诱因[29]。众多研究表明细胞的氧化应激反应与高血压[30]、高血脂[31]、炎症[32-33]等疾病有着密切关系。本研究发现紫苏籽油可降低乙醇氧化损伤小鼠的MDA和PCO含量,升高GSH含量和SOD活性。MDA是机体内脂质过氧化作用分解所产生的,其浓度与细胞膜受损程度呈正相关[34];机体内氧化剂含量升高会加速蛋白质羰基化,使细胞遭受自由基的破坏,体内PCO含量越高,表明机体抗氧化能力越弱[35]。GSH和SOD可以清除体内过氧化氢和脂质过氧化物,具有抗氧化作用,机体可以通过提高这类抗氧化物酶活力来强化机体清除自由基的能力[16]。CASTELLANI等[32]研究发现高脂饮食可引起MDA升高,经过500 mg/kg BW紫苏籽油干预12周可显著降低MDA含量。IDE等[36]研究发现紫苏籽油可显著降低小鼠血清中的MDA含量并提高血清中谷胱甘肽还原酶的活性。张扬等[37]发现紫苏油可通过降低肝脏内的MDA、PCO含量,提高GSH含量和SOD活力发挥抗氧化作用。ALDAMARANY等[38]研究发现2 g/kg BW紫苏籽油可显著降低高脂饮食体重,显著降低MDA含量且升高SOD活性。本研究结果与上述研究基本一致,紫苏籽油富含ω-3脂肪酸,经过一段时间的干预可降低体内的脂质氧化产物,升高抗氧化酶活性及抗氧化物质含量,从而抵抗因过量乙醇引起的氧化应激。
4 结论
小鼠经紫苏籽油干预30 d,菌群物种明显增多且菌群构成明显改变,提示紫苏籽油具有减肥、抗氧化应激的作用。建立乙醇氧化损伤模型对紫苏籽油的抗氧化能力进行功能验证,发现紫苏籽油具有抗氧化功能,且高剂量组小鼠体重显著降低。本研究结果为紫苏籽油的功能性研究提供了更多数据支撑和理论依据。
[1] B UMLER A J, SPERANDIO V.Interactions between the microbiota and pathogenic bacteria in the gut[J].Nature, 2016, 535(7610):85-93.
UMLER A J, SPERANDIO V.Interactions between the microbiota and pathogenic bacteria in the gut[J].Nature, 2016, 535(7610):85-93.
[2] ISOLAURI E, SALMINEN S, OUWEHAND A C.Probiotics[J].Best Practice &Research Clinical Gastroenterology, 2004, 18(2):299-313.
[3] SHEN W, GASKINS H R, MCINTOSH M K.Influence of dietary fat on intestinal microbes, inflammation, barrier function and metabolic outcomes[J].The Journal of Nutritional Biochemistry, 2014, 25(3):270-280.
[4] MATSUNAGA H, HOKARI R, KURIHARA C, et al.Omega-3 polyunsaturated fatty acids ameliorate the severity of ileitis in the senescence accelerated mice (SAM) P1/Yit mice model[J].Clinical &Experimental Immunology, 2009, 158(3):325-333.
[5] NORIEGA B S, SANCHEZ-GONZALEZ M A, SALYAKINA D, et al.Understanding the impact of omega-3 rich diet on the gut microbiota[J].Case Reports in Medicine, 2016, 2016:3089303.
[6] MYLES I A, PINCUS N B, FONTECILLA N M, et al.Effects of parental omega-3 fatty acid intake on offspring microbiome and immunity[J].PLoS One, 2014, 9(1):e87181.
[7] YANG R N, ZHANG L X, LI P W, et al.A review of chemical composition and nutritional properties of minor vegetable oils in China[J].Trends in Food Science &Technology, 2018, 74:26-32.
[8] ZAMANI GHALESHAHI A, EZZATPANAH H, RAJABZADEH G, et al.Comparison and analysis characteristics of flax, Perilla and basil seed oils cultivated in Iran[J].Journal of Food Science and Technology, 2020, 57(4):1258-1268.
[9] WANG L M, SUN X Y, YE S J, et al.Molecular mechanism of polyunsaturated fatty acids improving spatial learning and memory in developmental rat[J].Food Science and Technology, 2022, 42(7):1-8.
[10] ZHANG T, ZHAO S, LI W, et al.High-fat diet from Perilla oil induces insulin resistance despite lower serum lipids and increases hepatic fatty acid oxidation in rats[J].Lipids in Health &Disease, 2014, 13(1):15.
[11] 王丽梅, 叶诚, 吴晨, 等.紫苏油对衰老模型大鼠的抗衰老作用研究[J].食品科技, 2013, 38(1):280-284.WANG L M, YE C, WU C, et al.The effect of Perilla oil on anti-aging for aging model rats[J].Food Science and Technology, 2013, 38(1):280-284.
[12] SHIMIZU T, KITAMURA T, SUZUKI M, et al.Effects of α-linolenic acid on colonic secretion in rats with experimental colitis[J].Journal of Gastroenterology, 2007, 42(2):129-134.
[13] TRIPATHI C B, PARASHAR P, ARYA M, et al.QbD-based development of alpha-linolenic acid potentiated nanoemulsion for targeted delivery of doxorubicin in DMBA-induced mammary gland carcinoma:In vitro and in vivo evaluation[J].Drug Delivery and Translational Research, 2018, 8(5):1313-1334.
[14] LEE H C, KO H K, T-G HUANG B E, et al.Antidepressant-like effects of Perilla frutescens seed oil during a forced swimming test[J].Food &Function, 2014, 5(5):990-996.
[15] HASHIMOTO M, MATSUZAKI K, KATO S, et al.Twelve-month studies on Perilla oil intake in Japanese adults possible supplement for mental health[J].Foods, 2020, 9(4):530.
[16] BOTTINO F, LUCIGNANI M, NAPOLITANO A, et al.In vivo brain GSH:MRS methods and clinical applications[J].Antioxidants, 2021, 10(9):1407.
[17] LEE A Y, LEE M H, LEE S, et al.Alpha-linolenic acid from Perilla frutescens var.japonica oil protects Aβ-induced cognitive impairment through regulation of APP processing and Aβ degradation[J].Journal of Agricultural and Food Chemistry, 2017, 65(49):10719-10729.
[18] ENGEN P A, GREEN S J, VOIGT R M, et al.The gastrointestinal microbiome:Alcohol effects on the composition of intestinal microbiota[J].Alcohol Research Current Reviews, 2015, 37(2):223-236.
[19] TURNBAUGH P J, B CKHED F, FULTON L, et al.Diet-induced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome[J].Cell Host &Microbe, 2008, 3(4):213-223.
CKHED F, FULTON L, et al.Diet-induced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome[J].Cell Host &Microbe, 2008, 3(4):213-223.
[20] 王睿, 王霖, 魏广义, 等.黄芩素调节肠道菌群并改善小鼠化疗诱导性肠黏膜炎的作用及其机制[J].药学学报, 2020, 55(5):868-876.WANG R, WANG L, WEI G Y, et al.The effect and mechanism of baicalein on regulating gut microbiota and improving chemotherapy-induced intestinal mucositis in mice[J].Acta Pharmaceutica Sinica, 2020, 55(5):868-876.
[21] MU H N, ZHOU Q, YANG R Y, et al.Naringin attenuates high fat diet induced non-alcoholic fatty liver disease and gut bacterial dysbiosis in mice[J].Frontiers in Microbiology, 2020, 11:585066.
[22] JENSEN B A H, HOLM J B, LARSEN I S, et al.Lysates of Methylococcus capsulatus bath induce a lean-like microbiota, intestinal FoxP3+RORγt+IL-17+ Tregs and improve metabolism[J].Nature Communications, 2021, 12(1):1093.
[23] WANG M, XU W X, YU J, et al.Astaxanthin from Haematococcus pluvialis prevents high-fat diet-induced hepatic steatosis and oxidative stress in mice by gut-liver axis modulating properties[J].Frontiers in Nutrition, 2022, 9:840648.
[24] 冯涵. 紫苏油与虾青素联合作用调节高脂小鼠脂代谢与肠道菌群的研究[D].武汉:武汉轻工大学, 2018.FENG H.The study on the effect of Perilla oil and astaxanthin regulate lipid metabolism and gut microbiota in high-fat mice[D].Wuhan:Wuhan Polytechnic University, 2018.
[25] WANG F, ZHU H J, HU M Y, et al.Perilla oil supplementation improves hypertriglyceridemia and gut dysbiosis in diabetic KKAy mice[J].Molecular Nutrition &Food Research, 2018, 62(24):e1800299.
[26] TIAN G Y, WANG H L, YUAN F H, et al.Perilla oil has similar protective effects of fish oil on high-fat diet-induced nonalcoholic fatty liver disease and gut dysbiosis[J].Biomed Research International, 2016, 2016:9462571.
[27] 刘树兴, 闫莉斐, 陈蕊, 等.紫苏油对益生菌的增殖作用研究[J].中国油脂, 2018, 43(1):61-63.LIU S X, YAN L F, CHEN R, et al.Effects of Perilla oil on proliferation of probiotics[J].China Oils and Fats, 2018, 43(1):61-63.
[28] KAWAMURA A, NEMOTO K, SUGITA M.Effect of 8-week intake of the n-3 fatty acid-rich Perilla oil on the gut function and as a fuel source for female athletes:A randomised trial[J].British Journal of Nutrition, 2022, 129(6):1-11.
[29] FIALKOW L, WANG Y C, DOWNEY G P, Reactive oxygen and nitrogen species as signaling molecules regulating neutrophil function[J].Free Radical Biology and Medicine, 2007, 42(2):153-164.
[30] GRIENDLING K K, CAMARGO L L, RIOS F J, et al.Oxidative stress and hypertension[J].Circulation Research, 2021, 128(7):993-1020.
[31] KANGWAN N, PRATCHAYASAKUL W, KONGKAEW A, et al.Perilla seed oil alleviates gut dysbiosis, intestinal inflammation and metabolic disturbance in obese-insulin-resistant rats[J].Nutrients, 2021, 13(9):3141.
[32] CASTELLANI P, BALZA E, RUBARTELLI A.Inflammation, DAMPs, tumor development, and progression:A vicious circle orchestrated by redox signaling[J].Antioxidants &Redox Signaling, 2014, 20(7):1086-1097.
[33] ANDERSON M T, STAAL F J, GITLER C, et al.Separation of oxidant-initiated and redox-regulated steps in the NF-kappa B signal transduction pathway[J].Proceedings of the National Academy of Sciences, 1994, 91(24):11527-11531.
[34] TSIKAS D.Assessment of lipid peroxidation by measuring mailondialdehyde (MDA) and relatives in biological samples:Analytical and biological challenges[J].Analytical Biochemistry, 2017, 524:13-30.
[35] WEBER D, DAVIES M J, GRUNE T.Determination of protein carbonyls in plasma, cell extracts, tissue homogenates, isolated proteins:Focus on sample preparation and derivatization conditions[J].Redox Biology, 2015, 5:367-380.
[36] IDE T, TANAKA A, α-Lipoic acid ameliorated oxidative stress induced by Perilla oil, but the combination of these dietary factors was ineffective to cause marked deceases in serum lipid levels in rats[J].Nutrition Research, 2017, 48:49-64.
[37] 张扬, 孙和平, 刘卓, 等.紫苏油在乙醇诱导氧化损伤模型小鼠体内的抗氧化作用[J].食品科学, 2015, 36(23):279-282. ZHANG Y, SUN H P, LIU Z, et al.Antioxidant effect of Perilla oil on ethanol-induced oxidative stress in mice[J].Food Science, 2015, 36(23):279-282.
[38] ALDAMARANY W A S, HUANG T C, DENG L L, et al.Perilla, sunflower, and tea seed oils as potential dietary supplements with anti-obesity effects by modulating the gut microbiota composition in mice fed a high-fat diet[J].European Journal of Nutrition, 2023, 62(6):2509-2525.