豆腐制品因营养高、风味好而受到人们的欢迎。传统豆腐是由豆浆和凝固剂凝固而成的凝胶制品,制备过程复杂,通常需要将大豆用水浸泡、研磨、过滤制豆浆、煮沸、凝固、破凝,最后压成凝胶。但是豆浆中含有一定量的脂质、大豆低聚糖、异黄酮和胰蛋白酶抑制,剂是大豆异味、过敏反应和胀气的来源。因此使用大豆分离蛋白(soybean protein isolate, SPI)作为豆腐原料,被认为对人体健康更有益,并且制备过程简单、清洁、易于控制[1]。谷氨酰胺转氨酶(transglutaminase),简称TGase或TG酶,可催化蛋白质或多肽中谷氨酰胺残基与赖氨酸形成ε-(γ-谷氨酰胺)赖氨酸共价键,其反应条件温和,易于控制,常被用于交联豆腐凝胶。但是,用TG酶制备豆腐凝胶需要一定的交联作用位点才能形成凝胶,这比使用传统盐水凝固剂制成的豆腐略软[2]。因此LI等[3]在研究木瓜蛋白酶预处理水解对TG酶交联豆腐凝胶特性的影响时发现,使用木瓜蛋白酶处理后制备而成的豆腐凝胶的凝胶强度、保水能力均大于未预处理的豆腐凝胶。此外为满足生产需求,可采用复合凝固剂制备豆腐凝胶。ZHU等[4]研究发现,TG酶与盐水和葡萄糖酸-δ-内酯联合使用比使用单一凝固剂制备的豆腐相比,其弹性和咀嚼性有所改善,微观网状结构更细,孔隙更小,孔隙率更低。
魔芋葡甘露聚糖(konjac glucomannan,KGM)是一种亲水性极强的中性多糖,具有良好的保水性、增稠性、凝胶性和乳化性,可以通过填充支撑作用而稳定蛋白凝胶的网络结构,同时能与蛋白质产生相互作用,有效增强凝胶强度和持水能力[5]。KGM的凝胶性能优于其他生物大分子,其分子链的柔性结构使得其可以任意伸展、卷曲,因而可以与其他胶体发生偶合,协同增效高聚物的内部结构[6]。罗华彬等[7]研究了不同亲水胶体对带鱼鱼糜品质的影响,得出相比于瓜尔胶、沙嵩胶,魔芋胶最能改善鱼糜凝胶的凝胶强度、质构特性。除分子质量大小外,KGM的凝胶特性和增稠特性与其分子骨架上的乙酰基团密切相关,KGM凝胶的临界浓度和时间会随着乙酰基的量减少而降低[8]。ZHANG等[9]发现添加脱乙酰魔芋葡甘露聚糖(deacetylated konjac glucomannan,DKGM)可以有效缓解蛋白质在120 ℃高温处理过程中的蛋白质变性,对凝胶强度有积极的影响。ZHANG等[10]将KGM和NaHCO3加入植物性猪皮凝胶中使凝胶结构更稳定。RAN等[11]研究了KGM促进大豆蛋白-魔芋葡甘露聚糖复合物凝胶的应变硬化和结晶度,发现KGM浓度的增加促进蛋白质聚集,复合凝胶相对结晶指数增加,促进了蛋白质网络的构建。但是,目前缺乏有关脱乙酰度对TG酶交联形成的大豆分离蛋白凝胶品质的影响的研究。因此,本研究制备了不同脱乙酰度的DKGM,并探究其对TG酶凝固SPI凝胶及手磨豆干品质的影响。旨在解决手磨豆干生产过程中出现的问题,并为KGM在蛋白质产品的生产应用和推广中提供理论参考。
1 材料与方法
1.1 材料与试剂
纯化魔芋精粉(纯度≥86%),湖北十堰花仙子魔芋制品有限公司;大豆分离蛋白(蛋白质含量≥90%),山东御馨生物科技股份有限公司;大豆油,益海粮油工业有限公司;谷氨酰胺转氨酶,济南青瑞生物科技有限公司;食用盐,湖南盐业股份有限公司。
1.2 仪器与设备
Braun FP3010食品加工机,意大利De Longhi公司;TA-XT plus质构仪,英国Stable Micro Systems公司;Phenom Pro-17A0040型扫描电镜,荷兰Phenom World 公司;DSC4000型差示扫描量热仪,珀金埃尔默公司;DHG-9023A电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;DZ真空包装机,上海凯鸣电子机械有限公司;电蒸汽两用杀菌釜,诸城市万兴机械有限公司;WR-18精密色差仪,深圳市威服光电科技有限公司。
1.3 实验方法
1.3.1 不同脱乙酰度DKGM的制备
参考LI等[12]的方法,略作修改。称取24 g KGM 与720 mL 30%的乙醇溶液(体积分数)混合,在 50 ℃下恒温振荡30 min,之后加入不同体积(12、24、48、72 mL) 0.1 mol/L 的 NaOH 溶液于50 ℃下反应30 min,待脱乙酰基反应完成后,使用梯度体积分数的乙醇溶液(50%、75%、95%、100%)进行脱水,所得产物经真空冷冻干燥得到DKGM。参考XIAO等[13]的方法测定DKGM的脱乙酰度。经测定,4种DKGM脱乙酰度分别为:21.30%、36.28%、62.85%、87.88%,分别命名为DK-1、DK-2、DK-3、DK-4。
1.3.2 SPI-DKGM复合凝胶的制备
将SPI粉和不同脱乙酰度的KGM混合(12.5%, 质量分数)加入冰水及大豆油(10%, 质量分数)中,先低速斩拌至无明显干粉后,再进行高速斩拌(转速>1 000 r/min);斩拌10 min后添加0.1% TG酶至斩拌完全,将样品置于模具中,4 ℃下反应2、4、6、8、10 h,之后在80 ℃条件下水浴40 min,完成后进行冰浴。制得的大豆分离蛋白凝胶分别命名为SPI、SPI-KGM、S-DK1、S-DK2、S-DK3、S-DK4。将凝胶置于4 ℃条件下贮藏,用于后续指标测定。
1.3.3 SPI-DKGM手磨豆干的制备
取1.3.2节中反应8 h的复合凝胶,在80 ℃条件下卤制1 h,卤制后置于90 ℃烘箱中进行烘烤70 min,将烘干后的豆干进行真空包装,在120 ℃,0.21 MPa 条件下灭菌26 min。
1.3.4 SPI-DKGM复合凝胶强度测定
取1.3.2节中制备的不同反应时间的复合凝胶进行凝胶强度测定。使用TA XT plus质构分析仪测定样品的凝胶强度,条件设置如下:探头为P/0.5,测试前、测试中、测试后速率均为1.0 mm/s,压缩比为60%,触发力5 g。
1.3.5 SPI-DKGM复合凝胶白度测定
取1.3.2节制备反应8 h复合凝胶进行白度测定。使用色差仪测定样品的亮度(L*)、红绿度(a*)、黄蓝度(b*)。测定前用标准白板校正仪器。凝胶白度W计算如公式(1)所示:
(1)
1.3.6 SPI-DKGM复合凝胶质构测定
质构测定参照GUO等[14]的方法并进行修改,复合凝胶样品切成1 cm高,底部为2 cm直径的圆柱。使用P36R探头,50 kg称重传感器校准设备。预测试、测试、后测试速度和触发力分别设置为5.0、2.0、2.0 mm/s和3 g。压缩比为50%,起始距离为25 cm,2次下压式间隔时间为5 s。使用随附软件计算硬度、弹性、黏着性和咀嚼性。
1.3.7 SPI-DKGM复合凝胶持水率和蒸煮损失率测定
持水率参照陈凡凡等[15]的方法进行测定。取1.3.2节制备的8 h复合凝胶进行持水性测定,记质量为m1,将其放置于离心管中,5 000 r/min离心15 min,用滤纸沾去复合凝胶的表面水分,称量复合凝胶记质量为m2,然后将复合凝胶置于105 ℃下干燥 8 h,记质量为m3计算如公式(2)所示:
持水率![]()
(2)
蒸煮损失率参照CHANG等[16]的方法进行测定并做修改,取1.3.2节制备的8 h复合凝胶进行蒸煮损失率测定。准确称取10 g凝胶样品,放入沸水中煮8 min后过筛,将过筛后的溶液烘干至恒重并测定质量,复合凝胶蒸煮损失率计算如公式(3)所示:
蒸煮损失率![]()
(3)
式中:m1,凝胶的质量;w,凝胶的水分含量;m2,烘干后凝胶质量。
1.3.8 SPI-DKGM复合凝胶微观结构观察
取1.3.2节制备的8 h复合凝胶进行冷冻干燥,取冻干后的样品在扫描电镜(scanning electron microscope, SEM)下进行观察。
1.3.9 SPI-DKGM复合凝胶热稳定性测试
参考TANG等[17]的方法稍作修改进行差示扫描量热法(differential scanning calorimetry, DSC)测试。取冷冻干燥的样品研磨过80目筛,称取10~20 mg密封于样品盒中,扫描温度10~200 ℃,加热速率为10 ℃/min,氮气流速80 mL/min,测定变性峰的峰温度。
1.3.10 SPI-DKGM手磨豆干质构特性和盐分含量测定
取1.3.3节中烘烤和灭菌后的手磨豆干进行质构特性测定。测定方法参考1.3.6节。盐分含量测定方法参考GB 5009.44—2016《食品中氯化物的测定》。
1.4 数据分析
实验数据均使用Origin 2023软件作图,SPSS 20.0进行显著性分析。本研究中试验至少重复3次,结果以平均值±标准差表示,P<0.05表示有显著性差异。
2 结果与分析
2.1 DKGM对不同反应时间大豆分离蛋白复合凝胶的凝胶强度影响
对1.3.2节中制备的复合凝胶进行凝胶强度测定。结果如图1所示,随着反应时间延长,各组凝胶强度逐渐升高,SPI组凝胶强度从71.64 g增至92.44 g,S-DK3组从103.42 g增至136.79 g。这是由于随着反应时间的增加,参与TG酶交联的SPI增多,导致蛋白质凝胶强度增强。反应8 h后,各组凝胶强度几乎不再改变。同一反应时间内,添加KGM和DKGM组复合凝胶的凝胶强度均显著高于对照组,且随着脱乙酰度的增加,复合凝胶的凝胶强度呈现先增大后减小的趋势。这可能是在高温灭酶过程中,亲水胶体加热形成的凝胶加强了蛋白质分子网络结构。同时较低脱乙酰度DKGM与大豆分离蛋白交联,并作为有效黏合剂,因此复合凝胶强度增强。高脱乙酰度DKGM暴露的基团增加,与大豆分离蛋白残基交联增加,阻碍了SPI分子间或分子内聚合及TG酶在体系中的分散,导致凝胶强度降低[9]。S-DK3组复合凝胶的凝胶强度在同一反应时间内均为最大,添加DK-3形成的复合凝胶的三维网络结构最稳定。因此,4 ℃下TG酶交联SPI形成复合凝胶反应8 h即可反应完成且添加DK-3使得复合凝胶强度达到最大值。
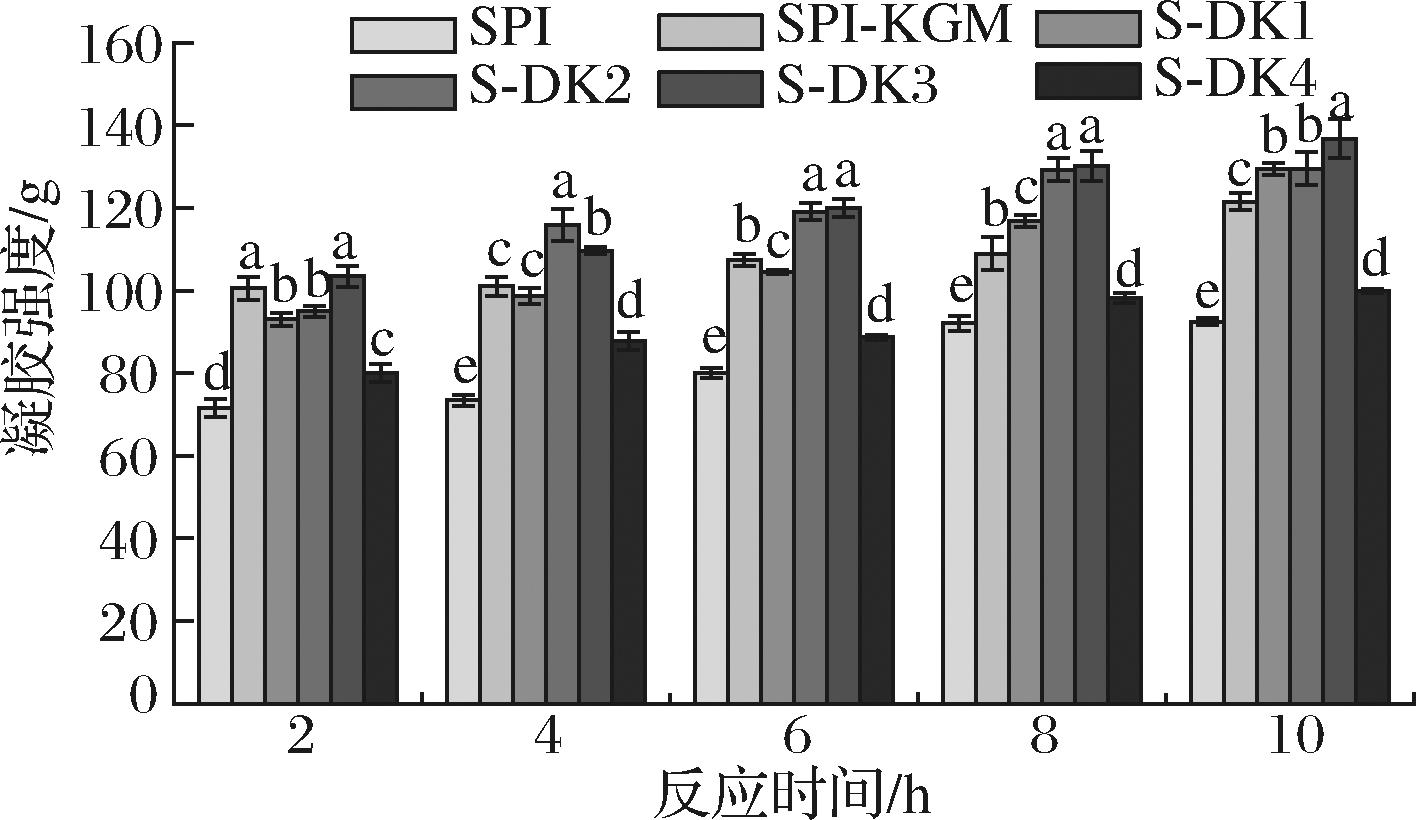
图1 DKGM对不同反应时间大豆分离蛋白复合凝胶的凝胶强度影响
Fig.1 Effect of DKGM on the strength of composite gels of soybean protein isolate with different reaction times.注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 DKGM对大豆分离蛋白复合凝胶表观形态及白度影响
如图2所示,复合凝胶组织状态存在较大差异。SPI组凝胶有孔隙,随着脱乙酰度的增加,孔隙逐渐减少。这些孔隙可能是在斩拌过程中空气被吸入水中造成的。KGM黏度大,亲水性强,具有大量游离羟基,易于水合和溶解,脱乙酰度的增加导致DKGM的溶解性和黏度降低,使得形成的复合物网络结构笼络的空气变少,因此复合凝胶呈现大气孔数量变少。
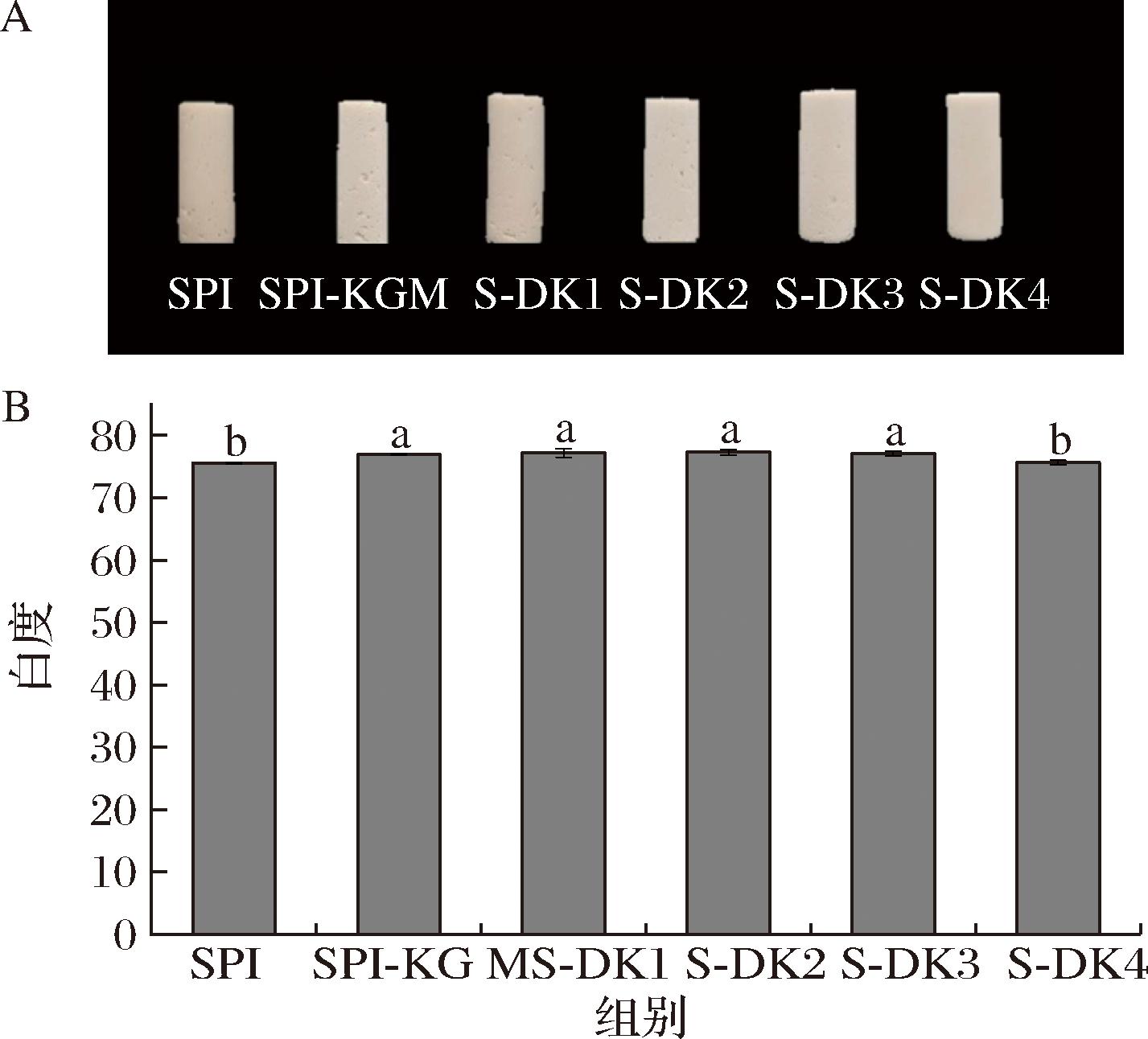
A-表观形态;B-白度
图2 DKGM对大豆分离蛋白复合凝胶表观形态及白度的影响
Fig.2 Effect of DKGM on apparent morphology and whiteness of composite gels of soybean protein isolate
注:不同小写字母表示差异显著(P<0.05)(下同)。
所有凝胶白度均>75,呈现较好的白色。添加KGM与DKGM后,除S-DK4组外,复合凝胶的白度均显著高于SPI组。可能是由于DKGM的适度脱乙酰能够促进凝胶中复合物的相互作用,使得TG酶分散均匀,形成复合凝胶的溶解度和共混能力提高,所形成的聚集体反射或散射大量的光,导致白度增加[18]。
2.3 DKGM对大豆分离蛋白复合凝胶质构特性的影响
质构特性是评价凝胶品质的重要方法之一。硬度为第一次压缩的最大力,弹性表示第二次压缩期间检测到的高度的距离与原始压缩距离的比率[19]。与SPI凝胶相比,加入不同脱乙酰度的KGM后,复合凝胶的硬度、弹性、黏着性和咀嚼性均有不同程度的增强,这与凝胶强度结果趋势一致(图1)。这可能是由于KGM长链多糖可以连接整个蛋白质网络,增强复合凝胶结构[20]。同时加入KGM后蛋白质周围的水分子重排,改变了SPI分子间作用力,进而导致SPI中亲水性氨基酸暴露,为TG酶催化ε-(γ-谷氨酰胺)赖氨酸键的形成提供了有利条件[21]。如表1所示除S-DK4组之外,随着脱乙酰度的增加复合凝胶的硬度逐渐增大。当脱乙酰度增加至62.85%时,复合凝胶的硬度达到最大值1 034.57 g,相比于SPI组提升了66.31%。一方面可能是DKGM脱除乙酰基后,排除了空间位阻效应[22]。同时一些基团与SPI进行部分交联,并作为有效黏合剂在凝胶基质中充当填充剂,进而提高复合凝胶的质构特性[9]。但当脱乙酰程度增高至87.88%时,DKGM有较大的粒径,这使得凝胶网络结构崩解,从而破坏凝胶网络结构的完整性。
表1 DKGM对大豆分离蛋白复合凝胶质构特性的影响
Table 1 Effect of DKGM on the textural characters of composite gels of soybean protein isolate
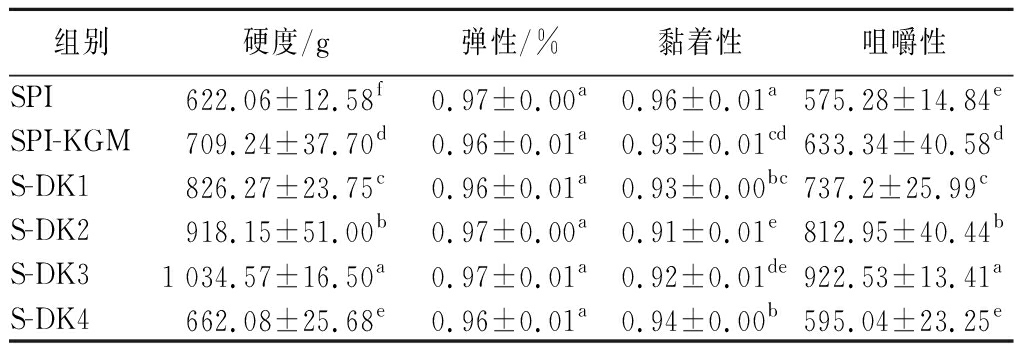
组别硬度/g弹性/%黏着性咀嚼性SPI622.06±12.58f0.97±0.00a0.96±0.01a575.28±14.84eSPI-KGM709.24±37.70d0.96±0.01a0.93±0.01cd633.34±40.58dS-DK1826.27±23.75c0.96±0.01a0.93±0.00bc737.2±25.99cS-DK2918.15±51.00b0.97±0.00a0.91±0.01e812.95±40.44bS-DK31 034.57±16.50a0.97±0.01a0.92±0.01de922.53±13.41aS-DK4662.08±25.68e0.96±0.01a0.94±0.00b595.04±23.25e
注:同列不同小写字母表示差异显著(P<0.05)(下同)。
咀嚼性也表现出类似的趋势。咀嚼性与咀嚼固体食物至可吞咽状态所需的工作有关[23]。随着脱乙酰度的增加,复合凝胶的咀嚼性从575.28增至922.53。SPI-DKGM复合凝胶质构特性结果表明,适宜的脱除程度会促进蛋白质发生更好的交联,使得蛋白质网络稳定性提高,从而提高复合凝胶的凝胶性能。
2.4 DKGM对大豆分离蛋白复合凝胶持水性和蒸煮损失率的影响
凝胶网络结构决定凝胶持水性,这些结构倾向于将水“截留”在蛋白质网络中。如图3所示,与SPI组相比,KGM加入后复合凝胶的持水率由94.12%升至95.51%。随着脱乙酰度的增加,除S-DK4组外,复合凝胶持水性相比于SPI组均显著增强。KGM具有良好的水溶性,结合水能力强,并可阻断蛋白质分子间疏水位点的结合,从而提高持水能力[24]。随着脱乙酰度的增加,DKGM持水力和溶解度逐渐降低[25],蛋白质的疏水性增加,含有部分乙酰基的KGM疏水相互作用较弱,与水结合和增强氢键的能力较好。这与YUAN[8]等研究结果一致。
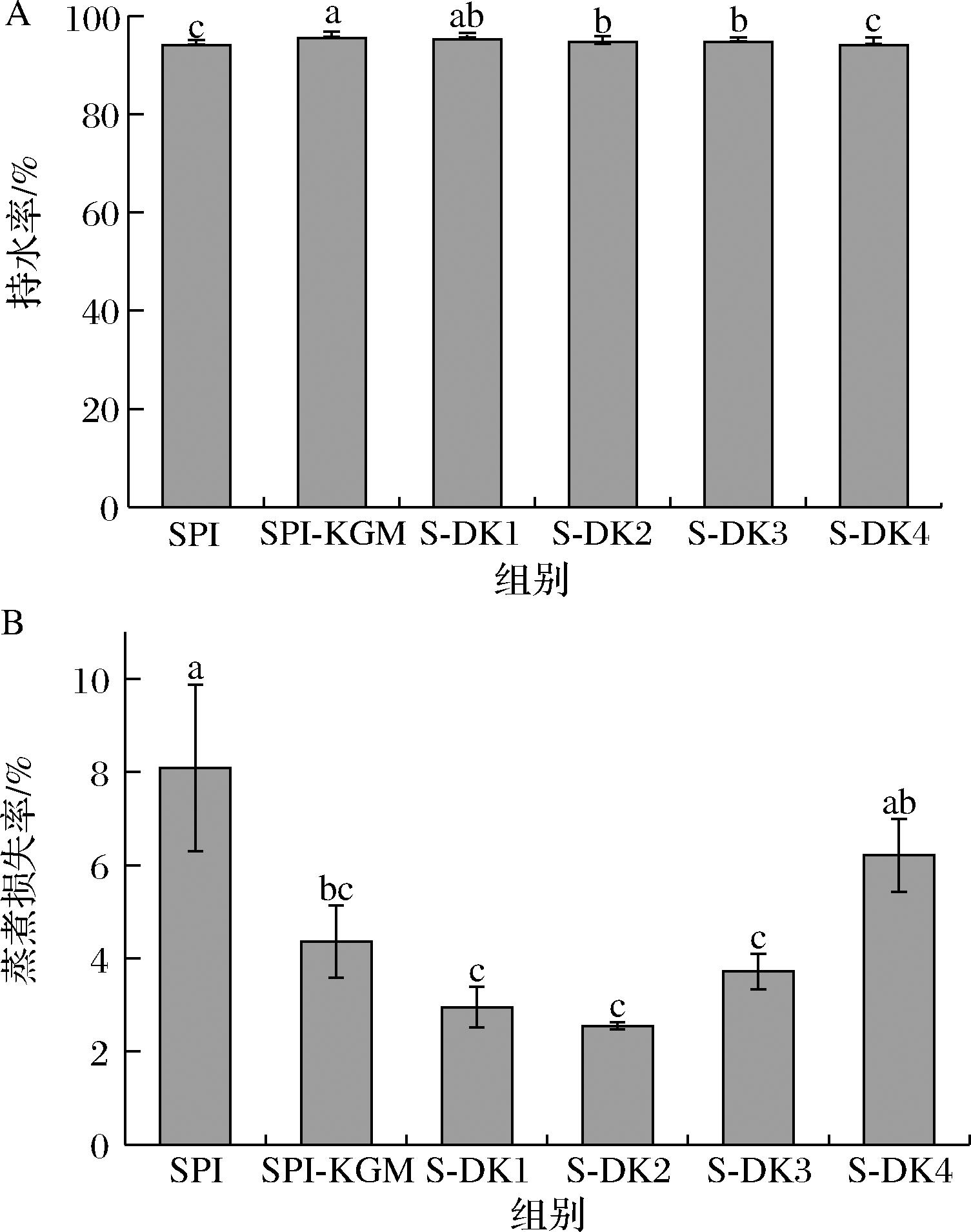
A-持水率;B-蒸煮损失率
图3 DKGM对大豆分离蛋白复合凝胶持水性和蒸煮损失率的影响
Fig.3 Effect of DKGM on the water holding capacity and cooking loss of composite gels of soybean protein isolate
相较于SPI组,复合凝胶蒸煮损失率均呈现一定程度的降低。其蒸煮损失率分别为8.09%、4.36%、2.95%、2.55%、3.72%、6.21%,S-DK2组的蒸煮损失率最低。除S-DK4外,其余组间没有显著性差异,说明高脱乙酰度的添加对大豆分离蛋白复合凝胶稳定性有不利影响,这与凝胶强度(图1)结果一致。可得出一定脱乙酰度的DKGM的加入可达到降低蒸煮损失率的效果。
2.5 DKGM对大豆分离蛋白复合凝胶微观结构的影响
如图4所示,所有样品均具有三维网状结构,表明凝胶具有弹性行为。在2 000×下观察凝胶的微观结构,发现SPI-KGM组蛋白质骨架增厚,这可能是由于多糖的黏附作用和蛋白质与多糖的相互作用,增强了蛋白质凝胶强度。SPI-KGM组中聚集的油滴填充在不规则网络孔洞中。随着脱乙酰度增加,复合凝胶网络结构中的水分通道逐渐减小,网络框架变紧凑,这与质构特性的结果一致(表1)。同时复合物聚集体更均匀,这也是白度增加的主要原因(图2)。脱乙酰度的增加导致复合凝胶蛋白质的聚集程度减弱,油脂与蛋白质充分结合,蛋白质被乳化完全,形成了均匀的“蛋白质-多糖-油脂”复合物。这可能是由于脱乙酰度高的DKGM更容易形成凝胶,凝胶网络加强,并通过长链多糖空间效应阻止蛋白质分子的扩展聚集[8]。然而高脱乙酰度的DKGM能够聚集成较大颗粒,导致油脂聚集,SPI不能充分乳化,复合凝胶网络结构崩溃[26]。
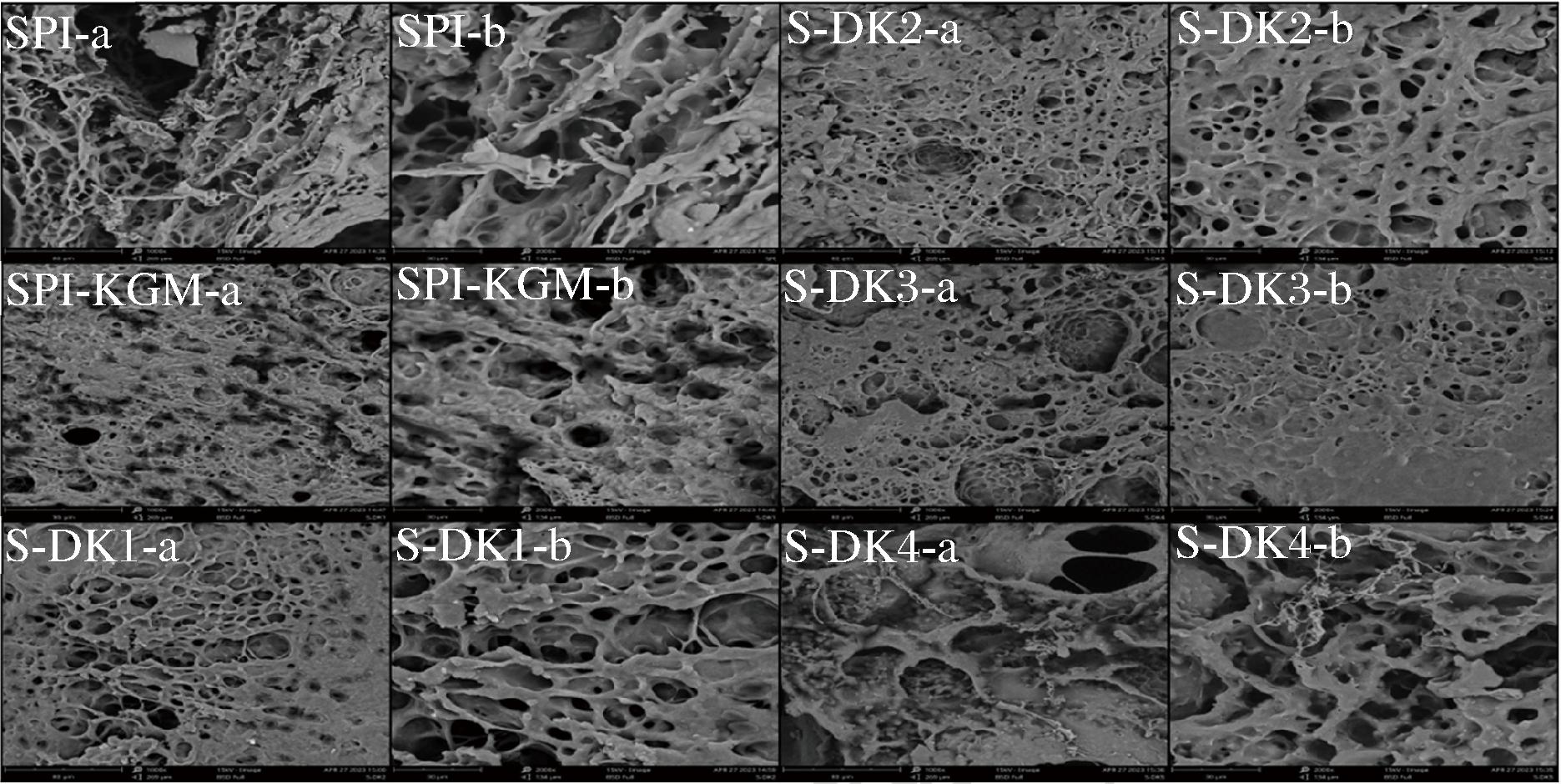
a-1 000×;b-2 000×
图4 DKGM对大豆分离蛋白复合凝胶微观结构(SEM)的影响
Fig.4 Effect of DKGM on SEM micrographs of composite gels of soybean protein isolate
2.6 DKGM对大豆分离蛋白复合凝胶热稳定性的影响
用DSC记录混合蛋白凝胶热变性过程中的能量变化,变性温度和变性焓(ΔH)可以分别反映蛋白质的热稳定性和聚集程度[27]。由表2可知,复合凝胶的变性峰值温度在47~50 ℃。这与TANG等[17]研究发现一致。添加KGM后,复合凝胶变性温度稍向左移。相比于KGM,DKGM的添加使凝胶热变性温度从41.35 ℃升至44.67 ℃,提高了复合凝胶的热稳定性。但是相比于SPI组,添加不同脱乙酰度的DKGM,复合体系的峰值温度稍向右移,但是差异并不显著,可能是由于多糖的添加量较低,对蛋白质变性和聚集的影响有限。有报道称复合蛋白凝胶的热稳定性与掺入多糖的浓度呈正相关[28]。
表2 DKGM对大豆分离蛋白复合凝胶热稳定性的影响
Table 2 Effect of DKGM on the thermal stability of composite gels of soybean protein isolate
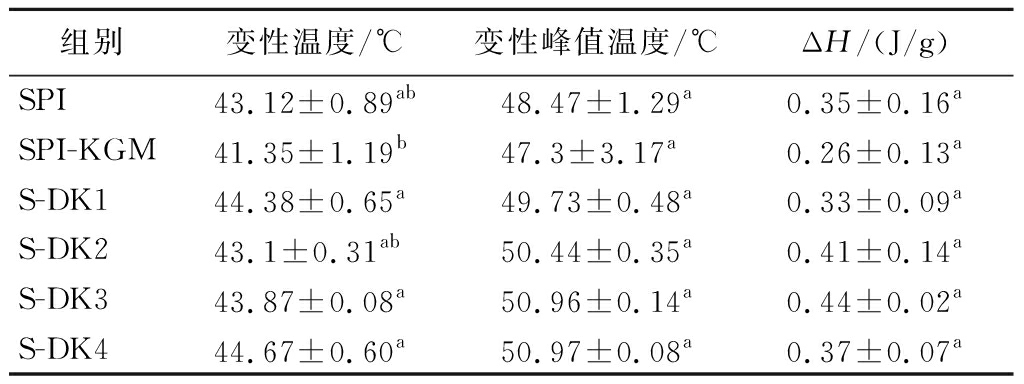
组别变性温度/℃变性峰值温度/℃ΔH/(J/g)SPI43.12±0.89ab48.47±1.29a0.35±0.16aSPI-KGM41.35±1.19b47.3±3.17a0.26±0.13aS-DK144.38±0.65a49.73±0.48a0.33±0.09aS-DK243.1±0.31ab50.44±0.35a0.41±0.14aS-DK343.87±0.08a50.96±0.14a0.44±0.02aS-DK444.67±0.60a50.97±0.08a0.37±0.07a
2.7 DKGM对手磨豆干质构特性的影响
如表3所示,烘烤后的手磨豆干其质构特性均在一定程度上增强,硬度、黏着性和咀嚼性与复合凝胶趋势一致。与复合凝胶相比,烘烤后其质构特性均增强。可能是卤制时加入的食盐可活化蛋白质,增强蛋白质水合作用以及结合水的能力[29],同时Na+与水分子之间存在强烈的离子偶极相互作用,有助于提高DKGM所形成的三维网络凝胶结构强度,进而影响复合物网络结构[30]。烘烤后,凝胶表面因高温加热导致皱缩、变硬,凝胶在硬度、弹性和咀嚼性上均有一定程度提升。
表3 DKGM对手磨豆干质构特性的影响
Table 3 Effect of DKGM on the texture characteristics of dried tofu
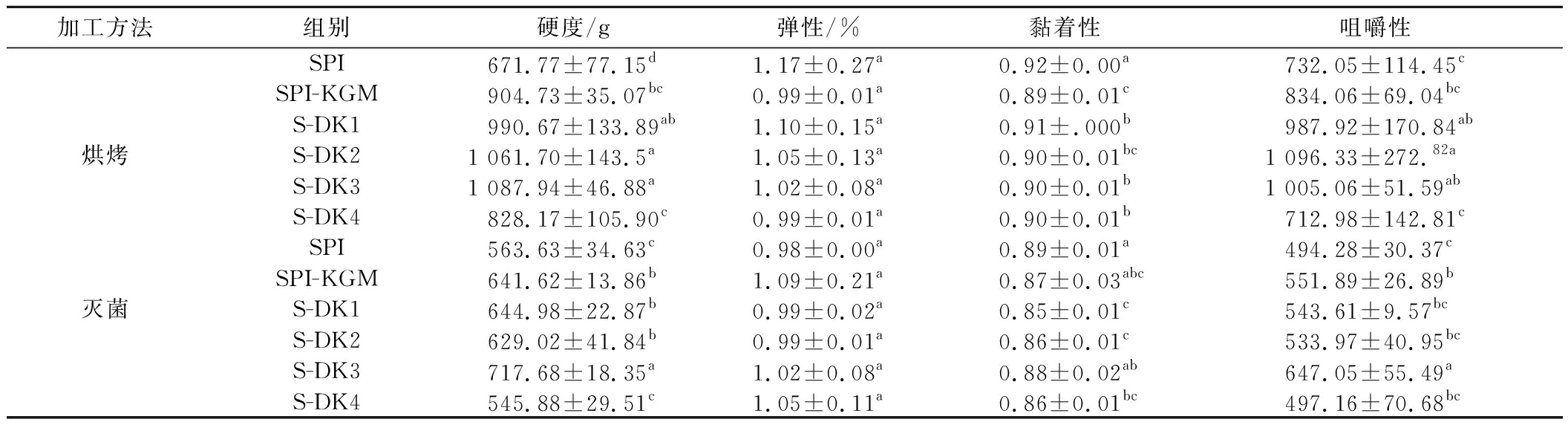
加工方法组别硬度/g弹性/%黏着性咀嚼性SPI671.77±77.15d1.17±0.27a0.92±0.00a732.05±114.45cSPI-KGM904.73±35.07bc0.99±0.01a0.89±0.01c834.06±69.04bcS-DK1990.67±133.89ab1.10±0.15a0.91±.000b987.92±170.84ab烘烤S-DK21 061.70±143.5a1.05±0.13a0.90±0.01bc1 096.33±272.82aS-DK31 087.94±46.88a1.02±0.08a0.90±0.01b1 005.06±51.59abS-DK4828.17±105.90c0.99±0.01a0.90±0.01b712.98±142.81cSPI563.63±34.63c0.98±0.00a0.89±0.01a494.28±30.37cSPI-KGM641.62±13.86b1.09±0.21a0.87±0.03abc551.89±26.89b灭菌S-DK1644.98±22.87b0.99±0.02a0.85±0.01c543.61±9.57bcS-DK2629.02±41.84b0.99±0.01a0.86±0.01c533.97±40.95bcS-DK3717.68±18.35a1.02±0.08a0.88±0.02ab647.05±55.49aS-DK4545.88±29.51c1.05±0.11a0.86±0.01bc497.16±70.68bc
手磨豆干经高温灭菌后,SPI组硬度和咀嚼性分别下降了约16%和33%。添加DKGM的复合凝胶硬度和咀嚼性下降了约27%~51%,得出高温处理对蛋白质复合物质构特性有负面影响。S-DK3组手磨豆干硬度,咀嚼性均为最高,因此DK-3入后形成的蛋白质复合物网络结构抵抗高温处理破坏的能力最强,形成的网络结构较为致密。
2.8 DKGM对手磨豆干盐分含量的影响
手磨豆干制备过程中,常加入各种风味香辛料进行拌料腌制,赋予手磨豆干更多的风味。通过测定手磨豆干中盐分含量,一定程度上能反映出手磨豆干对风味物质的吸附和保持能力。如图5所示,随着脱乙酰度的增大,SPI-DKGM手磨豆干的盐分含量先减小后增大再减小。加入DK-3后形成的蛋白质复合物对盐分的吸附能力强。蛋白质通过疏水作用力吸附挥发性风味物质[31],因此可能存在加入DKGM后,蛋白质分子之间的疏水作用增强,导致蛋白质对风味物质的吸附减少。但是S-DK3的网络结构致密均匀,可能导致其能将盐分更稳固的吸附。

图5 DKGM对手磨豆干盐分含量的影响
Fig.5 Effect of DKGM on salt content of dried tofu
3 结论
本研究探讨不同脱乙酰度DKGM对大豆分离蛋白复合凝胶性质的影响,并得出结论:相比SPI,KGM和DKGM增加了复合凝胶的凝胶强度和质构特性,酶交联反应时间8 h时,凝胶强度从92.03 g增至最高130.06 g;增强了复合凝胶的白度和持水性。大豆分离蛋白复合凝胶蒸煮损失率从8.09%降至2.55%。相比于KGM,DKGM组复合凝胶及烘烤、灭菌后的手磨豆干的硬度、咀嚼性和黏着性均显著性增强;DKGM的添加使得凝胶热变性温度从41.35 ℃升至44.67 ℃,提高了复合凝胶的热稳定性。DK-3对手磨豆干盐分含量影响较大,所形成的复合凝胶表观形态较佳。通过SEM可以看出,S-DK3组复合凝胶有更为紧凑致密的蛋白质复合物网络结构。综上,DKGM能改善复合凝胶的品质,适度脱乙酰度的DK-3效果更佳。但是,对于DKGM影响TG酶作用下大豆分离蛋白凝胶的相互作用机制仍需进一步探究。
[1] WANG X F, LUO K Y, LIU S T, et al.Textural and rheological properties of soy protein isolate tofu-type emulsion gels:Influence of soybean variety and coagulant type[J].Food Biophysics, 2018, 13(3):324-332.
[2] RUI X, FU Y T, ZHANG Q Q, et al.A comparison study of bioaccessibility of soy protein gel induced by magnesiumchloride, glucono-δ-lactone and microbial transglutaminase[J].LWT-Food Science and Technology, 2016, 71:234-242.
[3] LI C Y, WU X F, MU D D, et al.Effect of partial hydrolysis with papain on the characteristics of transglutaminase-crosslinked tofu Gel[J].Journal of Food Science, 2018, 83(12):3092-3098.
[4] ZHU J R, DENG H, YANG A S, et al.Effect of microbial transglutaminase cross-linking on the quality characteristics and potential allergenicity of tofu[J].Food &Function, 2019, 10(9):5485-5497.
[5] 刘璐, 庞杰.魔芋葡甘聚糖复合凝胶网络结构的研究进展[J].粮油食品科技, 2021, 29(2):129-134.LIU L,PANG J.Research progress on material and composite structure of konjac glucomannan composite gel[J].Science and Technology of Cereals, Oils and Foods, 2021, 29(2):129-134.
[6] WU D, YU S M, LIANG H S, et al.An innovative konjac glucomannan/κ-carrageenan mixed tensile gel[J].Journal of the Science of Food and Agriculture, 2022, 102(7):3057.
[7] 罗华彬, 林露, 司永利, 等.不同亲水胶体对带鱼鱼糜凝胶品质的影响[J].核农学报, 2019, 33(7):1371-1376.LUO H B,LIN L,SI Y L,et al.Effects of different hydrocolloids on the gel quality of Hairtail Surimi[J].Journal of Nuclear Agricultural Sciences, 2019, 33(7):1371-1376.
[8] YUAN L, YU J M, MU J L, et al.Effects of deacetylation of konjac glucomannan on the physico-chemical properties of surimi gels from silver carp (Hypophthalmichthys molitrix)[J].RSC Advances, 2019, 9(34):19828-19836.
[9] ZHANG T, XUE Y, LI Z J, et al.Effects of deacetylation of konjac glucomannan on Alaska Pollock surimi gels subjected to high-temperature (120 ℃) treatment[J].Food Hydrocolloids, 2015, 43:125-131.
[10] ZHANG Q B, HUANG L, LI H, et al.Mimic pork rinds from plant-based gel:The influence of sweet potato starch and konjac glucomannan[J].Molecules, 2022, 27(10):3103.
[11] RAN X L, YANG H S.Promoted strain-hardening and crystallinity of a soy protein-konjac glucomannan complex gel by konjac glucomannan[J].Food Hydrocolloids, 2022, 133:107959.
[12] LI J, YE T, WU X, et al. Preparation and characterization of heterogeneous deacetylated konjac glucomannan[J]. Food Hydrocolloids, 2014, 40: 9-15.
[13] XIAO M, DAI S H, WANG L, et al.Carboxymethyl modification of konjac glucomannan affects water binding properties[J].Carbohydrate Polymers, 2015, 130:1-8.
[14] GUO Y L, HU H, WANG Q, et al.A novel process for peanut tofu gel:Its texture, microstructure and protein behavioral changes affected by processing conditions[J].LWT, 2018, 96:140-146.
[15] 陈凡凡, 滕飞, 韩松, 等.酶解对豆腐干凝胶结构和理化特性的影响[J].食品科学, 2020, 41(5):23-30.CHEN F F, TENG F, HAN S, et al.Effect of enzymatic hydrolysis of soymilk on the microstructure and physicochemical properties of dried tofu[J].Food Science, 2020, 41(5):23-30.
[16] CHANG Y H, SHIAU S Y, CHEN F B, et al.Effect of microbial transglutaminase on the rheological and textural characteristics of black soybean packed tofu coagulating with Agar[J].LWT - Food Science and Technology, 2011, 44(4):1107-1112.
[17] TANG C H, CHEN Z, LI L, et al.Effects of transglutaminase treatment on the thermal properties of soy protein isolates[J].Food Research International, 2006, 39(6):704-711.
[18] BUDA U, PRIYADARSHINI M B, MAJUMDAR R K, et al.Quality characteristics of fortified silver carp surimi with soluble dietary fiber:Effect of apple pectin and konjac glucomannan[J].International Journal of Biological Macromolecules, 2021, 175:123-130.
[19] ZHENG L, WANG Z J, KONG Y, et al.Different commercial soy protein isolates and the characteristics of Chiba tofu[J].Food Hydrocolloids, 2021, 110:106115.
[20] RAN X L, LOU X W, ZHENG H Q, et al.Improving the texture and rheological qualities of a plant-based fishball analogue by using konjac glucomannan to enhance crosslinks with soy protein[J].Innovative Food Science &Emerging Technologies, 2022, 75:102910.
[21] 孙乐常, 周典颖, 杜瀚, 等.魔芋胶对南美白对虾肌原纤维蛋白凝胶特性的影响[J].食品科学, 2022, 43(12):42-50.SUN L C, ZHOU D Y, DU H, et al.Effect of konjac glucomannan on gelling properties of myo brillar protein from the paci
brillar protein from the paci c white shrimp Litopenaeus vannamei[J].Food Science, 2022, 43(12):42-50.
c white shrimp Litopenaeus vannamei[J].Food Science, 2022, 43(12):42-50.
[22] XIN C, CHEN J, LIANG H S, et al.Confirmation and measurement of hydrophobic interaction in sol-gel system of konjac glucomannan with different degree of deacetylation[J].Carbohydrate Polymers, 2017, 174:337-342.
[23] ZHENG L, TENG F, WANG N, et al.Addition of salt ions before spraying improves heat- and cold-induced gel properties of soy protein isolate (SPI)[J].Applied Sciences, 2019, 9(6):1076.
[24] TOBIN J T, FITZSIMONS S M, CHAURIN V, et al.Thermodynamic incompatibility between denatured whey protein and konjac glucomannan[J].Food Hydrocolloids, 2012, 27(1):201-207.
[25] 葛珍珍, 许明月, 靳学远, 等.脱乙酰基魔芋葡甘聚糖理化性质及其对凉皮质构和体外消化的影响[J].食品科学, 2023, 44(4):85-90.GE Z Z, XU M Y, JIN X Y, et al.Physicochemical properties of deacetylated konjac glucomannan and its effects on the quality and in vitro characteristics of cold noodles[J].Food Science,2023, 44(4):85-90.
[26] YAN W L, YIN T, XIONG S B, et al.Gelling properties of silver carp surimi incorporated with konjac glucomannan:Effects of deacetylation degree[J].International Journal of Biological Macromolecules, 2021, 191:925-933.
[27] 李承花, 张奕, 左琴华, 等.差式扫描量热仪的原理与应用[J].分析仪器, 2015(4):88-94.LI C H, ZHANG Y, ZUO Q H, et al.Application of differential scanning calorimeter[J].Analytical Instrumentation, 2015(4):88-94.
[28] JIANG L, REN Y M, XIAO Y H, et al.Effects of Mesona chinensis polysaccharide on the thermostability, gelling properties, and molecular forces of whey protein isolate gels[J].Carbohydrate Polymers, 2020, 242:116424.
[29] 牛祥臣, 王洪彩, 马军, 等.食盐浓度和热处理条件对大豆蛋白凝胶特性影响的研究[J].食品研究与开发, 2018, 39(6):19-22.NIU X C, WANG H C, MA J, et al.Effects of salt concentration and heat treatment on the gel characteristics of soybean protein[J].Food Research and Development, 2018, 39(6):19-22.
[30] HERRANZ B, BORDERIAS A J, SOLO-DE-ZALD VAR B, et al.Thermostability analyses of glucomannan gels.Concentration influence[J].Food Hydrocolloids, 2012, 29(1):85-92.
VAR B, et al.Thermostability analyses of glucomannan gels.Concentration influence[J].Food Hydrocolloids, 2012, 29(1):85-92.
[31] SOLMS J, OSMAN-ISMAIL F, BEYELER M.The interaction of volatiles with food components[J].Canadian Institute of Food Science and Technology Journal, 1973, 6(1):A10-A16.