链霉素(streptomycin,STR)是从灰链霉菌中分离提取出的一种氨基糖苷类抗生素,对革兰氏阴性菌和结核分枝杆菌有很强的杀菌效果[1],常用于人细菌性感染的治疗和动物疫病的防控。然而,STR具有肾毒性、耳毒性等毒副作用,易引发神经肌肉阻滞、皮疹、发热、血管性水肿、剥脱性皮炎和过敏性休克等症状[2]。近年来,美国联邦法规法典第21篇第556部《食品中新型兽药的残留容许量》、欧盟委员会第37/2010号法规 《食品中药物活性物质最大残留限量》、国际食品法典委员会CXM 2-2023 《食品中兽药残留最大残留限量和风险管理建议》和我国GB 31650—2019 《食品安全国家标准 食品中兽药最大残留限量》都已经对动物性食品中STR制定了残留限量标准。我国NY/T 752—2020《绿色食品 蜂产品》中规定了蜂蜜中STR的最大残留限量为20 μg/kg。
近年来,在国内外STR检测方法中,仪器分析方法需要昂贵的设备,前处理相对复杂,且成本高,不适合基层现场使用(如分光光度法[3-4]、高效液相色谱法[5-6]、毛细管电泳法[7-8]、液相色谱-串联质谱法[9-11]);免疫分析法需要制备特异性人工抗原和抗体,过程冗长,周期长,影响因素多,容易出现假阳性或假阴性结果(如酶联免疫法[12-14]、免疫层析法[15-16]);微生物分析方法灵敏度低,繁琐耗时,存在交叉反应[17-18]。
电化学分析法具有样品处理简便、分析速度快、成本低廉和易于现场即时检测等优点,同分子印迹技术结合后的仿生印迹电化学传感器,可以将目标物质浓度转化为电信号,快速准确检测。目前,仿生印迹电化学传感器已应用于STR的检测,WEN等[19]在玻碳电极(glassy carbon electrode,GCE)表面通过电化学方法沉积了一层还原氧化石墨烯(electrochemically reduced graphene oxide,EGRO),采用ERGO作为衬底,在其表面电聚合3-吡咯-3-羧酸形成STR印迹膜,选择性结合识别STR分子。
本研究以STR为模板,3-氨基苯硼酸(3-aminobenzeneboronic acid,3-APBA)和邻苯二胺(O-phenylenediamine,OPD)为复合功能单体,壳聚糖(chitosan,CS)和氧化石墨烯(graphene oxide,GO)为修饰材料,通过电聚合法制备分子印记聚合物(molecular imprinted polymer,MIP),构建出一种灵敏度高、特异性强的STR仿生印迹电化学传感器,成功应用于蜂蜜样品中痕量STR的快速检测。
1 材料与方法
1.1 材料与试剂
氯化钾、无水乙醇、亚铁氰化钾、铁氰化钾、磷酸二氢钠(NaH2PO4)、磷酸氢二钠(Na2HPO4)、甲醇,天津市德恩化学试剂有限公司;OPD,上海阿拉丁生化科技股份有限公司;3-APBA,阿达玛斯试剂有限公司;GO,南京先丰纳米材料科技有限公司;氧化铝、CS、硫酸新霉素、红霉素、硫酸庆大霉素,上海麦克林生化科技有限公司;STR,北京酷来搏科技有限公司;冰乙酸,天津天力化学试剂有限公司;氯化钠,江苏强盛功能化学股份有限公司。以上试剂均为分析纯,试验用水为超纯水。
1.2 仪器与设备
CHI660E型电化学工作站、三电极体系CHI104型玻碳电极(工作电极,直径3.0 mm)、R0302 Ag/AgCl电极(参比电极,直径1.0 mm)、CHI115型铂丝电极(辅助电极),上海辰华仪器有限公司;KQ-50型超声清洗仪,昆山市超声仪器有限公司;TM 3030 plus型台式扫描电镜,日本日立公司;H1850型高速离心机,湖南湘仪离心机有限公司。
1.3 实验方法
1.3.1 玻碳电极的预处理
将纳米氧化铝倒在干净的麂皮上,电极置于纳米氧化铝溶液中打磨10 min,待玻碳电极的表面光滑如镜面时,去离子水冲洗后,依次放入水和无水乙醇中超声清洗5 min,室温晾干。然后采用循环伏安法(cyclic voltammetry,CV)在-0.2~+0.6 V电位窗口内,以50 mV/s的扫描速率,在含0.1 mol/L KCl的5.0 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6]溶液中测定响应电流,当氧化还原峰差值小于等于90 mV时,说明电极处理符合要求。
1.3.2 CS-GO修饰材料的制备
选取CS和GO作为修饰材料,其中CS含有丰富的—OH和—NH3基团,可以增强GO与电极的吸附作用。且CS的成膜能力良好,有利于纳米复合材料的组装。具体修饰过程如下:称取50.0 mg CS溶于50.0 mL 2%(体积分数)的CH3COOH溶液中,磁力搅拌溶解后,用0.1 mol/L的NaOH溶液调节pH值至5.5,配制成1.0 mg/mL的CS溶液。再称取1.0 mg GO加入到3.0 mL l.0 mg/mL CS溶液中,超声分散1 h,得到均匀分散的CS-GO混合体系。将10 μL CS-GO 混合溶液滴涂至GCE表面,紫外干燥20 min,形成复合膜。采用扫描电镜(scanning electron microscope,SEM)表征GO和CS-GO复合膜的表面形貌[20-21]。
1.3.3 仿生印迹电化学传感界面的构建
将制备好的CS-GO混合物用超声波分散30 min,漩涡5 min,然后取10 μL的CS-GO溶液滴涂于GCE表面,紫外干燥得到CS-GO/GCE。所得电极置于含有20.0 mmol/L STR、50.0 mmol/L OPD和20.0 mmol/L 3-APBA的0.1 mol/L 磷酸盐缓冲溶液PBS(pH 8.0)中,进行电聚合,电位为0~+0.9 V,CV循环扫描20圈(100 mV/s)。随后,将电极置于10% 乙酸甲醇溶液中,磁力搅拌25 min,以洗脱模板,获得修饰电极(MIP/CS-GO/GCE)。同时,制备非印迹(non-imprinted polymer,NIP)电极(NIP/CS-GO/GCE),制备方法与MIP相同,但不添加模板分子STR。
1.3.4 电化学检测方法
在含0.1 mol/L KCl的5.0 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6]溶液中,采用循环伏安法(cyclic voltammetry,CV)、差分脉冲伏安法(differential pulse voltammetry,DPV)及电化学阻抗法(electrochemical impedance spectrum,EIS)研究传感器的电化学性能。首先将MIP/CS-GO/GCE置于不同浓度的STR溶液中孵育20 min,孵育完成后使用超纯水去除非特异性吸附物。测量过电化学信号后,再将电极置于10% 乙酸甲醇溶液中洗脱25 min去除STR,以备后续传感检测使用。CV法的扫描电位为-0.2~+0.6 V,扫描速率50 mV/s。DPV法的扫描电位为-0.2~+0.6 V,电位增量4 mV,振幅50 mV,脉冲周期0.5 s。EIS法的频率为0.01~105 Hz,振幅为5 mV。
1.3.5 样品前处理
洋槐蜜、枣花蜜和桂花蜜样品购自河南省洛阳市洛龙区大张超市。称取5 g蜂蜜试样置于50 mL离心管中,滴加10 mL 20 g/L三氯乙酸溶液,涡旋振荡混合5 min后,超声15 min。然后用0.1 mol/L 磷酸盐缓冲溶液PBS(pH 7.4)定容至25 mL,摇匀后以8 000 r/min 离心5 min。收集上清液并调节其pH值至6.5,用0.22 μm微孔滤膜过滤,收集滤液待测。称取STR溶于10 mL PBS磷酸盐缓冲液(pH 8.0),配制STR标准液,采用外标法建立标准曲线,进行定量分析和样品加标回收试验。
2 结果与分析
2.1 仿生印迹传感界面的形貌表征
为进一步表征印迹传感界面的修饰和成膜状况,通过扫描电镜观察了GO、CS-GO复合膜、MIP/CS-GO/GCE和NIP/CS-GO/GCE的表面形貌。结果如图1所示。从图1-a中可以看到GO具有典型的皱折结构,图1-b显示的CS-GO复合膜较GO更为光滑。这是由于CS具有良好的成膜性和分散性,使得GO在电极表面分散得更加均匀,加大了电极的比表面积,促进了电极表面的电子转移。经过电聚合后,在CS-GO/GCE表面得到了一层均匀致密的聚合物膜。STR洗脱后的形貌见图1-c,可以清楚地看到MIP/CS-GO/GCE表面形成了一些孔穴,这些孔穴存在有利于靶分子的传质与识别。同样,图1-d也可以明显看到模板洗脱后的NIP/CS-GO/GCE表面出现了少量且不同尺寸的孔穴,但均匀度和分布较为凌乱。基于印迹识别原理,在没有模板的情况下,NIP印迹膜的表面难以形成均匀和稳定的印迹识别位点,对STR进行选择性吸附的作用很小。上述结果表明,印迹识别体系中模板分子对聚合物形貌具有显著影响,继而可能影响识别与检测性能。

a-GO粉末;b-CS-GO复合材料;c-MIP/CS-GO/GCE;d-NIP/CS-GO/GCE
图1 仿生印迹传感界面的SEM表征
Fig.1 SEM characterization of biomimetic imprinted sensing interfaces
2.2 仿生印迹传感器的电化学表征
通过CV法考察传感器的电化学行为。结果如图2所示,裸电极呈现一对稳定可逆的氧化还原峰(曲线a)。CS-GO/GCE的峰值电流明显增加(曲线b)。STR@MIP/CS-GO/GCE表面的非导电聚合物阻碍了电子在电极表面的传递,氧化还原峰消失(曲线c)。MIP/CS-GO/GCE表面存在大量印迹空腔,为电子扩散提供了通道,电流明显增大(曲线d)。NIP/CS-GO/GCE电极表面由于缺乏印迹空腔,显示出较低的电流响应(曲线e)。MIP/CS-GO/GCE电极在STR标准溶液中进行孵育后,STR与印迹空腔进行特异性结合,堵塞了部分离子的扩散通道,峰值电流下降(曲线f)。
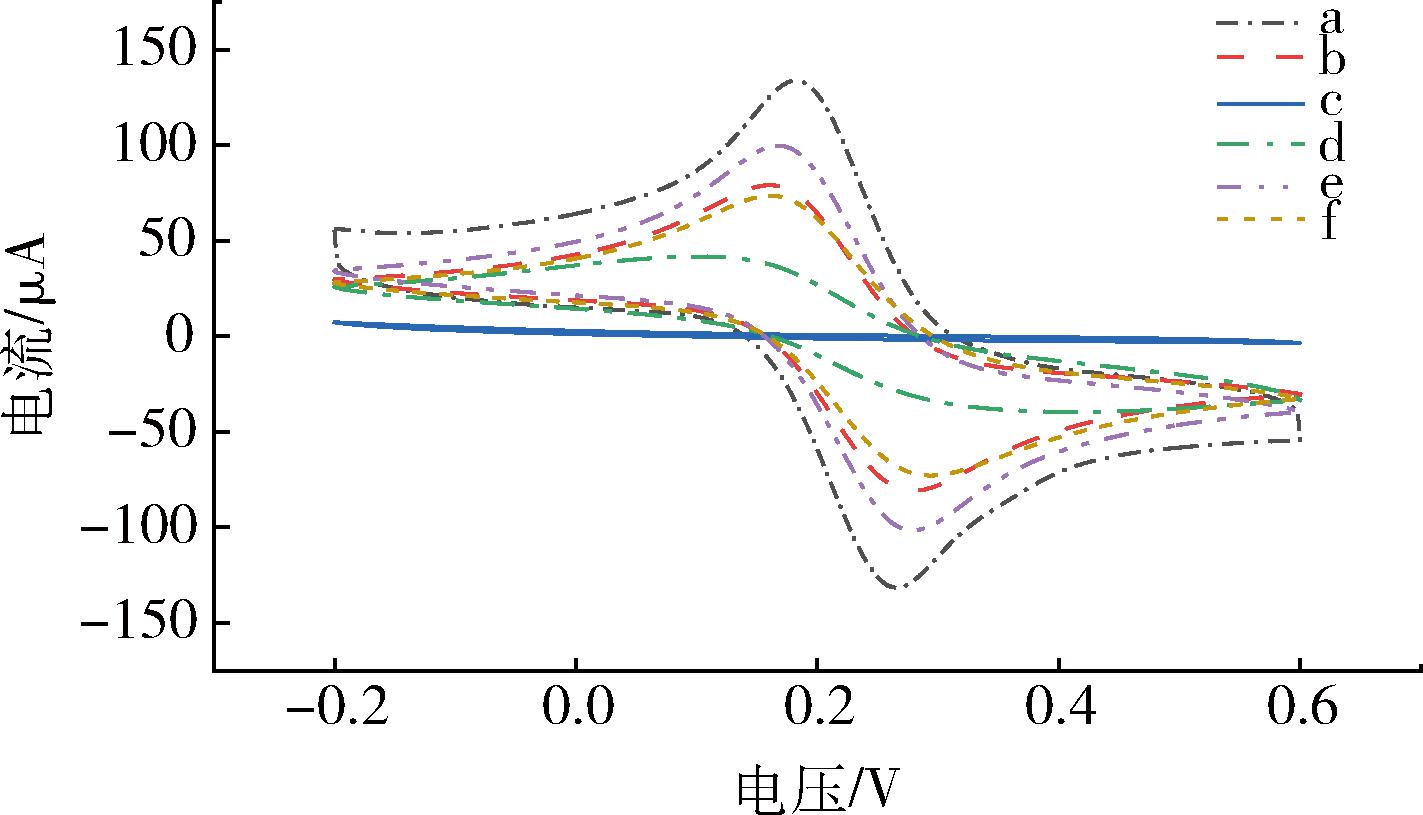
图2 仿生印迹电化学传感器的CV表征曲线
Fig.2 CV responses of the biomimetic imprinted electrochemical sensor
注:a:裸GCE;b:CS-GO/GCE;c:STR@MIP/CS-GO/GCE;d:MIP/CS-GO/GCE;e:NIP/CS-GO/GCE;f:MIP/CS-GO/GCE孵育30 min。
为了进一步确证传感器的构建是否成功,使用EIS来表征不同电极。半圆部分为高频区,代表电极表面电子传递的电阻(resistance,Ret)。线性部分为低频区,代表电极表面探针离子的扩散过程。如图3所示,裸电极对应EIS曲线的Ret值相对较小(曲线a),而CS-GO修饰电极后Ret值进一步降低(曲线b),这表明CS-GO/GCE具有良好的导电性。
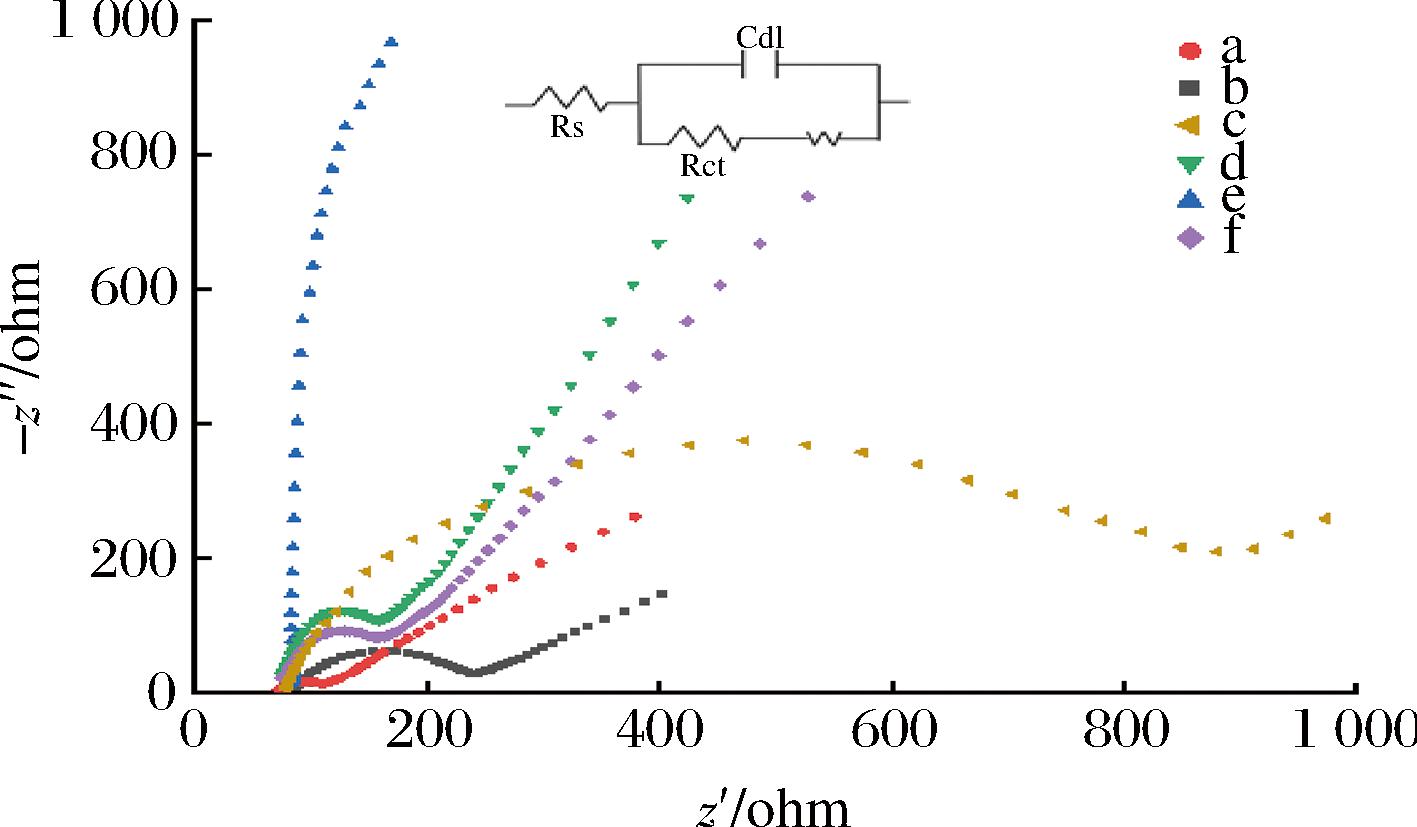
图3 仿生印迹电化学传感器的EIS表征曲线
Fig.3 EIS responses of the biomimetic imprinted electrochemical sensor
注:a:裸GCE;b:CS-GO/GCE;c:STR@MIP/CS-GO/GCE;d:MIP/CS-GO/ GCE;e:NIP/CS-GO/GCE;f:MIP/CS-GO/GCE孵育30 min。
由图3可知,当在CS-GO/GCE表面进行电聚合后,形成了一层不导电的印迹膜,阻碍了电极表面的电子转移,导致Ret值急剧增大(曲线c)。模板分子洗脱后,印迹电极表面形成了很多印迹空腔,为K3[Fe(CN)6]/K4[Fe(CN)6]提供了扩散通道,造成Ret值显著降低(曲线d)。由于非印迹聚合物中没有模板分子,进行洗脱后不能产生印迹空穴,因此电极表面电阻值依旧很大(曲线e)。随后,当印迹电极在STR标准溶液中孵育时,由于底物分子重新结合了部分印迹空腔,阻碍了电子传输过程,印迹电极的Ret值显著增加(曲线f)。综上所述,EIS表征结果与CV表征结果一致,证明了所构建的传感器可以有效识别STR,能够实现靶标物质的精准识别与定量分析。
2.3 试验条件的优化
2.3.1 模板分子与功能单体摩尔比优化
在试验过程中,固定STR的浓度为10 mmol/L,选择STR、OPD和3-APBA的摩尔比分别为1∶1∶1、2∶2∶3、2∶3∶2、2∶5∶2、2∶3∶3和2∶2∶5进行最优化试验。从图4可以看出,在2∶5∶2的摩尔比下,电流响应差值达到最大,说明模板分子与单体的摩尔比在2∶5∶2时产生的识别位点最多。因此,本试验模板分子与功能单体的最佳摩尔比为2∶5∶2。
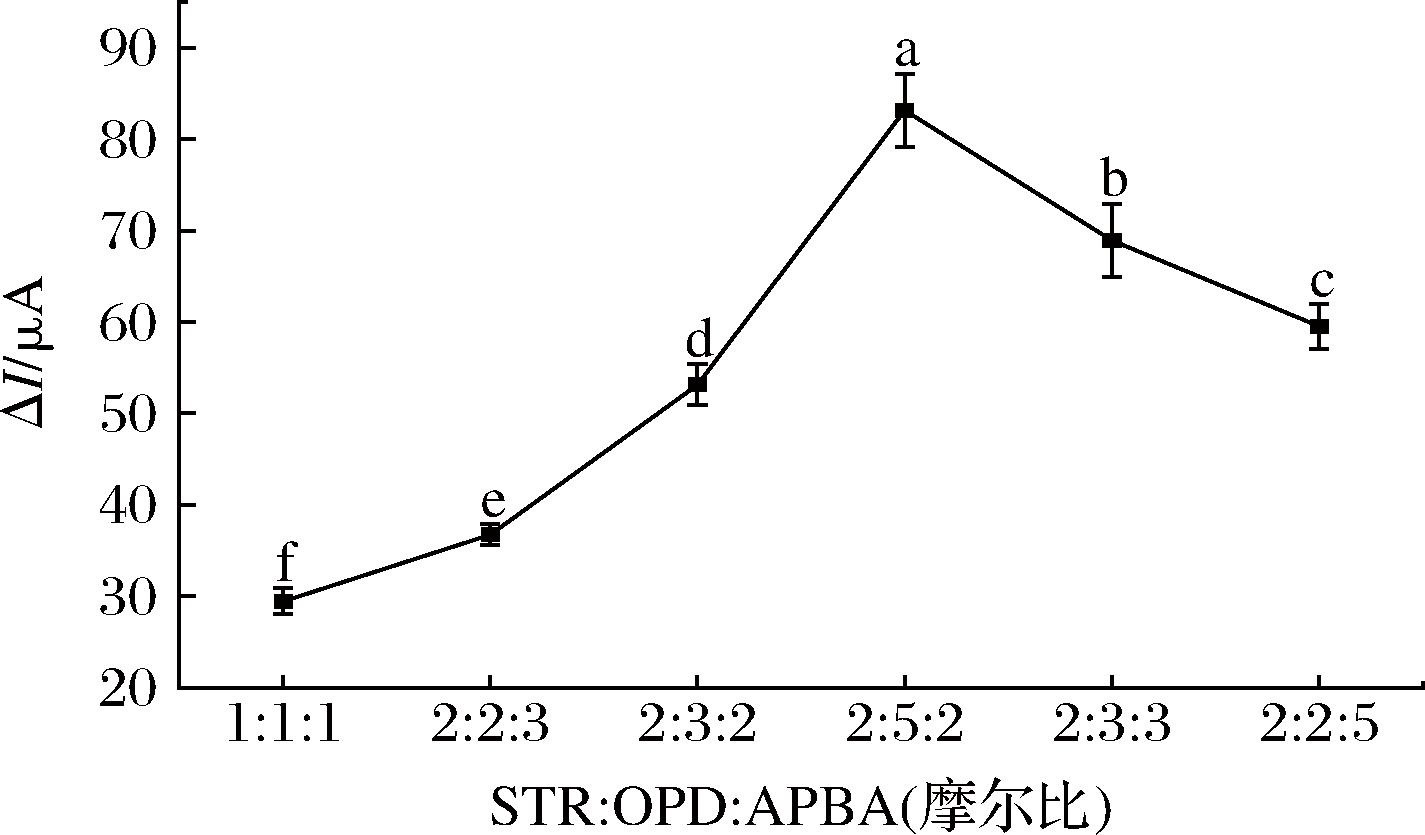
图4 模板分子与功能单体摩尔比对STR仿生印迹电化学传感器电流响应的影响
Fig.4 Effect of molar ratio of template molecule to functional monomers on the current response of the STR biomimetic imprinted electrochemical sensor
注:误差棒表示试验结果平均值的标准偏差(n=5),不同字母表示试验结果间存在显著性差异(P<0.05)(下同)。
2.3.2 聚合圈数的优化
在传感识别过程中,印迹膜的厚度对识别性能有很大的影响,而电聚合过程中扫描圈数的设置决定着印迹膜薄厚。由图5可知,随着电聚合圈数的增加,峰值电流差值逐渐增大,当电聚合圈数达到20时,峰值电流差值最大,所以最佳电聚合循环圈数为20次。
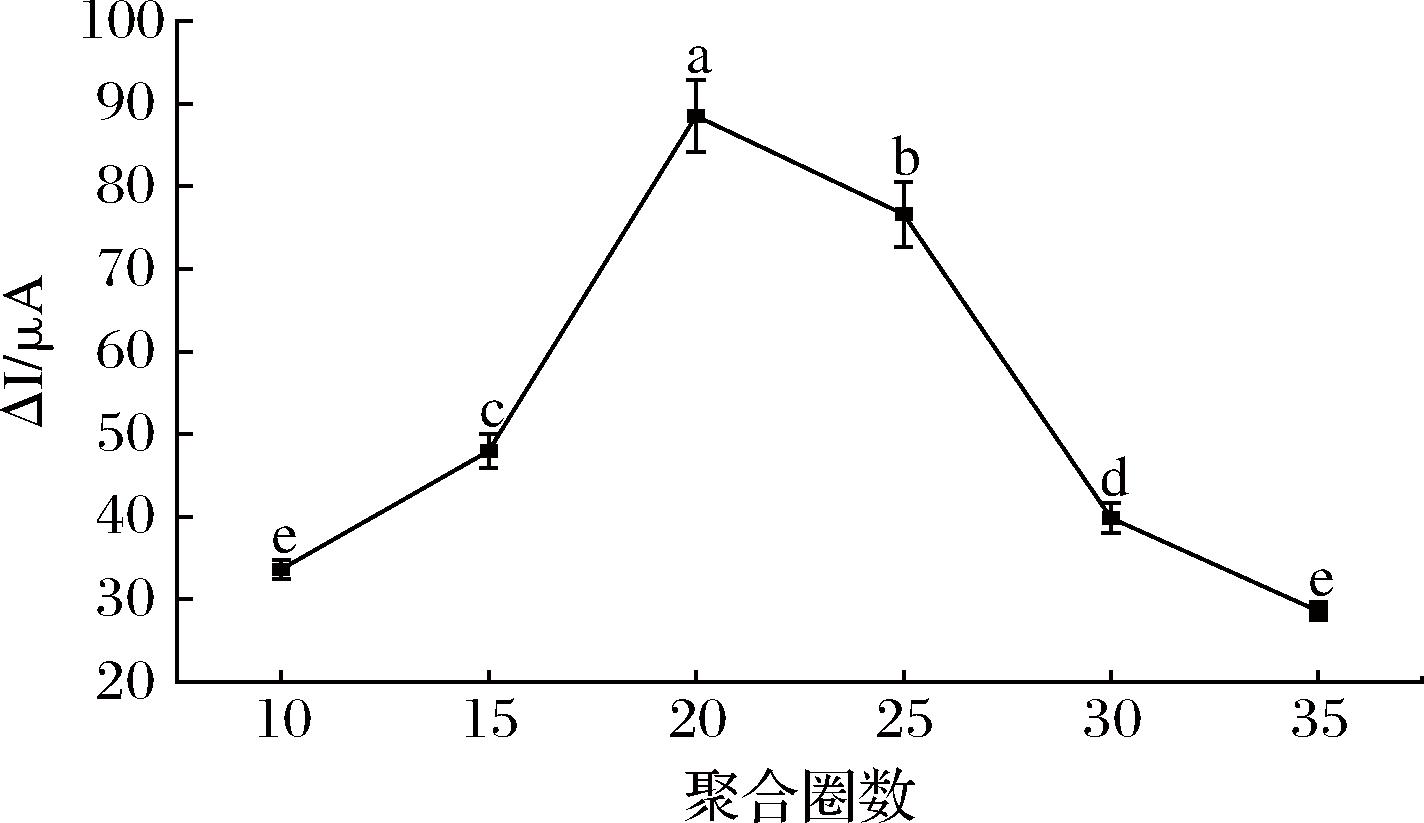
图5 电聚合圈数对STR仿生印迹电化学传感器电流响应的影响
Fig.5 Effect of different electropolymerization cycles on the response of STR biomimetic imprinted electrochemical sensor
2.3.3 洗脱剂及洗脱时间的优化
印迹识别空穴的数量有赖于模板分子的洗脱程度。洗脱条件需在不破坏印迹膜结构的前提下充分去除模板。试验过程中,分别以0.1 mol/L NaOH溶液、70%(体积分数,下同)乙醇水溶液、10% 乙酸甲醇溶液、50% 乙酸水溶液和30% 乙酸水溶液作为洗脱溶液。从图6可以看出,10% 乙酸甲醇溶液的洗脱性能最佳。
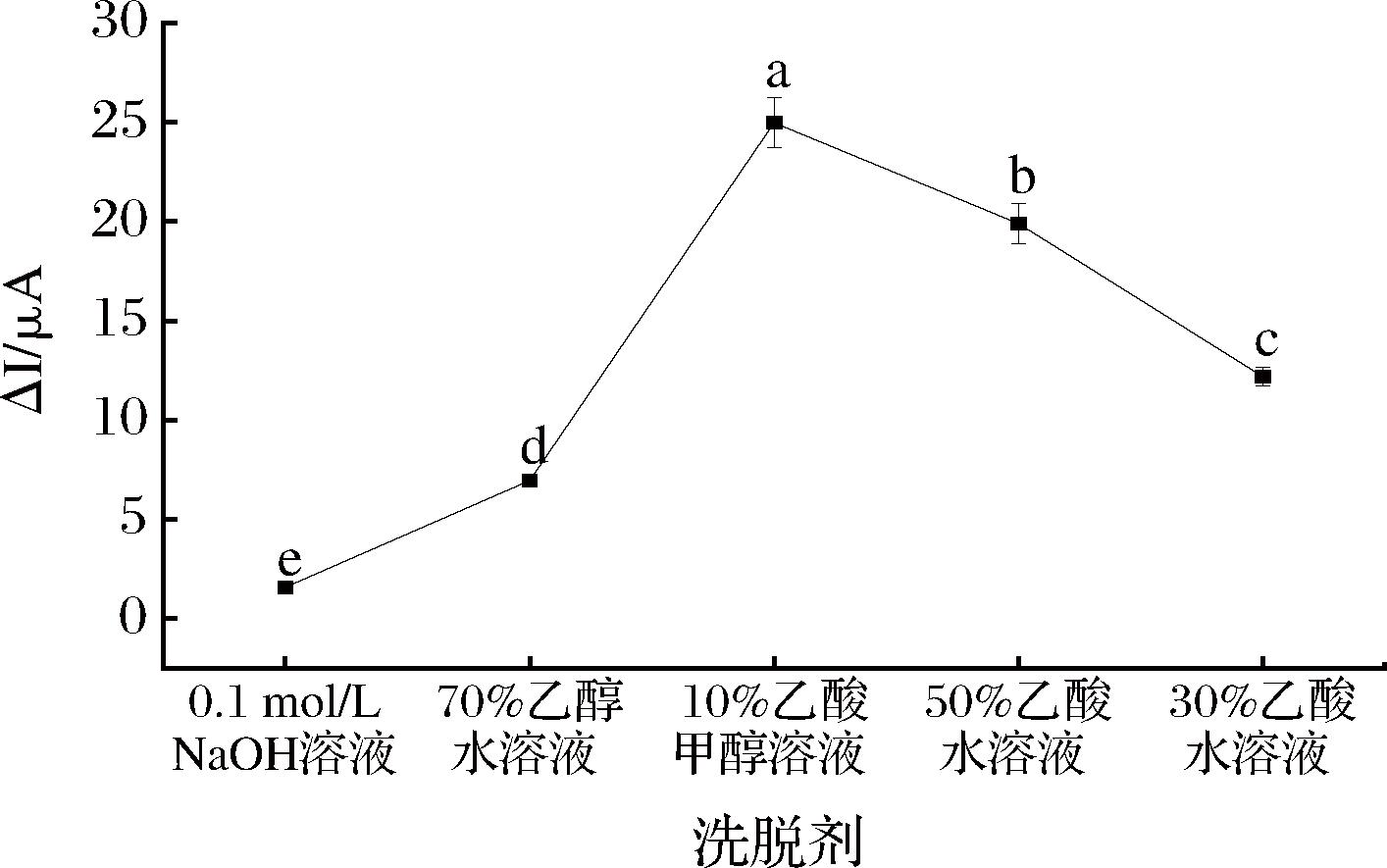
图6 洗脱剂对STR仿生印迹电化学传感器电流响应的影响
Fig.6 Effect of eluent on current response of STR bionic imprinted electrochemical sensor
洗脱时间对模板分子的洗脱效果也有重要影响。从图7可以看出,在25 min以前,洗脱时间越长,电流差值越大,形成印迹识别空穴的数量也越多。洗脱25 min后,峰值电流差值呈降低趋势,表明模板分子在印迹膜中已被充分洗脱。在实际应用中,长时间洗脱不仅会降低检测效率,还可能破坏印迹传感界面的识别位点。所以甲醇-乙酸溶液洗脱25 min为最佳洗脱条件。
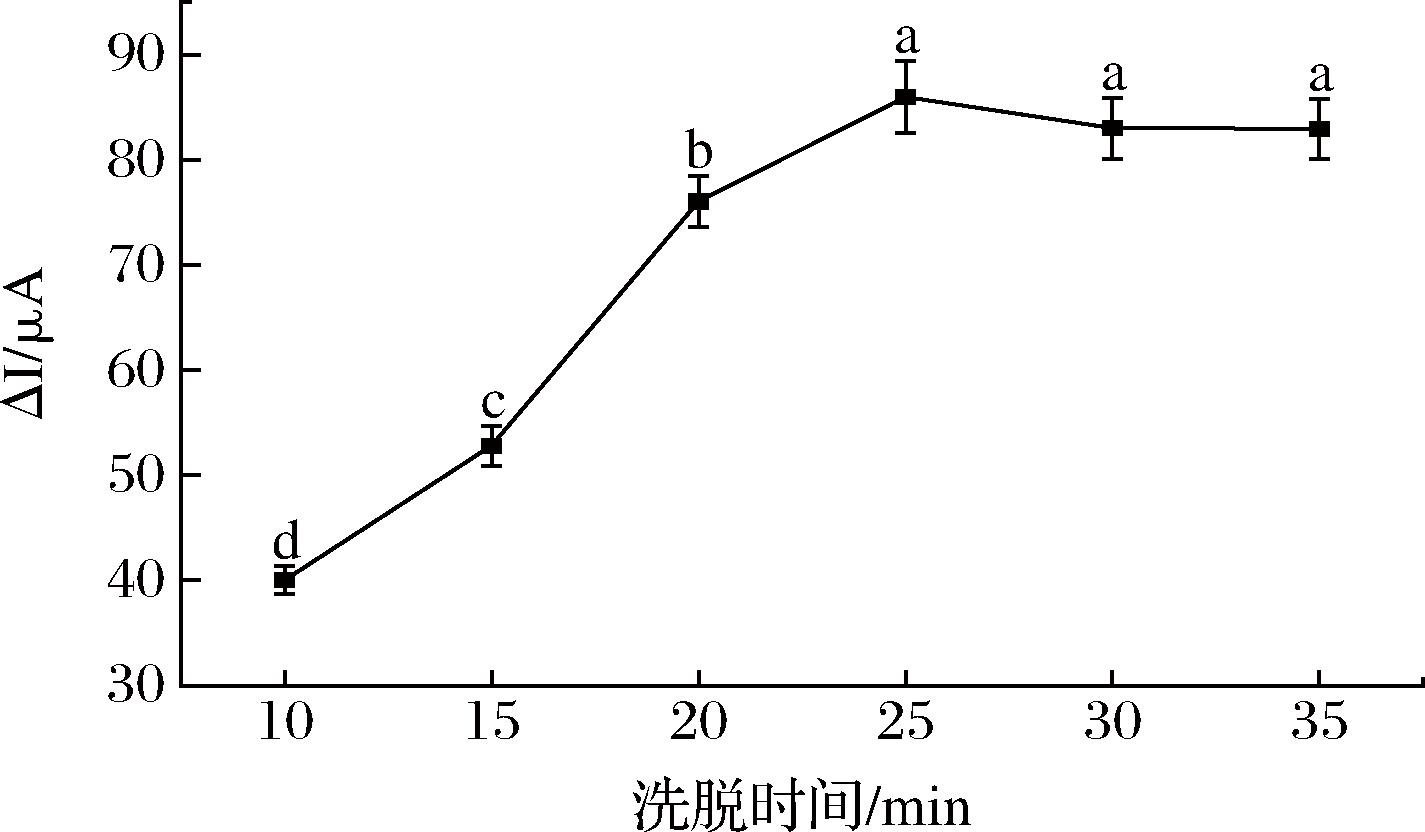
图7 洗脱时间对STR仿生印迹电化学传感器电流响应的影响
Fig.7 Effect of elution time on the response of STR biomimetic imprinted electrochemical sensor
2.3.4 pH值的优化
模板分子(STR)与功能单体OPD和3-APBA可分别形成氢键和可逆共价键,这种化学键的相互作用决定了特异性识别性能的强弱。适宜的pH值可以协同增强STR与单体之间的作用力。为研究pH值的具体影响,分别在pH值从5.0到11.0不等的磷酸盐缓冲液中进行了电聚合。由图8可知,pH为8.0时电流差值最大。此时,模板分子与单体间的作用力最强,印迹膜上可形成的印迹识别位点最多。因此,本试验选择缓冲液的最佳pH值为8.0。
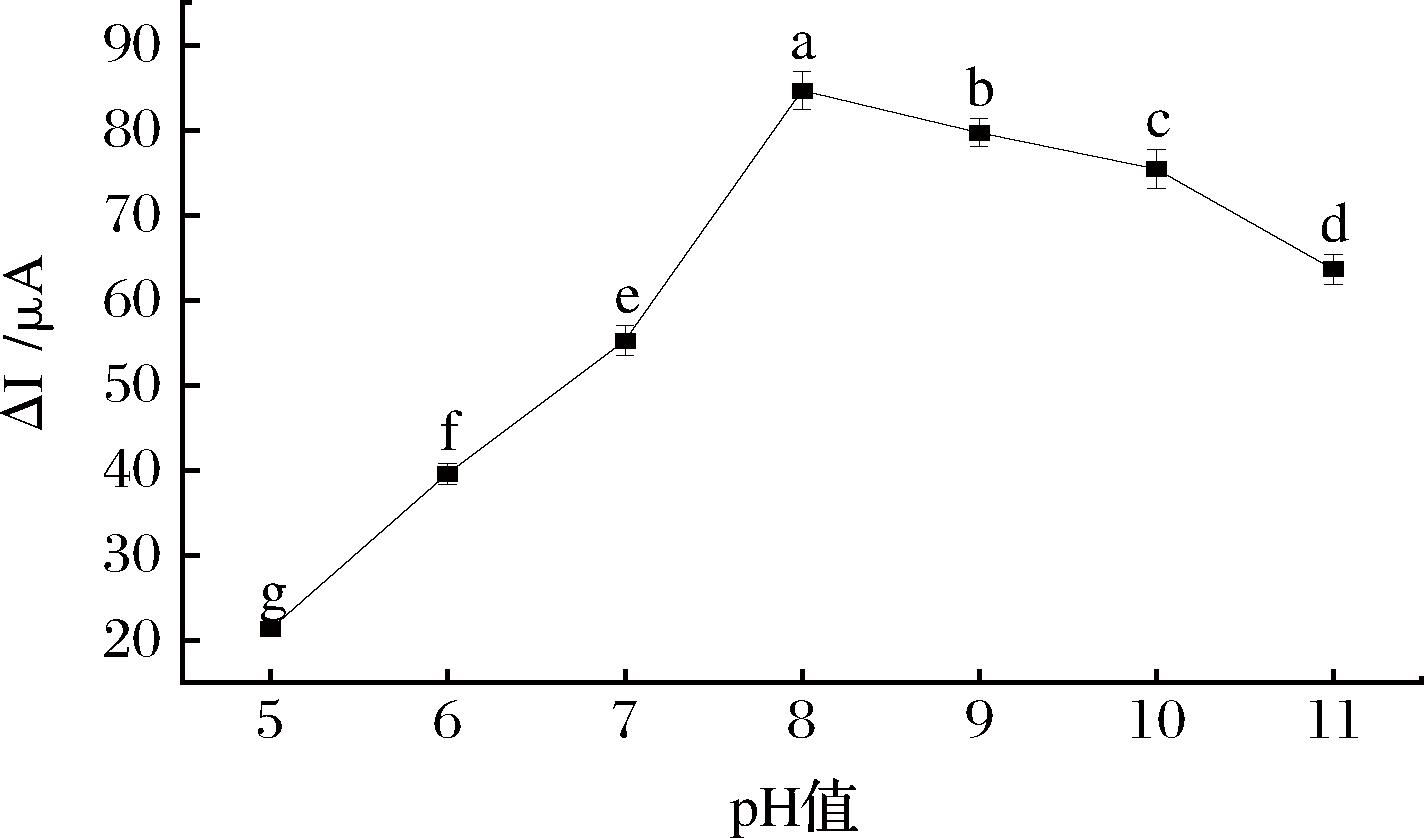
图8 pH值对STR仿生印迹电化学传感器电流响应的影响
Fig.8 Effect of pH value on the response of STR biomimetic imprinted electrochemical sensor
2.3.5 孵育时间的优化
孵育时间的长短对印迹膜的底物识别过程具有重要影响。为了探究最佳的孵育时间,将印迹电极(去除模板后)在10.0 μmol/L STR溶液中分别孵育10 min、15 min、20 min、25 min、30 min和35 min,然后采用DPV法测量相应的响应电流。
如图9所示,随着孵育时间的延长,印迹电极对STR的吸附量逐渐增加,峰值电流变化量显著增加,在20 min后趋于平缓,此时印迹识别位点对STR的结合与识别能力基本达到了饱和状态。过长的孵育时间还有可能使STR与识别位点发生不同程度的解离,进而降低识别和检测性能。因此,选择20 min为最佳孵育时间。
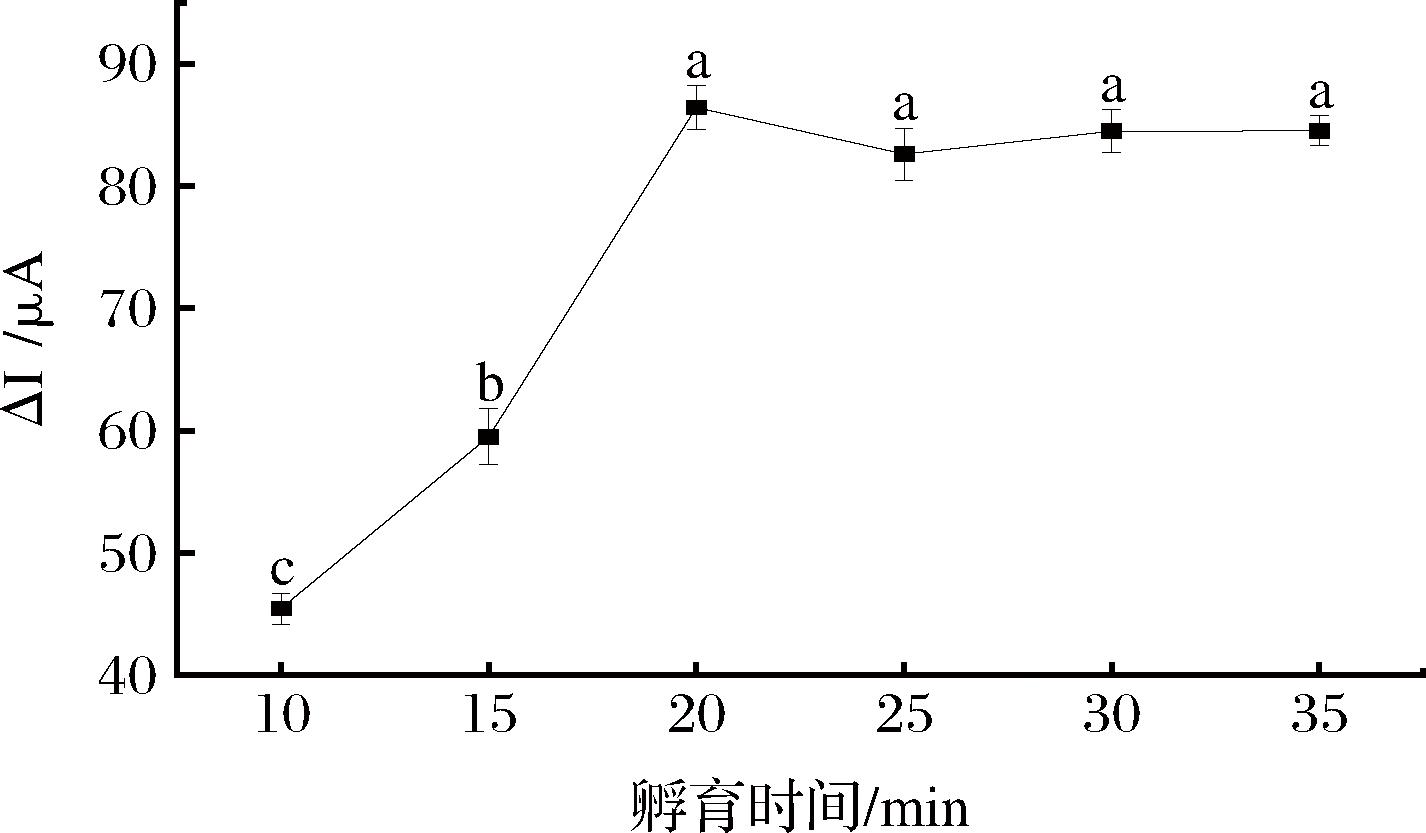
图9 孵育时间对STR仿生印迹电化学传感器电流响应的影响
Fig.9 Effect of incubation time on the response of STR biomimetic imprinted electrochemical sensor
2.4 传感器的线性范围与检出限
在最佳条件下,将MIP/CS-GO/GCE置于不同浓度的STR溶液中孵育20 min,进行DPV电化学测试。结果如图10-a所示,峰值电流值随着STR浓度的增加逐渐降低。这是由于STR占据了越来越多的识别位点,阻碍了电子转移,降低了电流响应信号。从图10-b可以看出,响应电流差值(ΔI)在1.0×10-10~1.0×10-6 mol/L内与STR浓度的对数值呈良好的线性关系,线性回归方程为ΔI=5.51lgC+62.93,相关系数r为0.998 89,检测限为2.59×10-12 mol/L。
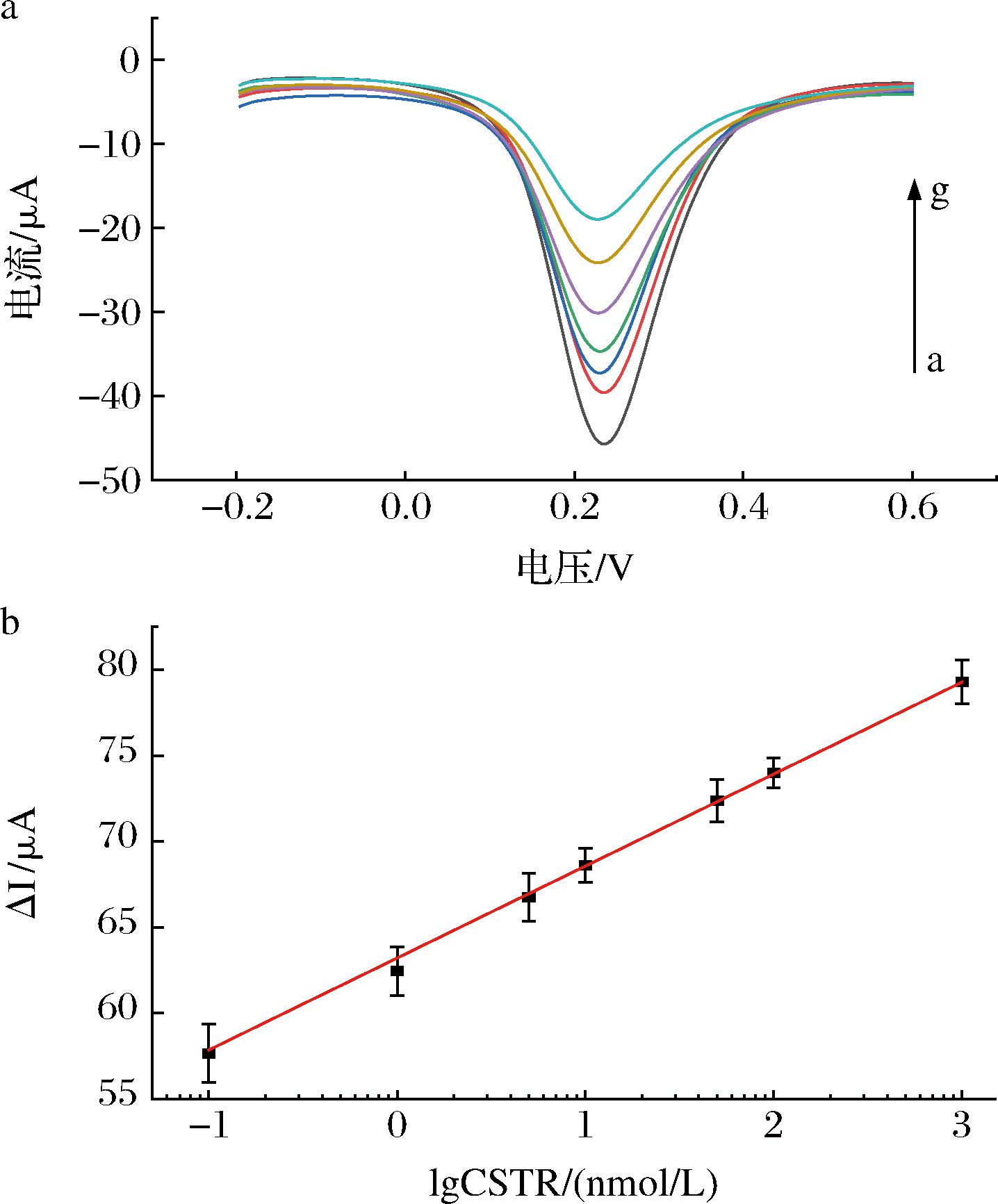
a-DPV曲线;b-标准曲线
图10 仿生印迹电化学传感器对不同浓度STR响应的DPV曲线和标准曲线
Fig.10 DPV curve and standard curve of biomimetic imprinted electrochemical sensor for STR response to different concentrations
注:a图中,a→g分别对应0.1、1、5、10、50、100、1 000 nmol/L。
本研究将该传感器的响应特性与其他STR传感器进行了对比,以进一步明确所构建传感器的优越性。结果如表1所示,所开发的传感器相比相关文献中描述的其他方法性能更好,特别是在检出限、线性范围和制备的便捷性等方面。比对结果表明,该方法能够用于复杂食品基质中痕量STR的快速检测。
表1 不同电化学方法检测STR的性能比较
Table 1 Comparison of different electrochemical methods for STR detection

修饰材料线性范围/(mol/L)检出限/(mol/L)参考文献EGRO-PPy3C8.0×10-8~1.0×10-65.00×10-10[19]Cytc-ZnONPs-MWCNTs2.0×10-8~2.2×10-62.80×10-9[22]Fe3O4@Au-MWNTs-CTS/PbSNPs/Au1.0×10-6~1.0×10-31.50×10-9[23]Au(Ⅲ)-nano-Fe3O48.5×10-11~3.4×10-81.70×10-11[24]GOx-STR1.4×10-11~1.4×10-89.60×10-12[25]CS-GO1.0×10-10~1.0×10-62.59×10-12本研究
2.5 传感器的选择性
为了评价所构建传感器的选择性,本研究选择了双氢链霉素(dihydrostreptomycin,DSTR)、庆大霉素(gentamicin,GEN)、新霉素(neomycin,NEO)和卡那霉素(kanamycin,KAN)等氨基糖苷类药物进行了选择性试验。如图11所示,MIP传感器的响应电流变化均强于NIP传感器。与NIP传感器相比,只有STR引起了明显的电流信号变化,而其他抗生素都没有观察到明显的变化。
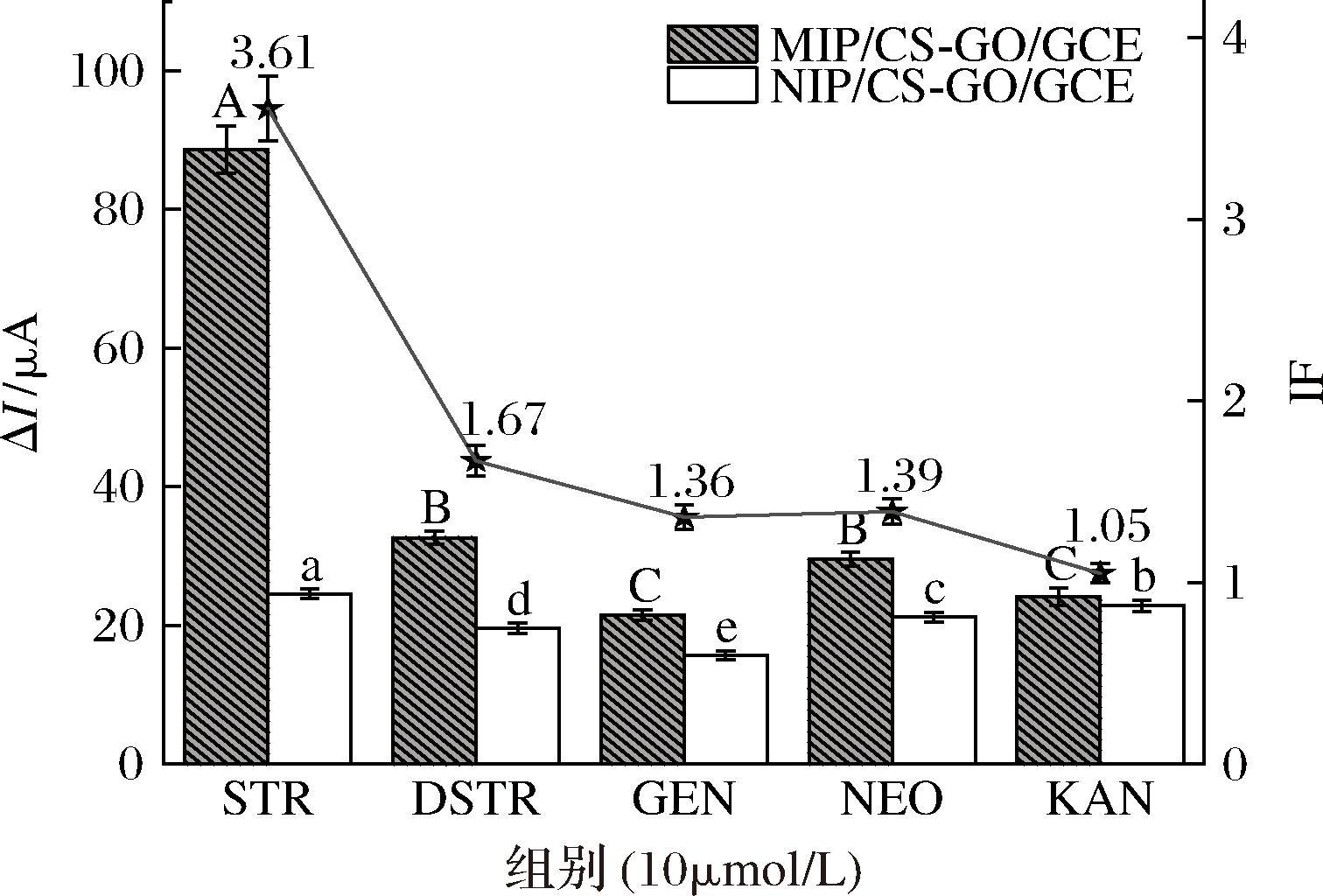
图11 基于MIP和NIP的仿生印迹电化学传感器对不同溶液的选择性测试
Fig.11 Specificity test of the MIP- and NIP-based biomimetic imprinted electrochemical sensor for different slutions
注:不同小写字母表示相同条件基于NIP的仿生印迹电化学传感器对不同底物试验结果间之间存在显著性差异(P<0.05);不同大写字母表示相同条件基于MIP的仿生印迹电化学传感器对不同底物试验结果间之间存在显著性差异(P<0.05);印记因子(imprinting factor,IF)为MIP与NIP结合容量的比值。
2.6 传感器的重现性及稳定性
如图12所示,为表征印迹传感器的重现性,分别在最佳条件下制备了6支相同的MIP/CS-GO/GCE。用10% 乙酸甲醇溶液洗脱后,在10 mmol/L STR溶液中孵育并分别测定其电流响应值,测定结果的相对标准偏差为3.69%。电极使用后经10% 乙酸甲醇溶液再生,对同一电极重复测定6次后,记录并分析其响应电流,电流值的相对标准偏差为3.53%,表明该印迹电极具有较好的重现性。

a-重现性;b-稳定性
图12 STR仿生印迹电化学传感器的重现性和稳定性
Fig.12 Reproducibility and stability of biomimetic imprinted electrochemical sensor for detection of STR
此外,将制备好的电极保存在4 ℃下进行长期稳定性研究,每2 d使用一次,持续12 d。8 d后,电流值下降至原始值的97.07%,第12天下降至原始值的92.51%。试验结果表明,该传感器具有良好的稳定性。同时也表明STR印迹传感界面具有高度稳定的印迹识别位点,可以特异且稳健地识别靶标物质。
2.7 实际样品分析
基于最佳的检测条件,对市售的洋槐蜜、枣花蜜和桂花蜜样品进行分析检测,经上述方法检测并未在样品中检出STR残留。随后,分别在样品中加入浓度为1.0 nmol/L、5.0 nmol/L、10.0 nmol/L、20.0 nmol/L、50 nmol/L、100 nmol/L和500 nmol/L的STR。MIP/CS-GO/GCE在样品溶液中进行孵育后,每个加标样品平行测定5次。由表2可知,平均加标回收率分别为94.78%~106.24%、93.65%~103.81%和97.19%~106.18%,相对标准偏差≤4.28%。结果表明,所建方法在检测过程中无明显的基质干扰,能够满足实际样品中痕量STR残留检测的要求。为进一步验证所建传感分析方法的精准度,分别采用仿生印迹传感检测和高效液相色谱-蒸发光散射法同时检测蜂蜜中STR的浓度,2种方法的测量结果具有较好的相关性(图13),相关系数r分别为0.997 81、0.998 99和0.997 61。结果表明,所建立的传感分析方法与仪器分析方法具有良好的一致性。
表2 仿生印迹电化学传感器检测蜂蜜中STR
Table 2 Detection of STR with the biomimetic imprinted electrochemical sensor in honey
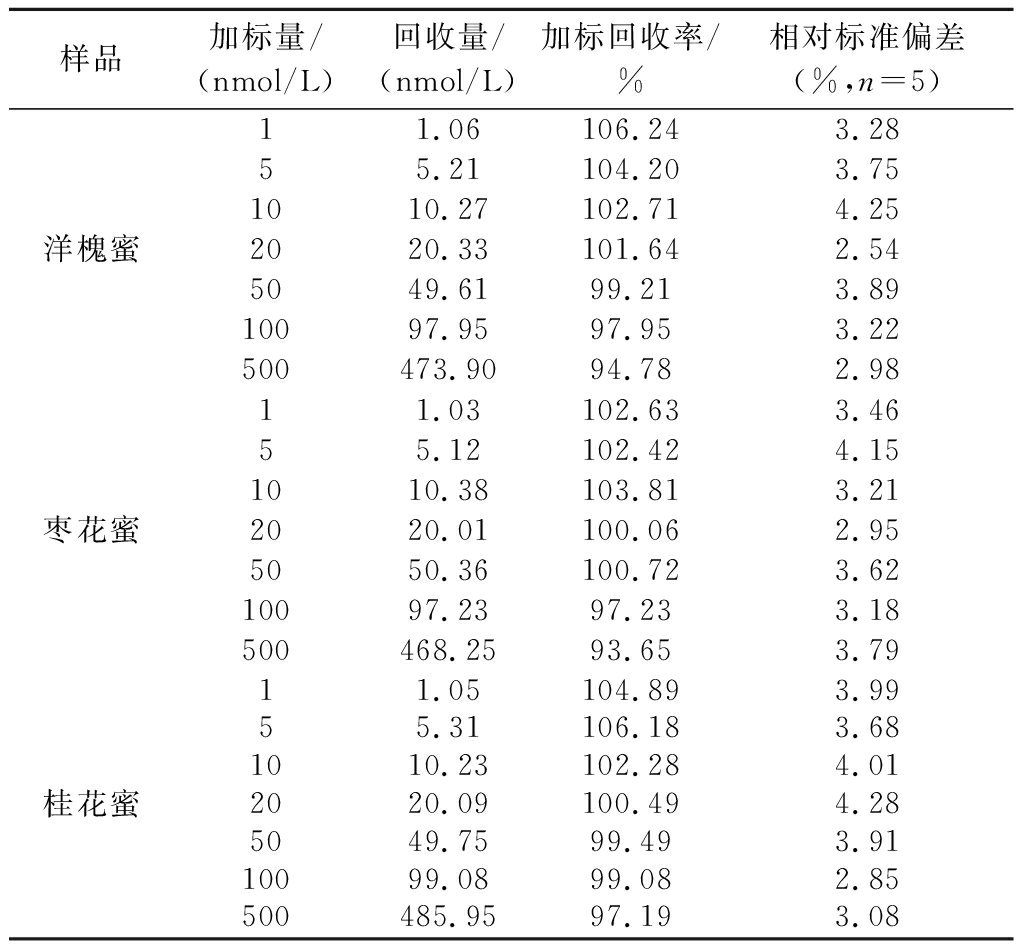
样品加标量/(nmol/L)回收量/(nmol/L)加标回收率/%相对标准偏差(%,n=5)洋槐蜜11.06106.243.2855.21104.203.751010.27102.714.252020.33101.642.545049.6199.213.8910097.9597.953.22500473.9094.782.98枣花蜜11.03102.633.4655.12102.424.151010.38103.813.212020.01100.062.955050.36100.723.6210097.2397.233.18500468.2593.653.79桂花蜜11.05104.893.9955.31106.183.681010.23102.284.012020.09100.494.285049.7599.493.9110099.0899.082.85500485.9597.193.08
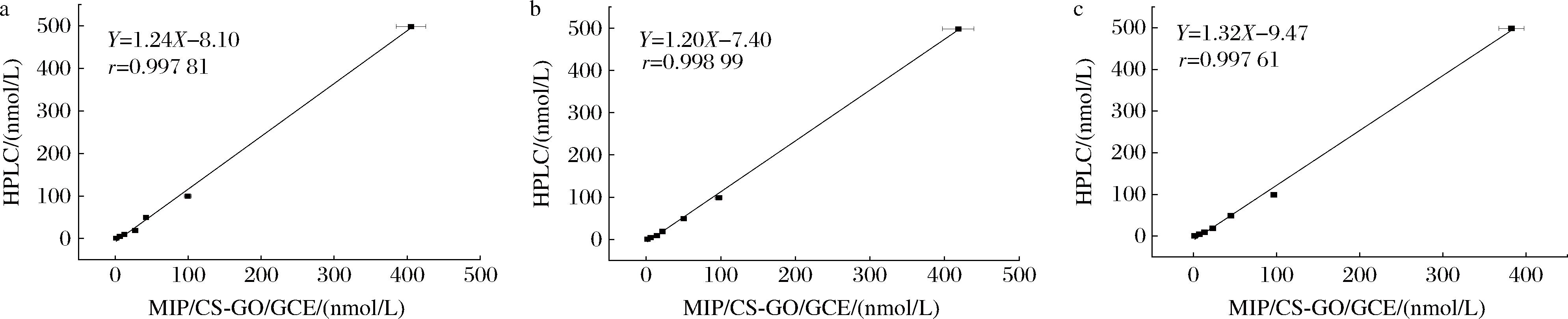
a-洋槐蜜;b-枣花蜜;c-桂花蜜
图13 MIP/CS-GO/GCE法和HPLC法检测蜂蜜样品的结果相关性
Fig.13 Correlation between MIP/CS-GO/GCE method and HPLC method to detect the results of honey samples
对实际样品的分析结果显示,所建立的仿生印迹传感器具有良好的分析性能,传感器在相应的电位区间未检测到空白样品提取液的电化学响应值,样品的基质效应对检测结果影响较小,这表明MIP/CS-GO/GCE仿生印迹传感界面的特异性较好,相应的样品前处理方法能够满足检测需要。所建立的仿生印迹传感检测方法具有良好的选择性,能有效避免干扰,可以准确、灵敏和稳键检测蜂蜜中的STR残留。
3 结论
本文以CS-GO为纳米增敏材料,以OPD和3-APBA 为复合功能单体,构建了仿生印迹传感界面,开发了一种用于痕量STR残留检测的新型仿生印迹电化学传感器。该传感器线性范围为1.0×10-10~1.0×10-6 mol/L,检测限为2.59×10-12 mol/L。在蜂蜜中STR的残留检测过程中,该传感器表现出良好的灵敏度、选择性、重复性和稳定性,可实现实际样品中痕量残留物的高效检测。
[1] SCHATZ A, BUGLE E, WAKSMAN S A. Streptomycin, a substance exhibiting antibiotic activity against gram-positive and gram-negative bacteria[J]. Experimental Biology and Medicine, 1944, 55(1):66-69.
[2] 陈溪, 曲世超, 黄大亮, 等. 链霉素在动物体内残留和代谢的研究进展[J]. 检验检疫学刊, 2015, 25(4):49-51.CHEN X, QU S C, HUANG D L, et al. Research progress on residues and metabolism of streptomycin in animals[J]. Journal of Inspection and Quarantine, 2015, 25(4):49-51.
[3] 江虹, 黄冬梅. 金莲橙OO与链霉素的显色反应及应用[J]. 化学试剂, 2008, 30(2):129-131.JIANG H, HUANG D M. Color reactions of tropeolin OO with streptomycin and their analytical applications[J]. Chemical Reagents, 2008, 30(2):129-131.
[4] FRUGERI P M, DO LAGO A C, WISNIEWSKI C, et al. A spectrophotometric flow injection system for streptomycin determination in veterinary samples[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2014, 117:304-308.
[5] WANG X R, YANG S P, LI Y, et al. Optimization and application of parallel solid-phase extraction coupled with ultra-high performance liquid chromatography-tandem mass spectrometry for the determination of 11 aminoglycoside residues in honey and royal jelly[J]. Journal of Chromatography A, 2018, 1542:28-36.
[6] IANNI F, PUCCIARINI L, CAROTTI A, et al. Hydrophilic interaction liquid chromatography of aminoglycoside antibiotics with a diol-type stationary phase[J]. Analytica Chimica Acta, 2018, 1044:174-180.
[7] KOWALSKI P, OL![]() DZKA I, LAMPARCZYK H. Capillary electrophoresis in analysis of veterinary drugs[J]. Journal of Pharmaceutical and Biomedical Analysis, 2003, 32(4-5):937-947.
DZKA I, LAMPARCZYK H. Capillary electrophoresis in analysis of veterinary drugs[J]. Journal of Pharmaceutical and Biomedical Analysis, 2003, 32(4-5):937-947.
[8] MORENO-GONZ LEZ D, LARA F J, JURGOVSK
LEZ D, LARA F J, JURGOVSK N, et al. Determination of aminoglycosides in honey by capillary electrophoresis tandem mass spectrometry and extraction with molecularly imprinted polymers[J]. Analytica Chimica Acta, 2015, 891:321-328.
N, et al. Determination of aminoglycosides in honey by capillary electrophoresis tandem mass spectrometry and extraction with molecularly imprinted polymers[J]. Analytica Chimica Acta, 2015, 891:321-328.
[9] D EZ C, GUILLARME D, STAUB SPÖRRI A, et al. Aminoglycoside analysis in food of animal origin with a zwitterionic stationary phase and liquid chromatography-tandem mass spectrometry[J]. Analytica Chimica Acta, 2015, 882:127-139.
EZ C, GUILLARME D, STAUB SPÖRRI A, et al. Aminoglycoside analysis in food of animal origin with a zwitterionic stationary phase and liquid chromatography-tandem mass spectrometry[J]. Analytica Chimica Acta, 2015, 882:127-139.
[10] GREMILOGIANNI A M, MEGOULAS N C, KOUPPARIS M A. Hydrophilic interaction vs ion pair liquid chromatography for the determination of streptomycin and dihydrostreptomycin residues in milk based on mass spectrometric detection[J]. Journal of Chromatography A, 2010, 1217(43):6646-6651.
[11] ARSAND J B, JANK L, MARTINS M T, et al. Determination of aminoglycoside residues in milk and muscle based on a simple and fast extraction procedure followed by liquid chromatography coupled to tandem mass spectrometry and time of flight mass spectrometry[J]. Talanta, 2016, 154:38-45.
[12] DU B Y, WEN F, GUO X D, et al. Evaluation of an ELISA-based visualization microarray chip technique for the detection of veterinary antibiotics in milk[J]. Food Control, 2019, 106:106713.
[13] DU B Y, WEN F, ZHANG Y D, et al. Presence of tetracyclines, quinolones, lincomycin and streptomycin in milk[J]. Food Control, 2019, 100:171-175.
[14] WEI D L, ZHANG X Y, CHEN B, et al. Using bimetallic Au@Pt nanozymes as a visual tag and as an enzyme mimic in enhanced sensitive lateral-flow immunoassays: Application for the detection of streptomycin[J]. Analytica Chimica Acta, 2020, 1126:106-113.
[15] ALHAMMADI M, ALIYA S, UMAPATHI R, et al. A simultaneous qualitative and quantitative lateral flow immunoassay for on-site and rapid detection of streptomycin in pig blood serum and urine[J]. Microchemical Journal, 2023, 195:109427.
[16] WU J X, ZHANG S E, ZHOU X P. Monoclonal antibody-based ELISA and colloidal gold-based immunochromatographic assay for streptomycin residue detection in milk and swine urine[J]. Journal of Zhejiang University. Science. B, 2010, 11(1):52-60.
[17] 马秋霞, 刘楠, 丛黎明, 等. 改进的FilmplateTM纸片法与国标法检测大肠菌群数的比较[J]. 解放军预防医学杂志, 2015, 33(1):14-17.MA Q X, LIU N, CONG L M, et al. Comparison between modified filmplateTM method and national standard method for the detection of coliform groups[J]. Journal of Preventive Medicine of Chinese PLA, 2015, 33(1):14-17.
[18] 蔡金华, 刘雅妮, 顾欣. 链霉素在牛奶中残留的微生物学检测方法[J]. 中国兽药杂志, 2004, 38(11):7-9.CAI J H, LIU Y N, GU X. Determination of streptomycin residues in milkby microbiologic inhibition tests[J]. Chinese Journal of Veterinary Drug, 2004, 38(11):7-9.
[19] WEN Y P, LIAO X N, DENG C X, et al. Imprinted voltammetric streptomycin sensor based on a glassy carbon electrode modified with electropolymerized poly(pyrrole-3-carboxy acid) and electrochemically reduced graphene oxide[J]. Microchimica Acta, 2017, 184(3):935-941.
[20] 温馨, 刘静, 赵斯琴, 等. GO/介孔TiO2复合材料的制备及性能研究[J]. 化学试剂, 2018, 40(7):623-628.WEN X, LIU J, ZHAO S Q, et al. Preparation and properties of GO/TiO2 mesoporous composites[J]. Chemical Reagents, 2018, 40(7):623-628.
[21] 李荣强, 张军丽, 闫永康. GO-CMWNTs-CS-GCE电极检测腐败小白菜中亚硝酸盐的含量[J]. 化学试剂, 2018, 40(3):235-238.LI R Q, ZHANG J L, YAN Y K. Electrochemical detection of nitrite content in corrupt Chinese cabbage by GO-CMWNTs-CS-GCE electrode[J]. Chemical Reagents, 2018, 40(3):235-238.
[22] CHOKKAREDDY R, REDHI G G, THANGAVEL K. Cytochrome c/multi-walled carbon nanotubes modified glassy carbon electrode for the detection of streptomycin in pharmaceutical samples[J]. Analytical Sciences: the International Journal of the Japan Society for Analytical Chemistry, 2021, 37(9):1265-1273.
[23] HU Y F, ZHANG Z H, ZHANG H B, et al. Selective and sensitive molecularly imprinted Sol-gel film-based electrochemical sensor combining mercaptoacetic acid-modified PbS nanoparticles with Fe3O4@Au-multi-walled carbon nanotubes-chitosan[J]. Journal of Solid State Electrochemistry, 2012, 16(3):857-867.
[24] LIU B Q, TANG D P, ZHANG B, et al. Au(III)-promoted magnetic molecularly imprinted polymer nanospheres for electrochemical determination of streptomycin residues in food[J]. Biosensors &Bioelectronics, 2013, 41:551-556.
[25] QUE X H, LIU B Q, FU L B, et al. Molecular imprint for electrochemical detection of streptomycin residues using enzyme signal amplification[J]. Electroanalysis, 2013, 25(2):531-537.