水苏糖是一种功能性低聚糖,可作为碳源促进乳酸菌增殖,是颇具应用前景的低聚糖类益生元[1-2]。但水苏糖在乳酸菌中的代谢途径尚未被完全解析,因此,本研究尝试建立一种水苏糖及其代谢产物含量测定的HPLC方法,通过水苏糖及其代谢产物含量的动态变化为阐释水苏糖在乳酸菌中的代谢途径提供技术支撑。目前糖类测定的方法主要是HPLC[3-7],且其检测主要与液相色谱仪中配备的检测器相关。糖类物质测定的检测器主要有紫外检测器、示差检测器和蒸发光检测器(evaporative light scattering detector, ELSD)[8-9]。由于糖类物质结构中无发色基团[10],使用紫外检测器、示差检测器检测时,常需对糖类物质进行衍生化等前处理,操作过程复杂,且重现性差[11]。而ELSD检测时,无需对糖类进行衍生前处理,且检测结果灵敏度高[12],故被广泛关注。BEPARY等[13]使用HPLC-ELSD方法有效分离测定了米豆中的水苏糖等多种糖类物质;陈泽麟等[14]利用HPLC-ELSD同时测定了丹参、川芎嗪注射液中间体中的水苏糖和棉子糖等物质;ZHANG等[15]利用HPLC-ELSD测定了桔梗中水苏糖及棉子糖等多种糖类物质。为了实验的简便性,同时为减少相对误差,应探索能在同一设备同时完成水苏糖及其代谢产物检测的方法,而HPLC-ELSD法能否同时分析测定水苏糖及其代谢产物,目前尚未见相关报道。综上,本研究拟建立一种操作简便、重现性和稳定性较好的检测水苏糖及其代谢产物含量的HPLC-ELSD方法,以期为阐释水苏糖在乳酸菌中的代谢途径提供技术支持,对揭示益生元及益生菌的互作具有现实意义。
1 材料与方法
1.1 材料与试剂
水苏糖、棉籽糖及蜜二糖标准品,上海源叶生物科技公司;蔗糖、半乳糖、果糖标及葡萄糖标准品(纯度均≥98.0%),美国Sigma-Aldrich公司;乙腈(色谱纯),天津赛孚瑞科技有限公司;氨水、Tween-80,广州化学试剂厂;浓硫酸,佛山惠欣化学品公司;苯酚,天津市永大化学公司。
1.2 仪器与设备
Agilent 1260 Infinity蒸发光散射检测器、HPLC 1260-Ⅱ Infinity,美国安捷伦公司;循环水式真空泵、微孔过滤膜(有机系)0.45 μm,天津市津腾实验设备有限公司;Waters BEH XBridge Amide色谱柱(4.6 mm×250 mm, 5 μm),沃特世(Waters)公司;ME104型电子分析天平,梅特勒-托利多精密仪器公司。
1.3 实验方法
1.3.1 色谱条件的优化
1.3.1.1 ELSD载气流速的优化
载气流速为1.0~2.0 mL/min,以0.2 mL/min为单位间隔取6个载气流速,比较不同载气流速对信号值和信噪音比的影响。
1.3.1.2 ELSD漂移管温度的优化
漂移管温度范围为50~75 ℃,以5 ℃为点位间隔取6个温度,对比不同漂移管温度对信号值和信噪比的影响。
1.3.1.3 流动相比例对分离度的影响
固定流动相流速为1.0 mL/min,ELSD载气流速为1.2 mL/min,漂移管温度50 ℃,改变流动相(乙腈∶水)的体积比,比较不同比例流动相对样品分离度的影响。
1.3.1.4 流动相流速的优化
流动相流速为0.6~1.0 mL/min,以0.1 mL/min单位间隔取5个流速,对比不同流速对组分保留时间的影响。
1.3.2 方法学评价
1.3.2.1 加标回收率试验
制备含量依次为1.0、1.5、2.0、2.5、3.0 mg的各个糖加标样品溶液。在最佳色谱条件下检测,实验重复测定3次,计算各种糖的回收量、回收率、平均回收及相对标准偏差(relative standard deviation, RSD)。
1.3.2.2 定量限和检出限计算方法
参照TEIXEIRA等[16]的方法,定量限和检出限分别按照信噪比S/N=10∶1、S/N=3∶1进行计算,建立检测回归方程。
1.3.2.3 精密度评价
参照王梦等[17]的方法将配置的标准溶液平均分成6份,以最优色谱条件测定并计算各个糖类组分峰面积的RSD。
1.4 数据分析处理
实验数据采用SPSS 26软件进行统计分析,结果以平均值±标准偏差表示,数据图表采用Origin 2022软件进行绘制。
2 结果与分析
2.1 色谱条件的优化
2.1.1 ELSD参数优化
2.1.1.1 载气流速的优化
ELSD中载气流速的变化影响待测组分在雾化过程中形成雾状颗粒的大小,从而影响待测组分在ELSD中的响应[18]。为优化载气流速对待测组分的信号值和信噪比的影响,保证其余条件不变,对比不同载气流速对组分在检测器中信号值和信噪比的影响,设置漂移管温度为60 ℃,探究ELSD载气流速对7种糖类组分在ELSD检测器上信号值及信噪比的影响。如图1-A所示,随载气流速升高,糖类组分信号值变化均呈现先上升后下降的趋势,在载气流速为1.6 mL/min时达到最大值。另一方面,载气流速同时影响检测信噪比,载气流速过小时流动相可能蒸发不完全,导致基线噪音增大。如图1-B所示,糖类组分的信噪比变化随载气流速升高呈现相同的变化趋势,随着载气流速升高,信噪比同样呈现先升后降的趋势,并在1.6 mL/min时达到最大值。因此,选择1.6 mL/min为最佳载气流速。
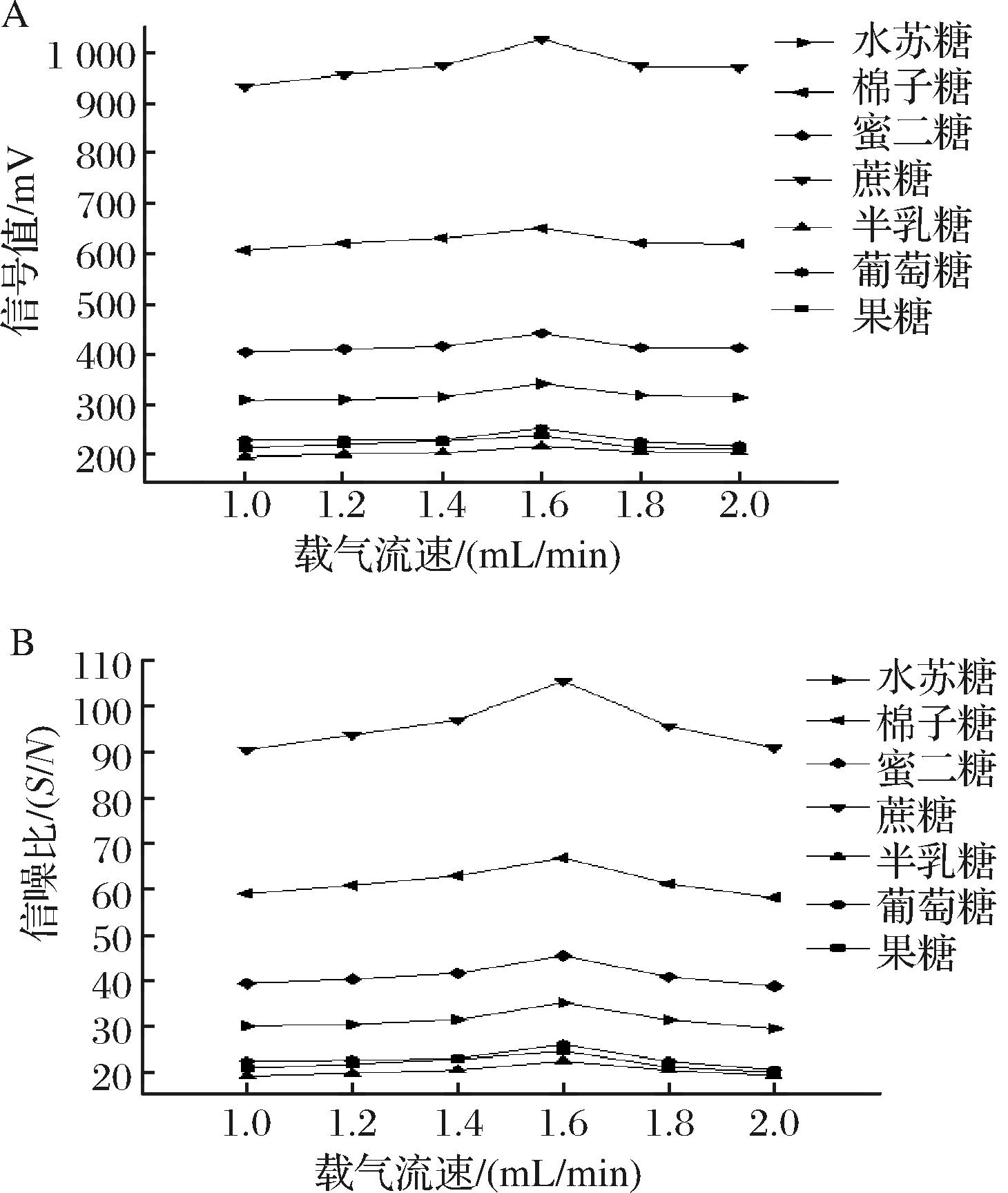
A-载气流速对信号值的影响;B-载气流速对信噪比的影响
图1 载气流速对信号值及信噪比的影响
Fig.1 Effect of carrier gas velocity on signal value and signal-to-noise ratio
2.1.1.2 漂移管温度优化
考虑到漂移管温度在40 ℃时,流动相未能完全蒸发,导致基线饱和,因此以50 ℃为起始温度进行漂移管温度优化。如图2-A所示,糖类组分信号值呈现先升高后下降的趋势,最终趋于稳定,在60 ℃时所有糖类组分在ELSD上均达到最大响应。此外,糖类组分的信噪比变化呈先增加后降低的趋势,当温度为50 ℃时具有较好的信噪比,随着漂移管温度升高,在60 ℃时信噪比达到峰值(图2-B)。温度变化会影响物质在检测器上的响应,温度过低时流动相无法完全蒸发,而温度过高,虽能提高信噪比,但过高的温度会使样品汽化,导致信号值过小[19]。因此,应在使流动相基本蒸发完全的基础上,选择具有可接受噪音的最低温度。本实验中,55、60、65 ℃条件时,60 ℃下信噪比最高,且同样具有较好的糖类组分信号值。因此,选择60 ℃作为最佳漂移管温度。
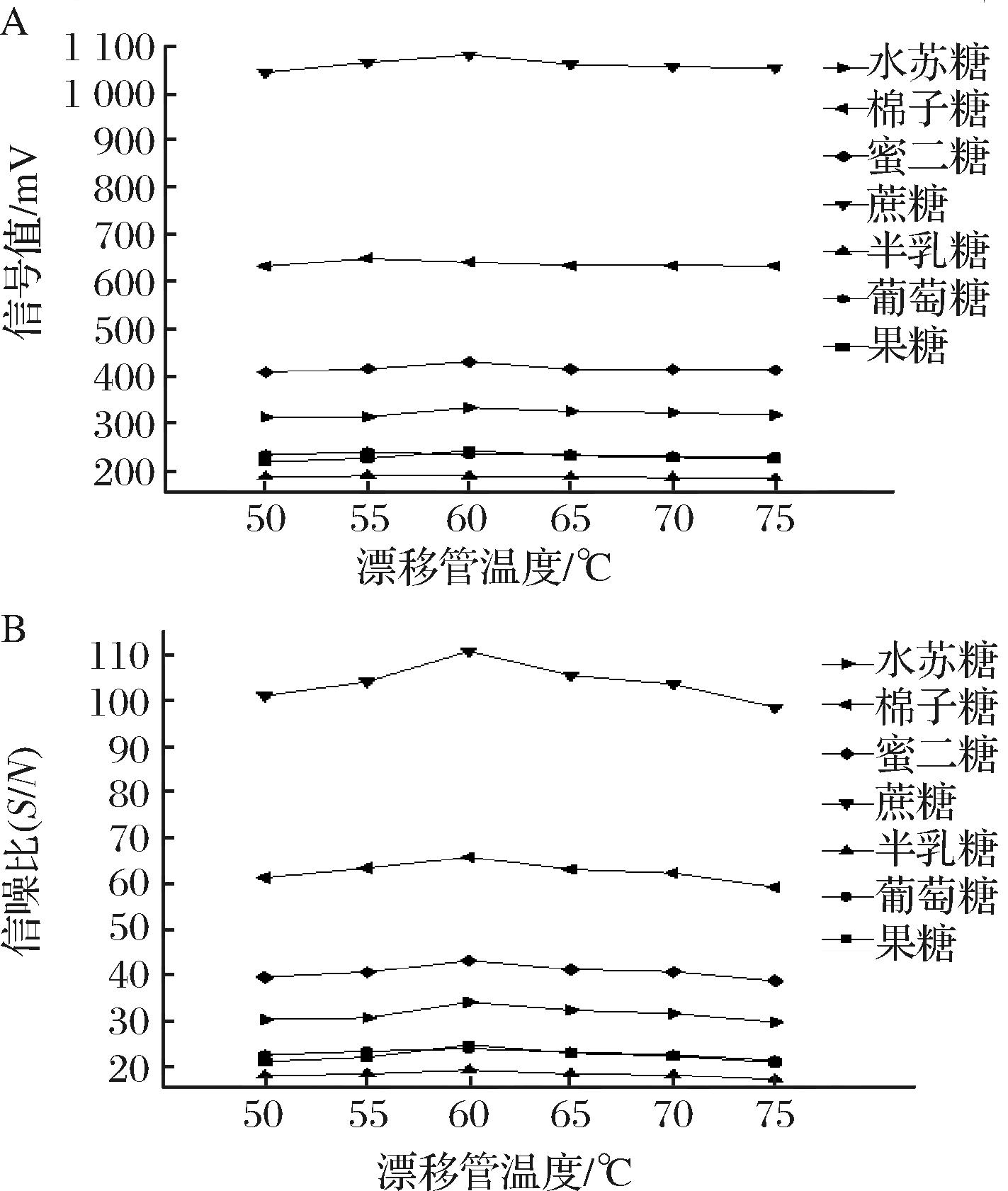
A-漂移管温度对信号值的影响;B-漂移管温度对信噪比的影响
图2 漂移管温度对信号值及信噪比的影响
Fig.2 Effect of drift tube temperature on signal value and signal-to-noise ratio
2.1.2 流动相比例对分离度的影响
采用乙腈和水作为分离糖类组分的流动相,通过改变流动相比例对糖类组分进行洗脱。如图3所示,随着有机相比例的不断增加,所有试验的糖类组分在色谱柱上的保留时间都延长,同时检出的含量存在差异。因不同糖类组分在水相中的溶解度不同,当有机相比例增加时,糖类组分溶解度下降,在色谱柱的保留时间延长。而当水相比例增加时,在色谱柱的保留时间相当,易出现信号重叠,降低分离度,其中的单糖在水相比例较大时发生重叠现象更为明显。V(乙腈)∶V(水)=80∶20条件下的分离效果最好,能较好分离各种糖,峰形尖锐对称性好,但葡萄糖和半乳糖无法达成基线分离。葡萄糖和半乳糖互为差向异构体,高温以及高pH条件可使葡萄糖和半乳糖相互转换[20],但温度和pH的变化会使其他糖类组分的分离受到影响。因此,将柱温稳定在室温,虽然不能使得葡萄糖和半乳糖达到基线分离,但可采取垂线分峰法的方式,计算出2个组分的完整峰面积[21]。综上,采取流动相比例为V(乙腈)∶V(水)=80∶20作为后续实验的最佳流动相比例。

A-V(乙腈)∶V(水)=60∶35;B-V(乙腈)∶V(水)=70∶30;C-V(乙腈)∶V(水)=75∶25;D-V(乙腈)∶V(水)=80∶20;E-V(乙腈)∶V(水)=85∶15
图3 不同流动相比例色谱图
Fig.3 Proportional chromatogram of different mobile phases
注:图中数字1~7对应色谱峰分别代表:果糖、葡萄糖、半乳糖、蔗糖、蜜二糖、棉子糖、水苏糖。
2.1.3 流动相流速对保留时间的影响
流动相流速会对组分在色谱柱中的保留时间产生一定影响,流动相流速过大或过小都会影响待测物质在检测器中的响应,过慢会使分析时间延长且准确度降低,过高会时使组分重叠,且柱压升高,导致柱子内的填料塌陷[22]。在使用Waters BEH Amide色谱柱时,为了维持色谱柱的柱效,流动相的流速应控制在合适范围内。本研究将流动相流速控制在0.6~1.0 mL/min,分析流动相流速对糖类组分测定时间的影响,以确定最佳流速条件。如图4-A所示,随着流动相流速增加,各种组分之间保留时间逐渐缩短,其中分子量大的组分更易受流速影响。但不同流动相流速条件下,各糖类组分均可以有效分离,表明流动相流速对7种糖组分的分离度影响不明显。然而,当流速过低时,色谱峰的纵向扩散增大,导致峰宽变宽,色谱峰的对称性下降,从而影响定量结果。综上,当流速为1.0 mL/min时,所有样品的分析时间缩短,分离度较好,峰的对称性较好。
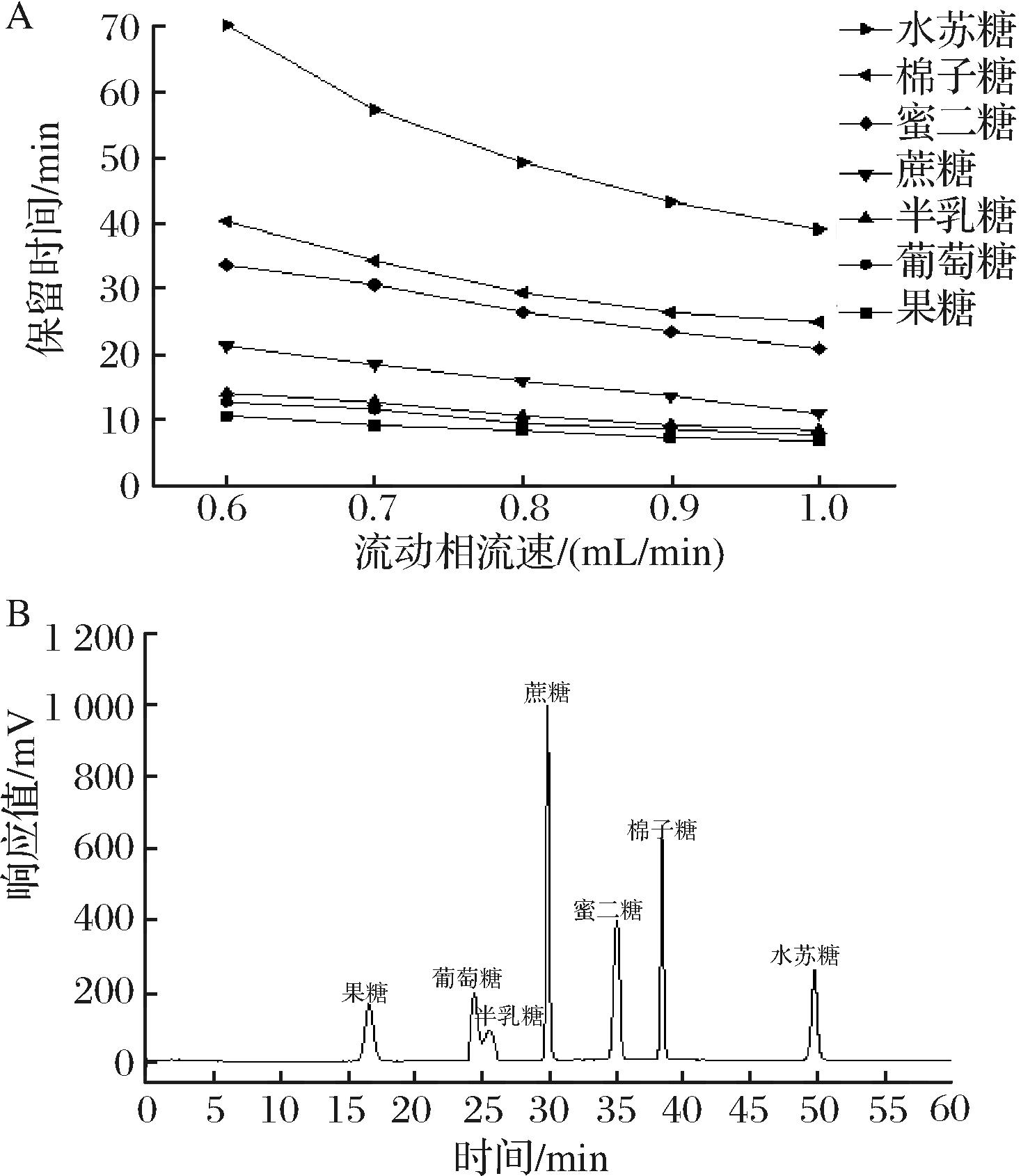
图4 流动相流速对保留时间的影响及7种混合标准糖的HPLC色谱图
Fig.4 Effect of mobile phase flow rate on retention time and HPLC chromatograms of seven mixed standard sugars
根据上述4个色谱条件因素的优化结果,筛选出分离7种糖类组分的最佳色谱条件为:使用Waters BEH Xbridge Amide色谱柱联合ELSD检测器,流动相为V(乙腈)∶V(水)=80∶20,流动相流速为1.0 mL/min,ELSD检测器条件为漂移管温度60 ℃、载气流速为1.6 mL/min。在该条件下,得到了水苏糖及其代谢产物混合标准品的分离色谱图(图4-B)。
2.2 方法学评价
2.2.1 加标回收试验
通过加标回收率评估分析方法的准确性和可靠性。如表1所示,水苏糖、棉籽糖、蜜二糖、蔗糖、葡萄糖、半乳糖、果糖的平均回收率为95.91%~99.13%,RSD为0.98%~3.61%(RSD<5%),说明该色谱条件对检测水苏糖及其代谢产物准确可靠。
表1 加标回收结果(n=5)
Table 1 Result of recycling with added label (n=5)
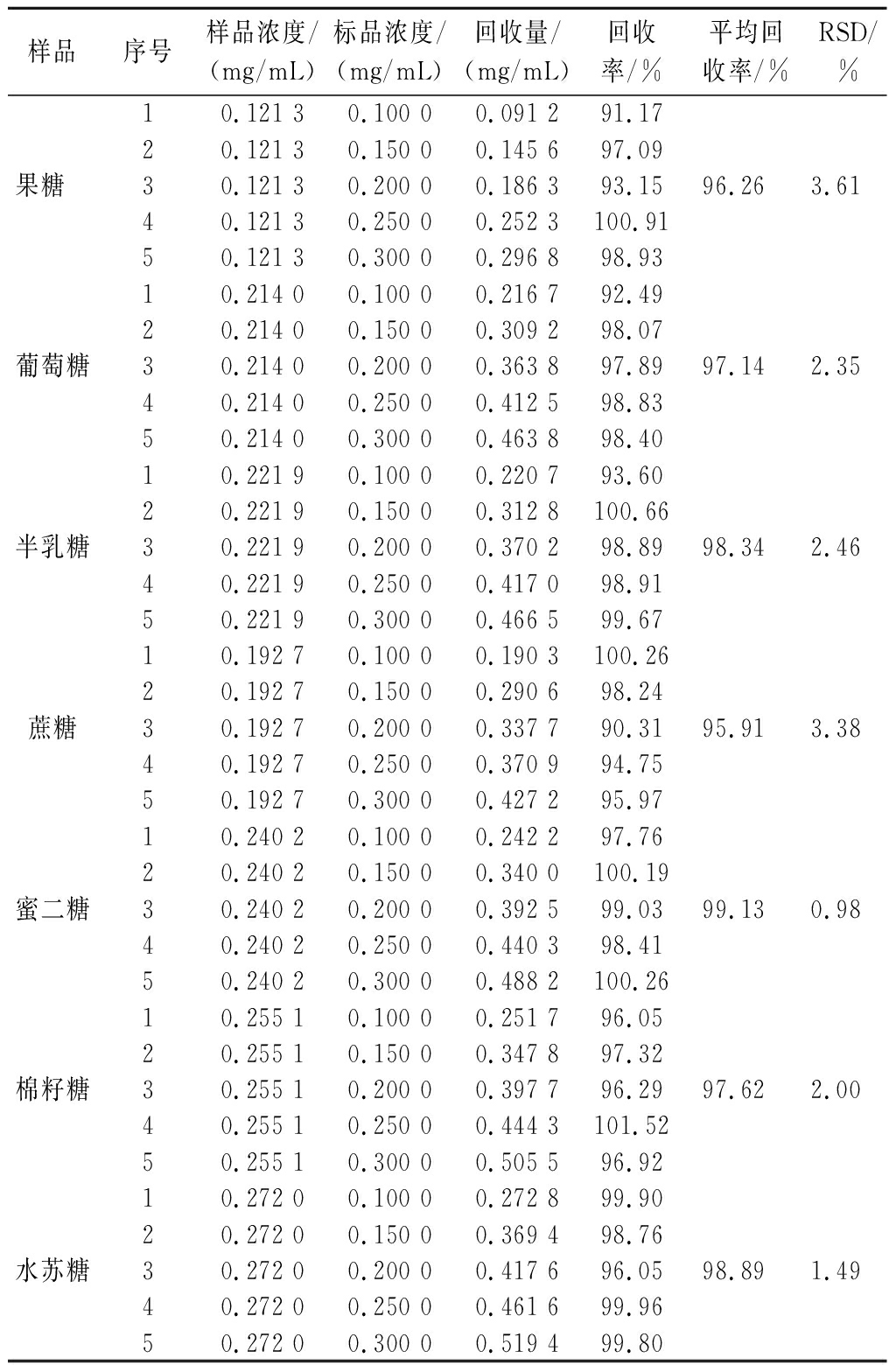
样品序号样品浓度/(mg/mL)标品浓度/(mg/mL)回收量/(mg/mL)回收率/%平均回收率/%RSD/%果糖 10.121 30.100 00.091 291.1720.121 30.150 00.145 697.0930.121 30.200 00.186 393.1540.121 30.250 00.252 3100.9150.121 30.300 00.296 898.9396.263.61葡萄糖10.214 00.100 00.216 792.4920.214 00.150 00.309 298.0730.214 00.200 00.363 897.8940.214 00.250 00.412 598.8350.214 00.300 00.463 898.4097.142.35半乳糖10.221 90.100 00.220 793.6020.221 90.150 00.312 8100.6630.221 90.200 00.370 298.8940.221 90.250 00.417 098.9150.221 90.300 00.466 599.6798.342.46蔗糖10.192 70.100 00.190 3100.2620.192 70.150 00.290 698.2430.192 70.200 00.337 790.3140.192 70.250 00.370 994.7550.192 70.300 00.427 295.9795.913.38蜜二糖10.240 20.100 00.242 297.7620.240 20.150 00.340 0100.1930.240 20.200 00.392 599.0340.240 20.250 00.440 398.4150.240 20.300 00.488 2100.2699.130.98棉籽糖10.255 10.100 00.251 796.0520.255 10.150 00.347 897.3230.255 10.200 00.397 796.2940.255 10.250 00.444 3101.5250.255 10.300 00.505 596.9297.622.00水苏糖10.272 00.100 00.272 899.9020.272 00.150 00.369 498.7630.272 00.200 00.417 696.0540.272 00.250 00.461 699.9650.272 00.300 00.519 499.8098.891.49
2.2.2 检出限及定量限分析
基于前述优化的HPLC-ELSD检测条件,得到水苏糖及其代谢产物的标准曲线回归方程及相关系数,并进一步测定本方法对水苏糖、棉籽糖、蜜二糖、蔗糖、葡萄糖、半乳糖、果糖7种糖类组分的检出限及定量限。结果如表2所示,上述7种糖类组分的检出限为5.32~20.00 μg/mL,定量限为16.27~68.25 μg/mL,该方法对于水苏糖及其代谢产物的检测具有很高的灵敏度。
表2 七种糖的标准曲线
Table 2 Standard curve of seven sugars
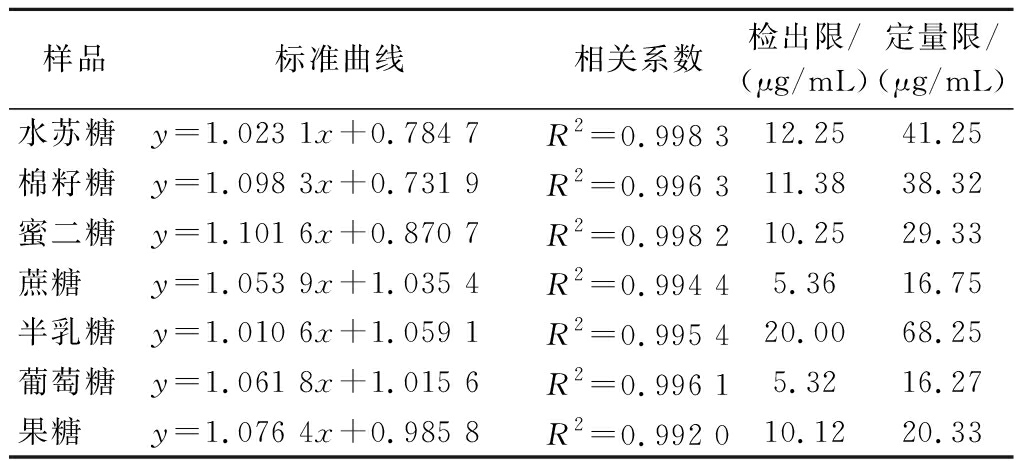
样品标准曲线相关系数检出限/(μg/mL)定量限/(μg/mL)水苏糖y=1.023 1x+0.784 7R2=0.998 312.2541.25棉籽糖y=1.098 3x+0.731 9R2=0.996 311.3838.32蜜二糖y=1.101 6x+0.870 7R2=0.998 210.2529.33蔗糖y=1.053 9x+1.035 4R2=0.994 45.3616.75半乳糖y=1.010 6x+1.059 1R2=0.995 420.0068.25葡萄糖y=1.061 8x+1.015 6R2=0.996 15.3216.27果糖y=1.076 4x+0.985 8R2=0.992 010.1220.33
2.2.3 精密度分析
如表3所示,水苏糖、棉籽糖、蜜二糖、蔗糖、葡萄糖、半乳糖、果糖的RSD分别为1.69%、1.56%、1.73%、1.00%、1.65%、1.30%、1.06%,表明本试验所建立的水苏糖及其代谢产物糖类组分HPLC-ELSD检测方法的精密度良好。
表3 进样精密度结果(n=6)
Table 3 Precision result of injection (n=6)
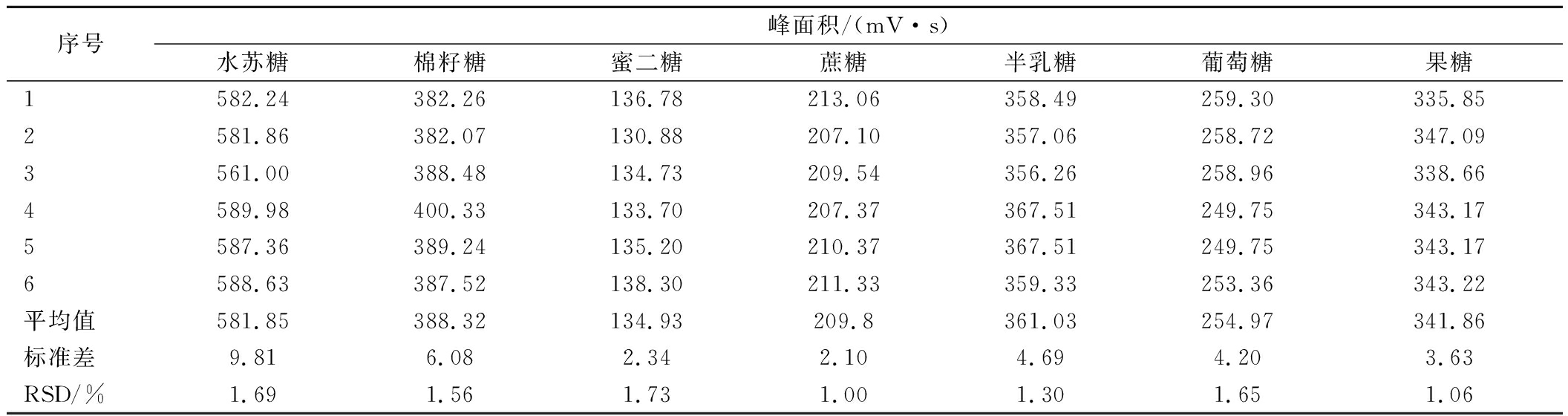
序号峰面积/(mV·s)水苏糖棉籽糖蜜二糖蔗糖半乳糖葡萄糖果糖1582.24382.26136.78213.06358.49259.30335.852581.86382.07130.88207.10357.06258.72347.093561.00388.48134.73209.54356.26258.96338.664589.98400.33133.70207.37367.51249.75343.175587.36389.24135.20210.37367.51249.75343.176588.63387.52138.30211.33359.33253.36343.22平均值581.85388.32134.93209.8361.03254.97341.86标准差9.816.082.342.104.694.203.63RSD/%1.691.561.731.001.301.651.06
3 结论
水苏糖是一种能通过有效促进益生菌生长调节肠道微生物菌群的益生元[23]。本研究建立了检测乳酸菌中水苏糖及其代谢产物的HPLC-ELSD分析方法,优化得到了最佳色谱条件如下:使用Waters BEH Amide色谱柱结合ELSD检测器,洗脱条件为V(乙腈)∶V(水)=80∶20、流动相流速为1.0 mL/min,ELSD检测器条件为温度60 ℃,载气流速1.0 mL/min。用本方法检测水苏糖及其代谢产物,精密度为1.00~1.73,检出限在20.00 μg/mL以下,定量限在68.25 μg/mL以下,加标回收率达95.91%~99.13%。本方法适用于水苏糖及其代谢产物的检测,精密度良好,分离效果和检测重现性好,稳定性高,可以为乳酸菌中水苏糖及其代谢产物的检测及其代谢途径研究提供基础。
[1] 段盛林. 水苏糖的益生元活性及其应用研究进展[J].中国食品添加剂, 2023, 34(1):75-82.DUAN S L.Research progress on prebiotic activity and application of stachyose[J].China Food Additives, 2023, 34(1):75-82.
[2] ZHONG X F, ZHANG Y B, HUANG G D, et al.Proteomic analysis of stachyose contribution to the growth of Lactobacillus acidophilus CICC22162[J].Food and Function, 2018, 9(5):2979-2988.
[3] MARRUBINI G, APPELBLAD P, MAIETTA M, et al.Hydrophilic interaction chromatography in food matrices analysis:An updated review[J].Food Chemistry,2018, 257:53-66.
[4] KIELY L J, HICKEY R M.Characterization and analysis of food-sourced carbohydrates[J].Methods in Molecular Biology,2022, 2370:67-95.
[5] DOLASHKA P, DASKALOVA A, DOLASHKI A, et al.De novo structural determination of the oligosaccharide structure of hemocyanins from molluscs[J].Biomolecules,2020, 10(11):1470.
[6] 苏骏敏, 沈昌莹, 张树权.食品中糖的检测方法研究进展[J].现代食品, 2022, 28(6):43-47.SU J M, SHEN C Y, ZHANG S Q.Research progress on the detection methods of sugar content in food[J].Modern Food, 2022, 28(6):43-47.
[7] YEGANEH-ZARE S, FARHADI K, AMIRI S.Rapid detection of apple juice concentrate adulteration with date concentrate, fructose and glucose syrup using HPLC-RID incorporated with chemometric tools[J].Food Chemistry, 2022, 370:131015.
[8] MCGINNIS G D, LAVER M L, BIERMANN C J.High-Performance Liquid Chromatography (HPLC) of Carbohydrates[M].Boca Raton:CRC Press, 2021:19-26.
[9] COELHO E M, DA SILVA PADILHA C V, MISKINIS G A, et al.Simultaneous analysis of sugars and organic acids in wine and grape juices by HPLC:Method validation and characterization of products from northeast Brazil[J].Journal of Food Composition and Analysis, 2018, 66:160-167.
[10] LV Y, YANG X B, ZHAO Y, et al.Separation and quantification of component monosaccharides of the tea polysaccharides from Gynostemma pentaphyllum by HPLC with indirect UV detection[J].Food Chemistry,2009, 112(3):742-746.
[11] 许歆瑶. 糖类化合物分析新方法研究及中药葛根多糖的提取、纯化与结构鉴定[D].上海:上海交通大学, 2020.XU X Y.Study on the analysis of saccharides and the extraction, purification and structure identification of Peuraria polysaccharides[D].Shanghai:Shanghai Jiao Tong University, 2020.
[12] MUIR J G, ROSE R, ROSELLA O, et al.Measurement of short-chain carbohydrates in common Australian vegetables and fruits by high-performance liquid chromatography (HPLC)[J].Journal of Agricultural and Food Chemistry, 2009, 57(2):554-565.
[13] BEPARY R H, WADIKAR D D.HPLC profiling of flatulence and non-flatulence saccharides in eleven ricebean (Vigna umbellata) varieties from North-East India[J].Journal of Food Science and Technology,2019, 56(3):1655-1662.
[14] 陈泽麒, 苟维, 刘飞, 等.HPLC-ELSD同时测定丹参川芎嗪注射液中间体中7种糖类成分[J].中国现代应用药学, 2021, 38(11):1349-1353.CHEN Z Q, GOU W, LIU F, et al.Simultaneous determination of seven saccharides in the intermediates of Danshen Chuanxiongqin injection by HPLC-ELSD[J].Chinese Journal of Modern Applied Pharmacy, 2021, 38(11):1349-1353.
[15] ZHANG H Q, LIU P, DUAN J N, et al.Comparative analysis of carbohydrates, nucleosides and amino acids in different parts of Trichosanthes kirilowii Maxim.by (ultra) high-performance liquid chromatography coupled with tandem mass spectrometry and evaporative light scattering detector methods[J].Molecules, 2019, 24(7):1440.
[16] TEIXEIRA C R V, LANA R P, TAO J Y, et al.Comparing the responses of rumen ciliate protozoa and bacteria to excess carbohydrate[J].FEMS Microbiology Ecology, 2017, 93(6).DOI:10.1093/femsec/fixbo.
[17] 王梦, 周香菊, 聂嘉文, 等.氟虫腈亚砜荧光衍生化、HPLC-FLD检测方法的建立及应用[J].食品工业科技, 2021, 42(20):286-293.WANG M, ZHOU X J, NIE J W, et al.Establishment and application of HPLC-FLD method for fipronil sulfoxide detection by pre-column fluorescence derivatization[J].Science and Technology of Food Industry, 2021, 42(20):286-293.
[18] 宋文杰, 李慧帆, 姜俊羽, 等.基于高效液相色谱技术的啤酒花指纹图谱研究[J].食品与发酵工业, 2022, 48(22):279-284.SONG W J, LI H F, JIANG J Y, et al.Analysis of hops fingerprint based on HPLC[J].Food and Fermentation Industries, 2022, 48(22):279-284.
[19] 仝慧. 高效液相色谱仪的故障分析及解决办法[J].山东化工, 2020, 49(12):88-89;91.TONG H.Fault analysis and treatment methods of high performance liquid chromatography[J].Shandong Chemical Industry, 2020, 49(12):88-89;91.
[20] SHAO X, CAI W, SUN P, et al.Quantitative determination of the components in overlapping chromatographic peaks using wavelet transform[J].Analytical Chemistry, 1997, 69(9):1722-1725.
[21] 陈文明. 色谱重叠峰的解析方法概论[J].中国水运(下半月), 2020,20(5):69-71.CHEN W M.Introduction to analytical methods of chromatographic overlapping peaks[J].China Water Transport, 2020,20(5):69-71.
[22] 董子豪. 高效液相色谱法测定PTA循环水中微量乙酸含量[J]. 聚酯工业, 2023, 36(3): 20-22. DONG Z H. Determination of trace acetic acid in PTA circulating water by high performance liquid chromatography [J]. Polyester industry, 2023, 36(3): 20-22.
[23] YAN T, LIU T Q, SHI L, et al.Integration of microbial metabolomics and microbiomics uncovers a novel mechanism underlying the antidiabetic property of stachyose[J].Journal of Functional Foods, 2023, 102:105457.