碱性蛋白酶是一类在碱性条件下具有较高活性的酶,广泛应用于工业领域,特别是在洗涤剂制造、食品加工、皮革和纺织品处理以及医药开发等行业[1-2]。地衣芽孢杆菌(Bacillus licheniformis)作为一种革兰氏阳性细菌,因其能够产生大量碱性蛋白酶而备受关注[3]。这种菌株不仅能够产生多种类型的酶,如蛋白酶、脂肪酶和多糖酶等,而且其产生的碱性蛋白酶具有热稳定性好、pH适应范围广等优点,使其在工业生产中具有很高的应用价值[4]。
培养基的组成是影响微生物发酵产酶的关键因素之一,优化培养基不仅能提高酶的产量和质量,还能增强发酵过程的可控性[5-6]。传统上,地衣芽孢杆菌的培养和碱性蛋白酶的生产通常依赖于富含氮源和碳源的天然培养基,如豆粕、酵母提取物等[7],这些成分虽然营养丰富,但成本较高,且组分复杂[8],不利于地衣芽孢杆菌的代谢特性分析。相比之下,化学合成培养基以其成分明确、易于控制等优势,逐渐成为工业微生物生产的研究热点[9-10]。然而,合成培养基的优化是一个复杂且细致的过程,需要系统地筛选和调整各种营养物质,以达到最佳的菌体生长和产酶效果[11-13]。目前,对于产碱性蛋白酶地衣芽孢杆菌全合成培养基的相关研究较少。
本研究基于豆粕成分分析,通过单一组分移除、组分添加、碳源种类优化等实验,对地衣芽孢杆菌的合成培养基进行了深入研究和系统优化。本文不仅关注了氨基酸、维生素、金属离子等基本营养物质的作用,还特别探讨了碳源对菌体生长和产酶的影响。通过以上研究,本文成功开发出了一种化学全合成培养基CDM3,显著提高了地衣芽孢杆菌的生长速率和碱性蛋白酶的产量,为地衣芽孢杆菌的工业化生产提供了重要的理论和实践基础。
1 材料与方法
1.1 菌种
地衣芽孢杆菌(Bacillus licheniformis)DW2菌株由湖北大学陈守文教授课题组提供。
1.2 培养基
活化平板培养基(g/L):蛋白胨 10,氯化钠 10,酵母提取物 5,琼脂 20;
种子培养基(g/L):蛋白胨 10,氯化钠 10,酵母提取物 5;
发酵复合培养基(g/L):玉米淀粉 92,豆粕 35,硫酸铵 5,酵母提取物 5,硫酸镁 1,轻钙 6;
发酵合成培养基见表1,其中CDM0为初始合成培养基。
表1 合成培养基成分 单位:g/L
Table 1 Components of chemically defined medium

组分CDM0CDM1CDM2CDM3丙氨酸0.5精氨酸1111天冬酰胺0.50.50.5天冬氨酸0.5半胱氨酸0.50.50.50.5谷氨酸0.5谷氨酰胺0.50.50.50.5甘氨酸1111组氨酸0.50.50.50.5异亮氨酸1111脯氨酸1111苏氨酸0.5缬氨酸0.50.50.50.5亮氨酸1111赖氨酸1甲硫氨酸0.5苯丙氨酸1丝氨酸0.50.50.50.5色氨酸1111酪氨酸1生物素0.0010.0010.0010.001盐酸硫胺素0.03核黄素0.002烟酸0.20.20.20.2泛酸钙0.40.40.40.4盐酸吡哆辛0.040.040.040.04腺嘌呤0.050.050.05鸟嘌呤0.050.050.050.05胞嘧啶0.050.050.050.05胸腺嘧啶0.05尿嘧啶0.050.050.050.05ZnCl20.002 4MnCl2·4H2O0.001 50.001 50.001 50.001 5FeSO4·7H2O0.006KCl0.80.80.80.8CuSO4·5H2O0.000 450.000 450.000 450.000 45NaCl0.006 3KH2PO40.217CaCl20.1CoCl2·6H2O0.000 07(NH4)2SO4333MgSO4·7H2O1Na2HPO44444CaCO36666葡萄糖505050半乳糖50
1.3 培养方法及条件
1.3.1 平板活化培养
将保存于-20 ℃的甘油菌在活化培养基中划线,37 ℃静置培养14~16 h,长出来的菌落用作活化菌种。
1.3.2 摇瓶种子培养
挑取活化平板上的单菌落接入种子培养基(25 mL/250 mL)于恒温摇床37 ℃、220 r/min 条件下培养12 h,得到一级种子液。将一级种子液按3%接种量接入种子培养基(25 mL/250 mL)于恒温摇床37 ℃、220 r/min条件下培养约4~6 h,至OD600值为4左右,得到二级种子液。
1.3.3 发酵培养
取适量体积的二级种子液于无菌50 mL离心管中,10 000 r/min离心2 min,弃上清,使用无菌水清洗菌体两次,最后将菌体重悬于合适体积的无菌水中,使其OD600值为4左右,接种量为5%,于37 ℃、220 r/min条件下培养72 h,每组实验设置3个平行。复合培养基发酵无洗菌操作,其余方法同合成培养基。
1.4 分析方法
1.4.1 菌体浓度测定
平板菌落计数法:每个时间点取样后,在无菌间中准备已灭菌的1.5 mL离心管,以10倍的稀释梯度进行菌液稀释,将稀释到合适倍数的菌液取100 μL于LB固体培养基上,涂布完成后,置于37 ℃恒温培养箱中培养24 h后进行菌落计数。
光密度法:使用1 mmol/L HCl将发酵液稀释合适倍数后(除去培养基中的碳酸钙),通过酶标仪在波长600 nm处测定菌液吸光值。
1.4.2 碱性蛋白酶活力测定
碱性蛋白酶的1个酶活力单位定义为在40 ℃和pH 10.5的条件下,在1 min内1 mL液体酶或1 g固体酶粉水解酪蛋白所产生1 μg酪氨酸。碱性蛋白酶活力的测定方法参考GB/T 23527—2009福林酚法,并稍加修改[14]。碱性蛋白酶水解酪蛋白生成含有酚基的氨基酸,于碱性环境中还原福林酚试剂,显蓝色,在680 nm处有最大吸收波长。
试剂配制:分别配制42.4 g/L Na2CO3 溶液、65.4 g/L三氯乙酸溶液、20 g/L NaOH溶液、1 mmol/L和0.1 mmol/L HCl溶液、硼酸缓冲液(pH 10.5)、10 g/L酪蛋白溶液以及不同浓度的L-酪氨酸标准溶液0、10、20、30、40、50 μg/mL,福林酚试剂稀释3倍后使用。
标准曲线绘制:分别取上述不同浓度的L-酪氨酸标准液1 mL于离心管中,加入碳酸钠溶液5 mL、福林酚试剂1 mL,混合均匀后40 ℃水浴20 min,于680 nm处测定吸光值。空白对照中不含L-酪氨酸标液。以吸光度为纵坐标,L-酪氨酸标液浓度为横坐标,绘制成标准曲线如公式(1)所示:
Y=0.010 48X-0.005 6(R2=0.996 3)
(1)
样品碱性蛋白酶活力测定:取发酵液1 mL于1.5 mL离心管中,12 000 r/min离心2 min,取上清液,稀释适宜倍数后,取1 mL加入10 mL离心管(分为实验组和对照组)中,40 ℃水浴2 min;实验组中加入1 mL酪蛋白溶液,对照组加入2 mL三氯乙酸溶液,40 ℃水浴10 min后 取出;实验组中加入2 mL三氯乙酸溶液,对照组中加入1 mL 酪蛋白溶液,40 ℃水浴20 min后,4000 r/min、离心10 min;取离心后的上清液1 mL置于新的离心管中,实验组和对照组中加入5 mL 碳酸钠溶液,随后加入1 mL福林酚试剂,加入后立即混合均匀;40 ℃水浴加热20 min 后,于680 nm处测定吸光值。
按公式(2)计算样品中碱性蛋白酶活力:
(2)
式中:X为样品的酶活力,U/mL;A为样品平均吸光值;A0为对照组平均吸光值;4为反应试剂的总体积,mL;K为吸光常数(经计算K=95.95,在95~100范围内,符合要求);n为样品的稀释倍数;10为反应的时间,10 min。
1.5 合成培养基成分优化
1.5.1 豆粕主要成分检测
金属离子测定:样品经微波消解后转入比色管中并定容,后采用Agilent 5800 ICP-OES等离子体发射光谱仪进行测定,分析波长为167~785 nm;光学分辨率<0.007 nm(188.98 nm处);杂散光≤2.0 mg/L。
维生素测定:a)色谱条件:样品经代谢物提取后采用Agilent 1290 Infinity LC超高效液相色谱系统进行分离,色谱柱为HSS T3(2.1 mm×100 mm);样品置于4 ℃自动进样器中,柱温45 ℃;流动相A:5 mmol/L的甲酸铵+0.3%甲酸水溶液,流动相B:纯甲醇,流速为300 μL/min,进样量5 μL。样本队列中每间隔一定数量的实验样本设置1个QC样本,用于检测和评价系统的稳定性及重复性。b)质谱条件:采用5500 QTRAP 质谱仪(AB SCIEX)在正离子模式下进行质谱分析,源条件如下:源温度,550 ℃;离子源气体1和气体2流速,55 mL/min;帘幕气体流速,40 mL/min;离子喷雾电压浮动,+4 500 V。采用MRM模式检测待测离子对,Multiquant 3.0.2软件提取色谱峰面积及保留时间,用目标物质的标准品矫正保留时间进行鉴定。
1.5.2 单一组分移除实验
为了优化合成培养基的组分,在初始合成培养基(CDM0)的基础上,对其中的氨基酸、金属离子、维生素、碱基以及无机盐进行单一组分移除实验,以移除某一组分后菌体生长下降20%为标准,初步筛选出对菌体生长有显著影响的组分。
1.5.3 组分添加实验
根据单一移除实验的结果,逐一添加CDM0中剩下的9种氨基酸(天冬酰胺、丙氨酸、天冬氨酸、谷氨酸、苏氨酸、赖氨酸、甲硫氨酸、苯丙氨、酪氨酸)、2种维生素(核黄素和盐酸硫氨酸)、2种碱基(胸腺嘧啶和腺嘌呤)、5种金属离子[(NH4)2SO4、NaCl、Fe2+、Ca2+、Mg2+、Zn2+、Co2+]和无机盐(KH2PO4),按照初始合成培养基CDM0中各物质对应的浓度进行添加,如天冬氨酸添加浓度为0.5 g/L,其他组分详见表1。如果添加后菌体OD600能够提高20%以上,则确定该组分对菌体生长具有促进作用。对于能够显著促进菌体生长的组分进行26种组合添加,最终确定最佳组合。
1.5.4 碳源种类优化实验
在组合添加实验得到的合成培养基的基础上,分别用甘油、单糖(果糖、甘露糖、半乳糖、木糖、鼠李糖)和双糖(海藻糖、麦芽糖、蔗糖)作为单一碳源,替代葡萄糖,添加浓度为50 g/L。发酵时间为3 d,期间24、48、60、72 h分别进行取样,并测定每组的菌体浓度(OD值)与碱性蛋白酶活力。
1.5.5 摇瓶发酵验证
分别使用优化前后的合成培养基CDM0和CDM3培养地衣芽孢杆菌,发酵周期为96 h,24 h开始每隔12 h进行1次取样,测定2组发酵摇瓶中的菌浓(OD值)与碱性蛋白酶活力,并比较优化前后培养基的性能。
2 结果与分析
2.1 初始合成培养基成分的确定
在进行本研究之前,需要确定初始的合成培养基成分,一般来说合成培养基成分主要包括氨基酸、维生素、核苷酸碱基、金属离子和无机盐这五类物质[15]。本课题组前期研究得到一种复合培养基(由玉米淀粉、豆粕、酵母提取物、硫酸镁、硫酸铵等组成),它能够支持地衣芽孢杆菌生长且高效合成碱性蛋白酶,豆粕是此复合培养基当中的一种主要成分,它是一种价廉且富含营养物质的氮源。可以认为豆粕是上述培养基中支持菌体生长和产酶的主要营养物质,可考虑从豆粕入手寻找开发全合成培养基的合理成分。豆粕是豆类加工后的副产品,含有丰富的蛋白质和营养物质,但是其中的成分尚不明确[16],因此本研究首先测定了豆粕中的主要金属离子和维生素成分(表2、表3),并根据复合培养基中豆粕的添加量计算出所需的金属离子和维生素添加量,得到的添加浓度见表1。然后通过查阅文献确定了豆粕中的氨基酸含量[17],最后结合多种地衣芽孢杆菌和枯草芽孢杆菌的化学合成培养基成分[18-19],确定了本实验的初始合成培养基CDM0(表1)。
表2 豆粕中主要维生素的含量 单位:ng/g
Table 2 The content of the main vitamins in soybean meal
维生素盐酸硫胺素核黄素烟酸泛酸钙盐酸吡哆辛生物素含量932.466 258.093 15 860.810 612 073.343 7810.895 637.090 9
表3 豆粕中主要金属离子的含量 单位:mg/kg
Table 3 The content of the main metal ions in soybean meal
金属元素MnZnFeCaKPCoCuNaMg含量43641703 20023 0006 2002131803 000
2.2 不同培养基中菌体的生长和产酶情况
为进一步研究CDM0筛选和优化工作,先对其性能进行考察,分别使用CDM0和复合培养基发酵培养地衣芽孢杆菌72 h,并对二者的菌体生长和碱性蛋白酶合成做了比较,结果见图1。图1的柱状图清晰地显示,地衣芽孢杆菌在CDM0上生长虽不及于复合培养基,但也比较旺盛,可以作为后续组分优化实验的出发培养基。同时观察其生长曲线发现菌体生长在66 h之前就能达到顶峰,故选定60 h作为后续实验中培养基生长最大化性能考察的发酵周期。
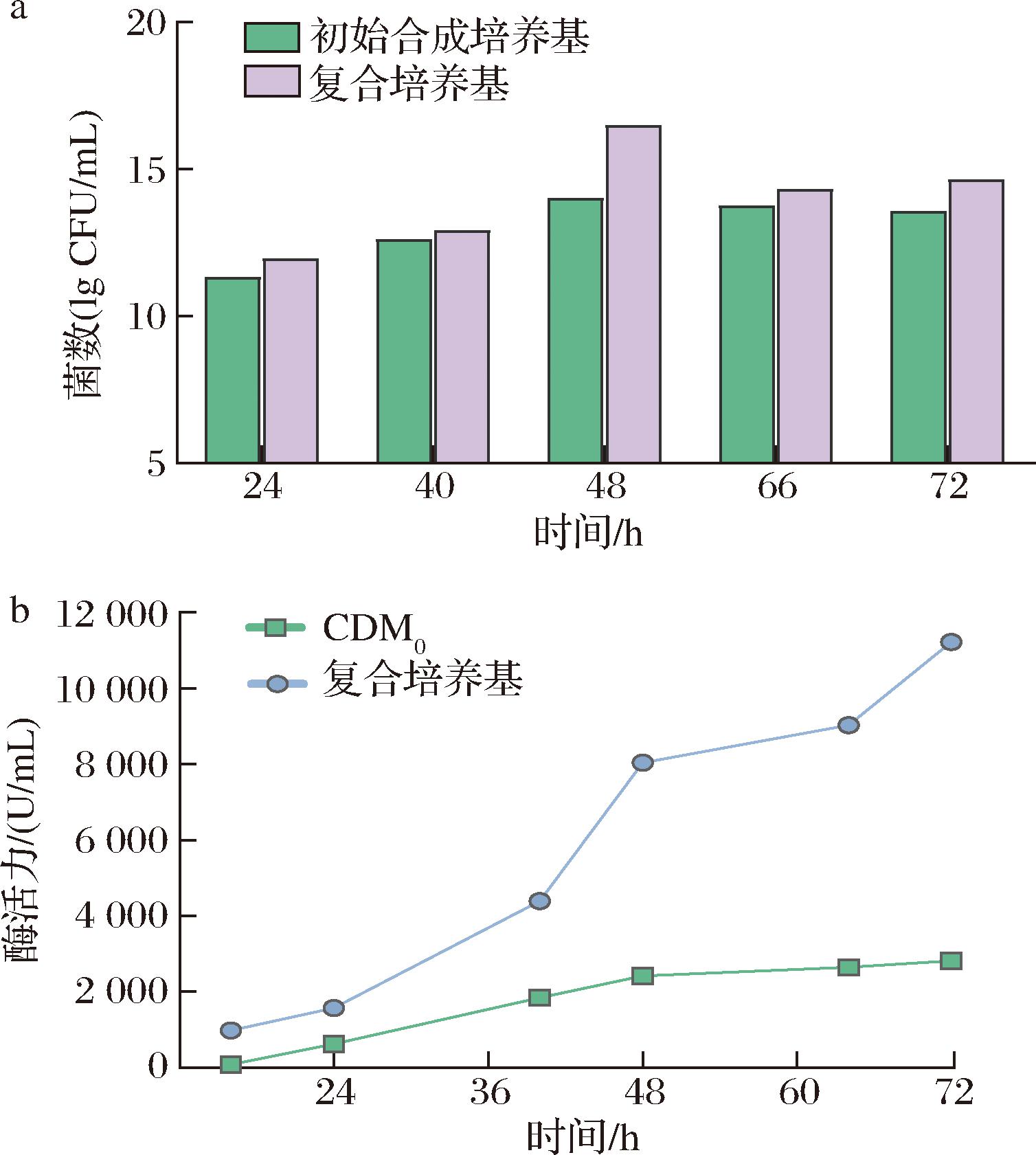
a-菌体生长;b-酶活力
图1 不同培养基中菌体的生长与产酶情况
Fig.1 Growth and enzyme production of cells in different media
由图1可知,地衣芽孢杆菌在合成培养基中的碱性蛋白酶活力最高仅有2 819.75 U/mL,远低于复合培养基中获得的碱性蛋白酶活力(11 221.47 U/mL)。这可能是由于复合培养基中的豆粕作为一种迟效氮源,能够逐步被菌体分解利用,释放丰富的氮源满足菌体生长,同时支持菌体在发酵过程中持续长时间地产酶。
2.3 单一组分移除实验结果
为了考察初始合成培养基(CDM0)中每种物质对菌体生长的影响,本研究首先采用单组分移除实验对CDM0中的成分进行逐一移除,并比较移除前后菌体的生长情况(测量OD600值)。同时,由于其中有物质能够相互转化,比如一些氨基酸,因此本实验也研究了成对移除谷氨酰胺/谷氨酸和天冬氨酸/天冬酰胺对菌体生长的影响,移除实验结果如图2所示。 图2-a显示的是单一移除碱基对菌体生长的影响,本文发现单一移除腺嘌呤(A)和胸腺嘧啶(T)后的OD值较对照组相比,只降低15%和20%,说明这2种组分对菌体的生长影响不大,而移除了余下3种碱基(鸟嘌呤、胞嘧啶和尿嘧啶)之后,可以看到OD值有明显的降低,说明这3个组分是影响菌体生长的重要因素。由图2-b可知,维生素类中核黄素(维生素B2)和盐酸硫氨酸(维生素B1)对菌体生长影响也不大,故可以从培养基当中移除。
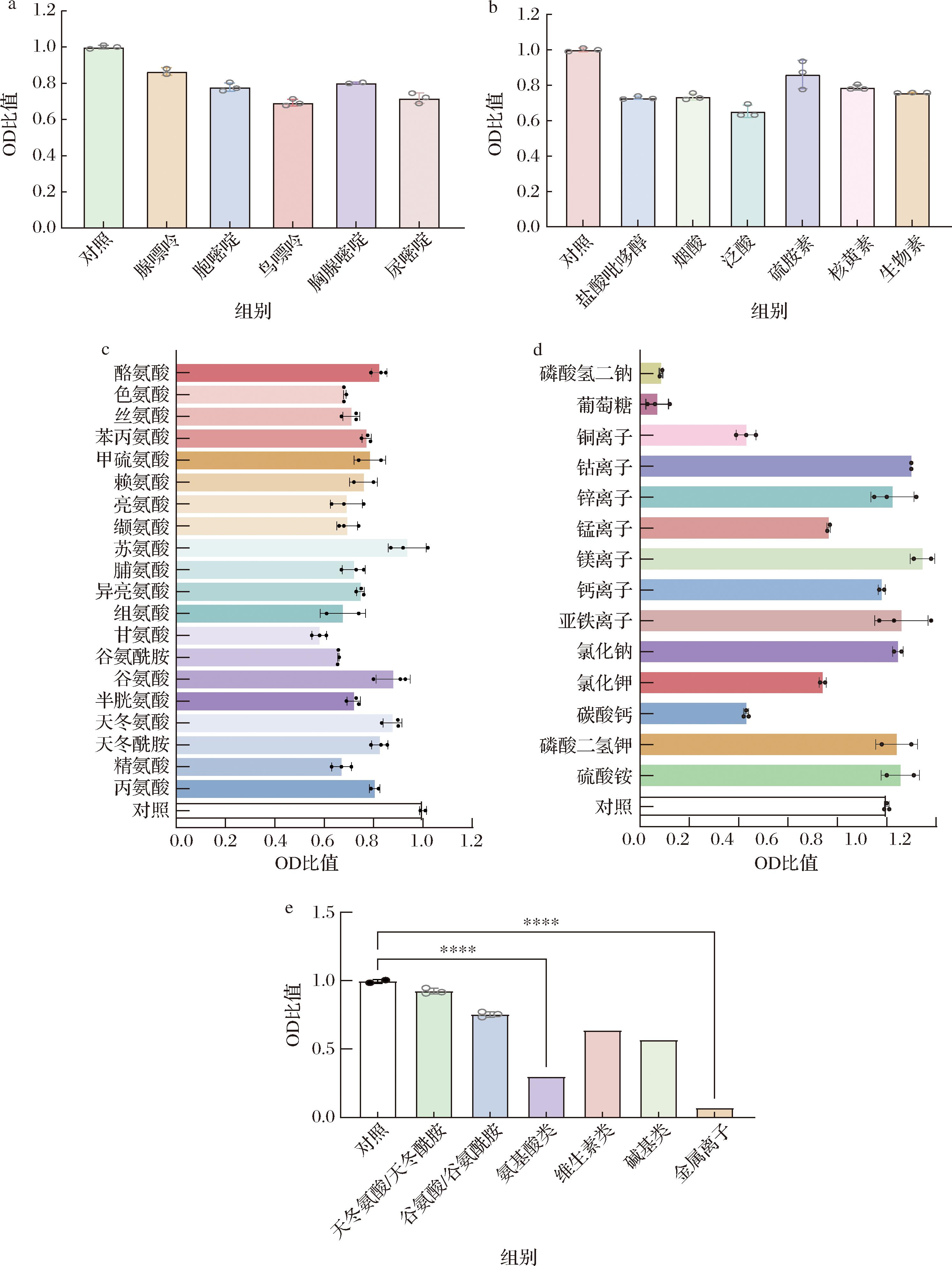
a-单一移除碱基;b-单一移除维生素;c-单一移除氨基酸;d-移除金属离子和其他物质;e-分类移除
图2 单一组分移除实验结果
Fig.2 Results of one component removal at one time experiments
注:OD比值代表实验组与对照组的比值,OD比值>1说明该物质移除后有利于菌体生长,OD比值<1说明移除该物质后菌体生长不如对照组;所有实验均在96孔板中操作,每组设置3个平行。
氨基酸不仅是组成蛋白质的基本单元,还能够为菌体提供生长所需的能量以及促进能量代谢,更是合成常见含氮化合物的前体[20-21]。因此,在合成培养基的营养成分中,氨基酸也充当主要的氮源物质,本研究对20种氨基酸进行单一移除实验,结果显示(图2-c),移除精氨酸、半胱氨酸、谷氨酰胺、甘氨酸、组氨酸、缬氨酸、亮氨酸、丝氨酸、色氨酸、异亮氨酸和脯氨酸这几种氨基酸后,相比于对照组OD值下降了20%以上,因此可以认为这些氨基酸是对菌体生长较为重要的组分,而移除天冬酰胺、丙氨酸、天冬氨酸、谷氨酸、苏氨酸、赖氨酸、甲硫氨酸、苯丙氨、酪氨酸后,OD值只降低了不到20%,说明这些物质的缺失并没有显著影响菌体的生长。金属离子和培养基中其他物质的单一移除实验结果如图2-d所示。由图2-d可知,当葡萄糖和NaH2PO4移除后,OD值相较于对照组下降了90%以上,菌体生长被严重制约,表明了这2种物质是菌体生长所必需的;CaCO3、Cu2+、Mn2+和KCl的移除使菌体生长减少了20%~60%,说明这4种成分是对菌体生长比较重要的物质;(NH4)2SO4、KH2PO4、NaCl、Fe2+、Mg2+、Zn2+、Co2+移除后,OD值反而上升,但不到15%,移除Cu2+后,相比于对照OD值下降了不到5%,说明这8种成分的缺失不影响菌体生长。
除了单一移除CDM0中的各类成分外,本研究还将氨基酸类、维生素类、金属离子和碱基这四类物质进行分类移除,发现移除所有的金属离子对菌体生长的影响最大,OD值比对照组下降了90%以上(图2-e),可能是由于金属离子在调节酶的活性上起着关键性的作用。其次,氨基酸作为培养基中最主要的氮源,此类物质的移除也严重阻碍了菌体的生长。
根据上述实验结果,移除那些对菌体生长影响不大的成分,选择碱基类,鸟嘌呤、胞嘧啶、尿嘧啶;维生素类,生物素、盐酸吡哆辛、烟酸、泛酸钙;氨基酸类,精氨酸、半胱氨酸、谷氨酰胺、甘氨酸、组氨酸、缬氨酸、亮氨酸、丝氨酸、色氨酸、异亮氨酸、脯氨酸,以及葡萄糖、NaH2PO4、CaCO3、Cu2+、Mn2+和KCl组成合成培养基CDM1,并以此作为后续组分添加实验的基础。
2.4 组分添加实验结果
虽然CDM1已经能够支持地衣芽孢杆菌生长,但可能由于某些营养物质的缺乏,菌体生长较为缓慢,为了能够进一步改善菌体的生长,后续组分添加实验以CDM1为基础,初步考察了CDM1中剩下的9种氨基酸(天冬酰胺、丙氨酸、天冬氨酸、谷氨酸、苏氨酸、赖氨酸、甲硫氨酸、苯丙氨、酪氨酸)、2种维生素(核黄素和盐酸硫氨酸)、2种碱基(胸腺嘧啶和腺嘌呤)、5种金属离子[(NH4)2SO4、NaCl、Fe2+、Ca2+、Mg2+、Zn2+、Co2+]和无机盐(KH2PO4)对生长的影响,实验结果见图3。
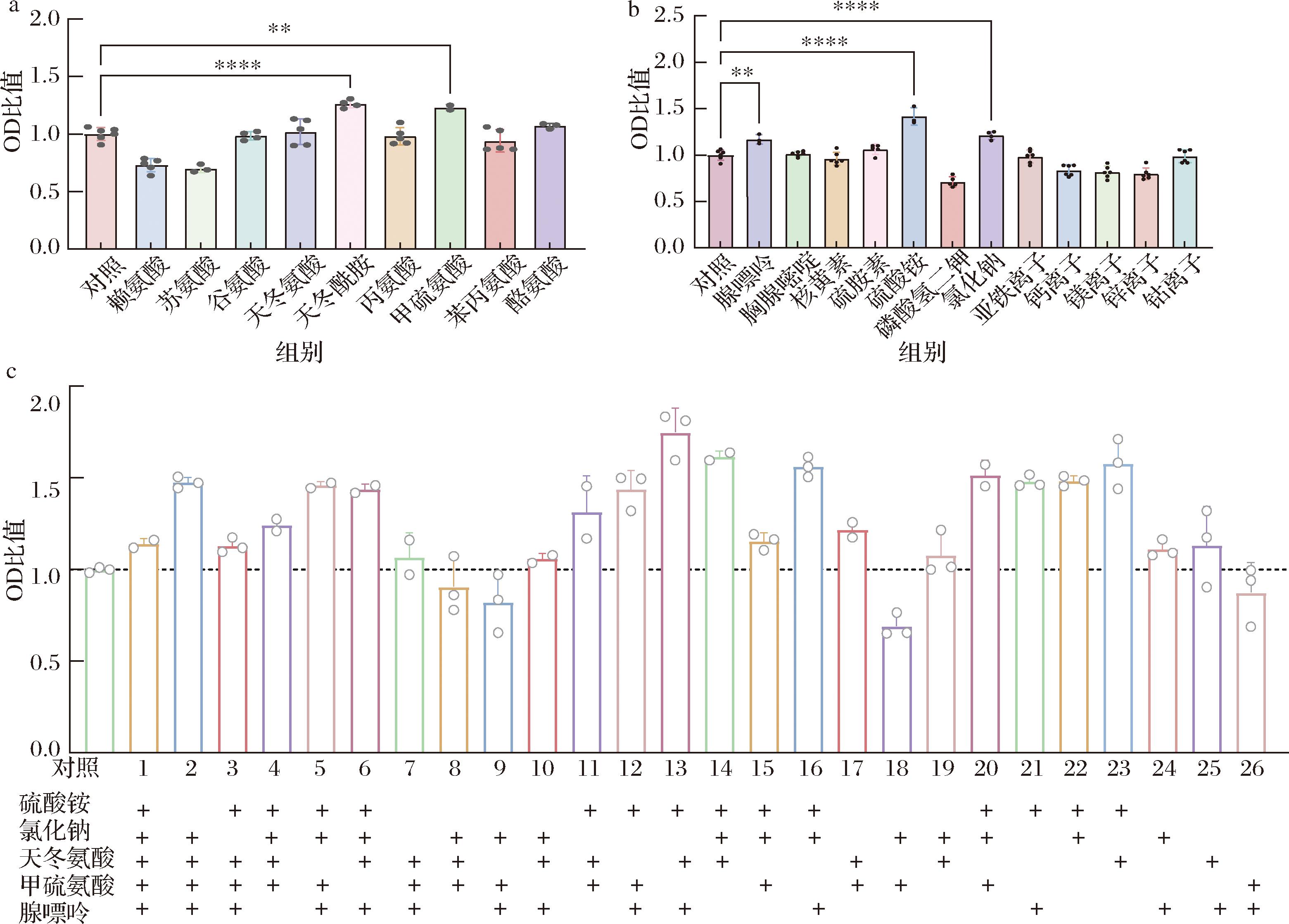
a-单一添加氨基酸;b-单一添加碱基、维生素和金属离子;c-组合添加
图3 单一组分添加实验结果
Fig.3 Results of one component addition at one time experiments
注:OD比值代表实验组与对照组的比值,OD比值>1说明组分添加后,其生长超过对照组,OD比值<1说明不利于菌体生长。“+”代表该物质被添加。所有实验均在96孔板中操作,每组设置3个平行。
图3-a为添加不同氨基酸对菌体生长的影响,柱状图显示天冬酰胺(Asn)和甲硫氨酸(Met)添加组的OD值与其他几个添加组相比,明显高于对照组,这表明添加Asn和Met这两种氨基酸有利于菌体生长;而图3-b也展示了腺嘌呤(A)、(NH4)2SO4和NaCl的添加使菌体OD值增加了20%以上。
基于以上实验结果,选择这5种利于生长的物质做了进一步的组合添加实验,共有26种组合,具体添加情况和结果如图3-c所示。值得注意的是,除了组合1、8、9、10、18和16外,其他组合的OD值均要比对照组高,其中组合添加(NH4)2SO4、腺嘌呤和天冬酰胺这3种物质对菌体生长带来的影响最为显著,使菌体浓度提高了约80%。于是,在CDM1的基础上我们继续添加(NH4)2SO4、Asn和腺嘌呤得到合成培养基CDM2。
2.5 不同种类碳源对菌体生长及产酶的影响
碳源作为影响微生物生长和产物合成的重要物质[22],在培养基中是必要成分。后续研究在合成培养基CDM2的基础上,选取了9种不同的碳源:甘油、果糖、甘露糖、半乳糖、木糖、鼠李糖、海藻糖、麦芽糖和蔗糖替代CDM2中的葡萄糖,分别考察这10种不同碳源对地衣芽孢杆菌生长和产酶的影响,结果如图4 所示。以甘油和蔗糖作为碳源时,发酵液碱性蛋白酶活力远不及葡萄糖添加组,但是菌体生长却是相反的情况,可能由于其利用碳源优先进行生长,而不是用于产酶。而当以木糖为碳源时,由图4-d可以发现,地衣芽孢杆菌的生长和碱性蛋白酶产酶都要比对照组低得多,可能是由于木糖相较于葡萄糖,更不易被菌体利用或者是由于其代谢途径效率低下,致使菌体生长缓慢,从而导致产物合成效率也低。图4-e~图4-i分别是以鼠李糖、海藻糖和蔗糖为单一碳源时,菌体的生长和产酶情况,在发酵60 h时菌体OD600值达到峰值,3组的菌体生长都与对照组相似,但鼠李糖与海藻糖的碱性蛋白酶活不及对照葡萄糖组,蔗糖的碱性蛋白酶酶活更是远不如对照组。与上述情况不同,当碳源为果糖、甘露糖和半乳糖时,菌体生长较快,OD600值在发酵48 h时就达到最大值,碱性蛋白酶的活力随着发酵时间的延长而逐渐增强,其中以半乳糖为碳源(图4-i)碱性蛋白酶的活力最大,约为8 651.08 U/mL,比以葡萄糖为碳源时的酶活力提高了约55%。因此,选择半乳糖替代CDM2中的葡萄糖,从而得到合成培养基CDM3。

a-果糖;b-葡萄糖;c-甘露糖;d-木糖;e-鼠李糖;f-甘油;g-海藻糖;h-麦芽糖;i-蔗糖;j-半乳糖
图4 不同碳源对生长和产酶的影响
Fig.4 Effect of different carbon sources on growth and enzyme production
图5显示了不同碳源发酵过程48~72 h的pH变化情况。由图5可知,当以葡萄糖、蔗糖、麦芽糖、甘露糖、半乳糖和果糖为碳源时,发酵液的pH是逐渐升高的;以木糖和鼠李糖为碳源时,发酵液的pH保持稳定基本没有变化,而当以甘油作为碳源时,发酵液的pH与其他几种碳源不同,呈现出持续降低的趋势。造成这种pH变化的原因可能是以甘油为碳源时,大部分碳通量流向了菌体生长,有机酸合成增加,因此发酵液的pH持续下降。以甘油为碳源的发酵前期,菌体生长缓慢,60 h后菌体出现二次生长现象,可能是菌体利用了发酵液中的有机酸,使其能够再次生长,同时也表现为这段时间发酵液的pH下降变得缓慢。以海藻糖为碳源时,发酵液pH先降低而后又升高,通过观察菌体生长(图4-g)发现生物量表现为先增加后减少的趋势,且减少速率大于增加速率,与pH变化速率相似。
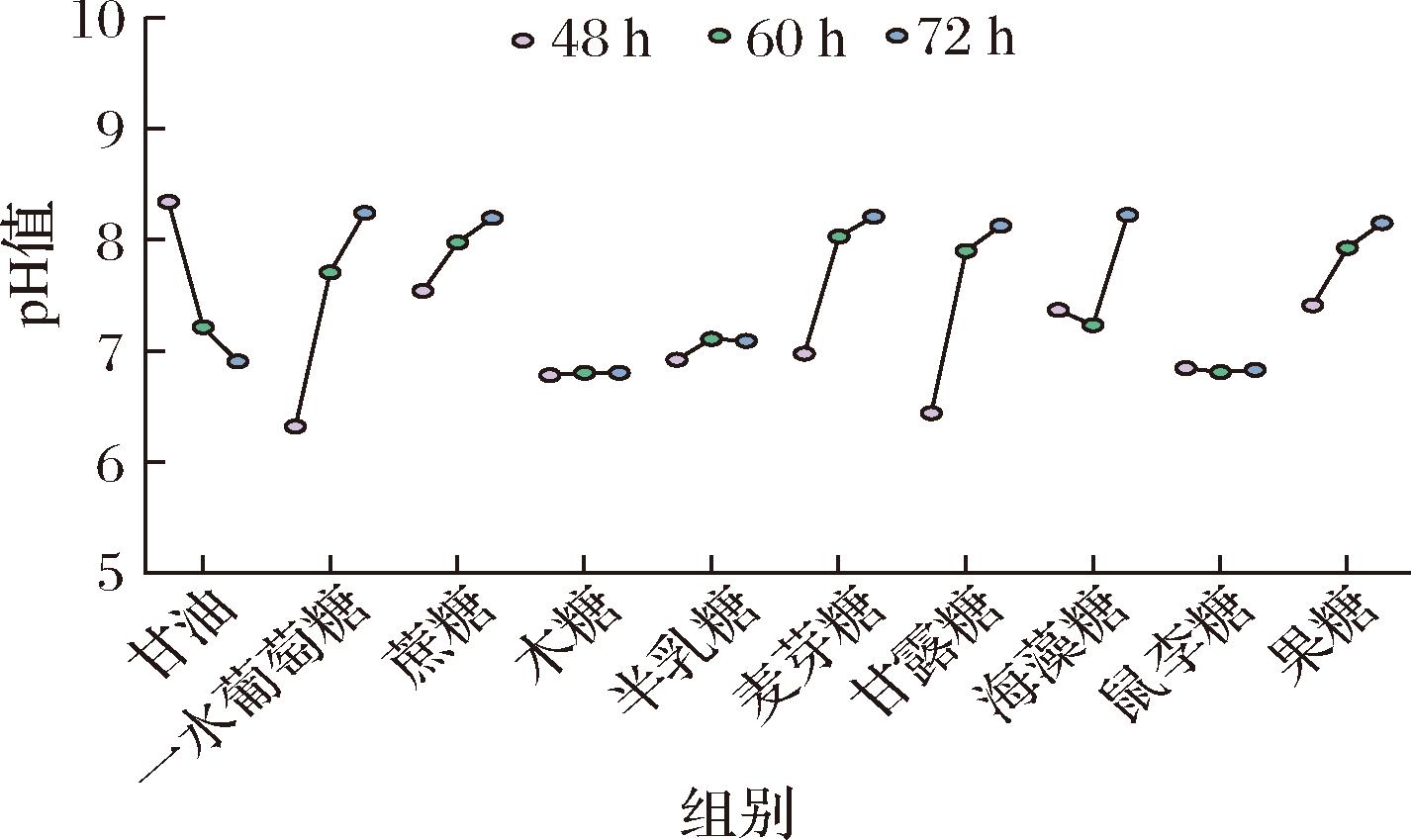
图5 不同碳源对发酵过程pH的影响
Fig.5 Effect of different carbon sources on pH of fermentation process
注:所有实验均在96孔板中操作,每组设置3个平行。
2.6 摇瓶发酵验证
经过上述组分移除、组分添加实验,得到合成培养基CDM2,接着探究了碳源种类对地衣芽孢杆菌生长和碱性蛋白酶合成的影响,最终得到了成分明确的化学全合成培养CDM3,为了考察合成培养基CDM3的性能,需要对此培养基在摇瓶水平上进行发酵验证。因此,本研究分别比较了合成培养基CDM3和CDM0的菌体生长以及碱性蛋白酶的合成。菌体生长情况如图6-a所示。由图6-a可知,用CDM0培养地衣芽孢杆菌在发酵48 h左右生长就达到了最大值,随后生长进入稳定期,OD值没有明显的增长。产物碱性蛋白酶在24~72 h快速合成,72 h时碱性蛋白酶的活力达到最大,最高达到2 947.2 U/mL(图6-b)。在合成培养基CDM3中,不同于初始合成培养基,菌体在48~72 h快速生长,在72 h后生长才逐渐变慢进入稳定期(图6-a),碱性蛋白酶的活力与菌体生长具有较强的相关性,生长速率大的阶段产酶速率也同样快,酶活力在72 h 左右达到最大值,为10 300.7 U/mL,随后酶活力不再继续变大并趋于稳定(图6-b)。同时发现,不论是菌体生长速率还是产物合成速率都高于使用合成培养基CDM0培养时菌体的生长速率和产物合成速率。
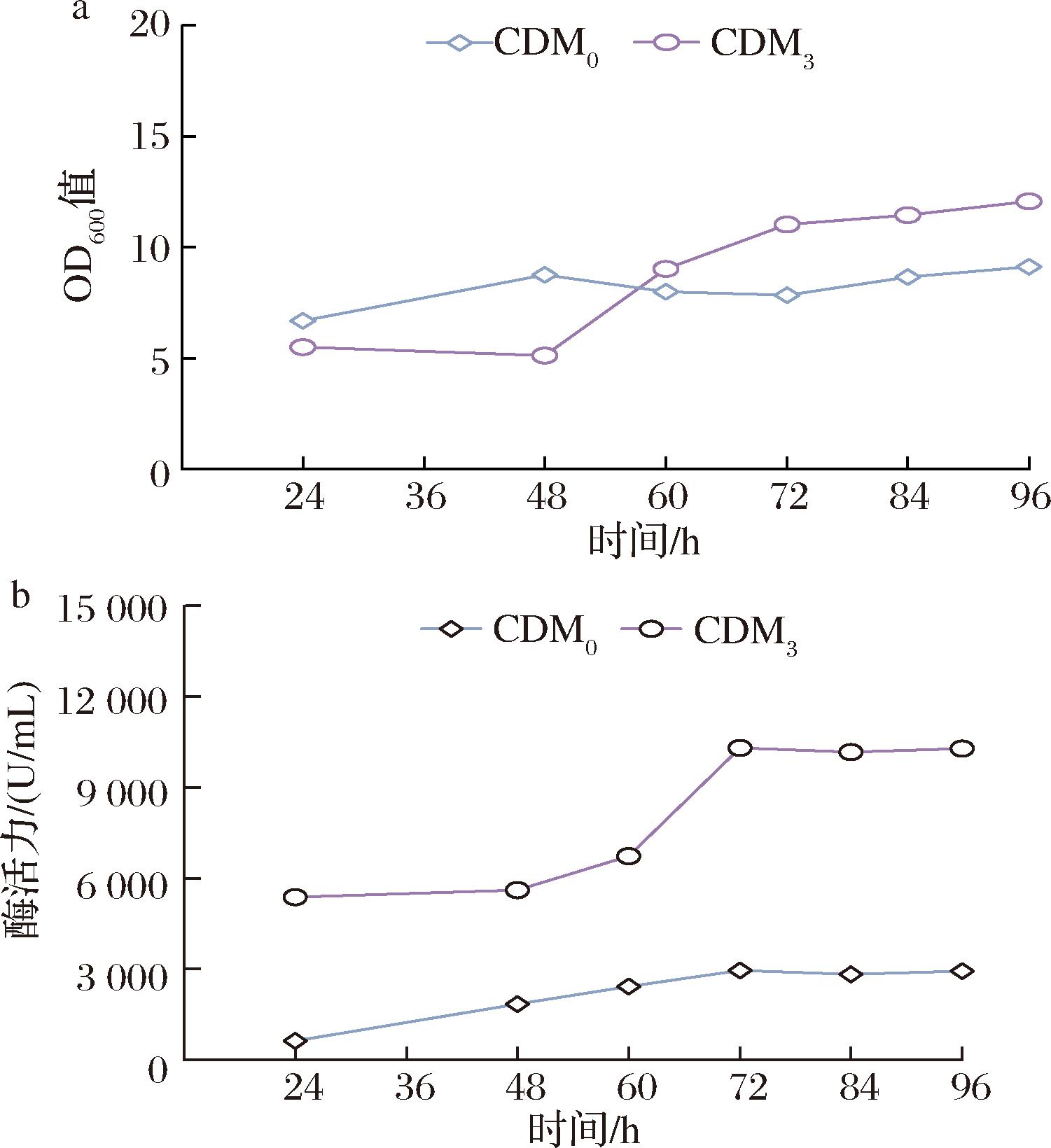
a-生长情况比较;b-产酶情况比较
图6 合成培养基优化前后生长和产酶比较
Fig.6 Comparison of growth and enzyme production before and after medium optimization
综上,合成培养基CDM3在满足菌体生长的同时,产物合成速率也比较高,虽然碱性蛋白酶活力略低于复合培养基培养时的酶活力,但相比于初始的全合成培养基CDM0,酶活力得到了显著提升,约为其3.5倍。
3 结论
本研究旨在筛选一种与复合培养基效果相当的地衣芽孢杆菌(Bacillus licheniformis)DW2产碱性蛋白酶化学合成发酵培养基。首先,基于豆粕成分分析和文献报道构建初始化学合成培养基CDM0,然后通过单一组分移除实验,识别出对菌体生长的影响较大的11种氨基酸、3种碱基和4种维生素以及一些金属离子和无机盐,构建CDM1。将从CDM0在中剔除的组分再分别添加到CDM1中,观察到特定营养物质,包括天冬酰胺、甲硫氨酸、腺嘌呤、(NH4)2SO4和NaCl这5种物质,能提高菌体生长20%以上。特别是将(NH4)2SO4、腺嘌呤和天冬酰胺这3种物质进行组合添加时,对菌体生长的促进效果最为显著,提升率约为80%,由此构建CDM2。在碳源种类的优化实验中,发现以半乳糖作为碳源时,菌体生长和碱性蛋白酶的产酶效率与葡萄糖相比均得到显著提升,其中酶活力提升了约55%。最终,用半乳糖作为碳源构建CDM3,通过摇瓶发酵的验证实验,与初始培养基CDM0相比较,经过优化的化学合成培养基CDM3不仅支持了更快的菌体生长,而且在72 h时,碱性蛋白酶的活力达到了10 300.7 U/mL,相较于初始培养基提高了约2.5倍。
此外,本研究得到的化学全合成培养基与传统的工业复合培养基相比,二者的产酶效果相当,但前者具有成分明确且稳定、重复性好、污染风险低的优点,其成本也通常较工业用培养基低。在代谢工程和系统生物学研究中,相比于成分复杂且未知复合培养基,合成培养基的使用有助于精确地研究特定代谢途径和代谢产物的生成。采用本文得到的合成培养基可以对地衣芽孢杆菌的胞内代谢特性及产碱性蛋白酶的关键代谢因素进行分析,为该菌株的进一步深入研究及产量优化奠定了基础。
[1] 程晓芳, 袁丹丹, 张余慧, 等.蛋白酶在食品工业中的应用研究进展[J].食品研究与开发, 2018, 39(7):221-224.CHENG X F,YUAN D D,ZHANG Y H,et al.Research progress of proteases in the food industry[J].Food Research and Development,2018, 39(7):221-224.
[2] KHAMBHATY Y.Applications of enzymes in leather processing[J].Environmental Chemistry Letters, 2020, 18(3):747-769.
[3] ZHANG G Q, CHEN Y K, LI Q H, et al.Growth-coupled evolution and high-throughput screening assisted rapid enhancement for amylase-producing Bacillus licheniformis[J].Bioresource Technology, 2021, 337:125467.
[4] 艾雨晴, 陈松骏, 秦娟, 等.微生物产蛋白酶的研究进展[J].食品工业科技, 2021, 42(19):451-458.AI Y Q, CHEN S J, QIN J, et al.Advances in proteases producted by microorganisms[J].Science and Technology of Food Industry, 2021, 42(19):451-458.
[5] SONI S, CHHOKAR V, BENIWAL V, et al.Cost effective media optimization for PHB production by Bacillus badius MTCC 13004 using the statistical approach[J].International Journal of Biological Macromolecules, 2023, 233:123575.
[6] ZHAO F, ZHENG M Y, XU X M.Microbial conversion of agro-processing waste (peanut meal) to rhamnolipid by Pseudomonas aeruginosa:Solid-state fermentation, water extraction, medium optimization and potential applications[J].Bioresource Technology, 2023, 369:128426.
[7] 周魏, 曾嵩玉, 余金凤, 等.一株地衣芽胞杆菌产碱性蛋白酶条件优化[J].微生物学通报, 2022, 49(7):2753-2766.ZHOU W, ZENG S Y, YU J F, et al.Optimization of alkaline protease production by a strain of Bacillus licheniformis[J].Microbiology China,2022,49(7):2753-2766.
[8] 何冬萍, 周康熙, 朱晓萍, 等.葛根淀粉为基质液态发酵生产红曲色素的培养基成分优化[J].中国食品学报, 2019, 19(2):108-115.HE D P, ZHOU K X, ZHU X P, et al.Optimization of medium components producing Hongqu pigments in liquid-state fermentation using kudzu root starch as culture media[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(2):108-115.
[9] 胡栋, 柯灵超, 张敬宇, 等.响应面法设计优化阿维菌素化学合成发酵培养基[J].中国抗生素杂志, 2018, 43(8):1055-1061.HU D, KE L C, ZHANG J Y, et al.Development and optimization of a fermentation chemically defined medium composition for the production of avermectins by response surface methodology[J].Chinese Journal of Antibiotics, 2018, 43(8):1055-1061.
[10] 汤宝, 王金子, 赵延存, 等.抗真菌物质HSAF发酵全合成培养基的筛选[J].中国生物防治学报, 2022, 38(3):645-652.TANG B, WANG J Z, ZHAO Y C, et al.Screening of chemically defined medium for antifungal substance HSAF[J].Chinese Journal of Biological Control, 2022, 38(3):645-652.
[11] 施盛超, 刘志豪, 王永红.拟干酪乳杆菌全合成培养基氨基酸及维生素组分优化研究[J].食品与发酵工业, 2023, 49(18):24-30.SHI S C, LIU Z H, WANG Y H.Optimization of amino acids and vitamins components in complete chemical defined medium of Lactobacillus paracasei[J].Food and Fermentation Industries, 2023, 49(18):24-30.
[12] 宋萍, 戚小灵, 胡燚, 等.响应面法优化枯草芽孢杆菌产脂肪酶的合成培养基[J].中国生物工程杂志, 2010, 30(8):100-105.SONG P, QI X L, HU Y, et al.Optimization of lipase production conditions by Bacillus subtilis using surface methodology[J].China Biotechnology, 2010, 30(8):100-105.
[13] 廖建国, 洪铭, 储炬.运用高通量筛选技术优化红霉素A发酵的合成培养基[J].中国抗生素杂志, 2018, 43(1):51-58.LIAO J G, HONG M, CHU J.Optimizition of synthetic medium for erythromycin A production by highthroughput screening technology[J].Chinese Journal of Antibiotics, 2018, 43(1):51-58.
[14] 胡悦, 李汉文, 喻晨, 等.LiCl-ARTP复合诱变选育高产碱性蛋白酶菌株及其发酵条件优化[J].中国酿造, 2021, 40(2):59-65.HU Y, LI H W, YU C, et al.Breeding of high yield alkaline protease strain by LiCl-ARTP compound mutation and fermentation condition optimization[J].China Brewing, 2021, 40(2):59-65
[15] ZHANG J, ZHOU J W, LIU J, et al.Development of chemically defined media supporting high cell density growth of Ketogulonicigenium vulgare and Bacillus megaterium[J].Bioresource Technology, 2011, 102(7):4807-4814.
[16] KUMARI R, SHARMA N, SHARMA S, et al.Production and characterization of bioactive peptides in fermented soybean meal produced using proteolytic Bacillus species isolated from kinema[J].Food Chemistry, 2023, 421:136130.
[17] IB
 EZ M A, DE BLAS C, C
EZ M A, DE BLAS C, C MARA L, et al.Chemical composition, protein quality and nutritive value of commercial soybean meals produced from beans from different countries:A meta-analytical study[J].Animal Feed Science and Technology, 2020, 267:114531.
MARA L, et al.Chemical composition, protein quality and nutritive value of commercial soybean meals produced from beans from different countries:A meta-analytical study[J].Animal Feed Science and Technology, 2020, 267:114531.
[18] MÜLLER J, BECKERS M, MUßMANN N, et al.Elucidation of auxotrophic deficiencies of Bacillus pumilus DSM 18097 to develop a defined minimal medium[J].Microbial Cell Factories, 2018, 17(1):106.
[19] CHAMBI D, LUNDQVIST J, NYGREN E, et al.Production of exopolysaccharides by cultivation of halotolerant Bacillus atrophaeus BU4 in glucose- and xylose-based synthetic media and in hydrolysates of quinoa stalks[J].Fermentation, 2022, 8(2):79.
[20] XIAO F, GUO F F.Impacts of essential amino acids on energy balance[J].Molecular Metabolism, 2022, 57:101393.
[21] TOMITA T.Structure, function, and regulation of enzymes involved in amino acid metabolism of bacteria and archaea[J].Bioscience, Biotechnology, and Biochemistry, 2017, 81(11):2050-2061.
[22] WANG X, XIA K, YANG X J, et al.Growth strategy of microbes on mixed carbon sources[J].Nature Communications, 2019, 10(1):1279.