生物胺(biogenic amine,BA)是一类极性或中等极性、具有生物活性的小分子有机碱性化合物[1]。适量的BA在人体中作为激素或神经递质发挥着重要的生理功能,是生物活性细胞必不可少的成分,因此通过饮食摄入适量BA有利于增强人体代谢活力和提高免疫力[2]。但过量的BA(特别是酪胺和组胺)蓄积于血液可能会引发心肺、神经、消化和免疫系统的危害,如头痛、呕吐、呼吸紊乱和血压变化等各种生理症状[3]。BA通过游离氨基酸在氨基酸脱羧酶的作用下脱羧或酮、醛物质还原胺化生成,主要由酵母、乳酸菌或其他污染微生物发酵产生。BA广泛存在于发酵豆制品、酒精饮料、乳制品等多种食品中,是食品细菌性腐败的重要化学标志物[4]。
酒精饮料是发酵食品的代表性产品,一定浓度的乙醇(<10%vol)会提高氨基酸脱羧酶的活性,同时也会抑制胺类氧化酶的活性,从而导致生物胺过度积累[1]。乙醇和乙醛会增加生物胺的吸收而增强其毒性作用,因此,饮料酒中由乙醇、乙醛增效的组胺和酪胺,是饮酒后出现恶心、头痛和呼吸障碍等症状的重要物质[5],也是酒后引起上头的主要原因之一[6]。
白兰地是一种以葡萄等水果为原料,经过发酵、蒸馏、陈酿及调配制成的饮料酒,是世界六大蒸馏酒之一,具有优雅的葡萄果香和浓郁的橡木香,口感甘冽醇厚,余香经久不散[7]。目前,对生物胺的研究多集中在不同类别食品中BA检测方法的建立及其危害控制上,如啤酒[8]、白酒[9]、葡萄酒[10]、黄酒[11-12]、果酒[13]、红酒[14]等酒精饮料以及水产品[15]、酱油和醋[16]及奶酪[17]等,鲜少有文献报道白兰地原酒及成品酒中BA种类及含量。食品中生物胺的测定除可采用毛细管电泳法、分子印迹法、传感器法和离子色谱法[10, 16]外,最常用方法为高效液相色谱法[9, 11-13]和液相色谱质谱法[14, 16-18]。毛细管电泳法等方法灵敏度较低,离子色谱法分析时间偏长[10],液相色谱法需衍生化,操作复杂、耗时长、稳定性不佳、检出限高[10],而液相色谱质谱法虽提高了检测效率,但仍存在生物胺出峰不稳定、方法重现性差等问题[17],无法满足白兰地中低含量生物胺的检测需求。高效液相色谱-高分辨质谱法具有无需衍生化、前处理便捷、分析速度快、灵敏度高、抗干扰能力强等优点,因此拟建立白兰地中9种BA的高效液相色谱-四极杆/静电场轨道阱高分辨质谱法(liquid chromatography-quadrupole/electrostatic field orbit trap high-resolution mass spectrometry, HPLC-Q-Exactive-Orbitrap-HRMS)测定方法,并考察不同工艺白兰地原酒及不同档次白兰地成品酒中生物胺种类及含量差异特征,初步分析葡萄品种、蒸馏方式和贮藏条件等条件与白兰地原酒中BA含量的相关性。
1 材料与方法
1.1 材料与试剂
9种生物胺标准物质(色胺、盐酸吡哆胺、腐胺、2-苯乙胺、组胺、酪胺、精胺和亚精胺,纯度≥98.0%;尸胺,纯度≥96.2%),上海安谱璀世标准技术服务有限公司;实验用水由Milli-Q超纯水机制得。
不同工艺白兰地原酒及不同档次白兰地成品酒购于烟台可雅白兰地酒庄有限公司和北京地区大型超市,各样品信息及编号详见表1。
表1 白兰地样品信息及编号
Table 1 Brandy samples information and number

序号编号样品名称产品级别/工艺情况1FB-1中低档成品1#2FB-2中低档成品2#中低端3FB-3中低档成品3#4FB-4中低档成品4#5FB-5中低档成品5#6FB-6高档成品1#VSOP7FB-7高档成品2#XO8FB-8高档成品3#XO高端9FB-9轩尼诗VSOP10FB-10轩尼诗XO11FB-11人头马VSOP12FB-12人头马XO13FB-13马爹利VSOP14RB-1玫瑰香酒精塔式蒸馏,自然存放。15RB-2木纳格酒精塔式蒸馏,自然存放。16RB-3西班牙进口酒精塔式蒸馏,自然存放。17RB-4优质木纳格酒精塔式蒸馏,泡橡木板。18RB-5红杂自流酒精塔式蒸馏,自然存放。19RB-6多品种葡萄酒精塔式蒸馏,自然存放。20RB-7白兰地酒精2年塔式蒸馏,贮存2年以上。21RB-8普通糖蜜酒精塔式蒸馏22RB-9优质糖蜜酒精塔式蒸馏23RB-10陈酿原酒12年壶式二次蒸馏,橡木桶陈酿12年24RB-11陈酿原酒6年壶式二次蒸馏,橡木桶陈酿6年25RB-12西班牙陈酿原酒4年塔式蒸馏,橡木桶陈酿4年26RB-13法国陈酿原酒3年塔式和壶式混蒸,橡木桶陈酿3年27RB-14法国陈酿原酒4年壶式二次蒸馏,橡木桶陈酿4年28RB-15法国陈酿原酒2年壶式二次蒸馏,橡木桶陈酿2年29RB-16玫瑰香酒精30RB-17玫瑰香酒精处理后31RB-18红杂酒精32RB-19红杂酒精处理后活性炭处理33RB-20D级酒精34RB-21D级酒精处理后35RB-22糖蜜酒精36RB-23糖蜜酒精处理后
1.2 仪器与设备
Orbitrap Exploris 120高效液相色谱-四极杆/静电场轨道阱高分辨质谱,赛默飞世尔科技公司;XH-C旋涡混合器,江苏省金坛区白塔新宝仪器厂;KQ2200DE型数控超声波清洗器,昆山市超声仪器有限公司;0.22 μm一次性针头过滤器,上海安谱实验科技股份有限公司;MSA225P分析天平,赛多利斯科学仪器(北京)有限公司。
1.3 实验方法
1.3.1 标准溶液配制
准确称取9种生物胺标准物质各10 mg(精确至0.01 mg)至10 mL容量瓶中,用超纯水溶解并定容,制得1 000 mg/L标准储备溶液。再分别准确吸取1 mL 9种单标准储备液于100 mL容量瓶中,用超纯水定容得10 mg/L混合标准溶液,再以超纯水分别稀释配制0.01、0.05、0.1、0.2、0.5、1.0、2.0、5.0、10.0 mg/L的梯度混合标准溶液。
1.3.2 样品处理方法
取白兰地样品过0.22 μm水相滤膜至进样瓶中,上机分析。每个样品重复进样3次。
1.3.3 仪器条件
色谱条件:色谱柱,Phenomenex C18(100 mm×4.6 mm×2.6 μm);流动相:乙腈(A)-1%甲酸水溶液(B),梯度洗脱,洗脱程序为:1.0~2.0 min,90% B,2.0~4.0 min,90%~50% B,4.0~5.0 min,50%~20% B,5.0~5.1 min,20% B,5.1~6.5 min,20%~90% B;分析时间:6.5 min;流速:0.30 mL/min;进样体积:5 μL;柱温:40 ℃。
质谱条件:加热电喷雾离子化源(electron spray ionization,ESI)320 ℃;喷针电压:3 200 V(正离子);扫描范围:80~210 m/z;分辨率:R=60 000,如表2所示。
表2 九种生物胺质谱条件
Table 2 Mass spectrum conditions of 9 biogenic amines
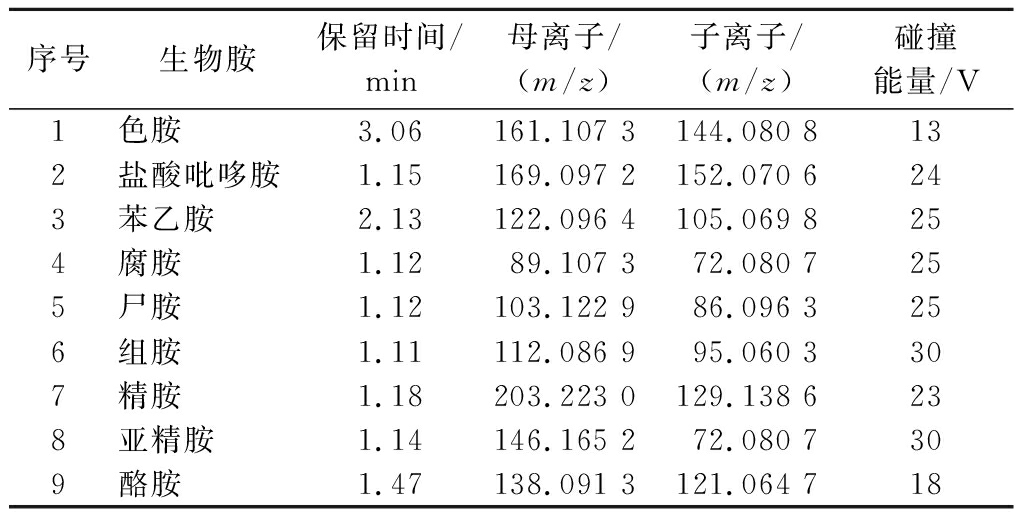
序号生物胺保留时间/min母离子/(m/z)子离子/(m/z)碰撞能量/V1色胺3.06161.107 3144.080 8132盐酸吡哆胺1.15169.097 2152.070 6243苯乙胺2.13122.096 4105.069 8254腐胺1.1289.107 372.080 7255尸胺1.12103.122 986.096 3256组胺1.11112.086 995.060 3307精胺1.18203.223 0129.138 6238亚精胺1.14146.165 272.080 7309酪胺1.47138.091 3121.064 718
1.4 数据处理与分析
采用Chromeleon 7.3色谱分析软件采集谱图及处理原始数据。用Microsoft Excel 2016、MetaboAnalyst、Origin 2021和SPSS Statistics 21软件进行数据整理和作图。
2 结果与分析
2.1 方法条件优化
2.1.1 质谱模式离子监测条件的优化
首先采用FS-DDMS2(full scan-data dependent mass spectrometry2)模式测定生物胺的保留时间,确认得到目标化合物母离子质量数,使用优化后的FS-DDMS2出口电压,选择定量离子,优化碰撞能量。tMS2定量,使用已优化后的FS-DDMS2和碰撞能量,在ESI+模式下对9种生物胺进行定性和定量离子,优化后的tMS2条件见表2,取1.0 mL 1.0 mg/L的生物胺混合标准溶液于进样小瓶中,注射泵直接进样,将标准物质注入质谱。9种生物胺中均含有氨基,为极性碱性化合物,在结构上氮原子具有孤对电子,容易加合质子形成带正电荷的离子[18],在ESI+扫描模式下响应值较高,因此选择在电喷雾正离子模式下进行tMS2质谱扫描,确定母离子质量数,优化碰撞能量等参数,使母离子响应值达到最高,得到tMS2模式下的最佳离子对。
2.1.2 色谱条件优化
首先比较了纯水和甲醇、纯水和乙腈两种流动相体系,对比发现后者条件下各生物胺色谱峰分离效果更好,且响应更高、峰型更佳,仅精胺和亚精胺峰型略有拖尾现象。然后考察了流动相B分别为0.1%、0.5%、1.0%甲酸时,在梯度洗脱条件下混合标准液的分离情况,结果表明,甲酸浓度过低时各标准无法分离,峰型差且易分裂,相比之下以1.0%甲酸溶液作为流动相B时分离效果较好,1.0%甲酸和乙腈作为流动相精胺和亚精胺无严重拖尾,在4.2.3的色谱条件下,各生物胺能达到分离,且峰型较好,因此,选用1%甲酸-乙腈作为流动相。tMS2模式下各混合标准液总离子流色谱图和各化合物定量离子见图1和图2。
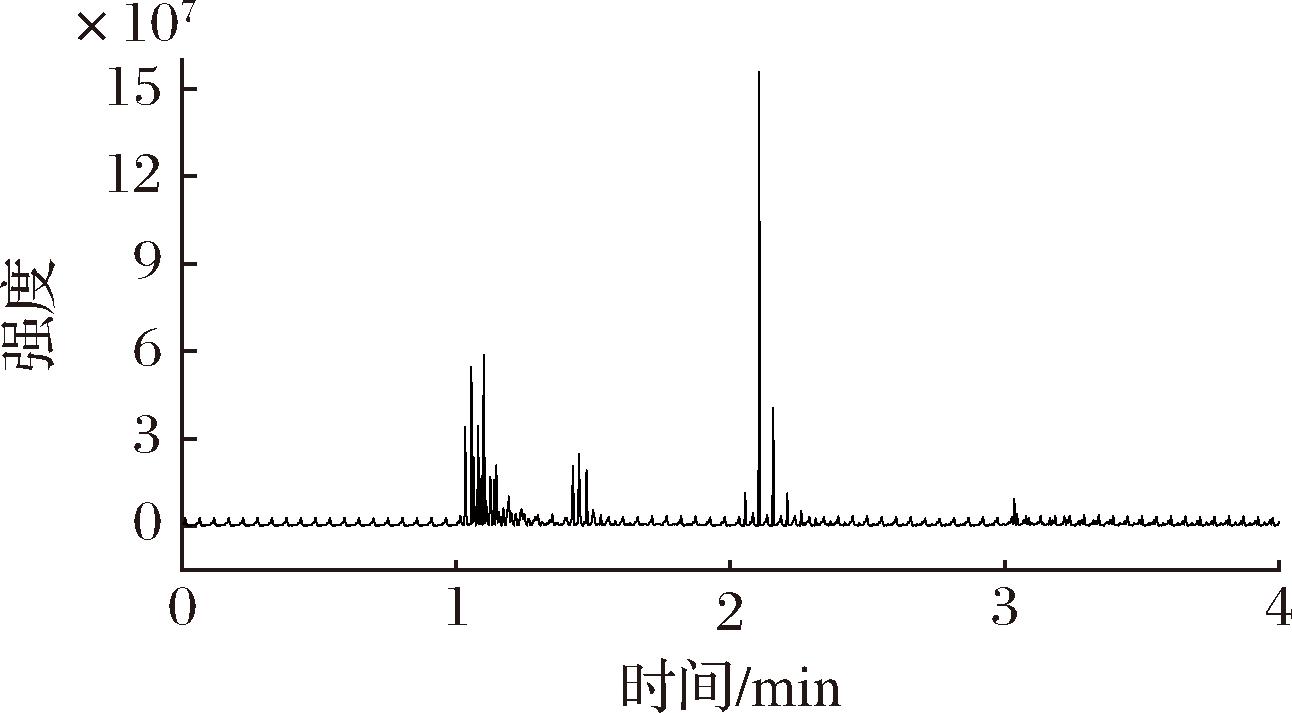
图1 标准溶液液HPLC-Q-Exactive-Orbitrap-HRMS分析总离子流色谱图
Fig.1 Total ion flow chromatogram of mixed standard liquid by HPLC-Q-Exactive-Orbitrap-HRMS analysis

a-酪胺;b-腐胺;c-尸胺;d-组胺;e-β-苯乙胺;f-亚精胺;g-色胺;h-盐酸吡哆胺;i-精胺
图2 九种生物胺定量离子色谱图
Fig.2 Quantitative ion chromatograms of 9 biogenic amines
2.2 线性关系、检出限和定量限
为排除检测中基质效应的影响,使用白兰地基质样品作为本底,添加不同体积的生物胺混合标准溶液,建立9种生物胺标准曲线并计算检出限和定量限。根据前期检测结果,在低浓度时精胺和亚精胺的响应值较其他7种生物胺低,故调整精胺和亚精胺标准溶液线性范围为0.05~10 mg/L。9种BAs在0.01~10.0 mg/L线性范围内线性关系好,相关系数均≥0.995 2。以3倍信噪比(S/N=3)和10倍信噪比(S/N=10)作为检出限(limit of detection,LOD)和定量限(limit of quantitation,LOQ),计算出方法检出限和定量限,9种生物胺的LOD为0.02~2.26 μg/L,LOQ为0.05~7.55 μg/L。回归方程、相关系数及检出限见表3。
表3 九种生物胺的线性关系、相关系数与检出限
Table 3 Linear relationship, correlation coefficient and detection limit of 9 biogenic amines

序号生物胺回归方程相关系数r线性范围/(mg/L)LOD/(μg/L)LOQ/(μg/L)1精胺 y=8.173×107x0.996 40.05~10.00.411.362尸胺 y=1.253×107x0.999 50.01~10.00.461.553腐胺 y= 9.7×106x0.997 10.01~10.02.267.554盐酸吡哆胺y=12.676×107x0.998 70.01~10.00.130.425亚精胺 y=3.439×107x0.998 40.05~10.00.180.616组胺 y=4.547×107x0.999 10.01~10.00.230.787酪胺 y=5.094×107x0.997 90.01~10.00.280.928苯乙胺 y=1.828×108x0.996 20.01~10.00.020.079色胺 y=1.997×107x0.995 20.01~10.00.020.05
2.3 加标回收
取白兰地样品,采用3水平加标方式,将生物胺标准溶液进行稀释后按照1.3.2节做加标回收试验,每一加标水平平行测定6次,计算样品平均回收率结果见表4。平均加标回收率在80.8%~119.2%,相对标准偏差(relative standard deviation,RSD)在1.1%~9.7%,该方法对BAs的检测结果准确,重复性较好。
表4 白兰地中9种生物胺的加标回收率
Table 4 Recovery rates of spiked biogenic amines in brandy
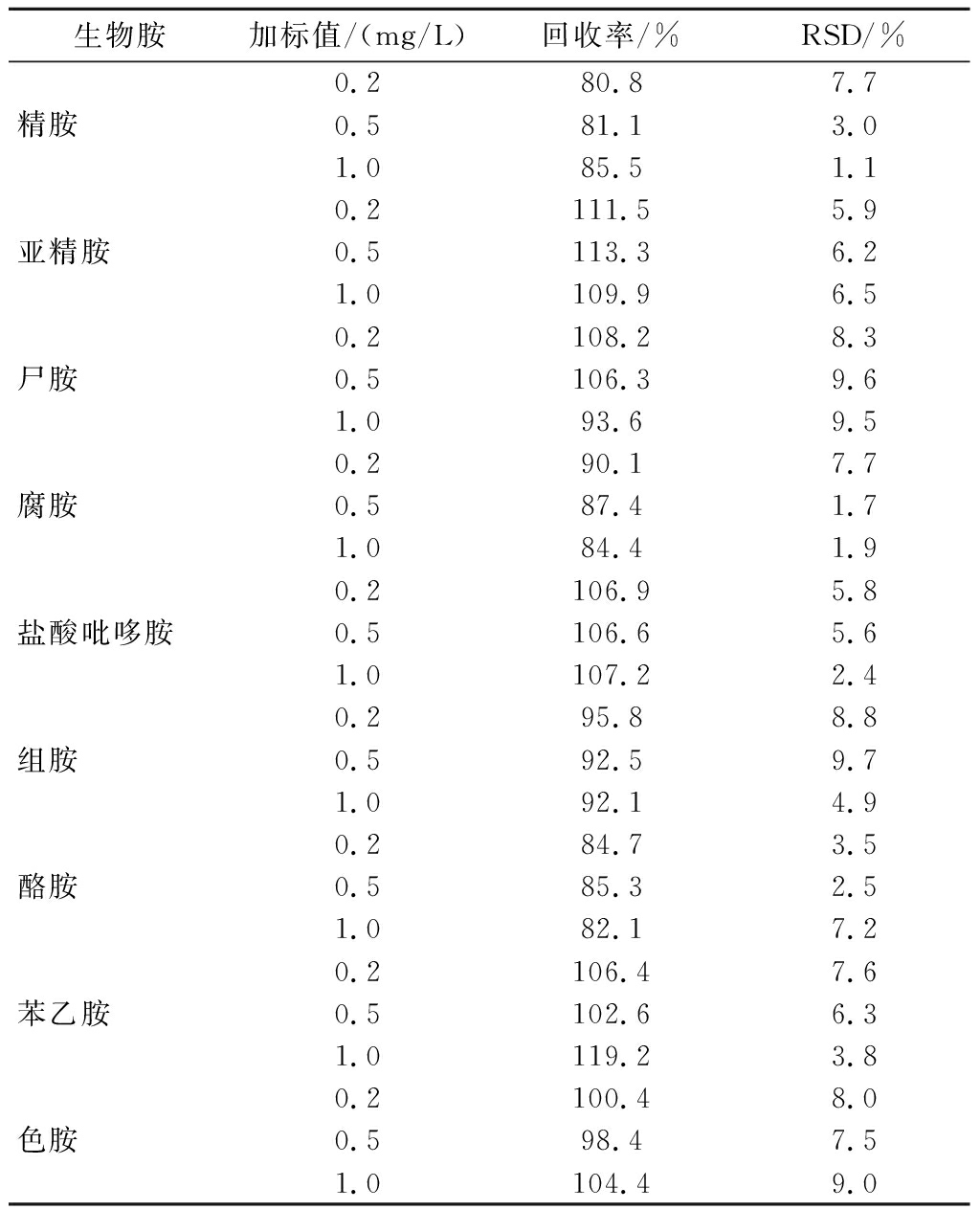
生物胺加标值/(mg/L)回收率/%RSD/%0.280.87.7精胺0.581.13.01.085.51.10.2111.55.9亚精胺0.5113.36.21.0109.96.50.2108.28.3尸胺0.5106.39.61.093.69.50.290.17.7腐胺0.587.41.71.084.41.90.2106.95.8盐酸吡哆胺0.5106.65.61.0107.22.40.295.88.8组胺0.592.59.71.092.14.90.284.73.5酪胺0.585.32.51.082.17.20.2106.47.6苯乙胺0.5102.66.31.0119.23.80.2100.48.0色胺0.598.47.51.0104.49.0
2.4 白兰地样品分析
用所建方法对不同档次白兰地成品酒及不同工艺白兰地原酒中的生物胺进行测定,结果(图3、图4)表明生物胺总量为3.0~148.0 μg/L,不同档次成品酒、不同工艺原酒(含酒精)生物胺含量和种类差异显著。其中,中低端产品中组胺和酪胺含量分别为62.0~105.0 μg/L和18.0~30.0 μg/L,高档产品中盐酸吡多胺含量为12.0~73.0 μg/L,组胺为2.0~83.0 μg/L,精胺和亚精胺未检出。葡萄酒精原酒中生物胺总量为5.0~113.0 μg/L,其中腐胺含量为2.0~12.0 μg/L,组胺为2.0~33.0 μg/L,盐酸吡多胺为2.0~101.0 μg/L,色胺未检出。糖蜜酒精中所含生物胺种类无差异,但普通糖蜜酒精中含量高于优质糖蜜酒精,其总量分别为20.0 μg/L和17.0 μg/L。
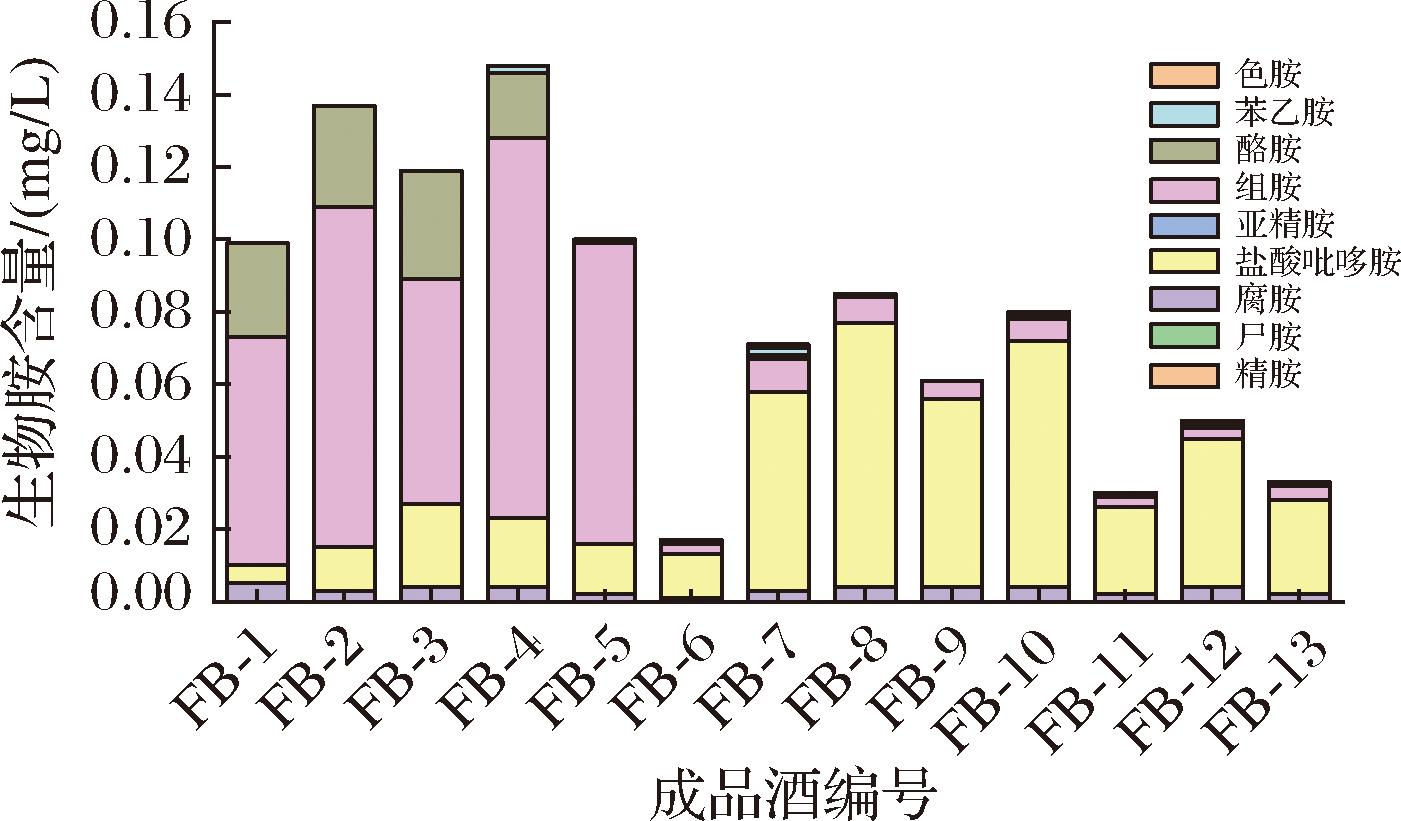
图3 不同档次成品酒中生物胺
Fig.3 Biogenic amines in different grades of finished wine
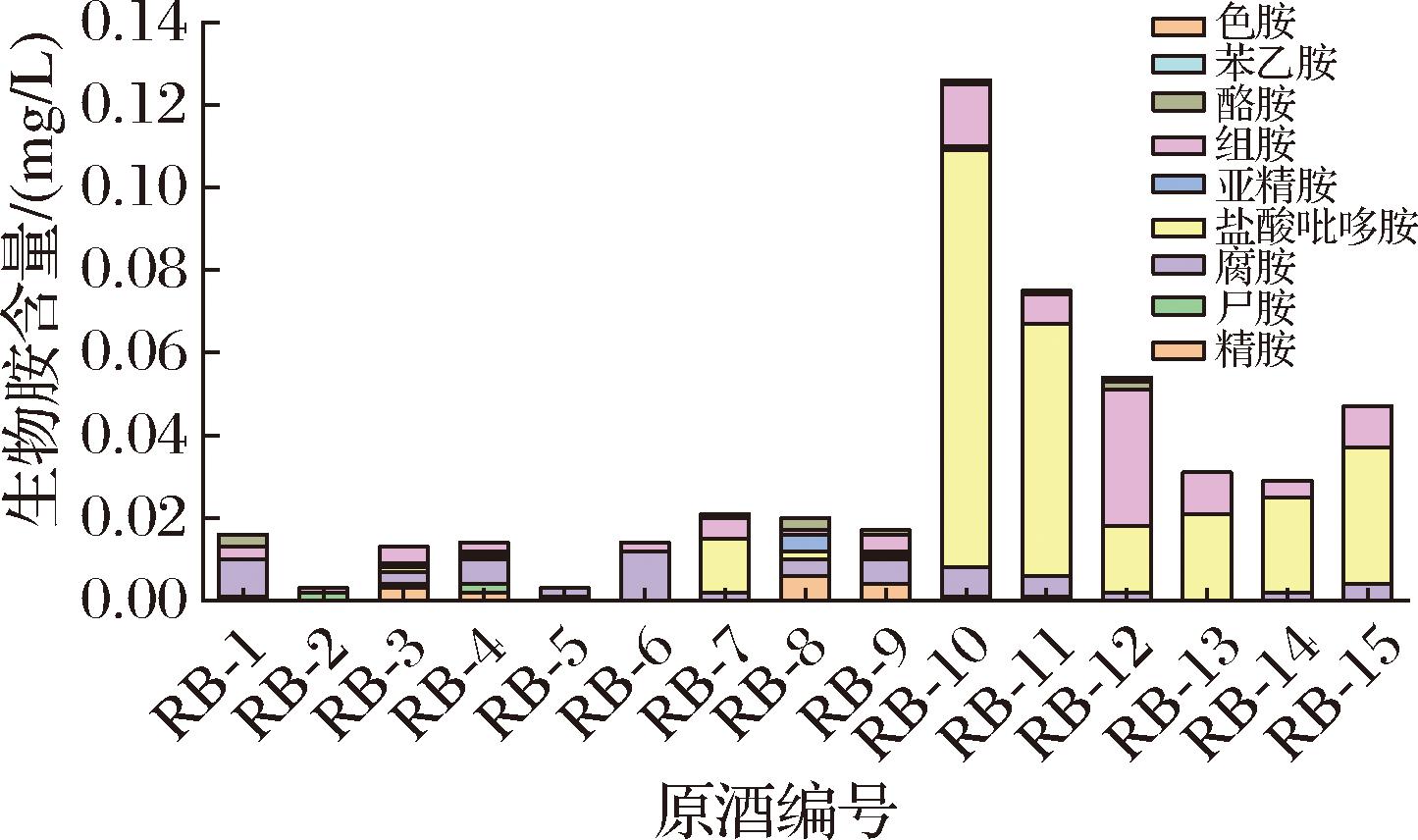
图4 原酒及食用酒精中生物胺含量
Fig.4 Biogenic amine content in raw brandy and edible alcohol
2.4.1 成品白兰地
由图3可知,白兰地成品酒中生物胺以盐酸吡哆胺、组胺、酪胺和腐胺为主,苯乙胺含量较其他BAs低,而精胺、尸胺、亚精胺和色胺几乎未检出。中低档各白兰地中生物胺含量和种类差异不明显,组胺和酪胺含量最高。高档白兰地中BAs总量差异相对较大,国产VSOP级白兰地FB-6与同级别进口白兰地FB-9、FB-11和FB-13相比,其生物胺总量更低。国产XO白兰地(FB-7和FB-8)与进口(FB-10)产品中生物胺总量和种类基本相似。
高档成品酒中主要以盐酸吡哆胺为主,在各化合物不超标的情况下,有关研究表明[19]:在防治糖尿病慢性并发症发生、发展的过程中,盐酸吡哆胺发挥着重要作用。生物胺与乙醇也有协同作用,尤其组胺和苯乙胺会加剧饮酒后带来的不适感[20],因此,饮料酒中低生物胺含量对于提升成品酒品质具有重要意义[21]。通常,葡萄酒中苹果酸-乳酸发酵(malic-lactic fermentation,MLF)被认为是BA产生的关键因素,主要由MLF过程中的乳酸菌形成,在这一阶段,产生的BA主要是腐胺、组胺和酪胺[21],说明生物胺的生成过程相对复杂,可推测白兰地酒样中生物胺含量变化与蒸馏过程中的酒头、中段酒、尾酒中各单体生物胺的属性有关[22]。
2.4.2 新蒸馏酒精及陈酿原酒
白兰地酒精及原酒是生产成品白兰地的基础,其品质的优劣一定程度上决定着成品白兰地的档次。新蒸馏普通级糖蜜酒精(RB-8)和优质糖蜜酒精(RB-9)生物胺种类无差异,但优质酒精生物胺总含量略低于普通酒精(图4),且前者以组胺和腐胺为主,后者则以精胺和亚精胺为主。与葡萄酒精相比,糖蜜酒精中生物胺种类较多,总量也较高。此外,国产白兰地原酒(RB-10、RB-11)生物胺总量(分别为126.0 μg/L和75.0 μg/L)高于进口原酒(RB-12、RB-14等)。在不同档次原酒中,生物胺含量范围在5.0~113.0 μg/L。
初步对比原酒不同贮存/陈酿方式,采用泡橡木板的木纳格酒精(RB-4)中BA总量较自然存放酒精(RB-2)更高,且经过橡木桶陈酿的原酒(RB-13~RB-15)显著高于未经桶藏的酒精,说明原酒贮藏过程中所接触的橡木对其生物胺(尤其组胺和盐酸吡哆胺)含量有明显影响。
对比活性炭处理对食用酒精中BA的影响(图5),经处理后,食用酒精中BA种类和总量均不同程度减少。其中,组胺和酪胺在处理前后含量基本无明显变化,但腐胺(除RB-20和RB-21外)含量平均降低61.5%,且原含有的微量盐酸吡哆胺被完全消除。研究[23]也表明在黄酒中添加活性炭对生物胺等物质具有吸附作用。
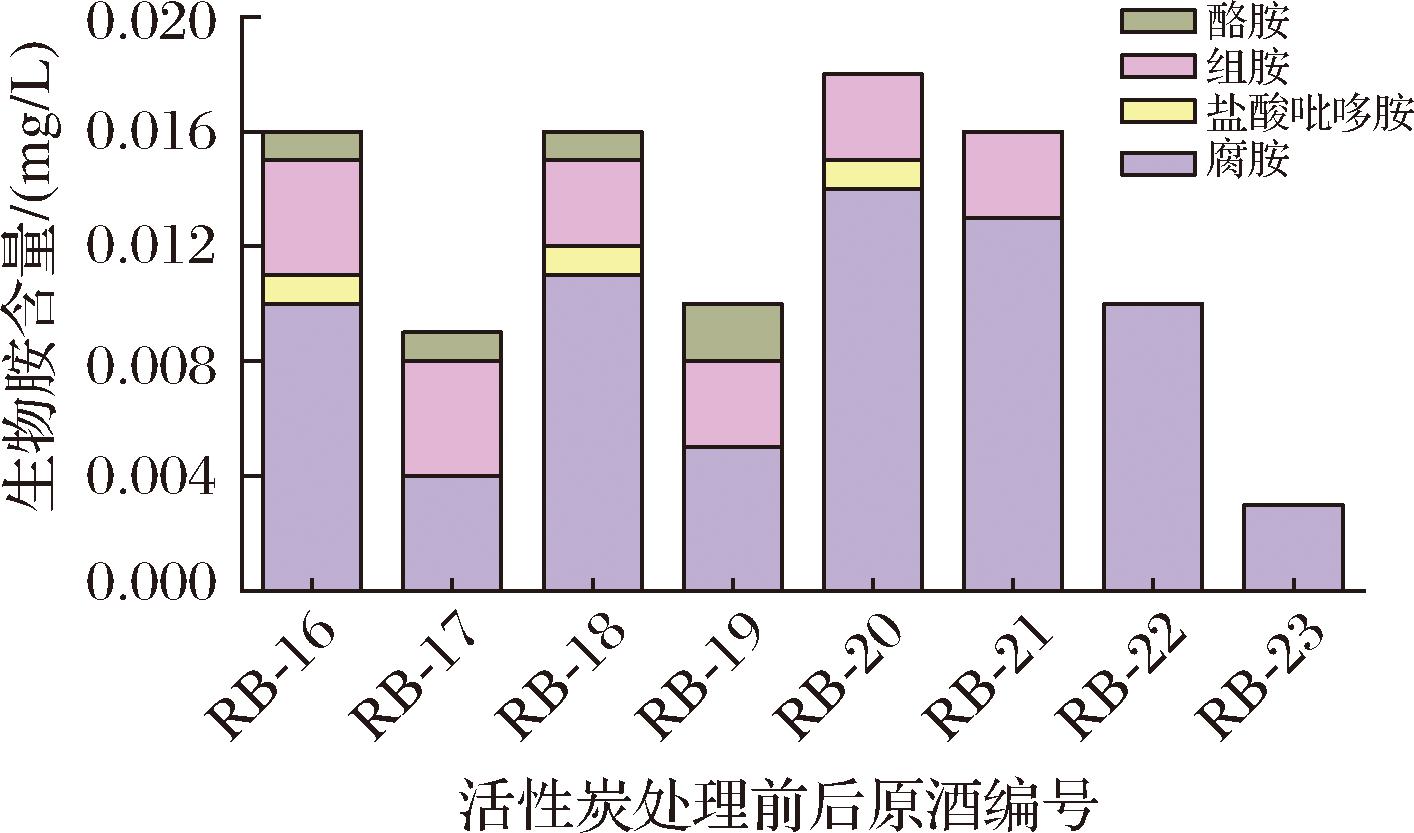
图5 活性炭处理原酒中生物胺含量
Fig.5 Biogenic amine content in raw wine treated with activated carbon
2.4.3 原酒和成品酒PCA分析
以白兰地成品酒及原酒样品中生物胺含量进行PCA分析,提取2个主成分,并分别以因子1和因子2的得分为横、纵坐标建立二维坐标图(图6)及在不同变量下的载荷矩阵表(表5),由图6可知,原酒和成品酒除聚集在各自特定的区域外,有部分样品相互交叉聚集(两个区域部分重叠),说明原酒和成品酒在生物胺含量上除具有显著差异之外,还具有一定相似性。其中,成品酒集中分布在X轴的负半轴,与中低端原酒有明显区别,主要因其主成分因子1相关的盐酸吡多胺(载荷系数0.620)、苯乙胺(载荷系数0.609)含量较高,且精胺(载荷系数-0.786)和亚精胺(载荷系数-0.740)含量与其他样品存在较大差异。同为X轴负半轴上的成品酒和高端原酒在Y轴的分布上也差异明显,经对比,中低端成品酒中与主成分因子2相关的酪胺(载荷系数0.816)和组胺(载荷系数0.765)具有较高的含量,而高端成品酒和高端原酒生物胺含量相似且相对较低。
表5 主成分因子载荷矩阵
Table 5 Rotated coefficient matrix of principal component factor

成分组分12精胺-0.786-0.045尸胺-0.488-0.069腐胺-0.2280.125盐酸吡哆胺0.620-0.492亚精胺-0.740-0.043组胺0.4710.765酪胺0.3350.816苯乙胺0.609-0.324色胺0.389-0.522
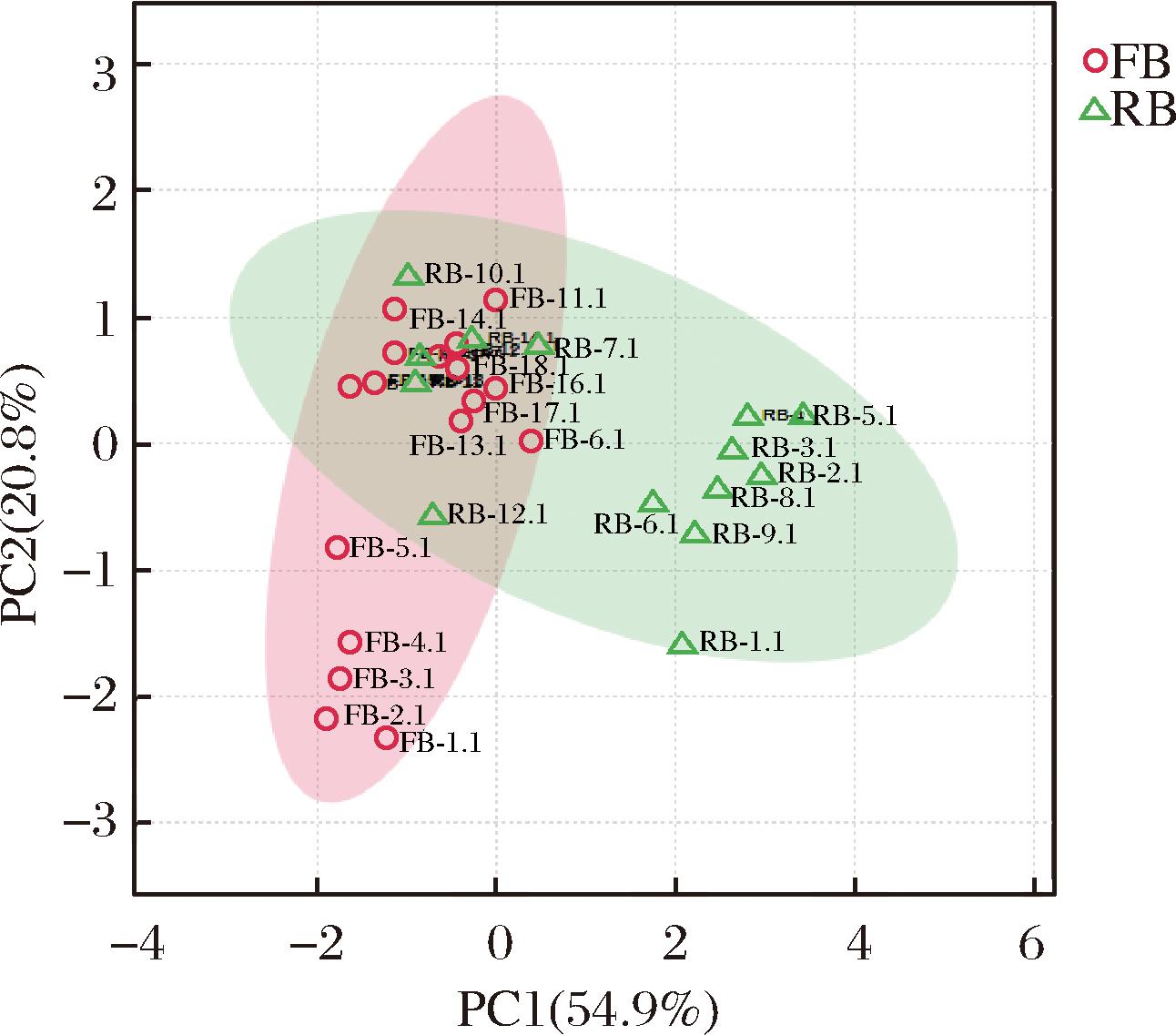
图6 主成分因子得分图
Fig.6 Score plot of principal component factor
注:FB代表成品酒;RB代表原酒。
2.5 不同酒精饮料中生物胺含量对比分析
不同类型的酒精饮料中,所含的生物胺通常具有明显差异。啤酒中BA总量约为4.21~10.59 mg/L[8],黄酒和白酒分别为2.56~260 mg/L和0.220 1~13.027 mg/L[21],而93个有检出的国内外葡萄酒中BA总量为0.27~44.89 mg/L(平均值12.58 mg/L)[24]。由此可知,成品白兰地中BA总量(17.0~148.0 μg/L,平均值70.9 μg/L)远低于黄酒等其他饮料酒,而白酒中BA含量同样相对较低,说明蒸馏环节可有效减少发酵产生的BA进入酒体[12]。
综上分析,白兰地中BA含量及种类可能与其原酒(酒精)原料、贮藏方式和陈酿时间等相关。白兰地原酒及成品酒中BA总量较低,显著低于黄酒等发酵酒,正常饮用水平下,白兰地途径摄入BA引起的安全风险相对较低。
3 结论
建立了同时检测白兰地中9种生物胺的HPLC-Q-Exactive-Orbitrap-HRMS方法,样品无需衍生化前处理,过滤膜后直接上机分析,C18色谱柱分离,正离子tMS2模式扫描,6.5 min内可完成9种生物胺的测定。各BA标准曲线相关系数值均大于0.995 2,LOD和LOQ分别为0.02~2.26 μg/L和0.05~7.55 μg/L。加标实验(n=6)各组分平均回收率为80.8%~119.2%,RSD为1.1%~9.7%。该方法简便快速,具有良好的灵敏度和精密度,可用于白兰地产品中BA含量的高效检测。
经样品分析,白兰地原酒和酒精中生物胺总量为3.0~126.0 μg/L,成品酒为17.0~148.0 μg/L。不同档次成品白兰地中组胺、酪胺和盐酸吡哆胺含量差异较大:盐酸吡哆胺为成品酒中最主要生物胺,且高档次酒中含量更高,而组胺和酪胺主要存在于中低档成品酒中,高档酒中含量极低。腐胺在不同档次酒样中虽均有检出,但含量较低;苯乙胺主要存在于成品酒中,其含量低于其他有检出的生物胺;不同产地和生产工艺的白兰地原酒样品中生物胺含量及种类有较大差异。研究结果可为高品质白兰地的酿造和质量控制提供一定的技术支撑。
[1] 潘思弋, 徐佳敏, 张惠玲, 等.一株降解生物胺乳酸菌用于葡萄酒苹果酸乳酸发酵的特性研究[J].食品与发酵工业, 2023, 49(24):140-148.PAN S Y, XU J M, ZHANG H L, et al.Characteristics of wine malolactic fermentation by a biogenic amine-degrading lactic acid bacterium[J].Food and Fermentation Industries, 2023, 49(24):140-148.
[2] 杨姗姗, 张凤艳, 蒋万枫, 等.发酵酒中生物胺的研究进展[J].中国酿造, 2022, 41(3):18-23.YANG S S, ZHANG F Y, JIANG W F, et al.Research progress of biogenic amines in fermented alcoholic drink[J].China Brewing, 2022, 41(3):18-23.
[3] REDRUELLO B, LADERO V, RIO B D, et al.A UHPLC method for the simultaneous analysis of biogenic amines, amino acids and ammonium ions in beer[J].Food Chemistry, 2017, 217:117-124.
[4] 冯雅蓉, 马俪珍.生物胺对食品安全和人类健康的重要性[J].肉类研究, 2005,19(12):25-28.FENG Y R, MA L Z.Significance of biogenic amines to food safety and human health[J].Meat Research, 2005,19(12):25-28.
[5] PRESTER L.Biogenic amines in fish, fish products and shellfish:A review[J].Food Additives and Contaminants:Part A, 2011, 28(11):1547-1560.
[6] 张凤杰, 王德良, 李红, 等.酒中生物胺对小鼠醉酒行为及脑中5-羟色胺含量的影响[J].酿酒科技, 2015(2):40-44.ZHANG F J, WANG D L, LI H, et al.Effects of biogenic amine in liquor on mice′s drunken behavior and the 5-HT content in thier brains[J].Liquor-Making Science &Technology, 2015(2):40-44.
[7] 王卉青, 张军翔.白兰地品质及其影响因素研究进展[J].中国酿造, 2019, 38(10):21-25.WANG H Q, ZHANG J X.Advances in research on brandy quality and its influencing factors[J].China Brewing, 2019, 38(10):21-25.
[8] 栾光辉, 刘春凤, 李崎.不同啤酒生物胺含量的比较[J].食品与发酵工业, 2013, 39(1):176-180.LUAN G H, LIU C F, LI Q.The comparison of biogenic amine content in different beers[J].Food and Fermentation Industries, 2013, 39(1):176-180.
[9] 温永柱, 范文来, 徐岩, 等.白酒中5种生物胺的HPLC定量分析[J].食品工业科技, 2013, 34(7):305-308.WEN Y Z, FAN W L, XU Y, et al.Quantification for 5 selected biogenic amines in Chinese liquor by HPLC[J].Science and Technology of Food Industry, 2013, 34(7):305-308.
[10] 丁涛, 吕辰, 柳菡, 等.高效液相色谱-四极杆/静电场轨道阱高分辨质谱检测葡萄酒中8种生物胺[J].分析测试学报, 2014, 33(1):27-32.DING T, LYU C, LIU H, et al.Determination of eight biogenic amines in red wines by liquid chromatography-quadrupole/electrostatic field orbit trap mass spectrometry[J].Journal of Instrumental Analysis, 2014, 33(1):27-32.
[11] 曹利瑞, 朱松, 俞剑燊, 等.黄酒中9种生物胺的高效液相色谱分析法[J].食品科学, 2016, 37(4):103-107.CAO L R, ZHU S, YU J S, et al.Development of an Analytical Method for Nine Biogenic Amines in Chinese Yellow Wine by HPLC[J].Food Science, 2016, 37(4):103-107.
[12] 刘慧琳, 赵源, 张瑛, 等.白酒和黄酒中生物胺的高效液相色谱分析法[J].中国食品学报, 2020, 20(8):248-254.LIU H L, ZHAO Y, ZHANG Y, et al.Determination of biogenic amines in Baijiu and Chinese rice by high performance liquid chromatography[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(8):248-254.
[13] 李湘楠, 梅涌现, 张晓晴, 等.超高效液相色谱法测定不同品种桃果酒中8种生物胺含量[J].食品安全质量检测学报, 2022, 13(12):3937-3944.LI X N, MEI Y X, ZHANG X Q, et al.Determination of 8 kinds of biogenic amines in different varieties of peach wines by ultra performance liquid chromatography[J].Journal of Food Safety and Quality, 2022, 13(12):3937-3944.
[14] 张颖, 张蕴, 赵永纲.分散固相萃取-高效液相色谱-串联质谱法测定红酒中14种生物胺及其代谢产物[J].中国卫生检验杂志, 2022, 32(9):1025-1029.ZHANG Y, ZHANG Y, ZHAO Y G.Detection of 14 biogenic amines and their metabolites in red wine by dispersive solid-phase extraction coupled with high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Health Laboratory Technology, 2022, 32(9):1025-1029.
[15] 周凌聿, 林倩妃, 王鸿霖, 等.水产品中生物胺的检测技术研究进展[J].肉类研究, 2022, 36(8):57-65.ZHOU L Y, LIN Q F, WANG H L, et al.Progress in analytical techniques for the detection of biological amines in aquatic products[J].Meat Research, 2022, 36(8):57-65.
[16] 张永茂, 唐会鑫, 李朔, 等.酱油和醋中8种生物胺的高效液相色谱串联质谱测定法[J].职业与健康, 2022, 38(14):1898-1901.ZHANG Y M, TANG H X, LI S, et al.Determination of eight kinds of biogenic amines in soy sauce and vinegar by high performance liquid chromatography tandem mass spectrometry[J].Occupation and Health, 2022, 38(14):1898-1901.
[17] 张慧, 曹慧, 王瑾, 等.高效液相色谱—三重四极杆串联质谱法分析奶酪中5种生物胺[J].食品与机械, 2023, 39(10):80-86.ZHANG H, CAO H, WANG J, et al.Determination of 5 kinds of biogenic amines in cheeses by high performance liquid chromatography-tandem mass spectrometry[J].Food &Machinery, 2023, 39(10):80-86.
[18] 刘洋帆, 李绪鹏, 冯阳, 等.超高效液相色谱-串联质谱法测定鲣鱼中的生物胺[J].食品与发酵工业, 2022, 48(20):225-230.LIU Y F, LI X P, FENG Y, et al.The detection of biogenic amines in skipjack tuna by using the ultrahigh performance liquid chromatography-tandem mass spectrometry method[J].Food and Fermentation Industries, 2022, 48(20):225-230.
[19] SINGH R, BARDEN A, MORI T, et al.Advanced glycation end-products:A review[J].Diabetologia, 2001, 44(2):129-146.
[20] SUN H L, LIU S P, MAO J Q, et al.New insights into the impacts of Huangjiu compontents on intoxication[J].Food Chemistry, 2020, 317:126420.
[21] 李书婷, 尹礼国, 吴正云, 等.中国黄酒和白酒中生物胺的研究进展[J].食品与发酵工业, 2024, 50(10):327-334.LI S T, YIN L G, WU Z Y, et al.Research progress of biogenic amines in Chinese Huangjiu and Baijiu[J].Food and Fermentation Industries, 2024, 50(10):327-334.
[22] 范文来, 徐岩, 温永柱.白酒发酵与蒸馏过程中5种生物胺变化[J].食品工业科技, 2015, 36(9):144-146;157.FAN W L, XU Y, WEN Y Z.Quantification for 5 selected biogenic amines in fermentation and distillation of Chinese liquor by HPLC[J].Science and Technology of Food Industry, 2015, 36(9):144-146;157.
[23] 谢铃, 刘双平, 毛健.活性炭过滤对黄酒品质的影响研究[J].食品与发酵工业, 2024, 50(4):31-36.XIE L, LIU S P, MAO J.Effect of activated carbon filtration on the quality of Huangjiu[J].Food and Fermentation Industries, 2024, 50(4):31-36.
[24] 刘睿, 王琳, 毕会芳, 等.葡萄酒中生物胺含量分析和控制措施[J].食品工业, 2020, 41(12):331-336.LIU R, WANG L, BI H F, et al.Analysis and control of biogenic amines in wine[J].The Food Industry, 2020, 41(12):331-336.