雨生红球藻(Hoematococcus pluvialis)是一种隶属绿藻门,红球藻属的海洋藻类,因其富含β-胡罗卜素、藻蛋白、ω-3不饱和脂肪酸等生物活性物质[1-2],被誉为具有高营养价值的经济微藻。有研究表明雨生红球藻提取物(Haematococcus pluvialis extract,HPE)可以促进细胞再生,减少衰老细胞的堆积,以及维持机体的平衡[3],通过降低细胞内活性氧(reactive oxygen species, ROS)水平、促进线粒体膜电位(mitochondrial membrane potential, MMP)水平和积累储存碳水化合物(糖原)来有效延长酵母实际寿命[4]。由于HPE具有出色的抗氧化性与抗衰老特性[5],已被广泛地用于保健品、饲料、化妆品等领域[6-7]。然而,目前对于HPE的研究主要集中在虾青素[8-9],HPE除虾青素外的其他活性成分(如小分子活性肽等)与延缓皮肤衰老机制均不明确。
网络药理学是根据系统生物学理论进行多种成分、靶点的药物研究的学科,通常使用成分筛选和收集、靶点预测和网络分析来呈现全面的药物-靶点-疾病相互作用网络[10]。近年来,网络药理学已成为筛选潜在的生物活性化合物、发现靶点、研究多靶点药理作用和复杂作用机制的主导范式[11-13]。
鉴于HPE除虾青素外的其他活性成分不明确、延缓皮肤衰老的作用机制尚不清晰,本研究拟通过超高效液相色谱串联质谱法(ultra performance liquid chromatography-mass spectrometry,UPLC-MS/MS)进行HPE成分鉴定,结合网络药理学,预测HPE延缓皮肤衰老的关键成分、核心靶点以及成分、靶点的作用通路,并通过体外细胞实验进行功效验证。
1 材料与方法
1.1 材料与试剂
HPE由禾美(浙江)生物科技有限公司制备:用中性蛋白酶对雨生红球藻粉进行酶解,离心收集上清液。澄清上清液后,收集淡黄色澄清透明的HPE溶液。
细胞培养所用Gibico优质胎牛血清、青链霉素混合液、杜氏改良Eagle培养基(Dulbecco′s modified eagle medium, DMEM)、用于 NO含量检测的ELISA试剂盒购自上海碧云天有限公司;用于Ⅰ型胶原蛋白(collagenⅠ,COⅠ)含量检测的ELISA试剂盒购自杭州联科生物公司。
1.2 仪器与设备
Thermo Scientific UltiMate 3000液相色谱系统, 美国赛默飞世尔科技公司;ACQUITY UPLC BEH C18色谱分析柱(100 mm×2.1 mm,1.8 μm),美国沃特世公司;TripleTOF5600 plus高分辨率质谱仪,英国SCIEX公司。
1.3 实验方法
1.3.1 HPE成分分析
量取20 μL HPE溶液,溶解于120 μL 50%(体积分数,下同)甲醇溶液中,振动充分混匀,放-20 ℃冰箱过夜,沉淀HPE中蛋白质。离心后,转移上清液到96孔板。
数据采集时,柱温设置为 35 ℃,流速为0.4 mL/min。采用的流动相为A相:水(0.1%甲酸);B相:乙腈(0.1%甲酸)。液相梯度设置如表1所示。
表1 液相梯度设置表
Table 1 Liquid phase gradient settings
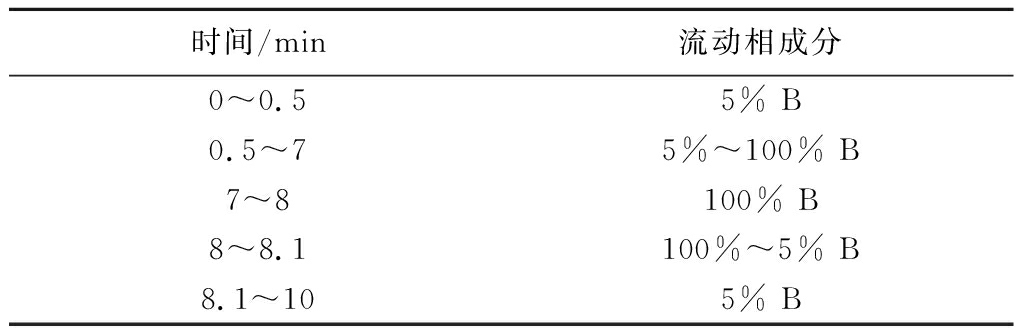
时间/min流动相成分0~0.5 5% B0.5~7 5%~100% B7~8100% B8~8.1 100%~5% B8.1~105% B
质谱条件:每个样本进行1次正离子模式采集(电压为5 000 V)和1次负离子模式采集(电压为-4 500 V)。采集数据的模式为信息依赖性采集模式。
1.3.2 HPE网络药理学分析
1.3.2.1 HPE活性成分靶点预测及衰老相关靶点筛选
通过TCMSP(https://old.tcmsp-e.com/tcmsp.php)、SwissTargetPrediction(http://swisstargetprediction.ch/)等数据库查询活性成分及相关靶点,用UniPort数据库(https://www.uniprot.org/)校正靶点名称为标准名称。此方法符合网络药理学评价方法指南相关要求[14]。
通过衰老生物学的多组学数据库Aging Atlas(https://ngdc.cncb.ac.cn/ag-ing/index)、细胞衰老基因数据库CellAge(https://genomics.senescence.info/cells)、人类老龄化基因组资源HAGR(https://genomics.senescence.info/)、基因集富集分析GSEA(https:// www.gseamsigdb.org)中输入“Aging”查询衰老相关靶点,汇总后去重。
1.3.2.2 原料-活性成分-靶点-症状网络图的构建
汇总所筛选得到的HPE有效成分及其所对应的潜在靶点,构建HPE中有效成分与其潜在靶点的网络关系图。
1.3.2.3 蛋白-蛋白相互作用网络的构建及核心靶点筛选
将HPE延缓衰老的靶点导入STRING平台进行分析,物种限于人(homo sapien),创建蛋白互作(protein-protein interaction networks, PPI)网络,将PPI网络下载之后导入Cytoscape3.6.1,基于CytoNCA插件进行核心靶点分析,点度中心(degree centrality,DC)值(D值)排名前30的靶点为HPE延缓衰老的核心靶点。
1.3.2.4 GO、KEGG富集分析与关键成分-核心靶点-通路网络图的构建
通过MetaScape平台(https://metascape.org/gp/index.html)对核心靶点进行基因本体(gene ontology, GO)富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes, KEGG)通路富集分析。
汇总HPE中核心靶点及其对应的关键成分,构建HPE关键成分-核心靶点-通路网络图。
1.3.2.5 分子对接
通过Auto Dock软件进行分子对接,其中靶蛋白结构通过蛋白质数据库(protein data bank, PDB)(https://www1.rcsb.org/)下载,关键成分的3D结构通过Pubchem (https://pubchem.ncbi.nlm.nih.gov/)下载。对接分数<-3的化合物和靶点具有较好的结合能力,最后利用Pymol进行可视化处理。
1.3.3 细胞实验
1.3.3.1 细胞培养
使用含10%(体积分数)FBS及2%(体积分数)青链霉素混合液的高糖DMEM培养液,在5% CO2、37 ℃环境下培养小鼠巨噬(Raw264.7)细胞与人包皮成纤维(human foreskin fibroblast, HFF)细胞。
1.3.3.2 ELISA法检测Raw264.7细胞经LPS损伤后NO含量
取对数生长期Raw264.7细胞,调整密度为2×105个/孔,接种于12 孔板中,每孔1 mL,培养24 h后(细胞融合度60%~75%)弃去上清液,根据预实验结果,空白对照组加培养液1 mL,阴性对照组加含1 μg/mL脂多糖(lipopolysaccharide,LPS)的培养液1 mL,阳性对照组加含100 μg/mL地塞米松的培养液1 mL,样品组加含体积分数0.5%、1% HPE的培养液100 μL,继续培养24 h后,取上清液,每组设置2个复孔,使用ELISA试剂盒检测NO含量。
1.3.3.3 ELISA法检测HFF细胞经UVA照射后CO Ⅰ含量
取对数生长期HFF细胞,调整密度为1×105个/孔,接种于24孔板中,每孔500 μL,培养24 h后(细胞融合度60%~75%)弃去上清液,阳性对照组加含0.1 μg/mL 转化生长因子-β1(transforming growth factor beta 1, TGF-β1)的培养液100 μL,样品组加含体积分数0.5% HPE的培养液100 μL,其余组加培养液100 μL,放置于紫外光疗仪,照射剂量为2~5 J/cm2,照射15 min。照射完成后弃去上清液,用PBS缓冲液洗涤细胞1~2次,重复加样操作,继续培养24 h后,取上清液,每组2个复孔,使用ELISA试剂盒检测CO Ⅰ含量。
1.4 数据处理与分析
采用GraphPad Prism 9进行统计分析,数据以![]() 表述。多组间数据比较采用单因素方差分析。P<0.05为差异具有统计学意义。
表述。多组间数据比较采用单因素方差分析。P<0.05为差异具有统计学意义。
2 结果与分析
2.1 HPE成分鉴定
通过UPLC-MS/MS检测,得到了HPE总离子流图(图1-A、图1-B),在正离子、负离子模式下色谱峰均较为丰富。通过比对二级质谱图谱库,共鉴定得到五类活性物(图1-C),共16种活性成分(表2),16种活性成分均能检索到靶点且物质类药性(drug-like properties,DL)不小于0.18(DL≥0.18)。
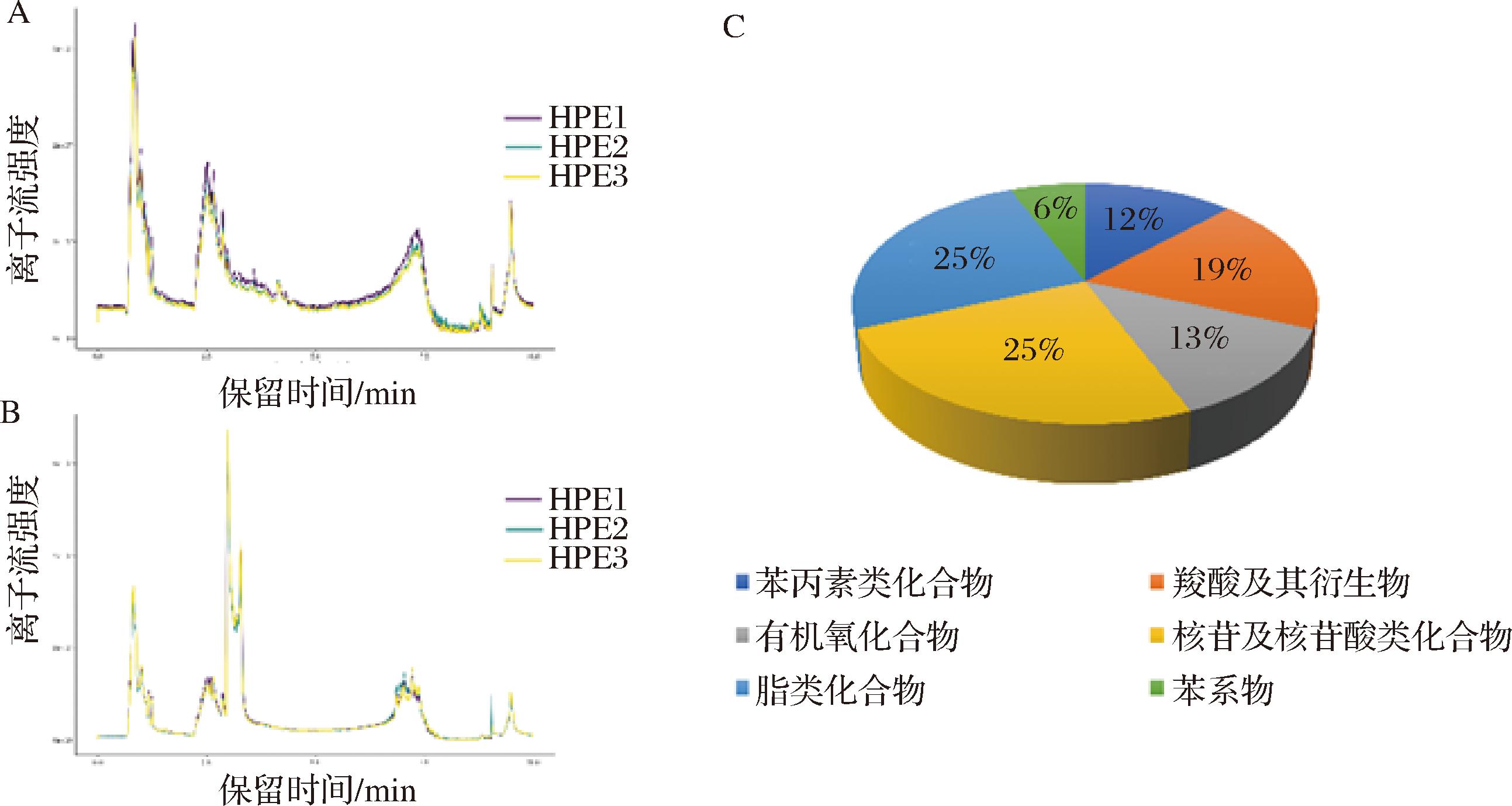
A-正离子模式下离子流图;B-负离子模式下离子流图;C-化合物分类图
图1 总离子流图与化合物分类图
Fig.1 Total ion currentand compound classification chart
表2 HPE活性成分具体信息
Table 2 HPE active ingredients specific information
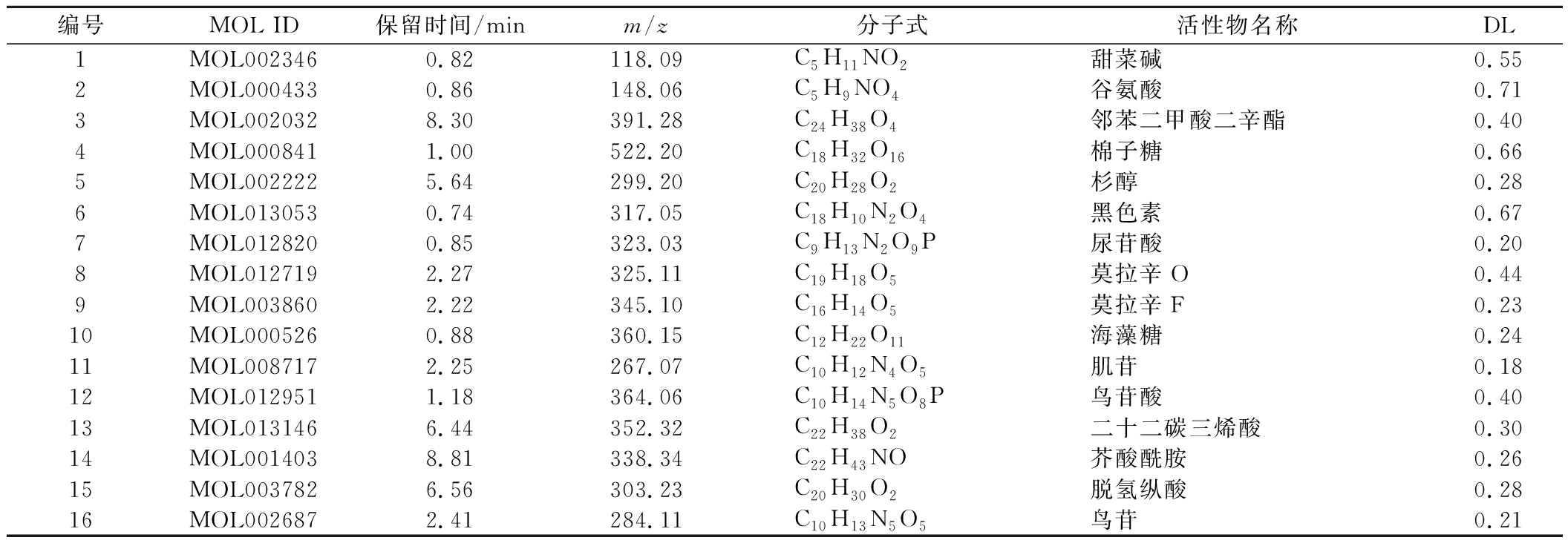
编号MOL ID保留时间/minm/z分子式活性物名称DL1MOL0023460.82118.09C5H11NO2甜菜碱0.552MOL0004330.86148.06C5H9NO4谷氨酸0.713MOL0020328.30391.28C24H38O4邻苯二甲酸二辛酯0.404MOL0008411.00522.20C18H32O16棉子糖0.665MOL0022225.64299.20C20H28O2杉醇0.286MOL0130530.74317.05C18H10N2O4黑色素0.677MOL0128200.85323.03C9H13N2O9P尿苷酸0.208MOL0127192.27325.11C19H18O5莫拉辛O0.449MOL0038602.22345.10C16H14O5莫拉辛F0.2310MOL0005260.88360.15C12H22O11海藻糖0.2411MOL0087172.25267.07C10H12N4O5肌苷0.1812MOL0129511.18364.06C10H14N5O8P鸟苷酸0.4013MOL0131466.44352.32C22H38O2二十二碳三烯酸0.3014MOL0014038.81338.34C22H43NO芥酸酰胺0.2615MOL0037826.56303.23C20H30O2脱氢纵酸0.2816MOL0026872.41284.11C10H13N5O5鸟苷0.21
2.2 HPE网络药理学分析
2.2.1 HPE活性成分作用靶点、衰老靶点检索结果
通过SwissTargetPrediction平台进行16种活性成分作用靶点预测,设置物种为人(homo sapiens),16种活性成分共预测得到725个靶点。
通过Aging Atlas、CellAge、HAGR、GSEA等数据库,以“Aging”为关键词进行检索,共得到衰老相关靶点805个。
2.2.2 原料-活性成分-靶点-症状网络的构建结果
HPE活性成分作用靶点与衰老相关靶点取交集后,得到HPE延缓衰老的潜在靶点196个(图2-A)。绘制HPE延缓衰老的“原料-活性成分-靶点-症状”网络(图2-B),体现HPE的16种活性成分通过196个靶点实现延缓衰老的作用网络。
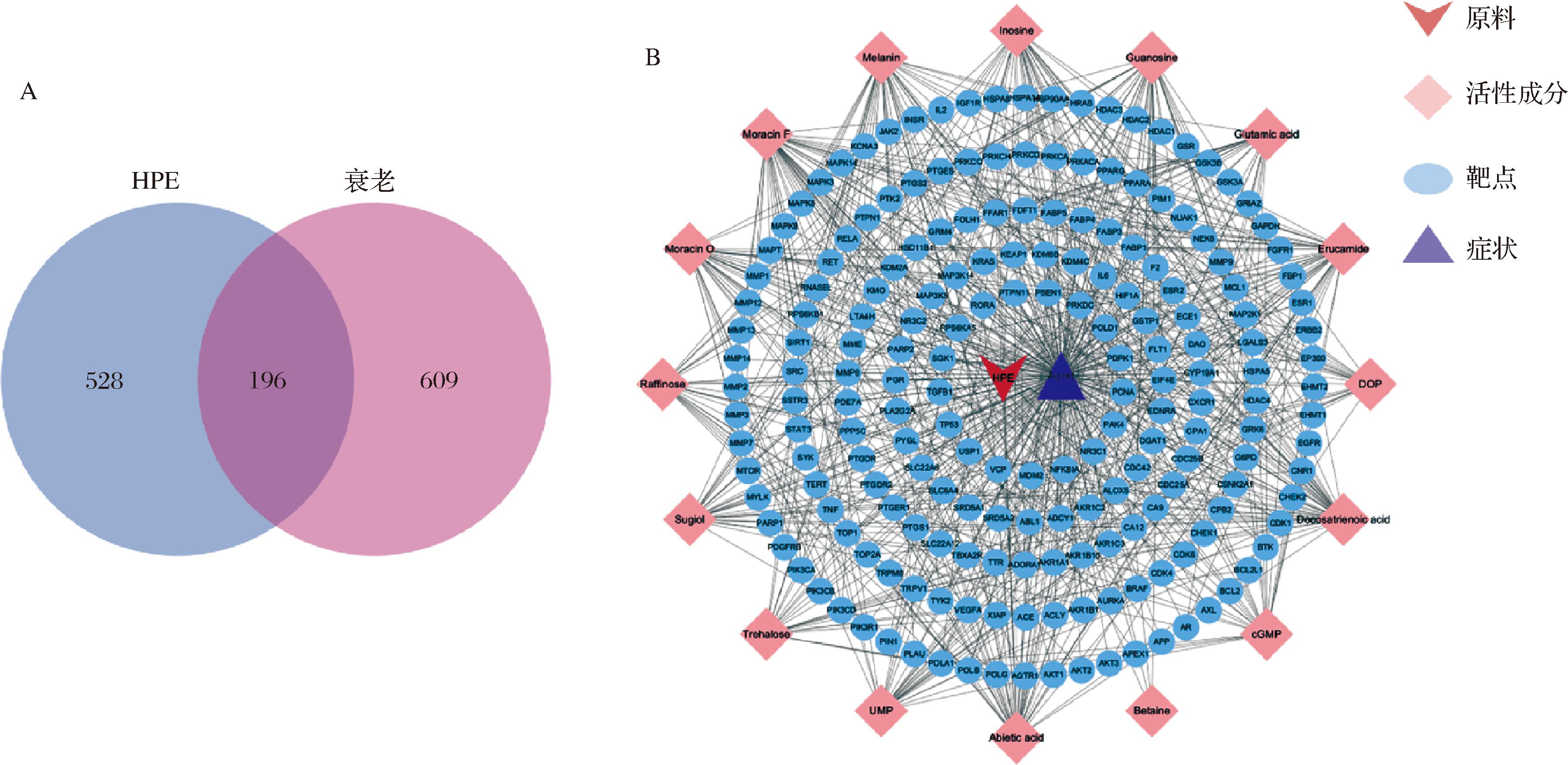
A-HPE与衰老交集靶点;B-原料-活性成分-靶点-症状网络图
图2 HPE-衰老交集靶点与原料-活性成分-靶点-症状网络图
Fig.2 HPE-aging crossover target and material-active ingredient-target-symptom network
2.2.3 蛋白-蛋白相互作用网络的构建及核心靶点筛选结果
将HPE延缓衰老的靶点导入STRING平台,构建PPI网络。在196个蛋白质节点中共有1 344条互作连线,平均D值为33.5。在String网站中下载TSV格式文件导入Cytoscape(图3-A),通过CytoNCA插件对靶点进行分析,按介数中心性(betweenness centrality, BC)进行筛选,D值进行排名,颜色越深的靶点排名越靠前,即相互作用的蛋白越多。取D值排名前30的靶点为核心靶点(图3-B,表3)。
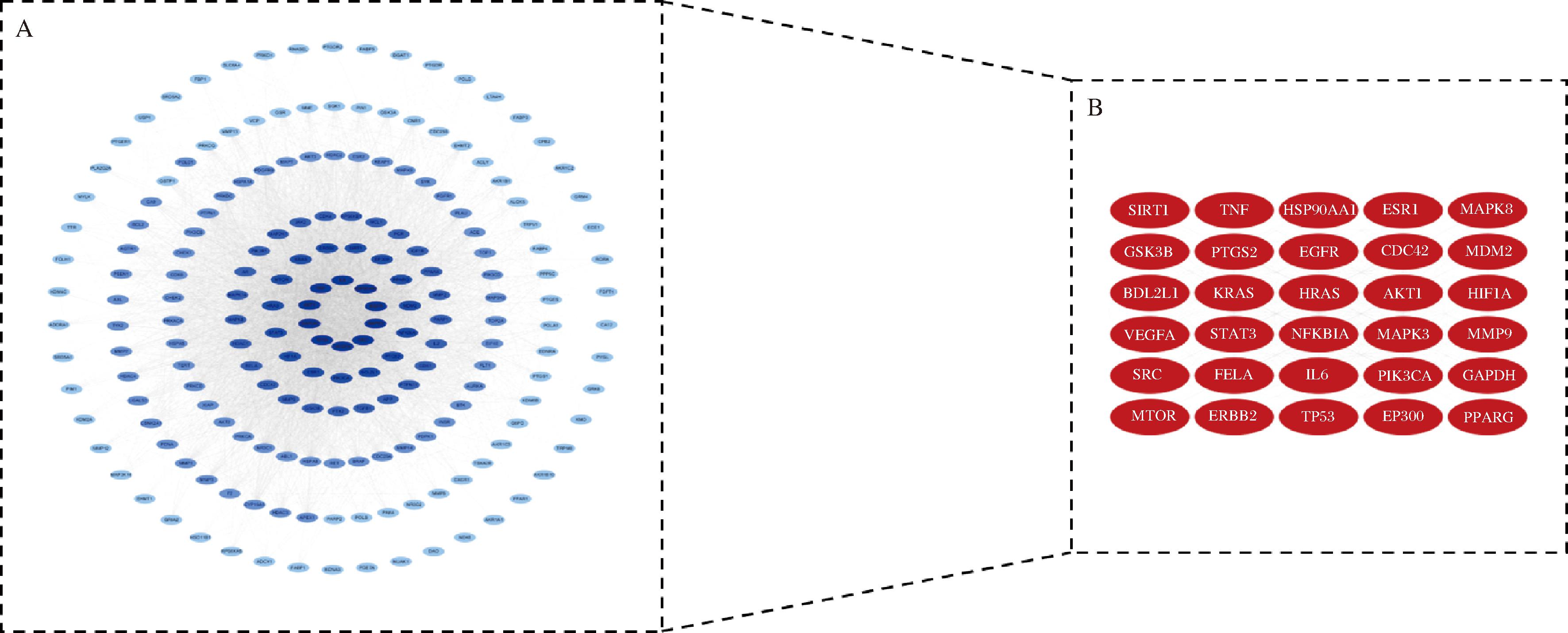
A-蛋白互作网络;B-核心靶点网络
图3 蛋白互作网络与核心靶点网络
Fig.3 protein interaction network and core target network
表3 HPE延缓衰老核心靶点D值
Table 3 HPE age-delaying core target degree value
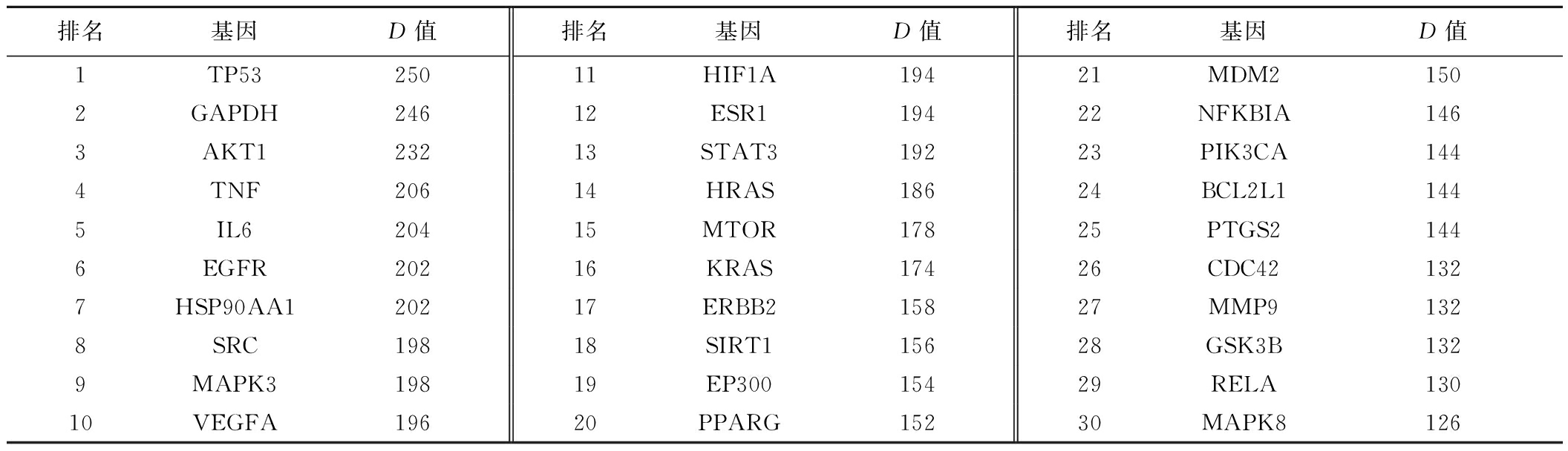
排名基因D值排名基因D值排名基因D值1TP5325011HIF1A19421MDM21502GAPDH24612ESR119422NFKBIA1463AKT123213STAT319223PIK3CA1444TNF20614HRAS18624BCL2L11445IL620415MTOR17825PTGS21446EGFR20216KRAS17426CDC421327HSP90AA120217ERBB215827MMP91328SRC19818SIRT115628GSK3B1329MAPK319819EP30015429RELA13010VEGFA19620PPARG15230MAPK8126
2.2.4 GO、KEGG富集分析与关键成分-核心靶点-通路网络图的构建结果
对HPE延缓衰老的核心靶点进行GO富集,按照富集强度选择排名前十的条目进行分析(图4-A),细胞组成主要为核因子κB (nuclear factor kappa-B, NF-κB)与NF-κB抑制剂(inhibitor of NF-κB, I-κB)复合体、转录调节复合物、核膜等;分子功能主要体现在NF-κB结合、NO合酶调节活性、丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)活性等方面;生物过程主要涉及到原代miRNA加工的负调节、I-κB磷酸化的正向调节、对UVA的反应等方面。
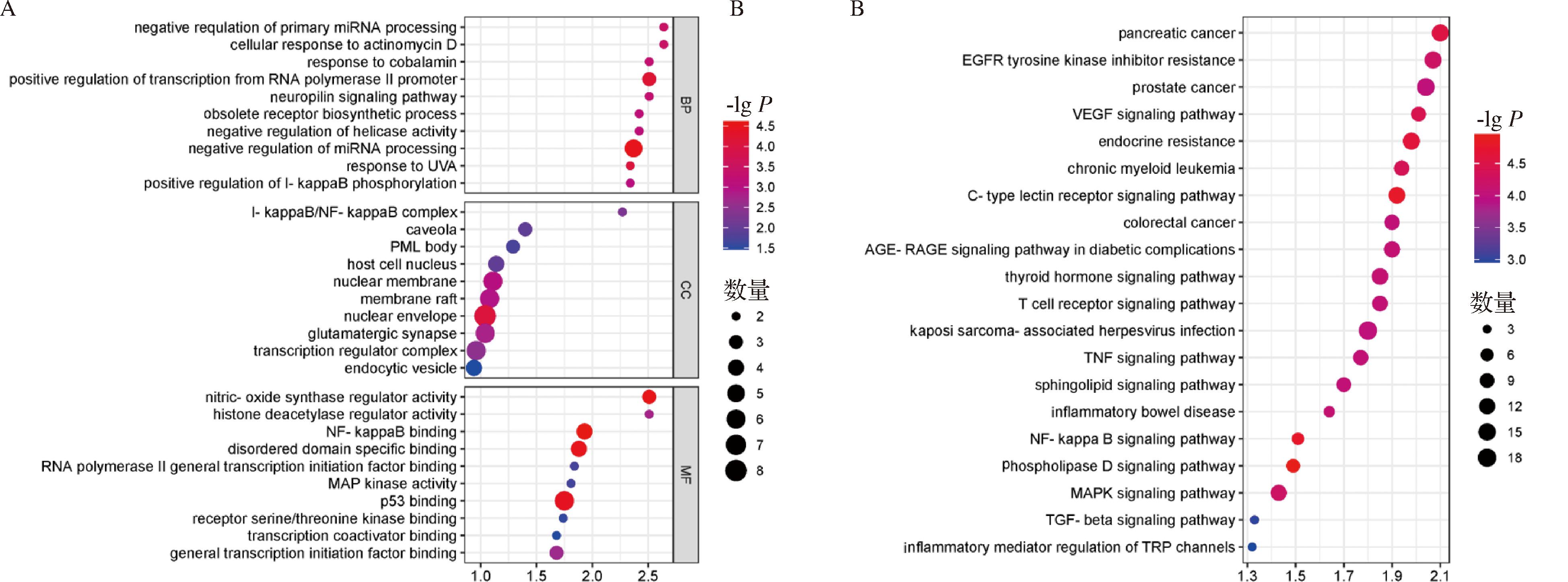
A-GO富集分析气泡图;B-KEGG富集分析气泡图
图4 GO富集与KEGG富集分析气泡图
Fig.4 GO enrichment analysis and KEGG enrichment analysis bubble diagram
对HPE延缓衰老的核心靶点进行KEGG富集,按照富集强度选择排名前20的通路进行分析(图4-B),去除与皮肤衰老无关的通路,HPE主要作用于调控MAPK信号通路(hsa04010)、NF-κB信号通路(hsa04064)、瞬时受体电位(transient receptor potential, TRP)离子通道的炎症介质调节通路(hsa04750)、转化生长因子 (transforming growth factor beta,TGF-β)信号通路(hsa04350)等,实现延缓皮肤衰老的功效。
构建关键成分-核心靶点-通路网络图如图5所示。节点和节点之间的连线代表相互作用的关键成分、核心靶点和通路之间的联系。
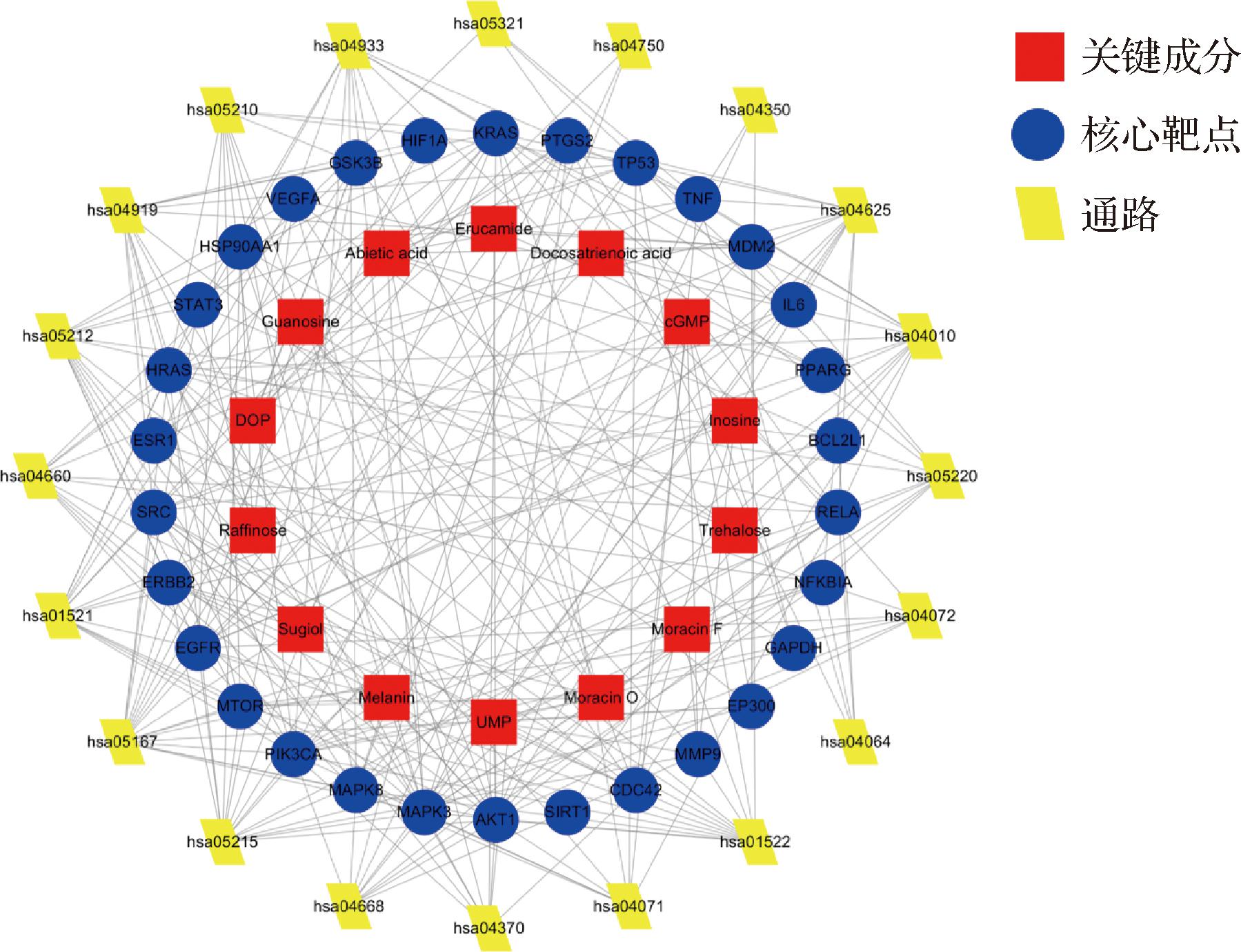
图5 关键成分-核心靶点-通路网络图
Fig.5 Key component-core target-pathway network diagram
2.2.5 分子对接
根据关键成分-核心靶点-通路网络图,选择与皮肤衰老最相关的通路中D值排名前3的关键成分与核心靶点,分别是NF-κB通路中的肿瘤坏死因子(tumor necrosis factor,TNF)、MAPK通路中的EGFR、MAPK3等3个核心靶点,与杉醇、脱氢纵酸、二十二碳三烯酸等3个关键成分的分子对接结果如表4所示,可视化结果如图6所示。3种关键成分与核心靶点的结合分数<-3,代表两者具有良好的结合能力。
表4 关键成分与核心靶点对接分数
Table 4 Key components and core target docking scores
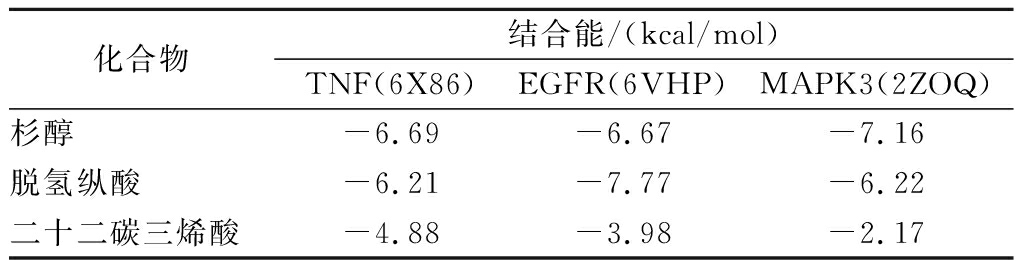
化合物结合能/(kcal/mol)TNF(6X86)EGFR(6VHP)MAPK3(2ZOQ)杉醇-6.69-6.67-7.16脱氢纵酸-6.21-7.77-6.22二十二碳三烯酸-4.88-3.98-2.17

图6 关键成分与核心靶点的分子对接图
Fig.6 Molecular docking map of key components to core targets
2.3 细胞实验
结合GO富集与KEGG富集结果,NO对NF-κB通路具有调控作用[15]、UVA对MAPK通路具有调控作用[16],以及富集到大量的炎症通路与炎症靶点,本研究对HPE降低炎症因子NO含量与修复UVA照射损伤的功效进行检测,从舒缓炎症与促进COⅠ分泌两方面实验,进一步说明HPE延缓皮肤衰老功效。
2.3.1 ELISA法检测Raw264.7细胞经LPS损伤后NO含量
如图7-A所示,经LPS诱导后,Raw264.7细胞中炎症因子NO表达,经地塞米松(阳性对照)、HPE作用后,炎症因子NO表达量降低(P<0.05),说明0.5%体积分数的HPE能显著(P<0.05)降低Raw264.7细胞中NO炎症因子表达。
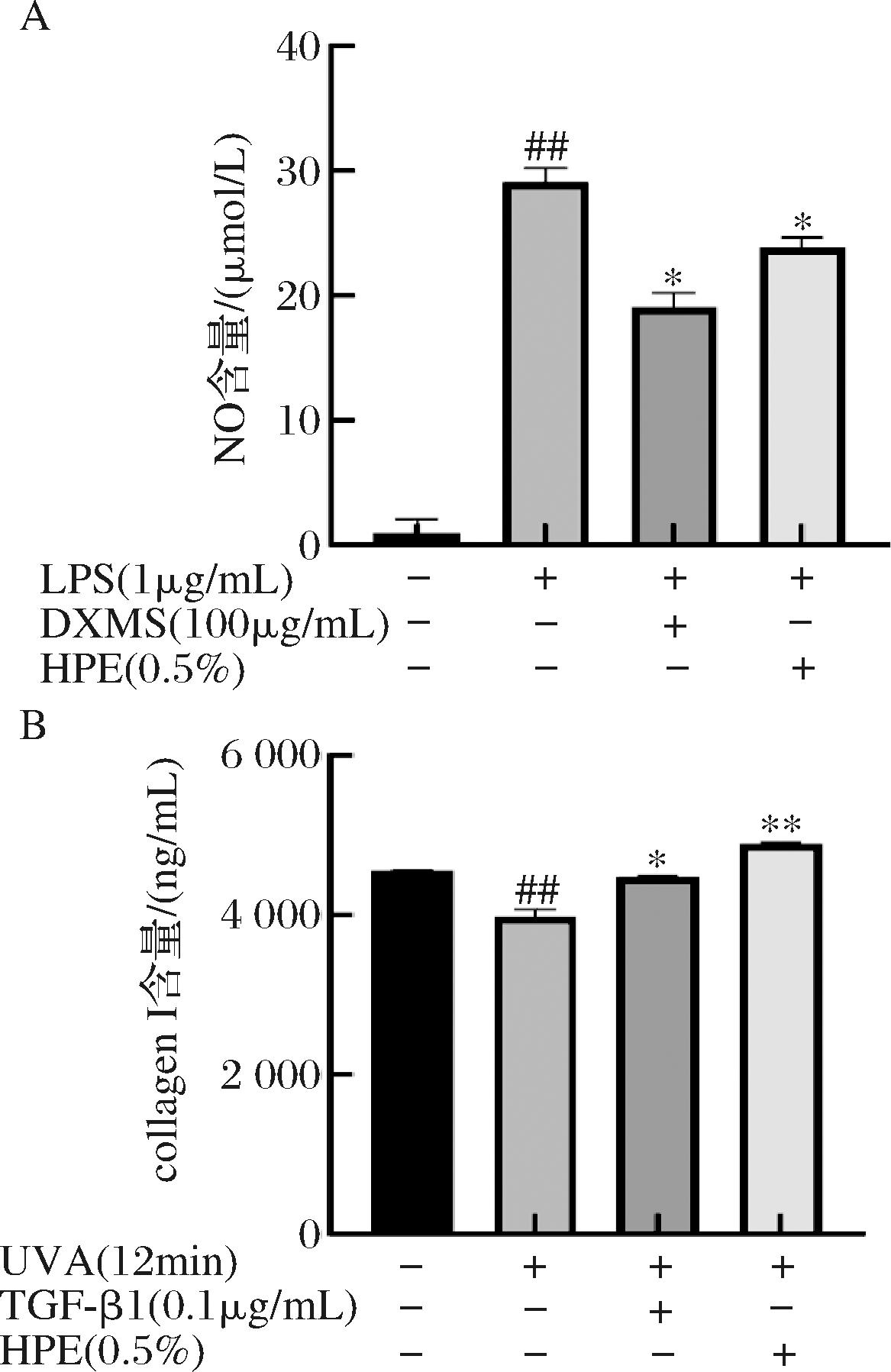
A-Raw264.7细胞中NO含量;B-UVA照射HFF细胞后COⅠ含量
图7 HPE作用对LPS损伤与UVA损伤的影响
Fig.7 Effect of HPE action on LPS damage and UVA damage
注:“##”表示损伤处理组与未经诱导细胞组相比具有显著差异且P<0.01,“*”表示HPE添加组与损伤处理组相比具有显著差异且P<0.05,“**”表示HPE添加组与损伤处理组相比具有显著差异且P<0.01。
2.3.2 ELISA法检测HFF细胞经UVA照射后COⅠ含量
如图7-B所示,经UVA照射损伤后,HFF细胞COⅠ含量降低,经TGF-β(阳性对照)、HPE作用后,COⅠ含量升高(P< 0.05),说明5%体积分数的HPE能极显著(P<0.01)促进HFF细胞COⅠ分泌,修复UVA照射造成的细胞损伤。
3 讨论
衰老是内源性因素(如遗传、激素变化、细胞程序性死亡等)与外源性因素(如紫外线照射、化学品刺激等)共同作用的结果[17],近年来大量研究表明,炎症已成为衰老与衰老相关疾病关联的通路[18-20]。在皮肤衰老的发生机制中,氧化应激与DNA损伤皆与炎症相关[21],且炎症介导多种皮肤不良反应的发生[22-24]。因此,对于炎症性通路的靶向调控是延缓皮肤衰老的新思路。
本研究通过网络药理学分析,筛选出HPE延缓皮肤衰老的关键成分、核心靶点及作用通路。关键成分-核心靶点-相关通路网络图显示,HPE中关键的活性成分有:海藻糖、棉子糖、杉醇、脱氢纵酸、芥酸酰胺、肌苷、莫拉辛O/F、二十二碳三烯酸、黑色素、邻苯二甲酸二辛酯、鸟苷、鸟苷酸、鸟苷酸等14种。海藻糖已被证实可通过增加抗氧化酶活力,降低TNF-α、IL-1β、IL-6等炎症因子释放,上调Nrf2、过氧化氢酶抗氧化基因等途径延缓机体衰老[25]。棉子糖通过刺激肝X受体介导角质形成细胞分化和脂质积累,增强皮肤屏障功能并减少炎症性皮肤病的发生[26-27]。杉醇能够抑制炎症反应,促进细胞凋亡,并对NF-κB和MAPK信号通路发挥明显的调节作用[28]。此3种成分已广泛用于化妆品研制,其他成分也均通过多条途径对体内炎症反应、机体衰老起到调节作用[29-33]。
通过对网络药理学预测得到的核心靶点进行GO富集,发现HPE关键靶点具有调节NF-κB结合、MAPK活性、NO合酶活力等功能,参与机体对UVA的反应过程。NF-κB被广泛认为是促炎转录因子,因其通常与促炎细胞因子基因表达相关[34]。MAPK是一组丝氨酸-苏氨酸蛋白激酶,能够被细胞因子、神经递质、激素等细胞外刺激激活,作为促炎细胞因子受体下游的信号分子,通过转录和转录后调控介导促炎细胞因子的合成[35]。NO合酶被促炎细胞因子激活后,释放大量NO,直接破坏线粒体氧化磷酸化功能,产生ROS,ROS直接通过细胞质、核孔进入细胞核内,造成DNA损伤[36],同时NO的持续作用使其下游靶标NF-κB无法被抑制,形成体内慢性促炎环境,引发机体炎症性衰老。UVA能够激活机体炎症介质的产生,以及NF-κB、MAPK信号通路等,释放促炎细胞因子,导致慢性炎症和炎症衰老的增加[37]。
通过KEGG代谢通路富集分析发现,HPE延缓皮肤衰老的机制主要涉及到NF-κB信号通路、TGF-β信号通路、MAPK信号通路、TRP通道的炎症介质调节通路等,其中NF-κB信号通路、MAPK信号通路前文已做出说明。TGF-β是一类转化生长因子,TGF-β信号转导障碍将导致人皮肤成纤维细胞中胶原蛋白生成量减少[38],从而使皮肤变薄,皱纹增加,这也是人体皮肤老化的突出特征。TRP通道是一类非特异性阳离子通道蛋白家族,在皮肤感觉神经元和非神经元细胞中广泛表达,能被多种刺激激活、参与多种炎症性皮肤病的发生[39],TRP通道的炎症介质调节通路能够调节炎症介质的产生和释放[40],例如TRPV4能够诱导促炎细胞因子的增加[41]。NF-κB信号通路、MAPK信号通路、TRP通道的炎症介质调节通路等引发的炎症反应与TGF-β信号转导障碍形成的胶原蛋白降解都造成皮肤衰老的发生。
结合网络药理学预测结果,本研究选择对HPE降低炎症因子NO含量与修复UVA照射损伤的功效进行检测。在炎症反应过程中,细胞会伴随产生大量NO,而NO能影响多种炎症因子的表达;成纤维细胞存在于真皮组织中,具有分泌胶原蛋白、弹性蛋白,形成胶原纤维和弹力纤维的功能。UVA的照射会诱导ROS增加进而造成人皮肤成纤维细胞中胶原蛋白的降解。本研究结果说明HPE作用后能显著抑制NO表达,修复UVA照射造成的弹性蛋白降解,具有延缓皮肤炎症性衰老的功效。
综上所述,本研究借助UPLC-MS/MS进行HPE成分测定,通过网络药理学方法分析了HPE延缓皮肤衰老作用机制,并结合细胞实验进行验证,初步证实了HPE通过对炎症通路的调控实现延缓皮肤衰老的目的,为进一步挖掘HPE活性成分的功效作用及其在化妆品中的应用提供了参考。
4 结论
皮肤衰老受到体内慢性低水平炎症的影响,一方面皮肤中的炎症导致了表皮平衡的失衡与光老化,另一方面,衰老又促进了体内炎症因子的表达,所以对炎症通路的调节是从根本上延缓皮肤衰老。本文在网络药理学的基础上,研究HPE延缓皮肤衰老的作用机制,结果表明HPE可通过对炎症性通路及炎症因子的调节延缓皮肤衰老,具有多成分-多靶点-多途径的特点。
[1] XING H L, LI Q Q, ZHAO Y T, et al.Exogenous prolinebooststheco-accumulation ofastaxanthin and biomassin stress-induced Haematococcus pluvialis[J].Bioresource technology, 2023, 369:128488.
[2] 王裕玉, 董浩, 孙爱华, 等.雨生红球藻的营养价值及其在虾蟹饵料中的应用研究进展[J].饲料研究, 2022, 45(18):142-145.WANG Y Y, DONG H, SUN A H, et al.Research progress on nutritional value of Haematococcus pluvialis and its application in shrimp and crab feed [J].Feed Research, 2022, 45(18):142-145.
[3] YIN Z H, WANG M W, ZENG M Y.Novel Pickering emulsion stabilized by natural fiber polysaccharide-protein extracted from Haematococcus pluvialis residues[J].Food Hydrocolloids, 2023, 134:108048.
[4] WANG M, XU P, LIAO L F, et al.Haematococcus pluvialis extends yeast lifespan and improves Slc25a46 gene knockout-associated mice phenotypic defects[J].Molecular nutrition &food research, 2021, 65(24):e2100086.
[5] 何宛诗, 郑钦生, 陈小艳, 等. 雨生红球藻新型抗氧化肽的制备纯化、鉴定筛选及其对秀丽线虫抗氧化能力的影响[J]. 食品科学, 2023(22):116-125.HE W S, ZHENG Q S, CHEN X Y, et al. Isolation, identification and evaluation by Caenorhabditis elegans of Haematococcus pluvialis novel antioxidant peptide[J]. Food Science, 2023(22):116-125.
[6] LI L M, WU Y H, ACHEAMPONG A, et al.Red light promotes autotrophic growth of Haematococcus pluvialis with improved carbonic anhydrase activity and CO2 utilization[J].Aquaculture, 2023, 571:739462.
[7] SANZO G D, MEHARIYA S, MARTINO M, et al.Supercritical carbon dioxide extraction of astaxanthin, lutein, and fatty acids from Haematococcus pluvialis microalgae[J].Marine Drugs, 2018, 16(9):334.
[8] RADICE R P, PADULA M C, LIGUORI A, et al.Genetic improvement to obtain specialized Haematococcus pluvialis genotypes for the production of carotenoids, with particular reference to astaxanthin[J].International Journal of Plant Biology, 2023, 14(1):276-285.
[9] ZHANG P W, QIAN C, HUANG J, et al.Suitable natural astaxanthin supplementation with Haematococcus pluvialis improves the physiological function and stress response to air exposure of juvenile red swamp crayfish (Procambarus clarkii)[J].Aquaculture, 2023, 573:739577.
[10] ZHOU A Z, LI X D, ZOU J, et al.Discovery of potential quality markers of Fritillariae thunbergii bulbus in pneumonia by combining UPLC-QTOF-MS, network pharmacology, and molecular docking[J].Molecular diversity, 2024, 28(2):787-804.
[11] PAN H T, XI Z Q, WEI X Q, et al.A network pharmacology approach to predict potential targets and mechanisms of “Ramulus Cinnamomi (cassiae)-Paeonia lactiflora” herb pair in the treatment of chronic pain with comorbid anxiety and depression[J].Annals of Medicine, 2022, 54(1):413-425.
[12] WEI P L, SHANG J J, LIU H X, et al.Molecular mechanisms of Notopterygii rhizoma et radix for treating arrhythmia based on network pharmacology[J].Combinatorial Chemistry &High Throughput Screening, 2023, 26(8):1560-1570.
[13] ZHU W, LI Y H, ZHAO J J, et al.The mechanism of triptolide in the treatment of connective tissue disease-related interstitial lung disease based on network pharmacology and molecular docking[J].Annals of Medicine, 2022, 54(1):541-552.
[14] 《网络药理学评价方法指南》发布[J].中国新药与临床杂志, 2021, 40(6):459.The publication of “guide to evaluation methods of network pharmacology”[J].Chinese Journal of New Drugs and Clinical Remedies, 2021, 40(6):459.
[15] SEO Y J, JEONG M, LEE K T, et al.Isocyperol, isolated from the rhizomes of Cyperus rotundus, inhibits LPS-induced inflammatory responses via suppression of the NF-κB and STAT3 pathways and ROS stress in LPS-stimulated RAW 264.7 cells[J].International Immunopharmacology, 2016, 38:61-69.
[16] MU J, CHEN H, YE M Y, et al.Acacetin resists UVA photoaging by mediating the SIRT3/ROS/MAPKs pathway[J].Journal of Cellular and Molecular Medicine, 2022, 26(16):4624 - 4628.
[17] OSIEWACZ H D.Impact of mitochondrial quality control and architecture on organismic aging[J].Biochimica et Biophysica (BBA) Acta- Bioenergetics, 2022, 1863:148599.
[18] AI G H, MENG M, GUO J, et al.Adipose-derived stem cells promote the repair of chemotherapy-induced premature ovarian failure by inhibiting granulosa cells apoptosis and senescence[J].Stem Cell Research &Therapy, 2023, 14(1):75.
[19] IWASAKI K, ABARCA C, AGUAYO-MAZZUCATO C.Regulation of cellular senescence in type 2 diabetes mellitus:From mechanisms to clinical applications[J].Diabetes &Metabolism Journal, 2023, 47(4):441-453.
[20] HONG Y, KIM H J, PARK S, et al.Single cell analysis of human thyroid reveals the transcriptional signatures of aging[J].Endocrinology, 2023, 164(4):bqad029.
[21] BULBIANKOVA D, D AZ-PUERTAS R,
AZ-PUERTAS R,  LVAREZ-MART
LVAREZ-MART NEZ F J, et al.Hallmarks and biomarkers of skin senescence:An updated review of skin senotherapeutics[J].Antioxidants, 2023, 12(2):444.
NEZ F J, et al.Hallmarks and biomarkers of skin senescence:An updated review of skin senotherapeutics[J].Antioxidants, 2023, 12(2):444.
[22] CAO J J, XU M F, ZHU L F, et al.Viaminate ameliorates Propionibacterium acnes-induced acne via inhibition of the TLR2/NF-κB and MAPK pathways in rats[J].Naunyn-Schmiedeberg′s archives of pharmacology, 2023, 396(7):1487-1500.
[23] HAN X Y, CHEN Z Y, YUAN J F, et al.Artemisia annua water extract attenuates DNCB-induced atopic dermatitis by restraining Th2 cell mediated inflammatory responses in BALB/c mice[J].Journal of ethnopharmacology, 2022, 291:115160.
[24] YAN S Y, ZHAO J F, HAN Y Q, et al.The challenges in investigating the pathogenesis of sensitive skin by noninvasive measurements:A systematic review[J].Clinical, Cosmetic and Investigational Dermatology, 2023, 16:237-251.
[25] SUN L Y, ZHAO Q, XIAO Y, et al.Trehalose targets Nrf2 signal to alleviate D-galactose induced aging and improve behavioral ability[J].Biochemical and Biophysical Research Communications, 2020, 521(1):113-119.
[26] NA T Y, KIM G H, OH H J, et al.The trisaccharide raffinose modulates epidermal differentiation through activation of liver X receptor[J].Scientific Reports, 2017, 7(1):43823.
[27] KANWAL F, REN D X, KANWAL W, et al.The potential role of non digestible Raffinose family oligosaccharides as prebiotics[J].Glycobiology, 2023, 33(4):274-288.
[28] GAO X Z, KANG X D, LU H W, et al.Piceatannol suppresses inflammation and promotes apoptosis in rheumatoid arthritis-fibroblast-like synoviocytes by inhibiting the NF-κB and MAPK signaling pathways[J].Molecular Medicine Reports, 2022, 25(5):180.
[29] 李超峰, 吴育萍, 李双双, 等.向日葵籽壳黑色素的分离提取及生物活性研究[J].中国生物工程杂志, 2022, 42(11):88-98.LI C F, WU Y P, LI S S, et al.Isolation and biological activity of melanin from sunflower seed shell[J].China Biotechnology, 2022, 42(11):88-98.
[30] WEI G Q, SHREYOSREE C, SANAHAN A, et al.Erucamide targets microglia to regulate the retinal angiogenic microenvironment and function as a neurotrophic factor[J].Investigative Ophthalmology &Visual Science, 2022, 63(7):273-318.
[31] KIM I S, JO E K.Inosine:A bioactive metabolite with multimodal actions in human diseases[J].Frontiers in Pharmacology, 2022, 13:1043970.
[32] HARDIANTI B, UMEYAMA L, LI F, et al.Anti-inflammatory compounds moracin O and P from Morus alba Linn.(Sohakuhi) target the NF-κB pathway[J].Molecular Medicine Reports, 2020, 22(6):5385-5391.
[33] CHEN Y, QIU X, YANG J.Comparing the in vitro antitumor, antioxidant and anti-inflammatory activities between two new very long chain polyunsaturated fatty acids, docosadienoic acid (DDA) and docosatrienoic acid (DTA), and docosahexaenoic acid (DHA)[J].Nutrition and Cancer, 2021, 73(9):1697-1707.
[34] KUSIAK A, BRADY G.Bifurcation of signalling in human innate immune pathways to NF-kB and IRF family activation[J].Biochemical Pharmacology, 2022, 205:115246.
[35] YEUNG Y T, AZIZ F, GUERRERO-CASTILLA A, et al.Signaling pathways in inflammation and anti-inflammatory therapies[J].Current Pharmaceutical Design, 2018, 24(14):1449-1484.
[36] KIM M J, YANG K W, YANG E J, et al.Citrus unshiu flower inhibits LPS-induced iNOS and COX-2 via MAPKs in RAW 264.7 macrophage cells[J].Oriental Journal of Chemistry, 2015, 31(4):1915-1922.
[37] SHIN K K, PARK S H, LIM H Y, et al.In vitro anti-photoaging and skin protective effects of Licania macrocarpa cuatrec methanol extract[J].Plants, 2022, 11(10):1383-1403.
[38] GOODMAN M B, SAVAGE-DUNN C. Reciprocal interactions between transforming growth factor beta signaling and collagens: Insights from Caenorhabditis elegans[J]. Developmental Dynamics, 2022, 251(1):47-60.
[39] 洪安澜, 林彤.TRP通道在炎症性皮肤病中的作用[J].中国麻风皮肤病杂志, 2023, 39(2):129-133.HONG A L, LIN T.Update of the role for TRP channels in inflammatory skin diseases [J].China Journal of Leprosy and Skin Diseases, 2023, 39(2):129-133.
[40] PARTIDA-SANCHEZ S, DESAI B N, SCHWAB A, et al.Editorial:TRP channels in inflammation and immunity [J].Frontiers in Immunology, 2021, 12:684172.
[41] MICHALICK L, KUEBLER W M.TRPV4-a missing link between mechanosensation and immunity[J].Frontiers in immunology, 2020, 11:413.