蛋白质是人类必需摄入的物质,根据食物来源分为植物性蛋白质和动物性蛋白质两大类。肉类、蛋类和奶类等是我们获取动物蛋白的重要来源,而植物性蛋白质主要通过食用种子来获取,比如豆类、谷物类、坚果类等。食用过多含动物蛋白的食物时,饱和脂肪酸和胆固醇的摄入会超出人体所需。近年来,随着“三高”等一系列疾病的增加,人们逐渐意识到,过多的摄入含动物蛋白的食物会导致各类疾病的发生。更多的植物源蛋白质被添加到了日常饮食当中,越来越多的人重视合理健康的饮食搭配。
植物蛋白因其独特的优势,受到人们广泛关注。其饱和脂肪酸和热量均远远低于动物蛋白且不含胆固醇,在食品加工领域可作为功能成分被添加其中。植物蛋白具有各种生物活性,可运用于医药领域。再加上拥有丰富的来源,生产周期短,价格便宜等优势,已成为近些年来的热点研究对象。
1 植物种子蛋白的来源和特点
植物蛋白的主要来源是种子,实际应用中通常以植物籽粕为原料来提取高纯度的蛋白产品。大量研究表明,种子中含有糖类、多酚、黄酮、果胶、蛋白质等多种具有生物活性的营养物质,有些成分甚至高于果肉和果汁中的含量。目前,仍有很多优质的种子资源未被合理利用。
植物种子蛋白不仅拥有很好的营养价值,并且有许多重要的理化性质,如:乳化性、乳化稳定性、起泡性、起泡稳定性、凝胶性、黏性、持油性和持水性等。这些理化性质的差异使蛋白质在食品工业中呈现出不同的价值优势,比如延长食品的品质保存时间、改善食品口感、增加弹性、保持水分和吸附油脂。有研究表明,罗汉果籽的乳化性和发泡性均高于大豆分离蛋白,且凝胶性接近,这些性质可以应用于食品工业当中[1];沙棘种子蛋白和果肉因具有很好的乳化性和持油性,能够运用于食品生产并保留沙棘的风味物质[2];牡丹籽蛋白具有高于大豆蛋白的发泡及发泡稳定性、乳化及乳化稳定性和持油能力,并且持水和持油能力均高于酪蛋白,使得其可运用于植脂末的制备[3];还有表现出优良的发泡性和乳化性的四季豆、红豌豆、葫芦巴种子等一系列具有优良功能性质的种子开始进入人们的视野[4-5]。
但植物种子蛋白也存在其缺陷,因为植物与动物存在本质区别,植物或多或少会存在限制性氨基酸。如大豆蛋白质中,第一限制性氨基酸为蛋氨酸,第二限制性氨基酸为苏氨酸。若长期单一或不均衡的食用植物蛋白可能影响到人体的生理机能,导致人体抵抗力的下降和新陈代谢的紊乱等。通过合理的植物蛋白搭配可以弥补植物蛋白的限制性缺陷,达到人体参考蛋白摄入的标准,为此研究新的植物蛋白和植物蛋白的搭配十分重要。
2 种子蛋白的提取方法
种子蛋白作为一种优质植物蛋白,其氨基酸组成不同,理化性质存在差异,因此要选用适宜的提取方法。如表1所示,目前主要的提取方法有碱溶酸沉法、反胶团萃取法、酶法提取、有机溶剂提取法、盐溶提取法取等。
表1 种子蛋白质提取方法
Table 1 Seed protein extraction method
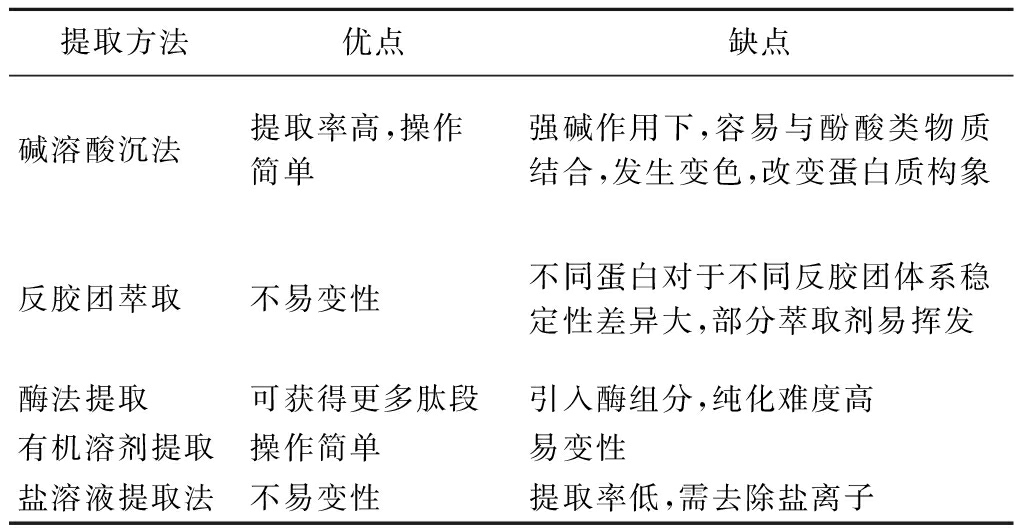
提取方法优点缺点碱溶酸沉法提取率高,操作简单强碱作用下,容易与酚酸类物质结合,发生变色,改变蛋白质构象反胶团萃取不易变性不同蛋白对于不同反胶团体系稳定性差异大,部分萃取剂易挥发酶法提取可获得更多肽段引入酶组分,纯化难度高有机溶剂提取操作简单易变性盐溶液提取法不易变性提取率低,需去除盐离子
2.1 有机溶剂提取法
有机溶剂提取法是利用脂溶性的乙醇、甲醇、丙酮等有机溶剂,使溶解在水中蛋白质的溶解度显著降低而沉淀析出的方法。封杏岚等[6]用醇法提取白芸豆醇溶蛋白,得出最佳提取条件为70%乙醇,液料比10∶1,温度为30 ℃,时间174 min,在该条件下提取率可达1.78%。
2.2 盐溶提取法
盐溶液提取的原理是通过利用氯化钠、硫酸铵和磷酸盐等中性盐溶液对蛋白进行提取。JAIN等[7]使用二价阳离子盐和一价阳离子盐提取辣木籽分离蛋白。并且得出二价阳离子盐虽然可以析出更多蛋白质,但是不会使蛋白质沉淀。单价阳离子中硫酸铵的提取率最高,但在析出蛋白时候却和氯化钠和溴化钠沉淀产物质量相接近。考虑到使用的广泛性,仍然选用氯化钠提取辣木籽分离蛋白。DU等[8]发现对辣木籽粕在不同氯化钠浓度的盐析条件下,氯化钠溶液的浓度会影响析出蛋白质的物理性质如溶解性和乳化性,在浓度越高的氯化钠溶液中,蛋白质的分子质量就越小,乳化性呈现出先增大后减小的趋势[7-8]。盐溶提取法的优点是蛋白质不会产生变性,保持了蛋白质的原有结构,缺点是蛋白提取率和纯度较低。
2.3 碱溶酸沉法
碱提酸沉法是提取种子蛋白最常见也是最经典的方法,主要依据不同酸碱条件下溶解度差异使得蛋白质被析出。碱溶酸沉法有蛋白质提取率高、花费较少和操作简易等优点。缺点在于蛋白质在碱提的过程中若碱液浓度过高蛋白质易发生永久变性,强碱也会使蛋白质的颜色发生改变。其结构与功能被破坏,会影响后续的蛋白检测分析。鹿杰等[3]以牡丹籽为原料,采用碱溶酸沉的方法提取牡丹籽蛋白,在优化条件下蛋白质得率为51.62%±0.34%,纯度为94.32%。BENZITOUNE等[9]通过响应面法对松子蛋白的提取工艺进行优化,得到提取工艺为:液料比10∶1(mL∶g)、提取时间108 min、pH值8.0,此条件下的蛋白提取率达到了89.13%。
2.4 反胶团萃取法
反胶团是表面活性剂与有机溶剂结合形成的,是一种相对稳定的体系[10]。反胶团萃取包含前萃取和后萃取两个过程,前萃取是蛋白质被反胶束包裹进入有机溶剂中,后萃取则是通过改变水相中的离子强度、pH值等,使蛋白质重新从有机溶剂中析出回到水相中[10-12]。反胶团萃取具有操作简单、快速、成本较低、前萃取和后萃取同时进行的优点,且反胶束内的环境与细胞内的环境相似,蛋白质基本不会变性。沈杨扬等[13]研究了十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)/正庚烷/正己醇反胶团萃取体系前萃取分离油茶籽粕蛋白质,得出最优工艺条件为:加入样品量为0.01 g/mL,十二烷基三甲基氯化铵(dodecyl trimethyl ammonium chloride,DTAC)浓度0.06 g/mL,w0值为35,温度35 ℃,萃取时间0.5 h,KCl浓度0.2 mol/L,增溶水pH 7.0,前萃率可达88.28%。其最佳后萃工艺为KCl浓度为:1.7 mol/L、pH值为6.6、振荡时间为98.5 min,此时后萃率为87.64%,实际提取率与其值相似为86.23%。
2.5 酶法提取
酶法提取一般是指使用单一或者复合不同种类的蛋白酶来酶解植物中的蛋白质,常用到的蛋白酶有木瓜蛋白酶、酸性蛋白酶、碱性蛋白酶、中性蛋白酶、纤维素酶和淀粉酶等。碱性蛋白酶与复合酶常常有更好的表现。也可用非蛋白酶水解,例如纤维素酶,纤维素酶可水解植物细胞壁从而提高蛋白的溶解率。酶法提取的最大特点是提高蛋白的提取率,并且可获得更多小分子量的多肽片段或氨基酸,具有更好的保健功效。其缺点是对条件较为严格,且酶的成本相对较高[14-15],相比碱提过程中增加了酶组分,其分离纯化的难度加大。李晓君等[16]以脱脂火麻粕为原料,采用正交试验得到最佳工艺参数为:原料粒径180 μm、料液比1∶6 (g∶mL)、中性蛋白酶添加量1.0%、温度50 ℃,提取时间90 min、重复2次,提取率为41.6%,蛋白质含量为75.9%。HOUDE等[17]报道过利用淀粉酶辅助大麦蛋白的提取,有效地提高了蛋白质的回收率并且蛋白质结构上存在较大差异。
2.6 其他提取方法
除了上述几种种子蛋白的提取方法外,超声波和均质机等作为辅助手段也常常被应用,其主要作用是用物理的方式将种子细胞分解的更加彻底,使蛋白质更快速的溶解,提高蛋白质溶出率,从而提高蛋白质的提取率。
3 种子蛋白肽的提取方法
蛋白质是大型生物分子,大部分蛋白质不能被人体直接吸收利用,在食用蛋白质后经过胃肠道消化酶的消化下,转变为短链的肽或者氨基酸才能够被人体更好的吸收利用。故将蛋白降解为肽尤为重要。
3.1 酶解法
酶解法具有反应条件适当、纯度高、完好保留肽的营养价值等特点。不同种类酶的酶切位点存在差异,产生的肽段分子量大小不同,其功能也会存在效果差异。如碱性蛋白酶作用位点在肽链的内部,切割肽键羧基侧为疏水性或芳香族氨基酸;胃蛋白酶水解芳香族氨基酸和其他氨基酸时会形成肽键。不同蛋白酶水解肽的效率也不同。一种蛋白酶的酶解效率通常低于混合酶的酶解效率,主要是由于不同蛋白的酶解位点差异。最佳的提取工艺还要通过酶的温度,pH,与底物的比例及时间等因素综合试验得出。LU等[18]使用碱性蛋白酶和胰蛋白酶来水解蛋白,双酶按照3∶7的比例,pH 8.35,酶底物比为6 145 U/g,水解4.4 h获得最高的血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制活性。
3.2 微生物水解法
微生物水解法分为固体发酵法和液体发酵法,通常用到乳酸菌、枯草芽孢杆菌、酵母菌等菌种。种子蛋白可以通过微生物发酵,进而转化为人体能够容易吸收的多肽,同时让分解出的蛋白肽具有芳香性,增加了口感。CHEN等[19]将芹菜籽蛋白用枯草芽孢杆菌进行液态发酵,其得到的水解产物降胆固醇能力显著高于芹菜籽蛋白。用枯草芽孢杆菌发酵得到的芹菜籽蛋白,拥有更疏松无序的二级结构,与胆汁盐结合的活性位点更多。
3.3 其他方法
肽的制备不常使用物理和化学方法,物理方法常常使用高温和机械处理,但是效率低产量少。电磁裂解制备法是一种新兴的制备方法,裂解60 min就能够获得较大量的大豆肽,在未来具有一定的发展空间[20]。
4 种子蛋白的纯化
根据蛋白质不同的物理和化学性质将常用的分离纯化方法划分为以下3种,如表2所示[21-23]。
表2 种子蛋白常用纯化方法
Table 2 Seed protein purification methods

纯化方法优点缺点透析去除小分子杂质,纯化量大透析时间长,需频繁换透析液,纯度相对低超滤操作简单,安全,效率高滤膜易发生堵塞,超滤管不能重复使用电泳法纯度高,分离速度块纯化蛋白量少色谱法纯度高,使用普遍成本较高
4.1 依据溶解度不同的纯化方法
蛋白质的溶解度受到温度、酸碱度、溶液浓度等多种因素的影响。即在同一溶解环境下,蛋白质和杂质的溶解度也会不同,从而使蛋白质和杂质进行分离,所以需要将纯化工艺进行一定优化,有利于蛋白质的分离纯化。目前常有的分离方法有盐析法、等电点沉淀法和低温有机溶剂沉淀法。马慧等[24]研究发现在提取葵花籽蛋白时,pH值过高会使蛋白质和绿原酸等酚类物质发生很强的互作,而在高盐浓度(1.6~2.1 mol/L)和弱酸(pH 6)的条件下提取蛋白,提高了葵花籽蛋白的产量并且有效的减少了蛋白质和多酚的互作,从而减少了酚类杂质。
4.2 依据蛋白质带电性质的纯化方法
蛋白质由于分子质量的不同,其所带的电荷数量也不同,蛋白质最终会集中在自身的等电点附近,进而达到分离蛋白质的目的。电泳法和色谱法纯化蛋白就是运用的此原理。电泳法因其纯化量过少,并没有在种子蛋白纯化中有过多的应用。
色谱法,也称层析法,已广泛应用于蛋白质、核酸、多糖、肽等生物大分子的分离。根据样品是否与填料结合,色谱法可分为吸附色谱法和非吸附色谱法。前者主要包括离子交换色谱、疏水色谱、亲和色谱和反相色谱,后者主要包括凝胶过滤色谱。张志军等[25]通过凝胶层析过滤、液相色谱与串联质谱联用(LC-MS/MS)和分子对接对核桃粕谷蛋白抗菌肽(WGP)进行分离,得出WGPⅢ-C组分抑菌活性更强。
4.3 依据蛋白质分子大小的纯化方法
根据蛋白质分子量的差异,可以通过透析和超滤等膜分离法的方式来得到所需要的蛋白质。透析是将蛋白质液体放入透析袋或透析盒中,将盐等小分子的杂质去除达到纯化的目的。此方法操作简单,但花费时间长并且要定时更换透析液,以保证透析的效果。
超滤是采用加压或者离心等物理的方法,将杂质或非目标蛋白质通过超滤膜,达到分离纯化蛋白的目的。此方法成本低,操作简单,无化学反应的安全纯化方式。膜分离技术是大规模分离有效生物活性肽的最佳手段之一,但缺陷是易造成滤膜表面堵塞。李白玉[26]通过超滤分离出3个分子质量组分的蛋白,研究表明分子质量低于3 Ku的蛋白组分有着最好的抗氧化性。
5 种子蛋白肽的生物活性
肽(peptides)是分子结构处于氨基酸与蛋白质之间的一类化合物,氨基酸是构成肽的基本单位。由2个氨基酸脱水缩合而成的肽就称为二肽,以此类推为三肽和四肽等。一般认为,10个氨基酸以内的肽为寡肽,多肽的氨基酸数目为10~50个,超过50个氨基酸的多肽链就叫做蛋白质[27]。由于形成肽的氨基酸数量、种类和排列方式不同,使得肽有着丰富繁杂的结构和作用,也是其生物活性的来源。
生物活性肽(biologically active peptide)被定义为具有激素或药物样活性,其最终通过与靶细胞上的特定受体的结合相互作用调节生理功能,并导致生理反应的诱导,是对生物机体的生命活动有益或具有生理功能的肽类聚合物,又称功能肽(functional peptide)[28]。目前,将其大致分为天然肽类、酶解肽类、发酵肽类和人工合成肽类。生物活性肽能够担任细胞间与血管间联系的桥梁,为内外分泌和神经系统传递信号,促进了生物的生长和发育,调节人体生理机能等作用。此外,活性肽拥有很强的生理活性,但是其含量却微乎其微[29-31]。1922年,通过使用从动物胰腺中提取的胰岛素治疗1型糖尿病,首次提出了肽在医学上的应用[32]。迄今为止,已有600多种肽应用于临床和临床前研究,其中60种已被批准为药物[33-34]。1975年,HUGHES等[35]第一次研究发现在动物组织中具有类吗啡活性的Met-脑啡肽和Leu-脑啡肽。
目前,天然的生物活性肽主要是从动植物以及微生物中分离获取。生物活性肽拥有强大的功能,但其结构既可以简单到由2个氨基酸组成,也可以复杂道成千上百个氨基酸构成。生物活性肽优点主要集中体现在能被人体更容易吸收和具有远超于氨基酸的生理功能两个方面,如图1所示,其生理功能主要包括抗高血压、抗血栓、抗菌、抗氧化、抗癌、促生长、降血脂、类玛咖活性、调控体内酶类,促进矿物质吸收等[36]。生物活性肽既可作为药物和疫苗的天然安全制备原材料,也可作为食品添加剂起到保鲜防腐的作用。
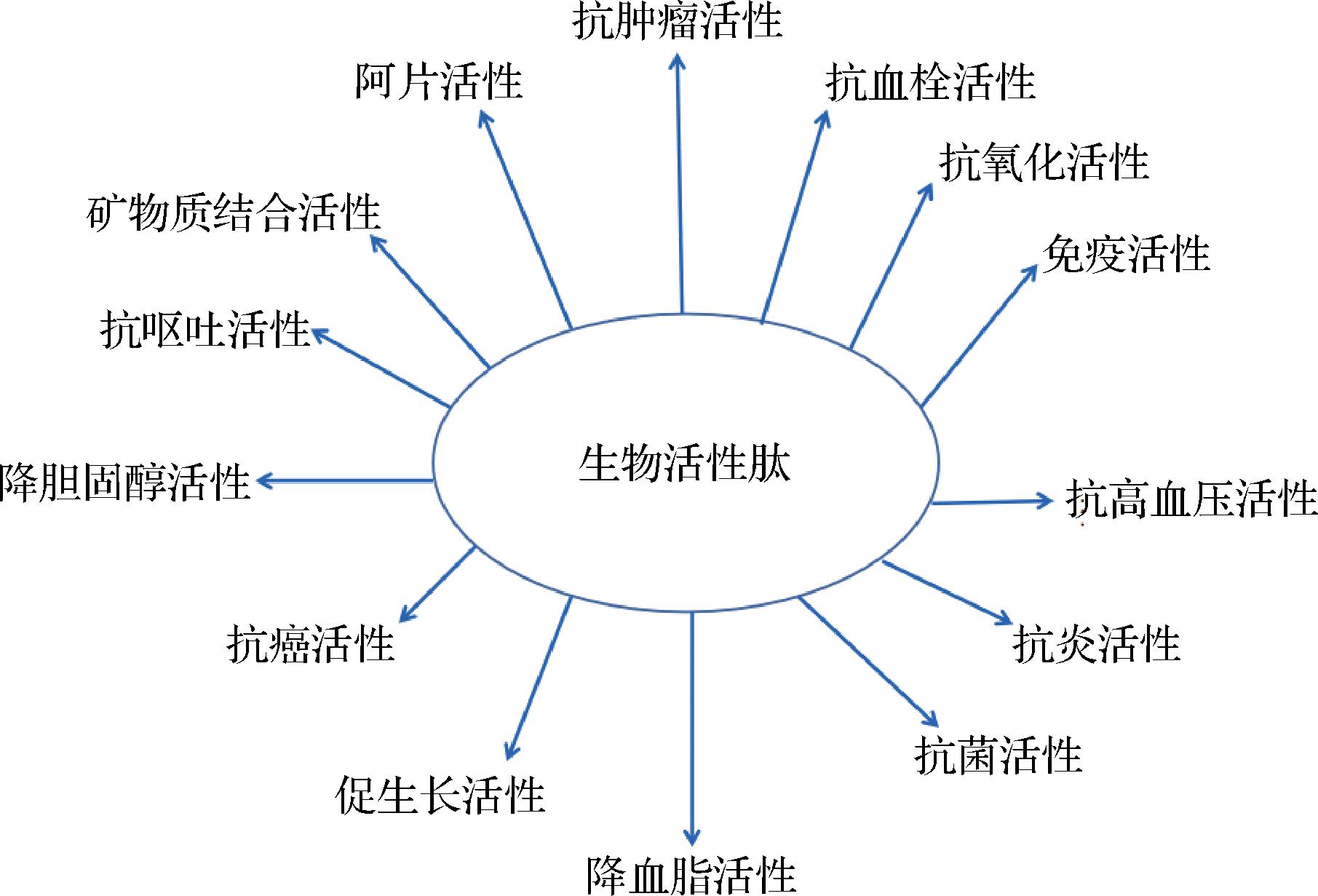
图1 生物活性肽的功能
Fig.1 Beneficial effects of bioactive peptide
5.1 抗菌活性
随着抗生素和化学农药使用的泛滥,菌群的抗药性以及抗生素残留问题日益严重。在一些文献中,抗菌肽又被称为肽类抗生素。因其具有抗菌的功能,且具备低毒、高效、广谱和低抗药性等特性,被认为是抗生素的最佳替代品[37]。最常见的便是牛奶中较小的乳清蛋白。抗菌活性肽为生物体的自卫产物,多数为碱性或正离子多肽,其赖氨酸和精氨酸的含量较高。抗菌肽既具有亲水性,又具备亲脂性。亲水性使其能够溶解于液体当中,亲脂性使其能够与细菌的细胞膜相结合,从而破坏细菌的细胞膜,致使其生长受到抑制直至死亡。ZHAO等[38]发现一种抗菌肽MOp2能够抑制金黄色葡萄球菌生长并且115 ℃的高温下仍可以保持30 min 78%的抗菌活性,MOp2通过增加膜通透性使细胞内的核苷酸库释放,对金黄色葡萄球菌造成不可逆膜损伤。此外,MOp2可以通过氢键与二氢叶酸还原酶和DNA聚合酶相互作用来抑制金黄色葡萄球菌的生长。在苦荞蛋白和辣椒籽肽研究中发现,降低胃肠道pH值可以促进抑制腐败菌和抗原菌的抑菌活性并且提高了蛋白肽的活性,苦荞蛋白研究表明可能是通过短链脂肪酸的生成,从而降低肠道pH值。抗菌肽普遍有广谱的抑菌特性,这使得这些肽类可以用于保鲜[39-40]。王攀等[41]用核桃蛋白在中性蛋白酶的酶解,酶添加量16 000 U/g,酶解pH 8.0,酶解温度45 ℃,酶解时间5 h得到了较好的抑菌活性肽,结果表明分子量越低的抗菌肽的抑菌圈直径越大,表现出更好的抑菌活性。
5.2 免疫活性
免疫活性肽具有分子质量低、不会诱发免疫排斥和人体内含量少的特点。免疫活性肽主要通过激活和促进巨噬细胞的吞噬能力、刺激淋巴细胞增殖、分化成熟和促进抗体生成等方式提高机体抵抗入侵病原体的能力[42-43]。以榛仁蛋白水解肽为对象,鉴定出Pro-Glu-Asp-Glu-Phe-Arg(PEDEFR)肽段具有免疫活性且对细胞没有损害作用,并且随着浓度的增加,小鼠巨噬细胞的吞噬能显著增加,在伴刀豆蛋白A的催化,其增值率更是达到53.22%[44]。核桃多肽可以调节细胞炎症因子(IL-10和IL-17A),在体内斑马鱼免疫调节模型中,核桃多肽增强了斑马鱼巨噬细胞的吞噬能力,并提高了吞噬墨汁巨噬细胞的数量,具有较好的免疫调节作用[45-46]。李玲玲等[47]则通过模拟胃肠道的环境水解薏苡醇溶蛋白,获得的分子肽可显著促进小鼠脾淋巴细胞体外增殖,调节机体免疫应答功能。陈显兵等[48]从大豆蛋白中分离提取出来的多肽Lunasin,可以调节T淋巴细胞表面I型跨膜糖蛋白配体(FasL)的表达,从而使T淋巴细胞自相残杀,最终达到抑制T淋巴细胞的目的以及产生破坏滑膜细胞的作用,因此,通过该免疫调节,可以有效治疗类风湿关节炎。大多数免疫调节肽中最常见的结构特征是C末端存在精氨酸,可增强淋巴细胞的增殖活性,提高抵抗能力。
5.3 抗氧化活性
如图2所示,氧化产生的自由基过多的积累会引起细胞毒性,使得细胞的蛋白质、细胞膜、DNA和酶损伤,从而导致动脉硬化、衰老、肿瘤等慢性疾病[49]。在食品中,过量的ROS/RNS/自由基促进脂肪食物的过氧化,使其产生食品的腐败以及异味,感官令人反感。抗氧化肽具有清除自由基、抑制生物大分子过氧化和与金属离子螯合减缓自由基的生成的功能。这些功能可以减少细胞的损伤和衰老、降低脂肪重过氧化氢含量和自氧化的速率等。抗氧化肽一般来自于自然界,安全性高且无副作用。因而抗氧化活性肽可添加于肉类中可以起到防腐的作用,作为天然的防腐剂在食品和饲料中有很好的应用前景[36,50]。
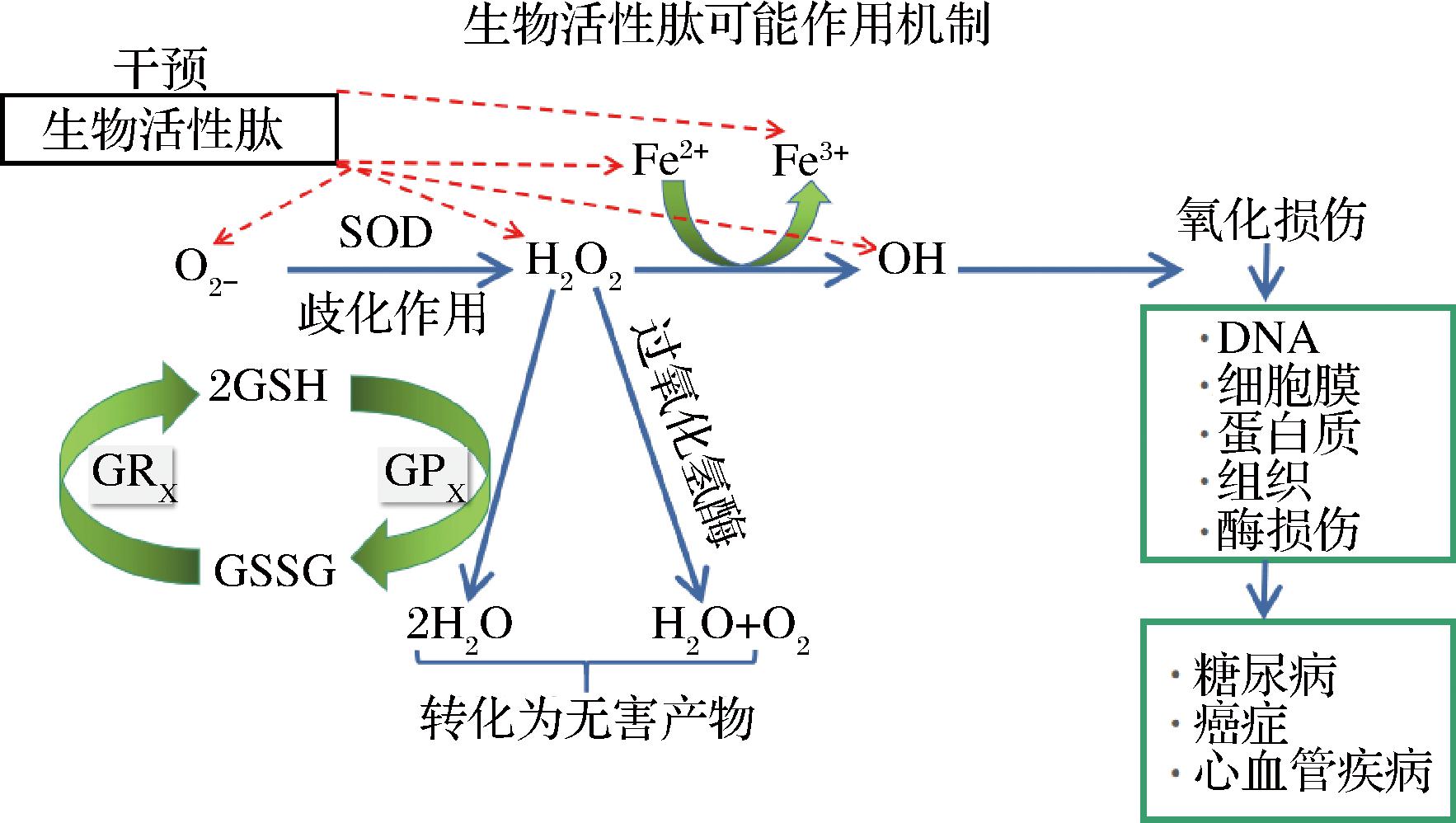
图2 生物活性肽作为抗氧化剂的可能作用机制
Fig.2 Possible mechanisms of action of bioactive as antioxidants
VILCACUNDO等[51]应用体外胃肠道消化模型,发现胃肠道消化对藜麦蛋白释放抗氧化肽有着重要的作用,在肠消化水解液中其抗氧化能力最高,体外抗氧化活性ORAC可达到2.72 μmol-Trolox equivalents/mg,经过超滤测定发现分子量小于5 kDa的短肽具有更高的清除自由基活性。何晓兰等[52]使用碱溶酸沉法和Osborne法提取的苦荞蛋白均具有体外抗氧化能力,其中清除自由基效果最好的是清蛋白,最差的是醇溶蛋白,分级蛋白间的抗氧化活性存在着差异。根据报道,大麻分离蛋白、绿豆蛋白、黑豆蛋白和油茶籽的水解的水解产物都有很好的抗氧化活性,他们能够更好的清除自由基和螯合金属离子。这些文献都表明小于5 kDa的肽段更具备较高的抗氧化活性[53-56]。
了解生物活性肽在预防氧化应激相关疾病中发挥抗氧化剂作用的各种机制,对于生产具有清除、减少ROS/RNS/自由基和螯合过渡金属以及充当脂质过氧化剂潜力的肽序列至关重要。这些研究也将有助于提出干预策略,这些策略可能会抑制甚至逆转一些基于氧化剂的疾病对人类的破坏。
5.4 抗高血压活性
如图3所示,降血压的作用机理主要是调节人类血压的两大系统为肾素-血管紧张素系统(renin-angiotensin system,RAS)和激肽氧化硝系统(kinin-nitric oxide system,KNOS)。这两个系统都由ACE所调节。故抑制ACE活性可以起到降压的作用。肝源性血管紧张素原在肾素作用下水解为血管紧张素I(Ang I)后,其C端氨基酸残基His-Leu将被ACE切割生成血管紧张素II(Ang II)。产生的血管紧张素II可通过上调交感神经系统活性、增加醛固酮分泌和盐调节来升高血压[57-58]。此类肽可以抑制ACE的活性,从而调节RAS,控制血管紧张素的生成实现降压的效果。研究认为抗高血压肽之所以能够保持高活性,原因在于其需要C末端有Pro、Phe和Tyr或肽中含有一定的疏水氨基酸。二肽中N末端的芳香氨基酸与血管紧张素结合从而达到降压的效果[59]。
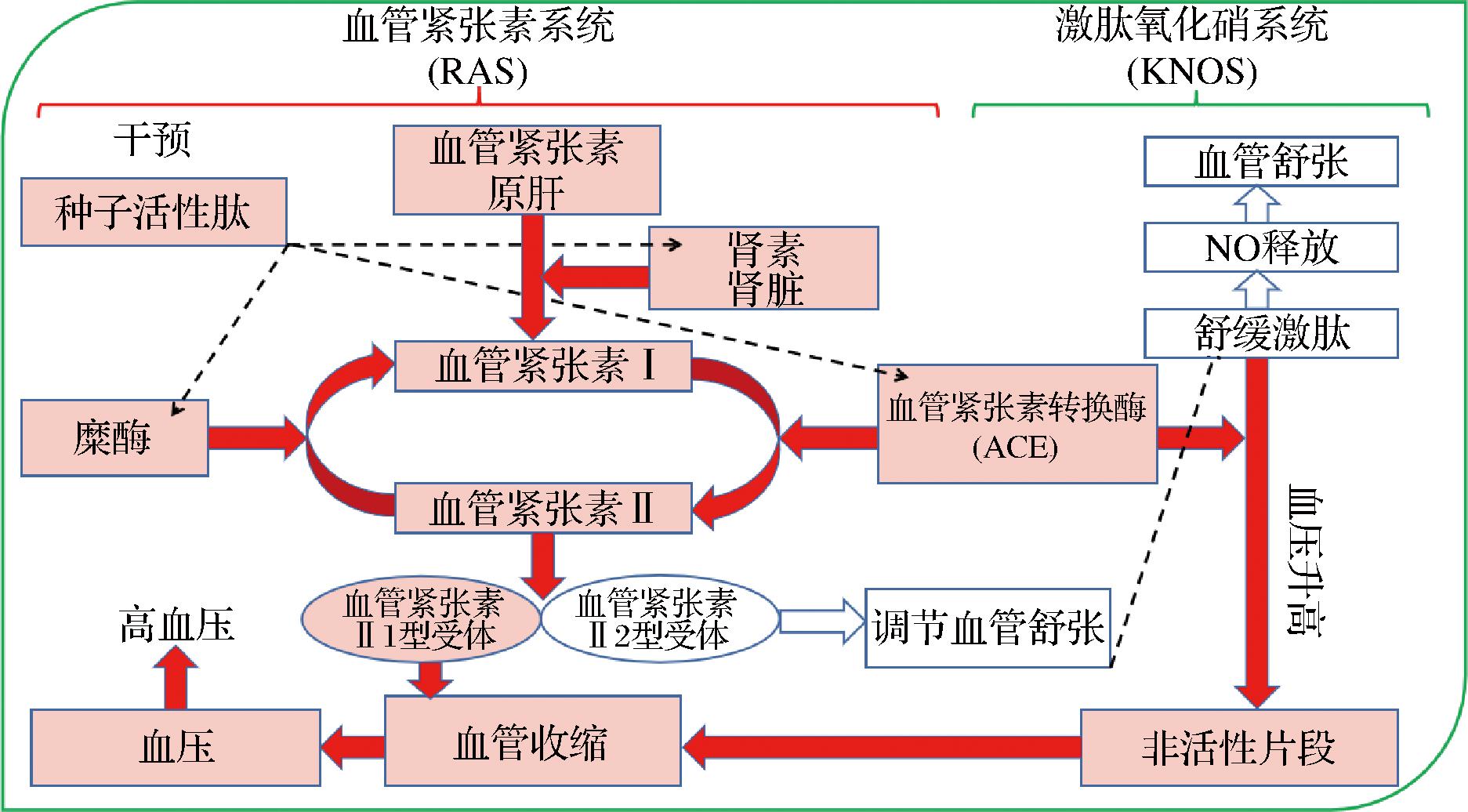
图3 肾素-血管紧张素系统的血压调节机制
Fig.3 A mechanism of blood pressure regulation in the renin-angiotensin system
HE等[60]分离出来的菜籽蛋白的水解产物分子量较低,鉴定出的ACE抑制肽(LY、TF和RALP)可对ACE与肾素有很好的抑制作用,其中LY与RALP的疏水氨基酸残基明显高于TF,使得它们在体内的活性更高,更适合作为降压药物。此外,体外ACE活性并不能代表其更具有降压的活性,能够更有效到达靶点的活性肽才能更适合作为降压药物。不同的肽对于肾素和ACE抑制活性存在差异,并不能同时达到很好的效果。与李玲玲等[47]对薏苡谷醇溶蛋白的水解多肽研究结果相似,张齐等[61]在对文冠果分离蛋白的研究中发现,小分子肽的ACE抑制活性比水解前多肽显著增强,可显著降低自发性高血压大鼠(SHR)的血压[47,61]。现在,研究的重点转向同时具有肾素和ACE抑制活性的降压药物或者生物活性物质,因为单独控制血管紧张素不能完全阻止Ang II的产生。
5.5 降胆固醇活性
胆固醇可分为对人体有益的高密度脂蛋白胆固醇和损害人体的低密度脂蛋白胆固醇。前者可去除动脉中的胆固醇,后者摄入过多会导致各种身体疾病。YUAN等[62]发现分子质量小于1 kDa的亚麻籽肽(FP5)可以减少胆固醇的吸收和合成。进而研究食用高胆固醇和高脂肪大鼠在补充FP5后可显著降低血清和肝脏胆固醇水平。并从FP5中鉴定出了一些疏水氨基酸,如亮氨酸和甘氨酸等。FP5改善了肝脏胆固醇代谢的机理,抑制胆固醇从头合成,促进胆汁酸的合成和排泄,以及抑制胆汁酸在肠肝中的再吸收。LAMMI等[63]发现一种由羽扇豆β-粘附素的胰蛋白酶消化产生的肽GQEQSHQDEGVIVR(T9),该肽可以被肠道中的Caco-2细胞吸收。T9可以通过抑制PCSK9基因D374Y突变体(PCSK9D374Y)或3-羟基-3-甲基戊二酰辅酶a还原酶的活性,提高低密度脂蛋白受体蛋白得水平,提高肝癌细胞(HepG2)摄取低密度脂蛋白的能力,起到降低胆固醇的的作用。此外,这些蛋白水解物可能起到ACE抑制剂的双重作用,同时通过将血脂调节到可接受的阈值来发挥其对抗动脉粥样硬化的有益作用。
5.6 促生长活性
促生长肽能促进细胞的生长分化,对动植物细胞培养有着重要的作用,目前,研究表明可选择植物蛋白水解物对细胞进行培养[43]。如使用蛋白酶对大豆蛋白进行酶解,不同的时间酶解形成的肽可以促进不同细菌的生长,酶解30 min促进啤酒酵母的生长,而酶解90 min促进黑曲霉的生长[64]。施用晖等[65]研究发现,当只添加小肽作为饲料时,精氨酸与赖氨酸的拮抗作用会消失,可以促进氨基酸的吸收。蛋白质合成过程中可以直接利用血液中的小肽。由于小肽可以直接进行吸收利用,可以快速增大血液中氨基酸浓度,进而增大了动静脉间氨基酸的差值,更易促进蛋白质的合成。FARGES-HADDANI等[66]对菜籽肽的研究发现在CHO细胞培养基中添加不同分子质量的肽类混合物,结果发现将一组大分子质量肽(500~5 000 Da)和小分子质量肽(<500 Da)组成混合物,当添加剂量为4 g/L时,可明显促进细胞生长和增殖。
5.7 抑制癌细胞生长转移活性
如图4所示,抗癌肽主要通过让癌细胞坏死、促进癌细胞凋亡、抑制肿瘤血管的生成,抑制DNA的合成等方式来抑制癌细胞的生长转移。癌细胞与抗癌肽通过静电吸附的方式与靶细胞膜结合,抗癌肽疏水基团与靶细胞疏水基团结合,破坏靶细胞的磷脂层,其亲水基团与胞膜结合形成跨膜通道,抗癌肽通过跨膜通道进入细胞内部,对内部蛋白质与脂质进行破坏,并破坏其渗透压,使细胞内物质外溢,从而促进细胞的凋亡和坏死。许多肽也可以通过控制与肿瘤血管生成的生长因子来抑制肿瘤血管生成,也有通过直接与癌细胞DNA结合或者与DNA复制相关的酶相互作用,进而抑制癌细胞DNA的复制[67-68]。
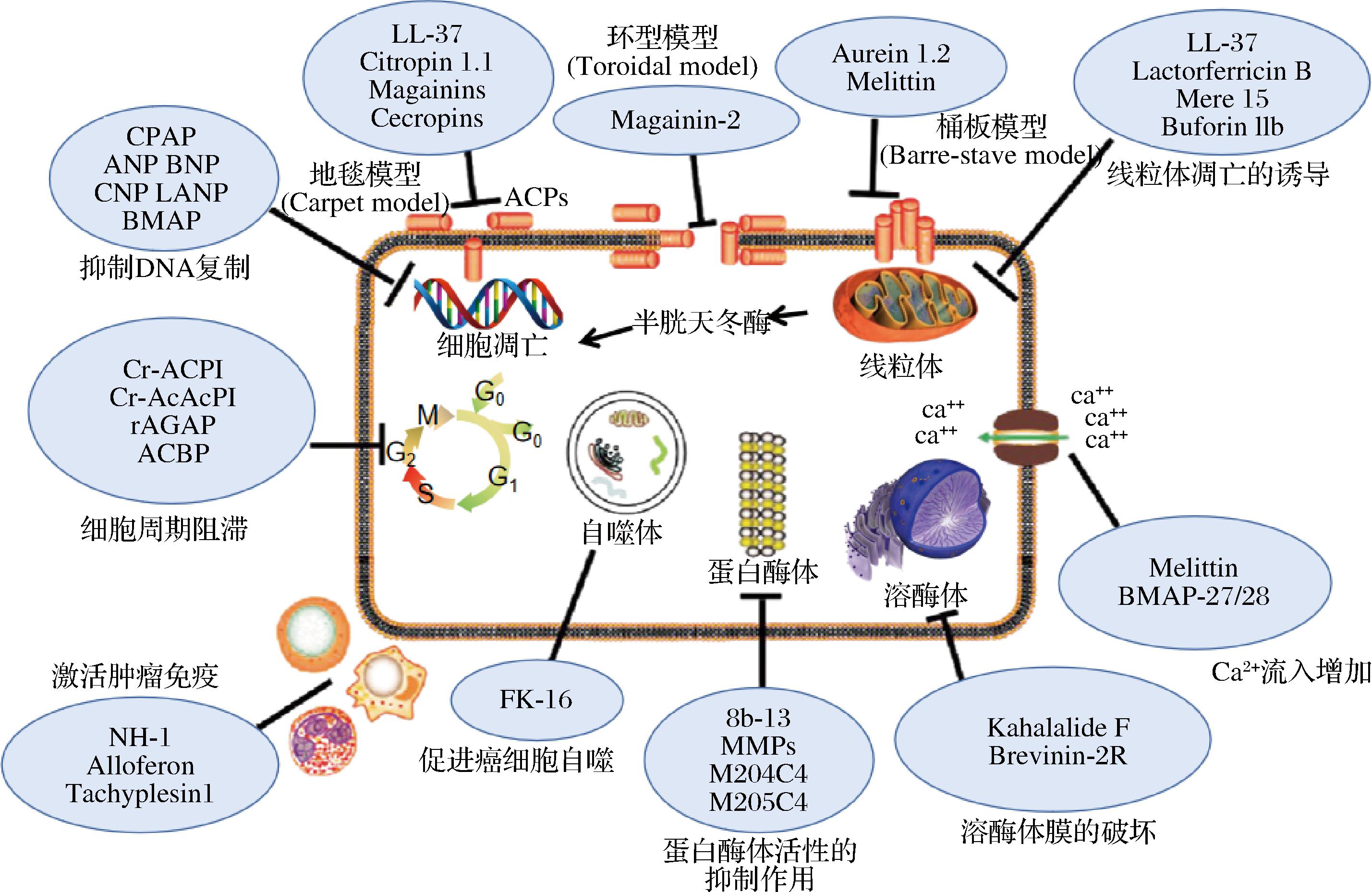
图4 抗癌肽的作用机制
Fig.4 Mechanisms of anticancer peptides
目前在种子蛋白肽的抗癌活性研究中,已经对人乳腺癌细胞(MCF -7)、人结肠癌细胞(Caco-2)、人宫颈癌细胞(Hela)、肺癌细胞(A549)[69-73]等癌细胞起到抑制作用。LIAO等[70]研究表明,核桃蛋白酶解物对人乳腺癌细胞(MCF-7)增殖具有抑制作用,通过活性氧介导的线粒体途径诱导人乳腺癌细胞凋亡。GIOVANNINI等[72]发现,小麦醇溶蛋白的水解产物加进人结肠腺癌细胞系Caco-2中,经过48 h后出现凋亡,但使用分子量为1 157.5 Da的小麦肽的话,却能完全地阻止Caco-2细胞的凋亡。不同分子量的肽对癌细胞起到的作用相反,有可能体现出肽的促生长作用。作为新兴的抗癌药物,抗癌肽有着相对简便的合成与修饰,不易产生耐药性。目前天然的抗癌肽产量还比较低,人工合成成本过于昂贵,如何保证药性,并且大量生产天然的抗癌肽仍然需要进一步研究。
5.8 其他生物活性
LI等[74]研究发现核桃多肽具有很好的健脑活性,其强大的抗氧化活性起到了关键的作用。并且核桃多肽中的谷氨酸可以作为神经递质改善脑内信号的传导,瓜氨酸也起到加强学习和记忆力的作用。进而核桃多肽也可以很好的促进抗老年痴呆的活性,大脑海马是公认的与记忆能力相关的核心区域,而核桃多肽可能通过缓解大脑海马的氧化失衡,从而大大提高大脑海马的抗氧化能力,调节炎症因子的水平,减少炎症带来的损伤[75]。
研究证实大豆多肽具有抗肥胖的功效,大豆多肽可以促进脂肪代谢、抑制脂肪贮藏、减少饥饿感和增加代谢率,从而起到减肥的作用。在此过程中依旧保持氮的平衡,保证人体的健康[76]。
6 总结与展望
目前,种子蛋白在豆类、菜籽、核桃等植物种子中已有研究。尽管越来越多的植物种子蛋白的组成成分、结构和功能已被我们知晓,但是不同的提取方法对蛋白质的影响还未被深入研究。由于蛋白质性质的影响,使用不同的温度、溶剂和破碎方式都会使蛋白质的分子量、结构与功能发生一定的改变。提取过程中采用不适合的条件会使蛋白质的活性降低,有可能导致蛋白永久变性失活。
蛋白质的功能特性可分为表面性质、水化性质、蛋白质之间相互作用3个主要类型,这些性质差异使得不同的种子蛋白被运用于各类食品加工中,作为食品原料的一环,丰富食品的营养,增加食品的风味,替代一些有害的食品添加剂等。植物蛋白由于其健康无害,营养丰富和生产便捷等多种优势,已成为越来越多食品加工产业青睐的蛋白质资源。
种子蛋白肽可以通过酶水解从植物种子蛋白中廉价生产,并且能够逃脱胃肠道的消化从而到达分子靶,在那里发挥生理作用。虽然,大多数的生物活性肽的效果不如药物,但是生物活性肽不受药物剂量的限制,也没有已知的副作用问题。这使得天然食品蛋白肽更容易被消费者接受,更加的安全。现在,在超市和药店中,有许多经批准的功能性食品和营养品,产品标签上有不同的健康声明和限定声明,供消费者购买,以获得各种益处。同时,种子蛋白肽又具有降血糖、降胆固醇、提高免疫力、抑菌、抗癌等生物活性,对疾病有一定的治疗效果,对人体的健康有一定辅助作用,其在生物医药方面有巨大的发展前景。
目前仍有许多问题亟需解决,生物活性肽该如何到达分子靶点需深入研究,生物活性肽的体外活性与体内活性存在着一定差异,在经过体内消化酶或各种蛋白酶作用下,有些生物活性肽就会降解使得效果减弱甚至消失。如何防止降解、寻找不易降解以及前药型的肽都是需要关注的问题。种子蛋白的研究将有助于开发新型的蛋白类食品和保健品,为今后的开发利用提供一定理论基础。
[1] 刘畅, 张东艳, 邓珍菊, 等. 罗汉果籽蛋白的提取及功能特性研究[J]. 河南工业大学学报:自然科学版, 2022, 43(2): 93-102.LI C, ZHANG D Y, DENG Z J, et al. Extraction and functional properties of Momordica grosvenori seed protein[J]. Journal of Henan University of Technology (Natural Science Edition), 2022, 43(2): 93-102.
[2] AKINTAYO E T, ADEBAYO E A, AROGUNDADE L A. Chemical composition, physicochemical and functional properties of akee (Bilphia sapida) pulp and seed flours[J]. Food Chemistry, 2002, 77(3): 333-336.
[3] 鹿杰, 黄志强, 邱敏, 等. 牡丹籽蛋白的制备工艺及其性质研究[J]. 粮食与油脂, 2022, 35(5):97-102.LU J, HUANG Z Q, QIU M, et al. Study on the preparation technology and properties of peony seed protein[J]. Cereals &Oils, 2022, 35(5):97-102.
[4] SHEVKANI K, SINGH N, KAUR A, et al. Structural and functional characterization of kidney bean and field pea protein isolates: A comparative study[J]. Food Hydrocolloids, 2015, 43:679-689.
[5] FEYZI S, VARIDI M, ZARE F, et al. Fenugreek (Trigonella foenum graecum) seed protein isolate: Extraction optimization, amino acid composition, thermo and functional properties[J]. Journal of the Science of Food and Agriculture, 2015, 95(15):3165-3176.
[6] 封杏岚, 黄程青, 徐瀹澄, 等. 白芸豆醇溶蛋白的提取工艺研究[J]. 农产品加工, 2019(17):30-34.FENG X L, HUANG C Q, XU Y C, et al. Study on the extraction process of prolamin in white kidney bean(Phaseolus vulgaris L.)[J]. Farm Products Processing, 2019(17):30-34.
[7] JAIN A, SUBRAMANIAN R, MANOHAR B, et al. Preparation, characterization and functional properties of Moringa oleifera seed protein isolate[J]. Journal of Food Science and Technology, 2019, 56(4):2093-2104.
[8] DU Q H, WU Y H, XUE S, et al. Extraction concentration of NaCl on structural, physicochemical and functional properties of Moringa oleifera seeds protein[J]. LWT, 2022, 155:112988.
[9] BENZITOUNE N, KADRI N, ADOUANE M, et al. Pine nuts (Pinus pinea L.) as a potential novel plant-based source of functional protein isolates: Optimization of alkali extraction conditions, evaluation of functional properties, and biochemical characterization[J]. Journal of Food Processing and Preservation, 2022, 46(4): e16471.
[10] ANDREWS B A, PYLE D L, ASENJO J A. The effects of pH and ionic strength on the partitioning of four proteins in reverse micelle systems[J]. Biotechnology and Bioengineering, 1994, 43(11):1052-1058.
[11] 彭运平, 何小维, 吴军林. 生物物质的分离新技术: 反胶团萃取[J]. 生命的化学, 2003, 23(4):311-313.PENG Y P, HE X W, WU J L. A novel technology of separating bioproduct: Reversed micellar extraction[J]. Chemistry of Life, 2003, 23(4):311-313.
[12] 史红勤, 雷夏, 沈志耀, 等. 反微团萃取: 一种新型的蛋白质分离方法[J]. 化工进展, 1988, 7(3):28-32.SHI H Q, LEI X, SHEN Z Y, et al. Reverse micellar extraction—A new protein separation method[J]. Chemical Industry and Engineering Progress, 1988, 7(3):28-32.
[13] 沈杨扬. 反胶束萃取法从油茶籽粕提取蛋白与茶油研究 [D].南昌:江西农业大学, 2014.SHEN Y Y. Research on reverse micelles extract protein and oil from camellia seed meal[D].Nanchang: Jiangxi Agricultural University, 2014.
[14] LATIF S, ANWAR F, HUSSAIN A I, et al. Aqueous enzymatic process for oil and protein extraction from Moringa oleifera seed[J]. European Journal of Lipid Science and Technology, 2011, 113(8):1012-1018.
[15] 荣先萍. 米渣蛋白成分分析及蛋白提取研究[D]. 无锡: 江南大学, 2011.RONG X P. Study on component analysis and protein extraction of rice residue protein[D]. Wuxi: Jiangnan University, 2011.
[16] 李晓君, 韩飞燕, 寇君, 等. 酶辅助火麻蛋白提取工艺的研究[J]. 粮食与油脂, 2019, 32(9): 17-21.LI X J, HAN F Y, KOU J, et al. Research progress on enzyme-assisted extraction of hempseed protein[J]. Cereals &Oils, 2019, 32(9): 17-21.
[17] HOUDE M, KHODAEI N, BENKERROUM N, et al. Barley protein concentrates: Extraction, structural and functional properties[J]. Food Chemistry, 2018, 254:367-376.
[18] LU X, SUN Q, ZHANG L X, et al. Dual-enzyme hydrolysis for preparation of ACE-inhibitory peptides from sesame seed protein: Optimization, separation, and identification[J]. Journal of Food Biochemistry, 2021, 45(4): e13638.
[19] CHEN G Y, CHEN Y, HOU Y J, et al. Preparation, characterization and the in vitro bile salts binding capacity of celery seed protein hydrolysates via the fermentation using B. subtilis[J]. LWT, 2020, 117:108571.
[20] 杨晶, 王雅洁, 许天阳, 等. 一种新型的电磁裂解装置用于制备大豆小分子多肽[J]. 食品研究与开发, 2019, 40(10):217-224.YANG J, WANG Y J, XU T Y, et al. A new type of electromagnetic cracking device to extract soybean minor peptides[J]. Food Research and Development, 2019, 40(10):217-224.
[21] DU M, HOU Z R, LIU L, et al. Progress, applications, challenges and prospects of protein purification technology[J]. Frontiers in Bioengineering and Biotechnology, 2022, 10:1028691.
[22] ALAVI F, CIFTCI O N. Purification and fractionation of bioactive peptides through membrane filtration: A critical and application review[J]. Trends in Food Science &Technology, 2023, 131:118-128.
[23] PICKARDT C, NEIDHART S, GRIESBACH C, et al. Optimisation of mild-acidic protein extraction from defatted sunflower (Helianthus annuus L.) meal[J]. Food Hydrocolloids, 2009, 23(7):1966-1973.
[24] 马慧, 顾雪敏, 梅洁, 等. 核桃谷蛋白抗菌肽的分离纯化及抑菌稳定性分析[J]. 食品科学, 2024, 45(7):69-77.MA H, GU X M, MEI J, et al. Isolation, purification and stability of antimicrobial peptides from walnut glutenin[J]. Food Science, 2024, 45(7):69-77.
[25] 张志军, 陈士国. 紫苏粕蛋白抗氧化活性肽的制备、分离纯化及序列鉴定[J]. 中国食品学报, 2023, 23(9):347-355.ZHANG H H, ZHANG Z J, CHEN S G, et al. Preparation, isolation, purification and sequence identification of antioxidant peptide from Perilla meal protein[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(9):347-355.
[26] 李白玉. 四棱豆种子蛋白的分离提取及其功能特性研究[D]. 长沙: 湖南农业大学, 2010.LI B Y. Studies on the extraction of protein from winged bean seed and its functional properties[D]. Changsha: Hunan Agricultural University, 2010.
[27] 冯怀蓉, 张慧涛, 茆军. 多肽简介及应用[J]. 新疆农业科学, 2002, 39(1):38-39.FENG H R, ZHANG H T, MAO J. Brief introduction and application of polypeptide[J]. Xinjiang Agricultural Sciences, 2002, 39(1):38-39.
[28] FITZGERALD R J, MURRAY B A. Bioactive peptides and lactic fermentations[J]. International Journal of Dairy Technology, 2006, 59(2):118-125.
[29] 姜晓光, 宋博, 迟春萍, 等. 生物活性肽的生理功能及研究进展[J]. 微生物学杂志, 2006, 26(5):82-85.JIANG X G, SONG B, CHI C P, et al. Physiological functions and research progress in bio-active peptides[J]. Journal of Microbiology, 2006, 26(5):82-85.
[30] 杨闯. 生物活性肽在营养保健中的应用[J]. 食品科学, 2003, 24(12):153-154.YANG C. Review on nutrition function of bioactive pephides[J]. Food Science, 2003, 24(12):153-154.
[31] KUSSMANN M. Prediction, discovery, and characterization of plant- and food-derived health-beneficial bioactive peptides[J]. Nutrients, 2022, 14(22):4810.
[32] BANTING F G, BEST C H, COLLIP J B, et al. Pancreatic extracts in the treatment of diabetes mellitus[J]. Canadian Medical Association Journal, 1922, 12(3):141-146.
[33] FUCHS J A, GRISONI F, KOSSENJANS M, et al. Lipophilicity prediction of peptides and peptide derivatives by consensus machine learning[J]. MedChemComm, 2018, 9(9):1538-1546.
[34] LAU J L, DUNN M K. Therapeutic peptides: Historical perspectives, current development trends, and future directions[J]. Bioorganic &Medicinal Chemistry, 2018, 26(10):2700-2707.
[35] HUGHES J, SMITH T W, KOSTERLITZ H W, et al. Identification of two related pentapeptides from the brain with potent opiate agonist activity[J]. Nature, 1975, 258(5536):577-580.
[36] 李勇. 生物活性肽研究现况和进展[J]. 食品与发酵工业, 2007, 33(1):3-9.LI Y. Current progress and advances of study on bioactive peptides[J]. Food and Fermentation Industries, 2007, 33(1):3-9.
[37] 侯晓姝, 胡宗利, 陈国平, 等. 抗菌肽的抗菌机制及其临床应用[J]. 微生物学通报, 2009, 36(1):97-105.HOU X S, HU Z L, CHEN G P, et al. Antimicrobial peptides: Antibacterial mechanism and therapeutic use[J]. Microbiology, 2009, 36(1):97-105.
[38] ZHAO Q, HE L, WANG X F, et al. Characterization of a novel antimicrobial peptide isolated from Moringa oleifera seed protein hydrolysates and its membrane damaging effects on Staphylococcus aureus[J]. Journal of Agricultural and Food Chemistry, 2022, 70(20):6123-6133.
[39] 李恩伟. 苦荞蛋白对肠道有害菌生长抑制机理研究[J]. 食品工业科技, 2017, 38(15): 306-310.LI E W. Effect of tartary buckwheat protein on the growth of harmful bacteria in intestinal[J]. Science and Technology of Food Industry, 2017, 38(15): 306-310.
[40] 杨叶梅, 刘志云, 曾兵, 等. 辣椒籽抗菌肽的抑菌活性及其稳定性研究[J]. 动物营养学报, 2019, 31(9): 4322-4330.YANG Y M, LIU Z Y, ZENG B, et al. Antimicrobial activity and stability of antimicrobial peptide derived from pepper seeds[J]. Chinese Journal of Animal Nutrition, 2019, 31(9): 4322-4330.
[41] 王攀, 范娜. 中性蛋白酶酶解核桃饼粕制备抑菌多肽的研究[J]. 食品工业, 2018, 39(9):153-157.WANG P, FAN N. Preparation of antibacterial peptides from walnut meal by neutral proteinase[J]. The Food Industry, 2018, 39(9):153-157.
[42] 卜汉萍, 王璐, 许宙, 等. 免疫活性肽的酶法制备及其活性机制研究进展[J]. 食品与机械, 2014, 30(3):244-248.BU H P, WANG L, XU Z, et al. Progress on preparation and active mechanism of immune-active peptide[J]. Food &Machinery, 2014, 30(3):244-248.
[43] SUI X N, JIANG L Z, LI Y, et al. The study on extracting protein from hazelnut kernel by aqueous enzymatic extraction method[J]. Procedia Engineering, 2011, 15:4661-4672.
[44] 王鹏, 王明爽, 刘春雷, 等. 榛仁免疫活性肽分离纯化及结构鉴定[J]. 食品科学, 2018, 39(3):200-205.WANG P, WANG M S, LIU C L, et al. Isolation, purification and structural identification of immunoactive peptides derived from hazelnut (Corylus heterophylla fisch.) protein[J]. Food Science, 2018, 39(3):200-205.
[45] 崔犁, 郭淼, 翟梦新, 等. 核桃仁蛋白中性蛋白酶水解物提高脾淋巴细胞和巨噬细胞功能[J]. 食品科技, 2013, 38(9):15-19.CUI L, GUO M, ZHAI M X, et al. Promotion of spleen lymphocyte and macrophage functions induced by neutral protease hydrolyzate of walnut protein[J]. Food Science and Technology, 2013, 38(9):15-19.
[46] 杨胜杰, 钟少达, 崔玉梅, 等. 核桃肽免疫调节作用的研究[J]. 北方药学, 2019, 16(7):129-131.YANG S J, ZHONG S D, CUI Y M, et al. Study on immunomodulatory effect of walnut peptide[J]. Journal of North Pharmacy, 2019, 16(7):129-131.
[47] 李玲玲, 李开, 张月圆, 等. 薏苡仁醇溶蛋白源小分子肽生物学活性研究[J]. 中医药学报, 2017, 45(5):21-25.LI L L, LI K, ZHANG Y Y, et al. Biological activity of Coix prolamin peptide[J]. Acta Chinese Medicine and Pharmacology, 2017, 45(5):21-25.
[48] 陈显兵, 王玲洁, 何一多, 等. 大豆多肽Lunasin对实验性类风湿关节炎大鼠细胞免疫功能的影响[J]. 基础医学与临床, 2016, 36(6):849-851.CHEN X B, WANG L J, HE Y D, et al. Effect of soybean polypeptide Lunasin on cellular immune function in experimental rheumatoid arthritis rats[J]. Basic &Clinical Medicine, 2016, 36(6):849-851.
[49] YOUNG I S, WOODSIDE J V. Antioxidants in health and disease[J]. Journal of Clinical Pathology, 2001, 54(3):176-186.
[50] 刘清, 谢奇珍, 师建芳. 菜籽蛋白活性肽研究[J]. 粮食与油脂, 2008, 21(3):4-6.LIU Q, XIE Q Z, SHI J F. Studies on bioactive peptides of rapeseed protein[J]. Cereals &Oils, 2008, 21(3):4-6.
[51] VILCACUNDO R, MIRALLES B, CARRILLO W, et al. In vitro chemopreventive properties of peptides released from quinoa (Chenopodium quinoa Willd.) protein under simulated gastrointestinal digestion[J]. Food Research International, 2018, 105:403-411.
[52] 何晓兰, 雷霆雯, 许庆忠, 等. 不同方法提取苦荞蛋白的体外抗氧化活性研究[J]. 安徽农业科学, 2017, 45(25):134-135, 163.HE X L, LEI T W, XU Q Z, et al. Study on antioxidant activity in vitro of Tartary buckwheat proteins extracted by different methods[J]. Journal of Anhui Agricultural Sciences, 2017, 45(25):134-135, 163.
[53] SARMADI B H, ISMAIL A. Antioxidative peptides from food proteins: A review[J]. Peptides, 2010, 31(10):1949-1956.
[54] ZHENG Z J, LI J X, LI J W, et al. Physicochemical and antioxidative characteristics of black bean protein hydrolysates obtained from different enzymes[J]. Food Hydrocolloids, 2019, 97:105222.
[55] TANG C H, WANG X S, YANG X Q. Enzymatic hydrolysis of hemp (Cannabis sativa L.) protein isolate by various proteases and antioxidant properties of the resulting hydrolysates[J]. Food Chemistry, 2009, 114(4):1484-1490.
[56] ADERINOLA T A, FAGBEMI T N, ENUJIUGHA V N, et al. Amino acid composition and antioxidant properties of Moringa oleifera seed protein isolate and enzymatic hydrolysates[J]. Heliyon, 2018, 4(10): e00877.
[57] LEE S Y, HUR S J. Antihypertensive peptides from animal products, marine organisms, and plants[J]. Food Chemistry, 2017, 228:506-517.
[58] GIRGIH A T, HE R, MALOMO S, et al. Structural and functional characterization of hemp seed (Cannabis sativa L.) protein-derived antioxidant and antihypertensive peptides[J]. Journal of Functional Foods, 2014, 6:384-394.
[59] 高丹丹. 棉籽抗氧化多肽和ACE抑制多肽的研究[D]. 南昌: 南昌大学, 2010.GAO D D. Antioxidant peptide and ACE inhibitory peptide derived from cottonseed protein[D]. Nanchang: Nanchang University, 2010.
[60] HE R, MALOMO S A, ALASHI A, et al. Purification and hypotensive activity of rapeseed protein-derived renin and angiotensin converting enzyme inhibitory peptides[J]. Journal of Functional Foods, 2013, 5(2):781-789.
[61] 张齐, 阎怡竹, 刘清清, 等. 文冠果降血压肽的制备及其活性研究[J]. 西北大学学报(自然科学版), 2018, 48(4):551-556.ZHANG Q, YAN Y Z, LIU Q Q, et al. Preparation and bioactivity of anti-hypertensive peptides from Xanthoceras Sorbifolia B[J]. Journal of Northwest University (Natural Science Edition), 2018, 48(4):551-556.
[62] YUAN X Y, BAO X L, LIU X J, et al. Flaxseed-derived peptides ameliorate hepatic cholesterol metabolism in Sprague-Dawley rats fed a high-cholesterol and high-fat diet[J]. Journal of the Science of Food and Agriculture, 2022, 102(12):5348-5357.
[63] LAMMI C, BOLLATI C, LECCA D, et al. Lupin peptide T9 (GQEQSHQDEGVIVR) modulates the mutant PCSK9D374Y pathway: In vitro characterization of its dual hypocholesterolemic behavior[J]. Nutrients, 2019, 11(7):1665.
[64] 陈美珍, 廖灶辉, 陈英歌, 等. 大豆蛋白酶解物抗氧化及促进微生物生长研究[J]. 汕头大学学报(自然科学版), 2007, 22(3):43-48.CHEN M Z, LIAO Z H, CHEN Y G, et al. Study on the antioxidant activity and the acceleration effect to the growth of microorganism of soybean isolated protein enzymatic hytrolysates[J]. Journal of Shantou University (Natural Science Edition), 2007, 22(3):43-48.
[65] 施用晖, 乐国伟, 杨凤. 不同比例小肽与游离氨基酸对来航公鸡氨基酸吸收的影响[J]. 四川农业大学学报, 1996, 14(S1): 37-45.SHI Y H, LE G W, YANG F. The effect of ratio of small peptides and free amino acids on the intestinal absorption of amino acids in chicken[J]. Journal of Sichuan Agricultural University, 1996, 14(S1): 37-45.
[66] FARGES-HADDANI B, TESSIER B, CHENU S, et al. Peptide fractions of rapeseed hydrolysates as an alternative to animal proteins in CHO cell culture media[J]. Process Biochemistry, 2006, 41(11):2297-2304.
[67] 李宁, 石爱民, 刘红芝, 等. 生物活性肽抗癌活性及其作用机制研究进展[J]. 中国食品学报, 2019, 19(11):261-269.LI N, SHI A M, LIU H Z, et al. Research progress of bioactive peptides′ anticancer function and its mechanism of action[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(11):261-269.
[68] 郭允峰, 李晓坤, 吴迪, 等. 抗癌肽抗癌作用机制的研究进展[J]. 现代肿瘤医学, 2022, 30(10):1875-1879.GUO Y F, LI X K, WU D, et al. Research progress on anticancer mechanism of anticancer peptides[J]. Journal of Modern Oncology, 2022, 30(10):1875-1879.
[69] 翟梦新, 赖莹, 崔犁, 等. 核桃仁蛋白木瓜酶水解物抑制癌细胞增殖[J]. 食品科技, 2013, 38(9):6-10.ZHAI M X, LAI Y, CUI L, et al. Inhibition of proliferation induced by papain hydrolysate of walnut protein on cancer cells[J]. Food Science and Technology, 2013, 38(9):6-10.
[70] LIAO W Z, LAI T, CHEN L Y, et al. Synthesis and characterization of a walnut peptides-zinc complex and its antiproliferative activity against human breast carcinoma cells through the induction of apoptosis[J]. Journal of Agricultural and Food Chemistry, 2016, 64(7):1509-1519.
[71] MA S H, HUANG D, ZHAI M X, et al. Isolation of a novel bio-peptide from walnut residual protein inducing apoptosis and autophagy on cancer cells[J]. BMC Complementary and Alternative Medicine, 2015, 15:413.
[72] GIOVANNINI C, SANCHEZ M, STRAFACE E, et al. Induction of apoptosis in Caco-2 cells by wheat gliadin peptides[J]. Toxicology, 2000, 145(1):63-71.
[73] MOHAMED YOUSSEF A, SAID EL-SWAIFY Z, AL-SARAIREH Y, et al. Anticancer effect of different extracts of Cynanchum acutum L. seeds on cancer cell lines[J]. Pharmacognosy Magazine, 2019, 15(64):261.
[74] LI W Z, ZHAO T T, ZHANG J N, et al. Effect of walnut protein hydrolysate on scopolamine-induced learning and memory deficits in mice[J]. Journal of Food Science and Technology, 2017, 54(10):3102-3110.
[75] 邹娟. 核桃多肽对体内外老年痴呆实验模型的干预作用研究[D]. 武汉: 华中科技大学, 2016.ZOU J. Protective effects of walnut peptides on Alzheimer′s disease model in vivo and vitro[D]. Wuhan: Huazhong University of Science and Technology, 2016.
[76] 陈琛. 大豆多肽的生物功能研究进展[J]. 饲料研究, 2010(5):28-31.CHEN C. Research progress on biological functions of soybean peptides[J]. Feed Research, 2010(5):28-31.