大曲作为一种常见的糖化发酵剂,在我国白酒的酿造中起着至关重要的作用,我国多数名优酒均是以大曲为糖化发酵剂,包括茅台、五粮液、剑南春、汾酒等。不同的是,由于环境、原料及制作工艺等的不同,不同产品所用大曲的类型存在差异,以发酵温度区分主要包括低温大曲(发酵顶温40 ℃~50 ℃)、中温大曲(发酵顶温50 ℃~60 ℃)和高温大曲(发酵顶温60 ℃~70 ℃)[1]。我国大曲清香型白酒使用低温大曲,浓香型白酒使用中温或中高温大曲,酱香型白酒使用高温大曲。近年来,随着酒类企业的发展,大曲的制作也由传统的手工制作演变为大规模的工业化生产,对大曲发酵过程的监测也由传统的感官监测转变为多种传感器共同辅助监测的模式。然而,大曲需通过自然接种和自发发酵的基础工艺并未改变,发酵过程涉及到的各种不可捉摸和难以控制的参数仍然依赖于经验丰富的工匠调控[2]。长期以来,诸多学者对大曲功能微生物群落组成及功能菌分离和应用保持较高的热情,促使人们对大曲微生态的认识更加深刻,有助于大曲品质控制技术的长足发展。本文综述了不同类型大曲的微生物群落组成,以及现有筛选鉴定出的功能菌,并概述了功能菌的应用情况,旨在为进一步完善大曲微生物资源库及功能菌的应用提供参考。
1 大曲微生物群落的组成及功能特性
随着生物技术的革新,研究大曲微生物群落的组成与多样性的方法也得到突破,一些基于分子或亚细胞水平的微生物测序技术在大曲微生态研究中得到了广泛应用,特别是扩增子测序、宏基因组测序和宏转录测序等。这些方法从不同维度对大曲微生物群落进行了解析,加深了人们对大曲微生物群落结构及功能的认识,推动了对大曲微生态的研究。
1.1 大曲微生物群落组成
1.1.1 优势微生物的组成
Venn分析显示了不同类型大曲优势微生物的分布情况(图1),芽孢杆菌(Bacillus)、高温放线菌(Thermoactinomyces)、泛菌(Pantoea)、葡萄球菌(Staphylococcus)、曲霉菌(Aspergillus)和嗜热子囊菌(Thermoascus)等6个微生物属是三类大曲均有的优势微生物。此外,、乳酸杆菌(Lactobacillus)、毕赤酵母(Pichia)和威克汉姆酵母(Wickerhamomyces)还是低温大曲和中温大曲共有的优势菌。相比之下,高温大曲含有更多的耐热微生物,包括克罗彭斯特德菌(Kroppenstedtia)、海洋芽孢杆菌(Oceanobacillus)、慢生芽孢杆菌(Lentibacillus)、盐生枝芽孢杆菌(Virgibacillus)和大曲岩石芽胞杆菌(Scopulibacillus)等,这与高温大曲发酵过程中处于60 ℃以上的发酵温度时间较长有关[2-5]。此外,低温大曲和中温大曲还被报道是以真菌群落为主,包括霉菌和酵母,而高温大曲是以细菌群落为主,这种差异也赋予了不同类大曲独特的感官特征和功能[6]。基于前文测序技术解析不同类型大曲的微生物群落如表1所示。
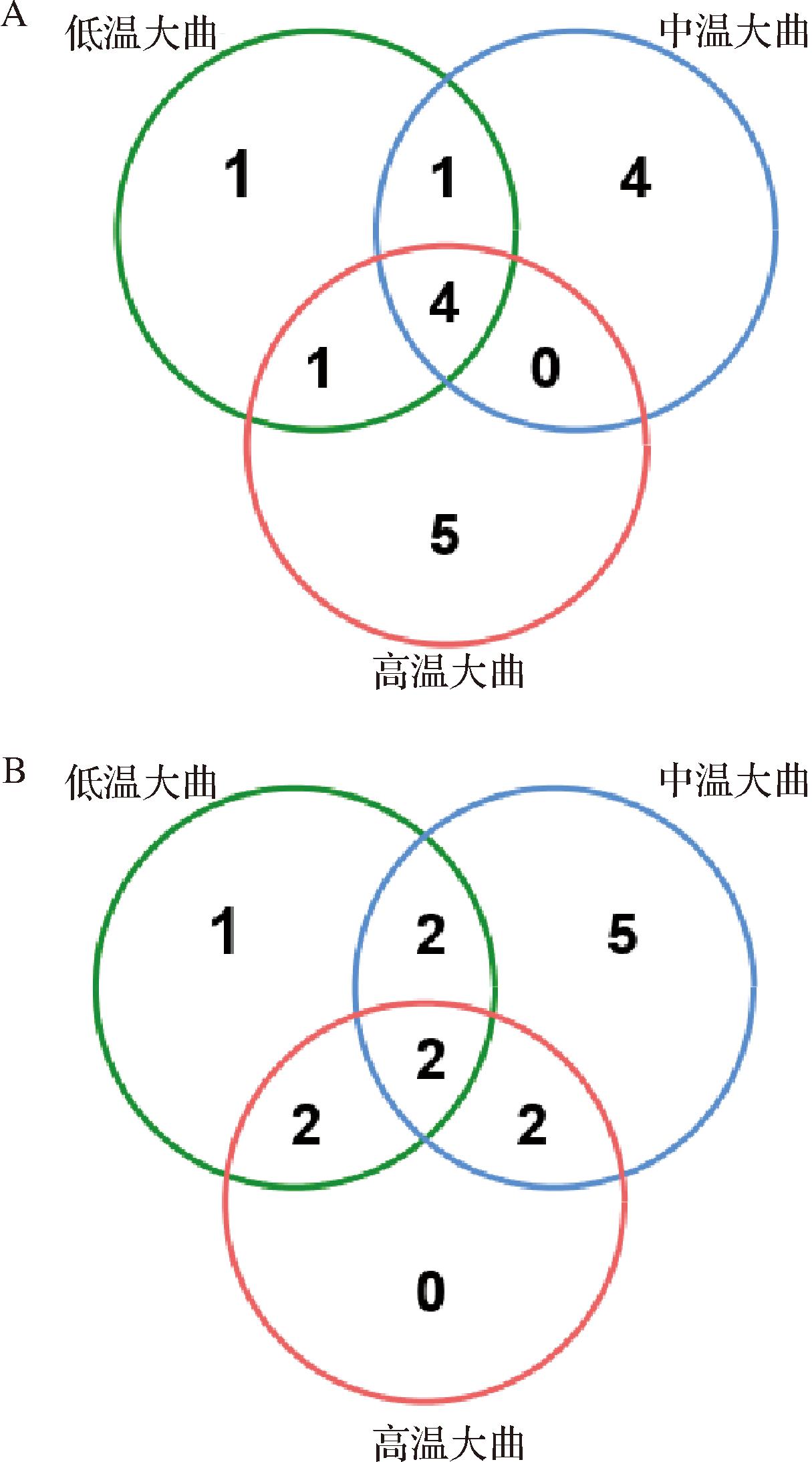
A-细菌;B-真菌
图1 三种类型大曲微生物群落的Venn分析
Fig.1 Venn analysis of three types of Daqu microbial communities
表1 不同类型大曲的优势微生物属(相对丰度≥1%)
Table 1 The dominant microbial of different types of Daqu (relative abundance ≥1%)

大曲类型微生物种类测序技术及来源低温大曲细菌:芽孢杆菌(Bacillus)、链霉菌(Streptomyces)、糖多孢菌(Saccharopolyspora)、乳酸杆菌(Lactobacillus)、高温放线菌(Thermoactinomyces)、葡萄球菌(Staphylococcus)、泛菌(Pantoea)真菌:扣囊腹膜孢酵母(Saccharomycopsis)、红曲霉(Monascus)、曲霉(Aspergillus)、嗜热子囊菌(Thermoas-cus)、毕赤酵母(Pichia)、假囊酵母(Eremothecium)、威克汉姆酵母(Wickerhamomyces)扩增子[3-5,7-8]宏基因组[6,9]中温大曲细菌:Bacillus、不动杆菌(Acinetobacter)、Thermoactinomyces、Pantoea、魏斯氏菌(Weissella)、Lactobacillus、Staphylococcus、片球菌(Pediococcus)、乳球菌(Lactococcus)真菌:热孢霉(Thermoascus)、奥默柯达菌(Kodamaea)、Aspergillus、埃莫森罗萨氏菌(Rasamsonia)、丝衣霉(Byssochlamys)、分枝横梗霉(Lichtheimia)、根霉(Rhizopus)、Pichia、Wickerhamomyces、嗜热真菌属(Ther-momyces)、酵母(Saccharomyces)扩增子[10-13]宏基因组[6,14-16]宏转录组[17]高温大曲细菌:克罗彭斯特德菌(Kroppenstedtia)、海洋芽孢杆菌(Oceanobacillus)、Bacillus、Streptomyces、慢生芽孢杆菌(Lentibacillus)、盐生枝芽孢杆菌(Virgibacillus)、大曲岩石芽胞杆菌(Scopulibacillus)、Pantoea、Ther-moactinomyces、Staphylococcus真菌: Thermomyces、Aspergillus、Thermoascus、Monascus、Saccharomycopsis、Byssochlamys扩增子[1-6]宏基因组[7]宏转录组[8]
1.1.2 稀有类群的组成
经自发发酵而成的大曲微生态具有微生物种类繁多、多样性高的特点。研究大曲微生物群落的组成及功能时,多侧重于探究大曲中的优势微生物,对大曲中的非优势微生物的研究较少。正如LOGARES等[17]的描述,自然微生态系统中的群落通常由相对丰度高的丰富类群和相对丰度低的稀有类群构成,具有分布上非均衡及非对称的特点,前者种类较少,而后者具有更高多样性。QIN等[14]以中温大曲为研究对象,通过宏基因组测序研究发现大曲中丰富类群(相对丰度≥0.5%)的物种最高仅27种,而稀有类群(相对丰度≤0.01%)物种在1 500种以上。SONG等[18]以0.1%为阈值将中温大曲微生物群落划分为丰富类群和稀有类群,研究表明2种不同的类群在大曲发酵过程中具有类似的聚集趋势,然而,稀有类群由更多种属的微生物组成,贡献了群落大多数的多样性。整体上,大曲丰富类群包含的微生物属也含有大量的稀有类群,如Bacillus、Weissella、Lactobacillus、Pediococcus、Thermomyces和Thermoascus等[18]。但由于稀有类群的丰度低且多样性高,目前对稀有类群组成的报道仍然缺乏较详细的概括。
1.2 大曲微生物的功能
随着对大曲微生态研究的深入,大曲中各种微生物的功能也逐渐被解析。目前,解析大曲微生物功能的方法主要包括功能预测、关联分析、可培养技术等方法[2]。相比之下,功能预测和关联分析表述了微生物可能具有的功能特性,可培技术则可提供更准确和验证性的结论。由于大曲中可被培养、筛选、鉴定的微生物种类占比较少[19],可培养验证性实验的实现往往存在较大困难。因此,本文仅对目前所研究报道的部分微生物功能特性进行了概述。
1.2.1 优势细菌
Bacillus:该微生物广泛存在于各类大曲,其可分泌多种类型的水解酶,如淀粉酶、葡糖淀粉酶和蛋白酶等,其可将淀粉和蛋白质等大分子化合物转化为葡萄糖和氨基酸,并产生各种风味物质及前体化合物[4]。特别地,其在高温大曲发酵过程中,还可通过美拉德反应代谢产生游离氨基酸和吡嗪类化合物,赋予了高温大曲和酱香白酒独特的香气[20-22]。此外,PAN等[11]的研究表明,Bacillus与其他种属间的互作是驱动中温大曲微生物群落定向构建的生物因素之一。
Thermoactinomyces:与Bacillus类似,该类微生物不仅能分泌蛋白酶、纤维素酶、果胶酶、嗜热淀粉酶和新支链淀粉酶等水解酶[4],也可产多种挥发性化合物,如分泌具有杏仁、焙烤香的吡嗪类物质和泥土味的土臭素,也是大曲和发酵糟醅中的核心功能细菌微生物[21]。此外,Thermoactinomyces在中温大曲中可能还与辛酸乙酯、苯乙醇和苯甲醇等的富集有关[10]。同时,其还被报道具有产生丁酸酯整合途径的基因[13]。
Pantoea:DU等[23]的研究表明,大曲中的Pantoea主要来源于制曲原料。其中,成团泛菌(Pantoea agglomerans)是初始曲醅中含量最丰富的微生物之一,其可分泌多种降解酶,与桃色欧文氏菌(Erwinia persicina)等微生物一起启动大曲的发酵[14]。伴随发酵的进行,Pantoea的丰度逐渐降低,取而代之的为Weissella和Bacillus [24]。ZHANG等[25]研究发现Pantoea与1-辛烯-3-酮、2-甲基丁醛和苯乙醛等几种挥发性有机化合物呈负相关,而与苯乳酸、D-肌醇4-磷酸、甲基丙二酸、L-酪氨酸、甲基异柠檬酸、2-异丙基苹果酸、N-乙酰神经氨酸等多种非挥发性成分呈正相关[26]。
Staphylococcus:Staphylococcus也是制曲原料的优势微生物之一,随着发酵的进行,其相对丰度也逐渐降低[25]。DENG等[20]的研究表明,Staphylococcus与大曲的糖化能力密切相关,这可能促进大曲初始微生物群落的演替。同时,其还可产生3-甲基-1-丁醇、二乙酰基、2-丁酮和乙偶姻等物质,在白酒发酵中具有重要作用[27]。
Lactobacillus:Lactobacillus是最常见的微生物之一,其含有α-葡萄糖苷酶基因,可将糖降解转化为多种酸类小分子物质[28]。特别地,其在浓香白酒发酵过程中,其还作为驱动糟醅微生物群落演替的生物因子之一[29]。此外,DU等[30]通过转录组学研究发现,Lactobacillus在转录过程中涉及的风味化合物及其前体生物合成的基因均较活跃,可能促进发酵体系风味轮廓的形成。这也证实了其可生产分别具有奶油香、果香、脂肪香特征的乙偶姻、乙醛和2,3-丁二酮等挥发性风味物质[31]。这些研究表明,Lactobacillus是大曲及其他发酵体系中重要的微生物之一。
Kroppenstedtia:黄魏等[32]的研究表明,Kroppenstedtia主要存在于高温大曲的黄色曲中,与水分含量呈显著负相关。相反,其与大曲的糖化、液化能力呈明显负相关性[33]。杨晨等[34]的研究表明,Kroppenstedtia与芳香类风味物质含量呈显著正相关,这可能赋予了高温大曲特有的功能属性。
Oceanobacillus:其作为高温大曲的功能微生物之一,被报道与多种有机酸(包括乙酸、亚油酸、草莓酸、癸酸等)、碳水化合物及碳水化合物缀合物的合成密切相关[26,29]。这与SU等[35]的研究结果一致,即高温大曲中主要贡献了风味物质的微生物为Oceanobacillus等细菌微生物。
1.2.2 优势真菌
Aspergillus:Aspergillus可分泌α-淀粉酶、糖化酶、葡萄糖苷酶、内切葡聚糖酶和β-葡萄糖苷酶等多种耐酸、耐乙醇的降解酶,不但有助于促进大曲微生物群落的演替,还有助于推动糟醅发酵,是大曲中重要的功能真菌之一[28,36]。QUAN等[26]和YI等[37] 的研究表明,Aspergillus与葡糖磷酸变位酶(EC:5.4.2.2)、葡糖淀粉酶(EC:3.2.1.3)、丙酮酸激酶(EC:2.7.1.40)和乙酰辅酶A水解酶(EC:3.1.2.1)等大曲关键代谢途径密切相关,证实了其在大曲微生态中分泌水解酶的能力。YANG等[15]通过对宏基因组分析发现,Aspergillus 具有合成4-乙烯基愈创木酚的潜力。此外,Aspergillus还可分泌酯酶和脂肪酶,促进亚油酸乙酯的合成[38-39]。
Byssochlamys:YANG等[15]和SHI等[33]研究发现,Byssochlamys主要存在中温大曲和高温大曲中。与Aspergillus类似,Byssochlamys可产裂解酶,与大曲的液化酶和糖化酶活力呈正相关[33]。此外,该菌也与多种挥发性化合物的合成有关,包括4-乙烯基愈创木酚和愈创木酚等[15]。
Thermoascus:其多存在于大曲发酵的后期[26],可产生丰富的水解酶,均具有很高的热稳定性和酶活力,包括过氧化氢酶、内切葡聚糖酶、葡萄糖苷酶、角质酶和几丁质酶等。这些酶在白酒发酵过程中的高温催化效率稳定,对白酒的堆积糖化、发酵和风味形成至关重要[40-41]。此外,相关性分析还表明,该菌与大曲中乙醇含量呈显著负相关,而与2-甲基丁醛、3-甲基丁醛、苯乙醛、甲酸盐、葡萄糖酸盐、琥珀酸酯、焦谷氨酸和谷氨酰胺等物质的合成显著正相关[42],表明该菌也可能影响大曲的代谢轮廓。
复膜孢酵母(Saccharomycopsis):其多在低温大曲的研究中被报道,是低温大曲最丰富的真菌之一[4]。可分泌α-淀粉酶、葡萄糖淀粉酶和β-葡萄糖苷酶等降解酶,赋予低温大曲较高的糖化酶和液化酶活力[43]。此外,它还能产生多种令人愉悦的挥发性化合物,如乙酸乙酯和丁酸乙酯,是白酒中主要的产香真菌之一[44]。特别是在物种水平上显著富集的扣囊复膜酵母(Saccharomycopsis fibuligera),被认为是最好的产生酯和淀粉分解酶的酵母之一,它可以降解原料中的淀粉,生成可吸收的碳用于酒精发酵[45-46]。
Pichia:Pichia主要在低温和中温大曲的研究中被报道,特别是克鲁维毕赤酵母(Pichia kudriazevii)[5],而在高温大曲的研究中报道较少。WANG等[47] 的研究表明,这类微生物能是分泌糖苷酶和糖基转移酶的重要贡献者。同时,其还可以利用蔗糖和葡萄糖生成乙醇、乙酸乙酯和4-羟基-2-丁酮等多种芳香化合物[48-49]。P.kudriavzevii也被证实具有较强的酯化作用,与大曲中的酯和苯乙醇生成均密切有关[50]。此外,Pichia还被界定为浓香和酱香白酒发酵的生物标志物,起着推动白酒发酵的关键作用[29]。
Wickerhamomyces:主要存在于低温和中温大曲[5]。PAN等[11]的研究表明,其与大曲的液化酶活力呈显著正相关,还可能直接影响大曲的香气成分。特别地,异常威克汉姆酵母(Wickerhamomyces anomalus) FBKL2.8023具有低产高级醇的潜力,被用于改善米酒和白酒的品质[51]。
1.2.3 其他非优势微生物
大曲微生态除包含优势微生物外,还包含大量的稀有物种。以上提到的优势细菌属和真菌属的功能情况代表了这些优势微生物属的整体功能特性。QIN等[14]的研究表明,稀有类群微生物对大曲中原料降解、有机酸和风味化合物的合成均有贡献,具有提供葡聚糖酶(EC:3.2.1.11)、D-乳酸脱氢酶(EC:1.1.5.12)、苯丙氨酸转氨酶(EC:2.6.1.58)等酶的潜力。此外,决定大曲微生态中物种间的相互作用的关键类群也多为稀有类群物种,具有增强大曲微生态鲁棒性、响应环境变化的重要作用[18]。
2 大曲微生物的分离及功能特性
2.1 功能菌筛选的技术方法
2.1.1 传统分离鉴定方法
在传统的微生物分离鉴定方法中,微生物的筛选会经过样品制备、分离培养和分析鉴定3个主要环节(图2)。但针对不同种类微生物,往往需要不同的微生物分离方法,特别是一些生长环境或生理特性较特殊的微生物,可通过样品预处理提高分离筛选的成功率,如芽孢杆菌、放线菌等(图2)。
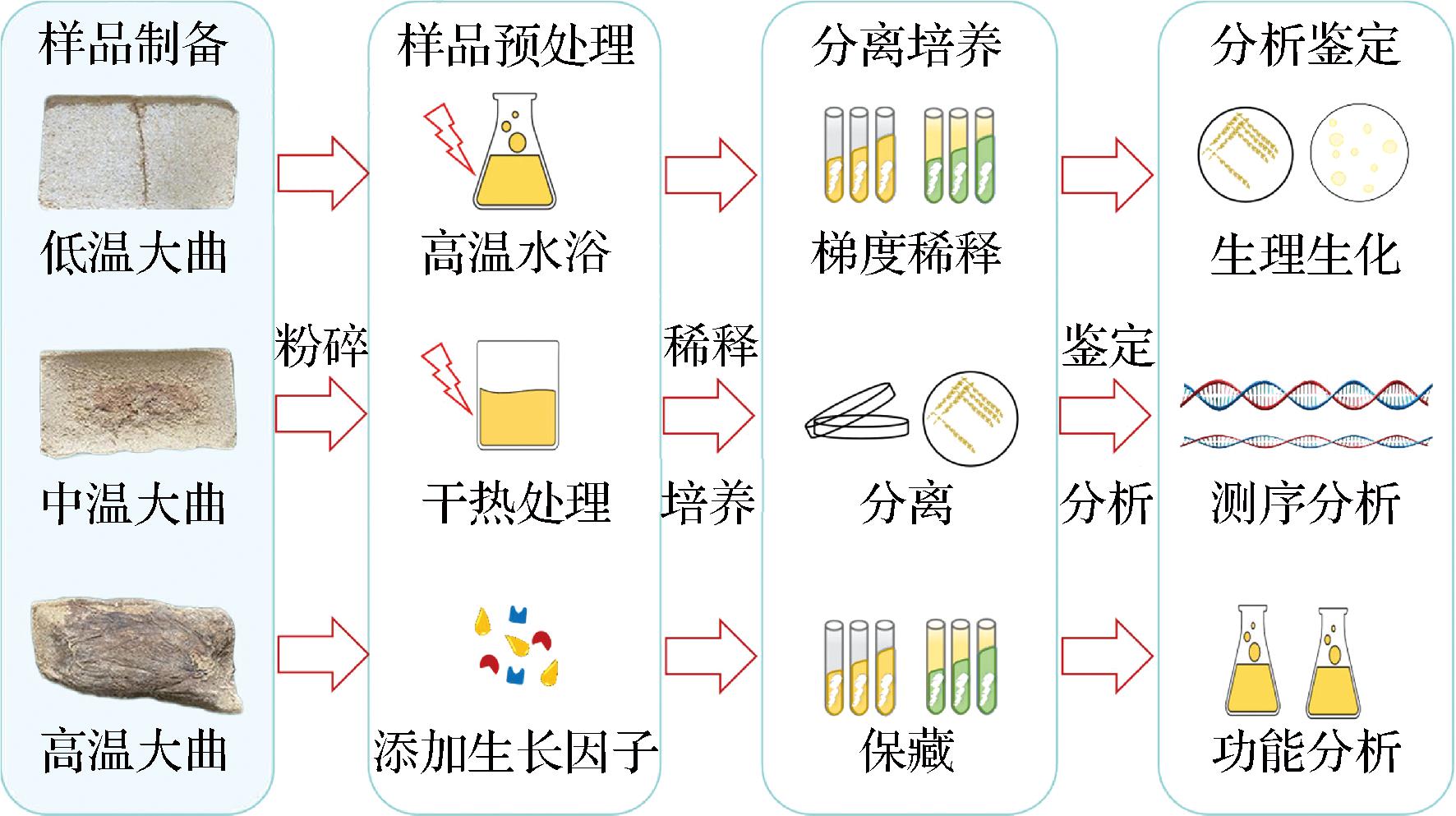
图2 分离鉴定大曲中功能微生物的传统方法
Fig.2 Traditional method for isolation and identification of functional microorganisms in Daqu
Bacillus:因Bacillus可产耐高温的芽孢,在筛选该类微生物时,为减少其他细菌微生物的影响,可将样品置于无菌水或生理盐水后,进行80~85 ℃水浴处理10~30 min后,再进行进一步的稀释分离[52-56]。
Thermoactinomyces:因该微生物可被培养的温度较高,为减少其他细菌微生物的干扰,可对样品进行预处理。筛选Thermoactinomyces的样品预处理方法包括以下5种[57-59]:a)干热处理:用灭菌的烧杯称取10 g样品后密封,放置于100 ℃烘箱加热1 h,再将样品进行稀释振荡备用;b)湿热处理:称取10 g样品于90 mL无菌(生理盐水)稀释液中,进行50 ℃水浴培养10 min,后振荡备用;c)先干热后湿热处理:即取干热处理后的样品10 g于90 mL无菌(生理盐水)稀释液中,进行50 ℃水浴培养10 min,后振荡备用;d)CaCO3 富集培养:在含样品的稀释溶液中按照样品10%(质量分数)添加CaCO3,然后在28 ℃环境下培养7 d,最后振荡备用;e)先用CaCO3富集培养后湿热处理:即在富集培养后再进行水浴培养[同方法b],最后振荡备用。
除芽孢杆菌、放线菌的筛选外,其他微生物(如酵母、霉菌和一般细菌等)可根据目标微生物的生理生化特性,通过添加抑制剂、信号分子、电子供受体或维生素、生物酶和蛋白因子等生长因子进行目标微生物的富集和分离培养[56]。
2.1.1 分离培养的新技术
大曲微生物种类繁多,包括细菌、放线菌、霉菌、酵母菌等。然而,由于不同微生物的生理生化特性的差异,以及对大曲微生态中不同微生物物种间的互作关系的认识存在局限性,使得大曲中绝大多数微生物物种仍未被分离鉴定[19]。目前,基于以上这些传统的筛选分离方法从大曲中分离鉴定出具有高活性、功能结构新颖的物种越来越困难。对此,一些新型培养技术逐渐被开发用于培养和捕获微生物,包括共培养、原位培养、微流控培养技术和细胞分选技术等[56]。
共培养:即根据已知物种间的互作关系(互生、共生、互斥等)设定适合多种微生物生长的营养条件来富集和培养目标微生物。该技术考虑了真实自然环境下微生物互作对微生物生长的影响,对于互生或共生关系的微生物针对性较强。然而,由于目前对大曲微生态中微生物间的互作机制及生长特性研究较少,少有关于通过该方法筛选鉴定大曲中功能菌的报道。
原位培养法:该方法是将稀释的样品置于区室独立小孔中,用半透性膜上下封闭小孔,最终将其放回原来所栖息的自然环境或模拟生境中进行培养。该装置的孔之间互不干扰,并且半透性膜具有选择性,仅允许某些信号分子或关键营养因子等小分子透过该膜,从而达到富集孔内难培养微生物的目的。该方法已被用于分离培养酱香大曲的微生物[19],并获得了多种仅从免培技术发现的微生物物种,包括副淀粉芽孢杆菌(Bacillus paramycoides)、死亡谷芽孢杆菌(Bacillus vallismortis)、木糖葡萄球菌(Staphylococcus xylosus)、粪产碱菌(Alcaligenes faecalis)、水生产碱杆菌(Alcaligenes aquatilis)、波茨坦短芽孢杆菌(Brevibacillus borstelensis)。
微流控培养技术:该技术涉及的培养和分析相关过程均是在单细胞的微观尺寸下进行,其能短时间同时检测多种未培养微生物的存在,还能获得目标微生物的纯培养物。该技术应用于固态发酵的大曲微生物分离培养,可能首先需要对大曲微生物的进行液态富集。但由于该技术与传统培养方法相比,技术操作性更强更复杂、成本也更高,目前还未见相关研究。
细胞分选技术:该技术是根据细胞所具有的特性把某种特定的细胞亚群从混合的细胞样品中分离出来,包括光学镊子、荧光激活细胞分选(fluorescence-activated cell sorting,FACS)和磁性激活细胞分选法(magnetic-activated cell separation,MACS)等。与传统方法相比,该方法不仅为目标亚群提供了营养条件,也规避了物种间竞争,可有效提升分离培养效率。目前,该技术仍在完善中,可能是具有分离筛选大曲微生物的潜力技术之一。
2.2 已分离鉴定的功能菌及其功能特性
如表2所示,近年来,从大曲中筛选的微生物物种,主要包括Bacillus、链霉菌(Streptomyces)、Aspergillus、Rhizopus、Saccharomycopsis等属的微生物。除Streptomyces主要分离至高温大曲外,其余微生物从低温大曲、中温大曲和高温大曲中均有分离。分离的芽孢杆菌微生物,包括贝莱斯芽孢杆菌(Bacillus velezensis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus licheniformis)等,均具有分泌淀粉酶、蛋白酶等降解酶,以及促进四甲基吡嗪合成的功能特性。分离的放线菌,包括T.vulgaris、可可链霉菌(Streptomyces cacaoi)、S.zaomyceticus、孟加拉链霉菌(Streptomyces bangladeshensis)等,均具有分泌蛋白酶、果胶酶,并具有一定碳水化合物和氨基酸代谢的潜力。分离的霉菌,主要具有分泌纤维素酶、淀粉酶、蛋白酶等降解酶的功能,包括多枝横梗霉(Lichtheimia ramosa)、米曲霉(Aspergillus oryzae)、黑曲霉(Aspergillus niger)、米根霉(Rhizopus oryzae)等物种。分离的酵母物种,包括W.anomalus)、S.fibuliger、伯顿丝孢毕赤酵母(Hyphopichia burtonii)、P.kudriavzevii、费比恩塞伯林德纳氏酵母(Cyberlindnera fabianii)等,除能够产乙醇外,均还能产多种香味组分,如苯乙醇、苯乙酸乙酯、乙酸异戊酯、乙酸乙酯和异丁醇等。
表2 已筛选的物种及其功能特性
Table 2 Selected species and their functional characteristics.

微生物分类物种名称功能特性来源芽孢杆菌目(Bacillales)蜡样芽孢杆菌(Bacillus cereus)高产蛋白酶、4-乙基愈创木酚高温大曲[53,60]解淀粉芽孢杆菌(Bacillus amyloliquefaciens)高产四甲基吡嗪高温大曲[54]副淀粉芽孢杆菌(Bacillus paramycoides)高产四甲基吡嗪高温大曲[55]苏云金芽孢杆菌(Bacillus thuringiensis)高产淀粉酶和蛋白酶高温大曲[61]贝莱斯芽孢杆菌(Bacillus velezensis)四甲基吡嗪产量较高;降低高级醇;高产淀粉酶高温大曲[55]中温大曲[62-63]西姆芽孢杆菌(Bacillus siamensis)高产四甲基吡嗪高温大曲[64]枯草芽孢杆菌(Bacillus subtilis)高产淀粉酶和四甲基吡嗪,并促进其他吡嗪类和醇类物质的合成中温大曲[65-66]低温大曲[67]地衣芽孢杆菌(Bacillus licheniformis)较强产香能力,包括4-乙基愈创木酚、3-羟基-2-丁酮、苯乙醛、β-苯乙醇等;分泌耐高温淀粉酶;降低高级醇中温大曲[63,68]低温大曲[69]嗜热脂肪芽孢杆菌(Geobacillus stearothermophilus)具备分泌蛋白酶和淀粉酶能力高温大曲[70]放线菌目(Actinomycetales)可可链霉菌(Streptomyces cacaoi)高产果胶酶,促进酯类和吡嗪类化合物的合成高温大曲[57]沙阿霉素链霉菌(Streptomyces zaomyceticus)高产果胶酶,促进酯类和吡嗪类化合物的合成高温大曲[57]糖莱斯氏菌(Laceyella sacchari)具备进行完整的碳水化合物和氨基酸代谢潜力;吡嗪类、芳香类物质高温大曲[58]高温放线菌(Thermoactinomyces vulgaris)高产蛋白酶;具有碱性磷酸盐酶、酯酶、类脂酯酶及萘酚-AS-BI-磷酸水解酶的活力高温大曲[71-72]娄彻氏链霉菌(Streptomyces rochei)高产蛋白酶高温大曲[73]孟加拉链霉菌(Streptomyces bangladeshensis)高产糖化酶和果胶酶高温大曲[74]链孢霉目(Moniliales)和散囊菌目(Eurotiales)和毛霉目(Mucorales)枝状枝孢菌(Cladosporium cladosporioides)产纤维素酶多枝横梗霉(Lichtheimia ramosa)中高温大曲[70]香港横梗霉(Lichtheimia hongkongensis)产淀粉酶、脂肪酶伞枝横梗霉(Lichtheimia corymbifera)意大利青霉(Penicillium polonicum)产酸性蛋白酶高温大曲[75]米曲霉(Aspergillus oryzae)高产蛋白酶,并促进1-辛烯-3-醇的合成中温大曲[76]低温大曲[77]黑曲霉(Aspergillus niger)具有一定的耐酸、耐酒精能力,产液化酶、糖化酶、酯化酶和蛋白酶高温大曲[78-79]中温大曲[80]低温大曲[77]米根霉(Rhizopus oryzae)高产糖化酶,促进十六酸乙酯和亚油酸乙酯等高沸点酯类化合物的合成中高温大曲[81]低温大曲[77]小孢根霉(Rhizopus microsporus)高产淀粉酶中温大曲[82]微小根毛霉(Rhizomucor pusillus)高产淀粉酶中高温大曲[83]橙色嗜热子囊菌(Thermoascus aurantiacus)高产淀粉酶中高温大曲[83]酵母目(Saccharomycetales)异常威克汉姆酵母(Wickerhamomyces anomalus)产淀粉酶,促进乙酸乙酯、乳酸乙酯和β-苯乙醇等组分的合成高温大曲[84]中温大曲[85]低温大曲[86]扣囊复膜酵母(Scchromycopsis fibuliger)产蛋白酶和淀粉酶及产苯乙醇、乙酸乙酯、辛酸乙酯等香味物质高温大曲[84,87-88]低温大曲[86]伯顿丝孢毕赤酵母(Hyphopichia burtonii)产乙酸乙酯、乙酸异戊酯和苯乙醇等物质高温大曲[89]库德里阿兹威毕赤酵母(Pichia kudriavzevii)产苯乙醇、苯乙酸乙酯、乙酸异戊酯、乙酸乙酯和异丁醇等香味组分低温大曲[90]费比恩塞伯林德纳氏酵母(Cyberlindnera fabianii)耐高温、耐乙醇、耐高糖低温大曲[91]
3 功能菌的应用现状
进行大曲功能微生物的分离培养,除用于揭示分离菌的生长特性、功能特性及其在原生微生态中的作用外,应用其改善原生微生态系统,起到强化或修复原生微生态系统的作用也是主要应用之一。此外,功能菌株也被用于其他微生态系统,用于开发新产品等。
3.1 应用大曲功能分离菌的主要途径
3.1.1 强化原生微生态系统
应用内源性菌株进行原生微生态系统的强化可规避食品安全、群落适应性等问题,该强化模式是近年来大曲研究的热点之一[92-96]。强化大曲的一般制作流程如图3所示,可分为种子制备和曲药制备2个环节。不同的是,对于细菌或酵母物种的种子制备,可选择制备为种子母液添加至生产用水中进行接种[11,29,40];而霉菌种子的制备,往往选择扩大培养为固体粉末的形式,如接种至麸皮进行扩大培养,然后将种子粉末接种在粮粉中进行强化大曲的生产[97]。
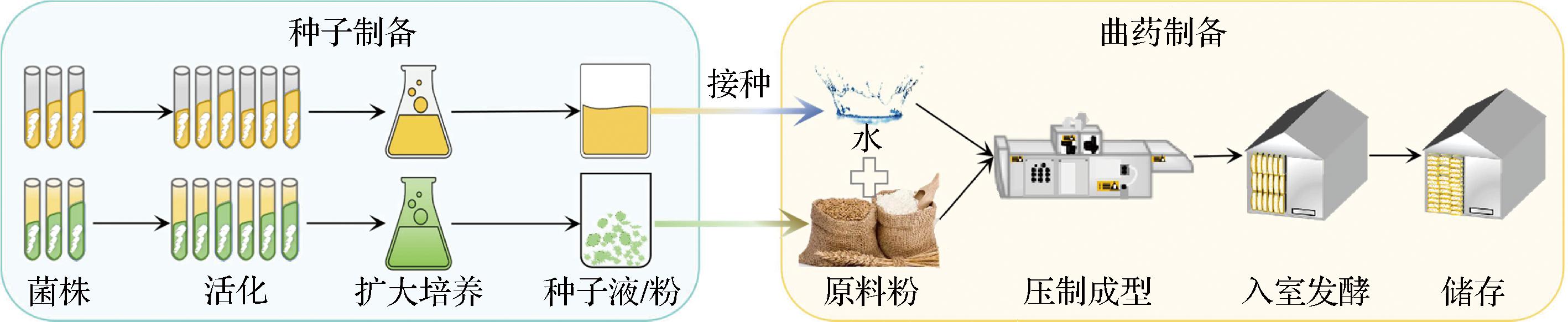
图3 制作强化大曲的基本流程
Fig.3 The basic process of making fortified Daqu
强化大曲的研究和应用进展如表3所示。在强化大曲的研究中,对强化中温大曲的研究最多,对强化高温大曲、低温大曲菌的研究较少,B.licheniformis、B.velezensis和B.subtilis是强化大曲中应用最多的细菌物种,酿酒酵母(Saccharomyces.cerevisiae)、W.anomalus、S.fibuligera是在强化大曲中应用常见的真菌物种。功能细菌分离株的应用主要改善了大曲的酶活力,并对大曲微生物群落和挥发性风味轮廓产生影响,影响程度与菌株的特异性和接种比例密切相关。功能真菌分离株的应用主要改善了大曲的挥发性风味轮廓,特别地,S.cerevisiae和W.anomalus的联用还可提升大曲的发酵力和酯化力。
表3 强化大曲的研究和应用进展
Table 3 The research and application progress of fortified Daqu

菌株接种比例强化效果大曲种类B.velezensis和B.subti-lis接种浓度为106 CFU/mL的种子液1%(mL∶g),种子液由2种菌按1∶1的比例组成Lactobacillus和Aspergillus等微生物的丰度受到显著影响。此外,大曲中风味物质的含量显著增加,主要是酯类和芳香化合物。中温大曲[11,29,40]B.siamensis接种比例及浓度未知四甲基吡嗪产量可以达到65.51 mg/kg,还具有浓郁的酱香味高温大曲[64]B.licheniformis接种浓度为106 CFU/mL的种子液,接种比例未知淀粉酶活力提高30.8%,糖淀粉酶和酯酶活力分别降低30.0%和38.8%。芳香族化合物含量显著增加143.2%,吡嗪类化合物含量增加15倍以上。低温大曲[92]B.licheniformis接种浓度为7.2×106 CFU/mL的种子液,接种比例未知大曲液化力、糖化力、发酵力、酯化力分别增加32.1%、7.5%、74.4%、38.8%,醇类和吡嗪类增加5倍以上,而酯类含量下降。中温大曲[93]B.licheniformis和B.velezensis接种浓度为106 CFU/mL的种子液1%,2种菌在种子液的比例未知糖化力、液化力、发酵力和酯化力分别提高59.7%、124.1%、396.9%和32.0%;苯乙醛和苯乙醇含量分别提高31.2%和19.5%中温大曲[94]B.subtilis接种种子液1%,种子液浓度未知蛋白酶和酯化酶活力分别提高46.7倍和1.6倍;醇类、酸类、醛类、酮类和酯类风味物质的含量分别增加27.8%、20.3%、89.0%和65.5%中温大曲[95]酿酒酵母(Saccharomy-ces.cerevisiae)和W.anomalus接种浓度为107 CFU/mL的种子液2%,种子液由2种菌按1∶2的比例组成发酵力和酯化力分别提高208.4%和64.3%;主要风味成分含量也显著增加中温大曲[96]谢瓦散囊菌(Eurotium chevalieri)接种浓度为105 CFU/mL的种子液,接种比例未知乙酸、4-乙基愈创木酚、正丁醇和四甲基吡嗪的含量分别增加86.3%、19.3%、144.9%和43.7%,并促进了1-辛烯- 3-醇和芳樟醇的合成中温大曲[97]S.fibuligera接种浓度为6×105 CFU/mL的种子液,接种比例未知产乳酸的细菌微生物丰度增加,增强了大曲代谢活性高温大曲[98]
3.1.2 改善或修复原生微生态系统
大曲分离株除应用于强化大曲的生产外,也被用于改善或修复原生微生态系统。大曲微生物作为白酒发酵系统主要的微生物来源之一,MU等[99]使用B.velezensis和B.subtilis混合接种的强化大曲,改善了浓香白酒发酵窖池的微生态系统。李富强等[54]将分离于高温大曲的B.amyloliquefaciens应用于芝麻香白酒的堆积过程,明显提升了芝麻香白酒的焦香,改善芝麻香型白酒品质。张学林等[90]将分离于低温大曲的P.kudriavzevii应用于白酒酿造,使酒中的β-苯乙醇、苯乙酸乙酯、乙酸异戊酯、乙酸乙酯和异丁醇含量分别提高12.83%、47.79%、3.66%、8.22%、29.06%,使白酒粮香、窖香、糟香、酯香协调,口感醇甜、舒顺,改善了原酒的品质。LIU等[100]接种20% W.anomalus和80%中高温大曲到特香型酒醅中,丁酸乙酯、乳酸乙酯和己酸乙酯含量分别提高了9.0%、22.2%和3.5%,改善了特香型白酒轮廓。游玲等[101]用长孢洛德酵母(Lodderomyces elongisporus)接种至浓香型糟醅中进行发酵,增加了糟醅中还原糖和己酸的含量,并影响了白酒风味。
3.1.3 新产品开发
此外,大曲分离株也被用于其他产品的开发。如杨第芹等[102]利用大曲中W.anomalus与发酵毕赤酵母(Pichia fermentans)接种至酱香酒醅中生产丢糟酒,可显著增加丢糟的产酒量及基酒品质。黄治国等[67]利用分离至大曲的B.licheniformis和B.velezensis酿造小曲白酒,可降低小曲酒中的高级醇含量,为解决小曲白酒中高级醇含量偏高问题提供了方法。徐晓萌等[103]利用大曲中酯香型酵母酿造啤酒,包括P.kudriavzevii、假丝酵母菌(Candida xylopsoci)和C.fabianii,其中,C.xylopsoci与S.cerevisiae按1∶1的比例顺序接种,可显著提高葡萄糖消耗速率、麦芽糖消耗速率和酯类物质总量,特别是水果香的乙酸乙酯含量显著增加,为开发具有水果香气的啤酒提供了新思路。
3.2 大曲功能分离菌应用存在的问题
3.2.1 功能菌对原生微生态产生的负面影响
大曲功能分离菌应用于强化大曲的生产和改善原生微生态系统过程中时,均涉及功能菌的接种方式和比例选择。对于前者,接种的功能菌分布是否均匀,这在固态发酵系统中至关重要。为确保均匀性,研究学者通常采取配置种子液或种子粉的方式进行接种[11,26,36,93],然而以上接种方式所引入的其他营养成分(种子的培养载体)可能对原生系统产生潜在影响,同时也可能是导致不同实验组差异的潜在原因。对于后者,由于功能菌接种的优先效应,当接种的比例达到一定量时,该类亚群在接种的微生态中快速繁殖,并对其他微生物的生长产生影响。如QIN等[14]和PAN等[104]的报道,接种Bacillus显著增强了大曲中对芽孢杆菌亚群的富集,但抑制了毕赤酵母、乳酸杆菌等亚群微生物的生长,这种外源接种的生物因素增加了大曲的糖化酶和液化酶活力以及游离氨基酸的含量,但也显著降低了醇类物质的含量。因此,使用功能菌进行强化大曲的生产和改善原生微生态系统时,不仅要规避富集功能菌的载体对原生微生态的影响,还要清晰认识功能菌可能产生的负面作用。
3.2.2 功能菌的生长特性导致应用困难
进行功能菌的应用时,可能由于菌株本身的特异性,难以接种至需要应用的微生态中,原因包括:a)菌株不适应微生态的初始生长条件;b)难以准确定量。对于原因a,由于多数功能菌是在发酵贮存后的大曲中筛选得到,这些菌株可能具有嗜热、耐干等特性,而在大曲发酵初期,曲醅多是低温、高湿状态,这可能导致接种的功能菌富集缓慢,在发酵过程中被其他微生物抢占生态位而被竞争抑制。对于原因b,如筛选鉴定出霉菌、放线菌等无法准确定量,可能也是少有相关应用研究报道的原因。
3.2.3 功能菌的功能活性对其他新产品的潜在影响
众所周知,同一物种在不同的外部条件下可能展现出不同的表型。尽管筛选的功能菌来源于具有长远应用历史的大曲,但将其应用于其他微生态系统中,可能也会分泌其他物质而导致潜在隐患。特别是应用于其他食品发酵,需要加深对功能菌株的功能活性和代谢潜力的研究,确保适用性和安全性。
4 结语
大曲微生态中微生物资源丰富,涉及到的代谢功能繁多,但由于筛选分离方法有限,对大曲中功能微生物的筛选鉴定仍然较少。此外,对不同微生物在大曲微生态系统中的互作关系、代谢作用等的认知不足也限制了物种的分离鉴定。已筛选鉴定出的功能菌主要为Bacillus、Streptomyces、Aspergillus、Rhizopus、Saccharomycopsis等属物种,其中,主要是Bacillus和Saccharomycopsis物种被进一步应用于强化原生微生态系统和新产品的开发。在下一步工作中,首先可在已分离的菌种资源库基础上,通过组学技术及微生物生态学等方法进一步探究功能菌的代谢潜力及功能特性,为其资源化利用奠定好基础。同时,可扩大筛选鉴定培养条件或尝试摸索新的菌株筛选分离方法,分离出更丰富的大曲功能物种,完善大曲微生物资源库,为进一步研究大曲功能菌的互作和重构大曲微生态系统等提供条件,旨在为相关发酵产品“提质增效”提供研究基础和优化思路。
[1] LIU J J, CHEN J Y, FAN Y, et al.Biochemical characterisation and dominance of different hydrolases in different types of Daqu-a Chinese industrial fermentation starter[J].Journal of the Science of Food and Agriculture, 2018, 98(1):113-121.
[2] KANG J M, XUE Y S, CHEN X X, et al.Integrated multi-omics approaches to understand microbiome assembly in Jiuqu, a mixed-culture starter[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(5):4076-4107.
[3] GE D Y, CAI W C, GUO Z, et al.Comparative analysis of microbial community structure in the peel and core of Houhuo low-temperature Daqu[J].Food Bioscience, 2024, 58:103596.
[4] CAI W C, WANG Y R, NI H, et al.Diversity of microbiota, microbial functions, and flavor in different types of low-temperature Daqu[J].Food Research International, 2021, 150:110734.
[5] ZHOU Q F, MA K, SONG Y, et al.Exploring the diversity of the fungal community in Chinese traditional Baijiu Daqu starters made at low-, medium- and high-temperatures[J].LWT, 2022, 162:113408.
[6] HOU Q C, WANG Y R, CAI W C, et al.Metagenomic and physicochemical analyses reveal microbial community and functional differences between three types of low-temperature Daqu[J].Food Research International, 2022, 156:111167.
[7] 席啦, 孔祥聪, 倪慧, 等.不同部位后火低温大曲真菌群落结构比较分析[J].食品研究与开发, 2023, 44(2):177-182.XI L, KONG X C, NI H, et al.Fungal diversity in different parts of Houhuo low-temperature Daqu[J].Food Research and Development, 2023, 44(2):177-182.
[8] 王强, 蔡文超, 刘忠军, 等.清徐低温大曲真菌菌群多样性及其功能性关联分析[J].中国酿造, 2022, 41(11):56-60.WANG Q, CAI W C, LIU Z J, et al.Diversity and functional association analysis of fungal flora in Qingxu low-temperature Daqu[J].China Brewing, 2022, 41(11):56-60.
[9] 刘忠军, 冯廷闯, 刘继明, 等.后火低温大曲曲皮和曲心细菌多样性及基因功能预测[J].食品研究与开发, 2022, 43(21):176-183.LIU Z J, FENG T C, LIU J M, et al.Bacterial diversity and gene functional prediction in different parts of Houhuo low-temperature Daqu[J].Food Research and Development, 2022, 43(21):176-183.
[10] DENG Y K, HUANG D, HAN B L, et al.Correlation:Between autochthonous microbial diversity and volatile metabolites during the fermentation of Nongxiang Daqu[J].Frontiers in Microbiology, 2021, 12:688981.
[11] PAN Q L, HUANG J, ZHANG S Y, et al.Response of microbiota to exogenous inoculation improved the enzymatic activities of medium-temperature Daqu[J].Frontiers in Microbiology, 2022, 13:1047041.
[12] ZHU M, ZHENG J, XIE J, et al.Effects of environmental factors on the microbial community changes during medium-high temperature Daqu manufacturing[J].Food Research International, 2022, 153:110955.
[13] MAO J J, LIU X L, GAO T, et al.Unraveling the correlations between bacterial diversity, physicochemical properties and bacterial community succession during the fermentation of traditional Chinese strong-flavor Daqu[J].LWT, 2022, 154:112764.
[14] QIN H, ZHANG S Y, WANG C, et al.Revealing the influence of exogenously inoculated Bacillus spp.on the microbiota and metabolic potential of medium-temperature Daqu:A meta-omics analysis[J].Food Research International, 2024, 182:114152.
[15] YANG Y, WANG S T, LU Z M, et al.Metagenomics unveils microbial roles involved in metabolic network of flavor development in medium-temperature Daqu starter[J].Food Research International, 2021, 140:110037.
[16] ZHANG J, LIU S P, SUN H L, et al.Metagenomics-based insights into the microbial community profiling and flavor development potentiality of Baijiu Daqu and Huangjiu wheat Qu[J].Food Research International, 2022, 152:110707.
[17] LOGARES R, LINDSTRÖM E S, LANGENHEDER S, et al.Biogeography of bacterial communities exposed to progressive long-term environmental change[J].The ISME Journal, 2013, 7(5):937-948.
[18] SONG X M, LI Z J, SONG C, et al.Rare taxa as the microbial taxa more sensitive to environmental changes drive alterations of Daqu microbial community structure and function[J].Food Bioscience, 2024, 59:103983.
[19] 邹云曼, 邱树毅, 郑佳, 等.基于原位培养和传统培养分析比较不同储存期酱香大曲的细菌群落[J].食品与发酵工业, 2023, 49(15):38-46.ZOU Y M, QIU S Y, ZHENG J, et al.Comparative analysis of bacterial community of high temperature Daqu with different storage periods based on in situ cultivation and traditional cultivation[J].Food and Fermentation Industries, 2023, 49(15):38-46.
[20] DENG L, MAO X, LIU D, et al.Comparative analysis of physicochemical properties and microbial composition in high-temperature Daqu with different colors[J].Frontiers in Microbiology, 2020, 11:588117.
[21] WANG Y R, CAI W C, WANG W P, et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Science &Nutrition, 2020, 9(2):1003-1016.
[22] LI H H, QIN D, WU Z Y, et al.Characterization of key aroma compounds in Chinese Guojing sesame-flavor Baijiu by means of molecular sensory science[J].Food Chemistry, 2019, 284:100-107.
[23] DU H, WANG X S, ZHANG Y H, et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].International Journal of Food Microbiology, 2019, 297:32-40.
[24] LEI Y, CAI W C, WANG Y R, et al.Elucidating the physicochemical parameters, bacterial community structure, and correlation characteristics of medium-high temperature Daqu[J].Food Bioscience, 2024, 58:103679.
[25] ZHANG Y D, XU J G, DING F, et al.Multidimensional profiling indicates the shifts and functionality of wheat-origin microbiota during high-temperature Daqu incubation[J].Food Research International, 2022, 156:111191.
[26] QUAN S K, WANG Y, RAN M F, et al.Contrasting the microbial community and non-volatile metabolites involved in ester synthesis between Qing-flavor Daqu and Nong-flavor Daqu[J].Journal of Bioscience and Bioengineering, 2023, 136(3):213-222.
[27] GUAN T W, YANG H, OU M Y, et al.Storage period affecting dynamic succession of microbiota and quality changes of strong-flavor Baijiu Daqu[J].LWT, 2021, 139:110544.
[28] XIA Y, ZHOU W, DU Y K, et al.Difference of microbial community and gene composition with saccharification function between Chinese nongxiangxing Daqu and jiangxiangxing Daqu[J].Journal of the Science of Food and Agriculture, 2023, 103(2):637-647.
[29] MU Y, HUANG J, ZHOU R Q, et al.Bioaugmented Daqu-induced variation in community succession rate strengthens the interaction and metabolic function of microbiota during strong-flavor Baijiu fermentation[J].LWT, 2023, 182:114806.
[30] DU R B, WU Q, XU Y.Chinese liquor fermentation:Identification of key flavor-producing Lactobacillus spp.by quantitative profiling with indigenous internal standards[J].Applied and Environmental Microbiology, 2020, 86(12):e00456-e00420.
[31] XIAO C, YANG Y, LU Z M, et al.Daqu microbiota exhibits species-specific and periodic succession features in Chinese Baijiu fermentation process[J].Food Microbiology, 2021, 98:103766.
[32] 黄魏, 李浪金, 谢丹, 等.3种高温大曲发酵过程中细菌群落结构演替规律[J].食品研究与开发, 2023, 44(22):155-162.HUANG W, LI L J, XIE D, et al.Investigation of bacterial community structure succession during the fermentation of three types of high-temperature Daqu[J].Food Research and Development, 2023, 44(22):155-162.
[33] SHI W, CHAI L J, FANG G Y, et al.Spatial heterogeneity of the microbiome and metabolome profiles of high-temperature Daqu in the same workshop[J].Food Research International, 2022, 156:111298.
[34] 杨晨, 杨栩松, 郭壮, 等.茅台镇某酒厂高温大曲微生物多样性与感官品质关联性分析[J].中国酿造, 2023, 42(11):48-53.YANG C, YANG X S, GUO Z, et al.Correlation analysis of microbial diversity and sensory quality of high-temperature Daqu from a distillery in Maotai town[J].China Brewing, 2023, 42(11):48-53.
[35] YAO S, LIU Y, LI H, et al.Bacterial communities during the process of high-temperature Daqu production of roasted sesame-like flavour liquor[J].Journal of the Institute of Brewing, 2015, 121(3):440-448.
[36] LI W W, FAN G S, FU Z L, et al.Effects of fortification of Daqu with various yeasts on microbial community structure and flavor metabolism[J].Food Research International, 2020, 129:108837.
[37] YI Z L, JIN Y L, XIAO Y, et al.Unraveling the contribution of high temperature stage to Jiang-flavor Daqu, a liquor starter for production of Chinese Jiang-flavor Baijiu, with special reference to metatranscriptomics[J].Frontiers in Microbiology, 2019, 10:472.
[38] SAKANDAR H A, HUSSAIN R, KHAN Q F, et al.Functional microbiota in Chinese traditional Baijiu and Mijiu Qu (starters):A review[J].Food Research International, 2020, 138:109830.
[39] GANDOLFI R, CONVERTI A, PIROZZI D, et al.Efficient and selective microbial esterification with dry mycelium of Rhizopus oryzae[J].Journal of Biotechnology, 2001, 92(1):21-26.
[40] HE G Q, HUANG J, ZHOU R Q, et al.Effect of fortified Daqu on the microbial community and flavor in Chinese strong-flavor liquor brewing process[J].Frontiers in Microbiology, 2019, 10:56.
[41] JAIN K K, DEY T B, KUMAR S, et al.Production of thermostable hydrolases (cellulases and xylanase) from Thermoascus aurantiacus RCKK:A potential fungus[J].Bioprocess and Biosystems Engineering, 2015, 38(4):787-796.
[42] WEI J L, DU H, ZHANG H X, et al.Mannitol and erythritol reduce the ethanol yield during Chinese Baijiu production[J].International Journal of Food Microbiology, 2021, 337:108933.
[43] KANG J M, CHEN X X, HAN B Z, et al.Insights into the bacterial, fungal, and phage communities and volatile profiles in different types of Daqu[J].Food Research International, 2022, 158:111488.
[44] SU C, ZHANG K Z, CAO X Z, et al.Effects of Saccharomycopsis fibuligera and Saccharomyces cerevisiae inoculation on small fermentation starters in Sichuan-style Xiaoqu liquor[J].Food Research International, 2020, 137:109425.
[45] JIN G Y, ZHU Y, XU Y.Mystery behind Chinese liquor fermentation[J].Trends in Food Science &Technology, 2017, 63:18-28.
[46] ZHENG X W, YAN Z, NOUT M J, et al.Characterization of the microbial community in different types of Daqu samples as revealed by 16S rRNA and 26S rRNA gene clone libraries[J].World Journal of Microbiology &Biotechnology, 2015, 31(1):199-208.
[47] WANG B W, WU Q, XU Y, et al.Specific volumetric weight-driven shift in microbiota compositions with saccharifying activity change in starter for Chinese Baijiu fermentation[J].Frontiers in Microbiology, 2018, 9:2349.
[48] LI P, LIN W F, LIU X, et al.Environmental factors affecting microbiota dynamics during traditional solid-state fermentation of Chinese Daqu starter[J].Frontiers in Microbiology, 2016, 7:1237.
[49] WANG J, ZHONG Q P, YANG Y Y, et al.Comparison of bacterial diversity between two traditional starters and the round-koji-maker starter for traditional Cantonese Chi-flavor liquor brewing[J].Frontiers in Microbiology, 2018, 9:1053.
[50] HE M W, JIN Y, ZHOU R Q, et al.Dynamic succession of microbial community in Nongxiangxing Daqu and microbial roles involved in flavor formation[J].Food Research International, 2022, 159:111559.
[51] WANG C X, TANG J D, QIU S Y.Profiling of fungal diversity and fermentative yeasts in traditional Chinese Xiaoqu[J].Frontiers in Microbiology, 2020, 11:2103.
[52] 张璋, 赵腾飞, 李红霞, 等.产淀粉酶芽孢杆菌的分离鉴定、高温驯化及酶学性质研究[J].中国酿造, 2023, 42(9):79-84.ZHANG Z, ZHAO T F, LI H X, et al.Isolation, identification, high temperature acclimation and enzymatic property of amylase-producing Bacillus[J].China Brewing, 2023, 42(9):79-84.
[53] 王成俊, 李玲珊, 范梅, 等.酱香型大曲中产4-乙基愈创木酚芽孢杆菌的筛选、鉴定及特性研究[J].酿酒科技, 2023(4):45-52.WANG C J, LI L S, FAN M, et al.Screening, identification and characterization of 4-ethylguaiacol producing Bacillus strains from Jiangxiang Daqu[J].Liquor-Making Science &Technology, 2023(4):45-52.
[54] 李富强, 曹振华, 闫培勋, 等.高产四甲基吡嗪细菌的筛选鉴定及应用研究[J].酿酒科技, 2022(12):65-69.LI F Q, CAO Z H, YAN P X, et al.Screening, identification and application of a bacterial strain with high yield of tetramethylpyrazine[J].Liquor-Making Science &Technology, 2022(12):65-69.
[55] 王庆, 王超彦, 徐海林, 等.高温大曲中高产四甲基吡嗪芽孢杆菌的分离鉴定及发酵条件优化[J].中国酿造, 2022, 41(10):125-129.WANG Q, WANG C Y, XU H L, et al.Isolation and identification of high-yield tetramethylpyrazine Bacillus from high-temperature Daqu and optimization of fermentation conditions[J].China Brewing, 2022, 41(10):125-129.
[56] 熊盈盈, 莫祯妮, 邱树毅, 等.未培养环境微生物培养方法的研究进展[J].微生物学通报, 2021, 48(5):1 765-1 779.XIONG Y Y, MO Z N, QIU S Y, et al.Research progress on culture methods of uncultured environmental microorganisms[J].Microbiology China, 2021, 48(5):1 765-1 779.
[57] 罗小叶, 王晓丹, 邱树毅.酱香大曲中3株放线菌的分离筛选及挥发性成分分析[J].中国酿造, 2018, 37(8):62-67.LUO X Y, WANG X D, QIU S Y.Isolation, screening and aroma component analysis of 3 strains of actinomycetes from Moutai-flavor Daqu[J].China Brewing, 2018, 37(8):62-67.
[58] 李豆南, 黄魏, 王晓丹, 等.酱香型大曲中高温放线菌的筛选及风味成分分析[J].食品科学, 2018, 39(6):171-176.LI D N, HUANG W, WANG X D, et al.Identification and flavor profile of a Thermoactinomycetaceae strain separated from Moutai-flavor Daqu[J].Food Science, 2018, 39(6):171-176.
[59] 王芙蓉, 曾辉, 许曌昕, 等.1株酱香型大曲中高温放线菌的分离和鉴定[J].酿酒科技, 2017(4):42-45.WANG F R, ZENG H, XU Z X, et al.Isolation &Identification of a Thermoactinomyces sp.Strain from High-temperature Jiangxiang Daqu[J].Liquor-Making Science &Technology, 2017(4):42-45.
[60] 张璋, 赵腾飞, 李红霞, 等, 产蛋白酶芽孢杆菌的筛选、耐酸性驯化及蛋白酶酶学性质分析[J].中国酿造, 2024, 43(1):84-90.ZHANG Z, ZHAO T F, LI H X, et al.Screening and acid resistance acclimatization of protease-producing Bacillus and enzymatic characteristics analysis[J].China Brewing, 2024, 43(1):84-90.
[61] 蒋泽元, 万义芳, 蒲驰中, 等.高温大曲中高产淀粉酶和蛋白酶细菌的分离、鉴定及生物学特性研究[J].中国酿造, 2024, 43(2):60-63.JIANG Z Y, WAN Y F, PU C Z, et al.Isolation, identification and biological characteristics of high-yield amylase and protease bacteria from high-temperature Daqu[J].China Brewing, 2024, 43(2):60-63.
[62] 刘宁, 张宿义, 明红梅, 等.中温大曲中产淀粉酶芽孢杆菌的筛选鉴定及培养条件优化[J].中国酿造, 2023, 42(12):38-44.LIU N, ZHANG S Y, MING H M, et al.Screening, identification and culture conditions optimization of amylase-producing Bacillus strain from medium-temperature Daqu[J].China Brewing, 2023, 42(12):38-44.
[63] 黄治国, 罗润森, 李彦中, 等.芽孢杆菌强化发酵降低小曲白酒中高级醇的含量[J].现代食品科技, 2023, 39(2):145-151.HUANG Z G, LUO R S, LI Y Z, et al.Concentration of higher alcohols in Xiaoqu liquor induced by enhanced fermentation with strains of Bacillus[J].Modern Food Science and Technology, 2023, 39(2):145-151.
[64] 范恩帝, 黄魏, 谢丹, 等.酱香大曲中高产四甲基吡嗪微生物的选育及应用研究[J].酿酒科技, 2022(11):45-50;71.FAN E D, HUANG W, XIE D, et al.Breeding and application of microorganisms with high yield of tetramethylpyrazine in Jiangxiang Daqu[J].Liquor-Making Science &Technology, 2022(11):45-50;71.
[65] 胡晓龙, 冯大鸿, 田瑞杰, 等.中温大曲产淀粉酶菌株的筛选鉴定及培养条件优化[J].中国酿造, 2023, 42(1):78-85.HU X L, FENG D H, TIAN R J, et al.Isolation, identification and culture conditions optimization of amylase-producing strains in medium-temperature Daqu[J].China Brewing, 2023, 42(1):78-85.
[66] 陈桂芳, 王晓慧, 赵琦, 等.洋河浓香型大曲产香细菌的筛选、鉴定及香气成分分析[J].酿酒科技, 2022(5):30-34.CHEN G F, WANG X H, ZHAO Q, et al.Screening, identification and aroma component analysis of aroma-producing bacteria in Yanghe Daqu[J].Liquor-Making Science &Technology, 2022(5):30-34.
[67] 张锦华, 张潇月, 白宝清, 等.清香型白酒大曲中高产四甲基吡嗪菌株的筛选、鉴定及发酵培养基优化[J].中国酿造, 2023, 42(3):47-52.ZHANG J H, ZHANG X Y, BAI B Q, et al.Screening, identification and fermentation medium optimization of high yield tetramethylpyrazine strains from light-flavor Baijiu Daqu[J].China Brewing, 2023, 42(3):47-52.
[68] 游勇, 吴晓玉, 廖家富, 等.特香型白酒大曲中一株耐热产淀粉酶地衣芽孢杆菌的分离和鉴定[J].酿酒科技, 2022(3):17-24.YOU Y, WU X Y, LIAO J F, et al.Isolation and identification of a heat-resistant amylase-producing Bacillus licheniformis strain from texiang Daqu[J].Liquor-Making Science &Technology, 2022(3):17-24.
[69] 刘小改, 李洪媛, 周林艳, 等.清香型大曲中产香细菌的分离筛选及鉴定[J].中国酿造, 2022, 41(5):96-100.LIU X G, LI H Y, ZHOU L Y, et al.Isolation, screening and identification of aroma-producing bacteria in light-flavor Baijiu Daqu[J].China Brewing, 2022, 41(5):96-100.
[70] 张运祺, 郑自强, 邢浩博, 等.一株嗜热脂肪芽孢杆菌的筛选及其产酶特性研究[J].酿酒科技, 2023(5):78-84.ZHANG Y Q, ZHENG Z Q, XING H B, et al.Screening of a Geobacillus stearothermophilus strain and study on its enzyme-producing characteristics[J].Liquor-Making Science &Technology, 2023(5):78-84.
[71] 王芙蓉, 李靖, 赵益梅, 等.酱香大曲中高温放线菌的筛选及其产蛋白酶条件优化[J].中国酿造, 2022, 41(8):132-136.WANG F R, LI J, ZHAO Y M, et al.Screening of high-temperature actinomycetes in sauce-flavor Daqu and optimization of protease-producing conditions[J].China Brewing, 2022, 41(8):132-136.
[72] 刘洋, 赵婷, 姚粟, 等.一株芝麻香型白酒高温大曲嗜热放线菌的分离与鉴定[J].生物技术通报, 2012(10):210-216.LIU Y, ZHAO T, YAO S, et al.Identification on a Thermoactinomyces sp.separated from high temperature Daqu of sesame flavor liquor[J].Biotechnology Bulletin, 2012(10):210-216.
[73] 于华, 黄丹, 陈卓, 等.酱香型大曲中产蛋白酶放线菌的分离及产酶条件研究[J].中国酿造, 2017, 36(2):64-68.YU H, HUANG D, CHEN Z, et al.Isolation of protease-producing actinomycetes from sauce-flavor Daqu and its protease-producing conditions[J].China Brewing, 2017, 36(2):64-68.
[74] 王晓丹, 罗小叶, 邱树毅.茅台大曲中一株嗜热放线菌的分离筛选及特性研究[J].中国酿造, 2018, 37(4):51-56.WANG X D, LUO X Y, QIU S Y.Isolation and screening of a thermophilic actinomycete from Moutai-flavor Daqu and its characterization[J].China Brewing, 2018, 37(4):51-56.
[75] 魏丕伟, 王凌云, 罗惠波, 等.大曲中高产酸性蛋白酶霉菌的分离鉴定[J].食品与发酵科技, 2014, 50(4):1-4;21.WEI P W, WANG L Y, LUO H B, et al.Isolation and identification of acid-protease producing fungi from Daqu[J].Food and Fermentation Technology, 2014, 50(4):1-4;21.
[76] 谢玉球, 时晓, 周二干, 等.洋河大曲中糖化酶高产霉菌的筛选鉴定及固态发酵条件优化[J].酿酒科技, 2016(4):39-42.XIE Y Q, SHI X, ZHOU E G, et al.Separation and identification of mold strain with high-yield of glucoamylase from Yanghe Daqu and optimization of its solid-state fermentation conditions[J].Liquor-Making Science &Technology, 2016(4):39-42.
[77] 柳旭, 张倩, 周森, 等.清香型大曲中高糖化力霉菌的筛选、鉴定及其挥发性风味物质分析[J].中国酿造, 2023, 42(6):72-78.LIU X, ZHANG Q, ZHOU S, et al.Screening, identification of mold with high saccharifying power from light-flavor Daqu and its volatile flavor compounds[J].China Brewing, 2023, 42(6):72-78.
[78] 蒋英丽, 卓毓崇, 聂正东, 等.高温大曲中产果香霉菌的分离及研究[J].酿酒科技, 2015(2):21-24.JIANG Y L, ZHUO Y C, NIE Z D, et al.Separation of fruit aroma-producing mold strains from high-temperature Daqu and study of its properties[J].Liquor-Making Science &Technology, 2015(2):21-24.
[79] 鲁珍, 王红照, 李恩中, 等.高温大曲中霉菌的筛选及其挥发性产物分析[J].酿酒科技, 2019(7):50-55.LU Z, WANG H Z, LI E Z, et al.Screening of a mold strain from high-temperature Daqu &identification of its volatile fermentation products[J].Liquor-Making Science &Technology, 2019(7):50-55.
[80] 程伟, 彭兵, 汪焰胜, 等.金种子浓香型大曲中一株具产酶功能霉菌的筛选及其应用分析[J].酿酒, 2017, 44(2):67-72.CHENG W, PENG B, WANG Y S, et al.Screening and application analysis of a mould strain with enzyme producing function from golden seed Luzhou-flavor Daqu[J].Liquor Making, 2017, 44(2):67-72.
[81] 郑自强, 卫春会, 张立伟, 等.中高温大曲中霉菌的分离及其麸曲制备[J].现代食品科技, 2022, 38(1):165-172. ZHENG Z Q, WEI C H, ZHANG L W, et al.Isolation of mold from medium high temperature Daqu and preparation of fuqu[J].Modern Food Science and Technology, 2022, 38(1):165-172.
[82] 刘延波, 张丽婷, 赵志军, 等.赊店老酒大曲中耐高温霉菌的筛选与产酶条件优化[J].江苏农业科学, 2020, 48(5):268-275.LIU Y B, ZHANG L T, ZHAO Z J, et al.Screening of molds with high temperature resistance and optimization of enzyme production conditions in Shedian Laojiu Daqu[J].Jiangsu Agricultural Sciences, 2020, 48(5):268-275.
[83] 姚灿, 李国友, 张彬, 等.中高温大曲中嗜热真菌的分离鉴定及其酶活力测定[J].酿酒, 2019, 46(5):32-35.YAO C, LI G Y, ZHANG B, et al.Isolation and identification of thermophilic fungi from moderate/high-temperature Daqu and determination of enzyme activity[J].Liquor Making, 2019, 46(5):32-35.
[84] 卢延想, 梁慧珍, 陈鹏, 等.高温大曲中产香酵母的筛选及特征香气分析[J].食品研究与开发, 2021, 42(11):167-174.LU Y X, LIANG H Z, CHEN P, et al.Screening and characteristic aroma analysis of aroma-producing yeasts in high-temperature Daqu[J].Food Research and Development, 2021, 42(11):167-174.
[85] 明红梅, 周健, 陈蒙恩, 等.大曲中异常威克汉姆酵母发酵产苯乙醇的条件优化[J].湖北农业科学, 2015, 54(14):3492-3496. MING H M, ZHOU J, CHEN M E, et al.Optimization of phenylethanol fermentation conditions of Wickerhamomyces anomalus from Daqu by response surface methodology[J].Hubei Agricultural Sciences, 2015, 54(14):3492-3496.
[86] 牟飞燕, 凌荔, 肖钧文, 等.清香型白酒大曲中产酶酵母的筛选与发酵特性研究[J].酿酒科技, 2023(2):48-52;64.MOU F Y, LING L, XIAO J W, et al.Screening of enzyme-producing yeasts from Qingxiang Daqu and study on their fermentation characteristics[J].Liquor-Making Science &Technology, 2023(2):48-52;64.
[87] 周阳子, 边名鸿, 刘文艺, 等.高温大曲中一株产淀粉酶酵母的分离鉴定及其特性研究[J].食品与发酵工业, 2020, 46(2):79-84.ZHOU Y Z, BIAN M H, LIU W Y, et al.Isolation and identification of an amylase producing yeast and its characteristics in high-temperature Daqu[J].Food and Fermentation Industries, 2020, 46(2):79-84.
[88] 罗小叶, 邱树毅, 陆安谋, 等.酱香大曲产香酵母的分离及鉴定[J].食品与发酵工业, 2016, 42(12):26-31.LUO X Y, QIU S Y, LU A M, et al.Isolation and identification of aroma-producing yeast in Moutai-flavor Daqu[J].Food and Fermentation Industries, 2016, 42(12):26-31.
[89] 王晓丹, 陈美竹, 班世栋, 等.茅台大曲中酵母的分离、鉴定及其功能初探[J].食品科学, 2017, 38(4):51-57.WANG X D, CHEN M Z, BAN S D, et al.Separation, identification and functional characterization of yeast strains from Moutai-flavor Daqu, a traditional Chinese liquor fermentation starter[J].Food Science, 2017, 38(4):51-57.
[90] 张学林, 季斌, 许玲, 等.清香型大曲中产β-苯乙醇酵母的分离、鉴定及在白酒酿造中的应用[J].中国酿造, 2022, 41(1):123-127.ZHANG X L, JI B, XU L, et al.Isolation and identification of β-phenylethanol-producing yeast from light-flavor Daqu and its application in Baijiu brewing[J].China Brewing, 2022, 41(1):123-127.
[91] 牟飞燕, 夏博宇, 张维, 等.清香大曲中高耐受性功能酵母的筛选[J].中国酿造, 2023, 42(11):163-168.MOU F Y, XIA B Y, ZHANG W, et al.Screening of high tolerance functional yeasts from light-flavor Daqu[J].China Brewing, 2023, 42(11):163-168.
[92] WANG P, WU Q, JIANG X J, et al.Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J].International Journal of Food Microbiology, 2017, 250:59-67.
[93] 陈晓茹, 黄钧, 周荣清, 等.不同强化方式对浓香型白酒大曲特性的影响[J].食品与发酵工业, 2021, 47(15):50-55.CHEN X R, HUANG J, ZHOU R Q, et al.Effects of fortifying patterns on the characteristics of strong flavor type Daqu[J].Food and Fermentation Industries, 2021, 47(15):50-55.
[94] XU B Y, XU S S, CAI J, et al.Analysis of the microbial community and the metabolic profile in medium-temperature Daqu after inoculation with Bacillus licheniformis and Bacillus velezensis[J].LWT, 2022, 160:113214.
[95] CHEN M Y, LIU X B, LUO A M, et al.Effects of an ester aroma-producing bacterial strain on Maotai-flavor fermented grains[J].Food Science, 2018, 39(10):199-205.
[96] PU S C, ZHANG Y, LU N, et al.Yeasts from Chinese strong flavour Daqu samples:Isolation and evaluation of their potential for fortified Daqu production[J].AMB Express, 2021, 11(1):176.
[97] 崔香香, 白飞荣, 于学健, 等.谢瓦散囊菌CICC 41584产香特性及在浓香型白酒大曲生产中的应用[J].食品与发酵工业, 2019, 45(21):60-67.CUI X X, BAI F R, YU X J, et al.Aroma characteristics of Eurotium chevalieri CICC 41584 and its application in aroma Baijiu Daqu production[J].Food and Fermentation Industries, 2019, 45(21):60-67.
[98] 孙思佳, 翟磊, 于学健, 等.扣囊复膜孢酵母CICC 33077对芝麻香白酒高温大曲微生物群落结构和功能特性的影响[J].食品与发酵工业, 2023, 49(7):99-105.SUN S J, ZHAI L, YU X J, et al.Influences of Saccharomycopsis fibuligera CICC 33077 on microbial community and functional characteristics of high temperature Daqu in sesame flavor Baijiu[J].Food and Fermentation Industries, 2023, 49(7):99-105.
[99] MU Y, HUANG J, ZHOU R Q, et al.Exploring the response patterns of strong-flavor Baijiu brewing microecosystem to fortified Daqu under different pit ages[J].Food Research International, 2022, 155:111062.
[100] LIU J J, CHEN Y, FU G M, et al.Improvement of the flavor of major ethyl ester compounds during Chinese Te-flavor Baijiu brewing by Wickerhamomyces anomalus[J].Food Bioscience, 2022, 50:102022.
[101] 游玲, 李美华, 王陟垚, 等.1株Lodderomyces elongisporus酵母对浓香型白酒发酵的影响[J].食品与发酵工业, 2017, 43(3):9-13.YOU L, LI M H, WANG Z Y, et al.Influences of a Lodderomyces elongisporus strain on fermentation of strong-flavored liquor[J].Food and Fermentation Industries, 2017, 43(3):9-13.
[102] 杨第芹.酱香酒醅和大曲中耐高温产酯酵母的筛选及其生产丢糟酒的研究[D].贵阳:贵州大学, 2022.YANG D Q.Screening of ester-producing yeast with high temperature tolerance in Maotai-flavor fermented grains and Daqu and study on producing distilled grains wine[D].Guiyang:Guizhou University, 2022.
[103] 徐晓萌.大曲中酯香型酵母酿造啤酒工艺研究[D].大连:大连工业大学, 2020.XU X M.Study on beer brewing process using ester-producing yeast from flavor Daqu[D].Dalian:Dalian Polytechnic University, 2020.
[104] PAN Q L, HUANG J, ZHANG S Y, et al.Synergistic effect of biotic and abiotic factors drives microbiota succession and assembly in medium-temperature Daqu[J].Journal of the Science of Food and Agriculture, 2023, 103(9):4392-4400.