鳕鱼是重要的远洋渔业资源之一,其主要分布于北大西洋和北太平洋海域,在我国主要分布于渤海、黄海和东海北部。鳕鱼富含蛋白质、不饱和脂肪酸、维生素及矿物质元素,具有较高的营养价值和经济价值[1-2]。我国鳕鱼年加工量约为40~50万t[3-4],目前主要以冻鳕鱼片、鳕鱼条、盐渍鳕鱼等初级加工制品为主,精深加工制品较少。在鳕鱼加工过程中产生的大量副产物,如鱼骨、鱼皮、鱼内脏等,通常被低值处理或直接丢弃,造成资源浪费和环境污染等问题。已有研究指出,鳕鱼骨中蛋白质含量可达湿基的35.9%,且氨基酸组成较为合理,是优质蛋白的良好来源[5],极具开发价值。明确鳕鱼骨蛋白的生物活性,拓展其在健康食品及生物医药制品领域的应用,对助力鳕鱼渔业绿色低碳高值发展具有重要意义。
生物体内过量产生的自由基会引起氧化应激,造成细胞或组织的功能受损,进而导致多种疾病的发生[6]。抗氧化剂的使用可有效调节体内自由基的产生,维持稳态平衡,达到防治疾病的效果[7]。近年来,以水产品加工副产物为原料生产抗氧化肽备受关注[8-9]。与化学合成抗氧化肽相比,天然抗氧化肽具有安全性高、易吸收、活性强等优势,已在食品、化妆品等多领域得到良好应用[10]。目前,鳕鱼骨来源蛋白肽已被证明在降尿酸[11]、促进钙吸收[12]和调节血压[13]等方面具有良好的作用效果,但关于鳕鱼骨蛋白肽的抗氧化活性及其稳定性仍鲜有报道。综上,本文以采用大西洋鳕鱼骨为原料酶解制备的胶原蛋白肽为研究对象,通过测定自由基清除能力和还原力系统评价其抗氧化活性,并考察温度、酸碱度、模拟胃肠道消化等条件对其稳定性的影响,以期为大西洋鳕鱼骨胶原蛋白肽在抗氧化相关功能制品领域的应用提供数据支持,为鳕鱼加工副产物资源的深度开发利用提供科学指导。
1 材料与方法
1.1 材料与试剂
大西洋鳕鱼(Gadus morhua)鱼骨,青岛南极维康生物科技有限公司;碱性蛋白酶(alcalase 2.4 L,200 000 U/mL),丹麦诺维信生物技术有限公司;胃蛋白酶(250 U/mg)、胰蛋白酶(250 U/mg)、Lowry法蛋白浓度测定试剂盒,北京索莱宝科技有限公司;DPPH(纯度≥97%),梯希爱(上海)化成工业发展有限公司;ABTS(纯度≥98%),上海麦克林生化科技有限公司;盐酸、过氧化氢(分析纯),西陇科学股份有限公司;邻苯三酚、水杨酸、过硫酸钾、氢氧化钠、磷酸氢二钾、磷酸二氢钾、三氯乙酸、铁氰化钾、氯化铁、乙醇(分析纯),上海国药化学试剂有限公司。
1.2 仪器与设备
BSA224S-CW型电子分析天平,赛多利斯科学仪器有限公司;ST3100型pH计,奥豪斯仪器(常州)有限公司;SHA-B型恒温振荡器、HH-4型数显恒温水浴锅,常州智博瑞仪器制造有限公司;LXJ-IIB型离心机,上海安亭科学仪器厂;Neofuge 15R型高速冷冻离心机,上海力申科学仪器有限公司;XS-Y-MINI-2型有机膜多功能实验设备,南京诺润机械科技有限公司;TFN-18-200 200D型纳滤膜,山东博纳生物科技集团有限公司;BILON-6000Y型喷雾干燥机,上海比朗仪器制造有限公司;UV1-102II型紫外/可见分光光度计,上海天美科学仪器有限公司。
1.3 实验方法
1.3.1 大西洋鳕鱼骨胶原蛋白肽制备工艺
参考文献[14-15]方法制备大西洋鳕鱼骨胶原蛋白肽:取适量新鲜大西洋鳕鱼骨,洗净后按照料液比1∶3(g∶mL)加入蒸馏水,105 ℃蒸煮4 h后冷却至室温,匀浆,调节pH至7.5,加入0.65%(质量分数)的碱性蛋白酶,55 ℃酶解2 h,反应结束后于95 ℃加热灭酶20 min。待酶解液冷却至60 ℃,加入10 g/L的粉末活性炭,脱色处理1 h后,5 000 r/min离心20 min,上清液在压力1.4 MPa条件下经200 Da纳滤膜循环脱盐处理3次,收集处理液,喷雾干燥即得大西洋鳕鱼骨胶原蛋白肽样品。制备获得的大西洋鳕鱼骨胶原蛋白肽样品,按照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》规定的凯氏定氮法测得其总蛋白含量为92.42%;按照GB 31645—2018《食品安全国家标准 胶原蛋白肽》中附录A规定的方法测得其相对分子质量集中分布于189~6 500 Da,其中3 000 Da以下的蛋白肽占比为97.63%。
1.3.2 大西洋鳕鱼骨胶原蛋白肽抗氧化活性测定
1.3.2.1 DPPH自由基清除能力测定
参照文献[16]方法进行测定:不同浓度的大西洋鳕鱼骨胶原蛋白肽溶液与等体积0.2 mmol/L DPPH乙醇溶液混合,室温避光反应30 min,在517 nm下测定吸光值(A样品),用等量乙醇代替DPPH乙醇溶液测定相应吸光值(A空白),等量蒸馏水代替大西洋鳕鱼骨胶原蛋白肽溶液测定相应吸光值(A对照),DPPH自由基清除率的计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
1.3.2.2 羟自由基清除能力测定
参照文献[16-17]方法进行测定:1 mL不同浓度的大西洋鳕鱼骨胶原蛋白肽溶液中依次加入0.5 mL 9 mmol/L硫酸亚铁溶液、1 mL 9 mmol/L水杨酸乙醇溶液、1 mL 4.4 mmol/L双氧水和2 mL蒸馏水,混匀后于37 ℃水浴反应30 min,在510 nm下测定吸光值(B样品),用等量乙醇代替水杨酸乙醇溶液测定相应吸光值(B空白),等量蒸馏水代替大西洋鳕鱼骨胶原蛋白肽溶液测定相应吸光值(B对照),羟自由基清除率的计算如公式(2)所示:
羟自由基清除率![]()
(2)
1.3.2.3 超氧阴离子自由基清除能力测定
参照文献[17]方法进行测定:0.1 mL不同浓度的大西洋鳕鱼骨胶原蛋白肽溶液与4.5 mL 50 mmol/L Tris-HCl缓冲液(pH 8.2)混合,25 ℃水浴保温25 min后立刻加入0.1 mL 3 mmol/L邻苯三酚溶液(使用10 mmol/L盐酸溶液配制),迅速混匀后于25 ℃水浴反应5 min,反应结束后立即在325 nm下测定吸光值(C样品),用等量蒸馏水代替邻苯三酚溶液测定相应吸光值(C空白),等量蒸馏水代替大西洋鳕鱼骨胶原蛋白肽溶液测定相应吸光值(C对照),超氧阴离子自由基清除率的计算如公式(3)所示:
超氧阴离子自由基清除率![]()
(3)
1.3.2.4 ABTS阳离子自由基清除能力测定
参照文献[16-17]方法进行测定:将5 mL 7 mmol/L ABTS溶液与88 mL 2.45 mmol/L过硫酸钾溶液混合,室温避光贮存12 h,采用乙醇稀释至734 nm处吸光度值为0.70±0.02,配制成ABTS试剂。0.4 mL不同浓度的大西洋鳕鱼骨胶原蛋白肽溶液与3.6 mL ABTS试剂混合,室温避光反应6 min,在734 nm下测定吸光值(D样品),用等量乙醇代替ABTS试剂测定相应吸光值(D空白),等量蒸馏水代替大西洋鳕鱼骨胶原蛋白肽溶液测定相应吸光值(D对照),ABTS阳离子自由基清除率的计算如公式(4)所示:
ABTS阳离子自由基清除率/%![]()
(4)
1.3.2.5 还原力测定
参照文献[18]方法进行测定:1 mL不同浓度的大西洋鳕鱼骨胶原蛋白肽溶液,加入1 mL 0.2 mol/L磷酸盐缓冲液(pH 6.6)和1 mL 1.0%铁氰化钾溶液,于50 ℃水浴避光反应20 min,之后加入1 mL质量分数10.0%的三氯乙酸溶液,5 000 r/min离心10 min,取1 mL上清液加入1 mL超纯水和200 μL 0.1%氯化铁溶液,于700 nm下测定吸光值,以吸光值表征样品的还原能力。
1.3.3 大西洋鳕鱼骨胶原蛋白肽稳定性测定
1.3.3.1 温度对大西洋鳕鱼骨胶原蛋白肽抗氧化活性的影响
参照文献[19]方法进行测定:取适量30 mg/mL(DPPH自由基清除率测定浓度)或10 mg/mL(羟自由基清除率测定浓度)大西洋鳕鱼骨胶原蛋白肽溶液,分别置于25、37、60、80、100 ℃水浴中保温1 h,保温结束后冷却至室温,分别测定DPPH自由基清除率和羟自由基清除率。
1.3.3.2 pH值对大西洋鳕鱼骨胶原蛋白肽抗氧化活性的影响
参照文献[19]方法进行测定:取适量30 mg/mL(DPPH自由基清除率测定浓度)或10 mg/mL(羟自由基清除率测定浓度)大西洋鳕鱼骨胶原蛋白肽溶液,用1 mol/L盐酸或氢氧化钠溶液调节pH值至2.0、4.0、6.0、7.0、8.0、10.0,置于37 ℃水浴中保温1 h,结束后调节溶液pH值至7.0,分别测定DPPH自由基清除率和羟自由基清除率。
1.3.3.3 体外模拟胃肠道消化对大西洋鳕鱼骨胶原蛋白肽抗氧化活性的影响
参照文献[19]方法进行测定:取适量30 mg/mL(DPPH自由基清除率测定浓度)或10 mg/mL(羟自由基清除率测定浓度)大西洋鳕鱼骨胶原蛋白肽溶液,用1 mol/L盐酸溶液调节pH值至2.0,加入底物质量分数4.0%的胃蛋白酶,置于37 ℃水浴振荡消化反应1.5 h,消化完成后分成两部分,一部分沸水浴加热10 min终止反应,为胃消化样品;剩余部分继续反应,用1 mol/L氢氧化钠溶液调节pH值至7.5,加入底物质量分数4.0%的胰蛋白酶,置于37 ℃水浴振荡消化反应2 h,反应完成后沸水浴加热10 min终止反应,为胃肠消化样品;分别测定消化前、胃消化、胃肠消化样品的DPPH自由基清除率和羟自由基清除率。
1.4 数据处理
实验数据采用“平均值±标准偏差”的形式表示,采用IBM SPSS 27.0、Excel 2007、Origin 2018等软件进行数据处理和图形绘制。采用单因素方差分析进行组间多重比较,以P<0.05为差异具有统计学意义。
2 结果与分析
2.1 大西洋鳕鱼骨胶原蛋白肽的抗氧化活性
2.1.1 大西洋鳕鱼骨胶原蛋白肽的DPPH自由基清除能力
DPPH自由基清除能力是评价蛋白肽体外抗氧化活性强弱的重要指标。DPPH溶于乙醇后呈深紫色,与抗氧化肽反应后颜色变淡,通过颜色变化程度可判断抗氧化肽的活性强弱[17]。由图1可知,大西洋鳕鱼骨胶原蛋白肽质量浓度在10~75 mg/mL时,DPPH自由基清除率为(15.71±0.36)%~(82.23±0.48)%;随蛋白肽浓度的升高,DPPH自由基清除活性显著增强(P<0.05),并呈现出一定的量效关系。经计算,大西洋鳕鱼骨胶原蛋白肽清除DPPH自由基的IC50值为33.48 mg/mL。
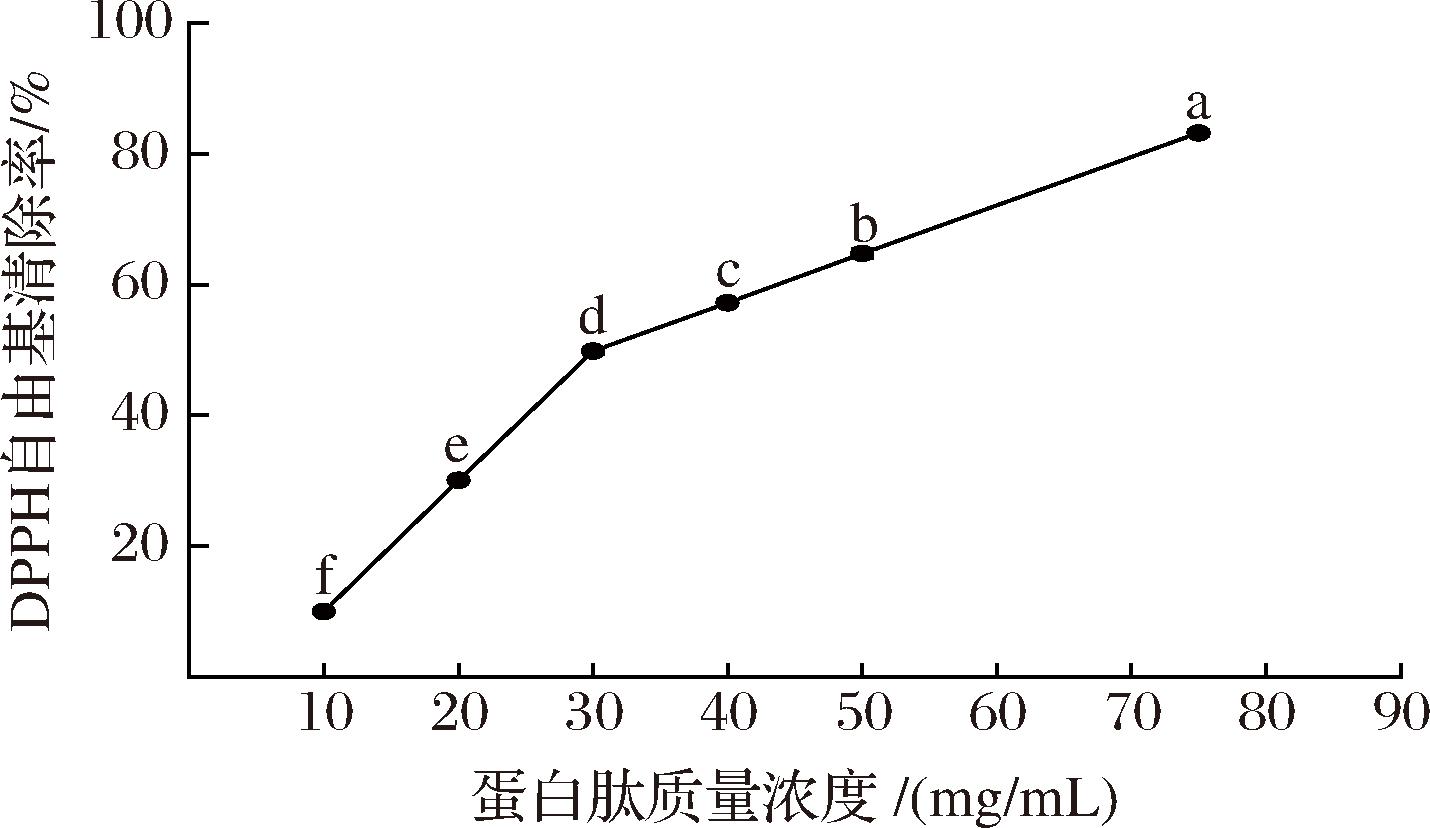
图1 大西洋鳕鱼骨胶原蛋白肽的DPPH自由基清除能力
Fig.1 DPPH free radical scavenging ability of collagen peptides from Atlantic cod (G.morhua) bone
注:不同字母标识表示不同实验组间具有显著性差异(P<0.05)(下同)。
2.1.2 大西洋鳕鱼骨胶原蛋白肽的羟自由基清除能力
二价铁离子与过氧化氢反应释放出的羟自由基与水杨酸相互作用后生成紫色物质,抗氧化肽的添加可减少羟自由基的产生而使反应体系颜色变浅,由颜色变化程度可判断抗氧化肽的活性强弱[20]。由图2可知,大西洋鳕鱼骨胶原蛋白肽质量浓度在4~20 mg/mL时,羟自由基清除率为(20.73±0.52)%~(88.87±0.68)%;随着蛋白肽浓度的升高,羟自由基清除活性显著增强(P<0.05);羟自由基清除能力与蛋白肽浓度呈正相关。与已有报道的马面鱼骨蛋白肽[21]相比,大西洋鳕鱼骨胶原蛋白肽具有更强的羟自由基清除能力。经计算,大西洋鳕鱼骨胶原蛋白肽清除羟自由基的IC50值为9.69 mg/mL。
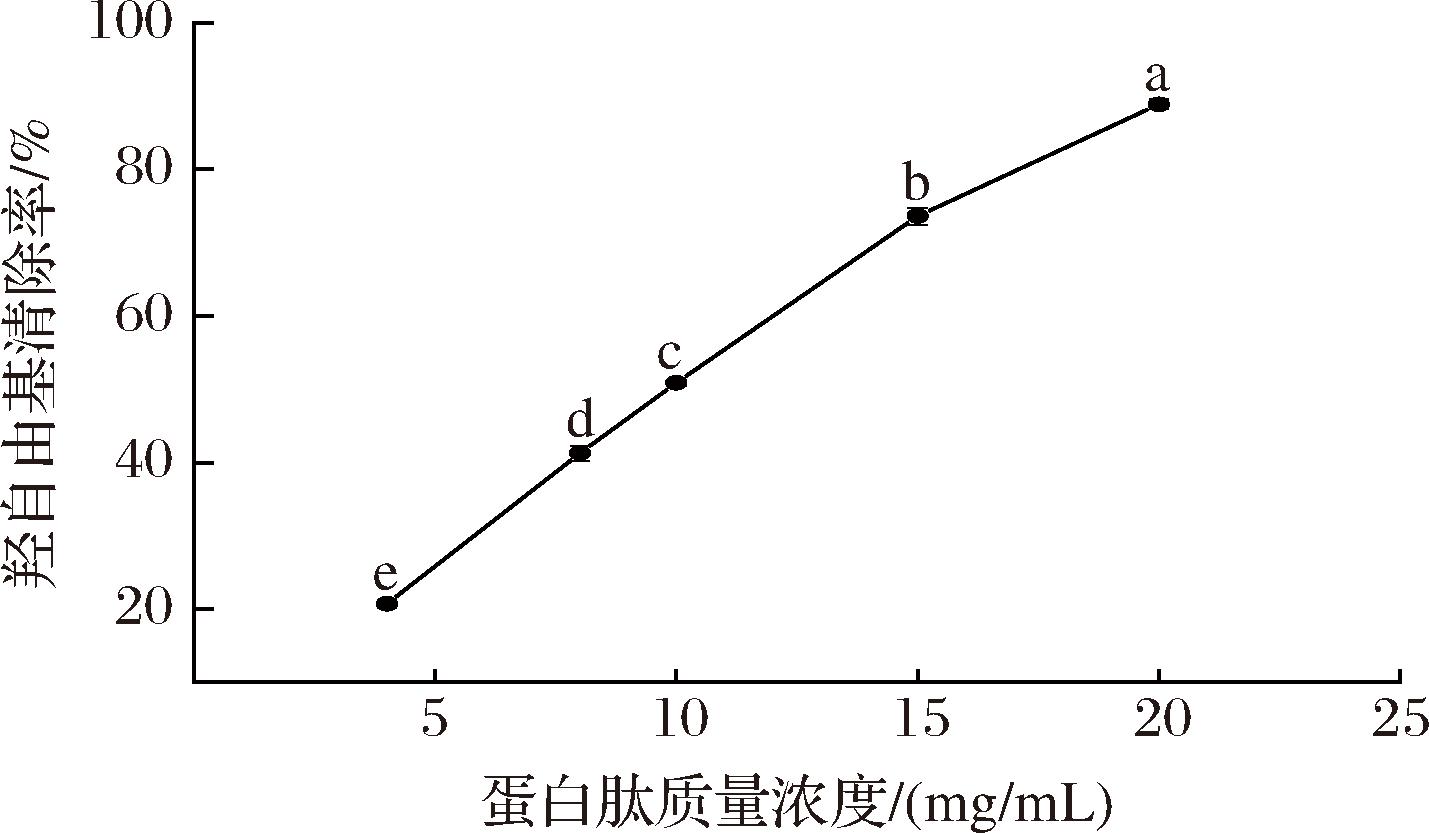
图2 大西洋鳕鱼骨胶原蛋白肽的羟自由基清除能力
Fig.2 Hydroxyl radical scavenging ability of collagen peptides from Atlantic cod (G.morhua) bone
2.1.3 大西洋鳕鱼骨胶原蛋白肽的超氧阴离子清除能力
超氧阴离子自由基具有强氧化性,可引发一系列氧化反应生成其他氧自由基,进而导致细胞或组织损伤,超氧阴离子自由基的清除对生物体具有重要意义[17]。抗氧化肽可以清除邻苯三酚自氧化过程中产生的超氧阴离子自由基而抑制邻苯三酚自氧化[22-23]。由图3可知,大西洋鳕鱼骨胶原蛋白肽质量浓度在0.1~25 mg/mL时,超氧阴离子自由基清除率为(22.33±1.18)%~(88.64±1.50)%;随着蛋白肽浓度的升高,超氧阴离子自由基清除活性显著增强(P<0.05)。与已有报道的鲶鱼骨蛋白肽[24]相比,大西洋鳕鱼骨胶原蛋白肽具有更强的超氧阴离子自由基清除能力。经计算,大西洋鳕鱼骨胶原蛋白肽清除超氧阴离子自由基的IC50值为6.86 mg/mL。
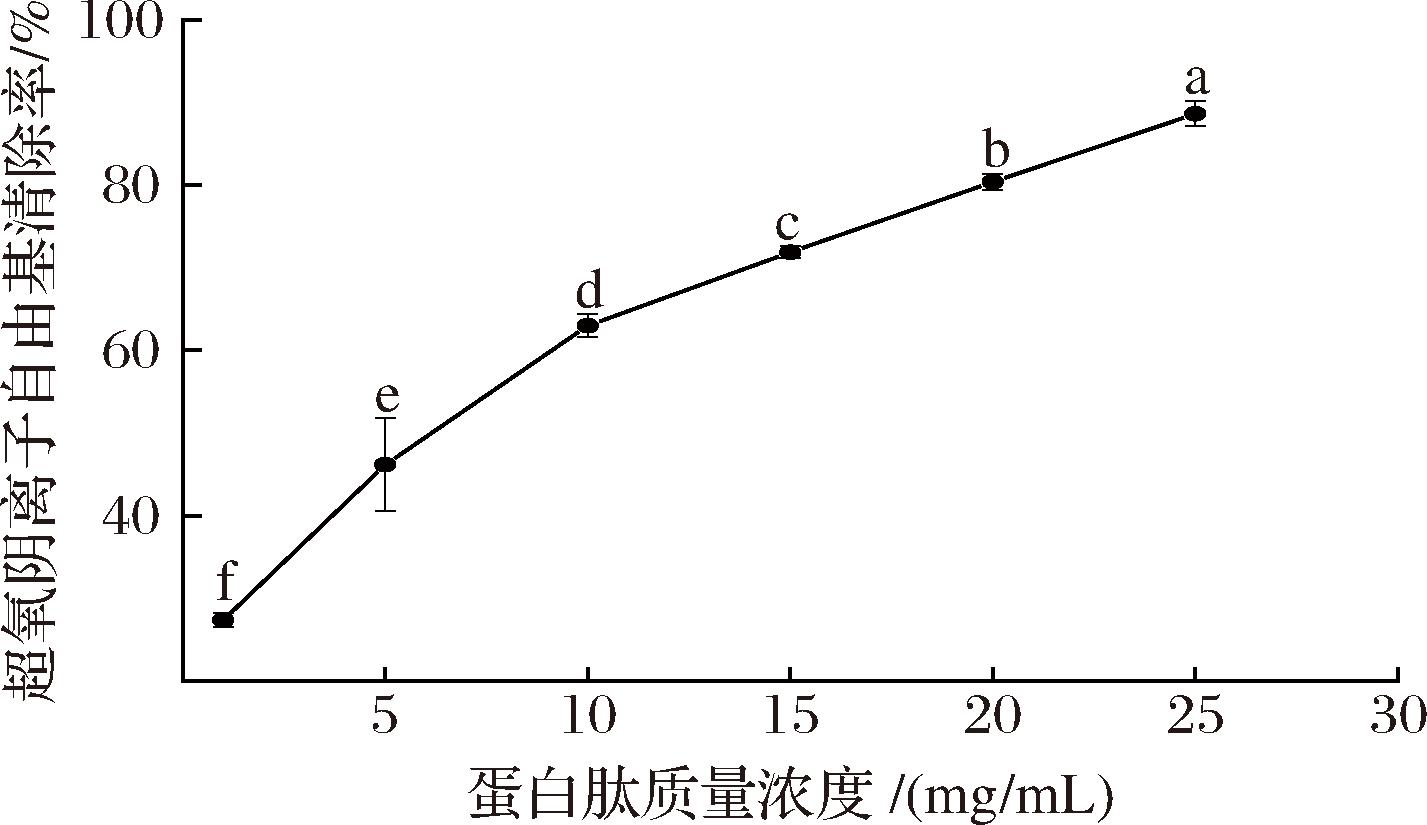
图3 大西洋鳕鱼骨胶原蛋白肽的超氧阴离子自由基清除能力
Fig.3 Superoxide anion free radical scavenging ability of collagen peptides from Atlantic cod (G.morhua) bone
2.1.4 大西洋鳕鱼骨胶原蛋白肽的ABTS阳离子自由基清除能力
ABTS阳离子自由基清除能力是评估抗氧化肽活性强弱的常用方法之一[25]。ABTS在氧化剂作用下被氧化生成绿色的ABTS阳离子自由基,抗氧化肽可抑制ABTS阳离子自由基的产生[20]。由图4可知,大西洋鳕鱼骨胶原蛋白肽质量浓度在10~30 mg/mL时,ABTS阳离子自由基清除率为(14.28±1.20)%~(97.34±0.15)%;随着蛋白肽浓度的升高,ABTS阳离子自由基清除活性显著增强(P<0.05),ABTS阳离子自由基清除能力与蛋白肽浓度呈正相关。经计算,大西洋鳕鱼骨胶原蛋白肽清除ABTS阳离子自由基的IC50值为17.78 mg/mL。
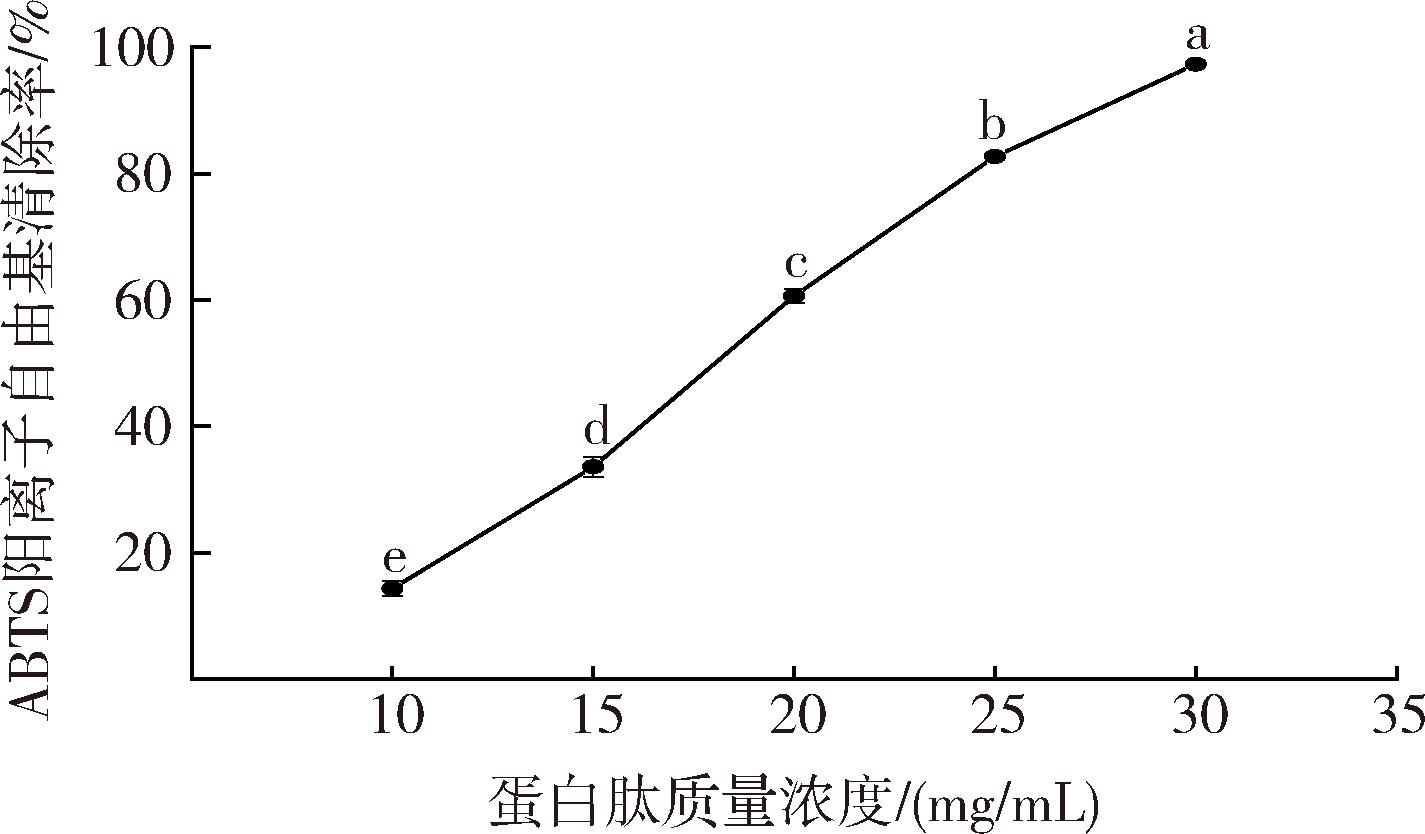
图4 大西洋鳕鱼骨胶原蛋白肽的ABTS阳离子自由基清除能力
Fig.4 ABTS cationic radical scavenging ability of collagen peptides from Atlantic cod (G.morhua) bone
2.1.5 大西洋鳕鱼骨胶原蛋白肽的还原力
铁氰化钾与抗氧化肽混合后被还原成亚铁氰化钾,亚铁氰化钾进一步与铁离子发生反应生成普鲁士蓝,其在700 nm处有较大的吸收,吸光值越大则抗氧化肽的还原能力越强[26]。由图5可知,大西洋鳕鱼骨胶原蛋白肽具有较好的还原能力,在3~15 mg/mL质量浓度范围内时,蛋白肽的还原能力随浓度的增加显著增强(P<0.05)。
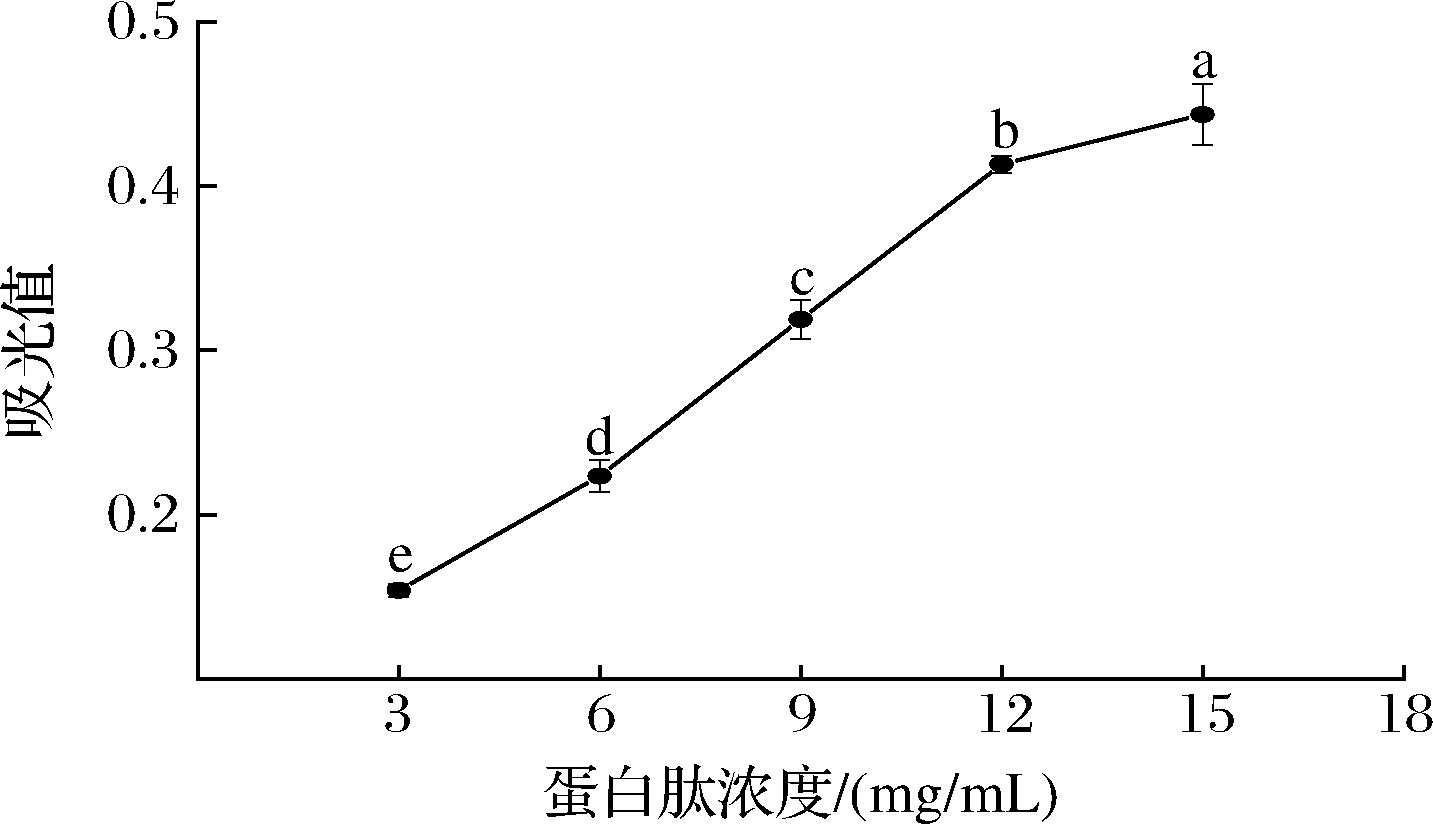
图5 大西洋鳕鱼骨胶原蛋白肽的还原力
Fig.5 Reducing power of collagen peptides from Atlantic cod (G.morhua) bone
2.2 大西洋鳕鱼骨胶原蛋白肽的稳定性
2.2.1 温度对大西洋鳕鱼骨胶原蛋白肽抗氧化活性的影响
大西洋鳕鱼骨胶原蛋白肽溶液在温度为25~100 ℃时,其DPPH自由基清除活性受温度影响变化不显著(P>0.05),羟自由基清除活性随着温度升高先升高而后有所降低(P<0.05),推测这与高温环境使活性多肽的结构遭到部分破坏有关[27]。虽然在温度>60 ℃条件下,大西洋鳕鱼骨胶原蛋白肽的羟自由基清除活性有所下降,但仍能达到原有活性的95.06%以上。综上可知,大西洋鳕鱼骨胶原蛋白肽具有良好的热稳定性。
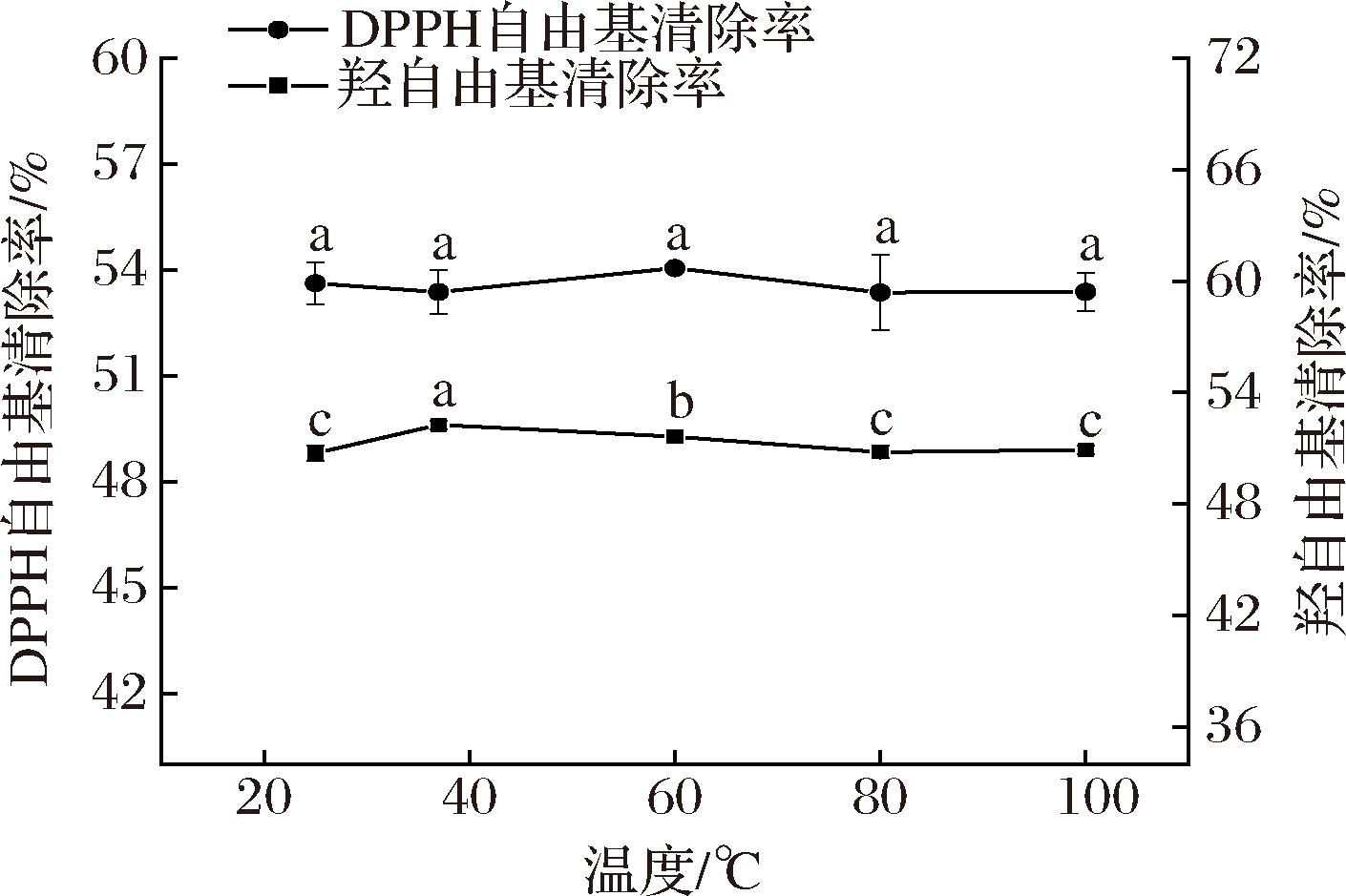
图6 温度对大西洋鳕鱼骨胶原蛋白肽抗氧化活性的影响
Fig.6 Effect of temperature on stability of collagen peptides from Atlantic cod (G.morhua) bone
2.2.2 pH值对大西洋鳕鱼骨胶原蛋白肽抗氧化活性的影响
大西洋鳕鱼骨胶原蛋白肽溶液在pH 2.0~10.0时,随着pH的增加,其DPPH自由基清除活性和羟自由基清除活性均先升高后下降,变化显著(P<0.05)。在pH 6.0~8.0时,大西洋鳕鱼骨胶原蛋白肽清除DPPH自由基和羟自由基的能力较强,而在强酸性或强碱性条件下,其清除DPPH自由基和羟自由基的能力均有下降。酸性条件易影响多肽的溶解度,使其与自由基结合受抑制,导致活性降低[28];而碱性环境中,多肽易发生外消旋或脱酰胺反应,导致活性减弱[29]。因此,大西洋鳕鱼骨胶原蛋白肽的加工或贮藏过程,应避免强酸、强碱条件的影响。
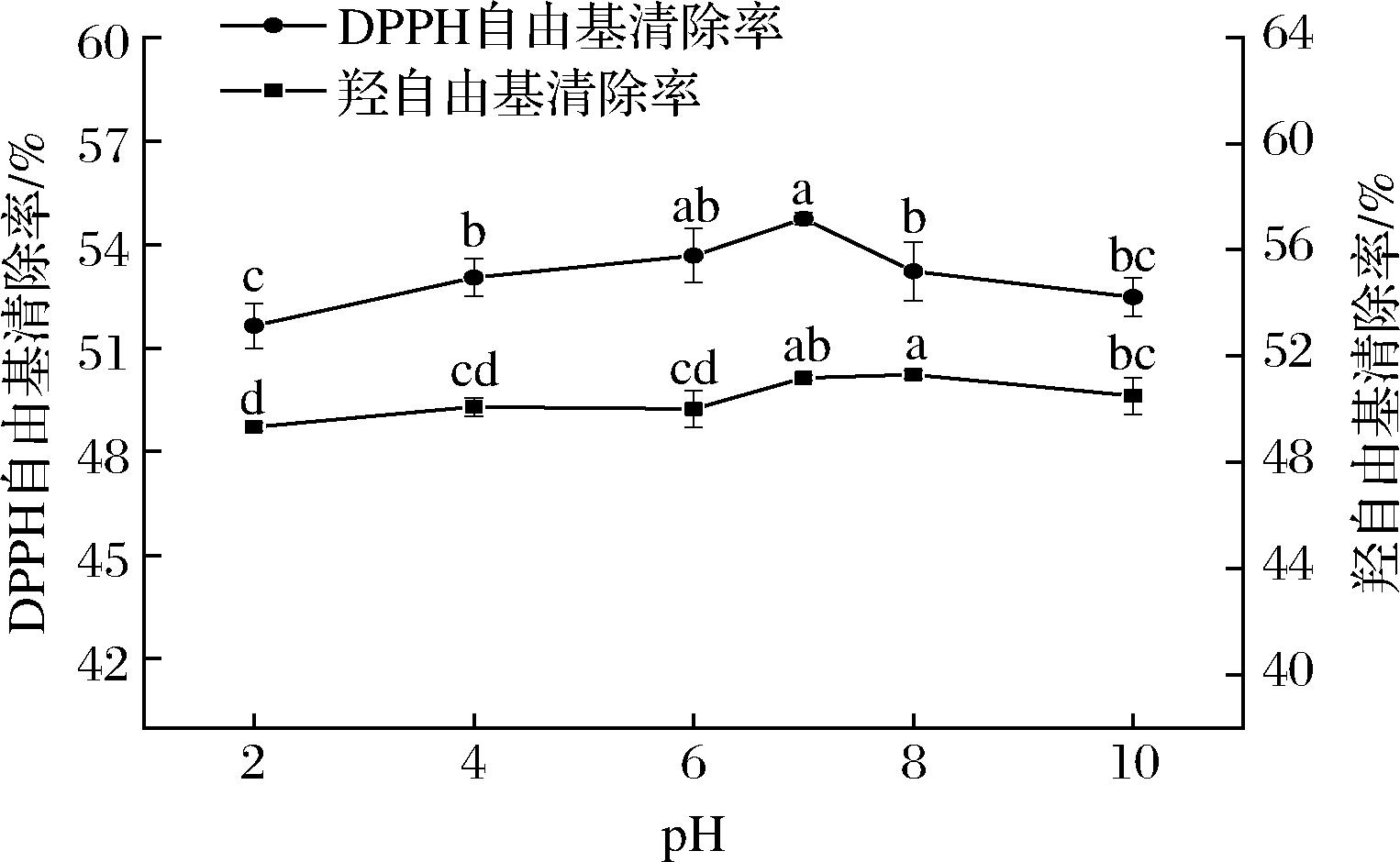
图7 pH对大西洋鳕鱼骨胶原蛋白肽抗氧化活性的影响
Fig.7 Effect of pH on stability of collagen peptides from Atlantic cod (G.morhua) bone
2.2.3 模拟胃肠道消化对大西洋鳕鱼骨胶原蛋白肽抗氧化活性的影响
大西洋鳕鱼骨胶原蛋白肽经模拟胃液消化处理后,其DPPH自由基清除率由(54.70±0.60)%下降至(45.76±0.17)%(P<0.05),羟自由基清除率由(51.78±0.26)%下降至(50.63±0.58)%(P<0.05);再经模拟肠液消化处理后,其DPPH自由基清除率下降至(43.90±0.55)%(P<0.05),羟自由基清除率下降至(48.66±0.38)%(P<0.05)。多肽的生物活性主要依靠肽链中各个氨基酸分子间的协同作用,因此,多肽活性优于游离氨基酸[30]。大西洋鳕鱼骨胶原蛋白肽在胃肠消化过程中,经胃蛋白酶、胰蛋白酶进一步酶解为相对分子质量更小的短肽和游离氨基酸,部分活性多肽遭到破坏,进而导致抗氧化活性降低。大西洋鳕鱼骨胶原蛋白肽经胃肠消化后,其抗氧化活性仍能保持原有活性的80.26%以上,较好的消化稳定性有利于其作为功能原料在相关制品中应用。
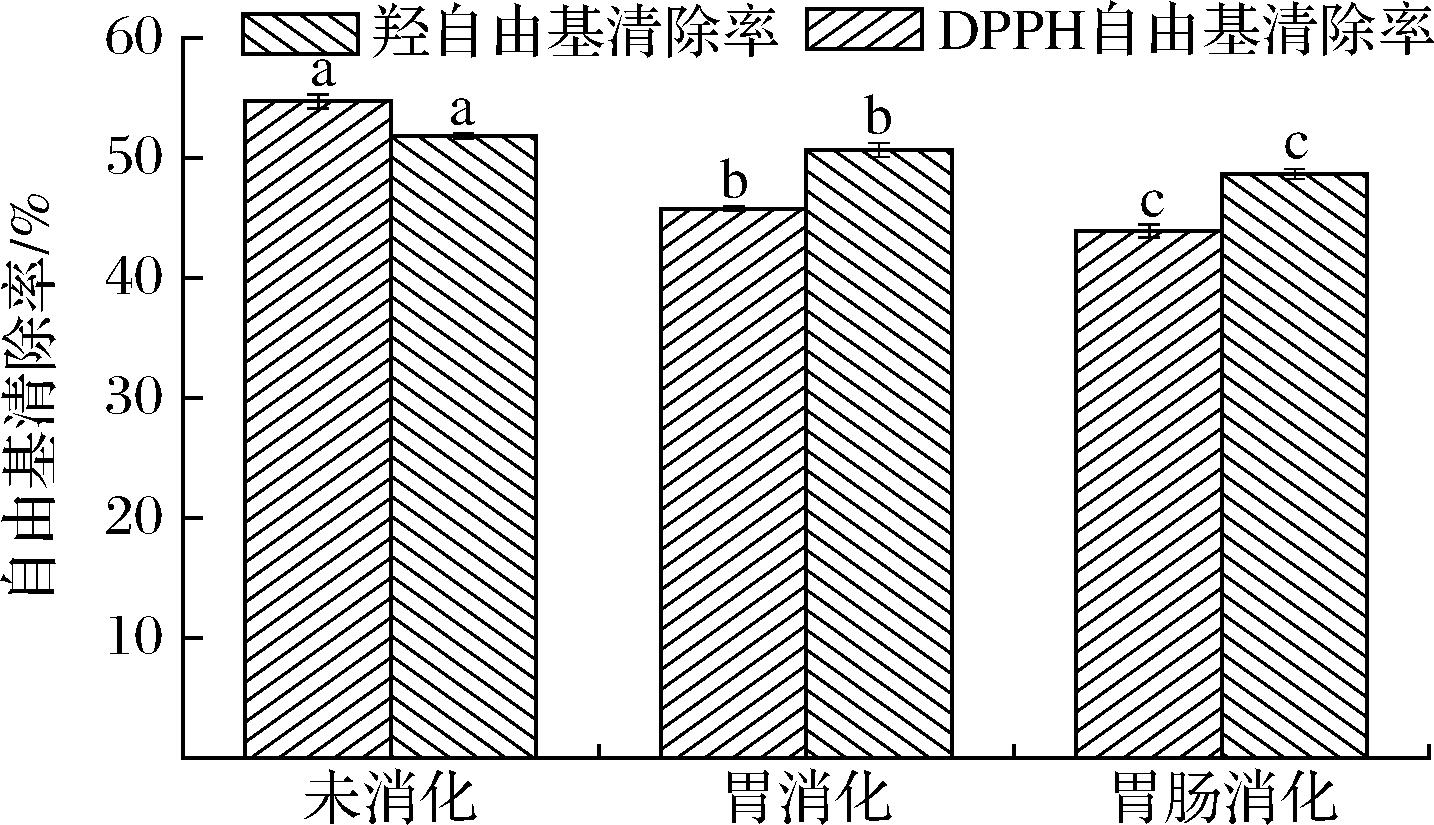
图8 胃肠道消化环境对大西洋鳕鱼骨胶原蛋白肽稳定性的影响
Fig.8 Effects of gastrointestinal digestive environment on stability of collagen peptides from Atlantic cod (G.morhua) bone
3 结论
本研究对大西洋鳕鱼骨胶原蛋白肽的抗氧化活性及稳定性进行了评价。抗氧化活性研究结果表明,大西洋鳕鱼骨胶原蛋白肽具有良好的DPPH自由基、羟自由基、超氧阴离子自由基、ABTS阳离子自由基清除能力和显著的还原能力。稳定性研究结果表明,大西洋鳕鱼骨胶原蛋白肽在温度为25~100 ℃时具有良好的热稳定性;pH对其稳定性具有一定影响,在强酸、强碱条件下抗氧化活性明显降低;经体外模拟胃肠道消化后仍可保留较强的抗氧化活性。未来研究可对大西洋鳕鱼骨胶原蛋白肽进一步分离纯化,筛选得到抗氧化活性最优组分,并解析其构效关系,定向开发功能制品。本研究对促进鳕鱼骨资源高值利用和新型抗氧化肽产品开发具有积极意义。
[1] 步营, 李月, 杨琬琳, 等.鳕鱼骨汤的熬制及风味物质释放规律[J].现代食品科技, 2020, 36(3):226-233.BU Y, LI Y, YANG W L, et al.Cooking progress and flavor release of alaska pollock frame soup[J].Modern Food Science and Technology, 2020, 36(3):226-233.
[2] 谭晓怡. 鳕鱼骨蛋白及其营养调味料制备技术研究[D].哈尔滨:哈尔滨工业大学, 2017.TAN X Y.Preparations of cod bone proteins and its nutritional seasonings[D].Harbin:Harbin Institute of Technology, 2017.
[3] 袁照路, 苗君, 张欣欣, 等.鳕鱼骨粉乳酸菌发酵工艺研究[J].中国食品添加剂, 2023, 34(2):203-210.YUAN Z L, MIAO J, ZHANG X X, et al.Optimization of fermentation technology of cod bone powder by Lactobacillus[J].China Food Additives, 2023, 34(2):203-210.
[4] 史刘辉. 鳕鱼皮胶原及其低聚肽的制备及特性研究[D].无锡:江南大学, 2012.SHI L H.Study on preparation and characters of cod skin collagen and collagenous oligopeptide[D].Wuxi:Jiangnan University, 2012.
[5] TOPPE J, ALBREKTSEN S, HOPE B, et al.Chemical composition, mineral content and amino acid and lipid profiles in bones from various fish species[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2007, 146(3):395-401.
[6] WANG L Y, MA M T, YU Z P, et al.Preparation and identification of antioxidant collagen peptides from cottonseed proteins[J].Food Chemistry, 2021, 352:129399.
[7] LYU R Z, DONG Y F, BAO Z J, et al.Advances in the activity evaluation and cellular regulation pathways of food-derived antioxidant collagen peptides[J].Trends in Food Science &Technology, 2022, 122:171-186.
[8] SILA A, BOUGATEF A.Antioxidant collagen peptides from marine by-products:Isolation, identification and application in food systems.A review[J].Journal of Functional Foods, 2016, 21:10-26.
[9] LORENZO J M, MUNEKATA P E S, G MEZ B, et al.Bioactive collagen peptides as natural antioxidants in food products—A review[J].Trends in Food Science &Technology, 2018, 79:136-147.
MEZ B, et al.Bioactive collagen peptides as natural antioxidants in food products—A review[J].Trends in Food Science &Technology, 2018, 79:136-147.
[10] 盖莉莉, 高丹丹, 李明生, 等.食源性抗氧化肽分离纯化方法研究进展[J].食品安全质量检测学报, 2018, 9(16):4343-4348. GAI L L, GAO D D, LI M S, et al.Research progress on separation and purification of antioxidative peptides derived from food[J].Journal of Food Safety &Quality, 2018, 9(16):4343-4348.
[11] ZHAO Q, MENG Y, LIU J C, et al.Separation, identification and docking analysis of xanthine oxidase inhibitory collagen peptides from pacific cod bone-flesh mixture[J].LWT, 2022, 167:113862.
[12] PENG Z, HOU H, ZHANG K, et al.Effect of calcium-binding peptide from Pacific cod (Gadus macrocephalus) bone on calcium bioavailability in rats[J].Food Chemistry, 2017, 221:373-378.
[13] JE J Y, PARK P J, KWON J Y, et al.A novel angiotensin I converting enzyme inhibitory peptide from Alaska pollack (Theragra chalcogramma) frame protein hydrolysate[J].Journal of Agricultural and Food Chemistry, 2004, 52(26):7842-7845.
[14] 杨露, 丁利君, 蓝德安.马面鱼骨胶原多肽的理化特性及其抗氧化活性[J].食品科学, 2013, 34(11):109-112.YANG L, DING L J, LAN D A.Physicochemical characterization and antioxidant properties of collagen polypeptide from Navodon septentionalis bone[J].Food Science, 2013, 34(11):109-112.
[15] 冯晓文, 赵晓涵, 潘骁琦, 等.体外模拟消化对海洋鱼骨胶原低聚肽结构和抗氧化活性的影响[J].食品与发酵工业, 2022, 48(5):173-179.FENG X W, ZHAO X H, PAN X Q, et al.The effect of simulated digestion in vitro on structure and antioxidant activity of marine fish bone collagen oligopeptides[J].Food and Fermentation Industries, 2022, 48(5):173-179.
[16] 刘小芳, 颜征, 冷凯良, 等.南极磷虾多肽的组成及其抗氧化与ACE抑制活性[J].食品研究与开发, 2020, 41(23):7-13.LIU X F, YAN Z, LENG K L, et al.Composition analysis and evaluation of the antioxidative and ACE inhibitory activities of polypeptides from Antarctic krill[J].Food Research and Development, 2020, 41(23):7-13.
[17] 盛周煌, 贾盟盟, 朱良, 等.罗非鱼皮胶原蛋白多肽的体外抗氧化活性[J].食品科技, 2018, 43(11):274-278.SHENG Z H, JIA M M, ZHU L, et al.In vitro antioxidant activity of collagen peptides from tilapia skin[J].Food Science and Technology, 2018, 43(11):274-278.
[18] 王忠合, 王军, 胡慧娟.模式类黑精及其分级产物清除自由基能力、抗氧化性及还原力分析[J].食品与发酵工业, 2016, 42(1):92-96.WNAG Z H, WANG J, HU H J.Analysis of free radical-scavenging and reducing ability of melanoidins and its fractions[J].Food and Fermentation Industries, 2016, 42(1):92-96.
[19] 栾晓旭, 冯美琴, 孙健.发酵香肠源抗氧化肽的稳定性[J].食品科学, 2020, 41(16):1-7.LUAN X X, FENG M Q, SUN J.Stability of antioxidant peptides extracted from fermented sausages[J].Food Science, 2020, 41(16):1-7.
[20] 刘威, 闵伟红, 刘春雷, 等.核桃清蛋白抗氧化肽的制备及其活性研究[J].食品研究与开发, 2017, 38(17):40-44.LIU W, MIN W H, LIU C L, et al.Preparation and activity of antioxidant peptide from walnut albumin[J].Food Research and Development, 2017, 38(17):40-44.
[21] 杨露. 马面鱼骨胶原多肽的制备及其抗氧化活性研究[D].广州:广东工业大学, 2012.YANG L.Studies on preparation and antioxidant of collagen polypeptide from bone of Navodon septentionalis[D].Guangzhou:Guangdong University of Technology, 2012.
[22] JIN D X, LIU X L, ZHENG X Q, et al.Preparation of antioxidative corn protein hydrolysates, purification and evaluation of three novel corn antioxidant collagen peptides[J].Food Chemistry, 2016, 204:427-436.
[23] ZHAO Y, ZHAO Q, LU Q Y.Purification, structural analysis, and stability of antioxidant collagen peptides from purple wheat bran[J].BMC Chemistry, 2020, 14(1):58.
[24] 梁鹏, 张阳, 窦媛.鲶鱼骨酶解物抗氧化活性及其稳定性研究[J].食品研究与开发, 2012, 33(11):49-52.LIANG P, ZHANG Y, DOU Y.Study on the antioxidant activity and stability of the hydrolysate of catfish bones[J].Food Research and Development, 2012, 33(11):49-52.
[25] YANG Q, CAI X X, YAN A N, et al.A specific antioxidant peptide:Its properties in controlling oxidation and possible action mechanism[J].Food Chemistry, 2020, 327:126984.
[26] 段帅, 吴晓彤.油莎豆粕抗氧化肽的制备及其稳定性研究[J].中国粮油学报, 2023, 38(1):80-89.DUAN S, WU X T.Research on preparation and stability of antioxidant peptides from cyperus esculentus meals[J].Journal of the Chinese Cereals and Oils Association, 2023, 38(1):80-89.
[27] ZHU C Z, ZHANG W G, KANG Z L, et al.Stability of an antioxidant peptide extracted from Jinhua ham[J].Meat Science, 2014, 96(2):783-789.
[28] PEREIRA A M, LISBOA C R, SANTOS T D, et al.Bioactive stability of microalgal protein hydrolysates under food processing and storage conditions[J].Journal of Food Science and Technology, 2019, 56(10):4543-4551.
[29] WANG X Q, YU H H, XING R G, et al.Optimization of the extraction and stability of antioxidative collagen peptides from Mackerel (Pneumatophorus japonicus) protein[J].BioMed Research International, 2017, 2017:6837285.
[30] 刘小芳, 黄岳磊, 李雅婷, 等.南极磷虾蛋白肽的抗氧化活性及稳定性研究[J].食品科技, 2022, 47(11):114-120.LIU X F, HUANG Y L, LI Y T, et al.Antioxidant activity and stability of peptides from Antarctic krill (Euphausia Superba)[J].Food Science and Technology, 2022, 47(11):114-120.