脂质氧化会通过引起必需脂肪酸的变质,降低肉类的营养价值,产生消费者无法接受的风味及潜在的有毒化合物,并促进其他重要分子的氧化,是影响肉及肉制品品质以及消费者可接受性的主要因素[1]。作为肌肉组织的主要组成部分,蛋白质在肉制品的感官、营养方面也起着决定性的作用。蛋白质的氧化可能导致必需氨基酸的损失和蛋白消化率降低,最终影响肉品的营养价值。同时,蛋白质的氧化也会显著降低蛋白质的溶解度和保水力,较低的蛋白质持水力会导致肉品在蒸煮过程中水分大量流失,降低食用品质[2]。并且,脂质氧化与蛋白质氧化是相互联系、相互作用的。脂质氧化产生的氧自由基、脂质氧化产物是蛋白质羰基化的潜在引发剂[3]。在血红素蛋白中,蛋白质氧化导致铁的释放,铁的释放会通过催化氢过氧化物的分解对脂质氧化过程产生促进作用[1]。为减少肉类在流通贮藏过程的氧化,人们广泛使用抗氧化剂来防止肉品氧化。常用的传统合成抗氧化剂,如丁基羟基茴香醚(butylated-hydroxyanisole,BHA)和二丁基羟基甲苯(butylated-hydroxytoluene,BHT),在最近的研究中发现可能具有潜在的毒性和致癌作用[4]。因此,肉类行业开始采用天然抗氧化剂来抑制肉及肉制品的氧化。植物精油等天然抗氧化剂具有抗氧化和抗菌特性,以薄膜和涂层的形式在食品工业中广泛应用,但它们具有挥发性和光降解性[5]。因此,将这些天然抗氧化剂直接添加到肉中存在局限性。此外,在中国和许多其他国家,禁止在生鲜肉中直接添加食品添加剂,这进一步限制了许多抗氧化剂的使用。近年来,通过宰前饲喂植物多酚提高肌肉抗氧化性能是研究热点之一。在动物日粮中添加天然抗氧化剂可以提高肌肉组织的抗氧化酶活性或总抗氧化能力[6-7]。
白藜芦醇(3,5,4′-三羟基二苯乙烯)是一种广泛存在于葡萄、浆果、花生和其他植物中的天然多酚,具有多种生物活性,包括抗氧化作用[8]、抗肿瘤活性[9]和抗炎活性[10]。研究报道日粮中添加白藜芦醇可以减少动物肌肉的脂质和蛋白质氧化[11-12]。氧化过程中的一个关键转录因子是核因子E2相关因子2(nuclear erythroid 2-related factor 2,Nrf2),该因子通过调控酶的合成参与抗氧化代谢、生物转化反应以及脂质和碳水化合物的间接转化[13]。研究发现,白藜芦醇可以破坏Nrf2与Kelch ECH结合蛋白1(kelch-like ECH-associated protein 1,Keap1)的结合并促使Nrf2向细胞核的易位,随后激活并调节靶基因的转录[14]。对此,相关研究证明白藜芦醇可以通过Nrf2机制提高肌肉的抗氧化性能,有效防止氧化应激对机体的损伤。如日粮中添加白藜芦醇可显著上调鸡肉的Nrf2基因和蛋白表达,降低Keap1的蛋白水平,白藜芦醇可以通过激活Nrf2-Keap1信号通路来增强鸡肉抗氧化能力[15]。
然而,肉牛属于反刍动物,饲喂白藜芦醇是否也会起到跟其他动物类似的抗氧化效果,这还需要进一步研究。目前尚未有日粮中添加白藜芦醇对牛肉抗氧化能力的报道。因此,本研究旨在探究日粮中添加白藜芦醇对牛肉抗氧化能力的影响及其对牛肉高氧气调包装贮藏期间氧化程度的影响。该研究结果可以为高氧气调包装牛肉产业的发展提供指导意义。
1 材料与方法
1.1 材料与试剂
本试验的研究对象为山东某公司肉牛养殖基地饲养的肉牛。白藜芦醇(纯度98%),西安瑞盈生物科技有限公司。
A005-1-2谷胱甘肽过氧化物酶测定试剂盒、A001-3-2超氧化物歧化酶测定试剂盒、A007-1-1过氧化氢酶测定试剂盒、A015-1-2总抗氧化能力测定试剂盒、A003-1-2丙二醛测定试剂盒,南京建成生物工程研究所;Evo M-MLV反转录预混型试剂盒、Pro Taq HS预混型qPCR试剂盒,湖南艾科瑞生物工程有限公司;HRP标记的山羊抗小鼠IgG,武汉赛维尔生物科技有限公司;HRP标记的山羊抗兔IgG,Cell Signaling Technology公司;兔GSH-Px单克隆抗体、鼠β-actin单克隆抗体,Abcam公司;兔SOD单克隆抗体、兔CAT单克隆抗体、兔Nrf2单克隆抗体、兔Keap1单克隆抗体、兔HO-1单克隆抗体,Proteintech公司。
1.2 仪器与设备
SP62便携式积分球分光光度仪,爱色丽仪器有限公司;DT-6D气调包装机,大江机械设备有限公司;BioTek Epoch2型酶标仪,美国伯腾仪器有限公司;Ultra-Turrax T18均质机,德国IKA;5804R高速冷冻离心机,德国Effendorf公司。
1.3 实验方法
1.3.1 实验设计与饲喂处理
选取12头健康状况良好、平均体重为(565±34) kg的约14月龄西门塔尔×鲁西杂交公牛为研究对象。随机分配到2组,对照组和白藜芦醇组,每组6头牛。对照组只提供全混合日粮,白藜芦醇组提供的是450 mg/kg白藜芦醇的全混合日粮[5 g/(头·d)],添加剂量和饮食组成参考LI等[16]的方法,饲养试验期120 d。为了避免白藜芦醇摄入量的差异,全混合日粮的量是固定的,并且对照组和白藜芦醇组采食量无显著差异(数据未展示)。试验牛每天喂食2次,每头牛分别在单独的围栏中喂食。所有的试验牛饲喂期间自由饮食和饮水。
1.3.2 样品采集与处理
在饲喂60 d和120 d时,于上午8点对每头牛进行空腹静脉采血15 mL,用于血清中抗氧化性能的研究。
饲喂120 d后,按照商业化标准屠宰工艺屠宰所有的试验牛。宰后45 min,在右半胴体背最长肌和腰大肌固定位置采集肌肉样品约20 g,于-80 ℃保存,用于肌肉中抗氧化酶活性、mRNA和蛋白表达的测定。胴体在0~4 ℃排酸24 h后,取下右侧胴体的背最长肌和腰大肌,将其真空包装并在3 h内于0~4 ℃下运送到实验室,修整后分别并切出8块2.54 cm的牛排,随机取6块牛排采用高氧气调包装(80% O2/20% CO2),并于4 ℃贮藏5、10、15 d,每个时间点2块牛排,盘内放置吸水垫。高氧气调包装采用氧气阻隔膜包装[氧气透过率:23 ℃/0%相对湿度下25 cm3/(m2·24 h),水蒸气透过率:4 ℃/100%相对湿度下10 g/(m2·24 h)]。在每个时间点,取样测量牛肉中的脂质氧化和蛋白质氧化。另外,准备2块牛排用于0 d时初始值的检测。
1.3.3 血清和肌肉抗氧化指标的测定
采集试验牛血液后,用离心机在3 000×g离心10 min收集血清,于-20 ℃保存。使用南京建成试剂盒测定血清和肌肉的谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活性、总抗氧化能力(total antioxidant capacity,T-AOC)及血清中丙二醛(malonaldehyde,MDA)含量。
1.3.4 抗氧化基因相对表达量的测定
参考LI等[16]的方法并稍作修改。本实验中GSH-Px、SOD、CAT、Nrf2、Keap1、HO-1为目的基因,甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因,全部引物由上海生工生物工程有限公司设计合成,引物序列如表1所示。
表1 引物序列及蛋白表达基因产物大小
Table 1 Primer sequences and product length

基因引物序列(5'-3')基因产物大小/bpGSH-PxF:CGAGGAGATCCTGAATTGCCTGAAGR:GAAGGAAGGCGAAGAGCGGATG122SODF:AGCCCTAACGGTGGTGGAGAACR:CCTTATTGAAGCCGAGCCAACCC148CATF:ACAGCCAGAAGAGAAACCCTCAAACR:ATCCATTCATGTGCCTGTGTCCATC147Nrf2F:TGGAGACACATTGCTTGGCTTCAGR:TGTGATGACGACAAAGGTTGGACTG138Keap1F:CGCCCTGGGAATTACCGTTCACR:TAACACTCCACGCTGTCCAAGAATG87HO-1F:GCTACCTGGGAGACCTGTCTGGR:ACTTGGTGGCACTGGCGATATTG126GAP-DHF:GATGGTGAAGGTCGGAGTGAACR:GTCATTGATGGCGACGATGT100
以反转录产物为模板,表1中为引物,利用SYBR® Green Pro Taq HS预混型qPCR试剂盒进行RT-qPCR。反应体系如表2所示。
表2 RT-qPCR反应体系
Table 2 RT-qPCR reaction system

组分名称使用量/μL2×SYBR Green Pro Taq HS Premix10cDNA2PCR Forward Primer(10 μmol/L)0.4PCR Reverse Primer(10 μmol/L)0.4RNase-free 水7.2Total20
RT-qPCR反应体系配制全程在冰盒上进行,每个反应管设置3个平行。RT-qPCR反应程序为预变性:95 ℃孵育30 s;PCR反应:95 ℃孵育5 s,60 ℃孵育30 s进行39个循环。反应结束后,采用2-ΔΔCt法计算目的基因的相对表达量。
1.3.5 抗氧化蛋白相对表达量的测定
参考ZHAO等[17]的方法并稍作修改。全蛋白提取后,计算出蛋白样品上样量,根据试剂盒说明书制好分离胶和浓缩胶。电泳时,先调整为电压90 V运行30 min,然后调整电压为120 V运行1 h左右。电泳结束后进行转印(90 V,90 min)将凝胶上的目标条带转印到PVDF膜。后用5%的脱脂奶粉在室温条件下对PVDF膜进行封闭90 min。封闭结束后,将PVDF膜置于按体积比稀释的GSH-Px一抗(1∶5 000),SOD一抗(1∶10 000),CAT一抗(1∶10 000),Nrf2一抗(1∶5 000),Keap1一抗(1∶5 000),HO-1一抗(1∶2 000),β-actin一抗(1∶5 000)中在4 ℃孵育过夜。孵育结束后,将膜分别置于按体积比稀释的羊抗小鼠二抗(1∶5 000)和羊抗兔二抗(1∶2 000)溶液中室温孵育90 min。配制ECL显影液进行显影。使用Image lab分析蛋白条带的强度。
1.3.6 脂质氧化的测定MDA含量的测定
参考SIU等[18]和YANG等[19]的方法并稍作修改。从每块牛排的多个位置随机取5 g肉样,并将其修整、切碎,与20 mL蒸馏水混合,并使用均质机彻底均质。加入10%三氯乙酸溶液20 mL,混合均匀,用Whatman 1#滤纸过滤,取滤液1 mL,与250 μL 60 mmol/L硫代巴比妥酸溶液混合,80 ℃水浴加热90 min,冷却至室温。使用酶标仪测量532 nm处的吸光度值,并使用1,1,3,3-四甲氧基丙烷(1,1,3,3-tetramethoxypropane,TMP)标准曲线定量,结果表示为MDA含量(mg/kg牛肉)。
1.3.7 羰基含量和活性巯基含量的测定
取肉样0.5 g加入5 mL缓冲液(20 mmol/L磷酸盐缓冲液,0.6 mmol/L NaCl,pH 6.5)进行研磨3次(45 Hz,45 s),研磨后离心(4 ℃,5 000×g,15 min),离心后分离上清液,测定蛋白质浓度、羰基含量。
样品中蛋白质的羰基含量测定根据LEVINE等[20]的2,4-二硝基苯肼(2, 4-dinitrophenylhydrazine,DNPH)方法稍作修改。取2份50 μL蛋白质溶液加入1 mL 10 mmol/L DNPH混合溶液中,立即置于黑暗中1 h,然后以20 min为间隔振荡10 s,以1 mL 2 mol/L HCl溶液为空白。孵育后,分别加入1 mL 20%三氯乙酸,然后用1 mL乙醇和乙酸乙酯的混合物(1∶1,体积比)洗涤沉淀3次,去除未反应的DNPH,然后用1.5 mL 6 mol/L盐酸胍(pH 6.5)溶解,在370 nm处测量吸光度。用22 000 mol/(L·cm)的摩尔吸光度系数计算羰基含量,结果表示为每克肉样品中羰基物质的含量。
活性巯基含量采用FU等[21]的方法进行分析并稍作修改。取100 μL蛋白溶液置于离心管中,加入900 μL磷酸盐缓冲液(50 mmol/L NaH2PO4,50 mmol/L Na2HPO4,0.6 mol/L KCl,10 mmol/L EDTA,pH 7.0),再加入0.04 mL 0.1% 5,5′-二硫代-2-硝基苯酸(5,5′-dithio-2-nitrobenzoic acid,DTNB)溶液,于4 ℃反应1 h,在412 nm下测定吸光度值,用反应摩尔吸光度系数13 600 mol/(L·cm)来计算活性巯基含量,结果表示为每克肉样品中活性巯基的含量。
1.4 数据处理与分析
本实验采用裂区设计来研究不同日粮处理、饲喂时间、肌肉部位和贮藏时间对牛肉抗氧化能力的影响。采用SAS Version 9.2中的MIXED程序分析日粮中添加白藜芦醇对血清抗氧化能力、抗氧化基因、蛋白的相对表达的影响,其中日粮处理和肌肉部位及其相互作用为固定效应,牛胴体为随机效应(n=6)。分析高氧气调包装牛肉贮藏期间脂质和蛋白质氧化程度时,日粮处理、肌肉部位、贮藏时间及其相互作用为固定效应,牛胴体为随机效应。P<0.05认为具有显著性差异,使用Sigma Plot 14.0软件进行作图。
2 结果与分析
2.1 日粮中添加白藜芦醇对肉牛血清抗氧化性能的影响
动物体内,包括GPx、SOD和CAT在内的酶性抗氧化防御系统能抵消并调节活性氧水平以维持生理平衡,有助于提高机体抗氧化能力[22]。由表3可知,日粮中添加白藜芦醇和饲喂时间两因素的交互作用对GSH-Px、CAT活性以及MDA含量具有显著性影响(P<0.05),与对照组相比,在饲喂期间白藜芦醇组显著增加了血清的GSH-Px、SOD、CAT的活性,显著提高了T-AOC(P<0.05),并显著降低了血清的MDA含量(P<0.05)。日粮中添加白藜芦醇和饲喂时间2个单因素分别对SOD活性及T-AOC具有显著性影响(P<0.05),白藜芦醇处理组SOD活性及T-AOC显著高于对照组(P<0.05),饲喂末期SOD活性显著降低而T-AOC显著提高(P<0.05)。因此,本研究结果表明,日粮补充白藜芦醇可以通过提高血清中抗氧化酶活性改善肉牛血清抗氧化能力,有助于动物机体抗氧化能力的提升。MENG等[23]也发现,日粮中补充白藜芦醇可以显著提高仔猪血清抗氧化能力是由于血清中GSH-Px、SOD、CAT活性增强,MDA水平降低。
表3 日粮中添加白藜芦醇对肉牛血清抗氧化性能的影响
Table 3 Effects of dietary resveratrol on serum antioxidant properties of cattle

指标日粮处理饲喂时间/d60120均值标准误差P值日粮处理饲喂时间日粮处理×饲喂时间GSH-Px/(U/mL)对照组128.45ay89.41by白藜芦醇组201.24ax132.06bx3.13*********对照组55.12 37.21 46.17ySOD/(U/mL)白藜芦醇组69.97 45.04 57.50x1.58******NS均值 62.54a 41.13bCAT/(U/mL)对照组 2.78ay 1.19by白藜芦醇组 4.79ax 2.25bx0.24*******对照组 2.943.973.45yT-AOC/(U/mL)白藜芦醇组3.845.124.48x0.15******NS均值3.39b4.54aMDA/(nmol/mL)对照组 4.24ax 2.07bx白藜芦醇组2.87ay1.83by0.25*******
注:a~b不同字母表示相同处理、不同饲喂时间具有显著性差异(P<0.05);x~y不同字母表示相同饲喂时间、不同处理具有显著性差异(P<0.05)。NS:P>0.05,*:P<0.05,***:P<0.001。
2.2 日粮中添加白藜芦醇对不同部位肌肉抗氧化酶活性的影响
由表4可知,日粮中添加白藜芦醇和肌肉部位两因素交互作用对CAT活性具有显著性影响(P<0.05),对照组中背最长肌与腰大肌的CAT活性无显著差异(P>0.05),而白藜芦醇处理组中,背最长肌CAT活性显著高于腰大肌(P<0.05)。这说明饲喂白藜芦醇对CAT活性的影响存在部位差异。日粮中添加白藜芦醇和肌肉部位2个单因素分别对T-AOC具有显著性影响(P<0.05),白藜芦醇处理组的T-AOC显著高于对照组,且腰大肌的T-AOC显著高于背最长肌(P<0.05)。日粮中添加白藜芦醇单因素对GSH-Px、SOD活性具有显著性影响(P<0.05)。白藜芦醇组的GSH-Px、SOD活性显著高于对照组(P<0.05)。类似的,JIN等[24]报道日粮中添加白藜芦醇可以提高鸭肉GSH-Px、SOD、CAT活性。因此,日粮中添加白藜芦醇不仅能改善血清抗氧化能力,还能增强肌肉抗氧化能力。相似的,有研究报道日粮中添加白藜芦醇可激活Nrf2信号通路进而提高肉鸡脾脏中T-AOC、T-SOD和CAT的活性[25]。这可能是因为白藜芦醇能作用于Nrf2信号通路增强抗氧化酶的活性[13]。
表4 日粮中添加白藜芦醇对不同部位肌肉抗氧化酶活性的影响
Table 4 Effects of dietary resveratrol on antioxidant enzyme activities in different muscles

指标/(U/mg prot)日粮处理部位背最长肌腰大肌均值标准误差P值日粮处理部位日粮处理×部位GSH-Px对照组46.1849.5247.85y2.70**NSNS白藜芦醇组54.4364.1259.27xSOD对照组27.3028.4827.89y0.71***NSNS白藜芦醇组33.2233.7233.47xCAT对照组0.59ym0.72ym-0.09******白藜芦醇组2.08xm1.56xn对照组0.761.000.88y-T-AOC白藜芦醇组1.041.191.12x-******NS均值0.91n1.09m-0.04
注:x~y不同字母表示相同部位、不同处理具有显著性差异(P<0.05);m~n不同字母表示相同处理、不同部位具有显著性差异(P<0.05)。NS:P>0.05,*:P<0.05,**:P<0.01,***:P<0.001。
2.3 日粮中添加白藜芦醇对不同部位肌肉抗氧化基因相对表达的影响
由表5可知,日粮中添加白藜芦醇和肌肉部位两因素交互作用对SOD、CAT、Keap1基因表达具有显著性影响(P<0.05)。白藜芦醇处理组中,2个部位肌肉的SOD、CAT基因表达均显著高于对照组,但在背最长肌中的表达水平均显著低于腰大肌(P<0.05)。白藜芦醇处理对背最长肌中的Keap1基因表达无显著影响,但显著降低了腰大肌中的表达(P<0.05)。日粮中添加白藜芦醇单因素对GSH-Px、Nrf2和HO-1基因表达具有显著性影响(P<0.05),与对照组相比,白藜芦醇处理组显著增加了牛肉中GSH-Px、Nrf2和HO-1的基因表达(P<0.05)。据报道,日粮中添加白藜芦醇可以上调猪胎盘中Nrf2参与抗氧化调控的基因表达,包括CAT、GSH-PX1、SOD1和HO-1[23]。结合上述结果表明日粮中添加白藜芦醇可以提高Nrf2抗氧化机制相关的基因表达。
表5 日粮中添加白藜芦醇对不同部位肌肉抗氧化基因表达的影响
Table 5 Effects of dietary resveratrol on the expression of antioxidant genes in different muscles
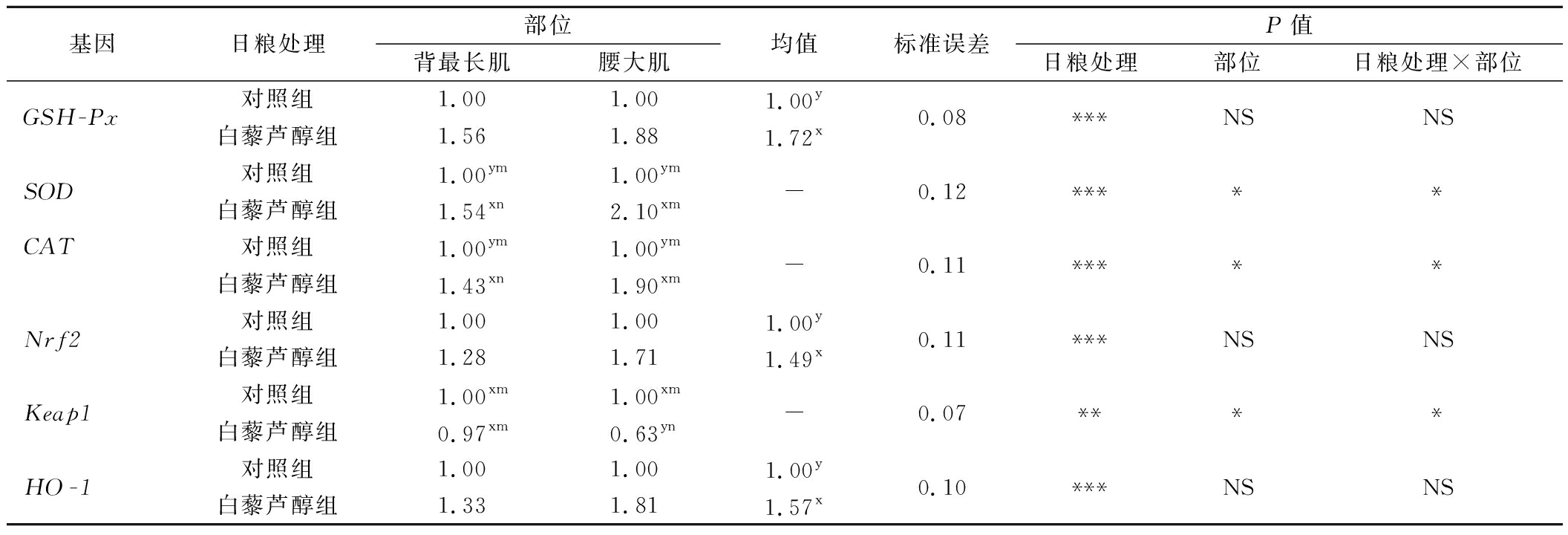
基因日粮处理部位背最长肌腰大肌均值标准误差P值日粮处理部位日粮处理×部位GSH-Px对照组1.001.001.00y0.08***NSNS白藜芦醇组1.561.881.72xSOD对照组1.00ym1.00ym-0.12*****白藜芦醇组1.54xn2.10xmCAT对照组1.00ym1.00ym-0.11*****白藜芦醇组1.43xn1.90xmNrf2对照组1.001.001.00y0.11***NSNS白藜芦醇组1.281.711.49xKeap1对照组1.00xm1.00xm-0.07****白藜芦醇组0.97xm0.63ynHO-1对照组1.001.001.00y0.10***NSNS白藜芦醇组1.331.811.57x
注:x~y不同字母表示相同部位、不同处理具有显著性差异(P<0.05);m~n不同字母表示相同处理、不同部位具有显著性差异(P<0.05)。NS:P>0.05,*:P<0.05,**:P<0.01,***:P<0.001。Nrf2:核因子E2相关因子2基因;Keap1:Kelch ECH结合蛋白1基因;HO-1:血红素氧合酶基因。
2.4 日粮中添加白藜芦醇对不同部位肌肉抗氧化蛋白相对表达的影响
由图1和表6可知,日粮中添加白藜芦醇和肌肉部位两因素交互作用对GSH-Px、Nrf2的蛋白表达有显著性影响(P<0.05)。与对照组相比,白藜芦醇处理组显著增加了2个肌肉部位的GSH-Px、Nrf2的蛋白表达(P<0.05);腰大肌的GSH-Px蛋白表达显著高于背最长肌(P<0.05),而Nrf2的蛋白表达显著低于背最长肌(P<0.05)。日粮中添加白藜芦醇单因素对SOD、CAT、Keap1和HO-1的蛋白表达有显著性影响(P<0.05),白藜芦醇处理组显著提高了牛肉的SOD、CAT和HO-1的蛋白表达(P<0.05),显著降低了Keap1的蛋白表达(P<0.05)。Nrf2在调节氧化应激中具有重要功能,是调节细胞氧化还原状态的重要靶点,它可以受白藜芦醇的作用转运到细胞核中激活抗氧化反应元件,从而诱导抗氧化酶(SOD、CAT和GSH-Px等)的表达;Keap1作为Nrf2的胞质结合蛋白,在正常生理条件下阻止Nrf2向细胞核易位,从而导致Nrf2蛋白酶体降解[14]。MENG等[23]研究发现猪日粮添加白藜芦醇后,猪胎盘中Nrf2蛋白表达水平升高,Keap1蛋白表达水平降低。这与本研究结果一致,表明肉牛日粮中添加白藜芦醇可激活Nrf2-Keap1通路。此外,ZHAO等[15]报道称,日粮中添加白藜芦醇通过调控Nrf2通路显著提高了肉鸡肌肉中总Nrf2和HO-1的蛋白水平。
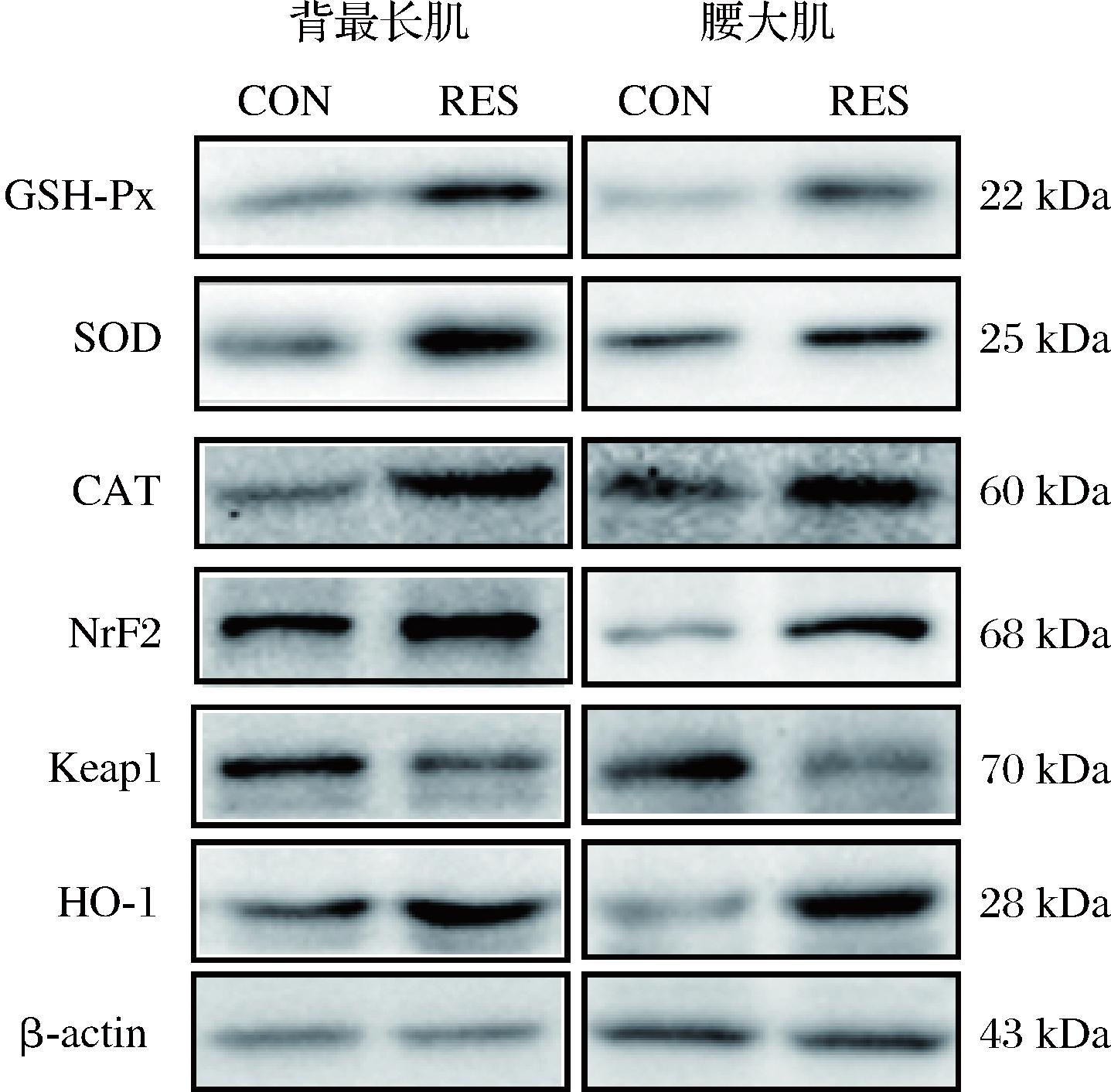
CON-对照组;RES-白藜芦醇组
图1 不同处理组肌肉中抗氧化蛋白的表达情况
Fig.1 Expression of antioxidant proteins in muscles of different treatment groups
表6 日粮中添加白藜芦醇对不同部位肌肉抗氧化蛋白表达的影响
Table 6 Effect of dietary resveratrol on the expression of antioxidant proteins in different muscles
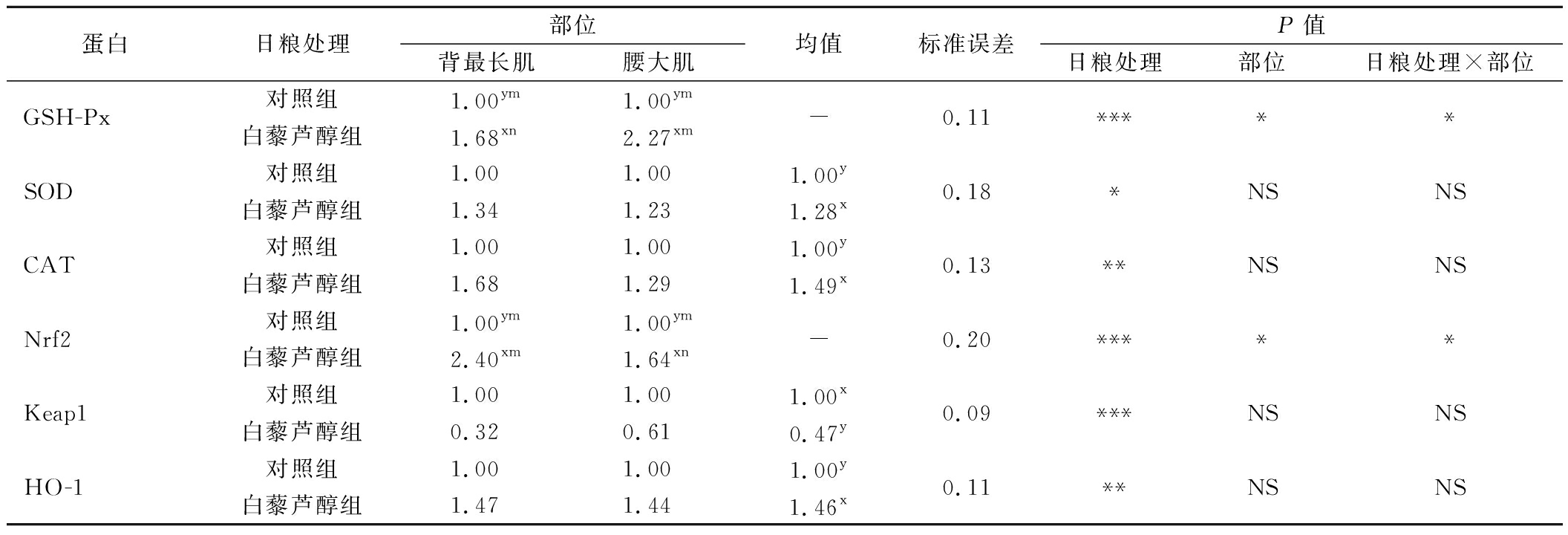
蛋白日粮处理部位背最长肌腰大肌均值标准误差P值日粮处理部位日粮处理×部位GSH-Px对照组1.00ym1.00ym-0.11*****白藜芦醇组1.68xn2.27xmSOD对照组1.001.001.00y0.18*NSNS白藜芦醇组1.341.231.28xCAT对照组1.001.001.00y0.13**NSNS白藜芦醇组1.681.291.49xNrf2对照组1.00ym1.00ym-0.20*****白藜芦醇组2.40xm1.64xnKeap1对照组1.001.001.00x0.09***NSNS白藜芦醇组0.320.610.47yHO-1对照组1.001.001.00y0.11**NSNS白藜芦醇组1.471.441.46x
注:x~y不同字母表示相同部位、不同处理具有显著性差异(P<0.05);m~n不同字母表示相同处理、不同部位具有显著性差异(P<0.05);NS:P>0.05,*:P<0.05,**:P<0.01,***:P<0.001;-表示无数值;HO-1:血红素氧合酶。
因此,由本研究中的基因表达及蛋白表达结果可知,肉牛日粮中添加白藜芦醇可通过作用于Nrf2-Keap1通路,提高Nrf2的表达,进而促进Nrf2下游抗氧化酶的转录,有利于增强牛肉中抗氧化酶活性。这与表4中GSH-Px、SOD、CAT活性及总抗氧化能力的增加相一致。
2.5 日粮中添加白藜芦醇对高氧气调包装牛肉贮藏期间脂质氧化的影响
脂质氧化对肉类贮藏期间的食用品质有重要影响。由图2-a可知,日粮中添加白藜芦醇和贮藏时间两因素交互作用对牛肉MDA含量具有显著性影响(P<0.05)。随着贮藏时间延长,对照组和白藜芦醇组牛肉MDA含量逐渐增加,而白藜芦醇组MDA含量显著低于对照组(P<0.05),表明日粮中添加白藜芦醇显著降低了牛肉贮藏期间的脂质氧化。由图2-b可知,肌肉部位和贮藏时间两因素交互作用对牛肉MDA含量具有显著性影响(P<0.05),腰大肌在贮藏第10天时脂质氧化程度显著高于背最长肌(P<0.05),但在其他时间点2个部位间差异不显著(P>0.05)。
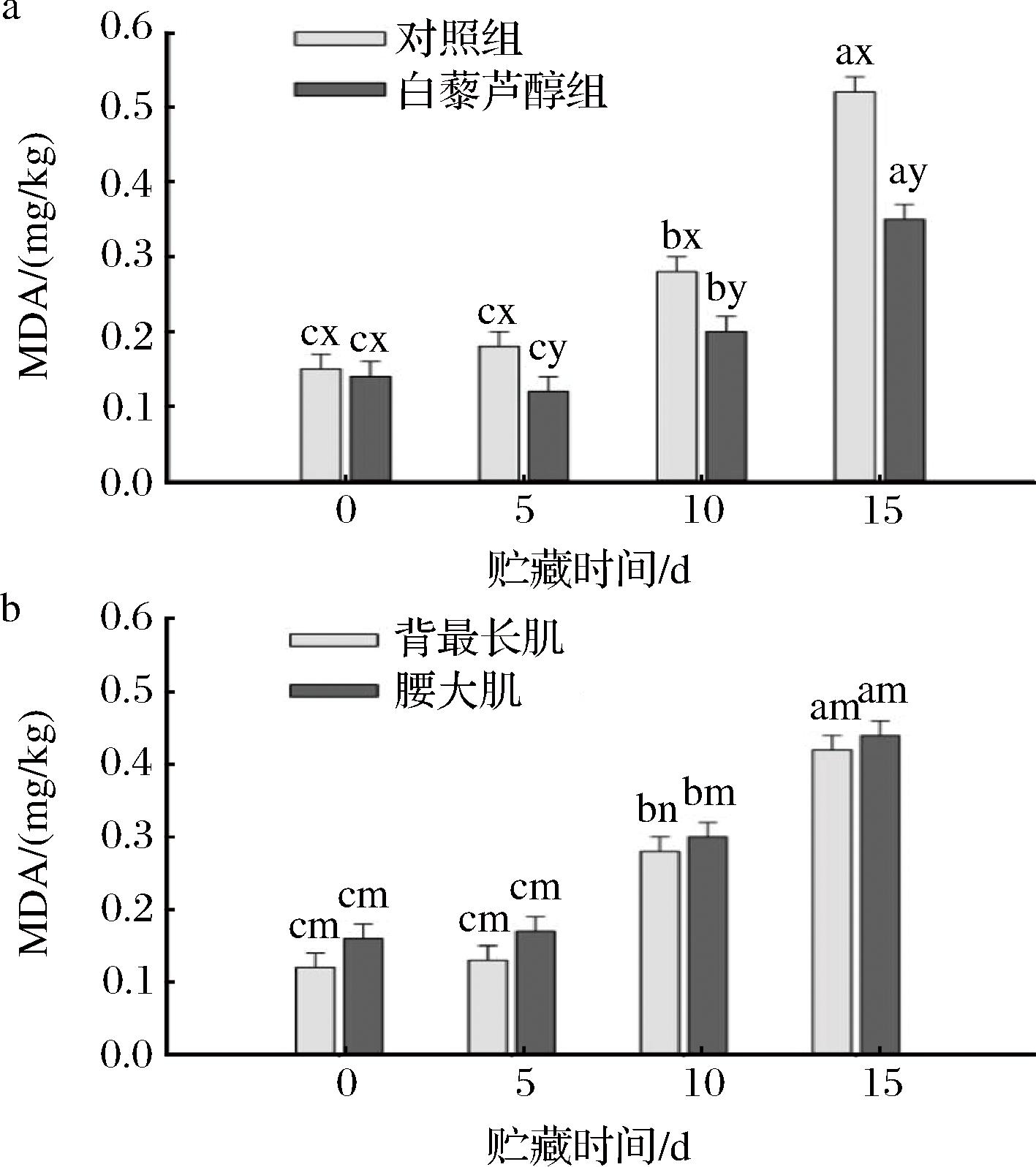
a-不同处理对牛肉贮藏期间脂质氧化的影响;b-不同部位牛肉贮藏期间的脂质氧化
图2 日粮中添加白藜芦醇处理对不同部位牛肉贮藏期间脂质氧化的影响
Fig.2 Effects of dietary resveratrol and different muscles on lipid oxidation of beef during storage
注:图a:a~c不同字母表示相同处理、不同贮藏时间具有显著性差异(P<0.05);x~y不同字母表示相同贮藏时间、不同处理具有显著性差异(P<0.05)。图b:a~c不同字母表示相同部位、不同贮藏时间具有显著性差异(P<0.05);m~n不同字母表示相同贮藏时间、不同部位具有显著性差异(P<0.05)。
因此,本研究中日粮添加白藜芦醇显著降低了高氧气调包装牛肉在贮藏期间的脂质氧化程度。前人在肉猪和肉鸡中的研究也发现通过日粮添加白藜芦醇可以提高肌肉抗氧化能力,减缓脂质氧化从而改善肉质[26-27],这与本研究结果一致。这是因为白藜芦醇增加了抗氧化酶基因和蛋白的表达(表5、表6),提高了抗氧化酶活性(表4),从而增强了肌肉抗氧化能力,进而抑制了牛肉贮藏期间的脂质氧化。
2.6 日粮中添加白藜芦醇对高氧气调包装牛肉贮藏期间蛋白质氧化的影响
蛋白质氧化会产生不同的氨基酸修饰,导致蛋白羰基的形成和活性巯基的减少[28]。由图3可知,日粮中添加白藜芦醇、肌肉部位和贮藏时间三因素交互作用对牛肉羰基含量具有显著性影响(P<0.05)。在整个贮藏过程中,日粮中添加白藜芦醇显著降低贮藏期间2个部位肌肉的羰基含量(P<0.05)。贮藏10 d后,对照组中腰大肌羰基含量显著高于背最长肌(P<0.05)。而白藜芦醇组中,只有在贮藏第10天时,两部位出现差异,腰大肌羰基含量显著高于背最长肌(P<0.05),这与脂质氧化的结果一致。这表明日粮中添加白藜芦醇可以减缓高氧气调包装牛肉的蛋白质氧化,且对背最长肌的作用效果更好。这可能得益于白藜芦醇对牛肉抗氧化能力的提高和对脂质氧化程度的抑制。此外,与背最长肌相比,腰大肌蛋白质氧化程度更高。这是由于腰大肌的脂质、肌红蛋白含量较高,更易被氧化[29]。ESTÉVEZ等[3]也研究发现,新鲜猪肉腰大肌中蛋白质氧化产物的浓度高于背最长肌。
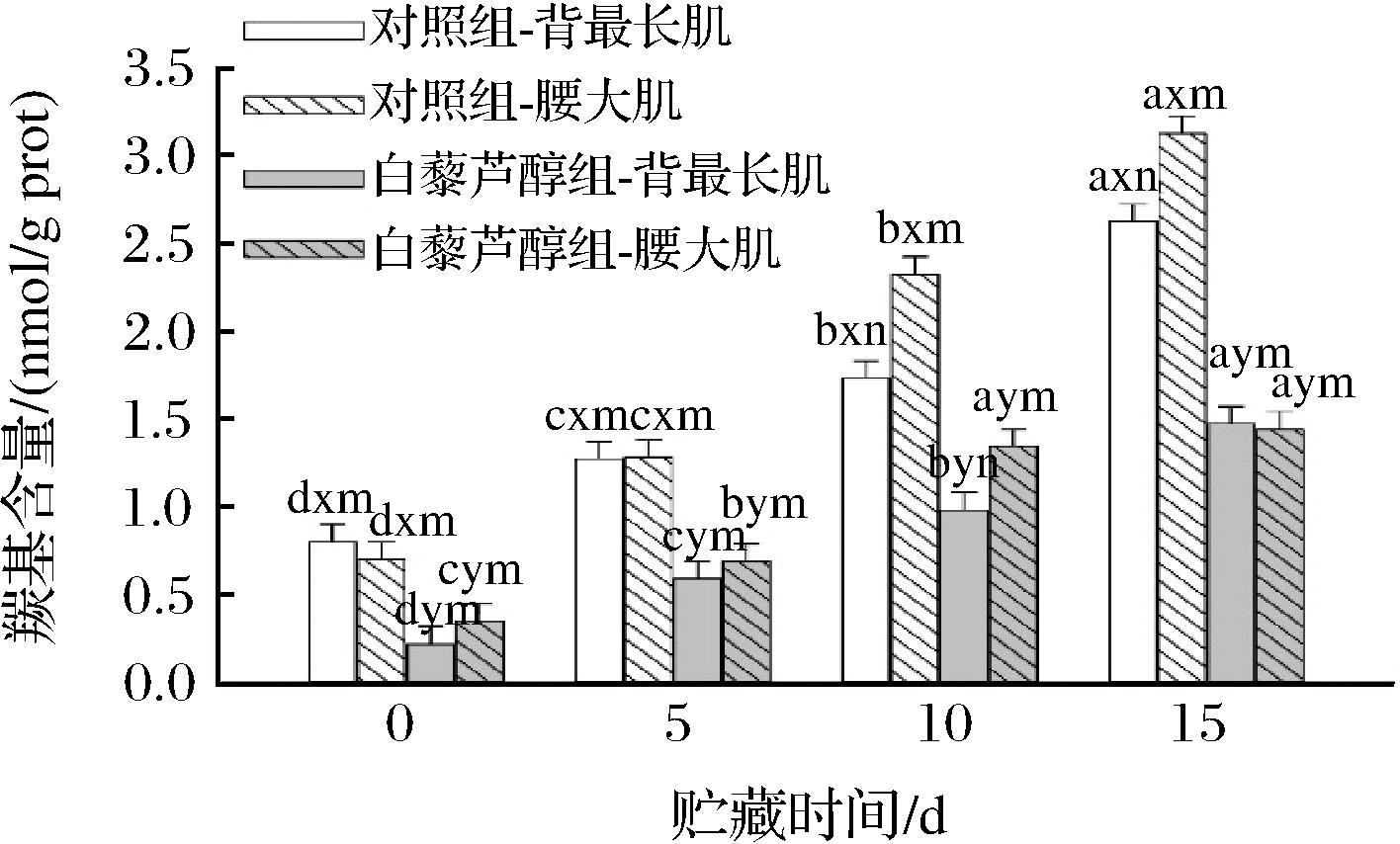
图3 日粮中添加白藜芦醇对不同部位牛肉贮藏期间羰基含量的影响
Fig.3 Effects of dietary resveratrol on carbonyl content in different muscles of beef during storage
注:a~d不同字母表示相同处理和部位、不同贮藏时间具有显著性差异(P<0.05);x~y不同字母表示相同部位和贮藏时间、不同处理具有显著性差异(P<0.05);m-n不同字母表示相同处理和时间、不同部位具有显著性差异(P<0.05)。
如图4所示,日粮中添加白藜芦醇、肌肉部位及贮藏时间的三因素交互作用对牛肉活性巯基含量具有显著性影响(P<0.05)。其中,各处理组牛肉活性巯基含量均随着贮藏时间的延长而降低,这表明蛋白质在贮藏过程中发生了氧化,这促进了牛肉中的活性巯基形成二硫键,导致活性巯基含量降低[28]。白藜芦醇处理组的2个部位牛肉在贮藏期间的活性巯基含量均显著高于对照组(P<0.05),这与羰基含量变化规律类似。对照组中腰大肌贮藏期间活性巯基含量显著低于背最长肌,白藜芦醇组中腰大肌在贮藏10 d内活性巯基含量显著低于背最长肌(P<0.05)。本研究活性巯基含量结果表明日粮中添加白藜芦醇可以减缓牛肉贮藏过程中蛋白质的氧化。这与JIN等[24]研究结果一致,该研究发现日粮中添加白藜芦醇能提高鸭肉抗氧化能力,抑制鸭肉蛋白质氧化。
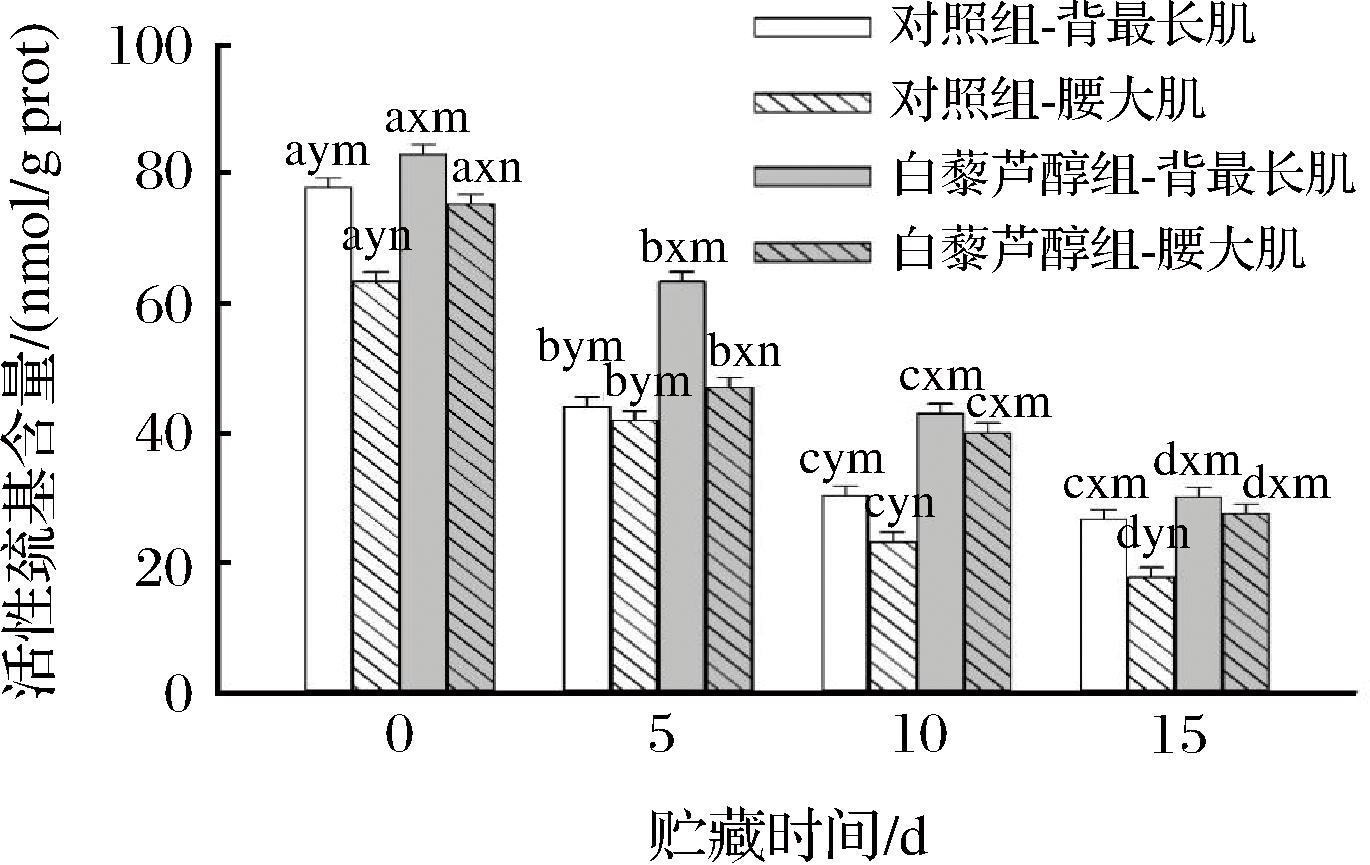
图4 日粮中添加白藜芦醇对不同部位牛肉贮藏期间活性巯基含量的影响
Fig.4 Effects of dietary resveratrol on active sulfhydryl content in different muscles of beef during storage
注:a~d不同字母表示相同处理和部位、不同贮藏时间具有显著性差异(P<0.05);x~y不同字母表示相同部位和贮藏时间、不同处理具有显著性差异(P<0.05);m~n不同字母表示相同处理和时间、不同部位具有显著性差异(P<0.05)。
3 结论
日粮中添加白藜芦醇[5 g/(头·d)]增加了牛肉中Nrf2及其下游靶基因的表达,降低了Keap1表达;增强了牛血清和肌肉中的GSH-Px、SOD、CAT的活性,提高了肌肉总抗氧化能力,进而降低了宰后牛肉HiOx-MAP贮藏期间脂质氧化和蛋白质氧化程度。因此,日粮中添加白藜芦醇可以有效增强牛肉的抗氧化性能,降低贮藏期间的氧化程度。该研究结果可以作为一种有效的牛肉抗氧化措施,为肉牛产业的发展提供技术和理论支持。
[1] DOM NGUEZ R, PATEIRO M, GAGAOUA M, et al.A comprehensive review on lipid oxidation in meat and meat products[J].Antioxidants, 2019, 8(10):429.
NGUEZ R, PATEIRO M, GAGAOUA M, et al.A comprehensive review on lipid oxidation in meat and meat products[J].Antioxidants, 2019, 8(10):429.
[2] LUND M N, HEINONEN M, BARON C P, et al.Protein oxidation in muscle foods:A review[J].Molecular Nutrition &Food Research.2011, 55(1):83-95.
[3] ESTÉVEZ M, VENTANAS S, HEINONEN M, et al.Protein carbonylation and water-holding capacity of pork subjected to frozen storage:Effect of muscle type, premincing, and packaging[J].Journal of Agricultural and Food Chemistry, 2011, 59(10):5435-5443.
[4] XU X Q, LIU A M, HU S Y, et al.Synthetic phenolic antioxidants:Metabolism, hazards and mechanism of action[J].Food Chemistry, 2021, 353:129488.
[5] SHARMA S, BARKAUSKAITE S, JAISWAL A K, et al.Essential oils as additives in active food packaging[J].Food Chemistry, 2021, 343:128403.
[6] ![]() A S, UNAL K, DILEK N M, et al.Antioxidant and antimicrobial effects of blackberry, black chokeberry, blueberry, and red currant pomace extracts on beef patties subject to refrigerated storage[J].Meat Science, 2022, 187:108765.
A S, UNAL K, DILEK N M, et al.Antioxidant and antimicrobial effects of blackberry, black chokeberry, blueberry, and red currant pomace extracts on beef patties subject to refrigerated storage[J].Meat Science, 2022, 187:108765.
[7] 马越, 王瑛, 李泽民, 等.饲粮中添加牛至精油对宰后不同成熟时间牛肉品质及抗氧化能力的影响[J].动物营养学报, 2023, 35(3):1729-1739.MA Y, WANG Y, LI Z M, et al.Effects of dietary supplementation of oregano essential oil on meat quality and antioxidant capacity of beef at different postmortem aging time[J].Chinese Journal of Animal Nutrition, 2023, 35(3):1729-1739.
[8] XIE Z F, CHEN X.Healthy benefits and edible delivery systems of resveratrol:A review[J].Food Reviews International, 2023, 39(7):3879-3905.
[9] CHEN J S, CAO X C, CUI Y H, et al.Resveratrol alleviates lysophosphatidylcholine-induced damage and inflammation in vascular endothelial cells[J].Molecular Medicine Reports, 2018, 17(3):4011-4018.
[10] ALMATROODI S A, A ALSAHLI M, S M ALJOHANI A, et al.Potential therapeutic targets of resveratrol, a plant polyphenol, and its role in the therapy of various types of cancer[J].Molecules, 2022, 27(9):2665.
[11] ZHANG C, YANG L, ZHAO X H, et al.Effect of dietary resveratrol supplementation on meat quality, muscle antioxidative capacity and mitochondrial biogenesis of broilers[J].Journal of the Science of Food and Agriculture, 2018, 98(3):1216-1221.
[12] MENG Q W, SUN S S, BAI Y S, et al.Effects of dietary resveratrol supplementation in sows on antioxidative status, myofiber characteristic and meat quality of offspring[J].Meat Science, 2020, 167:108176.
[13] MA Q.Role of nrf2 in oxidative stress and toxicity[J].Annual Review of Pharmacology and Toxicology, 2013, 53:401-426.
[14] FARKHONDEH T, FOLGADO S L, POURBAGHER-SHAHRI A M, et al.The therapeutic effect of resveratrol:Focusing on the Nrf2 signaling pathway[J].Biomedicine &Pharmacotherapy, 2020, 127:110234.
[15] ZHAO Y Y, LI Z, WANG X C, et al.Resveratrol attenuates heat stress-induced impairment of meat quality in broilers by regulating the Nrf2 signaling pathway[J].Animals, 2022, 12(15):1889.
[16] LI J Q, LIANG R R, MAO Y W, et al.Effect of dietary resveratrol supplementation on muscle fiber types and meat quality in beef cattle[J].Meat Science, 2022, 194:108986.
[17] ZHAO Y, KONG X, YANG X Y, et al.Effect of energy metabolism and proteolysis on the toughness of intermediate ultimate pH beef[J].Meat Science, 2022, 188:108798.
[18] SIU G M, DRAPER H H.A survey of the malonaldehyde content of retail meats and fish[J].Journal of Food Science, 1978, 43(4):1147-1149.
[19] YANG X Y, ZHANG Y, LUO X, et al.Influence of oxygen concentration on the fresh and internal cooked color of modified atmosphere packaged dark-cutting beef stored under chilled and superchilled conditions[J].Meat Science, 2022, 188:108773.
[20] LEVINE R L, GARLAND D, OLIVER C N, et al.Determination of carbonyl content in oxidatively modified proteins[J].Methods in Enzymology, 1990, 186:464-478.
[21] FU Q Q, LIU R, ZHANG W G, et al.Effects of different packaging systems on beef tenderness through protein modifications[J].Food and Bioprocess Technology, 2015, 8(3):580-588.
[22] FINKEL T, HOLBROOK N J.Oxidants, oxidative stress and the biology of ageing[J].Nature, 2000, 408(6809):239-247.
[23] MENG Q W, GUO T, LI G Q, et al.Dietary resveratrol improves antioxidant status of sows and piglets and regulates antioxidant gene expression in placenta by Keap1-Nrf2 pathway and Sirt1[J].Journal of Animal Science and Biotechnology, 2018, 9:34.
[24] JIN S J, PANG Q, YANG H, et al.Effects of dietary resveratrol supplementation on the chemical composition, oxidative stability and meat quality of ducks (Anas platyrhynchos)[J].Food Chemistry, 2021, 363:130263.
[25] ZHANG C, CHEN K K, ZHAO X H, et al.Protective effects of resveratrol against high ambient temperature-induced spleen dysplasia in broilers through modulating splenic redox status and apoptosis[J].Journal of the Science of Food and Agriculture, 2018, 98(14):5409-5417.
[26] ZHANG C, LUO J Q, YU B, et al.Dietary resveratrol supplementation improves meat quality of finishing pigs through changing muscle fiber characteristics and antioxidative status[J].Meat Science, 2015, 102:15-21.
[27] ZHANG C, ZHAO X H, WANG L, et al.Resveratrol beneficially affects meat quality of heat-stressed broilers which is associated with changes in muscle antioxidant status[J].Animal Science Journal, 2017, 88(10):1569-1574.
[28] XIONG Y L, DECKER E, FAUSTMAN C, et al.Protein oxidation and implications for muscle food quality[J].Antioxidants in Muscle Foods:Nutritional Strategies to Improve Quality, 2000:85-111.
[29] HASAN M M, SOOD V, ERKINBAEV C, et al.Principal component analysis of lipid and protein oxidation products and their impact on color stability in bison longissimus lumborum and psoas major muscles[J].Meat Science, 2021, 178:108523.