作为最常见的天然生物大分子,蛋白质和多糖在一定条件下会发生分子间或分子内的相互作用。蛋白质-多糖复合物的形成可由蛋白质和多糖上带电基团的相互作用(静电相互作用、氢键、疏水相互作用等)引起,并受到诸多因素的影响,如pH、温度、离子强度、混合比等。当携带相反电荷的蛋白质和多糖混合时,就会发生相互作用,生成可溶性或者不溶性复合物[1-2]。许多研究者已经尝试在分子水平上理解蛋白质/多糖络合机制,并利用了多种技术用于跟踪蛋白质/多糖络合在不同pH下的结构和形态转变,包括浊度法、静态/动态光散射法、荧光猝法、ζ-电位法等。例如LI等[3]采用动态光散射、浊度法、凝胶渗透色谱-多角度激光散射法联用探究了牛血清蛋白和甜菜果胶的络合,并将蛋白-多糖络合过程分为5个相区。同样的,ZHONG等[4]也采用了动态光散射、浊度法等多种方法研究了pH诱导的乳清分离蛋白和透明质酸在宏观和微观水平上的相互作用并建立了相图。此外,与单独的蛋白质相比,蛋白质-多糖复合物的功能特性更加优越,如改善食品胶体(乳液、凝胶、泡沫等)的结构特性和物理稳定性[5-6]。
尽管蛋白-多糖复合物的研究已经较多,但大部分工作都集中在研究多糖与动物蛋白的相互作用,如牛血清白蛋白-阿拉伯胶[7]、乳清分离蛋白-海藻酸钠[6]、β-乳球蛋白-合金欢胶[8]和乳清分离蛋白-卡拉胶[9]。豌豆分离蛋白作为一种典型的植物蛋白,氨基酸结构均衡、具有营养价值高等优点,但因溶解度低、乳化性差、豆腥味以及热稳定性不理想等缺点而限制了其广泛应用。因此,将植物蛋白与其他聚合物结合可以提高植物蛋白在食品系统中的表现,如和多糖形成功能性复合物,被认为是改善植物蛋白功能的最佳方法之一。例如,橡树分离蛋白和阿拉伯胶之间的复合提高了橡树分离蛋白的溶解度、持水性、起泡性、乳化稳定性和热稳定性[10]。为了降低豌豆分离蛋白的热聚集程度及提高其功能特性,本研究选择了食品中广泛应用的豌豆分离蛋白,以及结构和性能相对明确的卡拉胶(carrageenan, CG)作为研究对象,探究了蛋白多糖之间的复合相行为和多糖对蛋白质结构的的影响,为研究热改性豌豆分离蛋白(heat-treated pea protein isolated,HPPI)与多糖的相互作用奠定基础。
1 材料与方法
1.1 材料与试剂
豌豆蛋白粉(蛋白含量>80%),加拿大埃德蒙顿当地超市;κ-,ι-,λ-型卡拉胶(纯度>95%),加拿大Fisher Scientific试剂公司;氢氧化钠、盐酸、磷酸二氢钠、磷酸氢二钠等试剂,国药集团化学试剂有限公司。以上所有使用的化学试剂均为分析纯。
1.2 仪器与设备
RO 10磁力搅拌器,德国IKA公司;LBS-RUP60纯水机,成都浩康科技有限公司;EL-204分析天平、DELTA320型pH计,上海梅特勒-托利多仪器有限公司;LGJ-12型冷冻干燥机,郑州宏朗仪器设备有限公司;HITACHI CR21 N高速冷冻离心机,日本日立公司;Zetasizer Nano-ZS 90纳米粒度及电位分析仪,英国 Malvern公司;JEN-6300紫外光分光光度计,日本岛津公司;Thermo iS10傅立叶红外光谱仪,美国Thermo公司;HH-2数显恒温水浴锅,国华电器(江苏)有限公司;GZX-9140MBE恒温鼓风干燥箱,博迅实业有限公司(上海)医疗设备厂;Dimention icon原子力显微镜,德国布鲁克公司;OCA 15EC接触角测量仪,德国Dataphysics公司。
1.3 实验方法
1.3.1 热改性豌豆分离蛋白、卡拉胶和热改性豌豆分离蛋白-卡拉胶复合溶液的制备
将豌豆分离蛋白粉末溶解在去离子水中,在500 r/min下温和搅拌2 h,制成20 mg/mL的悬浮液,然后在95 ℃下加热20 min。最后将蛋白悬浮液在3 000×g、4 ℃离心10 min,收集上清液。将上清液在-20 ℃下冷冻12 h后冷冻干燥,得到HPPI。配制10 mg/mL的κ -卡拉胶(κCG)、ι-卡拉胶(ιCG)和λ -卡拉胶(λCG)储备液并以500 r/min搅拌2 h。将3种卡拉胶储备液在95 ℃下加热10 min,然后冷却至室温待用。
将HPPI储备液分别和κCG、ιCG、λCG储备液以质量比R(R=HPPI∶CG)分别为0.5∶1、1∶1、3∶1、6∶1,总生物聚合物浓度(CT)固定为5 mg/mL得到HPPI-CG混合物。以0.1 mol/L和0.01 mol/L的HCl溶液调节pH值为7.0、6.0和5.4得到蛋白多糖复合物。酸滴定后,将不同R和pH的HPPI-CG复合物冻干备用。
1.3.2 热改性豌豆分离蛋白-卡拉胶复合的相行为
1.3.2.1 ζ-电位的测定
用0.01 mol/L NaOH溶液将HPPI-CG混合液初始pH值调至7.0,接着利用0.1 mol/L NaOH溶液和0.5或0.1 mol/L HCl溶液进行调节,其中pH值设置为7.0~2.0,间隔为0.5。用纳米激光粒度及电位分析仪测定HPPI-CG复合体系的Zeta电位,平衡时间2 min,所有测量均在(25.0±0.1) ℃下进行,每个样品平行测定3次,取平均值。
1.3.2.2 浊度滴定和相图建立
基于ELMER等[1]的方法,稍作修改,使用紫外光分光光度计在波长为600 nm处测量了HPPI和HPPI-CG混合物在酸滴定过程中光密度(OD600)的变化。光密度被定义为总入射光除以透射光强的自然对数。对于胶体溶液,光密度值等于溶液的浊度[2]。用HCl溶液(0.01、0.02、0.05、0.10.1 mol/L,尽量避免因为HCl溶液的加入而导致溶液的稀释)调节HPPI和HPPI-CG混合物的pH值从中性到酸性,当pH值在0.01~0.05变化时,测量OD600并记录相应的pH值,用去离子水作为空白对照,为保证溶液混合均匀,实验过程在磁力搅拌器上进行。根据OD600-pH曲线图,通过计算2条曲线切线的交点,得到了形成可溶性复合物(pHc)、不溶性复合物(pHΦ1)、形成最大复合物(pHopt)和复合物溶解(pHΦ2)的临界pH值。以酸滴定过程中的临界pH值为纵坐标,不同的HPPI-CG比例为横坐标建立相图,并参考文献[1,3]将相图分成不同的相区。
1.3.3 热改性豌豆分离蛋白-卡拉胶复合物的表征
1.3.3.1 傅立叶红外光谱的测定
采用衰减全反射-傅立叶红外光谱对HPPI和HPPI-ιCG复合物冻干样品进行了测定,研究蛋白质的二级结构变化。分别将每种样品少量放置在光谱仪台上,在4 000~400 cm-1扫描采集光谱数据,分辨率为2 cm-1。然后使用OMNIC软件对数据进行分析,最后再利用Peakfit软件对其曲线的二阶导数曲线分析样品的二级结构。
1.3.3.2 水接触角的测定
使用接触角测量仪测量了HPPI和HPPI-ιCG复合物的水接触角。将冻干后的样品压制成约2 mm厚的薄片,然后在薄片表面缓慢垂直滴落3 μL的去离子水,设备上配备了高分辨率的数字摄像头,能够捕捉到水滴与薄片从首次接触到特定时间的形态变化。通过对捕获图像的分析并结合Laplace-Young拟合方程,可以获得液滴的接触角及亲疏水性。
1.3.3.3 微观结构的测定
使用原子力显微镜观察了HPPI、ιCG和HPPI-ιCG复合物的形貌,根据1.3.1节中制备样品,并用磷酸缓冲液稀释至质量分数为0.1 mg/mL,然后取10 μL稀释后的溶液滴在云母片上,在25 ℃空气干燥过夜。实验中采用驱动频率为70 kHz,弹性系数为0.4 N/m,型号为布鲁克ScanAsyst-Air的探针,最后使用软件Fiber APP 3.0进行分析。
1.4 数据统计与分析
每个样品独立实验并重复3次,实验结果取3次实验平均值并报告具有标准差的结果。使用Excel 2021绘制数据统计及图表。
2 结果与分析
2.1 ζ-电位分析
一般认为,pH值会影响HPPI所带有的氨基和羧基和卡拉胶所携带的硫酸盐基团的解离程度。此外,生物聚合物混合比也会影响蛋白质和多糖的整体电荷平衡,从而影响相互作用的水平。ζ-电位是评价静电相互作用在悬浮液中的一个有效指标,可以提供关于凝聚稳定性的重要信息[11]。图1-a、图1-c、图1-e是HPPI与不同类型卡拉胶在不同混合比下的的电位随pH的变化。随着pH的降低,HPPI的ζ-电位逐渐降低,并在pH 4.8左右达到蛋白等电点。相比之下,单个卡拉胶分子,无论哪种类型,在整个pH范围内都保持高负电荷(-40~-80 mV),这是由于卡拉胶分子的硫酸盐基团电离所致,与STONE等[12]报道的一致。此外,可以发现HPPI-CG混合物的ζ-电位介于纯HPPI和卡拉胶之间,表明蛋白质和多糖的表面电荷被中和。
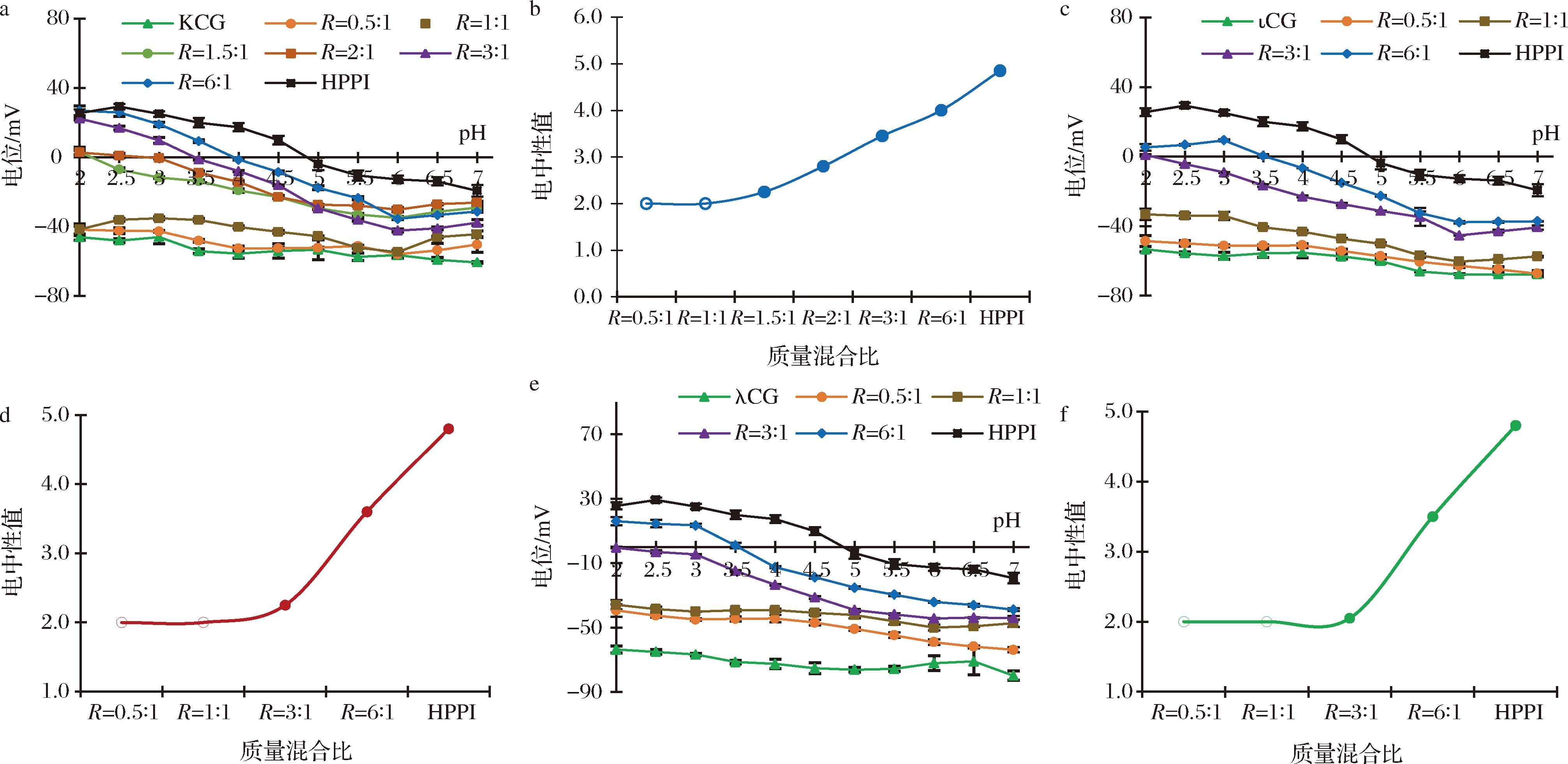
a、b-HPPI与κCG在不同质量混合比时的ζ-电位随pH的变化与混合体系电中性值;c、d-HPPI与ιCG在不同质量混合比时的ζ-电位随pH的变化与混合体系电中性值;e、f-HPPI与λCG在不同质量混合比时的ζ-电位随pH的变化与混合体系电中性值
图1 HPPI与不同类型卡拉胶在不同混合比(R)时的ζ-电位随pH的变化和混合体系电中性值随混合比的变化
Fig.1 ζ-potential at different pHs and the isoelectric point (IEP) for HPPI-CG mixtures with different protein-polysaccharide mass ratio R
注:生物聚合物总浓度控制在5 mg/mL。
图1-b、图1-d、图1-f是各个蛋白多糖混合体系的等电点随混合比的变化。对于HPPI/κCG混合体系,当R>1.5∶1时,发现每个混合比均有等电点,而R<1.5∶1时,均没有等电点。同样的,在HPPI/ιCG和HPPI/λCG体系中,R>3∶1时,发现每个混合比均有等电点,而R<3∶1时,均没有等电点。对这一现象的合理解释可能是,随着蛋白质的比例增加,由于卡拉胶中的硫酸盐基团被更多蛋白质中的阳离子基团中和,配合物的ζ-电位的电负性逐渐减弱[13]。当R<1.5∶1和R<3∶1时,整个系统的电位为负,表明系统中蛋白质的结合位点被完全消耗[4]。也就是说,当R≥1.5∶1和R≥3∶1时,卡拉胶分子可能的结合位点被过量的HPPI占据,系统以蛋白质为主导;当R<1.5∶1和R<3∶1时,卡拉胶分子过量,游离硫酸盐基团(未被占据的结合位点)通过质子化机制主导等电点,系统以多糖为主导。因此,可以认为R=1.5∶1是HPPI/κCG体系的临界质量混合比,R=3∶1均是HPPI/ιCG和HPPI/λCG体系的临界质量混合比。VINAYAHAN等[7]对牛血清白蛋白/阿拉伯胶体系也进行了类似的观察和解释。
2.2 浊度及相图分析
图2是HPPI和不同类型卡拉胶(κCG,ιCG,λCG)在不同质量混合比下的浊度(图2-a、图2-c、图2-e)随pH的变化以及与之相对应的相图(图2-b、图2-d、图2-f)。由于卡拉胶中硫酸盐基团的存在以及不同pH水平下分子间的强大静电斥力,导致不存在聚集体,浑浊度未见变化,因此数据未显示。KLASSEN等[14]认为,造成这种情况的原因可能是由于卡拉胶分子上的硫酸盐基团的pKa值较低(pKa<2.0),导致多糖没有质子化。

a、b-HPPI与κCG在不同质量混合比时的浊度随pH的变化和相图;c、d-HPPI与ιCG在不同质量混合比时的浊度随pH的变化和相图;e、f-HPPI与λCG在不同质量混合比时的浊度随pH的变化和相图;g-HPPI和卡拉胶相互作用生成不同类型复合物模型示意图
图2 HPPI与不同类型卡拉胶在不同质量混合比R下的浊度随pH的变化曲线和由临界pH值得到的HPPI-CG混合物的相图以及模型示意图
Fig.2 Turbidity curves as function of pH for HPPI-CG mixtures with different protein-polysaccharide mass ratio R, the phase diagram of HPPI-CG mixtures given by the critical pH values, and the schematic model for interactions of HPPI and CG at different pH values
注:pHc、pHΦ1、pHopt和pHΦ2 在图2-b、d、f和图2-g中分别表示开始形成可溶性复合物、形成不溶性复合物、浊度最大值和不溶性复合物开始解离的临界pH值,其中虚线表示HPPI的等电点(IEP)。不同的字母Ⅰ、Ⅱ、Ⅲ、Ⅳ在图2-b、d、f和图2-g中分别代表大分子共溶区、可溶性复合物区、不溶性复合物区和大分子共溶区,其中相区Ⅳ在本研究中未观察到。总生物聚合物浓度控制在5 mg/mL。
如图2-a、图2-c、图2-e所示,HPPI和HPPI-CG盐酸滴定曲线呈现整体波动,可以看出,在pH值逐渐降低的过程中,HPPI和HPPI-CG的浊度滴定曲线表现出很大的不同,单独的HPPI浊度曲线呈钟形曲线,即光密度从pH 6.0左右开始迅速增加,直到pH 5.29时达到平台值2.616,说明HPPI的溶解度从pH 6.0左右开始下降,在pH 5.29时溶解度达到最低点。HPPI溶液光密度的增加是因为当pH值接近IEP时,由于静电斥力降低,蛋白质聚集。但该值远高于HPPI的实际IEP值(pHIEP=4.8)。这种IEP偏差被认为与蛋白质表面电荷的不均匀性有关[3,15-16]。光密度的平稳期一直持续到pH 3.16,随后随着pH值的进一步降低而下降,这是由于低pH时静电斥力加剧导致蛋白质聚集体发生解离,这种现象也在其他研究中也出现过[5]。与单独的HPPI相比,添加不同类型卡拉胶体系的浊度曲线相似但不完全相同。相似之处在于,光密度上升到一个平台值之后保持上下波动,并且无论添加哪种类型的卡拉胶都不同程度的抑制了HPPI的聚集,这可以从混合体系的酸滴定过程中初始光密度值上升向更酸性pH的转变和光密度值大幅降低中看出。例如,通过观察图2-a、图2-c、图2-e可以发现,HPPI-CG复合体系所有混合比下的最大光密度值的平台值均小于单独的HPPI。这说明高电荷多糖与蛋白质之间强烈的静电斥力延迟了蛋白质的聚集。此外,随着混合比的减小,HPPI-CG混合物的光密度逐渐降低,多糖通过产生位阻斥力来阻止蛋白质聚集体的形成,而且它们与蛋白质相比具有弱的光散射[4]。此外,也可以发现随着pH值的持续下降,HPPI-CG体系的光密度保持相对波动范围,与纯HPPI溶液存在明显不同。这种相似的现象在乳清分离蛋白[17]和菜籽油分离蛋白[12]与不同类型卡拉胶复合的体系中被研究过。由于3种类型卡拉胶带有的硫酸盐基团数量的不同,使其与HPPI络合过程也表现出不同的现象。对比HPPI和3种类型的卡拉胶的浊度滴定曲线可以发现,HPPI-ιCG体系的初始光密度值低于单独的HPPI,初始pHc更靠近pH减小的方向,例如,当蛋白多糖混合比为6∶1时,HPPI-κCG体系、HPPI-ιCG体系、HPPI-λCG体系的pHc分别是6.3、6.0、6.7,这表明抵抗HPPI聚集的程度为ιCG>κCG>λCG,具体解释如下。κCG和ιCG都具有双螺旋结构,且分别具有1个和2个硫酸盐基团,在环境温度下二者均是有序构象,它们在溶液中形成的双螺旋结构会相互靠近并相互作用,形成一种稳定的凝胶网络。而ιCG由于含有更多的硫酸盐基团因而带有更多的负电荷,使得这种双螺旋结构之间的横向关联程度更大,而具有最为紧密和稳定的分子结构[18]。反之,虽然λCG具有3个硫酸盐基团,但不具有双螺旋结构,这就意味着其强的电负性和灵活的分子结构具有更多的活性位点和功能基团,因此能更快地和HPPI发生相互作用。有研究表明,分子质量大的聚合物会导致更大聚集体的形成[6],这对抵抗蛋白质的聚集是不利的。
根据光密度曲线的切线,得出不同质量混合比下的HPPI-CG混合物在酸化过程中的临界pH值并建立了相图,其中pHc、pHΦ1、pHopt和pHΦ2分别代表可溶性复合物形成的起点、不溶性复合物形成的起点、浊度初次达到最大值、不溶性复合物开始解离的临界pH值。如图2-b、图2-d、图2-f所示。正如上面提到的,由于卡拉胶分子强的电负性而引起的强静电斥力,在所有混合体系中均没有出现临界pHΦ2。在扁豆分离蛋白和不同类型卡拉胶体系中[16]也没有出现pHΦ2。将相图分为4个相区:(Ⅰ)大分子共溶区(pH>pHc),(Ⅱ)可溶性复合物区(pHΦ1
LI等[3]采用的是光散射和浊度以及多重光散射仪等多种方法联用构建了牛血清蛋白和甜菜果胶之间络合的相图,发现相变过程会形成了分子内可溶性复合物,因为瑞利散射对复合物的尺寸很敏感,较小的分子内可溶性复合物会对光发生瑞利散射,散射光强较强[7]。而本研究中的浊度是由于任意直径颗粒的光散射造成透射光的损失,对较大的颗粒更为敏感[8]。因此,单纯依靠浊度滴定法进行蛋白质-多糖络合,存在一个非常窄的pH窗口,形成分子内可溶性复合物,这是浊度滴定法无法识别的。因此,本研究中讨论的可溶性复合物可能包括分子内和分子间可溶性复合物。此外,通过观察可以发现,pHc均大于蛋白IEP,这就意味着蛋白质和多糖的相互作用可以发生在蛋白质IEP以上,这可以归因于蛋白质表面带电基团的分布不均匀[3,15-16]以及卡拉胶分子强烈的带电性[17]。也就是说,由于蛋白质表面存在带正电荷的斑块,pHc是HPPI与卡拉胶分子局部静电相互作用的结果,尽管高于蛋白质的IEP,但此时已形成可溶性复合物。
因此,基于上述分析,选择具有带电量适中且能够抵抗HPPI聚集的ιCG,同时选择了临界混合比3∶1以及相图中各选择一个具有代表性的pH值分别为7.0、6.0、5.4进行后续表征,以单独的HPPI和ιCG为对照。
2.3 傅立叶红外光谱分析
傅立叶红外光谱是测定蛋白质二级结构的常用技术之一,通过测定蛋白质在红外光谱区域的吸收峰位置和强度,可以提供关于蛋白质的二级结构信息[9]。如图3所示,显示了ιCG,HPPI,HPPI-ιCG在混合比为3,pH值为6.0时的红外吸收光谱图,其主要特征峰如表1所示。ιCG的光谱在1 024.24、1 065.7 cm-1处表现出与硫酸盐基团收缩振动相关的特征吸收峰,这与阴离子硫酸盐基团有关[19]。显然,与单独的HPPI相比,HPPI-ιCG复合物体系中也有ιCG分子明显的特征峰,并且与ιCG的典型特征峰相比发生了偏移(从1 024.24 cm-1移至1 028.08 cm-1;从1 065.7 cm-1到1 068.28 cm-1),证明了ιCG与HPPI的成功结合。根据测量光谱曲线的二阶导数来解析二级结构的变化,结果如表2所示。所有样品酰胺I带分别由β-折叠、无规则卷曲、α-螺旋、β-转角和其他成分组成[20]。其中在1 600~1 640 cm-1处的占比最大,因此可以认为,β-折叠结构为含量最多的二级结构单元[9]。对比ιCG,HPPI,HPPI-ιCG复合物可以发现,HPPI-ιCG复合物的β-折叠(为44.47%)低于HPPI,但高于ιCG,同时α-螺旋(为38.13%)均大于HPPI和ιCG,这一结果说明蛋白多糖复合物的形成导致蛋白质结构发生改变,这种改变可能包括部分β-折叠结构的转变为α-螺旋,这就意味着蛋白多糖复合可能提供了一种更稳定的环境,使蛋白质分子更容易形成α-螺旋结构[9]。此外,β-折叠与蛋白质的聚集状态相关,其含量愈高,其聚集愈强[20],本研究结果也证明了HPPI和ιCG的结合降低了HPPI的聚集程度,与2.2节中分析结果一致。
表1 HPPI、ιCG和HPPI-ιCG复合物的主要红外吸收峰
Table 1 Main infrared absorption peaks of HPPI, ιCG, and HPPI-ιCG complexes

特征峰HPPI/cm-1ιCG/cm-1HPPI-ιCG/cm-1羟基3 270.783 417.293 271.68甲基2 959.80—2 959.50酰胺I1 633.031 634.301 633.29酰胺Ⅱ1 531.63—1 537.21酰胺Ⅲ1 236.69—1 230.44硫酸酯基—1 065.701 068.28—1 024.241 028.08
注:—表示实验中未得到数据。
表2 HPPI、ιCG和HPPI-ιCG复合物的二级结构含量
Table 2 Secondary structure content of HPPI, ιCG, and HPPI-ιCG complexes

样品二级结构含量/%β-折叠(1 600~1 640 cm-1)无规卷曲(1 640~1 650 cm-1)α-螺旋(1 650~1 660 cm-1)β-转角(1 660~1 700 cm-1)其他HPPI51.938.1229.411.728.82ιCG44.474.4927.262.8820.9HPPI-ιCG49.843.8938.132.255.89
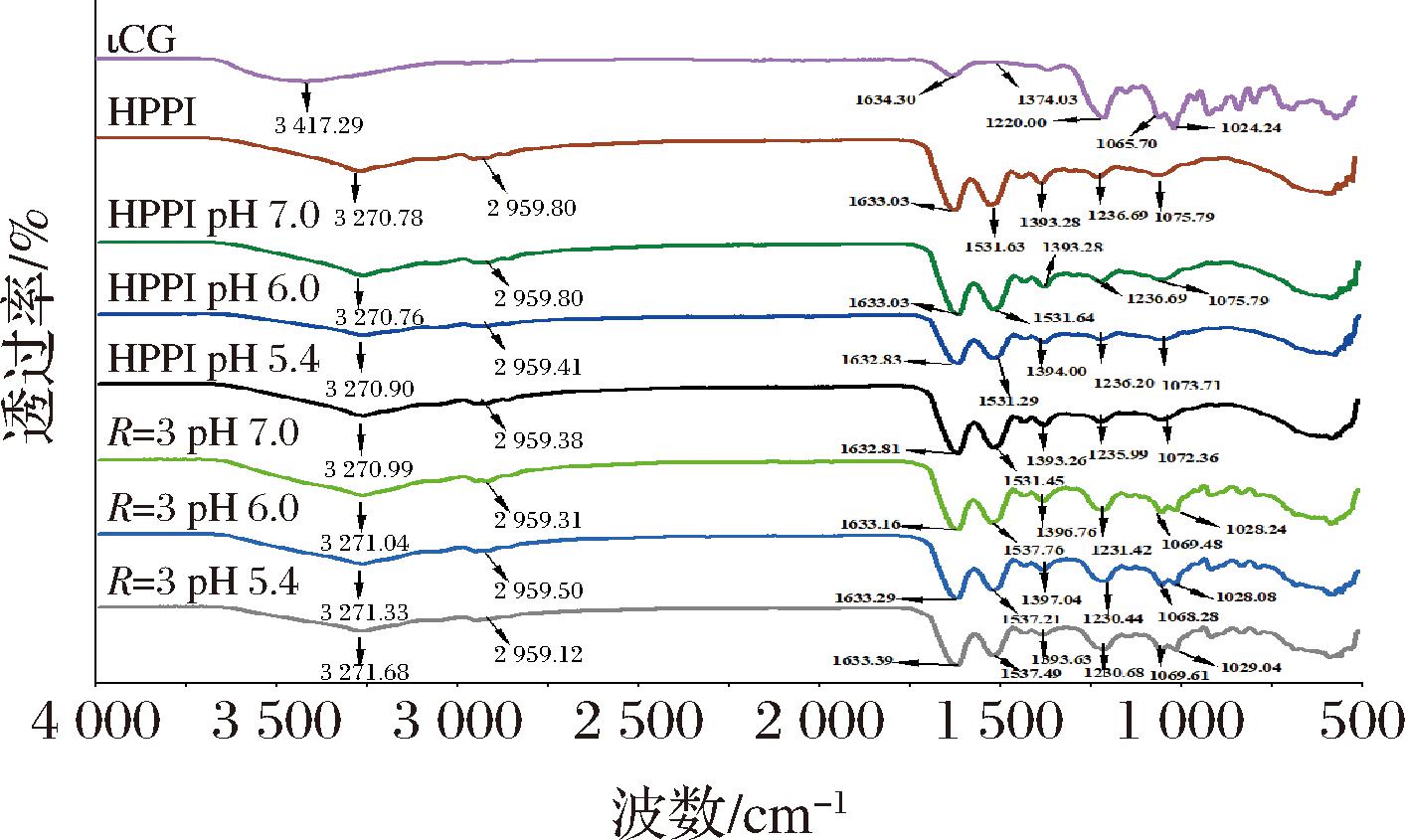
图3 HPPI、ιCG和HPPI-ιCG复合物的红外光谱
Fig.3 The infrared spectra of HPPI, ιCG, and HPPI-ιCG complexes
由图3可知,ιCG在3 417.29 cm-1,HPPI在3 270.78 cm-1有较为明显的吸收峰,这是由—OH伸缩振动引起的,表明在多糖和蛋白存在分子间或分子内的氢键[14]。此外,与HPPI相比,HPPI-ιCG复合物的酰胺I峰在1 633.03 cm-1偏移到1 633.29 cm-1但偏移不明显,而酰胺Ⅱ峰在1 531.63 cm-1偏移到1 537.21 cm-1。同时,HPPI-ιCG配合物在1 236.69 cm-1附近的峰偏移至1 230.44 cm-1。酰胺键中的C![]() O和N—H之间可以形成氢键,而蛋白质与多糖之间的结合可能会导致氢键的形成或破坏。当氢键形成时,酰胺键的振动频率会发生变化,从而引起酰胺Ⅰ和酰胺Ⅱ峰的红移。酰胺Ⅲ峰主要反映了酰胺键的振动模式,当氢键的强度增加时,会使酰胺键的特征峰红移或者蓝移[21-22]。因此可以证明ιCG的硫酸盐基团与HPPI的氨基之间存在氢键相互作用并且这些变化与静电相互作用有关[20],此外,HPPI-ιCG复合物在3 271 cm-1左右处的峰位发生了偏移,也能证明上述观点,这与前面与ζ电位分析结果一致。
O和N—H之间可以形成氢键,而蛋白质与多糖之间的结合可能会导致氢键的形成或破坏。当氢键形成时,酰胺键的振动频率会发生变化,从而引起酰胺Ⅰ和酰胺Ⅱ峰的红移。酰胺Ⅲ峰主要反映了酰胺键的振动模式,当氢键的强度增加时,会使酰胺键的特征峰红移或者蓝移[21-22]。因此可以证明ιCG的硫酸盐基团与HPPI的氨基之间存在氢键相互作用并且这些变化与静电相互作用有关[20],此外,HPPI-ιCG复合物在3 271 cm-1左右处的峰位发生了偏移,也能证明上述观点,这与前面与ζ电位分析结果一致。
2.4 疏水性分析
水接触角描述了液体在固体表面上展开的能力,具有较小θ的固体表面被称为亲水表面,因为它们能够吸引和保持水分子,使得液体能够均匀地分布在表面上。相反,θ较大的固体表面则被称为疏水表面[23]。图4是ιCG、HPPI、HPPI-ιCG复合物在不同pH下的水接触角θ。所有θ均小于90°,说明所有的样品均以亲水行为主导。其中ιCG是所有样品中θ最小的(水珠最为扁平),表明其亲水性较好,这是可以预见的,因为ιCG分子结构中包含了大量的羟基和其他极性基团,这些基团可以和水分子发生氢键相互作用,使得多糖亲水性较好[19]。单独的HPPI在pH 7.0和pH 5.4时分别具有最小和最大θ,这表明在pH值逐渐降低的过程中,蛋白的亲水性在减小,疏水性在增强,这是因为逐渐靠近蛋白等电点,蛋白表面带电量减少,减少的表面电荷密度会促使蛋白质结构发生变化,从而暴露更多的疏水基团到蛋白质表面[22]。添加ιCG的体系中,也出现了类似的趋势,但θ均小于单独的HPPI,说明ιCG的加入提高了体系的亲水性,然而,对比不同类型复合物的θ可以发现,pH 7.0时的θ更小,亲水性更好,可能的原因是在pH 6.0和pH 5.4时形成了可溶性和不溶性复合物,疏水残基的暴露增加了疏水性而降低了亲水性[9,24]。
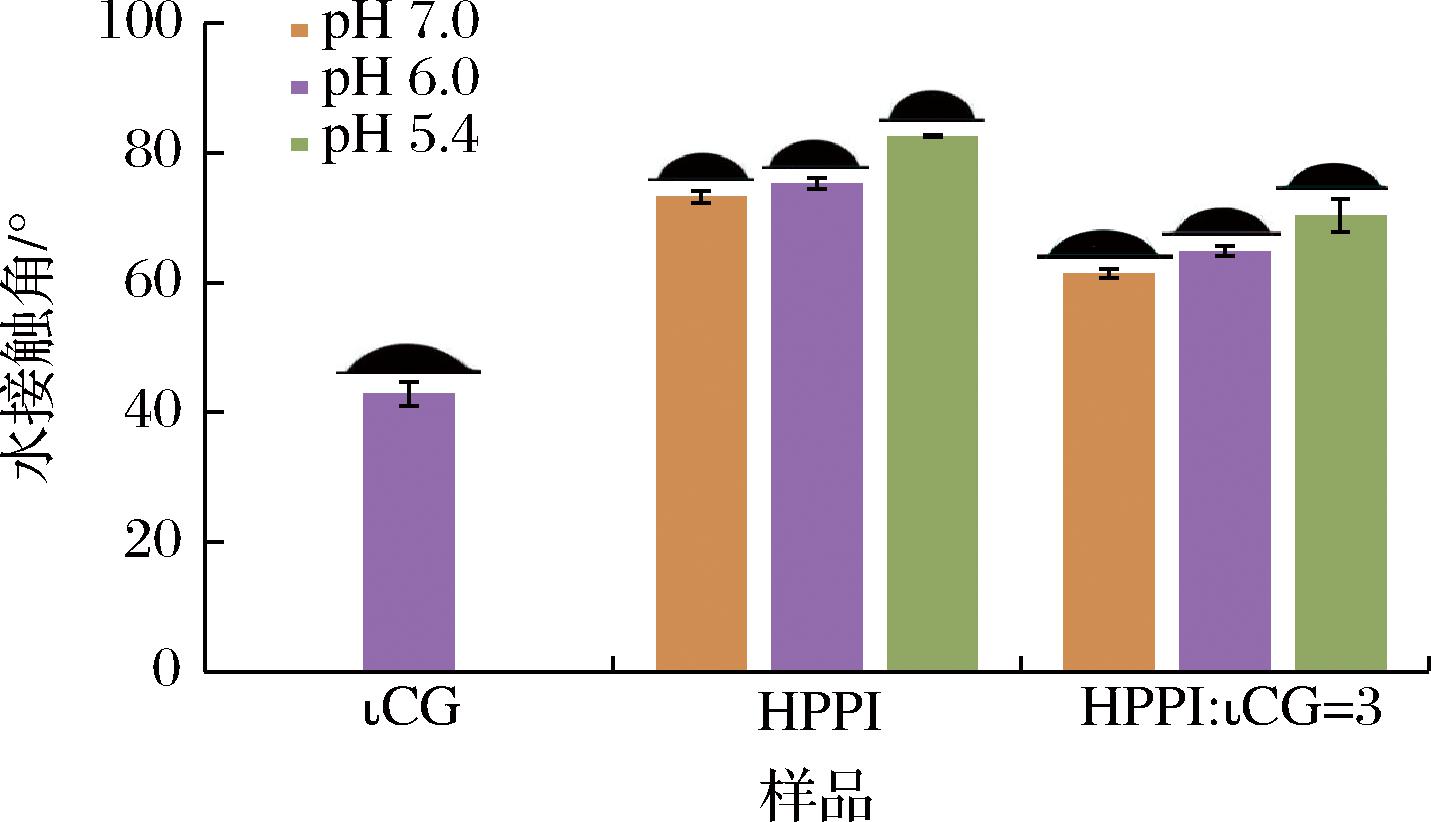
图4 ιCG、HPPI和HPPI-ιCG复合物的水触角θ
Fig.4 The water contact angle (θ) of ιCG, HPPI,and HPPI-ιCG different complexes
2.5 微观结构分析
利用原子力显微镜观察到的样品的微观图像如图5所示。单独的ιCG绝大部分呈现链状分布(图5-a),但是也出现了少量白色聚集体,可能是由于卡拉胶分子之间的相互作用导致的,也有可能是覆盖在样品表面的杂质可以看出[19]。单独的HPPI在不同pH下均呈不同大小的球形分布(图5-b~图5-d),这种现象也被其他研究者观察到[25]。可以看出,随着pH的降低,蛋白质的聚集状态也逐渐增强,蛋白质的球形颗粒从单个变成2个或者3个以上聚集,颗粒度从几纳米增加到几十纳米。在添加ιCG的体系中,在pH 7.0时,ιCG和HPPI均呈独立分布,其中蛋白和多糖各自均发生了轻微聚集,多糖呈现的颗粒度很小,蛋白则是椭球形,由于混合比为3时,蛋白质含量较多,所以图像主要由HPPI的颗粒性质决定。而在pH 6.0和pH 5.4呈现不规则形状,大多呈簇状和聚集态(图5-f、图5-g),这可以归因于多糖通过静电相互作用和氢键黏附在蛋白上。
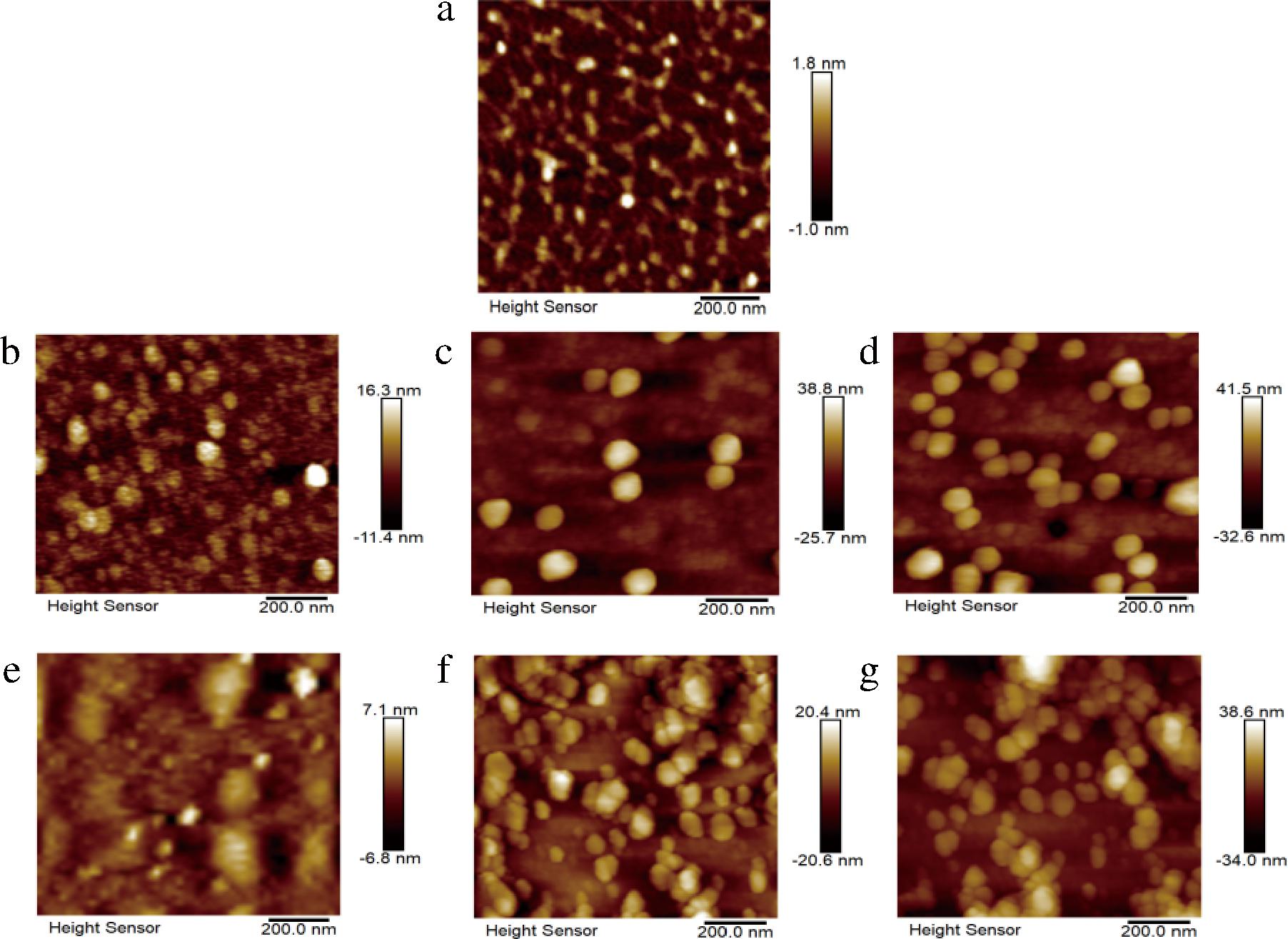
a-ιCG的AFM图像;b-HPPI在pH 7.0时的AFM图像;c-HPPI在pH 6.0时的AFM图像;d-HPPI在pH 5.4时的AFM图像;e-HPPI-ιCG复合物在pH 7.0时的AFM图像;f-HPPI-ιCG复合物在pH 6.0时的AFM图像;g-HPPI-ιCG复合物在pH 5.4时的AFM图像
图5 ιCG、HPPI和HPPI-ιCG复合物的AFM图像
Fig.5 The AFM images of ιCG, HPPI, and HPPI-ιCG complexes
3 结论
HPPI和不同类型卡拉胶(κCG,ιCG,λCG)的临界质量混合比分别是1.5∶1,3∶1,3∶1,这种现象与卡拉胶所携带的硫酸盐数量有关,3种类型卡拉胶的加入均可以抵抗HPPI的聚集,其中ιCG由于具有最为紧密和稳定的分子结构而最能延迟HPPI的聚集。不同于传统的相图,HPPI和不同类型卡拉胶络合的相图可以分为3个区,即大分子混合区、可溶性复合物区、不溶性复合物区,这可以归因于卡拉胶带有的强的电负性而使不溶性复合物没有解离,HPPI和卡拉胶以静电相互作用和氢键结合并且发生在远高于蛋白等电点以上,这是由于HPPI表面电荷分布不均匀导致的。此外,卡拉胶的加入减小了HPPI的疏水性,增加了亲水性,这是因为HPPI和卡拉胶的相互作用改变了蛋白的结构。单独的HPPI呈球形颗粒状分布,而HPPI-CG复合物则呈现簇状和聚集态。本研究为降低HPPI的热聚集程度和理解大分子混合体系的复杂相行为提供了理论指导,对扩大HPPI在食品中的应用具有重要的现实意义。
[1] ELMER C, KARACA A C, LOW N H, et al.Complex coacervation in pea protein isolate-chitosan mixtures[J].Food Research International, 2011, 44(5):1441-1446.
[2] 胡纪华, 杨兆禧, 郑忠.胶体与界面化学[M].广州:华南理工大学出版社, 1997.HU J H, YANG Z, ZHENG Z.Colloid and Interfacial Chemistry[M].Guangzhou:South China University of Technology Press, 1997.
[3] LI X Y, FANG Y P, AL-ASSAF S, et al.Complexation of bovine serum albumin and sugar beet pectin:Structural transitions and phase diagram[J].Langmuir, 2012, 28(27):10164-10176.
[4] ZHONG W G, LI C Q, DIAO M X, et al.Characterization of interactions between whey protein isolate and hyaluronic acid in aqueous solution:Effects of pH and mixing ratio[J].Colloids and Surfaces B:Biointerfaces, 2021, 203:111758.
[5] 沈可洁. 豌豆分离蛋白/多糖复合乳液的制备及性质研究[D].无锡:江南大学, 2022.SHEN K J.Study on the properties of emulsions stabilized by pea protein isolate/polysaccharide complexes[D].Wuxi:Jiangnan University,2022.
[6] 徐瑶. 多糖分子量对蛋白质/多糖静电复合及其食品功能特性影响研究[D].武汉:湖北工业大学, 2020.XU Y.Effects of molecular weight of polysaccharides on protein/polysaccharide electrostatic complexation and its functional properties[D].Wuhan:Hubei University of Technology, 2020.
[7] VINAYAHAN T, WILLIAMS P A, PHILLIPS G O.Electrostatic interaction and complex formation between gum Arabic and bovine serum albumin[J].Biomacromolecules, 2010, 11(12):3367-3374.
[8] MEKHLOUFI G, SANCHEZ C, RENARD D, et al.pH-induced structural transitions during complexation and coacervation of β-lactoglobulin and acacia gum[J].Langmuir, 2005, 21(1):386-394.
[9] 王丽杰. 乳清分离蛋白/λ-卡拉胶相互作用及其复合物功能性研究[D].沈阳:沈阳农业大学, 2019.Wang L J.Studies on the interaction of whey protein isolate/λ-carrageenan and the functional properties of their complex[D].Shenyang:Shenyang Agricultural University,2019.
[10] NADERI B, KERAMAT J, NASIRPOUR A, et al.Complex coacervation between oak protein isolate and gum Arabic:Optimization &functional characterization[J].International Journal of Food Properties, 2020, 23(1):1854-1873.
[11] LIU J, SHIM Y Y, WANG Y, et al.Intermolecular interaction and complex coacervation between bovine serum albumin and gum from whole flaxseed (Linum usitatissimum L.)[J].Food Hydrocolloids, 2015, 49:95-103.
[12] STONE A K, CHEUNG L, CHANG C, et al.Formation and functionality of soluble and insoluble electrostatic complexes within mixtures of canola protein isolate and (κ-, ι- and λ-type) carrageenan[J].Food Research International, 2013, 54(1):195-202.
[13] RABELO R S, TAVARES G M, PRATA A S, et al.Complexation of chitosan with gum Arabic, sodium alginate and κ-carrageenan:Effects of pH, polymer ratio and salt concentration[J].Carbohydrate Polymers, 2019, 223:115120.
[14] KLASSEN D R, ELMER C M, NICKERSON M T.Associative phase separation involving canola protein isolate with both sulphated and carboxylated polysaccharides[J].Food Chemistry, 2011, 126(3):1094-1101.
[15] KLEMMER K J, WALDNER L, STONE A, et al.Complex coacervation of pea protein isolate and alginate polysaccharides[J].Food Chemistry, 2012, 130(3):710-715.
[16] WANG Y X, GHOSH S, NICKERSON M T.Effect of biopolymer mixing ratios and aqueous phase conditions on the interfacial and emulsifying properties of lentil protein isolate-κ-carrageenan and lentil protein isolate-ι-carrageenan complexes[J].Cereal Chemistry, 2022, 99(1):169-183.
[17] STONE A K, NICKERSON M T.Formation and functionality of whey protein isolate-(κ, ι-, and λ-type) carrageenan electrostatic complexes[J].Food Hydrocolloids, 2012, 27(2):271-277.
[18] WU N N, YANG X Q, TENG Z, et al.Stabilization of soybean oil body emulsions using κ, ι, λ-carrageenan at different pH values[J].Food Research International, 2011, 44(4):1059-1068.
[19] UDO T, MUMMALETI G, MOHAN A, et al.Current and emerging applications of carrageenan in the food industry[J].Food Research International, 2023, 173:113369.
[20] YANG H Y, YANG S N, KONG J L, et al. Obtaining information about protein secondary structures in aqueous solution using Fourier transform IR spectroscopy[J]. Nature Protocols, 2015, 10(3):382-396.
[21] TANG M X, LEI Y C, WANG Y, et al. Rheological and structural properties of sodium caseinate as influenced by locust bean gum and κ-carrageenan[J]. Food Hydrocolloids, 2021, 112:106251.
[22] ZOU W J, MOURAD F K, ZHANG X Y, et al. Phase separation behavior and characterization of ovalbumin and propylene glycol alginate complex coacervates[J]. Food Hydrocolloids, 2020, 108:105978.
[23] ZHU X W, CHEN Y T, HU Y X, et al. Tuning the molecular interactions between gliadin and tannic acid to prepare Pickering stabilizers with improved emulsifying properties[J]. Food Hydrocolloids, 2021, 111:106179.
[24] TANG S, LI J S, HUANG G X, et al. Predicting protein surface property with its surface hydrophobicity[J]. Protein and Peptide Letters, 2021, 28(8):938-944.
[25] SHEN Q, LI J, SHEN X J, et al. Linear and nonlinear interface rheological behaviors and structural properties of pea protein (vicilin, legumin, albumin)[J]. Food Hydrocolloids, 2023, 139:108500.