γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种天然的非蛋白质氨基酸,是哺乳动物系统中一种重要的抑制性神经递质,可以和广泛分布于全身的受体特异性结合,达到一定的预防或治疗疾病的效果,如降血压、降血糖、延缓大脑衰老、参与组织再生、防止动脉硬化、治疗神经疾病等作用[1-3]。一般来说,人体中的GABA可由谷氨酸脱羧酶催化谷氨酸生成,但是随着年龄的增长和生活压力的增加,GABA含量会逐渐下降,适当的补充GABA有利于保持人体健康[4]。
目前,微生物发酵法由于更绿色、安全且适用于大规模生产,常用于生产GABA,菌种包括大肠杆菌、乳酸菌、霉菌和酵母菌等[5-6]。其中,乳酸菌(lactic acid bacteria,LAB)是一种食品安全级(generally recognized as safe,GRAS)并具有特殊生理活性的微生物,由于其可以调节肠道菌群[5]、增强机体免疫力[6]、提高抗氧化能力[7]、抑制病原菌在肠道的定植[8]等,被广泛认为是健康可食用的有益菌。目前利用微生物合成有用产物一般以单菌株培养为主,但秉承着模拟自然界微生物共存现象以提高产物产量的原则,混菌发酵在食品行业已被广泛使用[9-10],如乳制品中乳酸菌与乳酸菌或乳酸菌与酵母菌共同投入发酵体系,以达到协同增效的目的。
随着航天技术的成熟,利用宇宙空间特殊的、无法在地球模拟的复杂环境和物理诱变因素复合作用(微重力、零磁场、高真空)所获得的高突变且性状稳定的菌株已成为微生物学中一个新型的有广阔前景的领域[11-12]。研究发现,经过航天育种后的菌株发酵潜力得到提升,且主要应用于白酒[13]、调味品[14]、腐乳[15]等食品发酵行业。本研究通过航天诱变技术对乳酸菌进行诱变,利用纸层析法和高效液相色谱法,筛选高产GABA的乳酸菌并考察其益生特性;并将筛选出的1株植物乳杆菌L1-51和1株乳酸片球菌L21-48共培养,探究共培养体系产GABA最优培养条件,得到GABA含量较高的复配菌剂,为发酵行业提供了1种高产GABA的直投式发酵剂,拓宽了GABA发酵剂的选择,为航天育种菌株在发酵行业的利用提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
菌株:本实验室分离鉴定的乳酸菌L1、L10、L16、L21,均保藏于-80 ℃冰箱。
试剂:γ-氨基丁酸(色谱级),上海源叶生物科技有限公司;乙酸钠、异硫氰酸苯酯、三乙胺(均为色谱级),上海麦克林生化科技有限公司;甲醇、乙腈(均为色谱级),广州宝汇生物科技有限公司。
MRS培养基(g/L):胰蛋白胨10.0,牛肉膏5.0,酵母粉4.0,葡萄糖20.0,吐温-80 1.0 mL/L,磷酸氢二钾(K2HPO4·7H2O)2.0,乙酸钠(CH3COONa·3H2O)5.0,柠檬酸三胺 2.0,硫酸镁(MgSO4·7H2O)0.2,硫酸锰(MnSO4·4H2O)0.05,pH值为6.0。
GYP发酵培养基(g/L):酵母粉10.0,蛋白胨5.0,无水乙酸钠2.0,葡萄糖10.0,硫酸镁0.2,硫酸亚铁1.0 mg/L,硫酸锰1.0 mg/L,L-谷氨酸钠10.0,pH值为6.8。
LB培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,去离子水1 L,pH值为7.0。
以上培养基的固体培养基均需加入15~20 g琼脂,121 ℃灭菌20 min。
1.2 仪器与设备
高效液相色谱仪Alliance E2695系统,美国Waters公司;高压蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂;生物安全柜,美国Thermo Electron公司;连续波长多功能微孔板检测平台,美国Molecular Devices公司;超高速离心机,德国Eppendorf公司;光栅型酶标仪,VersaMax Melecular Devices;紫外可见分光光度计,美国Thermo FIsher Scientific公司;恒温培养箱,江苏省金坛市荣华仪器制造有限公司。
1.3 实验方法
1.3.1 菌株的活化
将经过航天诱变的固体培养物接入10 mL MRS液体培养基中37 ℃恒温培养48 h,取1 mL菌液梯度稀释,取稀释液100 μL涂布于MRS固体培养基上,37 ℃培养48 h。挑选菌落较大的单菌落活化2代后取单菌落接入MRS液体培养基中培养37 ℃恒温培养12 h。
1.3.2 改良纸层析法初筛乳酸菌
参考田蕊[16]的方法并略作修改。取2 μL不同浓度的标准溶液在滤纸上点样后,在展开剂[V(正丁醇)∶V(冰醋酸)∶V(水)=4∶1∶3,同时加入0.4%显色剂茚三酮]中展开,85 ℃烘箱中显色10 min后,将剪下的斑圈在洗脱液[V(0.1%硫酸铜)∶V(75%乙醇)=2∶38]中恒温振荡洗脱30 min后,于波长512 nm处测定洗脱液吸光度。以GABA质量浓度(mg/mL)为横坐标,吸光度A值为纵坐标,绘制标准曲线,计算回归方程和相关系数。菌种以4%的接种量接入GYP发酵培养基中37 ℃静置培养48 h后,4 ℃下8 000 r/min离心10 min,分别取2 μL上清液在滤纸上点样,筛选出高产GABA菌株。
1.3.3 反向衍生-高效液相色谱法复筛高产γ-氨基丁酸乳酸菌
参考马牧然[17]的方法,使用高效液相色谱Alliance E2695系统,Waters C18色谱柱(250 mm×4.6 mm, 5 μm)。利用反向衍生-高效液相色谱法,以GABA浓度为横坐标,峰面积为纵坐标,绘制标准曲线。取于GYP发酵培养基中培养48 h的菌液12 000 r/min离心3 min,取50 μL上清液置于150 μL的一级水中,加入14%(体积分数)三乙胺-乙腈溶液、1.2%苯异硫氰酸酯溶液各100 μL后混匀,室温放置1 h后加入400 μL正己烷,振荡后静置10 min,取240 μL下层溶液与960 μL一级水混匀后,用0.22 μm有机滤膜过滤,测定GABA含量。
1.3.4 高产GABA突变菌株遗传稳定性测试
将筛选得到的高产GABA菌株连续培养10代,每隔2代进行1次产GABA含量测定,测定方法同1.3.3节,以考察菌株产GBAB的遗传稳定性[18]。
1.3.5 两菌株相互作用分析
生长曲线测定:分别测定两菌株单独生长与共培养时的生长曲线,观察共培养是否对某一菌株的生长存在抑制作用。其中共培养时两菌按照1∶1混合,以4%接种量接种于MRS培养基中,37 ℃培养48 h。
平板实验:将两菌株在MRS平板上相交划线接种,37 ℃培养24 h,观察划线相交处菌落生长情况。
高效液相色谱法:将两株乳酸菌以相同的接种量分别接种于MRS培养基中活化,取活化2代后的乳酸菌100 μL于GYP发酵培养基中37 ℃发酵培养48 h,测定单菌株以及共培养菌株的GABA含量。
1.3.6 产GABA的菌株配比及培养条件优化
1.3.6.1 共培养发酵条件单因素试验优化
以高效液相色谱法测定GABA含量并结合菌株OD600结果,确定最佳发酵条件。将两菌株以4%的总接种量接种至pH为6.8的GYP发酵培养基中培养48 h,优化植物乳杆菌L1和乳酸片球菌L21的接种比例、接种量、培养温度和pH。设置的接种比例分别为2∶1、1∶1、1∶2、1∶3;接种量分别为3%、4%、5%、6%、7%;温度分别为28、30、33、35、37、40 ℃;pH值分别为5.0、6.0、7.0、8.0、9.0。
1.3.6.2 响应面法优化培养条件提高GABA产量
为了得到产GABA量高的培养条件,综合以上单因素试验结果,以接种比例、接种量、培养温度和培养pH值为试验因素,利用Design-expert 11.0软件设计4因素3水平的正交试验,根据GABA的产量,通过Box-Benhnken法确定最佳的培养条件,并且进行验证。
1.4 数据处理
试验均重复3次或3次以上,实验结果以均值±标准差(Means±SD)表示。利用Excel软件绘制表格,使用Graphpad prism 8.0绘制图,采用IBM SPSS Statistics 25.0软件进行数据统计学分析,组间差异釆用单因素方差分析以及最小显著差异检验和邓肯多重范围检验,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 高产γ-氨基丁酸的乳酸菌的航天诱变选育
2.1.1 改良纸层析法初筛产GABA乳酸菌株
纸层析法测定γ-氨基丁酸的标准曲线,得到方程y=0.111 8x+0.008 6,R2=0.999 3。诱变后菌株经纸层析法进行初筛,由图1-A可知,航天育种后的植物乳杆菌L1突变株较原始菌株产GABA的量总体提高,产量较高的菌株有L1-8、L1-50、L1-51、L1-52、L1-54;由图1-B可知,航天育种后的乳酸片球菌L21突变株较出发菌株产GABA的量亦总体提高,产量较高的菌株有L21-28、L21-48、L21-49、L21-68、L21-70。由于改良纸层析法定量不够精确,本研究中用于菌株的初筛。
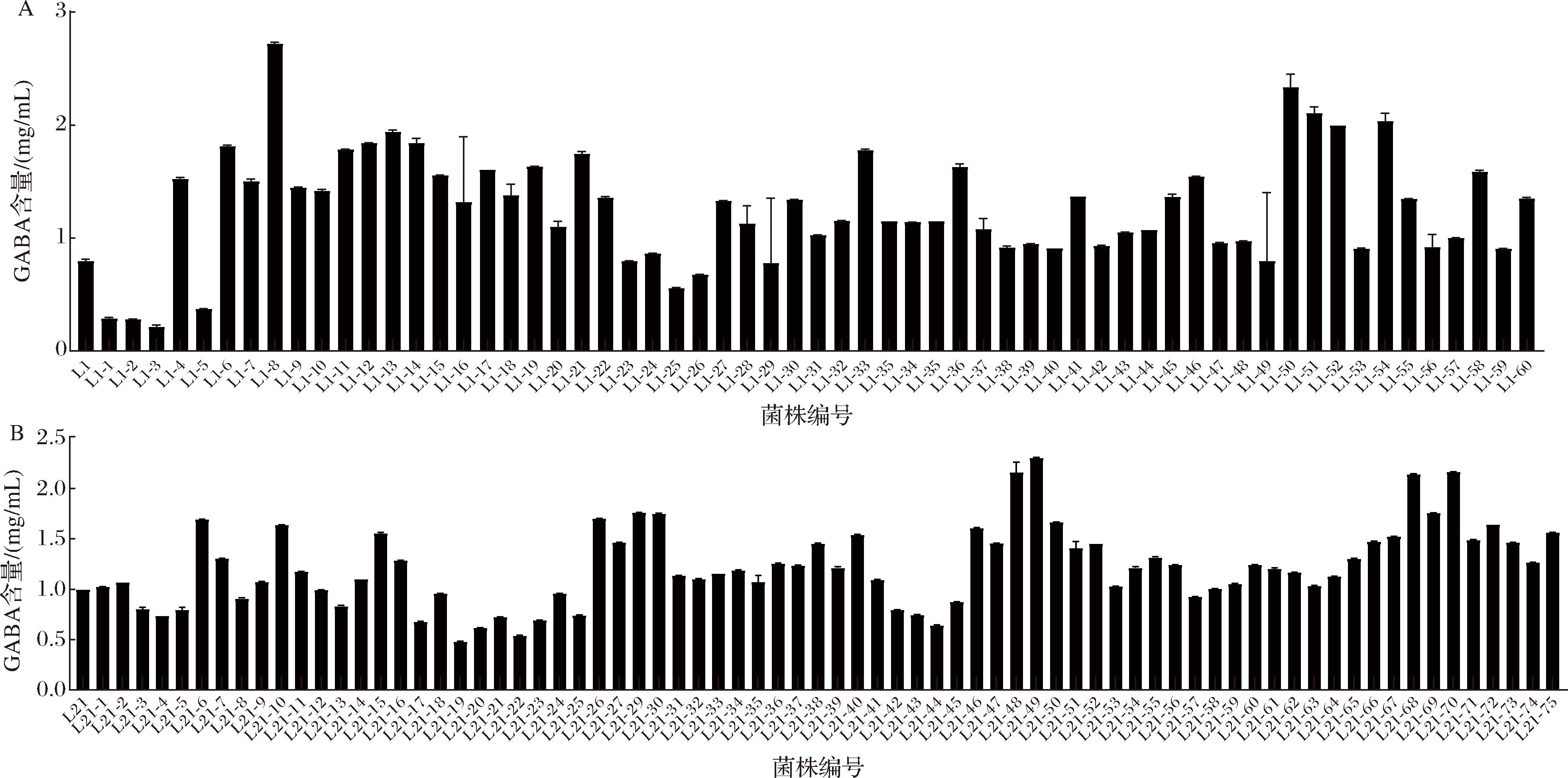
A-植物乳杆菌L1;B-乳酸片球菌L21
图1 植物乳杆菌L1和乳酸片球菌L21航天育种的不同菌株产GABA情况
Fig.1 The GABA productions of different space breeding strains of L.plantarum L1 and P.acidilactici L21
2.1.2 高效液相色谱法复筛产GABA乳酸菌株
经高效液相色谱法得到测定GABA含量的线性回归方程为:y=2E+07x-333 884,R2=0.999 1。参照纸层析法初筛结果,对产GABA含量较高的前5株菌株进行GABA含量的高效液相色谱法测定。如图2-A所示,原菌株植物乳杆菌L1的GABA产量为0.480 mg/mL,航天诱变后GABA产量最高的是L1-50和L1-51,分别为0.772、0.766 mg/mL,较原始菌株提高了60.83%和59.58%。图2-B中原始株乳酸片球菌L21的GABA产量为0.441 mg/mL,航天诱变后GABA产量最高的为L21-48和L21-28,分别为0.482、0.480 mg/mL,较原始菌株提高了9.29%和8.84%。
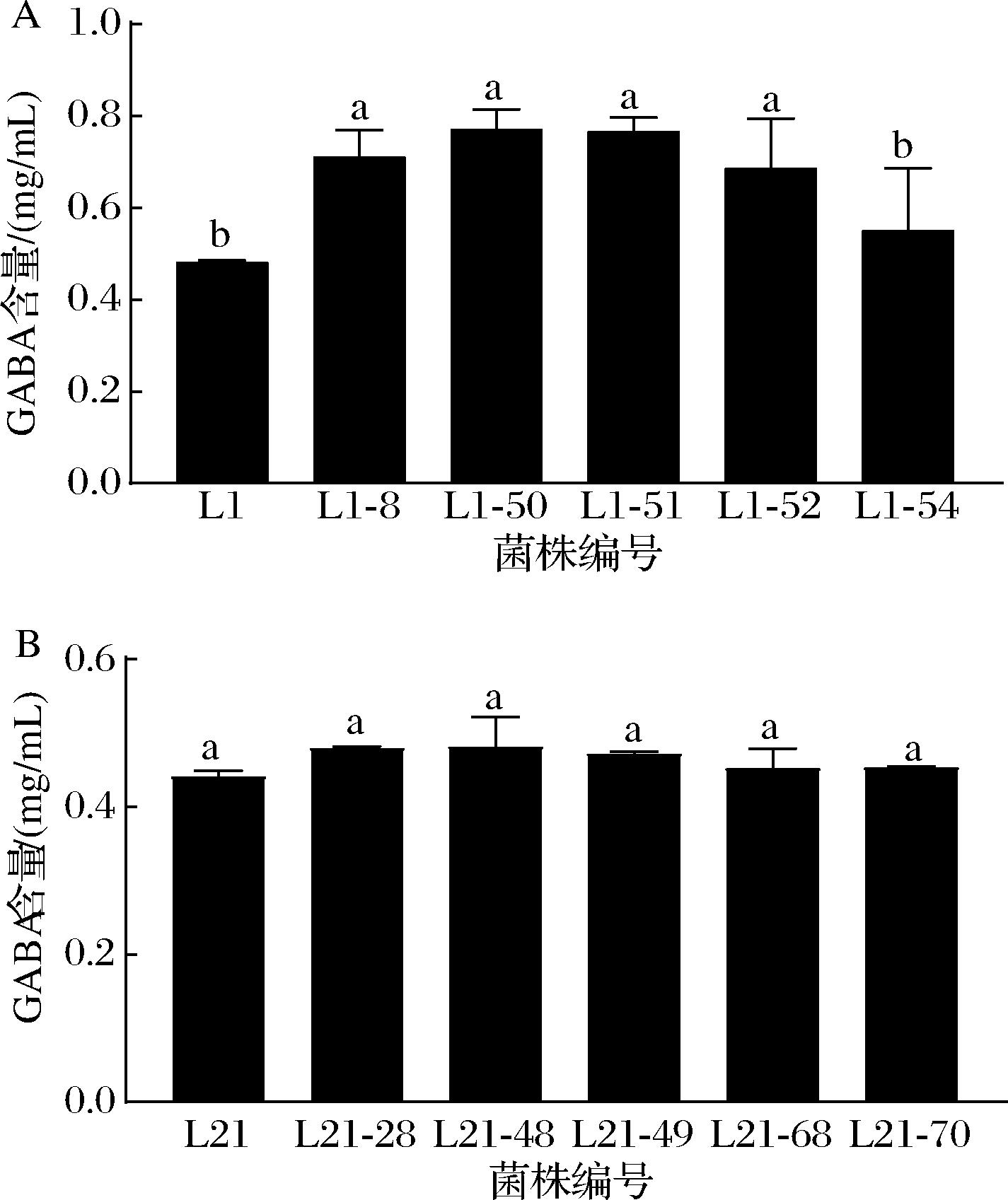
A-植物乳杆菌L1;B-乳酸片球菌L21
图2 植物乳杆菌L1、乳酸片球菌L21及其航天育种菌株GABA产量
Fig.2 The GABA yields of L.plantarum L1, P.acidilactici L21 and their space-bred strains
注:图柱上方的小写字母相同表示差异不显著(P>0.05),不同表示差异显著(P<0.05)(下同)。
2.1.3 乳酸菌诱变菌株的遗传稳定性
依据高效液相色谱法测定产GABA结果,选取GABA产量提高较大的植物乳杆菌突变株L1-50、L1-51以及乳酸片球菌突变株L21-28、L21-48,连续传代10次,每隔2代使用高效液相色谱法测定1次GABA含量,观察其产GABA稳定性。由图3可知,植物乳杆菌突变株L1-51、乳酸片球菌突变株L21-48的遗传稳定性较优越,故最终选择航天育种后突变株中的植物乳杆菌L1-51和乳酸片球菌L21-48进行后续实验。
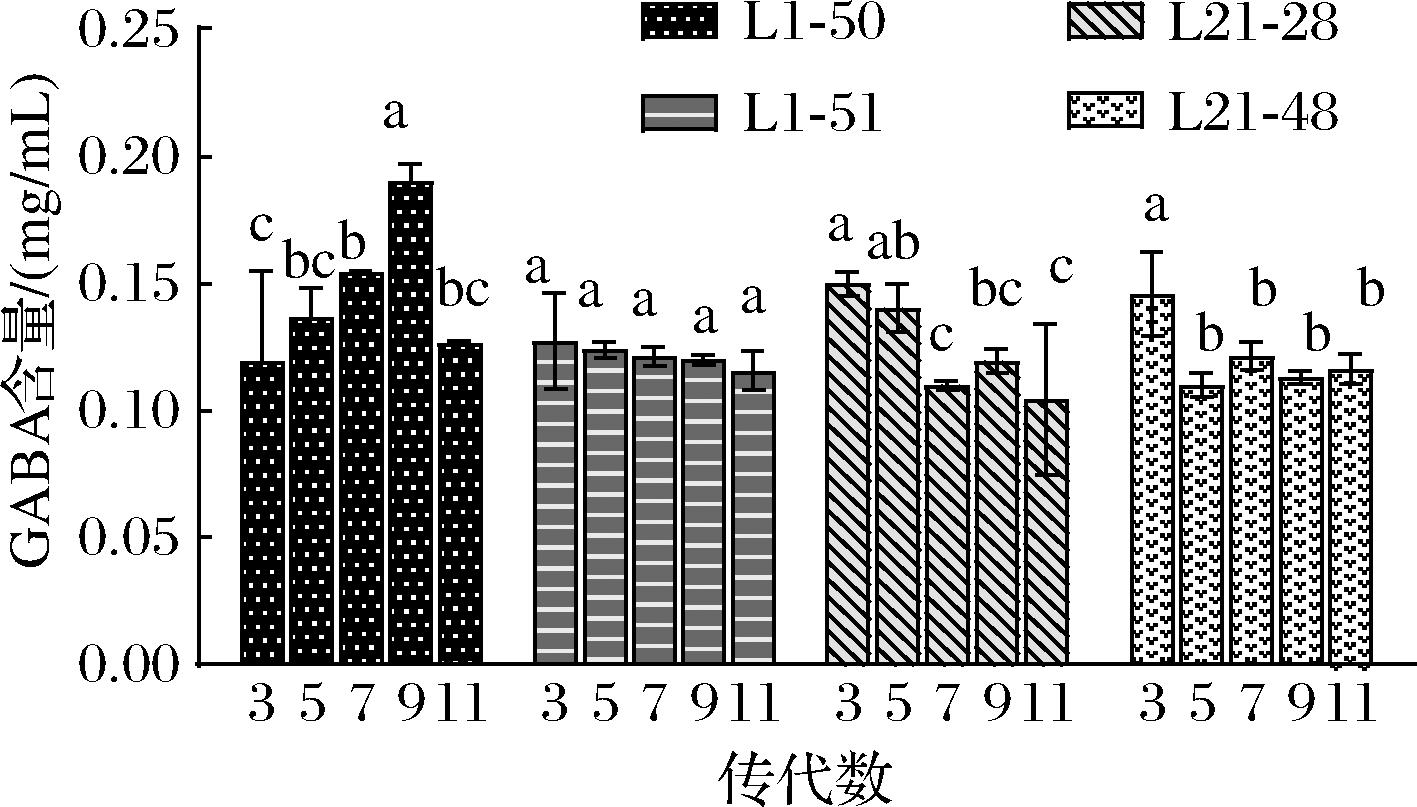
图3 产GABA乳酸菌的遗传稳定性
Fig.3 Genetic stabilities of GABA-producing strains
2.2 两菌株共培养体系及培养条件优化
2.2.1 两菌株相互作用
分别对单菌株以及共培养菌株进行生长曲线检测,如图4-A所示,在共培养和单培养相同接种量的情况下,共培养的OD值高于单菌的OD值,可表明共培养没有对两菌的生长产生抑制作用;另外,相互作用平板上,两菌株在相交处正常生长没有拮抗作用,如图4-B所示,进一步证明两菌株之间没有抑制作用。从图4-C中可以看出,菌株经过48 h培养后,共培养体系中GABA含量明显提高。有研究者将毕赤酵母和植物乳杆菌依次接种到植物基饮料中,发酵8 d之后,γ-氨基丁酸的浓度提高[19]。
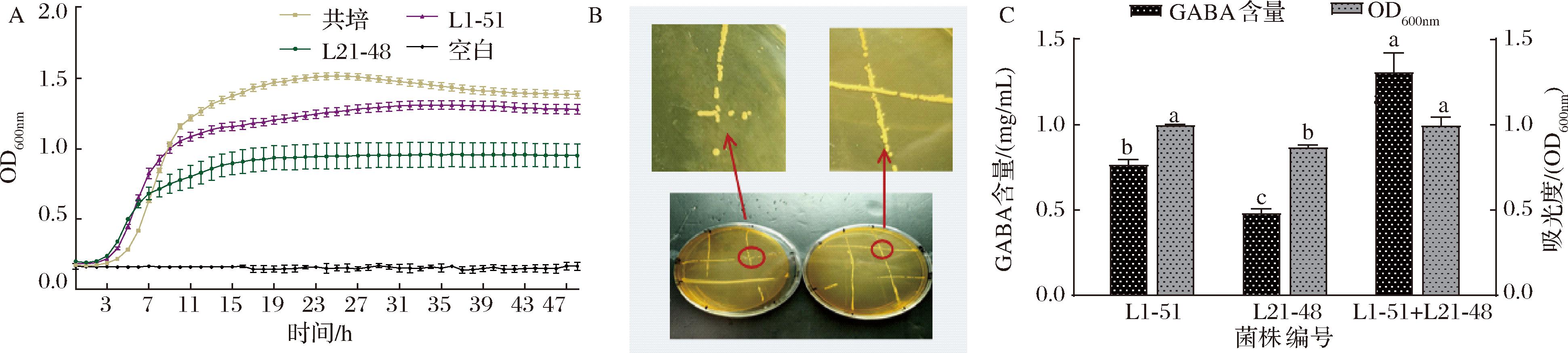
A-生长曲线;B-平板上相互作用;C-GABA的含量
图4 两菌株共培养生长曲线、平板上相互作用以及GABA的含量
Fig.4 The growth curves,interaction on plates and GABA content of both strains
2.2.2 共培养体系接种比例和接种量的优化
如图5-A所示,当两菌株的比例为2∶1、1∶1、1∶2、1∶3时,GABA含量有所不同,接种比例为1∶1时产GABA产量较高,因此共培养体系中,L1-51与L21-48的最优接种比例选择1∶1,这与发酵香肠中的植物乳杆菌和乳酸片球菌的最佳发酵配比一致[20]。
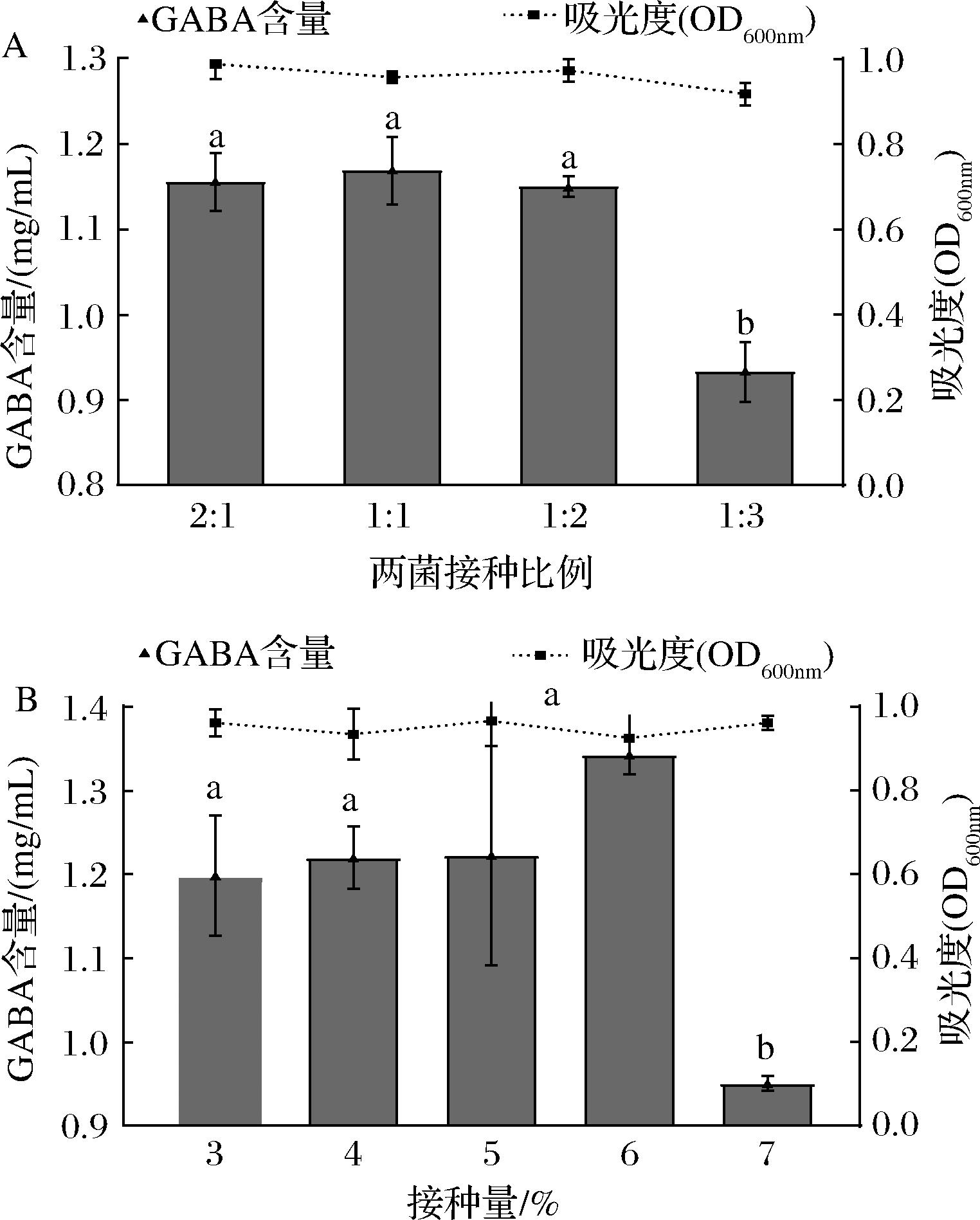
A-接种比例;B-接种量
图5 不同接种比例和接种量对共培养体系GABA产量影响
Fig.5 Effects of different inoculation proportions and amount on GABA production in co-culture system
由图5-B可知,随着接种量的提高,GABA产量呈现增加的趋势,在总接种量为6%时,共培养体系产GABA的量最多,达到1.343 mg/mL。当接种量过大时,微生物之间对营养物质的激烈竞争,营养缺乏会导致部分菌体死亡、GABA生成量急剧下降[21]。故共培养体系最优接种量为6%。
2.2.3 共培养体系温度和pH的优化
当共培养体系在不同温度下进行培养时,利用高效液相色谱测定GABA含量,如图6-A所示。随着发酵温度升高,共培养体系GABA产量呈现先升高后降低的趋势,在37 ℃时达到最大值1.410 mg/mL,继续升高温度到40 ℃时,GABA产量下降到1.126 mg/mL。可见,共培养体系的适宜发酵温度为37 ℃。
如图6-B所示,体系中GABA的生成量随着pH值的增加,先升高后缓慢降低。当培养基pH值为6时,共培养体系产GABA量最多。KIM等[22]利用天麻开发富含GABA的产品时发现,短乳杆菌和枯草芽孢杆菌共培养体系pH值为6.5时是产GABA的最佳发酵条件,推测混菌产GABA的最适pH值在6左右。
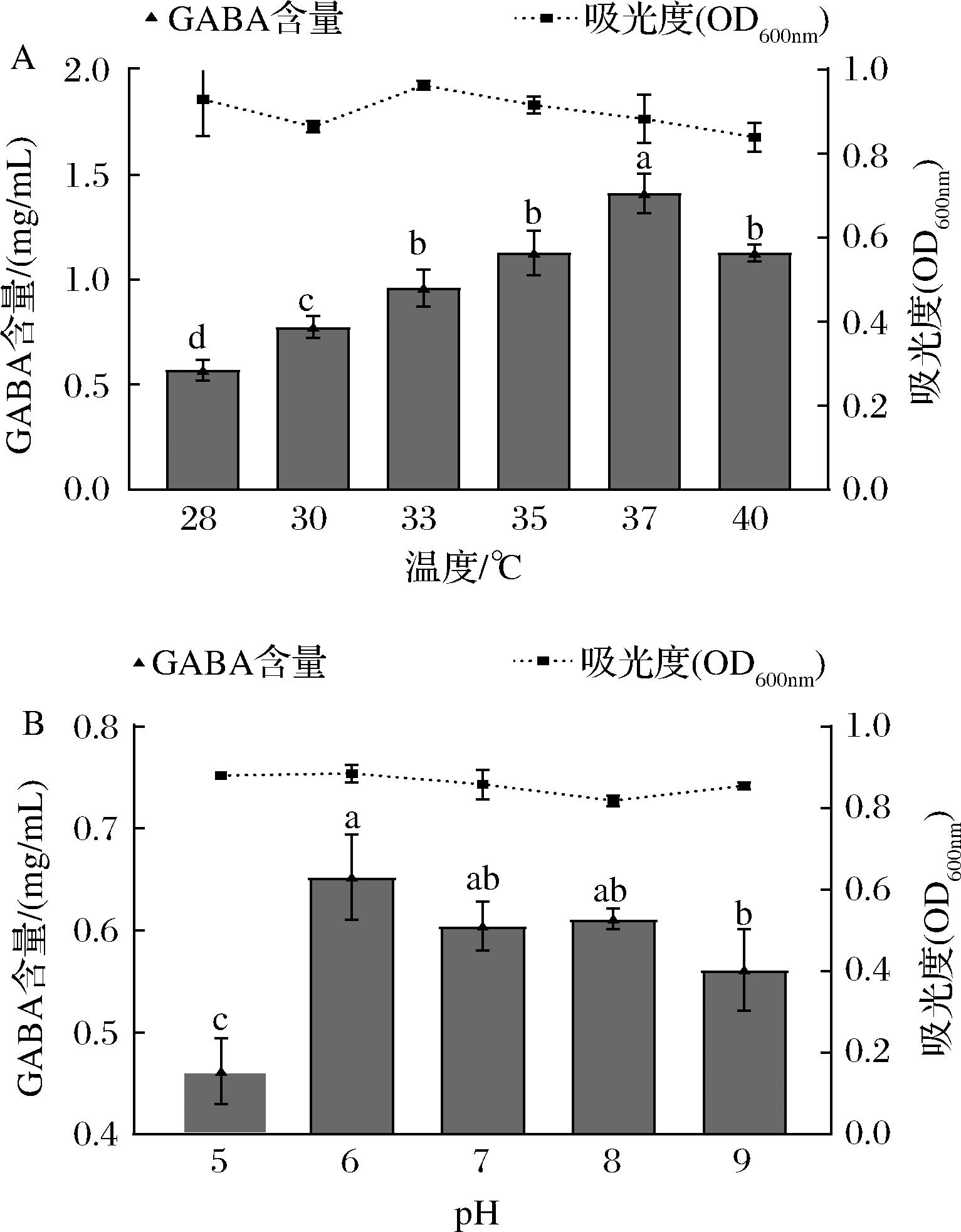
A-温度;B-pH
图6 不同温度和不同pH对共培养体系GABA产量影响
Fig.6 Effects of different temperatures and pH on GABA production in the co-culture system
2.2.4 响应面优化培养条件
根据单因素试验结果,基于Box-Benhnken法原理,以GABA产量作为响应值,利用Design-Expert 11.0软件设计4因素3水平的响应面实验(表1),实验结果使用RSA软件进行参数与显著性分析,结果如表2、表3所示。
表1 Box-Benhnken试验设计
Table 1 Box-Benhnken trial design
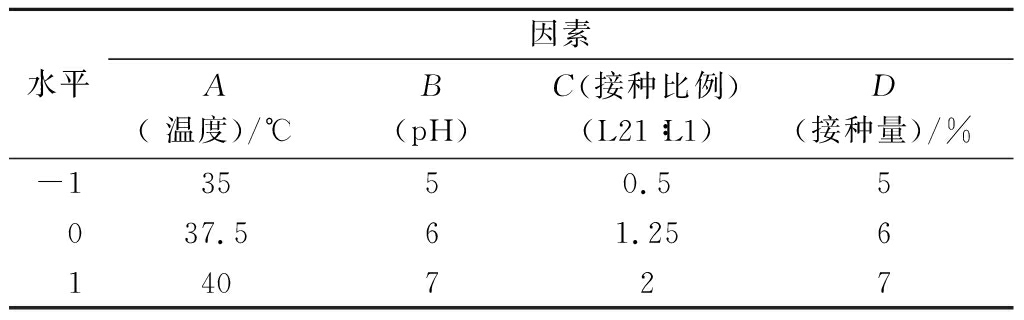
水平因素A( 温度)/℃B(pH)C(接种比例)(L21∶L1)D(接种量)/%-13550.55037.561.256140727
表2 中心组合实验的设计方案和响应值结果
Table 2 Design scheme and response value results of the central combined experiments
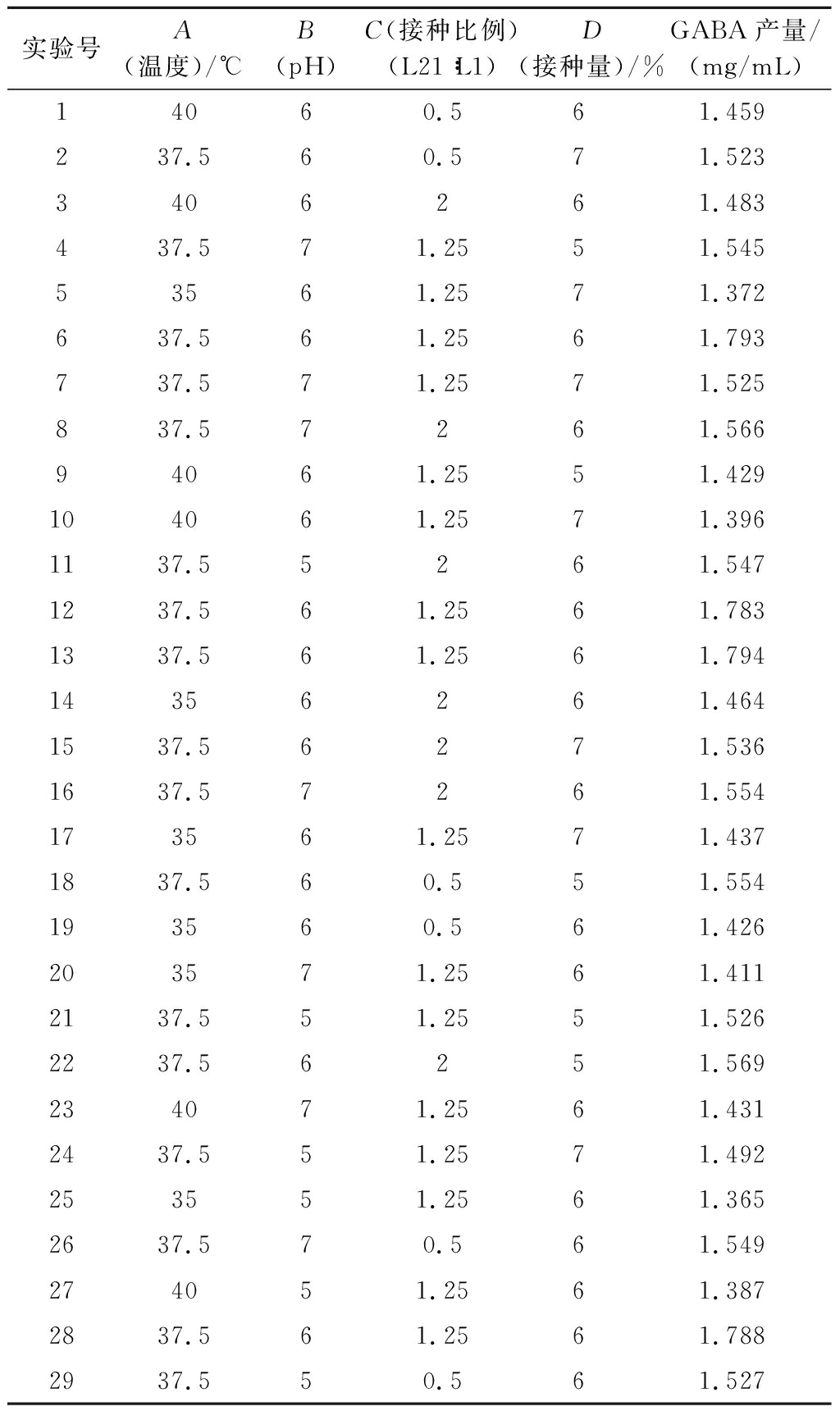
实验号A(温度)/℃B(pH)C(接种比例)(L21∶L1)D(接种量)/%GABA产量/(mg/mL)14060.561.459237.560.571.5233406261.483437.571.2551.54553561.2571.372637.561.2561.793737.571.2571.525837.57261.56694061.2551.429104061.2571.3961137.55261.5471237.561.2561.7831337.561.2561.79414356261.4641537.56271.5361637.57261.554173561.2571.4371837.560.551.554193560.561.426203571.2561.4112137.551.2551.5262237.56251.569234071.2561.4312437.551.2571.492253551.2561.3652637.570.561.549274051.2561.3872837.561.2561.7882937.550.561.527
表3 中心组合实验回归方程参数与显著分析
Table 3 Central combined experimental regression equation parameters and significant analysis

方差来源平方和自由度均方F值P值显著性模型0.486 1140.034 7177.03<0.000 1**A0.000 810.000 84.110.062 1B0.002 810.002 814.390.002**C0.001 310.001 36.790.020 8*D0.004 310.004 321.740.000 4**AB5.72E-0715.72E-070.002 90.957 7AC0.000 110.000 10.264 30.615 2AD0.000 510.000 52.40.143 4BC1.48E-0611.48E-060.007 60.932BD0100.236 90.634CD1.45E-0711.45E-070.000 70.978 7A20.373 210.373 21 902.58<0.000 1**B20.126 910.126 9647.11<0.000 1**C20.062 510.062 5318.87<0.000 1**D20.11710.117596.47<0.000 1**残差0.002 7140.000 2失拟误差0.002 5100.000 24.050.095纯误差0.000 240.000 1
注:*:P<0.05,显著差异;**:P<0.01,极显著差异。
对回归模型进行方差和差异显著性检验的结果如表3所示,反应不同变量与响应值之间拟合程度的F值为177.03,P<0.000 1,模型极其显著;失拟项F值为4.05,P=0.095,失拟项不显著,此模型建立有效。变量对GABA产量的影响可以用函数表示:函数R2为0.994 4,结果可信度高,矫正系数Adjusted R2为0.988 8,表明模型与试验结果的拟合度较好。从F值来看,各因素对高产GABA菌株复配体系加权分影响的顺序为:D(接种量)>B(pH值)>C(接种比例)>A(温度)。
上述回归参数以及响应面数据如图7所示,利用RSA软件进行100次模拟实验预测并结合实际操作调整后,确定共培养最佳发酵条件产GABA的条件为:发酵温度为37 ℃,pH值为6,植物乳杆菌L1-51和乳酸片球菌L21-48接种比例1∶1,接种量6%,GABA产量可达1.787 mg/mL。按照上述实验条件进行3次重复实验,测定共培养体系GABA产量为(1.675±0.014) mg/mL,表明该模型能够预测共培养体系中GABA产量,响应面法具有良好的可靠性和实用性。

A-pH与温度;B-接种比例与温度;C-接种量与温度;D-接种比例与pH;E-接种量与pH;F-接种量与接种比例
图7 四因素响应面图
Fig.7 The four-factor response surface diagram
3 结论与讨论
太空对菌株的诱变育种由于众多的突变因素,使得诱变菌株变异幅度大、突变方向多,但实际上与地面物理因素(如紫外射线、电离辐射等)并无本质不同[23]。本文将经过航天育种后产GABA含量得到提升且遗传稳定的2株乳酸菌——植物乳杆菌L1-51和乳酸片球菌L21-48进行共培养,探究了两菌株共培养体系产GABA最优条件,结果发现,在发酵温度为37 ℃,pH值为6,接种比例1∶1,接种量6%时,共培体系GABA产量可达(1.675±0.014) mg/mL。有研究者利用植物乳杆菌和其他乳酸菌混合发酵,最终牛奶中GABA含量为144 mg/kg[24];或通过混菌株(瑞士乳杆菌、动物双歧杆菌、枯草芽孢杆菌)发酵豆乳,GABA含量达到13.22 μg/mL[25]。KIM等[26]探究植物乳杆菌和乳酸乳球菌最适生长条件,确定两菌株在其最适条件下产GABA的含量分别达到了546.7、404.6 μg/mL。相较之下本研究的发酵菌剂产GABA含量较高,为航天育种菌株的开发利用提供了参考资料,并扩展了产GABA发酵菌剂的选择。
[1] SCHWEIZER-SCHUBERT S, GORDON J L, EISENLOHR-MOUL T A, et al.Steroid hormone sensitivity in reproductive mood disorders:On the role of the GABA (A) receptor complex and stress during hormonal transitions[J].Frontiers in Medicine, 2021.DOI:10.3389/FMED.2020.479646.
[2] HEPSOMALI P, GROEGER J A, NISHIHIRA J, et al.Effects of oral gamma-aminobutyric acid (GABA) administration on stress and sleep in humans:A systematic review[J].Frontiers in Neuroscience, 2020,14:923.
[3] 符琼,周文化,黄卫文, 等.发芽糙米生物活性物质及生理功能研究进展[J].食品工业科技, 2019, 40(14):325-333.FU Q, ZHOU W H, HUANG W W, et al.Research progress on bioactive substances and physiological function of germinated brown rice[J].Science and Technology of Food Industry, 2019, 40(14):325-333.
[4] BOONSTRA E, DE KLEIJN R, COLZATO L S, et al.Neurotransmitters as food supplements:The effects of GABA on brain and behavior[J].Frontiers in Psychology, 2015,6:1520.
[5] DURANTI S, LUGLI G A, MANCABELLI L, et al.Prevalence of antibiotic resistance genes among human gut- derived bifidobacteria[J].Applied and Environmental Microbiology, 2017,83(3):e02894-e02816.
[6] LI X L, SONG Y, MA X Y, et al.Lactobacillus plantarum and Lactobacillus fermentum alone or in combination regulate intestinal flora composition and systemic immunity to alleviate obesity syndrome in high-fat diet rat[J].International Journal of Food Science and Technology, 2018, 53(1):137-146.
[7] JIN X F, CHEN W X, CHEN H M, et al.Combination of Lactobacillus plantarum and Saccharomyces cerevisiae DV10 as starter culture to produce mango slurry:microbiological, chemical parameters and antioxidant activity[J].Molecules, 2019,24(23):4349.
[8] HUNG Y P, LEE C C, LEE J C, et al.The potential of probiotics to eradicate gut carriage of pathogenic or antimicrobial-resistant Enterobacterales[J].Antibiotics, 2021, 10(9):1086.
[9] KORT R, WESTERIK N, MARIELA SERRANO L, et al.A novel consortium of Lactobacillus rhamnosus and Streptococcus thermophilus for increased access to functional fermented foods[J].Microbial Cell Factories, 2015, 14(1):195.
[10] 李向来, 申晓林, 王佳, 等.微生物共培养生产化学品的研究进展[J].合成生物学, 2021,2(6):876-885.LI X L, SHEN X L, WANG J, et al.Recent advances in biosynthesis of chemicals by microbial co-culture[J].Synthetic Biology Journal, 2021, 2(6):876-885.
[11] CHI Y, WANG X J, LI F, et al.Aerospace technology improves fermentation potential of microorganisms[J].Frontiers in Microbiology, 2022,13:896556.
[12] SENATORE G, MASTROLEO F, LEYS N, et al.Effect of microgravity &space radiation on microbes[J].Future Microbiology, 2018, 13:831-847.
[13] 张彬, 杨涛, 管桂臻, 等.酿酒微生物太空育种及在生产中的应用研究(Ⅱ)芝麻香型白酒酿造功能微生物的太空育种[J].酿酒, 2014,41(6):45-50.ZHANG B, YANG T, GUAN G Z, et al.Mutagting strains in space of brew microorganisms and application of them in production (II) space mutation breeding of functional microorganisms in sesame flavor liquor[J].Liquor Making, 2014, 41(6):45-50.
[14] 陈志梅, 张宗舟, 薛林贵, 等.航天诱变混菌生抽发酵研究[J].甘肃农业大学学报, 2011, 46(3):104-108.CHEN Z M, ZHANG Z Z, XUE L G, et al.Mixed fermentation of soy sauce with space mutant strains[J].Journal of Gansu Agricultural University, 2011,46(3):104-108.
[15] 马丽, 魏海霞, 汪倩倩, 等.航天诱变毛霉ZY-3在腐乳生产中的应用研究[J].中国酿造, 2015,34(4):62-65.MA L, WEI H X, WANG Q Q, et al.Application of space mutation strain Mucor ZY-3 in sufu production[J].China Brewing, 2015,34(4):62-65.
[16] 田蕊. 产γ-氨基丁酸乳酸菌的筛选鉴定、紫外诱变及发酵条件优化[D].呼和浩特:内蒙古农业大学, 2018.TIAN R. Screening, identification, UV mutagenesis and fermentation conditions optimization of γ-aminobutyric acid by Lactobacillus[D]. Hohhot: Inner Mongolia Agricultural University, 2018.
[17] 马牧然. 产γ-氨基丁酸乳酸菌的筛选及培养条件的优化[D].呼和浩特:内蒙古农业大学, 2021.MA M R.Screening of lactic acid bacteria producing γ- aminobutyric acid and optimization of culture conditions[D].Hohhot:Inner Mongolia Agricultural University, 2021.
[18] LI H X, PEI J F, WEI C, et al.Sodium-ion-free fermentative production of GABA with Levilactobacillus brevis CD0817[J].Metabolites, 2023, 13(5):608.
[19] LIU H, NI Y, YU Q, et al.Evaluation of co-fermentation of L.plantarum and P.kluyveri of a plant-based fermented beverage:Physicochemical, functional, and sensory properties[J].Food Research International, 2023,172:113060.
[20] 刘玺, 宋照军, 王树宁, 等.富硒发酵香肠的工艺研究[J].食品科学, 2009,30(20):471-474.LIU X, SONG Z J, WANG S N, et al.Investigation of processing techniques for selenium-enriched fermented sausages[J].Food Science, 2009,30(20):471-474.
[21] 高世阳. 乳酸菌应用榨菜腌制工艺研究[D].杭州:浙江大学, 2014.GAO S Y. Application of lactic acid bacteria in mustard pickling process[D]. Hangzhou: Zhejiang University, 2014.
[22] KIM J A, PARK M S, KANG S A, et al.Production of γ-aminobutyric acid during fermentation of Gastrodia elata Bl.by co-culture of Lactobacillus brevis GABA 100 with Bifidobacterium bifidum BGN4[J].Food Science and Biotechnology, 2014,23(2):459-466.
[23] SHAO D Y, YAO L B, RIAZ M S, et al.Simulated microgravity affects some biological characteristics of Lactobacillus acidophilus[J].Applied Microbiology and Biotechnology, 2017,101(8):3439-3449.
[24] NEJATI F, RIZZELLO C G, DI CAGNO R, et al.Manufacture of a functional fermented milk enriched of angiotensin-I converting enzyme (ACE)-inhibitory peptides and γ-amino butyric acid (GABA)[J].LWT-Food Science and Technology, 2013,51(1):183-189.
[25] 方颖, 陈依彤, 林咏珊, 等.富含γ-氨基丁酸发酵豆酸乳的研制[J].中国乳品工业, 2021,49(8):60-64.FANG Y, CHEN Y T, LIN Y S, et al.Research on fermented soybean yogurt rich in γ-aminobutyric acid[J].China Dairy Industry, 2021,49(8):60-64.
[26] KIM N, KIM J M, RA C.Evaluation of γ-aminobutyric acid (GABA) production by lactic acid bacteria using 5-L fermentor[J].Microbiology and Biotechnology Letters, 2021,49(4):559-565.