各种霉菌毒素对农作物及产品的污染对人类健康带来潜在的危害,并且给粮食加工、食品、饲料和畜牧等行业都造成了巨大的经济损失[1]。1993年世界卫生组织已将黄曲霉毒素列为剧毒和一类致癌物,尤其是黄曲霉毒素B1(aflatoxin B1,AFB1)的毒性最强[2]。而玉米赤霉烯酮(zearalenone,ZEN)是雌性激素类物质,可能引起胎儿畸形和中枢神经系统中毒[3]。因此,解决霉菌毒素对于治理农产品的污染,对于保障食品安全和农业产量至关重要。目前虽然已经采取一些方法来控制霉菌毒素的产生,如控制温度和湿度以及使用化学试剂[4],但这些方法的局限性较大,难以满足工业生产的需求。许多结构稳定的霉菌毒素,无法在常规条件下利用物理化学法进行降解。如AFB1在紫外光下依然稳定,在强酸和强碱条件下也仅有极少量的分解,只有260 ℃以上的高温才能将其分解。因此,迫切需要开发新方法应对以AFB1为代表的霉菌毒素污染问题。
酶解法作为一种绿色高效的降解方法,被国际社会认为是解决霉菌毒素污染的重要解决方案。该方法是利用酶来降解霉菌毒素,具有广泛的应用前景[5]。然而我国相关产业仍处于初级阶段,与国外产品相比,本土产品的降解效率低,稳定性有限,产酶量也有待提高[6]。例如饲料领域需要耐高温酶种,而现有酶种多为常温品种,易失活。因此,开发新型高效、稳定(耐高温)的酶种,并实现其高效表达,是推动酶法降解霉菌毒素的关键。
漆酶由于其出色的催化能力和底物广谱性而受到国内外的广泛关注,具有降解难降解化合物的能力[7]。漆酶又名多酚氧化酶[8],已广泛应用于各种领域[9],包括生物技术和工业。漆酶具有分解多种有机物的能力,如木质素[10]、纤维素和多聚苯乙烯等,已广泛用于污水处理[11]、纸浆漂白、染料降解等领域[12]。在降解霉菌毒素方面,漆酶的应用也具有巨大潜力[13-14]。然而,当前现有的漆酶可能无法高效处理所有霉菌毒素[15]。
本研究旨在通过理性设计,获得对霉菌毒素降解能力提高的漆酶突变体。在经过比对后,选取了枯草芽孢杆菌(Bacillus subtilis)来源的漆酶BsCotA进行理性设计[16]。BsCotA具有较好的催化能力和碱性条件下的稳定性。然而异源表达的BsCotA存在表达量低、酸性条件下稳定性差等不足。同时BsCotA降解霉菌毒素需要介体ABTS的帮助,且BsCotA催化ABTS的最适pH值为4,属于酸性环境,这便存在矛盾之处,使得BsCotA催化霉菌毒素降解的能力表现不佳。这些不足使得BsCotA难以满足工业实际生产的需要[17],故本研究将关注漆酶的稳定性、表达量以及催化活力的提高,设计出能在酸性环境下稳定存在的突变体漆酶,以此来提高漆酶降解霉菌毒素的能力。
1 材料和方法
1.1 材料
1.1.1 实验材料
突变体漆酶基因由Genscript公司合成;野生型漆酶基因来源于B.subtilis cotA(基因NCBI的序列号为P07788.4);质粒pPICZαA、毕赤酵母菌株Pichia pastoris均由实验室保存。
1.1.2 试剂
ZeocinTM抗生素,美国赛默飞公司;PCR相关试剂,大连宝生物技术有限公司;ABTS、2,6-二甲基苯酚(2,6-dimethoxyphenol,2,6-DMP),美国西格玛公司;愈创木酚,上海源叶生物科技有限公司;酵母浸粉、胰蛋白胨,英国OXOID公司;Ampr、DNA Marker、Protein Marker,Biosharp公司;NaCl等其他试剂,国药公司。
1.1.3 培养基
LB (100 mL):称取NaCl 1 g,称取胰蛋白胨1 g,称取酵母浸粉0.5 g(配制固体培养基称取琼脂粉1.5 g),121 ℃高温高压灭菌20 min。
YPD (100 mL):称取胰蛋白胨2 g,称取酵母浸粉1 g(配制固体培养基称取琼脂粉1.5 g),121 ℃高温高压灭菌20 min,灭菌冷却后加入2 mL过滤除菌的50%葡萄糖溶液。
BMGY(buffered glycerol-complex medium)(100 mL):吸取甘油100 μL,称取胰蛋白胨2 g,称取酵母浸粉1 g,量取1 mol/L磷酸钾缓冲液10 mL,121 ℃高温高压灭菌20 min。
1.2 方法
1.2.1 漆酶蛋白结构模型的构建及理性设计
本研究选取源于芽孢杆菌的漆酶BscotA基因,作为构建突变体基因的野生型。从NCBI查询BsCotA的核苷酸序列及三维结构(ID:3ZDW),本文选定3个位点进行改造,以得到能在酸性条件下具高催化能力和较强稳定性的漆酶,突变体漆酶及其改造位点分别是:A344K(将第344位的丙氨酸突变为赖氨酸)、A317T(将第317位的丙氨酸突变为苏氨酸)以及T36Y(将第36位的苏氨酸突变为酪氨酸)。按照这3个突变位点,本文设计了4个漆酶突变体:漆酶CotAA344K(仅突变位点A344K)、漆酶CotAA317T(仅突变位点A317T)、漆酶CotAT36Y(仅突变位点T36Y)以及漆酶CotAgold(突变了位点A344K、A317T及T36Y)。在确定改造的位点后,本文借助Swiss-model预测并生成了突变体漆酶三维结构模型。
1.2.2 突变体菌株构建及筛选
本实验以漆酶cotA基因作为模板,利用PCR定点突变技术获得突变体漆酶基因。对于获得漆酶cotAA344K序列、cotAA317T序列、cotAT36Y序列的PCR反应体系(每个50 μL),成分如下:10 μL 5× Phanta缓冲液(含10 mmol/L MgSO4)、1 μL dNTP混合液(10 mmol/L each)、2 μL 正向引物、2 μL 反向引物、1 μL BscotA基因、34 μL ddH2O。获得漆酶CotAgold序列的PCR反应体系(每个50 μL)包括:10 μL 5× Phanta缓冲液(含10 mmol/L MgSO4)、1 μL dNTP混合液(10 mmol/L each)、6 μL 正向引物(每个突变位点的正向引物各2 μL)、6 μL 反向引物(每个突变位点的反向引物各2 μL)、1 μL BscotA基因、26 μL ddH2O。PCR使用的引物见表2。
表1 PCR使用引物
Table 1 PCR primers used in this study

引物名称引物序列引物大小/bpCotAA344K-Fgttccgggttaccaaaccgctttatcaaaaggatgaaagccgtaaac47CotAA344K-Rgtttacggctttcatccttttgataaagcggtttggtaacccggaac47CotAA317T-Fgagggagaatctataatacttactaacagcgcgggttg38CotAA317T-Rcaacccgcgctgttagtaagtattatagattctccctc38CotAT36Y-Fgtgaccatggaagaatgctatcaccagctgcaccgggac39CotAT36Y-Rgtcccggtgcagctggtgatagcattcttccatggtcac39
表2 酶动力学测定结果
Table 2 Enzyme kinetics measurement results
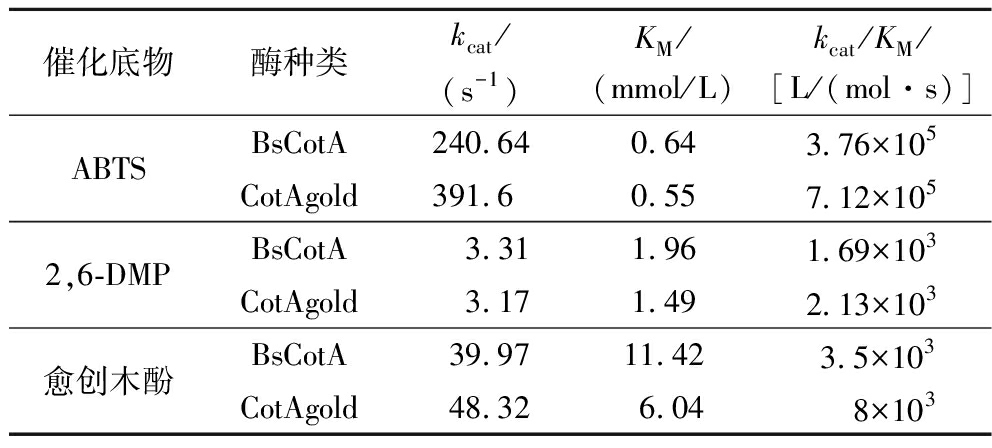
催化底物酶种类kcat/(s-1)KM/(mmol/L)kcat/KM/[L/(mol·s)]ABTSBsCotA240.640.643.76×105CotAgold391.60.557.12×1052,6-DMPBsCotA 3.311.961.69×103CotAgold3.171.492.13×103愈创木酚BsCotA39.9711.423.5×103CotAgold48.326.04 8×103
在验证PCR扩增结果后,我们将得到的产物进行酶切和纯化处理,然后进行无缝克隆,使得漆酶基因片段与载体pPICZαA连接。之后将克隆体转化至E. coli DH5α,并通过菌落PCR技术筛选阳性克隆子,提取重组表达载体质粒。最后,线性化重组载体质粒,并将其转化至P.pastoris,在选择性培养基中用抗生素Zeocin筛选阳性转化子。
1.2.3 突变体漆酶的诱导表达
突变体漆酶的诱导表达流程如图1所示。
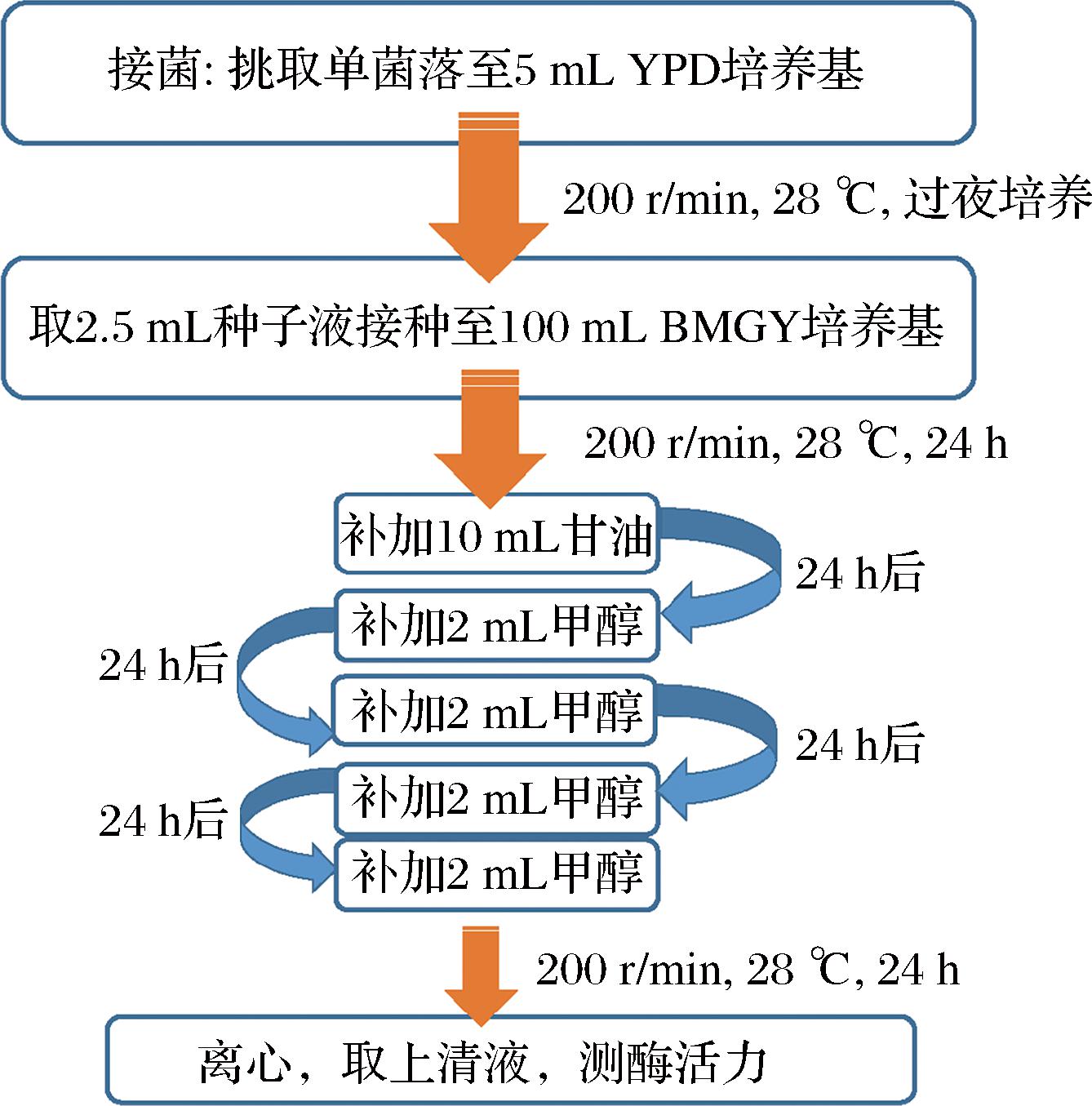
图1 毕赤酵母摇瓶诱导发酵流程
Fig.1 The induction fermentation process of P. pastoris
1.2.4 突变体漆酶的高密度发酵
首先,活化漆酶突变体的酵母表达宿主菌株甘油管,先在YPD平板上培养3~4 d,该平板带有氨苄青霉素、氯霉素和Zeocin抗生素。接着将这些活化的菌株接种至液体YPD培养基中,每瓶300 mL,分为3瓶,培养温度28 ℃,培养时间24 h,直到OD600达到20~25。随后,将种子液接种至5 L的发酵罐中,初始液量1.5 L,接种量10%~20%。发酵条件设置为温度30 ℃,pH值6.0,转速300 r/min,通气比1~2 vvm。在培养的10~12 h后,初始添加的20 g/L甘油会被耗尽,此时开始使用溶氧进料策略来控制溶氧。确保溶氧基线维持在大约20%左右,但不低于10%,峰值不超过60%左右。在此期间,如果溶氧基线下降,可以通过调整通气和搅拌来进行控制。当通气和搅拌已经达到最大程度,而溶氧无法控制时(OD600≥150),可以考虑开始诱导过程。在诱导开始前,停止添加甘油,进行1 h的饥饿处理,同时需要适度降低转速和减少通气以避免氧中毒(溶氧控制在50%~60%左右)。诱导过程开始时,首先添加质量浓度3 g/L甲醇(或者每1 h添加1 g/L,逐渐增加甲醇至3 g/L),此时pH值会上升。一旦甲醇消耗到较低浓度,再将甲醇质量浓度提高到3 g/L,继续观察pH变化。当pH开始正常下降时,稳定甲醇质量浓度在5~10 g/L(不能太低也不能太高)。最好在诱导过程中使用气相色谱检测甲醇浓度,整个诱导阶段的时间大约为96 h。诱导完成后,可停止发酵过程并将发酵液下罐。下罐后的发酵液具有酶活性,可以经过离心、纯化等处理步骤。
1.2.5 突变体漆酶的分离纯化
蛋白分离纯化的方法采用了镍柱纯化。首先,将经过发酵和抽滤处理的待纯化上清液在4 ℃冰箱中透析缓冲液的条件下过夜透析。随后,将透析后的样品与镍珠混合,放置在摇架上处理1 h,确保充分混匀,使酶蛋白与镍珠结合。接下来,将结合好的蛋白样品加入重力柱中,使用清晰缓冲液进行3次左右的冲洗。随后,使用洗脱缓冲液进行冲洗,并收集冲下的样品。接着,将收集的样品使用超滤管在4 ℃条件下进行超滤浓缩,以5 000×g的速度进行10 min,直到浓缩至目标体积。随后,再次将收集好的样品进行透析处理,保持在4 ℃下,透析时间为2 h。最后,将经透析处理后的样品使用液氮进行冻存,以备后续使用。这一系列步骤用于获得纯化的目标蛋白。
1.2.6 酶活性测定
在2 mL微量离心管中,加入200 μL pH 4的BR缓冲液,并添入10 μL 0.1 mol/L ABTS,然后用涡旋仪充分混匀,以确保ABTS的终浓度为5 mmol/L。随后,将实验组和对照组都放在70 ℃的金属浴上预热2 min。在预热后,依次向实验组中加入3 μL待测漆酶酶液,每次间隔15 s,然后放回金属浴中反应5 min。按照相同的时间间隔,依次取出样品,并加入等体积的甲醇以终止反应。对照组也以相同方式处理。从终止后的反应液中取出200 μL,加入96孔板中,在酶标仪上读取OD420。根据实验组和对照组的OD420计算酶活性。其酶活性计算如公式(1)所示
酶活性![]()
(1)
式中:ΔOD,反应前后吸光度变化;ξ,36 000 L/(mol·cm);T,时间,min;ρ,蛋白含量,μg/mL;V酶,酶的用量体积,μL;V反应体系,整个反应体系的体积,μL。
1.2.7 野生型漆酶及突变体漆酶的酶学性质分析
1.2.7.1 最适pH及pH稳定性
首先从诱导发酵后获得的酶液中取样,分装成7管。随后,使用酶稀释液将待测酶液稀释至2.2 μg/mg。为进行不同pH值的反应,配制pH值为2~8的反应液,其中底物为5 mmol/L的ABTS。在70 ℃条件下进行漆酶催化反应,反应时间5 min。反应结束后,加入等体积的甲醇以终止反应,并将终止后的反应液装入酶标条,使用酶标仪读取OD420,进而计算不同pH值下漆酶的酶活性。pH稳定性的研究,同样从诱导发酵后获得的酶液中取样,分装成11管。将这些酶液分别置于pH值为2~12的缓冲液中,孵育0.5 h后取出酶液,随后将酶液与ABTS反应,以测定酶活性。
1.2.7.2 最适温度及温度稳定性
先从诱导发酵后获得的酶液中取样,分装成7管。然后,使用酶稀释液将漆酶酶液稀释至100倍。为进行不同温度下的反应,配用pH值为4的反应液,其中底物为5 mmol/L的ABTS。分别在30、40、50、60、70、80、90 ℃进行漆酶催化反应,反应时间5 min。反应结束后,添加等体积的甲醇以终止反应,随后将反应液装入酶标条,使用酶标仪读取OD420,从而计算不同温度下漆酶的酶活性。为进行温度稳定性的研究,同样从诱导发酵后获得的酶液中取样,分装成7管。然后,将这些酶液分别置于30、40、50、60、70、80、90 ℃的水浴锅中,经过0.5 h的水浴后取出酶液。让酶液在室温下降温。随后,将酶液与ABTS反应,以测定酶活性。
1.2.8 酶学动力参数测定
取纯化后的漆酶CotAgold酶液,使用酶稀释液将CotAgold酶液分别稀释至5.7、1.73、0.57、0.173、0.057、0.017 3 mg/mL的蛋白浓度梯度。进行酶活测定,配制pH值为4底物为5 mmol/L的ABTS的反应液、pH值为6底物为5 mmol/L的2,6-DMP的反应液和pH值为7底物为5 mmol/L的愈创木酚的反应液。不同浓度的漆酶加入反应,反应时间为5 min。终止反应后,加入等体积的甲醇,然后将反应液装入酶标条中,使用酶标仪分别读取OD420(对于ABTS反应)和OD470(对于2,6-DMP和愈创木酚反应)。计算不同浓度下漆酶的酶活性,挑选蛋白浓度为0.057 mg/mL漆酶酶液作为测定动力学测定的反应酶量。进一步,配制不同浓度ABTS、2,6-DMP和愈创木酚的反应液,浓度梯度为:0、0.1、0.2、0.5、1、2、5、10 mmol/L。将300倍稀释的酶液加入在70 ℃反应5 min。终止反应后,加入等体积的甲醇,并读取OD420、OD470,计算出酶活力。使用GraphPad软件,拟合出动力学曲线,得到KM、Vmax,进一步计算kcat。
1.2.9 突变体漆酶的降解霉菌毒素
在本实验中,首先进行了必要的准备工作,包括准备纯化后的漆酶CotAgold酶液、测定出漆酶CotAgold降解霉菌毒素的最适pH(最适pH 的测定方法同1.2.7.1节)、制备10 mg/mL的AFB1、ZEN溶液,以及准备0.1%甲酸-水(流动相A)和纯乙腈(流动相B)。随后,进行了酶降解实验,在实验组中分别添加10 U/mL酶活力的CotAgold催化霉菌毒素的降解。反应体系配制包括pH值为4缓冲液、AFB1、ZEN溶液,1 mmol/L ABTS介体,反应体系总体积为100 μL。反应体系分别置于70 ℃,分别进行12 h的反应,然后加入甲醇终止反应。最后,为进行HPLC分析,制备了样品。这包括配制霉菌毒素标准液,稀释至合适的浓度,并经过高速离心和过滤。配制好的标准品溶液和反应后的样品被装填至色谱瓶,做好标记,再使用HPLC进行分析。
2 结果与分析
2.1 漆酶突变体的结构模拟及突变位点的分析
芽孢杆菌来源的漆酶BsCotA异源表达后表现对酸性耐受差,而BsCotA催化多种底物时需要ABTS的帮助,且BsCotA利用ABTS的最适pH值为4,这正与其不耐受酸性产生冲突,导致了BsCotA表现出的催化能力差强人意。故本研究对BsCotA进行理性设计做出增加结构内的氢键的改造(图2为4种突变体漆酶的三维模型构建的结果),以此来提高酶蛋白在酸性条件下的稳定性,使得改造后的突变体漆酶可以做到在酸性条件下高效、稳定利用介体进行催化,从而在应用场景中有更高效的表现。本研究基于对BsCotA蛋白结构的分析。重点关注关键的loop区域,遍历整个蛋白质结构以后,共找到3个具有形成氢键可能性的位点,针对其改造后形成以下突变体:CotAA344K、CotAA317T、CotAT36Y,及一个突变整合体CotAgold。图2-a为突变体漆酶CotAA344K的三维结构及突变的氨基酸位点A344K,用带正电荷的赖氨酸替换了不带电荷的丙氨酸,替换后赖氨酸的带正电的侧链基团能与187位的谷氨酸侧链基团的羟基形成氢键;图2-b为突变体漆酶CotAA317T的三维结构及突变的氨基酸位点A317T,丙氨酸被替换位亲水的苏氨酸,替换后苏氨酸的羟基能够与322位的天冬酰胺的酰胺基形成氢键;图2-c为突变体漆酶CotAT36Y的三维结构及突变的氨基酸位点T36Y,丝氨酸被替换为酪氨酸,酪氨酸的基团更大,替换后酪氨酸的酚羟基能与远处47位的精氨酸的侧链基团形成氢键;图2-d为突变体漆酶CotAgold的三维结构及突变的氨基酸位点A344K、A317T、T36Y,当3个位点被替换后,能各自发挥其对于结构的作用,实验结果显示三者间并未发现明显拮抗作用,使得漆酶CotAgold在酸性条件下的稳定性、催化能力、表达量均得到提高。
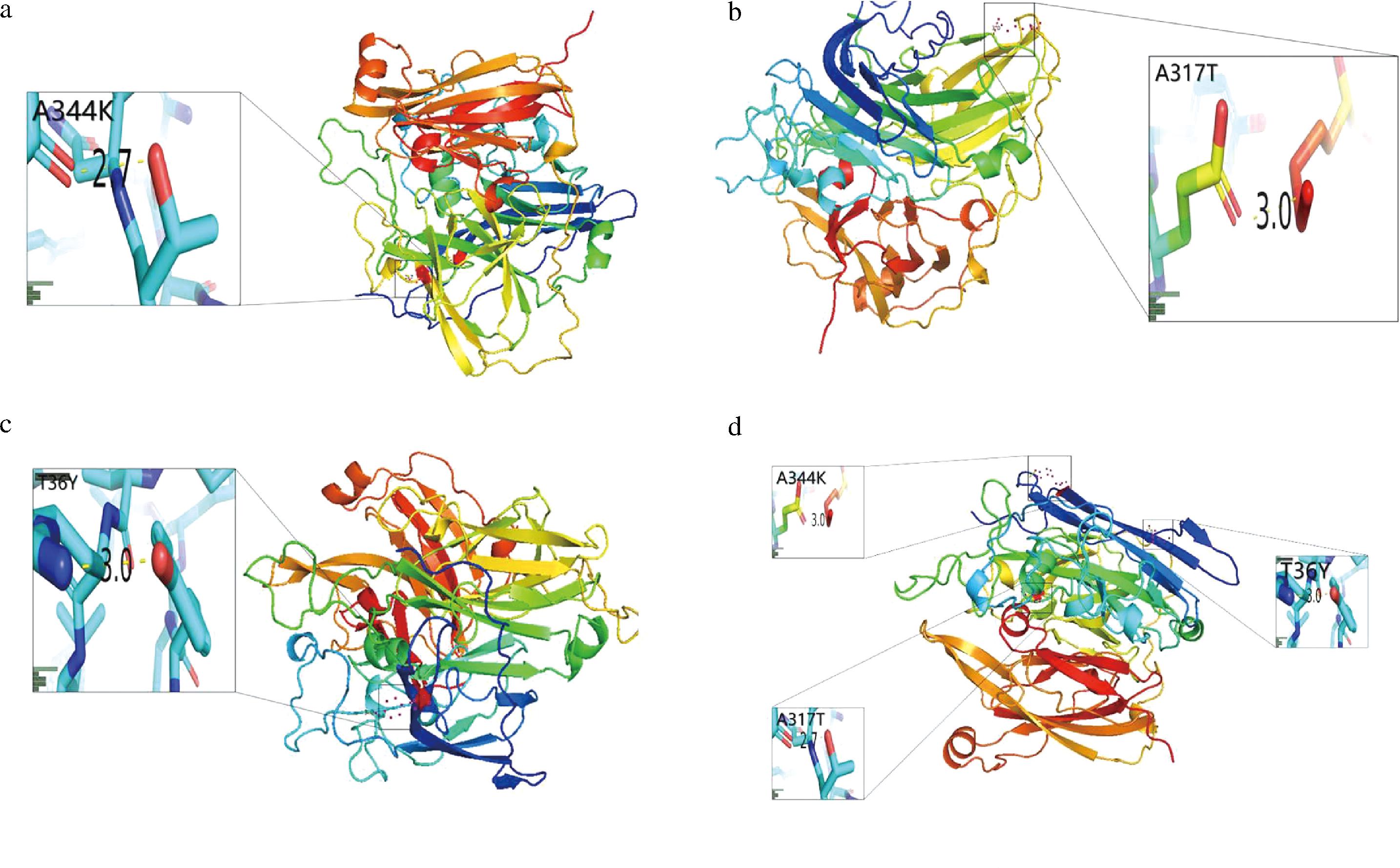
a-突变体漆酶CotAA344K的三维结构及突变的氨基酸位点A344K;b-突变体漆酶CotAA317T的三维结构及突变的氨基酸位点A317T;c-突变体漆酶CotAT36Y的三维结构及突变的氨基酸位点T36Y;d-突变体漆酶CotAgold的三维结构及突变的氨基酸位点A344K、A317T、T36Y
图2 突变体漆酶的三维结构及突变氨基酸的定位
Fig.2 The three-dimensional structure of mutant laccase and the localization of mutated amino acids
2.2 突变体漆酶基因的获得及表达菌株的构建
漆酶突变体基因的构建结果如图3所示。图3-a为通过PCR定点突变技术获得的漆酶突变体基因:cotAA344K、cotAA317T、cotAT36Y和cotAgold经过纯化后的核酸电泳结果,4个漆酶突变基因的大小均为1 581 bp。如图3-b和图3-c所示,4个漆酶突变基因的表达载体及野生型漆酶基因cotA表达载体的大小均为5 082 bp。
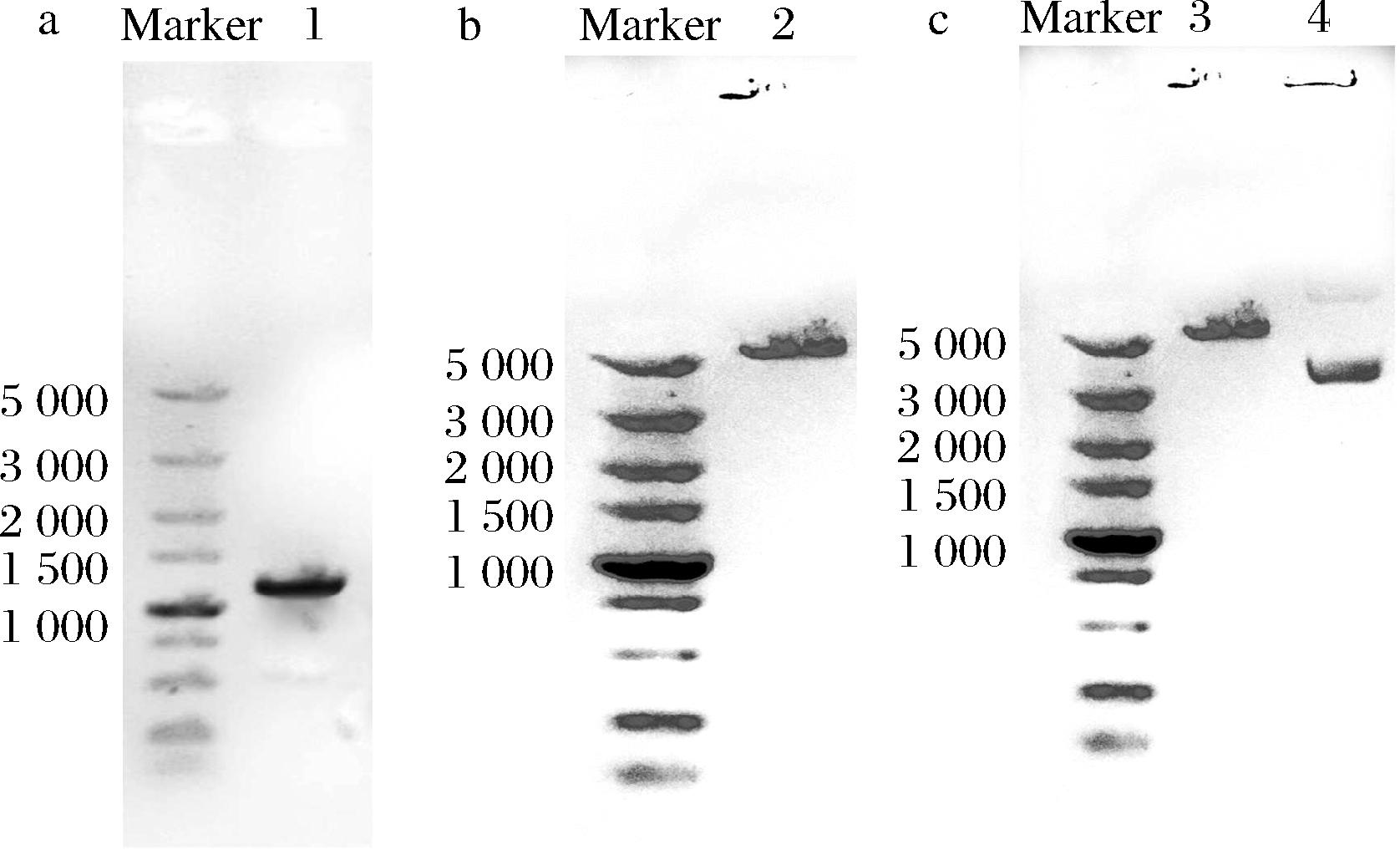
a-4个突变体基因经纯化核酸电泳结果;b-构建毕赤酵母表达质粒所用特异性载体pPICZαA质粒的核酸电泳结果;c-构建完成的漆酶突变基因表达载体的核酸电泳结果
图3 表达载体的构建
Fig.3 Construction of expression vector
注:Marker-5 000 bp DNA Marker;泳道1-目的片段的酶切胶回收结果;泳道2-pPICZαA载体的酶切胶回收结果;泳道3-漆酶突变体表达载体酶切验证结果;泳道4-漆酶突变体表达载体质粒。
2.3 突变体漆酶的诱导表达及分离纯化
2.3.1 突变体漆酶的诱导表达
图4为5株漆酶突变体重组酵母诱导发酵产物的SDS-PAGE分析,BsCotA蛋白在毕赤酵母中无法大量表达,CotAA344K、CotAA317T、CotAT36Y和CotAgold蛋白均显示出明显的表达,其中以CotAgold的表达量最高,经考斯马亮蓝法测定,CotAgold发酵上清液的蛋白质质量浓度为113 μg/mL。同时使用ABTS作为底物对5个漆酶突变体进行酶活性测定,测定的结果为:0.1 U/mL(BsCotA)、18 U/mL(CotAA344K)、12 U/mL(CotAA317T)、12 U/mL(CotAT36Y)、32 U/mL(CotAgold)。
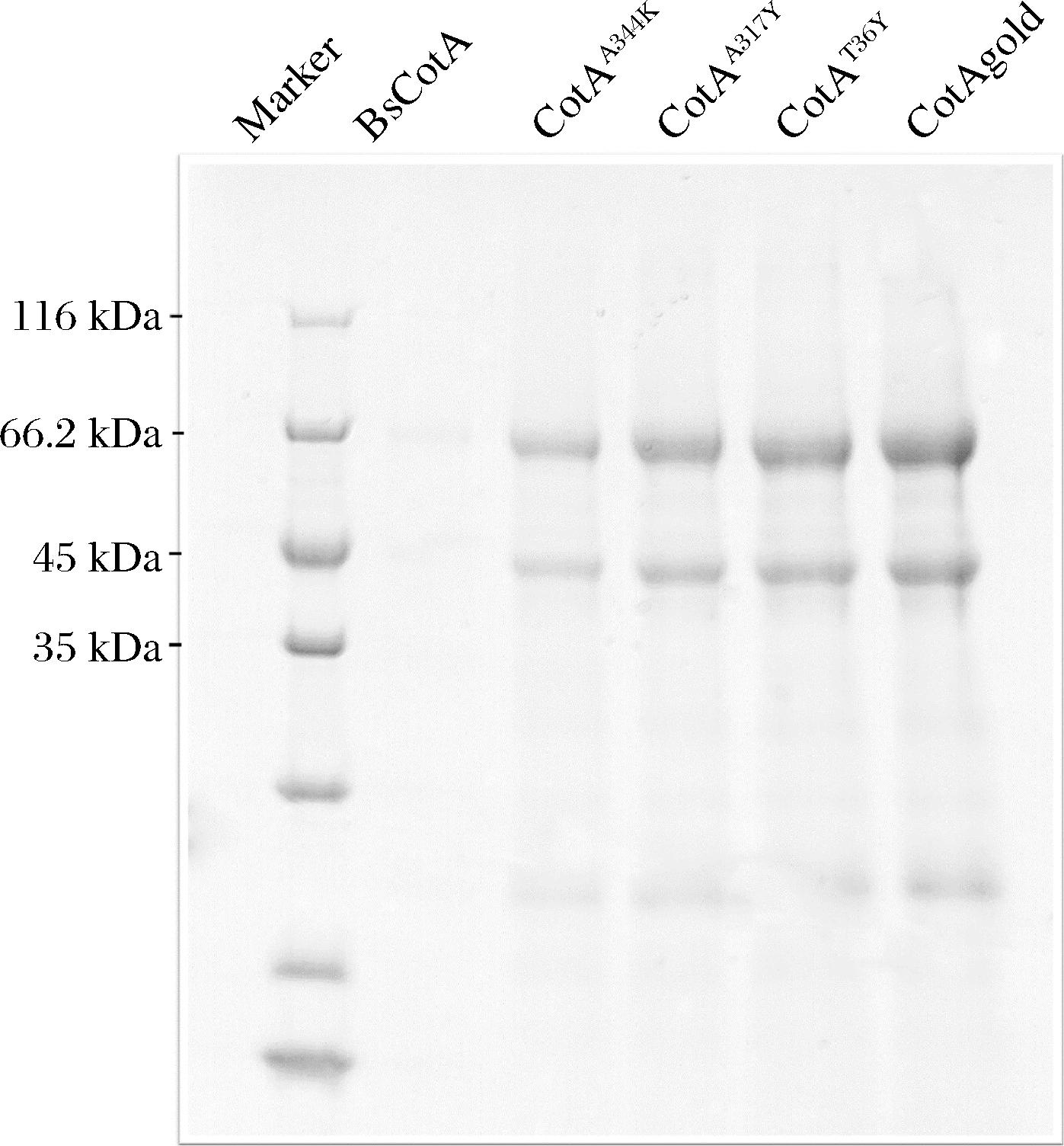
图4 突变体漆酶重组毕赤酵母诱导发酵上清液的SDS-PAGE分析
Fig.4 SDS-PAGE analysis of mutant laccase recombinantP.pastoris induced fermentation supernatant
注:Marker-低分子质量蛋白质Marker(图5、图6同)。
2.3.2 突变体漆酶的高密度发酵
基于前文对5种菌株在摇瓶中的诱导表达结果——漆酶CotAgold表现出最高的酶活性及最高的表达量,因此,本文选择了漆酶CotAgold的表达宿主进行高密度发酵。在高密度发酵过程中,该菌株的生长截止时间被设定为34 h,随后,每隔约12 h取样,处理后进行SDS-PAGE分析。如图5所示,随着时间的推移,漆酶CotAgold的产量逐渐增加,但在进入诱导阶段96 h后(全程第130 h),产量没有明显增加。因此,选择在这一时间点结束高密度发酵。通过考马斯亮蓝法测定,发酵上清液的蛋白质质量浓度为2.2 mg/mL,同时使用ABTS作为底物进行酶活力测定,测定结果为933 U/mL。
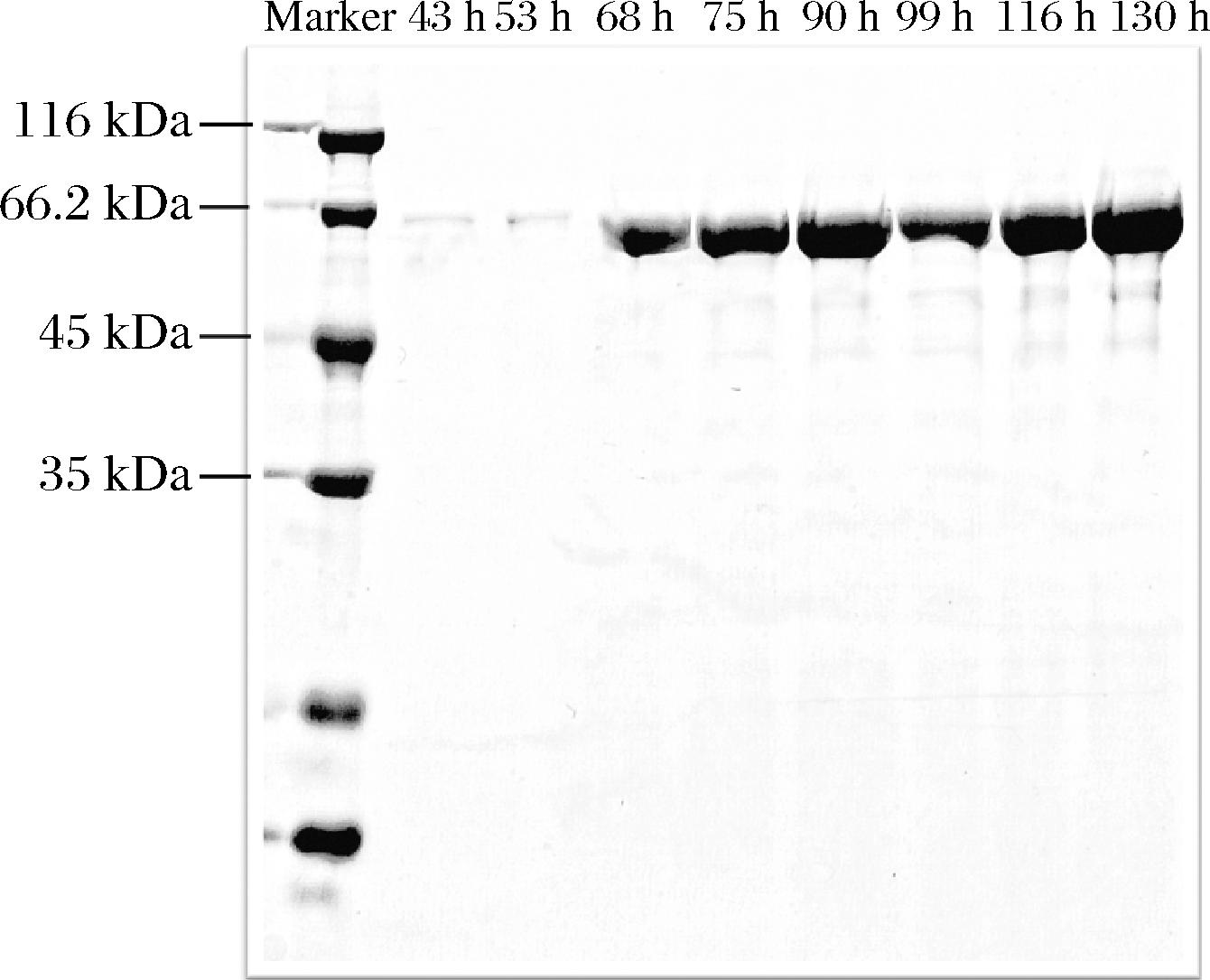
图5 P.pastoris/CotAgold高密度发酵上清液的SDS-PAGE分析
Fig.5 SDS-PAGE analysis of P.pastoris/CotAgold high-density fermentation supernatant
注:泳道1~8是重组酵母P.pastoris/CotAgold高密度发酵上清液不同时间所取的样,28 h进入诱导阶段。
2.3.3 突变体漆酶的分离纯化
图6为重组酵母P.pastoris/CotAgold 高密度发酵上清液纯化样品的SDS-PAGE分析结果,其中目标蛋白漆酶CotAgold的相对分子质量为66 kDa,纯化样品相对于总样品的浓度显著增加,杂蛋白的含量明显降低。此外,经过纯化后的蛋白溶液呈淡蓝色,透明清澈,表明发酵液中的菌体碎片和某些带有颜色的大分子物质也被去除了。同时使用ABTS作为底物进行酶活力测定,纯化后的漆酶CotAgold的酶活力达到了99.4 U/mL。
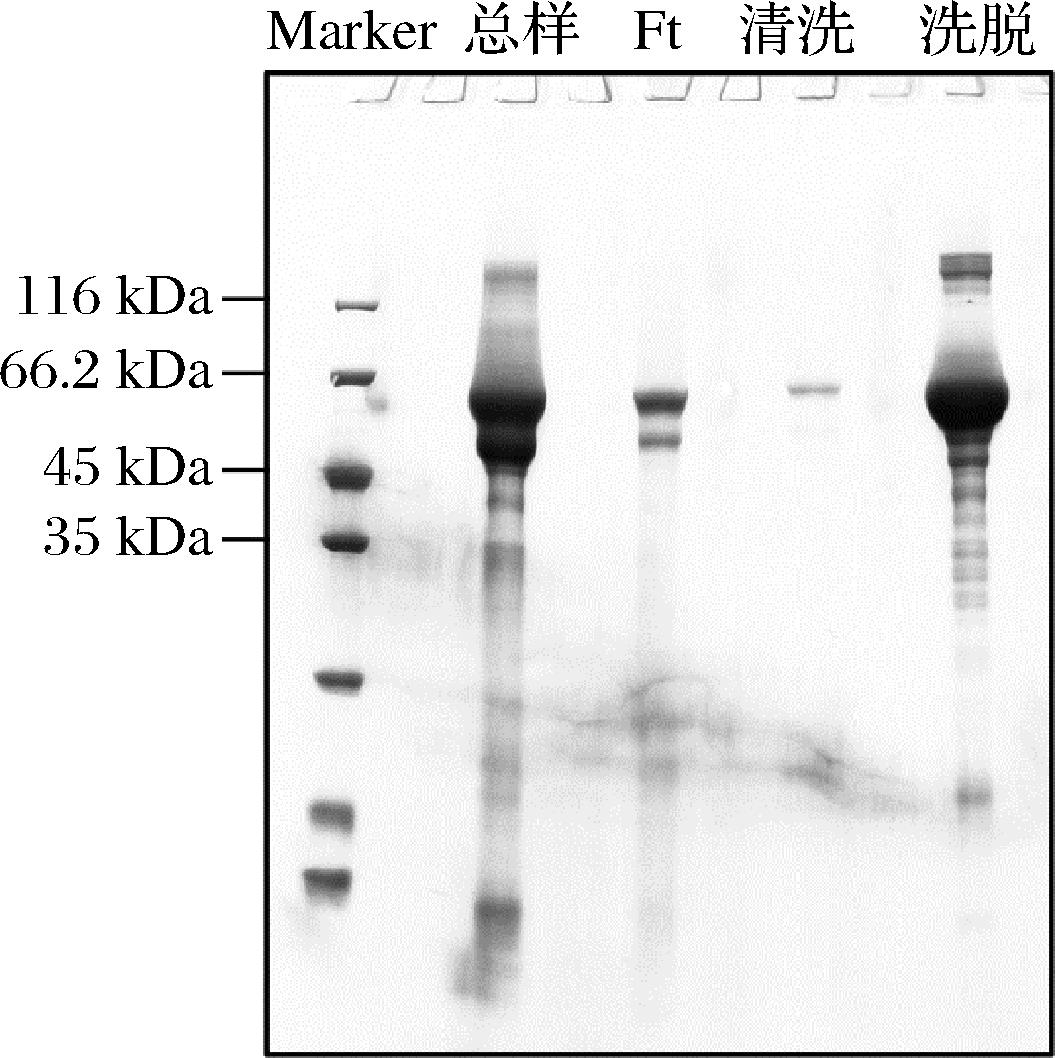
图6 P.pastoris /CotAgold 高密度发酵上清液纯化样品的SDS-PAGE分析
Fig.6 SDS-PAGE analysis of purified samples from high-density fermentation supernatant of P.pastoris/CotAgold
注:总样-高密度发酵的上清液;Ft-透析处理后所取样品;清洗-冲洗杂蛋白步骤中所取样品;洗脱-收集蛋白步骤中所取样品。
2.4 野生型和突变体漆酶的酶学性质分析
2.4.1 最适反应pH及最适反应温度
图7-a显示,野生型漆酶BsCotA和各突变体漆酶、对于ABTS的最适催化条件在基本一致。它们的最适反应pH值均为4。图7-b显示,野生型漆酶和突变体漆酶的最适反应温度也一致,均为70 ℃。
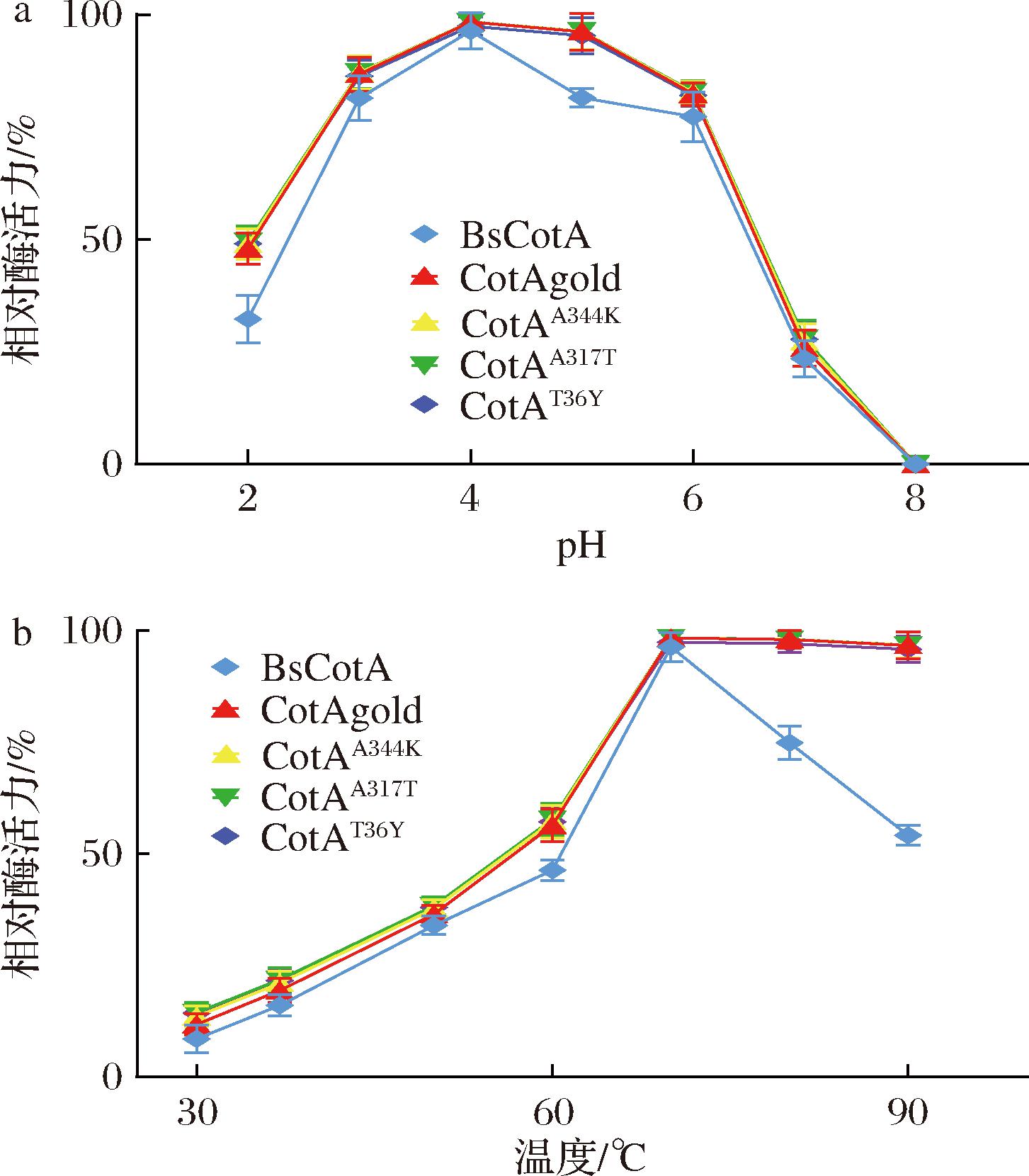
a-最适pH;b-最适温度
图7 突变体漆酶的最适pH及最适温度测定结果
Fig.7 Determination of the optimal pH and temperature of mutant laccase
注:最适反应条件下的酶活力为100%。
2.4.2 pH稳定性及温度稳定性
如图8-a所示,突变体漆酶CotAgold相对于野生型漆酶BsCotA在耐受强酸方面表现出明显的提高。野生型漆酶在pH≤3的环境下处理后,酶活力明显下降,残余酶活力不足20%。而突变体漆酶中表现最佳的CotAgold经过强酸处理后酶活力也能保持在70%以上。图8-b结果显示,野生型漆酶BsCotA在温度达到60 ℃后,酶活力明显下降,残余酶活力不足50%,经过70 ℃处理后,BsCotA丧失了催化能力。而突变体漆酶表现出较佳的耐高温能力,尤其是CotAgold,在经过90 ℃处理后,残余酶活力仍保持在95%以上。直至95 ℃处理后,酶活力才出现了明显下降,但仍有72%的残余酶活力。
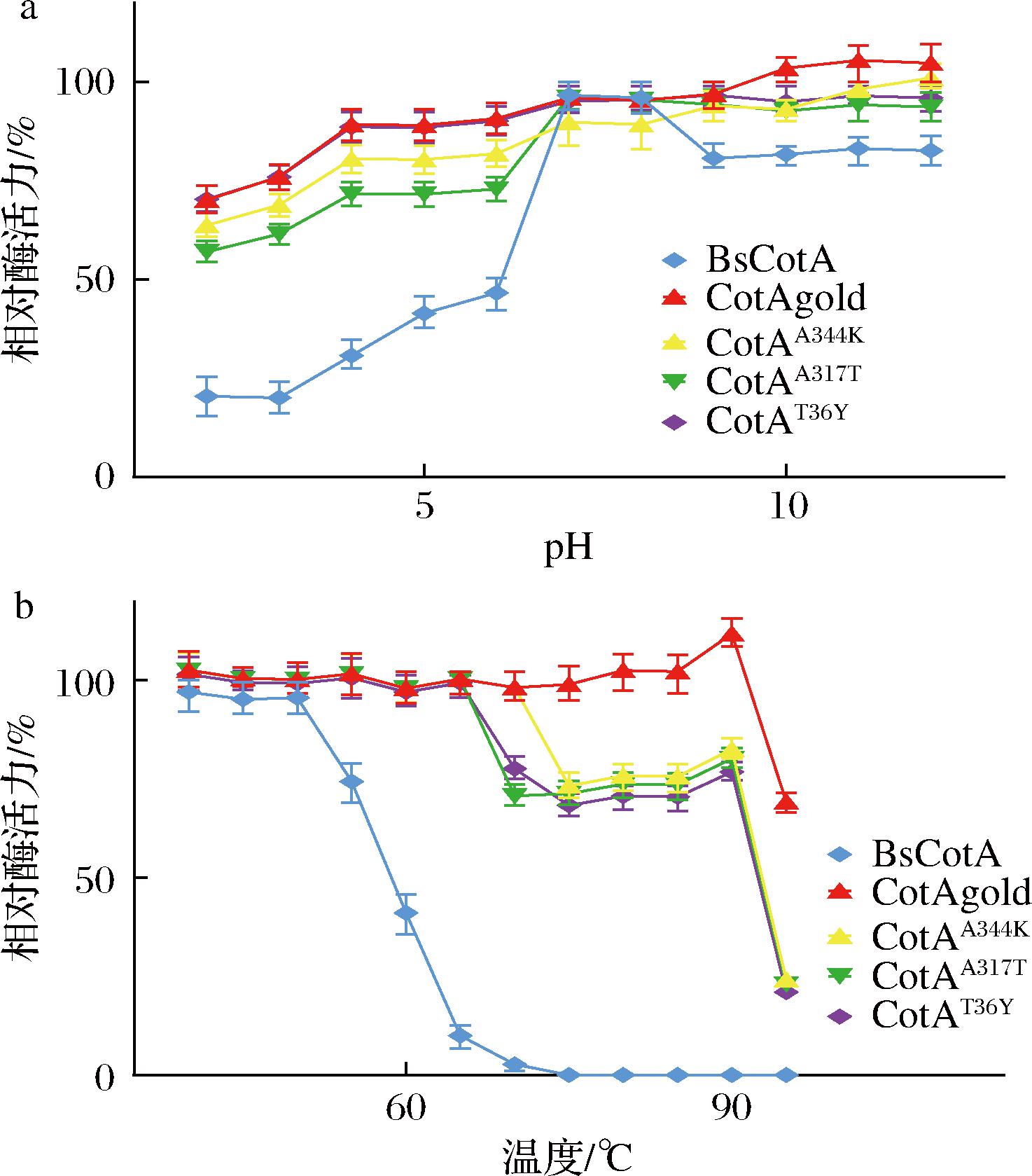
a-pH稳定性;b-温度稳定性
图8 突变体漆酶的pH及温度稳定性测定结果
Fig.8 Determination of pH and temperature stability of mutant laccase
注:未经处理的酶液反应的酶活力为100%。
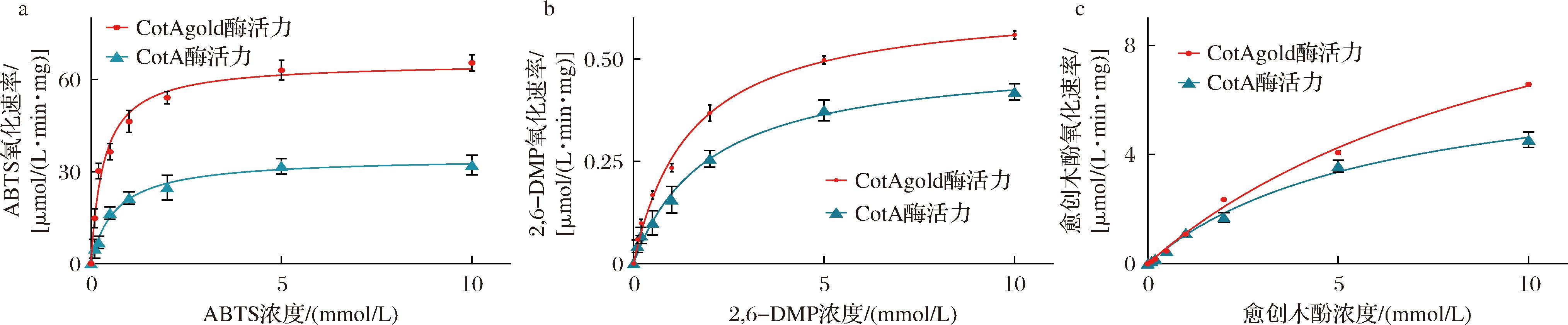
a-催化ABTS;b-催化2,6-DMP;c-催化愈创木酚
图9 漆酶CotAgold催化ABTS、2,6-DMP、愈创木酚分解的动力学测定结果
Fig.9 Kinetic measurement results of the decomposition of ABTS,2,6-DMP,guaiacol catalyzed by laccase CotAgold
2.4.3 动力学参数分析
如图9所示,为漆酶CotAgold及BsCotA催化ABTS、2,6-DMP、愈创木酚降解的动力学拟合曲线。如表2所示,为漆酶CotAgold及BsCotA催化ABTS、2,6-DMP、愈创木酚的酶动力学参数。
综上所述,漆酶CotAgold 相较于BsCotA在对于适宜漆酶催化的多种底物催化能力均有明显提高,且漆酶对于ABTS的底物亲和力最佳。
2.5 突变体漆酶对霉菌毒素的降解
根据图10-a的结果可知,漆酶CotAgold降解AFB1的最适pH值为4,在此条件下能做到对500 μg/mL的AFB1的完全降解,而在中性条件下则表现为难以降解;漆酶CotAgold降解ZEN的最适pH值为4,在此条件下能做到对500 μg/mL的ZEN的完全降解,而同样在中性条件下无法做到降解。表现出的pH偏好性与CotAgold对于ABTS的催化偏好性相一致。

a-突变体漆酶CotAgold催化霉菌毒素的最适pH的结果;b-突变体漆酶CotAgold催化ZEN降解的HPLC结果;c-突变体漆酶CotAgold催化AFB1降解的HPLC结果
图10 漆酶CotAgold催化霉菌毒素降解最适pH及与其与BsCotA降解产物的HPLC分析结果比对
Fig.10 Optimal pH for the degradation of mycotoxins catalyzed by laccase CotAgold and comparison of HPLC analysis results with BsCotA degradation products
根据图10-c的HPLC分析的结果可知,AFB1的特征峰出现在18 min左右,经过CotAgold处理的样品中,则未被检测出AFB1的特征峰(阈值:0.1 μg/mL),取而代之的是在15~16 min时间段内出现了两个新的产物峰。与之相反的是,BsCotA处理的产物,AFB1的特征峰仍能被检测到,且峰面积仅减小了5%。表明漆酶CotAgold成功降解了AFB1,并产生了新的产物,而漆酶BsCotA则无法做到对AFB1的明显降解。根据图10-b的HPLC分析结果可知,ZEN的特征峰出现在22 min左右,CotAgold未检测出ZEN的特征峰(阈值0.1 μg/mL),且在8~18 min的时间段中出现了3个新的产物峰。与之相反的是,野生型BsCotA处理后,ZEN的特征峰仍能被检测到,且峰面积仅减小了3%。表明漆酶CotAgold能够成功降解了ZEN,并产生了新的产物;而野生型BsCotA对ZEN的未发现明显降解。综上所述,漆酶CotAgold能做到降解500 μg/mL的AFB1和ZEN。
3 讨论
在全球范围内,霉菌毒素的安全问题已成为公共健康关注的重点,尤其是在农业产品安全和食品加工领域。尽管现有的霉菌毒素处理方法多种多样,包括物理方法的吸附以及化学方法的转化,但它们往往无法完全消除毒素或可能对环境产生负面影响。因此,开发既环保又高效的霉菌毒素降解策略正变得十分迫切。生物酶解法,特别是利用漆酶的酶催化过程,因其具有特有的环境友好性和高效性,受到了广泛的关注。然而,天然存在的漆酶常因其性质限制而难以满足实际应用的需求。所以本研究基于BsCotA选取了3个位点进行突变,构建了4个漆酶突变体,以克服野生型漆酶在霉菌毒素降解应用中的不足。
本研究首先明确了野生型漆酶在霉菌毒素降解应用上的限制因素,包括低活性、低产量及在酸性条件下的不稳定性,这些因素阻碍了其在实际应用中的效率。通过对BsCotA的关键位点A344、A317和T36进行精准突变,构建了4个突变体,以增强酶的活性、稳定性和酸性耐受性。通过对这4个突变体的催化活性、表达量和酶学性质的综合分析,发现CotAgold表现出最优异的特性,包括在体积比酶活力上320倍的提升、在表达量上高达2.2 mg/mL的水平、在酸性和高温条件下明显的稳定性增强。结果证实了本文选取的3个突变位点:A344K、A317T、T36Y改造后能够有效提高蛋白质结构的稳定性。同时由于在对酸性的耐受性的提高,使得漆酶CotAgold能在介体ABTS的最适pH值为4时下更高效地催化其氧化,从而表现出更好的催化能力[18-19]。相较于国外相关研究中所获得的霉菌毒素降解酶,虽然提高了酶的活性但其在酸性条件下这种改造酶的稳定性却并不理想,且产量也相对较低。故漆酶CotAgold在世界同类研究中具有领先的优势。
霉菌毒素降解实验的结果表明,CotAgold能在介体ABTS的帮助下完成对AFB1和ZEN的充分降解,相较于BsCotA在介体的帮助下只能降解5%~10%的霉菌毒素,有了显著的提高,这无疑证明了本研究的改造思路的可行性。同时CotAgold能够在实验室条件下实现将AFB1、ZEN污染的产物脱毒,这为潜在的应用提供了重要的参考和可能性。在食品和饲料加工领域,突变体漆酶可以提高产品的安全性,降低霉菌毒素的残留。此外,它们还可以在环境保护领域中用于处理受霉菌毒素污染的土壤和水体,有助于减轻霉菌毒素对生态系统的危害[20]。
综上所述,突变体漆酶的改造成果为霉菌毒素降解提供了新的途径,具有广泛的应用前景。在工业生产中,突变体漆酶有望成为霉菌毒素降解领域的重要工具,解决霉菌毒素污染问题,提高产品的质量和安全性。这些结果突出了本研究的重要性,也为未来的研究提供了有价值的方向。
[1] HOVE M, VAN POUCKE C, NJUMBE-EDIAGE E, et al.Review on the natural co-occurrence of AFB1 and FB1 in maize and the combined toxicity of AFB1 and FB1[J].Food Control, 2016, 59:675-682.
[2] LI S H, MUHAMMAD I, YU H X, et al.Detection of aflatoxin adducts as potential markers and the role of curcumin in alleviating AFB1-induced liver damage in chickens[J].Ecotoxicology and Environmental Safety, 2019, 176:137-145.
[3] BANU I, LUPU A C, APRODU I.Degradation of zearalenone by laccase enzyme[J].Scientific Study &Research:Chemistry &Chemical Engineering, Biotechnology, Food Industry, 2014, 14(2):79-84.
[4] CHAN-CHENG M, CAMBRONERO-HEINRICHS J C, MAS S-MORA M, et al.Ecotoxicological test based on inhibition of fungal laccase activity:Application to agrochemicals and the monitoring of pesticide degradation processes[J].Ecotoxicology and Environmental Safety, 2020, 195:110419.
S-MORA M, et al.Ecotoxicological test based on inhibition of fungal laccase activity:Application to agrochemicals and the monitoring of pesticide degradation processes[J].Ecotoxicology and Environmental Safety, 2020, 195:110419.
[5] MATUMBA L, MONJEREZI M, CHIRWA E, et al.Natural occurrence of AFB1 in maize and effect of traditional maize flour production on AFB1 reduction in Malawi[J].African Journal of Food Science, 2009, 3:413-425.
[6] ATACAG ERKURT H.Biodegradation and detoxification of BPA:Involving laccase and a mediator[J].CLEAN-Soil, Air, Water, 2015, 43(6):932-939.
[7] ASHE B, NGUYEN L N, HAI F I, et al.Impacts of redox-mediator type on trace organic contaminants degradation by laccase:Degradation efficiency, laccase stability and effluent toxicity[J].International Biodeterioration &Biodegradation, 2016, 113:169-176.
[8] KUNAMNENI A, BALLESTEROS A, PLOU F J, et al.Fungal laccase: A versatile enzyme for biotechnological applications[J].Communicating Current Research and Educational Topics and Trends in Applied Microbiology, 2007, 1:233-245.
[9] PATEL N, SHAHANE S, SHIVAM, et al.Mode of action, properties, production, and application of laccase:A review[J].Recent Patents on Biotechnology, 2019, 13(1):19-32.
[10] SINGH ARORA D, KUMAR SHARMA R.Ligninolytic fungal laccases and their biotechnological applications[J].Applied Biochemistry and Biotechnology, 2010, 160(6):1760-1788.
[11] SENTHILVELAN T, KANAGARAJ J, PANDA R C.Effective bioremoval of syntan using fungal laccase to reduce pollution from effluent[J].International Journal of Environmental Science and Technology, 2018, 15(7):1429-1440.
[12] VISWANATH B, RAJESH B, JANARDHAN A, et al.Fungal laccases and their applications in bioremediation[J].Enzyme Research, 2014, 2014:163242.
[13] LIU Y L, MAO H J, WOLDEMARIAM YOHANNES K, et al.Degradation of aflatoxin B1 by a recombinant laccase from Trametes sp.C30 expressed in Saccharomyces cerevisiae:A mechanism assessment study in vitro and in vivo[J].Food Research International, 2021, 145:110418.
[14] ZHOU Z M, LI R K, NG T B, et al.A new laccase of lac 2 from the white rot fungus Cerrena unicolor 6884 and lac 2-mediated degradation of aflatoxin B1[J].Toxins, 2020, 12(8):476.
[15] GUO Y P, QIN X J, TANG Y, et al.CotA laccase, a novel aflatoxin oxidase from Bacillus licheniformis, transforms aflatoxin B1 to aflatoxin Q1 and epi-aflatoxin Q1[J].Food Chemistry, 2020, 325:126877.
[16] MATE D M, ALCALDE M.Laccase engineering:From rational design to directed evolution[J].Biotechnology Advances, 2015, 33(1):25-40.
[17] WANG X L, BAI Y G, HUANG H Q, et al.Degradation of aflatoxin B1 and Zearalenone by bacterial and fungal laccases in presence of structurally defined chemicals and complex natural mediators[J].Toxins, 2019, 11(10):609.
[18] XU F.Effects of redox potential and hydroxide inhibition on the pH activity profile of fungal laccases[J].The Journal of Biological Chemistry, 1997, 272(2):924-928.
[19] FABBRINI M, GALLI C, GENTILI P.Comparing the catalytic efficiency of some mediators of laccase[J].Journal of Molecular Catalysis B:Enzymatic, 2002, 16(5-6):231-240.
[20] SONG Y Y, WANG Y N, GUO Y P, et al.Degradation of zearalenone and aflatoxin B1 by Lac2 from Pleurotus pulmonarius in the presence of mediators[J].Toxicon:Official Journal of the International Society on Toxinology, 2021, 201:1-8.