柚皮素是柑橘类水果(如西柚、柠檬等)中广泛存在的一种天然黄酮类化合物,具有抗氧化、清除自由基、调节酶活性和基因表达等性质[1]。近期研究表明,柚皮素可用于癌症、代谢综合征、退行性疾病的治疗,并且具有免疫调节和抗炎活性[2],应用前景广阔。然而,柚皮素本身疏水性强,水溶性差,且口服利用度相对较低,这极大地影响了它的效力并限制了其应用。因此,建立一种简单、高效的柚皮素递送方法具有重要研究意义和应用价值。
目前,用于递送柚皮素的方法主要包括聚合物纳米颗粒、微胶束、脂质体、纳米混悬液和纳米乳液等,其中聚合物纳米颗粒由于其独特的理化和生物性质而备受关注[3]。作为常用的纳米颗粒制备材料,玉米醇溶蛋白因其特有的疏水性而易于通过脱溶剂等方式被转化为纳米颗粒。然而,玉米醇溶蛋白的这种疏水性也导致所形成的胶体颗粒不稳定,易于在水媒介中发生聚集[4]。因此,为了避免该问题,通常使用蛋白质、多糖或多肽等稳定玉米醇溶蛋白纳米颗粒。近年来,玉米醇溶蛋白的这类复合纳米颗粒已广泛用于食品功能因子的递送。例如,JIANG等[5]使用玉米醇溶蛋白-海藻酸盐寡糖复合纳米颗粒递送姜黄素以用于姜黄素在胃肠道内的缓释;ZHANG等[6]使用玉米醇溶蛋白-酪蛋白酸钠纳米颗粒负载芦丁以改善芦丁的溶解性和抗氧化性。目前,使用这类复合纳米颗粒递送柚皮素的研究相对较少。YE等[7]报道使用玉米醇溶蛋白-透明质酸(hyaluronic acid,HA)制备柚皮素纳米递送载体的方法,但是这种复合纳米颗粒对柚皮素的包埋率较低(约30%~60%),从而使得该方法难以适应大规模工业应用。
近年来,在玉米醇溶蛋白-酪蛋白酸钠负载姜黄素的体系研究中发现,添加多酚表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)可以显著改善包封效率,并且可以提高玉米醇溶蛋白基姜黄素纳米颗粒的理化性质和生物可及性[8]。基于此,本研究比较了3种多酚,EGCG、没食子酸(gallic acid,GA)和单宁酸(tannic acid,TA)对玉米醇溶蛋白的共价修饰情况,并使用反溶剂沉淀法制备并表征了用于递送柚皮素的EGCG-修饰的玉米醇溶蛋白-HA复合纳米颗粒,为柚皮素的高效生物递送提供了良好的研究思路。
1 材料与方法
1.1 材料、试剂与仪器
玉米醇溶蛋白,南京都莱生物技术有限公司;邻苯二甲醛(o-phthalaldehyde,OPA)、EGCG(98%),上海源叶生物科技有限公司;GA(99%)、TA(98%)、柚皮素(97%)、HA(97%),上海麦克林生化科技有限公司;乙腈(色谱纯),赛默飞世尔科技有限公司;福林酚,北京百瑞极生物科技有限公司;1,1-二苯基-2-苦基肼自由基(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氮双(3-乙基苯并噻唑林-6-磺酸)二铵盐[diammonium2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonate,ABTS],上海蓝季生物科技发展有限公司。如无另外说明,所有溶液均使用去离子水配制。
RE-201D旋转蒸发仪,瑞德仪器设备有限公司;BT-100蠕动泵,兰格恒流泵有限公司;BeNano 90型纳米粒度和ζ电位仪,丹东百特仪器有限公司;Agilent Cary Eclipse荧光分光光度计、1260型液相色谱仪,安捷伦科技有限公司;VECTOR 33红外光谱仪,德国Bruker公司;L5型紫外-可见分光光度计,上海精密科学仪器有限公司
1.2 复合纳米颗粒的制备
1.2.1 多酚对玉米醇溶蛋白的修饰
采用碱处理诱导法进行多酚对玉米醇溶蛋白的共价修饰[9]。具体步骤如图1步骤1中所示。将1.0 g玉米醇溶蛋白和0.2 g多酚(EGCG、GA、TA)分别溶于50 mL 70%(体积分数,下同)的乙醇水溶液中,并用0.1 mol/L NaOH溶液分别将两溶液调节至pH 9.0。随后,将两溶液充分混合并暴露于空气,并在室温下持续搅拌反应24 h。反应结束后,将样品对70%乙醇水溶液透析24 h以去除残余的游离多酚和NaOH。随后,将透析后的样品在旋转蒸发仪上蒸发去除乙醇。然后,通过真空冷冻干燥将浓缩后的样品冷冻干燥以获得固体粉末。采用如上相同操作,使用不加多酚的70%乙醇水溶液作为对照组。将EGCG、GA、TA修饰的玉米醇溶蛋白分别表示为EGCG-Z、GA-Z和TA-Z。
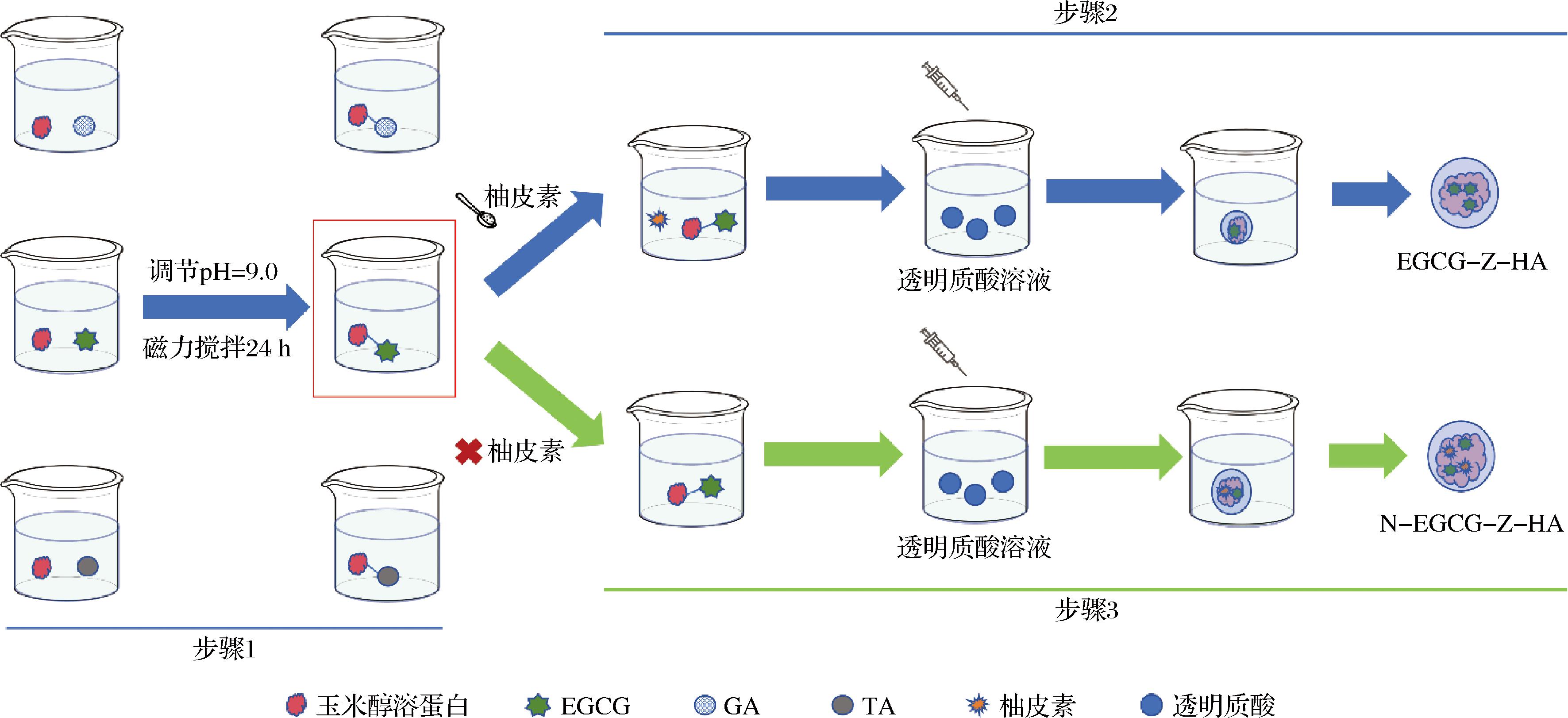
图1 制备复合纳米颗粒的流程图
Fig.1 Flow chart for preparation of the composite nanoparticles
1.2.2 EGCG修饰的玉米醇溶蛋白-HA复合纳米颗粒的制备
基于游离氨基含量和多酚当量测定结果,使用EGCG-Z进行后续复合纳米颗粒的制备,具体步骤如图1步骤2所示。将1.2.1节中制备的EGCG-Z溶于70%乙醇水溶液至10 mg/mL的质量浓度。在磁力搅拌下,使用蠕动泵以20 mL/min流速将上述溶液滴加至1% HA水溶液中,使得最终玉米醇溶蛋白与HA的质量比分别为2∶1、4∶1、6∶1、8∶1、10∶1、12∶1、14∶1和16∶1。滴加结束后,继续搅拌30 min,以形成EGCG修饰的玉米醇溶蛋白-HA复合纳米颗粒,并将其分别表示为EGCG-Z-HA-2∶1、EGCG-Z-HA-4∶1、EGCG-Z-HA-6∶1、EGCG-Z-HA-8∶1、EGCG-Z-HA-10∶1、EGCG-Z-HA-12∶1、EGCG-Z-HA-14∶1和EGCG-Z-HA-16∶1。
1.2.3 负载柚皮素的EGCG修饰的玉米醇溶蛋白-HA复合纳米颗粒的制备
采用反溶剂沉淀法制备负载柚皮素的EGCG修饰的玉米醇溶蛋白-HA复合纳米颗粒,具体步骤如图1步骤3中所示。将一定量的柚皮素粉末加入至1.2.1节中制备的EGCG-Z在70%乙醇水溶液,使柚皮素与玉米醇溶蛋白的质量比分别达到1∶5、1∶10、1∶20、1∶30、1∶50。在磁力搅拌下,使用蠕动泵以20 mL/min的流速将上述溶液滴加至1%(质量分数,下同)HA水溶液中,使得最终玉米醇溶蛋白与HA的质量比为10∶1。滴加结束后,继续搅拌30 min,以形成负载柚皮素的EGCG修饰的玉米醇溶蛋白-HA复合纳米颗粒。将在柚皮素与玉米醇溶蛋白质量比为1∶5、1∶10、1∶20、1∶30和1∶50条件下制备的复合纳米颗粒分别表示为N-EGCG-Z-HA-1∶5∶0.5、N-EGCG-Z-HA-1∶10∶1、N-EGCG-Z-HA-1∶20∶2、N-EGCG-Z-HA-1∶30∶3和N-EGCG-Z-HA-1∶50∶5。
1.3 多酚修饰的玉米醇溶蛋白的性质测定
1.3.1 游离氨基含量测定
采用OPA法测定[10]。将200 μL 2 mg/mL蛋白溶液加入至4 mL OPA试剂[每100 mL包含2 mL 4%(质量分数)OPA的甲醇溶液,50 mL 0.1 mol/L硼砂溶液、200 μL β-巯基乙醇、20 mL 5%(质量分数)十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液和27.8 mL去离子水],混合均匀后在35 ℃反应2 min。反应结束后,在340 nm测量其吸光值。采用相同操作,使用甘氨酸二肽作为标准品测定标准曲线。
1.3.2 总酚含量的测定
采用福林酚法测定[11]。将0.5 mL 2 mg/mL的多酚修饰的玉米醇溶蛋白溶液加入至2.5 mL 0.2 mol/L福林酚试剂中并充分混合。随后,将混合物在25 ℃下反应5 min。向混合物中加入2 mL的Na2CO3溶液,避光反应2 h。反应结束后,在760 nm测量其吸光值。采用如上操作,以EGCG、GA、TA标准溶液分别绘制标准曲线。
1.4 复合纳米颗粒的结构表征
1.4.1 粒径和ζ-电位测定
使用纳米粒度和ζ电位仪测定。参数设置:样品的折射率1.52,物质吸收率0.1,分散介质为水,折射率1.333,检测角度90°,平衡时间120 s,子检测次数为60次。所有数据均在室温下收集。
1.4.2 荧光光谱测定
以70%乙醇水溶液作为参比,使用荧光分光光度计在室温下测定样品的荧光光谱。参数设置:激发波长288 nm,发射波长范围290~450 nm,狭缝宽度5 mm,扫描速度120 nm/min。
1.4.3 傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)测定
使用红外光谱仪测定。将1.0 mg冻干样品与99 mg光谱纯KBr粉末混合,研磨并压片。使用KBr粉末作为背景,以4 cm-1的分辨率,在4 000~400 cm-1的波数范围内采集FT-IR。
1.5 复合纳米颗粒对柚皮素的包埋率和负载能力
参考SUN等[12]的方法测定。将纳米颗粒分散系以10 000 r/min离心15 min,收集上清液并通过HPLC测定其中柚皮素的含量。
使用液相色谱仪进行检测,进样量10 μL;色谱柱为C18色谱柱(4.6 mm×150 mm,5 μm),流动相为0.1%磷酸水溶液∶乙腈(30∶70体积比)的溶液;流速0.8 mL/min;检测波长288 nm;柱温25 ℃。分别根据公式(1)和公式(2)计算包埋率和负载能力:
包埋率![]()
(1)
负载能力![]()
(2)
1.6 抗氧化性测定
1.6.1 DPPH自由基清除活性测定
参考文献[7]的方法测定。用蒸馏水将样品稀释至柚皮素质量浓度为12.5 μg/mL。将0.5 mL样品与2.5 mL 0.1 mmol/L DPPH在75%乙醇水溶液中混合,并在室温下避光反应30 min。反应结束后,使用紫外可见分光光度计测定517 nm下的吸光值,并根据公式(3)计算样品的DPPH自由基清除率:
DPPH自由基清除率![]()
(3)
式中:Aa1,样品与DPPH混合体系的吸光值;Ab1,样品与无水乙醇混合体系的吸光值;Ac1,无水乙醇与DPPH混合体系的吸光值。
1.6.2 ABTS阳离子自由基清除活性测定
参考文献[7]的方法测定。用蒸馏水将样品稀释至柚皮素质量浓度为12.5 μg/mL。将100 μL样品与800 μL ABTS溶液混合,并在室温下避光反应30 min。反应结束后,使用紫外-可见分光光度计测定734 nm下的吸光值,并根据公式(4)计算样品的ABTS阳离子自由基清除率:
ABTS阳离子自由基清除率![]()
(4)
式中:Aa2,样品与ABTS混合体系的吸光值;Ab2,样品与无水乙醇混合体系的吸光值;Ac2,无水乙醇与ABTS混合体系的吸光值。
1.6.3 还原力测定
参考文献[7]的方法测定。用蒸馏水将样品稀释至柚皮素质量浓度为12.5 μg/mL。将0.1 mL样品溶液与0.4 mL 0.2 mol/L磷酸盐缓冲液(pH 6.6)和0.5 mL 0.1 g/L铁氰化钾溶液混合,并在50 ℃水浴中避光反应20 min。随后,向反应体系中再加入0.5 mL 10 g/L三氯乙酸溶液,然后将混合物以3 000 r/min离心10 min。离心后,向0.5 mL上清液中加入0.5 mL去离子水和0.1 g/L FeCl3溶液。测量700 nm下的吸光值,并用吸光值表示样品的还原力。
在上述抗氧化实验中,以相同方法测定同浓度游离柚皮素的抗氧化性。
1.7 统计分析
所有实验数据表示为3组实验的平均值±标准差。使用SPSS Statistics 26软件,对数据进行ANOVA分析,并采用Duncan多范围检验比较数据。以P<0.05表示统计学显著性差异。
2 结果与分析
2.1 多酚修饰的玉米醇溶蛋白
研究通过碱处理诱导法用3种多酚修饰玉米醇溶蛋白。在暴露于空气的条件下,空气中的氧会使多酚氧化成醌,并进一步与蛋白质上的亲核基团反应形成共价键。首先比较了3种多酚修饰后玉米醇溶蛋白上游离氨基的变化情况。如表1所示,与3种多酚反应后玉米醇溶蛋白上的游离氨基含量均显著降低,表明碱处理诱导后3种多酚均与玉米醇溶蛋白形成共价键。3种多酚之间相比,反应后玉米醇溶蛋白上羟基减少幅度由大到小分别为EGCG、TA和GA,表明多酚与玉米醇溶蛋白上游离氨基的反应性各不相同,这种反应性差异与羟基基团数目和位置有关[13]。
表1 玉米醇溶蛋白、玉米醇溶蛋白-多酚共价复合物的游离氨基含量和多酚当量
Table 1 Free amino content and polyphenol equivalent of zein and zein-polyphenol conjugates

样品游离氨基含量/(nmol/mg)多酚当量/(nmol/mg)玉米醇溶蛋白80.83±3.45a-EGCG-Z21.53±5.49d231.31±10.02aGA-Z49.35±1.86b170.74±16.58bTA-Z33.62±7.37c68.10±3.47c
注:不同字母表示数据之间存在显著性差异(P<0.05)。
如表1所示,EGCG-Z、GA-Z和TA-Z上的多酚含量分别为231.31、170.74、68.10 nmol/mg,多酚当量的变化规律与游离氨基的变化情况并不完全相同,表明多酚当量不仅受羟基基团数目和位置的影响,而且还与分子本身的大小有关。在3种多酚分子中,TA的分子质量(1 701.2 Da)显著大于EGCG(458.37 Da)和GA(170.17 Da),这导致在与玉米醇溶蛋白的反应过程中,TA的空间位阻更大且难以与玉米醇溶蛋白的内部结构发生反应,从而导致其所结合的多酚当量较小。在两种大小不同的单宁:双六羟基二苯酚基-三没食子酰葡萄糖(bihexahydroxydiphenoyl-trigalloylglucose,BDTG)和1-O-没食子酰基-4,6-六羟基二苯酚基-β-葡萄糖(1-O-galloyl-4,6-hexahydroxydiphenoyl-β-D-glucopyranose,OGβDG)与人血清白蛋白的相互作用研究中发现,与相对较小的分子OGβDG相比,更大的BDTG分子与蛋白之间的结合会阻碍其他BDTG分子,从而导致结合量的降低[14]。
基于上述实验结果,EGCG在游离氨基含量和多酚当量两方面均表现较好,因此后续实验使用EGCG修饰的玉米醇溶蛋白进行进一步研究。
2.2 EGCG修饰的玉米醇溶蛋白-HA复合纳米颗粒的表征
2.2.1 粒径和ζ电位分析
在本研究中,首先考察了玉米醇溶蛋白与HA的质量比对所形成的复合纳米颗粒粒径的影响。当仅有EGCG-Z时,所形成的颗粒粒径为(109.93±5.59) nm(图2-a)。在加入HA后,所形成的EGCG-Z-HA颗粒粒径显著升高。玉米醇溶蛋白与HA之间存在静电作用,因此HA的结合导致颗粒粒径增大。类似结果在通过静电作用形成乳清分离蛋白-甜菜果胶复合物时也得到报道[15]。在本研究中,随着玉米醇溶蛋白与HA质量比的增加,颗粒粒径显著降低,并且当质量比达到10∶1时,继续增加质量比将导致粒径降低。在低质量比时,HA的添加量较大,因此有更多HA结合在EGCG-Z表面,从而导致颗粒粒径相对较大。在高质量比时,ζ电位绝对值更小,颗粒表面电荷较少,因此颗粒间斥力增大,从而导致颗粒间聚集的可能性增大,进一步导致颗粒粒径增大。YE等[7]和CHEN等[16]在研究玉米醇溶蛋白与HA所形成的复合纳米颗粒时也报道了类似的现象。
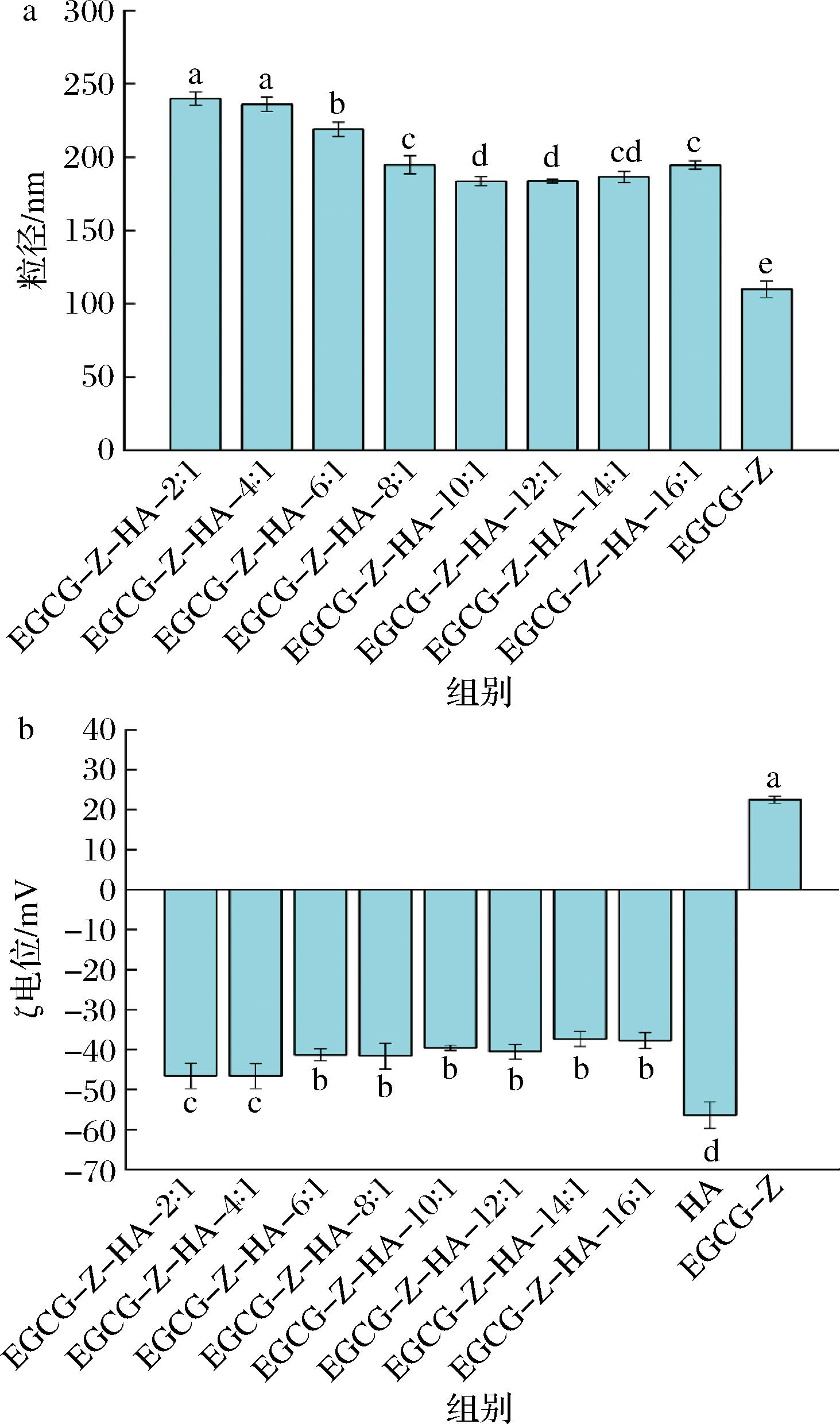
a-粒径;b-ζ电位
图2 EGCG-Z和EGCG-Z-HA复合纳米颗粒的粒径和ζ电位
Fig.2 The particle size and ζ potential of EGCG-Z and EGCG-Z-HA composite nanoparticles
注:字母表示组间显著性差异(P<0.05)(下同)。
EGCG-Z所形成的颗粒的ζ电位为(22.48±0.91) mV(图2-b)。在加入HA后,所形成的EGCG-Z-HA颗粒的ζ电位变为负值。HA是一种带负电荷的多糖,其ζ电位为(-56.37±3.29) mV,因此玉米醇溶蛋白与HA之间通过静电作用形成复合纳米颗粒。在形成复合纳米颗粒后,颗粒表面均带负电荷,表明HA包裹在颗粒外层。
2.2.2 荧光光谱分析
如图3所示,EGCG-Z在360 nm左右具有最大荧光强度,这是由于玉米醇溶蛋白中相对高的酪氨酸残基水平所造成的[8]。与对照EGCG-Z相比,添加HA导致荧光强度增加,但是最大发射波长位置变化不大,表明HA的添加导致EGCG-Z胶体颗粒稳定性增加,从而使得荧光强度升高[16]。然而,随着HA添加比例的升高,胶体颗粒荧光强度逐渐降低,这可能是由于EGCG-Z外过量HA的包裹所造成的。该结果与玉米醇溶蛋白-虫胶复合纳米颗粒的荧光光谱类似,其中当虫胶过量添加时,玉米醇溶蛋白的色氨酸残基被包裹在虫胶分子内部,从而导致颗粒的荧光强度降低[17]。
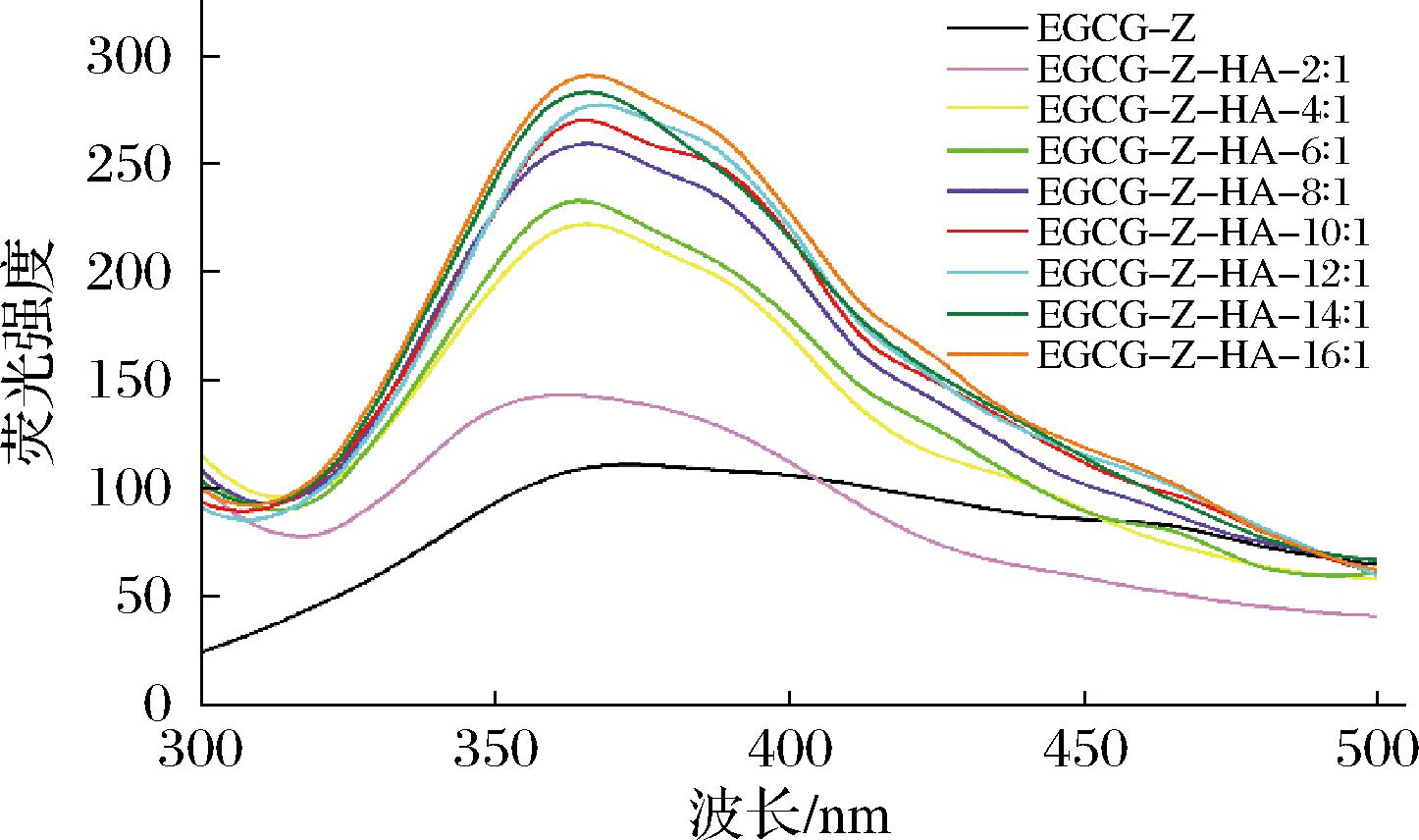
图3 EGCG-Z和EGCG-Z-HA复合纳米颗粒的荧光光谱图
Fig.3 Fluorescence spectra of EGCG-Z and EGCG-Z-HA composite nanoparticles
2.2.3 FT-IR分析
如图4所示,EGCG-Z分别在3 312.96、1 657.77、1 533.92 cm-1处具有特征峰,其中3 312.96 cm-1处的特征峰是由—OH基团的伸缩振动所造成的,而1 657.77 和1 533.92 cm-1处的特征峰分别表示酰胺I带(C—O和C—N的伸缩)和酰胺II带(C—N的伸缩和N—H的弯曲)。HA在3 416.64、1 320.01和1 080.21 cm-1处具有特征峰,该结果与先前报道一致[18]。
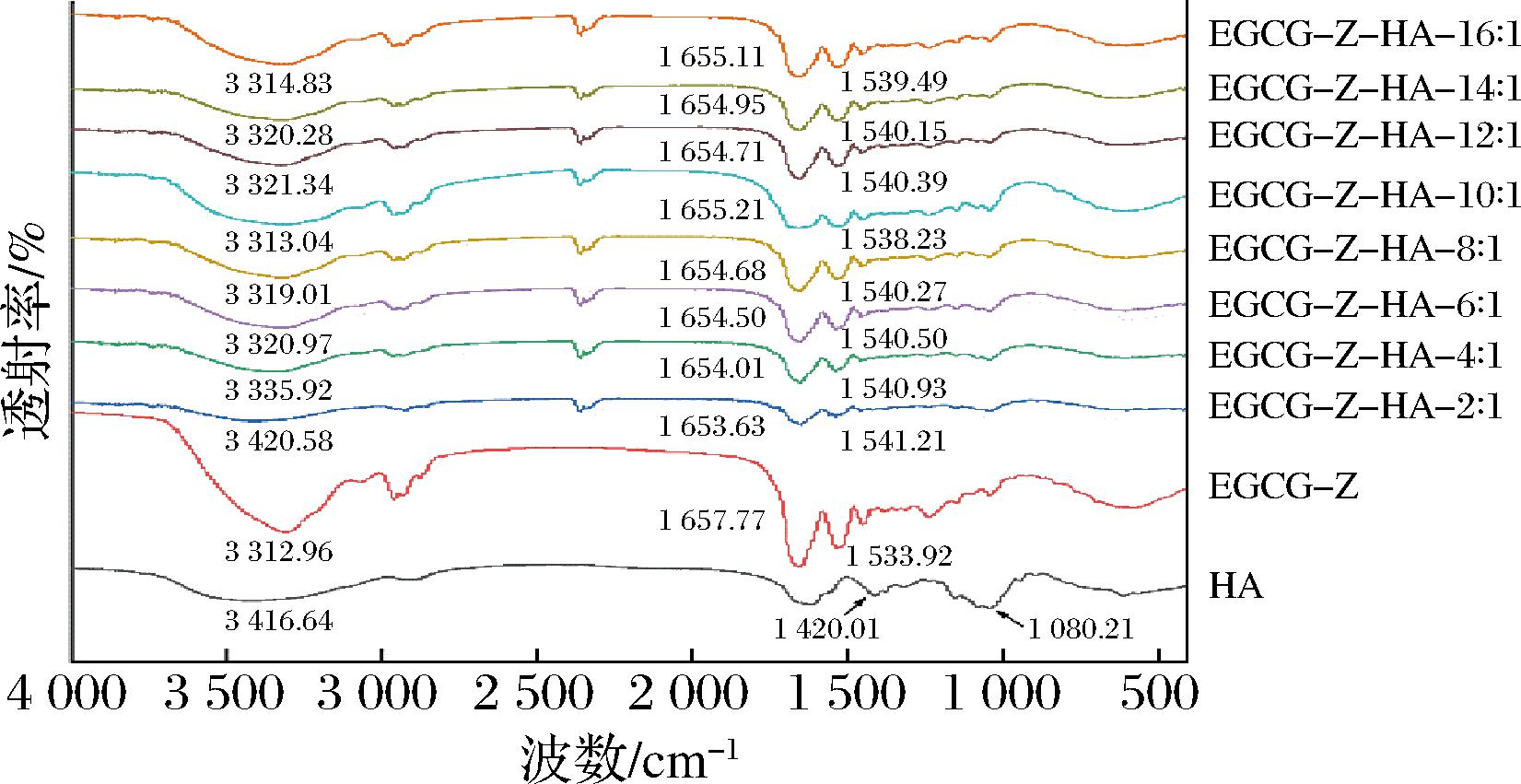
图4 HA和EGCG-Z-HA复合纳米颗粒的FT-IR图谱
Fig.4 FT-IR spectra of HA and EGCG-Z-HA composite nanoparticles
当加入HA后,3 312.96 cm-1处的特征峰发生不同程度的蓝移,且在HA添加量较大的情况下,蓝移程度与HA的添加量呈现正相关,表明玉米醇溶蛋白上的酰胺基与HA上的羧基和羟基形成了氢键[16]。在玉米醇溶蛋白与HA质量比较低时,3 312.96 cm-1处特征峰的蓝移程度更大,表明此时所形成的氢键强度更强。这可能与更大的HA添加量有关,更多的HA将能够提供更多用于产生氢键的羧基和羟基。研究表明这种氢键作用有助于蛋白-多糖复合纳米颗粒的形成和稳定[19]。对于酰胺I带和酰胺II带的特征峰,当加入HA后,与EGCG-Z相比,所形成的EGCG-Z-HA颗粒的峰强度显著降低,且在玉米醇溶蛋白与HA质量比较低时更显著,表明除氢键外,疏水相互作用在EGCG-Z-HA颗粒的形成和稳定中起到重要作用。因此,FT-IR结果进一步证明除静电作用外,在玉米醇溶蛋白与HA所形成的复合纳米颗粒中还存在氢键和疏水相互作用。
对于功能因子递送载体来说,粒径可以影响功能因子在体内的吸收、分布以及清除[20]。通常,递送载体粒径越小,则功能因子在体内的吸收程度越大[21]。另一方面,递送载体的稳定性也具有重要影响。通常,ζ电位的绝对值>30 mV的纳米颗粒倾向于彼此排斥而不会聚集[22]。在本研究中,纳米颗粒EGCG-Z-HA-10∶1的粒径最小(183.62 nm)且ζ电位为-39.57 mV。因此,选择EGCG-Z-HA-10∶1作为负载柚皮素的载体进行后续研究。
2.3 负载柚皮素的EGCG修饰玉米醇溶蛋白-HA复合纳米颗粒对柚皮素的包埋率和负载能力
包埋率和负载能力是评价复合纳米颗粒对生物活性成分的递送效率的重要参数。如图5所示,在未共价结合EGCG的情况下,柚皮素的包埋率为54.4%。该结果与先前报道类似,其中随着玉米醇溶蛋白与HA比例的改变,柚皮素的包埋率约为55%~75%[7]。相比之下,当玉米醇溶蛋白共价结合EGCG后,其包埋率显著提高,达到84.26%。同时,当柚皮素∶玉米醇溶蛋白从1∶5减少至1∶50时,随着柚皮素添加量的减少,包埋率进一步升高,并且比值达到1∶10时,其包埋率已超过99%,表明共价结合EGCG后,玉米醇溶蛋白和HA体系显示出良好的包埋作用。先前研究发现,在玉米醇溶蛋白-酪蛋白酸钠负载姜黄素的体系中,添加EGCG也可显著提高姜黄素的包埋率[8]。这些结果表明EGCG与柚皮素间存在相互作用,从而能够在反溶剂沉淀过程中促进柚皮素在复合纳米颗粒中的包埋。此外,随着柚皮素添加量的减少,复合纳米颗粒的对柚皮素的负载能力逐渐减小,其中在柚皮素∶玉米醇溶蛋白为1∶10时,其负载能力为7.14%,表现出较好的包埋率和负载能力。
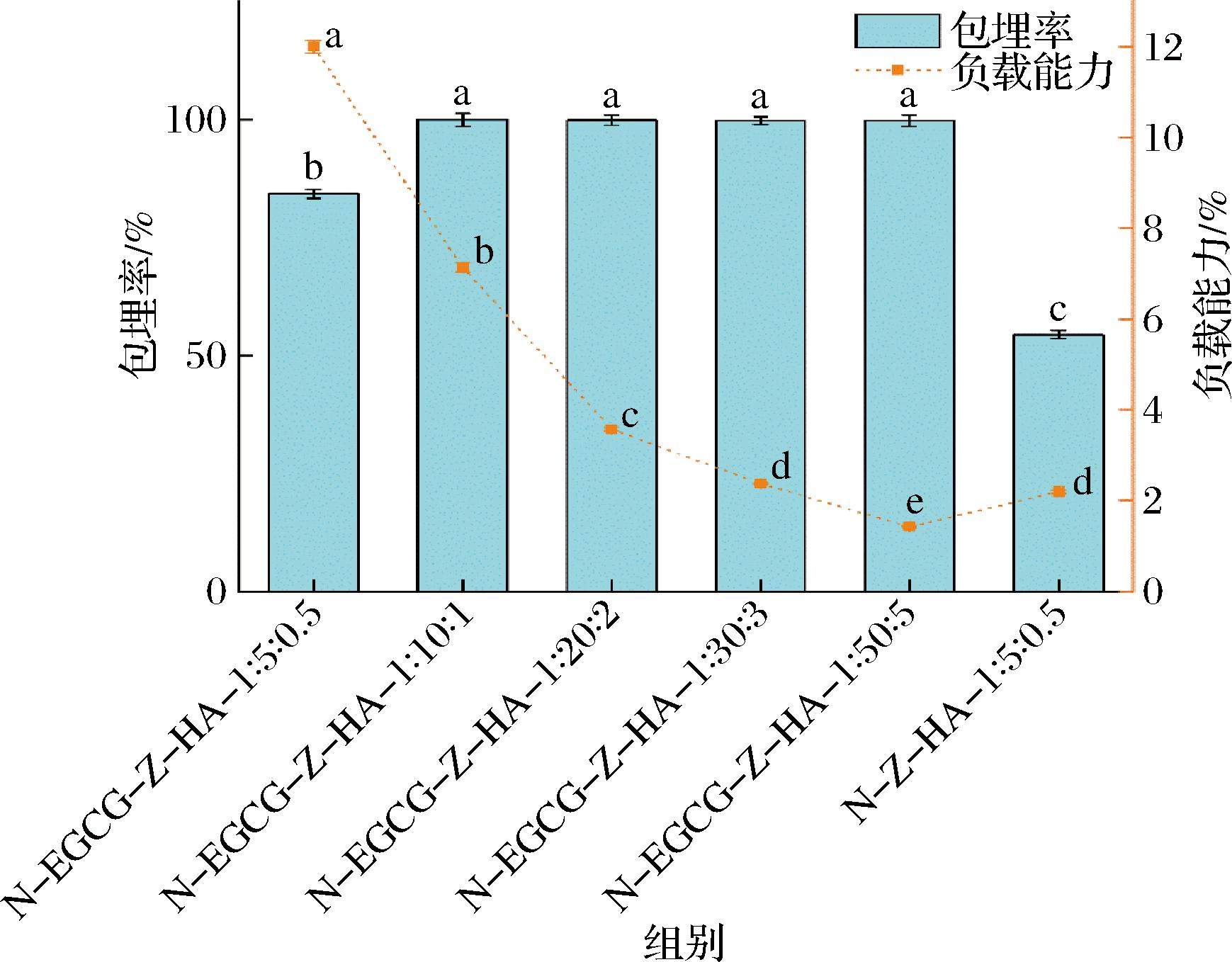
图5 柚皮素添加量对N-EGCG-Z-HA复合纳米颗粒中柚皮素的包埋率和负载能力的影响。
Fig.5 Effect of naringenin addition on the encapsulation efficiency and loading capacity of N-EGCG-Z-HA composite nanoparticles
2.4 负载柚皮素的EGCG修饰玉米醇溶蛋白-HA复合纳米颗粒的结构表征
2.4.1 粒径和ζ电位分析
与未添加柚皮素的复合纳米颗粒相比,添加柚皮素后,其粒径有所增大,从约180 nm提高至约240 nm(图6-a),表明柚皮素的添加可以通过与玉米醇溶蛋白上共价结合的EGCG发生相互作用,从而使更多蛋白分子结合,导致所形成的纳米颗粒尺寸整体增大。另外,添加柚皮素后,ζ电位的绝对值轻微降低,从约-40 mV降低至-30~-35 mV(图6-b),且与柚皮素的添加量呈现出部分依赖性关系,即当柚皮素与玉米醇溶蛋白之比在1∶50至1∶10之间时,其ζ电位保持基本不变,且与添加柚皮素之前的EGCG-Z-HA纳米颗粒的ζ电位较接近,而当柚皮素与玉米醇溶蛋白之比从1∶10升高至1∶5时,其ζ电位从约-35 mV升高至约-30 mV。对比包埋率(图5),当柚皮素与玉米醇溶蛋白之比在1∶50至1∶10之间时,柚皮素的包埋率在99%以上,表明绝大部分柚皮素被包埋在纳米颗粒内部,而当柚皮素与玉米醇溶蛋白之比从1∶10升高至1∶5时,可能有少量柚皮素通过与EGCG的相互作用而分布在纳米颗粒表面,从而导致ζ电位发生变化。相应地,与EGCG-Z-HA纳米颗粒相比,ζ电位绝对值的减小导致纳米颗粒之间斥力减小,从而进一步使得的粒径变大。总体上,在测试范围内,纳米颗粒粒径保持在230~245 nm,表明柚皮素的添加量对所制备的纳米颗粒影响较小,且整体较为稳定。
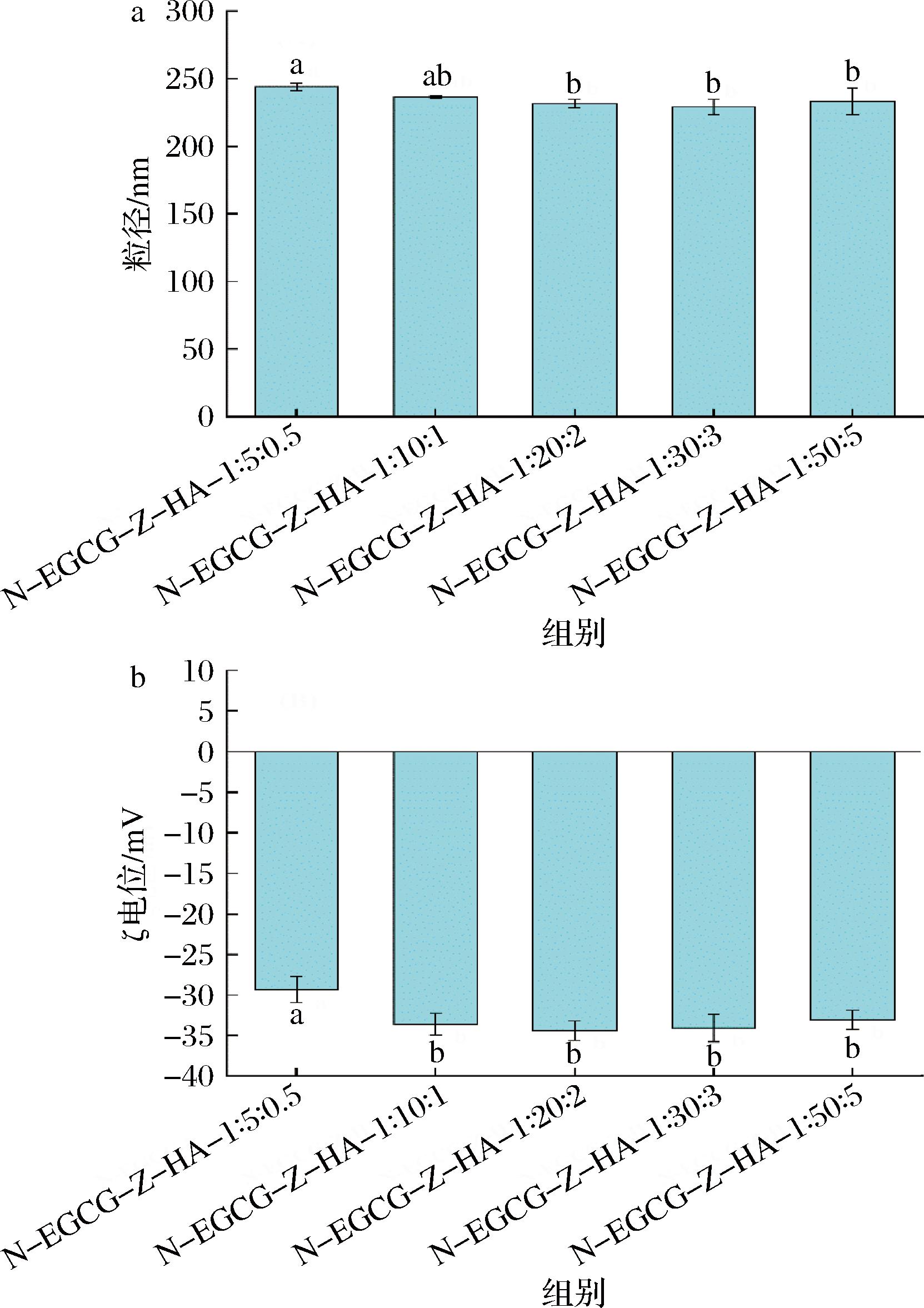
a-粒径;b-ζ电位
图6 柚皮素添加量对N-EGCG-Z-HA复合纳米颗粒的粒径和ζ电位的影响
Fig.6 Effect of naringenin addition on the particle size and ζ potential of N-EGCG-Z-HA composite nanoparticles
2.4.2 FT-IR分析
如图7所示,柚皮素在3 113.82、2 830.47、1 630.70、1 080.00 cm-1处显示出峰值,其分别代表—OH、—CH、C![]() O和C—O伸缩振动,并且还在1 580~1 615 cm-1显示出代表芳香环伸缩振动的峰值,该结果与先前研究报道一致[23]。当柚皮素包埋在EGCG-Z-HA纳米颗粒中后,其特征峰消失,表明其成功被复合纳米颗粒包埋,这也与粒径和ζ电位的结果一致。与EGCG-Z-HA纳米颗粒相比,添加柚皮素后,玉米醇溶蛋白在3 313.04 cm-1处的特征峰发生不同程度的蓝移,表明柚皮素与玉米醇溶蛋白以及EGCG之间发生了氢键作用。相比之下,添加柚皮素后,玉米醇溶蛋白在1 655.21(酰胺I带)和1 539.49 cm-1(酰胺II带)处的特征峰发生轻微迁移,表明柚皮素与玉米醇溶蛋白之间还存在一定的疏水相互作用。
O和C—O伸缩振动,并且还在1 580~1 615 cm-1显示出代表芳香环伸缩振动的峰值,该结果与先前研究报道一致[23]。当柚皮素包埋在EGCG-Z-HA纳米颗粒中后,其特征峰消失,表明其成功被复合纳米颗粒包埋,这也与粒径和ζ电位的结果一致。与EGCG-Z-HA纳米颗粒相比,添加柚皮素后,玉米醇溶蛋白在3 313.04 cm-1处的特征峰发生不同程度的蓝移,表明柚皮素与玉米醇溶蛋白以及EGCG之间发生了氢键作用。相比之下,添加柚皮素后,玉米醇溶蛋白在1 655.21(酰胺I带)和1 539.49 cm-1(酰胺II带)处的特征峰发生轻微迁移,表明柚皮素与玉米醇溶蛋白之间还存在一定的疏水相互作用。
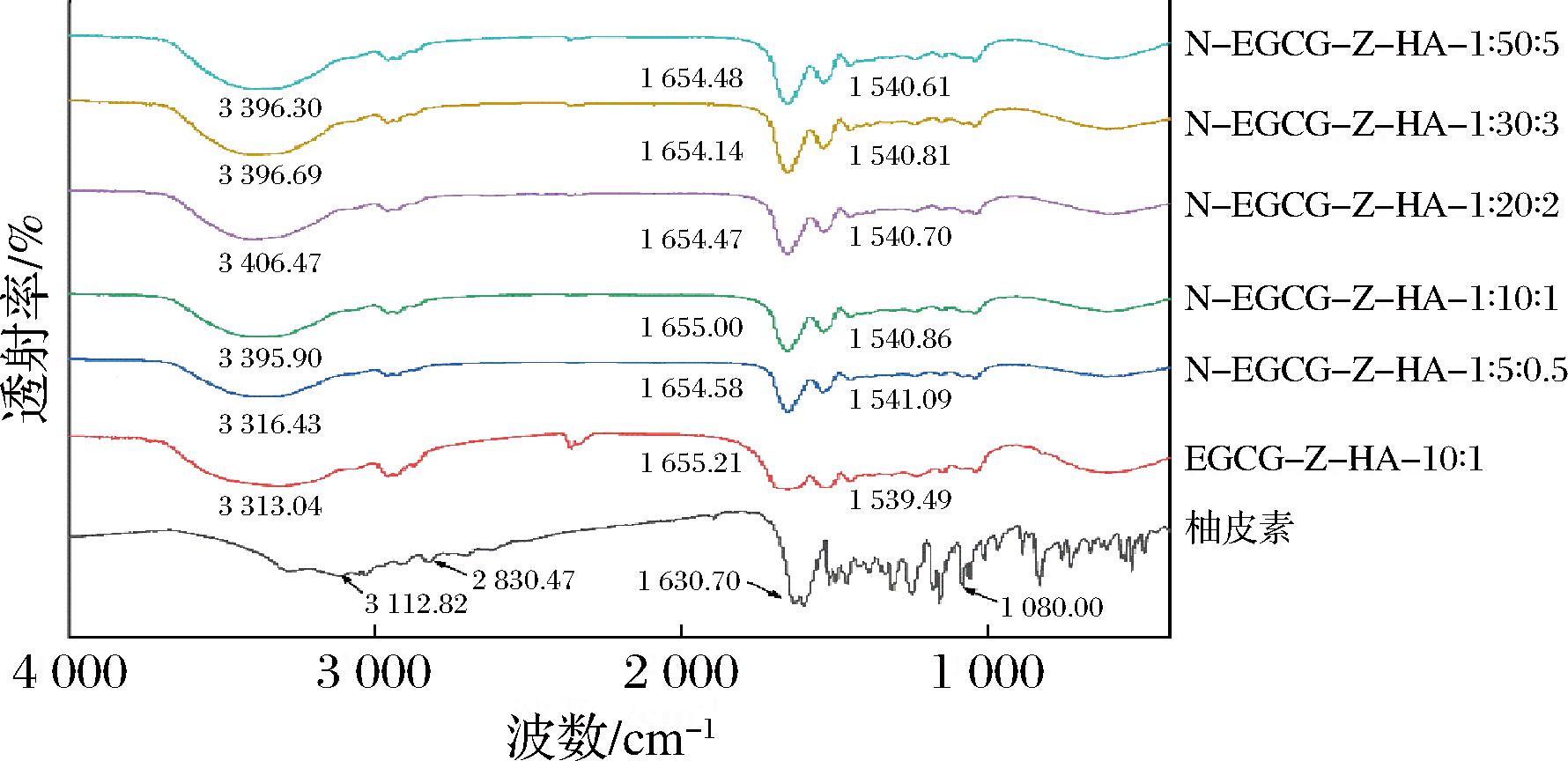
图7 柚皮素、EGCG-Z-HA-10∶1以及不同柚皮素添加量的N-EGCG-Z-HA复合纳米颗粒的FT-IR图谱
Fig.7 FT-IR spectra of naringenin, EGCG-Z-HA-10∶1 and N-EGCG-Z-HA composite nanoparticles prepared at different amount of naringenin added
基于上述研究,当柚皮素与玉米醇溶蛋白质量比为1∶10时,继续减小柚皮素添加量对包埋率无明显影响,且负载能力持续降低,因此选择N-EGCG-Z-HA-1∶10∶1进行后续抗氧化性研究。
2.5 抗氧化性
本研究通过DPPH自由基、ABTS阳离子自由基清除活性和还原力测定比较了游离柚皮素、EGCG-Z以及未负载(EGCG-Z-HA-10∶1)和负载柚皮素(N-EGCG-Z-HA-1∶10∶1)的复合纳米颗粒的抗氧化性(图8)。
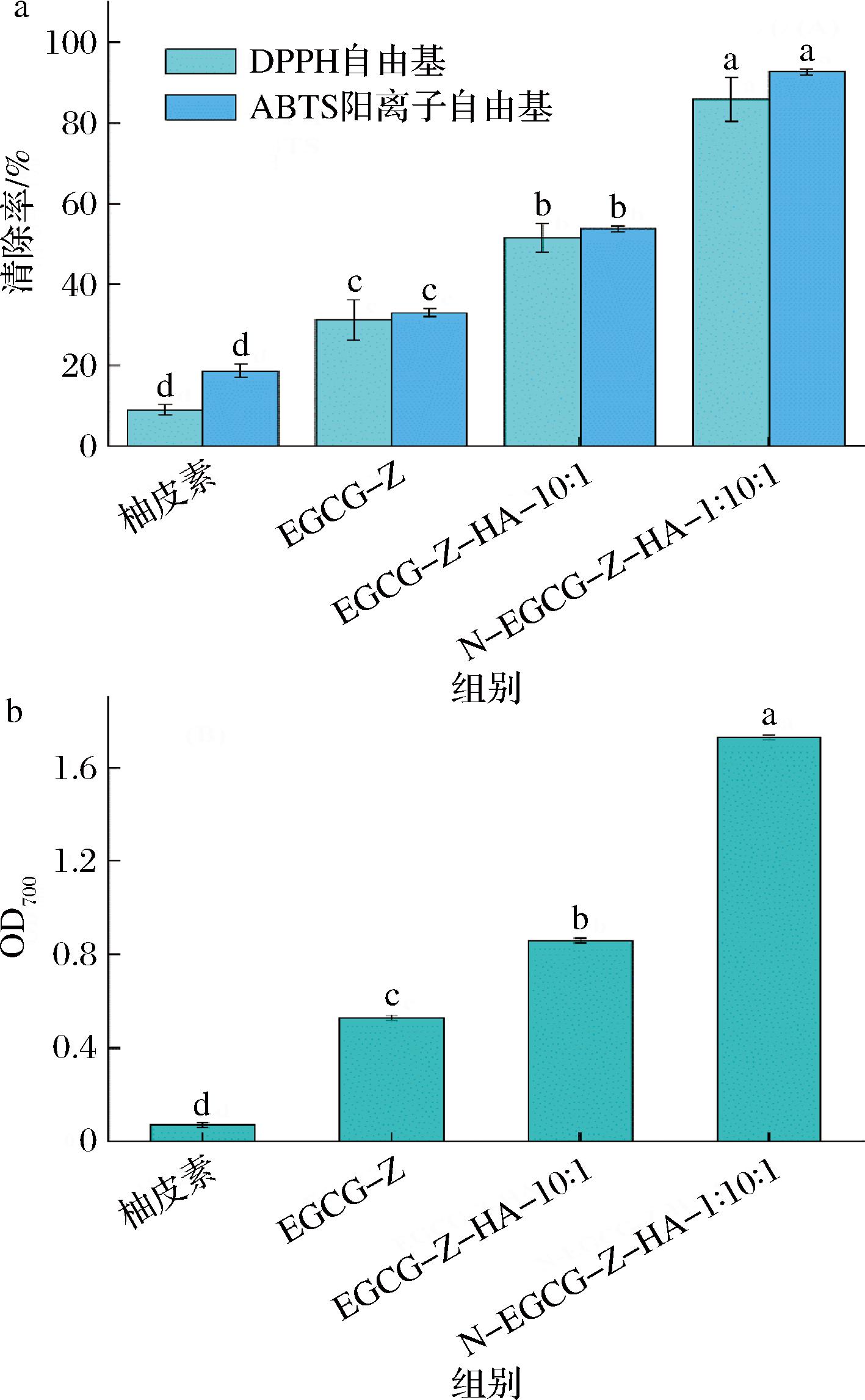
a-DPPH自由基和ABTS阳离子自由基清除率;b-还原力
图8 不同物质的抗氧化性分析
Fig.8 Antioxidant analysis of different substances
在3种抗氧化测定中,游离柚皮素的抗氧化能力均最低,而通过EGCG-Z-HA复合纳米颗粒包埋后,其抗氧化能力均显著提高,表明包埋在复合纳米颗粒中的柚皮素能够更好地分散,从而提高了柚皮素与自由基之间的接触,类似情况在玉米醇溶蛋白/羧甲基糊精负载姜黄素的纳米颗粒中也得到证实[24]。另一方面,EGCG本身具有较好的抗氧化性,通过EGCG修饰后,EGCG-Z的抗氧化能力相对较低,这可能是由于共价修饰引起的空间位阻所造成的[25]。总体上,负载柚皮素的N-EGCG-Z-HA-1∶10∶1的抗氧化能力大于单独柚皮素和单独未负载柚皮素的复合纳米颗粒EGCG-Z-HA-10∶1的抗氧化能力之和,表明采用EGCG修饰的玉米醇溶蛋白-HA体系负载柚皮素对整体抗氧化能力有促进作用。
3 结论
在本研究中,通过反溶剂沉淀法成功制备了负载柚皮素的EGCG共价修饰的玉米醇溶蛋白-HA复合纳米颗粒。与GA和TA修饰的玉米醇溶蛋白相比,EGCG共价修饰的玉米醇溶蛋白具有低游离氨基含量和高多酚当量,修饰效果良好。EGCG共价修饰的玉米醇溶蛋白与HA之间通过静电作用、氢键和疏水相互作用形成复合纳米颗粒。在不同HA添加量下,所形成的复合纳米颗粒的粒径在180~240 nm,且由于HA的包裹而表面带负电荷,其中在EGCG共价修饰的玉米醇溶蛋白与HA质量比为10∶1所获得的复合纳米颗粒粒径最小。由于EGCG的共价修饰,复合纳米颗粒对柚皮素的包埋率和负载能力均显著提高,且在柚皮素与EGCG共价修饰的玉米醇溶蛋白质量比为1∶10或更小时,包埋率>99%。结构表征显示,绝大部分柚皮素被包埋在复合纳米颗粒内部,且与EGCG和玉米醇溶蛋白之间存在氢键和疏水相互作用。抗氧化性测定表明负载柚皮素的复合纳米颗粒的抗氧化能力显著高于游离柚皮素,且大于单独柚皮素和单独未负载柚皮素的复合纳米颗粒EGCG-Z-HA-10∶1的抗氧化能力之和,表明采用EGCG修饰的玉米醇溶蛋白-HA体系负载柚皮素对整体抗氧化能力具有促进作用。
[1] ZAIDUN N H, THENT Z C, LATIFF A A.Combating oxidative stress disorders with citrus flavonoid:Naringenin[J].Life Sciences, 2018, 208:111-122.
[2] UÇAR K, GÖKTA Z.Biological activities of naringenin:A narrative review based on in vitro and in vivo studies[J].Nutrition Research, 2023, 119:43-55.
Z.Biological activities of naringenin:A narrative review based on in vitro and in vivo studies[J].Nutrition Research, 2023, 119:43-55.
[3] BHIA M, MOTALLEBI M, ABADI B, et al.Naringenin nano-delivery systems and their therapeutic applications[J].Pharmaceutics, 2021, 13(2):291.
[4] IRACHE J M, GONZ LEZ-NAVARRO C J.Zein nanoparticles as vehicles for oral delivery purposes[J].Nanomedicine, 2017, 12(11):1209-1211.
LEZ-NAVARRO C J.Zein nanoparticles as vehicles for oral delivery purposes[J].Nanomedicine, 2017, 12(11):1209-1211.
[5] JIANG F Y, YANG L L, WANG S Y, et al.Fabrication and characterization of zein-alginate oligosaccharide complex nanoparticles as delivery vehicles of curcumin[J].Journal of Molecular Liquids, 2021, 342:116937.
[6] ZHANG S L, HAN Y.Preparation, characterisation and antioxidant activities of rutin-loaded zein-sodium caseinate nanoparticles[J].PLoS One, 2018, 13(3):e0194951.
[7] YE G Y, WU T L, LI Z H, et al.Preparation and characterization of novel composite nanoparticles using zein and hyaluronic acid for efficient delivery of naringenin[J].Food Chemistry, 2023, 417:135890.
[8] YAN X J, ZHANG X L, MCCLEMENTS D J, et al.Co-encapsulation of epigallocatechin gallate (EGCG) and curcumin by two proteins-based nanoparticles:Role of EGCG[J].Journal of Agricultural and Food Chemistry, 2019, 67(48):13228-13236.
[9] LIU F G, WANG D, SUN C X, et al.Utilization of interfacial engineering to improve physicochemical stability of β-carotene emulsions:Multilayer coatings formed using protein and protein-polyphenol conjugates[J].Food Chemistry, 2016, 205:129-139.
[10] REN Y T, ZHAO Y, WU Y W, et al.Novel lysozyme-mannooligosaccharide conjugate with improved antimicrobial activity:Preparation and characterization[J].Journal of Food Measurement and Characterization, 2020, 14(5):2529-2537.
[11] TEIXEIRA N, MATEUS N, DE FREITAS V, et al.Wine industry by-product:Full polyphenolic characterization of grape stalks[J].Food Chemistry, 2018, 268:110-117.
[12] SUN C X, DAI L, GAO Y X.Binary complex based on zein and propylene glycol alginate for delivery of quercetagetin[J].Biomacromolecules, 2016, 17(12):3973-3985.
[13] LIU F G, SUN C X, YANG W, et al.Structural characterization and functional evaluation of lactoferrin-polyphenol conjugates formed by free-radical graft copolymerization[J].RSC Advances, 2015, 5(20):15641-15651.
[14] SEKOWSKI S, IONOV M, KASZUBA M, et al.Biophysical studies of interaction between hydrolysable tannins isolated from Oenothera gigas and Geranium sanguineum with human serum albumin[J].Colloids and Surfaces.B, Biointerfaces, 2014, 123:623-628.
[15] CHEN B C, LI H J, DING Y P, et al.Formation and microstructural characterization of whey protein isolate/beet pectin coacervations by laccase catalyzed cross-linking[J].LWT - Food Science and Technology, 2012, 47(1):31-38.
[16] CHEN S, HAN Y H, WANG Y Q, et al.Zein-hyaluronic acid binary complex as a delivery vehicle of quercetagetin:Fabrication, structural characterization, physicochemical stability and in vitro release property[J].Food Chemistry, 2019, 276:322-332.
[17] CHEN S, XU C Q, MAO L K, et al.Fabrication and characterization of binary composite nanoparticles between zein and shellac by anti-solvent co-precipitation[J].Food and Bioproducts Processing, 2018, 107:88-96.
[18] MOUSTAFA M A, EL-REFAIE W M, ELNAGGAR Y S R, et al.Fucoidan/hyaluronic acid cross-linked zein nanoparticles loaded with fisetin as a novel targeted nanotherapy for oral cancer[J].International Journal of Biological Macromolecules, 2023, 241:124528.
[19] SUN C X, DAI L, GAO Y X.Interaction and formation mechanism of binary complex between zein and propylene glycol alginate[J].Carbohydrate Polymers, 2017, 157:1638-1649.
[20] LAWSON M K.Improvement of therapeutic value of quercetin with chitosan nanoparticle delivery systems and potential applications[J].International Journal of Molecular Sciences, 2023, 24(4):3293.
[21] LIU Q Y, ZHANG X R, XUE J W, et al.Exploring the intrinsic micro-/ nanoparticle size on their in vivo fate after lung delivery[J].Journal of Controlled Release:Official Journal of the Controlled Release Society, 2022, 347:435-448.
[22] WANG L, ZHANG Y.Heat-induced self-assembly of zein nanoparticles:Fabrication, stabilization and potential application as oral drug delivery[J].Food Hydrocolloids, 2019, 90:403-412.
[23] SMRUTHI M R, NALLAMUTHU I, ANAND T.A comparative study of optimized naringenin nanoformulations using nano-carriers (PLA/PVA and zein/pectin) for improvement of bioavailability[J].Food Chemistry, 2022, 369:130950.
[24] MENG R, WU Z Z, XIE Q T, et al.Preparation and characterization of zein/carboxymethyl dextrin nanoparticles to encapsulate curcumin:Physicochemical stability, antioxidant activity and controlled release properties[J].Food Chemistry, 2021, 340:127893.
[25] LIU F G, SUN C X, WANG D, et al.Glycosylation improves the functional characteristics of chlorogenic acid-lactoferrin conjugate[J].RSC Advances, 2015, 5(95):78215-78228.