风味酯是存在于植物特别是水果和花卉中的天然成分,结构一般为短链羧酸酯,是植物特征香味的物质基础,其在食品、饮料、烟草、日化以及制药行业中被广泛应用[1]。但是天然的风味酯在植物中含量较低,提取过程易损耗、成本较高;此外,天然提取的风味酯为多种成分的混合物,原料产地以及提取工艺的不同也会造成嗅觉上的差别,难以标准化,对后期的使用造成不便。化学合成也是制备风味酯常用的方法之一,但是该过程通常会对环境产生不利的影响,并且化学合成不具备区域和结构选择性,造成副产物偏多,分离困难;同时,多数消费者对化学合成的产品应用在食品相关领域表现出抵触的情绪[2]。
脂肪酶,又称甘油酯水解酶(lipase,EC.3.1.1.3),其主要功能是催化酯的水解。在有机溶剂中,该酶能够通过酯化或者转酯反应合成酯类化合物,因此脂肪酶常用于合成多种风味酯[3]。酶法合成风味酯具有反应条件温和、选择性高以及污染少等优点。根据国际行业规定,通过酶或微生物发酵法制备的风味酯等同于从自然环境中提取所得到的,并且消费者对其接受度远高于化学合成品[4]。但是在有机溶剂中,游离酶的活性会有极大的损失,为了提高酶在有机溶剂中的稳定性,同时也是为了使催化剂能够重复使用,需要对脂肪酶进行固定化以提高其稳定性。在风味酯合成的研究中,最常用Nov435、Lipozyme TL-IM和Lipozyme RM-IM等3种商品化固定化脂肪酶[5-8]。除此之外,许多研究者也以磁性纳米颗粒、金属有机骨架以及碳纳米管等新材料为载体固定化脂肪酶用于合成丁酸乙酯、丁酸异戊酯和己酸乙酯等多种风味酯[9-11]。
大孔树脂是一种人工合成的具有多孔立体结构的聚合物颗粒,其内部空间较大,具有较高的吸附容量,经常被用作固定化酶的载体[12]。然而简单的吸附作用使得酶蛋白极易从树脂上脱落,为了提高固定化酶的稳定性,常采用戊二醛对酶蛋白进行交联,但是这会使酶活力有较大的损失。
本研究以大孔树脂为载体固定化脂肪酶,然后对吸附在大孔树脂上的酶蛋白表面进行丙烯酰化反应,引入不饱和的可发生聚合反应的双键官能团,最后通过聚合反应在其表面形成凝胶层,完成对大孔树脂固定化脂肪酶颗粒的包覆,制备过程如图1所示。此方法所制备的固定化酶不仅不易从树脂上所脱落,而且由于接枝聚合物壳层的厚度在纳米范围之内,因此不会产生较大的传质阻力;同时聚合物壳层与酶分子之间的共价连接以及聚合物壳层内合适的微环境可以大幅度提高酶的热稳定性和有机溶剂耐受性。全文研究了影响凝胶涂层包覆大孔树脂固定化脂肪酶制备的主要因素,对其结构进行了表征,考察了固定化酶的酶学性质以及合成乙酸丁酯和乙酸异戊酯的能力。
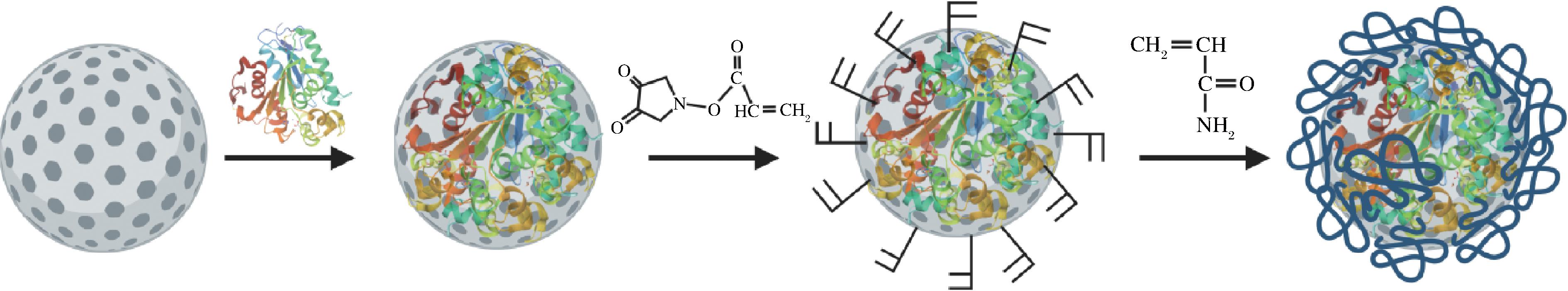
图1 凝胶涂层包覆的大孔树脂固定化脂肪酶的示意图
Fig.1 Schematic diagram of immobilization of lipase on macroporous adsorption resins followed by gel-coated
1 材料与方法
1.1 材料与仪器
脂肪酶(来源于Thermomyces lanuginosus,酶活力1×106 U/mL),阿拉丁试剂有限公司;其他试剂购自麦克林试剂有限公司,其中化学试剂均为分析纯。
L3可见分光光度计,上海仪电分析仪器有限公司;IRPrestige-21傅里叶变换红外光谱仪,日本岛津公司;NOVA 2000e比表面积及孔径分析仪,美国康塔仪器。
1.2 实验方法
1.2.1 固定化酶的制备
取1 g大孔树脂D101加入到5 mL稀释后的酶液中,于30 ℃、150 r/min的恒温振荡摇床中吸附2 h后过滤,缓冲液冲洗3次,获得大孔树脂固定化的脂肪酶(Lipase@Resins);将Lipase@Resins加入5 mL的0.05 mol/L、pH 7.0的PBS中,加入溶解于二甲基亚砜的N-丙烯酰氧基琥珀酰亚胺溶液(50 g/L)至终浓度为4 mmol/L,在4 ℃条件下搅拌反应3 h后过滤,缓冲液冲洗3次,去除未反应的溶液,然后加入100 mg丙烯酰胺,在室温条件下搅拌溶解,并通氮气吹扫20 min除去空气,然后加入10 mg过硫酸铵和15 μL的N,N,N′,N′-四甲基二乙胺作为复合引发剂,在4 ℃条件下搅拌反应5 h,反应结束后除去未反应的溶液,缓冲液冲洗3次,获得凝胶涂层包覆的大孔树脂固定化脂肪酶(Gel-coated Lipase@Resins)。
1.2.2 固定化酶的表征
采用傅里叶变换红外光谱和比表面积及孔径分析仪对D101 Resins、Lipase@Resins和Gel-coated Lipase@Resins的微观形态进行观测和表征。
1.2.3 固定化酶酶学性质的研究
最适反应pH和酸碱稳定性:将游离酶和固定化酶放置在不同pH值(4.0~9.0)的缓冲液中测定其催化活力,考察酶活力随pH的变化,确定最适pH;将游离脂肪酶和固定化脂肪酶放置在不同pH值(4.0~9.0)的缓冲液中3 h,测定其剩余酶活力,考察其酸碱稳定性。
最适反应温度和热稳定性:将游离酶和固定化酶放置在不同温度(30 ℃~55 ℃)中反应测定其催化活力,考察酶活力随温度的变化,确定最适温度;将游离酶和固定化酶放置在不同温度(40 ℃~70 ℃)中保持3 h,测定其剩余酶活力,考察其热稳定性。
有机溶剂耐受性:将游离酶和固定化酶分别放在不同的有机溶剂中50 ℃保持3 h后,测定其剩余酶活力,考察其有机溶剂耐受性。
酶促反应动力学参数:以棕榈酸对硝基苯酯为底物,测定酶在不同底物浓度(1~10 mmol/L)下的水解反应速率,根据Linewaver-Burk双倒数法计算Km值与Vmax值。
1.2.4 合成乙酸丁酯和乙酸异戊酯
乙酸丁酯的合成:在50 mL的具塞三角瓶中加入10 mL正庚烷、1 mmol乙酸、1 mmol丁醇和0.9 g分子筛3Å,混合均匀后加入0.25 g固定化酶,然后密封放入45 ℃、200 r/min的恒温振荡摇床中反应。
乙酸异戊酯的合成:在5 mL塑料离心管中加入3 mL乙酸乙烯酯和0.6 mmol异戊醇,混合均匀后加入0.25 g固定化酶,然后密封放入45 ℃、200 r/min的恒温摇床中反应。
1.2.5 分析检测
脂肪酶的活力测定以棕榈酸对硝基苯酯为底物采用比色法测定[13];蛋白质含量测定采用Bradford法[14];酶表面氨基修饰度的测定采用2,4,6-三硝基苯磺酸法测定[15];乙酸丁酯和乙酸异戊酯的检测采用气相色谱法测定[16-17]。其中蛋白质吸附率、酶活力回收率和氨基修饰度的计算如公式(1)、公式(2)和公式(3)所示:
蛋白质吸附率![]()
(1)
酶活力回收率![]()
(2)
氨基修饰度![]()
(3)
2 结果与分析
2.1 Gel-coated Lipase@Resins的制备
2.1.1 Lipase@Resins的制备
大孔树脂通过范德华力、氢键以及疏水作用等与酶蛋白相结合,通过对不同型号的树脂进行筛选,D101型号树脂吸附效果最好(图2-a),该树脂是一种非极性吸附树脂,具有较大的孔径和比表面积,因此能够提供更多的吸附位点,具有较好的吸附效果[18];从图2-b、2-c和2-d可看出,当pH为6.0、酶液添加量为0.2 mL/g、吸附时间为2 h时,吸附效果最佳,此时酶蛋白吸附率和酶活力回收率均在95%左右。随着吸附时间的延长,酶活力回收率略有下降,可能是由于树脂长时间浸泡在酶溶液中,孔隙吸附的酶分子过于饱和,在反应时酶分子不能充分展开,从而导致酶活力回收率下降。

a-树脂型号;b-pH;c-酶液添加量;d-吸附时间
图2 不同因素对固定化脂肪酶的影响
Fig.2 Effect of different factors on immobilization of lipase
2.1.2 Lipase@Resins的表面修饰
修饰剂N-丙烯酰氧基琥珀酰亚胺[N-(acryloyloxy)succinimide,NAS]能与脂肪酶表面的氨基残基(主要为赖氨酸氨基残基)发生反应,对酶进行表面修饰,在酶蛋白的表面引入可发生聚合反应的双键,这个过程被称为酶的丙烯酰化修饰,从而为后续的聚合反应提供位点[19]。由图3-a可知,随着NAS浓度的增加,脂肪酶表面氨基修饰度逐渐提高,但脂肪酶的酶活力回收率逐渐下降,这可能是NAS浓度低时对酶的影响小,而随着NAS浓度的提高,酶的催化活性中心被破坏,造成酶活力的损失,因此选择8 mmol/L作为NAS的浓度条件。从图3-b可看出,当表面修饰时间为3 h时效果最佳,继续延长时间反而使酶活力回收率下降。从图3-c可看出,表面修饰最佳pH为6,此时氨基修饰度和酶活力回收率均在80%以上。

a-修饰剂浓度;b-修饰时间;c-修饰pH
图3 不同因素对Lipase@Resins表面修饰的影响
Fig.3 Effect of different factors on the surface modification of Lipase@Resins
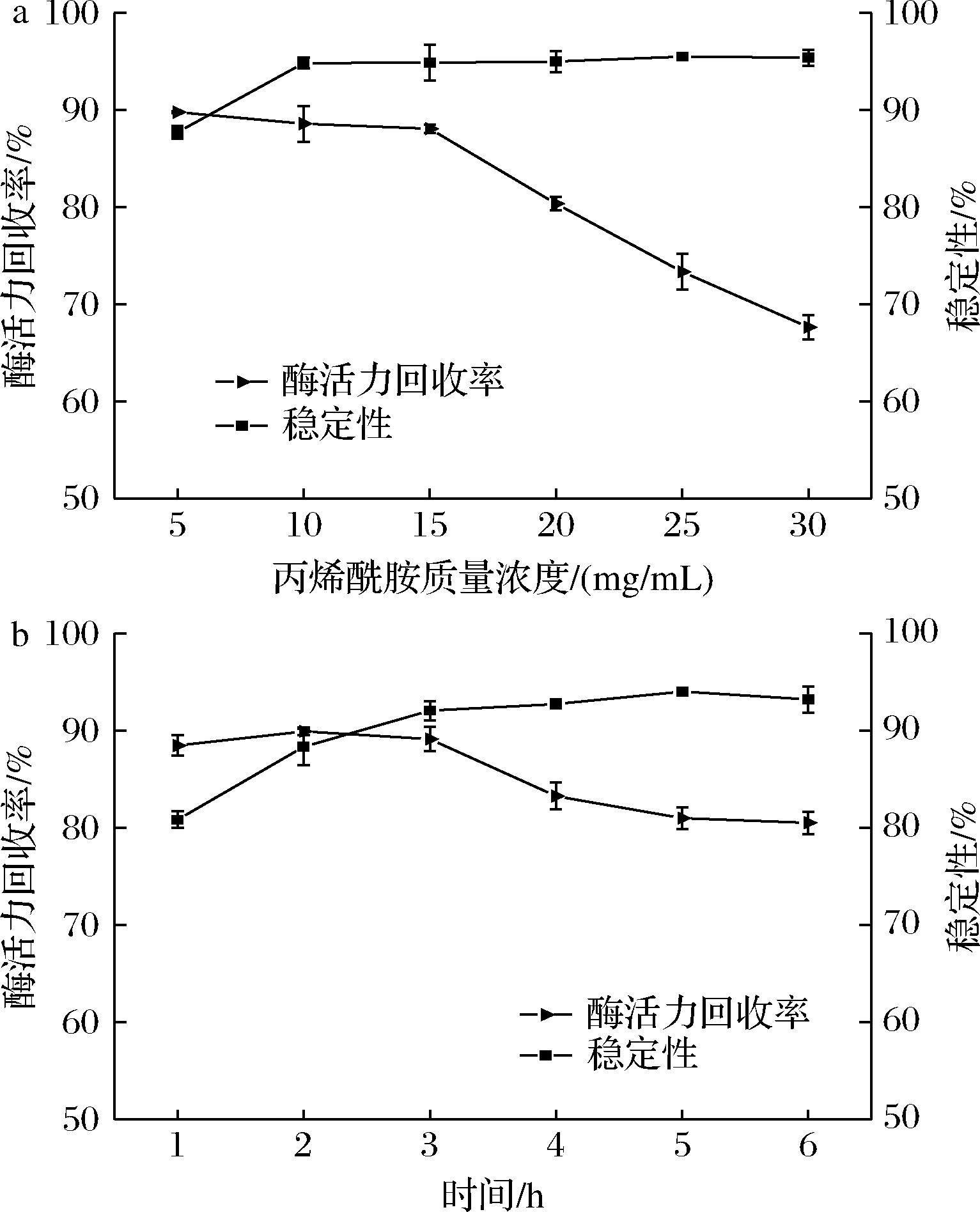
a-丙烯酰胺浓度;b-时间
图4 不同因素对Lipase@Resins表面聚合的影响
Fig.4 Effect of different factors on the surface polymerization of Lipase@Resins
2.1.3 Lipase@Resins的表面聚合
酶纳米凝胶的物理和化学性质受到丙烯酰胺浓度的影响,如图4-a所示,随着丙烯酰胺浓度的增加,酶活力回收率有所下降,但酶的稳定性基本维持在90%左右,这可能是由于丙烯酰胺的浓度增加,使聚合物壳层厚度增加,导致底物传质阻力变大,从而使得酶活力回收率降低,但聚合物壳层厚度增加的同时带来了稳定性的增加,因此选择10 mg/mL作为丙烯酰胺的质量浓度条件。从图4-b可看出,表面聚合时间为3 h是最合适的,此时酶活力回收率和稳定性分别为89.14%和92.05%。
2.2 Gel-coated Lipase@Resins的结构表征
2.2.1 红外光谱
采用傅里叶变换红外光谱仪对D101 Resins、Lipase@Resins、Gel-coated Lipase@Resins进行分析,结果如图5所示。酰胺Ⅰ带(1 600~1 700 cm-1)和酰胺Ⅱ带(1 500~1 600 cm-1)是蛋白质的特征吸收峰,对Lipase@Resins的红外光谱进行分析可以得知,在1 653 cm-1处的峰与酰胺Ⅰ带中C![]() O伸缩振动有关,1 511 cm-1处的峰与酰胺Ⅱ带中C—N的伸缩振动和N—H的弯曲振动有关,与D101 Resins的红外光谱对比表明脂肪酶被吸附在大孔树脂D101表面。在固定化酶Gel-coated Lipase@Resins的红外光谱中,3 313 cm-1处的峰对应为N—H的伸缩振动,2 925 cm-1和2 857 cm-1处的峰对应为亚甲基的反对称与对称伸缩振动,1 667 cm-1处的峰对应为C
O伸缩振动有关,1 511 cm-1处的峰与酰胺Ⅱ带中C—N的伸缩振动和N—H的弯曲振动有关,与D101 Resins的红外光谱对比表明脂肪酶被吸附在大孔树脂D101表面。在固定化酶Gel-coated Lipase@Resins的红外光谱中,3 313 cm-1处的峰对应为N—H的伸缩振动,2 925 cm-1和2 857 cm-1处的峰对应为亚甲基的反对称与对称伸缩振动,1 667 cm-1处的峰对应为C![]() O的伸缩振动,1 453 cm-1处的峰对应为亚甲基的弯曲振动,1 120 cm-1处的峰对应于C—N的伸缩振动,以上结果证明了聚丙烯酰胺纳米凝胶涂层的成功包覆。
O的伸缩振动,1 453 cm-1处的峰对应为亚甲基的弯曲振动,1 120 cm-1处的峰对应于C—N的伸缩振动,以上结果证明了聚丙烯酰胺纳米凝胶涂层的成功包覆。
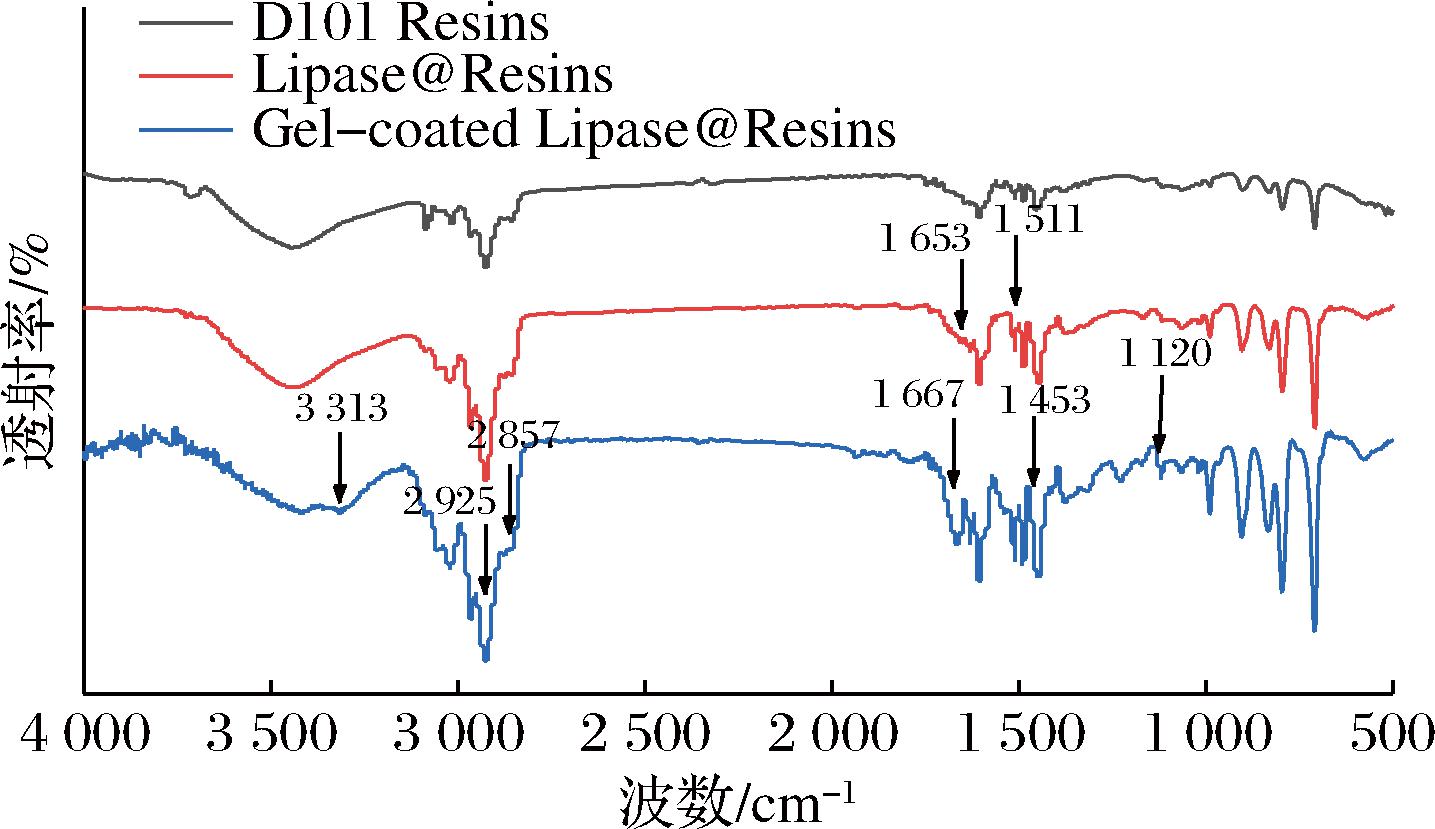
图5 D101 Resins、Lipase@Resins和Gel-coated Lipase@Resins的红外光谱图
Fig.5 Infrared spectra of D101 Resins, Lipase@Resins, and Gel-coated Lipase@Resins
2.2.2 比表面积和孔径
如表1所示,树脂的比表面积和孔体积分别是678.183 m2/g和1.467 cm3/g,吸附过脂肪酶以后,表面以及内部孔道中吸附有酶蛋白,比表面积和孔体积分别下降到626.935 m2/g和1.341 cm3/g,凝胶包覆以后,比表面积和孔体积下降到580.845 m2/g和1.133 cm3/g,虽然有一定程度的下降,但是下降程度不大,说明凝胶成功包覆,并且对树脂内部的孔道没有起到破坏,内部孔道依然保持顺畅,不妨碍酶催化反应时的传质作用。
表1 大孔树脂和固定化酶的比表面积和孔体积参数
Table 1 BET and BJH parameters of D101 Resins, Lipase@Resins, and Gel-coated Lipase@Resins

D101 ResinsLipase@ResinsGel-coated Lipase@Resins比表面积/(m2/g)678.183626.935580.845孔体积/(cm3/g)1.4671.3411.133
2.3 Gel-coated Lipase@Resins酶学性质的研究
2.3.1 最适反应pH及酸碱稳定性
由图6-a可知,游离脂肪酶和固定化酶的最适反应pH值均为8,说明固定化并没有对脂肪酶的催化活性中心结构产生较大的影响。由图6-b可知,固定化酶对酸碱的耐受性较游离酶有了一定程度的提高,特别是Gel-coated Lipase@Resins的耐受性在pH 4和pH 9的情况下提高了大约78%和12%。
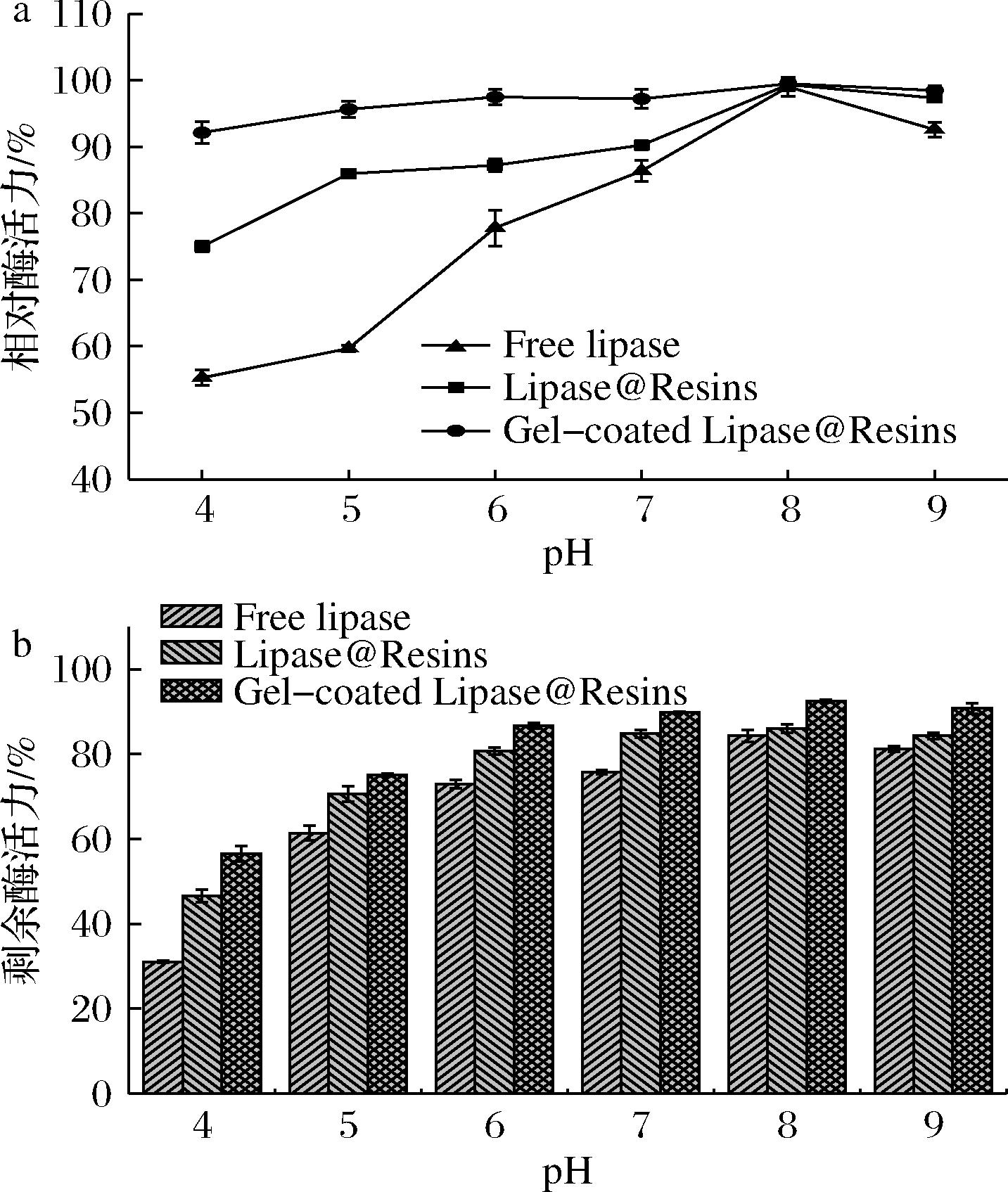
a-最适反应pH;b-酸碱稳定性
图6 固定化酶的最适反应pH和酸碱稳定性
Fig.6 Optimum reaction pH and acid-base stability of immobilized enzyme
2.3.2 最适反应温度和热稳定性
由图7-a可知,游离脂肪酶和固定化酶的最适反应温度都为50 ℃。温度<50 ℃时酶的催化活性随着温度的升高而增加,这符合一般酶催化的特性。温度>50 ℃时,游离酶的催化活性降低,而经过固定化处理后催化活性降低较少,说明经过固定化以后酶的稳定性有了一定程度的提高。在热稳定性方面,游离酶在60 ℃和70 ℃条件下酶活力损失较多,分别剩下59.5%和35.6%的酶活力。相比游离酶来说,两种形式的固定化酶在60 ℃和70 ℃酶活力损失大大减少,其中Lipase@Resins剩余酶活力为73.4%和55.8%,特别是Gel-coated Lipase@Resins剩余酶活力为83.7%和70.3%,证明凝胶包覆可使固定化酶的热稳定性进一步增强。

a-最适反应温度;b-热稳定性
图7 固定化酶的最适反应温度和热稳定性
Fig.7 Optimum reaction temperature and thermal stability of immobilized enzyme
2.3.3 有机溶剂耐受性
酶在有机溶剂等非水介质中催化活性会有较大损失,通过固定化手段能够在一定程度上减少酶活力的损失。由图8可知,游离酶对有机溶剂的耐受性较差,仅保留不到20%的酶活力,经过大孔树脂固定化以后的脂肪酶的有机溶剂的耐受性有一定程度的提高,进一步经过凝胶涂层包覆后,对这4种有机溶剂的耐受性大大提高。其中在二甲基亚砜和二甲基甲酰胺中保留40%左右的酶活力,这是由于亲水性聚丙烯酰胺凝胶层在酶蛋白的周围包裹形成水化层,有效屏蔽了酶分子和有机溶剂分子的接触,从而增加了Gel-coated Lipase@Resins对有机溶剂的耐受能力。
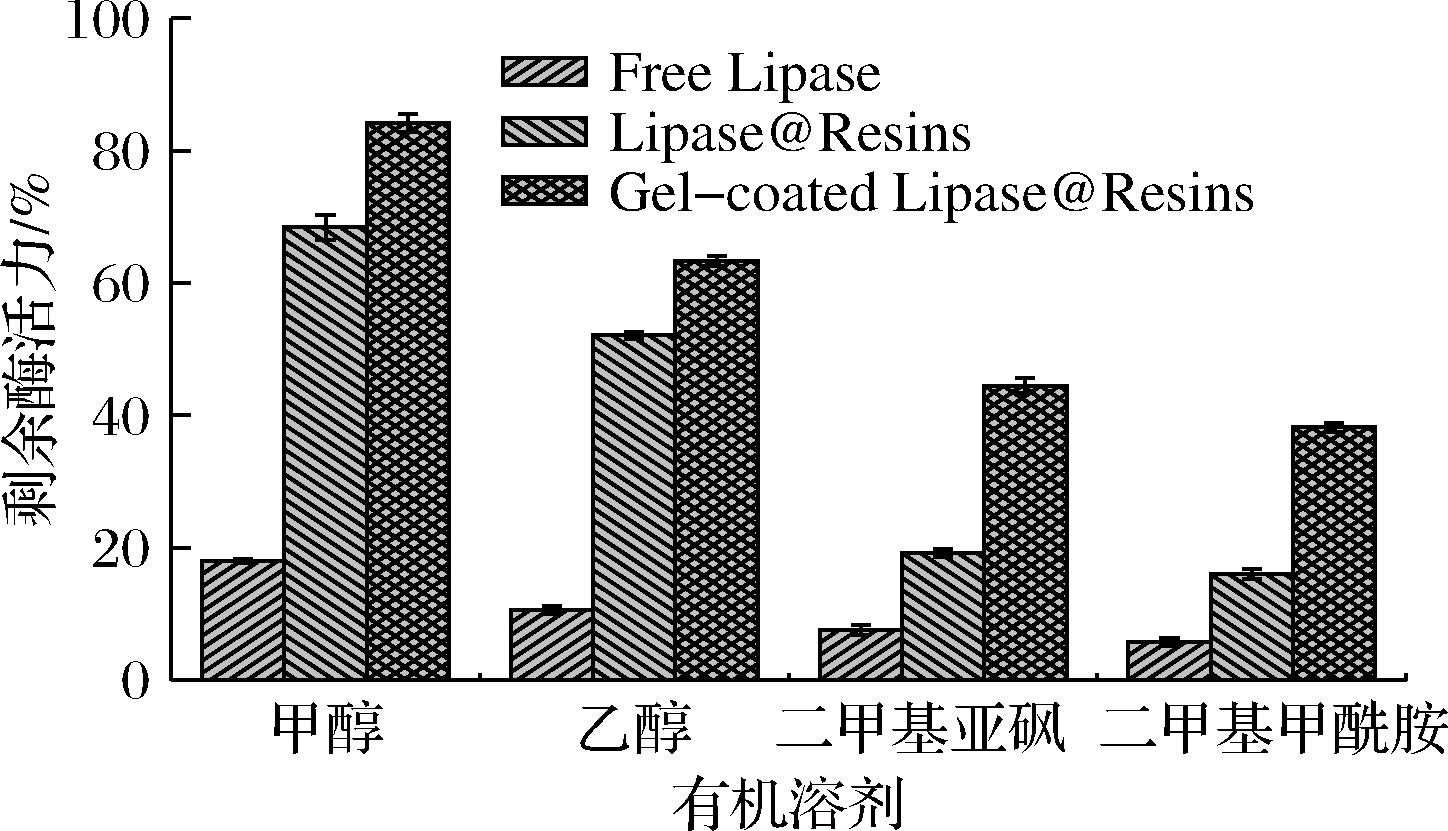
图8 固定化酶的有机溶剂耐受性
Fig.8 Organic solvent tolerance of immobilized enzyme
2.3.4 酶促反应动力学
由表2可知Gel-coated Lipase@Resins和Lipase@Resins的Km值比游离脂肪酶的Km值大,通常情况下,酶经过固定化以后其Km值都会增大,这是因为经过固定化以后酶与底物的接触面积以及底物进入酶催化活性中心都会受到影响。在本实验中聚合物壳层增加了底物进入酶催化活性中心的传质阻力,此外Gel-coated Lipase@Resins内部水解的产物无法及时扩散,也会对酶的催化活性产生一定的抑制作用,从而带来Km的增大和Vmax的减小。但由于聚合物层比较薄且通透性较好,并没有过多的增大其传质及扩散阻力,因此Gel-coated Lipase@Resins较Lipase@Resins对底物的亲和力仅略有下降。
表2 酶促反应动力学参数
Table 2 Kinetic parameters of enzymatic reaction
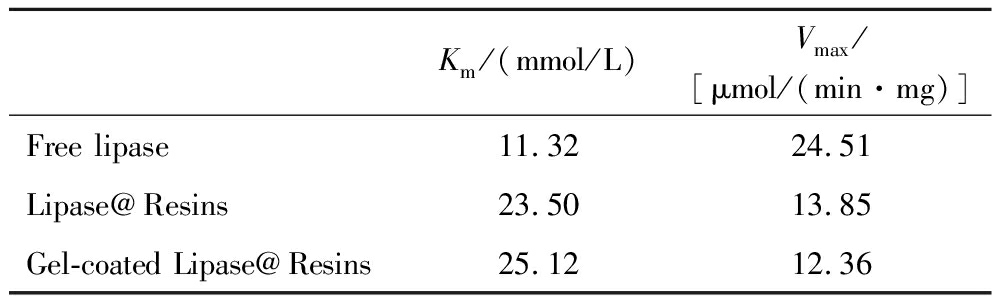
Km/(mmol/L)Vmax/[μmol/(min·mg)]Free lipase11.3224.51Lipase@Resins23.5013.85Gel-coated Lipase@Resins25.1212.36
2.4 Gel-coated Lipase@Resins合成乙酸丁酯和乙酸异戊酯
乙酸丁酯和乙酸异戊酯分别是具有菠萝和香蕉香味的化合物,在食品、化妆品以及制药行业有着广泛的用途[16-17]。为了检验所制备Gel-coated Lipase@Resins的酯合成性能,研究了在有机溶剂体系中直接酯化反应制备乙酸丁酯和无溶剂体系中转酯反应合成乙酸异戊酯的过程,并对涉及影响酯化和转酯反应的主要因素进行了探究。
2.4.1 有机溶剂体系中酯化反应合成乙酸丁酯
由图9-a可看出,以正庚烷为有机溶剂的效果最好,而以二甲基亚砜为有机溶剂时酯合成率较低,只有23.75%;由图9-b可以看出,当乙酸和丁醇的浓度均为0.1 mol/L时 酯合成率最高,达到了70%,随着底物浓度的增加,酯合成率降低;图9-c显示了乙酸和丁醇两者之间的物质量的比 对合成的影响,结果显示当两者的物质量的比为1∶1的时候,效果最好,以上结果表明在酯合成的反应体系中,过多的酸或醇可能会影响酶的催化活性,使得酯化效果降低;图9-d显示了酯化反应合成乙酸丁酯的最佳加酶量为1 g,此时酯化反应达到平衡状态,继续增加酶量,酯合成率并没有明显提高。在非水相反应体系中,水是维持酶的分子构象和发挥酶的催化活性所必需的,尽管水的影响有时是根据其含量来讨论,但实际上是水分活度在影响反应的平衡,目前最常用的方法是采用饱和盐溶液对反应体系进行预平衡,从而控制反应的水分活度[20]。如图9-e所示,当水分活度为0.54时,酯合成率最高,水分活度增加,酯合成率反而下降,这可能是由于酯化反应是可逆反应,较高的水分活度使得反应向酯化反应的逆反向进行。如图9-f所示,经过12 h的反应,乙酸丁酯的酯合成率达到了93.05%。相比较文献报道采用固定化米根霉脂肪酶为催化剂,分别以正庚烷和正己烷作为有机溶剂,经过24 h的反应,酯化率达到80%和76%[21],本实验的合成效率更高。

a-有机溶剂;b-底物浓度;c-底物摩尔比;d-加酶量;e-水分活度;f-反应时间
图9 不同因素对Gel-coated Lipase@Resins催化酯化反应合成乙酸丁酯
Fig.9 Effect of diffenrent factors on Gel-coated Lipase@Resins catalyzing esterification reaction for synthesis of butyl acetate
2.4.2 无溶剂体系中转酯反应合成乙酸异戊酯
图10显示了Gel-coated Lipase@Resins催化乙酸乙烯酯与异戊醇通过转酯反应生成乙酸异戊酯的情况,在此过程中,无需另外添加有机溶剂,乙酸乙烯酯既是反应的底物也起到了溶剂的作用,反应的副产物为乙醛,没有水的生成,从而促进反应向前进行,反应过程较易控制。图10表明在3 mL乙酸乙烯酯溶液中加入0.8 mol/L异戊醇和0.5 g固定化酶,在45 ℃下经过14 h的反应,酯合成率达到92.35%。这与MURAT[22]的结果相类似,其利用蛋白包覆的疏绵状嗜热丝孢菌脂肪酶催化乙酸乙烯酯和异戊醇在正己烷中通过转酯反应合成乙酸异戊酯,实现了95%的合成率。
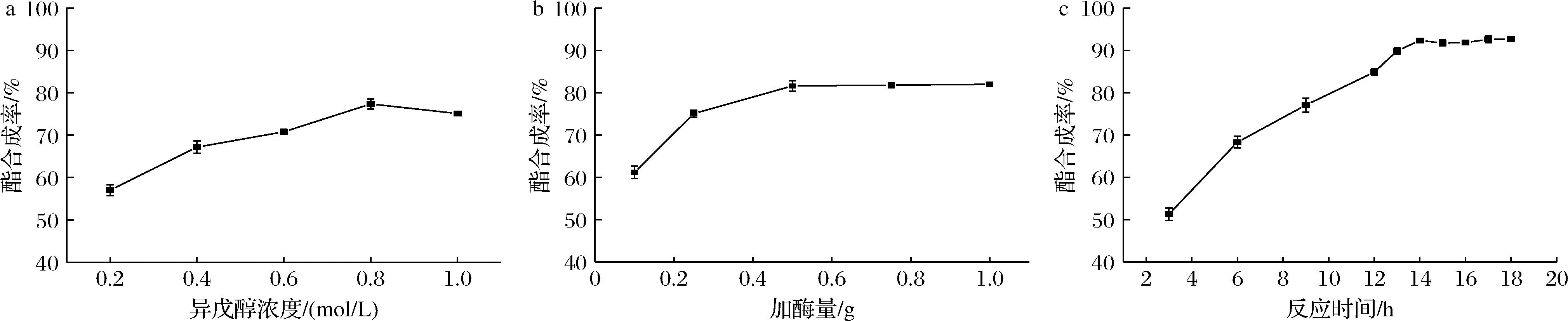
a-异戊醇浓度;b-加酶量;c-反应时间
图10 Gel-coated Lipase@Resins催化转酯反应合成乙酸异戊酯
Fig.10 Effect of different factors on Gel-coated Lipase@Resins catalyzing transesterification reaction for synthesis of isoamyl acetate
2.5 Gel-coated Lipase@Resins的重复使用性
重复使用性能是衡量固定化酶优劣的一个重要指标,从图11可以看出Gel-coated Lipase@Resins催化合成乙酸丁酯和乙酸异戊酯的过程中,连续重复利用4个批次后酯合成率分别还能达到70.83%和84.80%,依旧保持了较高的催化活性。这是因为通过凝胶包覆后,可以使脂肪酶更牢固的覆盖在树脂的表面,减少了酶的流失;同时聚合物所形成的凝胶层内合适的微环境可以有效减弱有机溶剂对酶的损伤,使得酶具有良好的重复使用性。
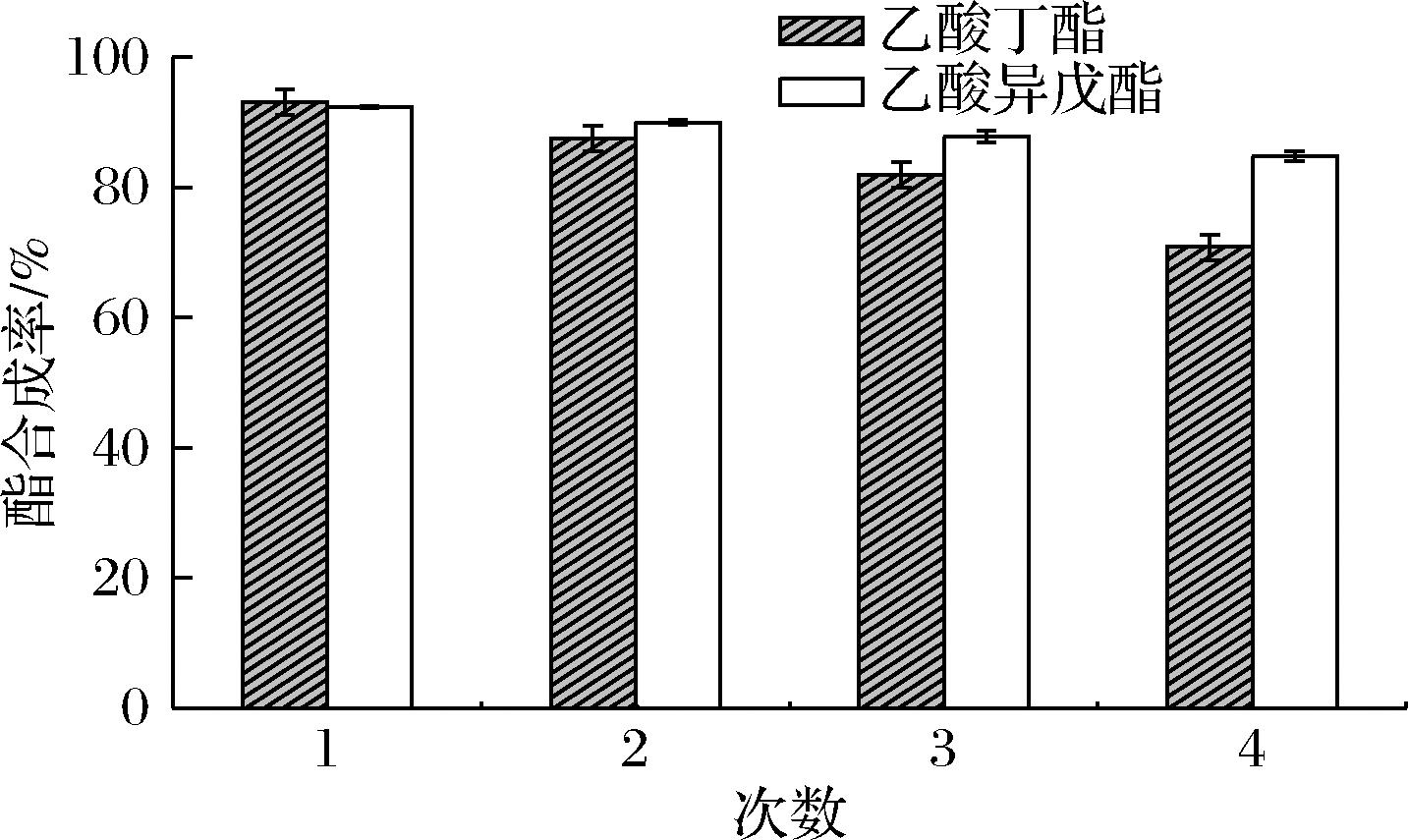
图11 Gel-coated Lipase@Resins的重复使用性
Fig.11 The reusability of Gel-coated Lipase@Resins
3 结论
本研究将树脂吸附固定化脂肪酶与酶蛋白表面修饰、聚合反应相结合,构建了凝胶涂层包覆大孔树脂固定化脂肪酶,酶学性质的研究表明其酸碱、热稳定性以及对有机溶剂的耐受性有了较大幅度的提高,这说明通过凝胶包覆所形成的聚合物壳层与酶分子之间的共价连接以及聚合物壳层内合适的微环境可以大幅度提高酶的酸碱稳定性、热稳定性和有机溶剂耐受性。
将固定化酶应用在乙酸丁酯和乙酸异戊酯的合成中,结果显示以正庚烷为溶剂,乙酸和丁醇均为0.1 mol/L,并添加1 g固定化酶,在45 ℃条件下反应12 h,乙酸丁酯的合成率达到93.05%,重复利用4次后仍然有70.83%的酯合成率;在3 mL乙酸乙烯酯溶液中加入0.8 mol/L异戊醇和0.5 g固定化酶,在45 ℃下经过14 h的反应,乙酸异戊酯的合成率达到92.35%以上,重复利用4次后仍然有84.80%的酯合成率。本研究建立了一种固定化脂肪酶的新方法,并为风味酯的制备奠定了基础。
[1] VILAS B AS R N, DE CASTRO H F.A review of synthesis of esters with aromatic, emulsifying, and lubricant properties by biotransformation using lipases[J].Biotechnology and Bioengineering, 2022, 119(3):725-742.
AS R N, DE CASTRO H F.A review of synthesis of esters with aromatic, emulsifying, and lubricant properties by biotransformation using lipases[J].Biotechnology and Bioengineering, 2022, 119(3):725-742.
[2] DE OLIVEIRA U M F, LIMA DE MATOS L J B, DE SOUZA M C M, et al.Efficient biotechnological synthesis of flavor esters using a low-cost biocatalyst with immobilized Rhizomucor miehei lipase[J].Molecular Biology Reports, 2019, 46(1):597-608.
[3] RODRIGUES R C, VIRGEN-ORT Z J J, DOS SANTOS J C S, et al.Immobilization of lipases on hydrophobic supports:Immobilization mechanism, advantages, problems, and solutions[J].Biotechnology Advances, 2019, 37(5):746-770.
Z J J, DOS SANTOS J C S, et al.Immobilization of lipases on hydrophobic supports:Immobilization mechanism, advantages, problems, and solutions[J].Biotechnology Advances, 2019, 37(5):746-770.
[4] ALVAREZ E, RODRIGUEZ J, VILLA R, et al.Clean enzymatic production of flavor esters in spongelike ionic liquids[J].ACS Sustainable Chemistry &Engineering, 2019, 7(15):13307-13314.
[5] ZHI G Y, LI X B, WANG Y, et al.A new approach to synthesis of benzyl cinnamate:Kinetic and thermodynamic investigation[J].Current Catalysis, 2021, 10(1):81-87.
[6] MARTINS A B, DA SILVA A M, SCHEIN M F, et al.Comparison of the performance of commercial immobilized lipases in the synthesis of different flavor esters[J].Journal of Molecular Catalysis B:Enzymatic, 2014, 105:18-25.
[7] ATE S, TÜRK B, BAYRAKTAR E, et al.Enhanced ethyl butyrate production using immobilized lipase[J].Artificial Cells, Nanomedicine, and Biotechnology, 2013, 41(5):339-343.
S, TÜRK B, BAYRAKTAR E, et al.Enhanced ethyl butyrate production using immobilized lipase[J].Artificial Cells, Nanomedicine, and Biotechnology, 2013, 41(5):339-343.
[8] KRISHNA S H, MANOHAR B, DIVAKAR S, et al.Lipase-catalyzed synthesis of isoamyl butyrate:Optimization by response surface methodology[J].Journal of the American Oil Chemists’ Society, 1999, 76(12):1483-1488.
[9] MONTEIRO R R C, NETO D M A, FECHINE P B A, et al.Ethyl butyrate synthesis catalyzed by lipases A and B from Candida antarctica immobilized onto magnetic nanoparticles.improvement of biocatalysts’ performance under ultrasonic irradiation[J].International Journal of Molecular Sciences, 2019, 20(22):5807.
[10] TAGHIZADEH T, AMERI A, TALEBIAN-KIAKALAIEH A, et al.Lipase@zeolitic imidazolate framework ZIF-90:A highly stable and recyclable biocatalyst for the synthesis of fruity banana flavour[J].International Journal of Biological Macromolecules, 2021, 166:1301-1311.
[11] JI S, LIU W, SU S, et al.Chitosan derivative functionalized carbon nanotubes as carriers for enzyme immobilization to improve synthetic efficiency of ethyl caproate[J].LWT-Food Science and Technology, 2021, 149:111897.
[12] 成天童, 何冰芳.大孔树脂MI-BN4固定化β-呋喃果糖苷酶Fru6及催化合成低聚果糖[J].食品与发酵工业, 2019, 45(20):16-21.CHENG T T, HE B F.Immobilization of β-fructofuranosidase Fru6 by macroporous resin MI-BN4 and its application in catalytic synthesis of fructo-oligosaccharides[J].Food and Fermentation Industries, 2019, 45(20):16-21.
[13] 江慧芳, 王雅琴, 刘春国.三种脂肪酶活力测定方法的比较及改进[J].化学与生物工程, 2007, 24(8):72-75.JIANG H F, WANG Y Q, LIU C G.Comparison and improvement of three determination methods for lipase activity[J].Chemistry &Bioengineering, 2007, 24(8):72-75.
[14] 俞建英, 蒋宇, 王善利.生物化学实验技术[M].北京:化学工业出版社, 2001:161-191.YU J Y, JIANG Y, WANG S L.Biochemical Techniques[M].Beijing:Chemical Industry Press, 2001:161-191.
[15] 孔宪, 李畅原, 卢滇楠, 等.青霉素酰化酶纳米凝胶的制备与性质[J].化工学报, 2011, 62(6):1641-1648.KONG X, LI C Y, LU D N, et al.Preparation and characterization of penicillin acylase nanogel[J].CIESC Journal, 2011, 62(6):1641-1648.
[16] WANG H H, LIU W J, GAO L Y, et al.Synthesis of n-butyl acetate via reactive distillation column using Candida antarctica lipase as catalyst[J].Bioprocess and Biosystems Engineering, 2020, 43(4):593-604.
[17] ZARE M, GOLMAKANI M T, NIAKOUSARI M.Lipase synthesis of isoamyl acetate using different acyl donors:Comparison of novel esterification techniques[J].LWT, 2019, 101:214-219.
[18] 吴茜茜, 穆文侠, 孙健, 等.大孔树脂D101固定中性脂肪酶及其生物催化应用[J].食品与发酵工业, 2008, 34(8):65-68.WU Q Q, MU W X, SUN J, et al.Lipase immobilization on macroporous resin D101 and application in bio-synthesis[J].Food and Fermentation Industries, 2008, 34(8):65-68.
[19] 戈钧. 脂肪酶纳米凝胶及其非水相催化合成有机化学品的研究[D].北京:清华大学, 2009.GE J.Design, fabrication and application of lipase nanogel for chemical synthesis in non-aqueous media[D].Beijing:Tsinghua University,2009.
[20] GUMEL A M, ANNUAR M S M, HEIDELBERG T, et al.Lipase mediated synthesis of sugar fatty acid esters[J].Process Biochemistry, 2011, 46(11):2079-2090.
[21] BEN SALAH R, GHAMGHUI H, MILED N, et al.Production of butyl acetate ester by lipase from novel strain of Rhizopus oryzae[J].Journal of Bioscience and Bioengineering, 2007, 103(4):368-372.
[22] MURAT T.Synthesis of isoamyl acetate using protein-coated microcrystals of different lipases[J].Polish Journal of Chemical Technology, 2023, 25(2):15-20.