果胶是一类广泛存在于植物细胞壁和胞间层中的复杂多糖,具有增稠、乳化、稳定和成膜等多种功能特性,在食品、化妆品、医药等领域有着广泛应用。然而,天然果胶的应用受到其自身物化性质的限制,例如水溶性差、易受微生物降解、生物活性较低等[1-2]。因此,采用接枝共聚法对果胶进行分子修饰,进而拓展其应用领域,一直是多糖化学领域的研究热点。该方法在保留果胶骨架结构的同时引入新的官能团,从而赋予果胶新的功能特性。
酚酸类化合物,如没食子酸、咖啡酸、阿魏酸等,因其优异的抗氧化、抑菌、抗炎和抗肿瘤等生物活性,被认为是理想的果胶接枝修饰基团[3]。传统的酚酸接枝方法主要有化学催化法和自由基接枝法。然而,这些方法普遍存在反应条件苛刻、选择性差、催化剂残留等问题,不仅增加了产物分离纯化的难度,还可能引入有害物质,不利于果胶衍生物在食品、医药等领域的应用[4]。
脂肪酶是一类在非水相中能催化酯交换反应的酶,常在叔丁醇、甲基叔丁醚(methyl tert-butyl ether, MTBE)等有机溶剂中,催化脂溶性物质的酯化修饰。与化学催化法和自由基接枝法相比,脂肪酶催化酯化反应的选择性更高,产物结构更易控制,残留的酶易于去除,更加符合绿色化学的理念。如XU等[5]以不同种类的脂肪酶为催化剂,在MTBE中对白藜芦醇进行酯化修饰,取代度最高可达98.7%。但对于果胶等水溶性大分子多糖,难以利用脂肪酶直接对其进行酰化修饰。因此,本课题组尝试以脂肪酶为催化剂,在水/有机溶剂两相体系中制备没食子酸-果胶共聚物,重点考察反应介质种类对接枝率的影响,并系统评价改性产物的抗氧化和抑菌活性,以期获得兼具高接枝率和优异生物活性的果胶衍生物。本研究不仅可为果胶的功能化改性提供新的思路和方法,还可拓宽果胶基天然防腐剂在食品、化妆品等领域的应用,具有重要的理论意义和实际应用价值。
1 材料与方法
1.1 材料与仪器
果胶、没食子酸、DPPH、β-胡萝卜素,上海麦克林生化科技有限公司;脂肪酶,上海阿拉丁试剂有限公司;无水乙醇、四氢呋喃(tetrahydrofuran,THF)、二甲基亚砜(dimethyl sulfoxide, DMSO)、N,N-二甲基甲酰胺(N,N-dimethylformamide, DMF)、MTBE、二氯甲烷,西陇化工股份有限公司;大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)菌株,中国微生物菌种收藏管理中心;Luria-Bertani(LB)液体培养基、LB琼脂培养基、液体培养基、真菌培养基、营养琼脂,北京陆桥技术有限公司。
Nicolet iSTM 10傅里叶红外光谱(Fourier transform infrared spectrometry, FTIR)仪、EscaLab 250Xi X射线光电子能谱(X-ray photoelectron spectrometry, XPS)仪,美国赛默飞世尔有限责任公司;T9紫外可见光谱(ultraviolet-visible spectrophotometry,UV-Vis)仪,北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 没食子酸-果胶共聚物的制备
首先,将30 mmol没食子酸溶解于300 mL DMSO中,同时将10 g天然果胶(Na-Pe)溶解于300 mL去离子水中并加入1 g脂肪酶。然后,将两种溶液混合,于60 ℃下反应24 h。反应结束后,通过旋转蒸发除去混合溶液中的有机溶剂,再将样品在7 000~14 000 Da透析袋中透析96 h,以去除未反应的没食子酸。最后,通过冷冻干燥除去水分,得到没食子酸接枝果胶,将其编号为DMSO-Pe[6-8]。
采用同样的方法,分别在DMF/水、THF/水和MTBE/水溶剂条件制备没食子酸-果胶共聚物,编号分别为DMF—Pe、THF—Pe和MTBE—Pe。
1.2.2 结构表征
UV-Vis分析:将样品溶解于去离子水中,在200~800 nm范围内扫描吸收光谱。
FTIR分析:将样品与KBr混合压片,在4 000~400 cm-1范围内扫描32次,步长4 cm-1,表征样品的官能团变化。
XPS分析:将样品涂布在支架上,以C1s(284.80 eV)校正电荷,Al Kα射线(1 486.6 eV)为X射线源,分析C1s高分辨谱。
1.2.3 接枝率测定
采用分光光度法测定改性果胶的酚酸接枝率。配制10 g/L改性果胶溶液并适当稀释,测定其在特定波长下的吸光度,每个样品重复3次。同时配制酚酸标准溶液,在相同条件下测定吸光度,建立浓度-吸光度标准曲线。将样品吸光度代入标准曲线,计算接枝酚酸含量,再根据公式(1)计算接枝率[3]:
接枝率![]()
(1)
式中:ρ1,改性果胶酚酸含量,mg/L;ρ2,纯酚酸含量,mg/L。
1.2.4 DPPH自由基清除率
配制DPPH乙醇溶液,使其在最大吸收波长处吸光度约为0.8。取4 mL DPPH溶液,加入60 μL 1 mg/L果胶溶液,暗处静置30 min后测定吸光度。另外,空白组以无水乙醇代替样品,按照公式(2)计算DPPH自由基清除率[9]:
DPPH自由基清除率![]()
(2)
式中:A0,参照样的吸光度;A1,样品的吸光度。
1.2.5 β-胡萝卜素漂白抑制率
制备含1 mg/mL β-胡萝卜素的二氯甲烷溶液,加入亚油酸、吐温-80和水,40 ℃减压蒸发除去氯仿,形成乳化液。将乳化液稀释,加入60 μL 1 mg/L果胶溶液,50 ℃水浴120 min,测定470 nm处吸光度。空白样品使用无水乙醇代替所测样品。β-胡萝卜素漂白的抑制率按公式(3)计算[10]:
β-胡萝卜素漂白抑制率![]()
(3)
式中:![]() 和
和![]() 分别表示空白样在加热前后的吸光度
分别表示空白样在加热前后的吸光度![]() 和
和![]() 分别表示花色苷样品在加热前后的吸光度(470 nm)。
分别表示花色苷样品在加热前后的吸光度(470 nm)。
1.2.6 抑菌活性测定
采用抑菌圈法评估天然果胶和改性果胶对E.coli和S.aureus的抑菌活性[11]。将活化菌液加入50 ℃左右的平板培养基中,使菌浓度达106~107 CFU/mL,倒平板。用无菌打孔器在平板上打孔,加入60 μL 质量分数5%的果胶溶液。4 ℃条件下使果胶溶液扩散,37 ℃培养24 h,测量抑菌圈直径,评估抑菌活性。
2 结果与分析
2.1 UV-Vis和接枝率分析
由图1-a可见,天然果胶在238 nm左右有一个紫外截止波长,在紫外光区范围内没有明显的吸收峰。而4种改性果胶在该区域出现了明显的吸收峰,这是由于接枝到果胶分子上的没食子酸引入了新的价电子π-π*跃迁。这一结果初步表明,没食子酸已成功接枝到果胶分子上,形成了新的共聚物。
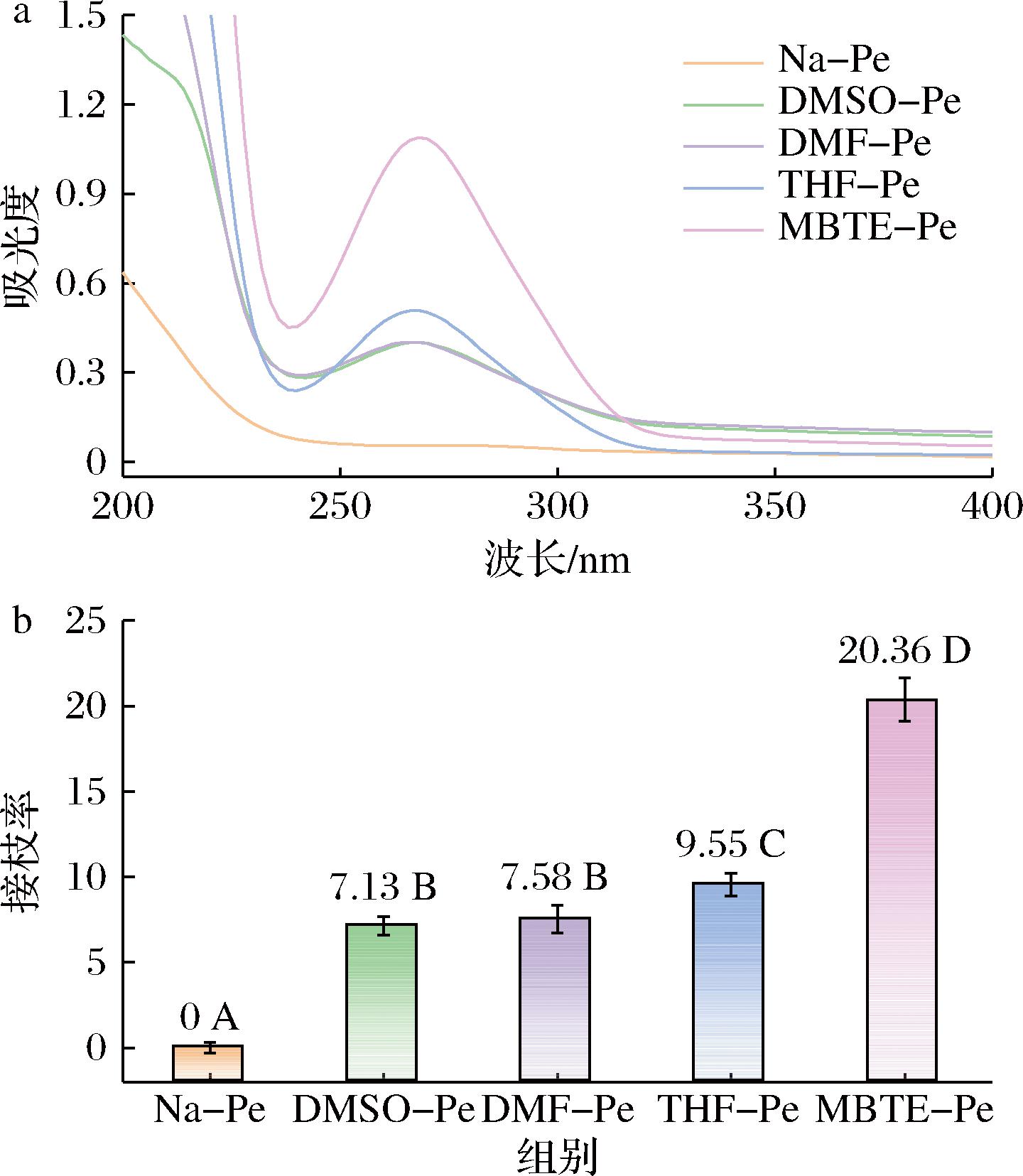
a-UV光谱图;b-接枝率
图1 天然果胶和改性果胶的UV光谱图和接枝率
Fig.1 UV spectrogram and grafting ratio of native and modified pectin
注:不同字母表示差异显著(P<0.05)(下同)。
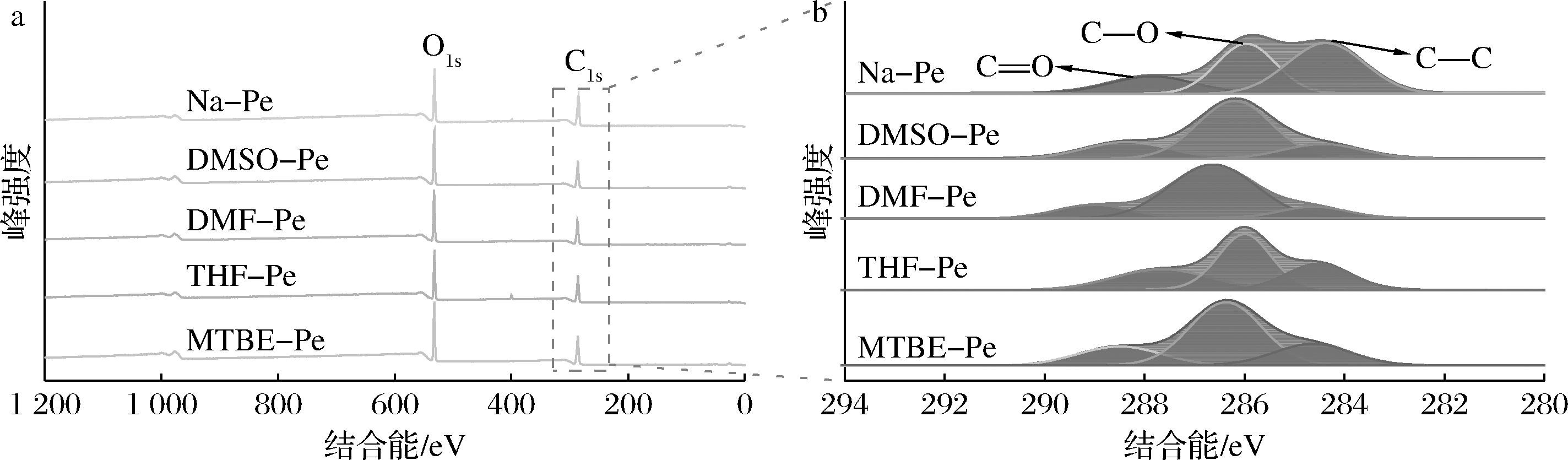
a-XPS全谱;b-C1s高分辨谱
图2 天然果胶和改性果胶的XPS光谱
Fig.2 XPS spectrogram of native and modified pectin
同时,通过分光光度法计算改性果胶的接枝率,如图1-b所示。在4种溶剂中,没食子酸均成功接枝到果胶分子上,其中在DMSO/水、DMF/水中制备的共聚物接枝率最低,在MTBE/水中制备的共聚物接枝度最高,达20.36%。这种差异可归因于溶剂的极性对脂肪酶催化活性的影响。具体来说,脂肪酶独特的结构赋予了其对溶剂环境敏感的催化活性。脂肪酶的一级结构包含Ser-His-Asp/Glu的催化三联体。在水溶液中,脂肪酶分子上α螺旋的“盖子”结构覆盖在催化三联体的活性中心上,使其与外部的溶剂隔绝,其主要表现为催化酯基水解。而当溶剂极性降低时,α螺旋的“盖子”结构打开,催化三联体的活性中心暴露在外部,从而导致其催化活性转变为催化酯基合成[12-13]。在本研究中,所用溶剂DMSO、DMF、THF和MTBE的相对极性值依次降低(0.444、0.386、0.207和0.124)。因此,可以推测,随着溶剂极性的降低,脂肪酶“盖子”打开的程度增加,酯化活性提高,导致MTBE-Pe的接枝率最高,而DMSO-Pe和DMF-Pe的接枝率最低。
2.2 XPS分析
为进一步验证没食子酸在果胶分子上的接枝,对天然果胶和改性果胶分子上的C元素结合能进行分析。由图2-a可见,各样品在结合能284和532 eV附近出现了较强的C1s和O1s峰,表明样品主要由C、O两种元素组成。进一步对C1s峰进行分峰拟合,如图3-b所示。C1s峰可分为3个子峰,其结合能为284.6、286.2和288.4 eV,分别对应于C—C/C—H、C—O和C![]() O基团中的碳原子。值得注意的是,与天然果胶相比,改性果胶中C—C/C—H峰的相对含量明显下降,而C—O和C
O基团中的碳原子。值得注意的是,与天然果胶相比,改性果胶中C—C/C—H峰的相对含量明显下降,而C—O和C![]() O峰的相对含量则明显提高。这可能是由于没食子酸接枝到果胶分子上,取代了果胶分子上的甲基。
O峰的相对含量则明显提高。这可能是由于没食子酸接枝到果胶分子上,取代了果胶分子上的甲基。
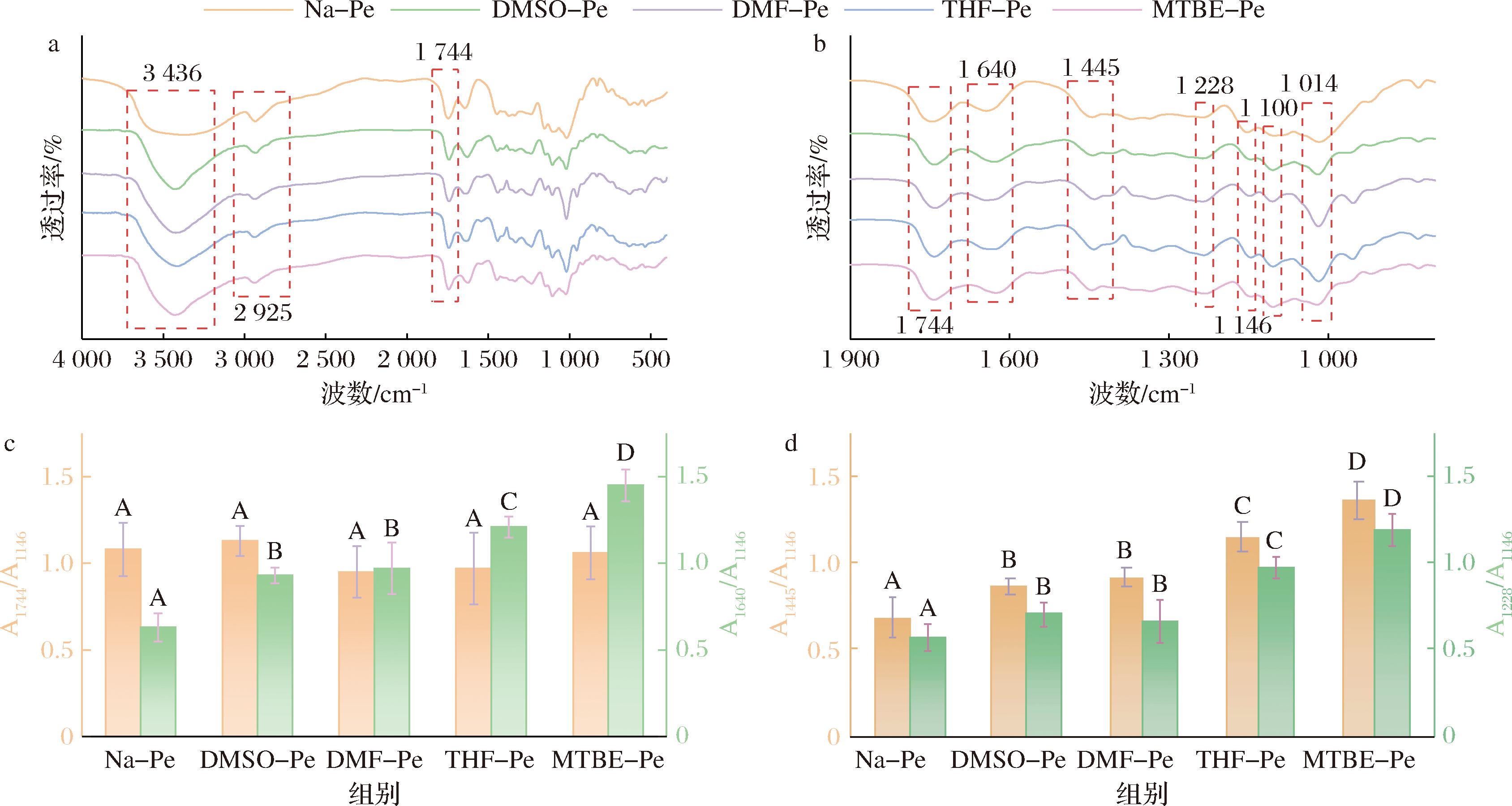
a-FTIR谱图(4 000~400 cm-1);b-FTIR局部放大图(1 900~800 cm-1);c-1 744 cm-1和1 640 cm-1处吸收峰强度与1 146 cm-1处吸收峰强度的比值;d-1 445 cm-1和1 228 cm-1处吸收峰强度与1 146 cm-1处吸收峰强度的比值
图3 天然果胶和改性果胶的FTIR图谱及相关数据
Fig.3 FTIR spectrogram and related data of native and modified pectin
2.3 FTIR分析
由图3-a可看出,天然果胶在3 436 cm-1处有一个宽而强的特征峰,这是由果胶分子上的羟基及氢键的伸缩振动造成的。与此相比,改性果胶在3 436 cm-1处的吸收峰表现为尖峰,这可能是由于没食子酸的引入带来的酚羟基造成的。另外,天然果胶在2 925 cm-1处有一个吸收峰,这是果胶分子上—CH3和—CH的伸缩振动造成的。随着没食子酸接枝率的提高,该峰的峰强度逐渐降低,这表明果胶分子上的甲酯基可能在脂肪酶的作用下发生了水解。
图3-b为FTIR局部放大图,位于1 744、1 640 cm-1处的吸收峰分别为酯基、羧基上的C![]() O伸缩振动造成的,而1 445、1 228 cm-1处的吸收峰分别对应了羧基上的C—OH、O—H弯曲振动。另外,位于1 228、1 100和1 014 cm-1处的3个特征峰是果胶分子糖环上骨架振动造成,其中1 146 cm-1处的峰对应了C—O—C的弯曲振动,是果胶分子中最不受环境因素影响的特征峰,且不与没食子酸上的基团频率峰重叠,常作为基准峰来衡量其他特征峰的强度高低。
O伸缩振动造成的,而1 445、1 228 cm-1处的吸收峰分别对应了羧基上的C—OH、O—H弯曲振动。另外,位于1 228、1 100和1 014 cm-1处的3个特征峰是果胶分子糖环上骨架振动造成,其中1 146 cm-1处的峰对应了C—O—C的弯曲振动,是果胶分子中最不受环境因素影响的特征峰,且不与没食子酸上的基团频率峰重叠,常作为基准峰来衡量其他特征峰的强度高低。
为定量评估接枝反应对特定基团含量的影响,以1 146 cm-1处特征峰的吸光度为基准,计算了1 744、1 640、1 445和1 228 cm-1处吸收峰的相对强度,结果如图3-c和图3-d所示。1 744 cm-1处吸收峰强度与1 146 cm-1处吸收峰强度的比值(A1744/A1146)在5个样品组中没有显著性差异,而A1640/A1146、A1445/A1146和A1445/A1146随着没食子酸接枝度的上升而提高。这表明,在没食子酸的接枝过程中,酯基含量保持不变,但羧基数量不断上升。造成以上现象的原因可能归结于脂肪酶的双重特异性催化活性。具体而言,脂肪酶在水相中催化果胶分子上的甲酯基水解,同时在有机相中催化果胶分子上的羧基与没食子酸分子上的羟基发生酯化反应。因此,样品组中的酯基含量未发生显著变化。同时,没食子酸分子上有1个羧基,其引入提高了改性果胶中的羧基含量[11]。
2.4 抗氧化活性分析
大多数酚酸具备优良的抗氧化活性,这主要得益于其分子结构中的酚羟基。酚羟基是良好的电子供体,并与氧自由基稳定结合,进而发挥抗氧化功能。然而,将酚酸通过共价连接与果胶分子结合时,可能会对酚羟基的结构完整性造成影响,进一步可能影响其原有的抗氧化活性。因此,通过DPPH自由基清除率和β-胡萝卜素漂白抑制率评价了天然果胶和改性果胶的抗氧化活性。如图4-a所示,天然果胶对DPPH自由基的清除率仅为1.62%,而4种改性果胶的清除率均显著高于天然果胶,说明没食子酸的接枝显著提高了果胶对DPPH自由基的清除能力,且清除率与接枝率呈正相关。β-胡萝卜素漂白实验的结果进一步支持了这一结论。如图4-b所示,天然果胶对β-胡萝卜素漂白的抑制率仅为5.21%,而改性果胶的抑制率则远高于此,其中MTBE-Pe的抑制率最高(56.4%)。以上结果表明,接枝反应后,没食子酸仍然保留了部分酚羟基,并仍赋予果胶良好的抗氧化能力[14]。
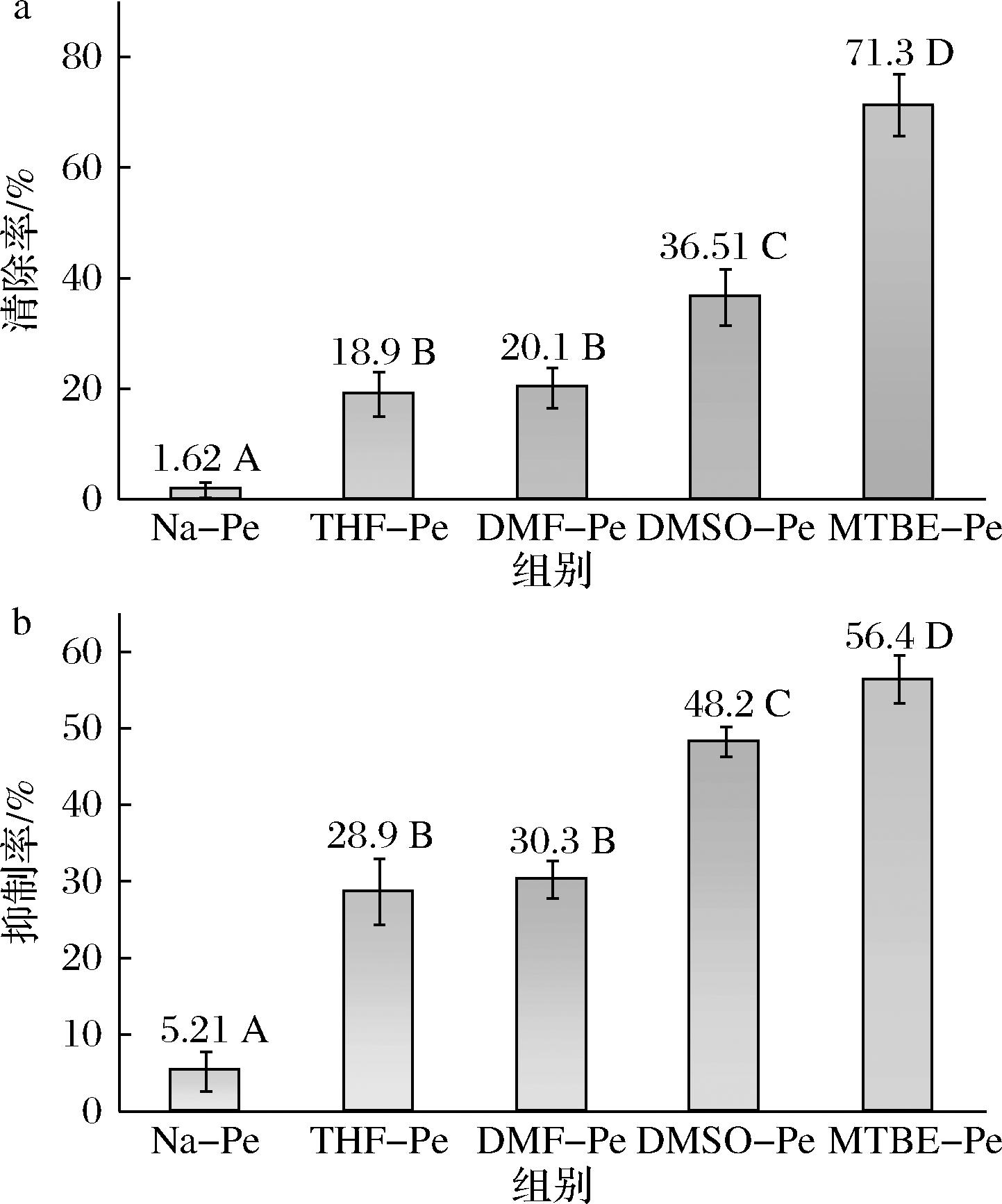
a-DPPH自由基清除率;b-β-胡萝卜素漂白抑制率
图4 天然果胶和改性果胶的抗氧化活性
Fig.4 Antioxidation activity of native and modified pectin
2.5 抑菌活性分析
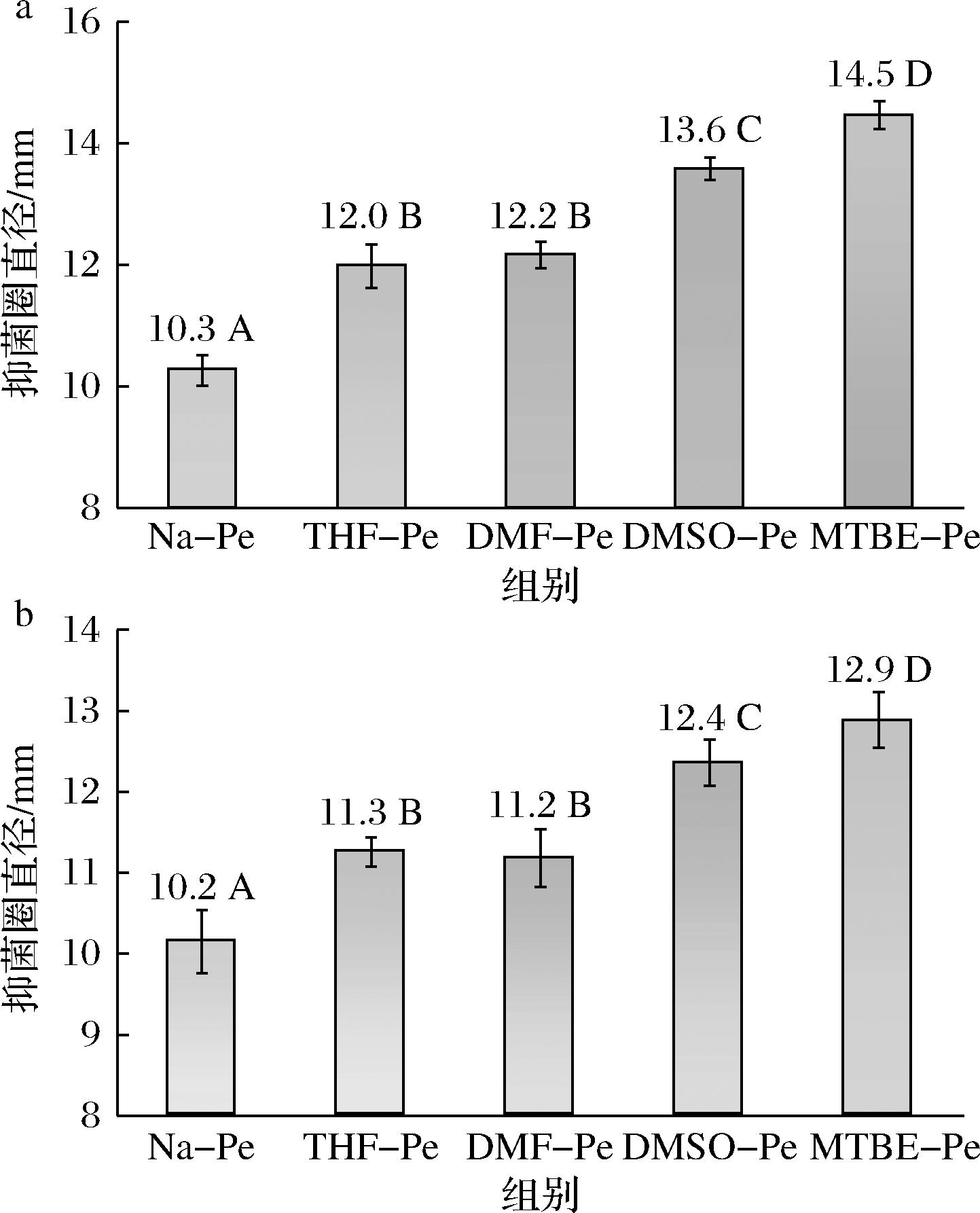
除了抗氧化活性,抑菌活性是没食子酸的另一个重要特性。通过抑菌圈法测定了果胶在改性前后对E.coli和S.aureus的抑制作用。由图5-a可见,天然果胶对E.coli的抑菌圈直径仅为10.3 mm,而4种改性果胶的抑菌圈直径均显著高于天然果胶,其中MTBE—Pe的抑菌效果最佳,DMSO—Pe次之,DMF—Pe和THF—Pe相近。这一结果表明,接枝没食子酸能够显著增强果胶对E.coli的抑制作用,且抑菌活性与接枝率呈正相关。对S.aureus的抑菌实验结果进一步证实了这一点。如图5-b所示,天然果胶对S.aureus的抑菌圈直径为10.2 mm,而改性果胶的抑菌效果则远优于天然果胶,其中MTBE—Pe的抑菌圈直径最大,达到12.9 mm,DMSO—Pe、THF—Pe和DMF—Pe依次降低。可见,没食子酸的接枝显著提高了果胶对S.aureus的抑制能力,且抑菌活性随着接枝率的易提高而增强。
a-大肠杆菌;b-金黄色葡萄球菌
图5 天然果胶和改性果胶对大肠杆菌和金黄色葡萄球菌的抑菌作用
Fig.5 Inhibition effect of native and modified pectin against E.coli and S.aureus
值得注意的是,相比于S.aureus,改性果胶对E.coli表现出更强的抑制作用。这可能与两种菌株的细胞壁结构差异有关。作为革兰氏阳性菌,S.aureus的细胞壁主要由肽聚糖组成,缺乏革兰氏阴性菌特有的外膜结构。没食子酸分子中的酚羟基可以与肽聚糖形成氢键,破坏细胞壁的完整性,从而抑制细菌生长[15]。
3 结论
本文采用DMSO/水、DMF/水、THF/水和MTBE/水四种溶剂体系,在脂肪酶的催化作用下,将没食子酸接枝到果胶分子上,制备了一系列没食子酸-果胶共聚物。研究发现,溶剂的种类对酯化反应和产物性能有显著影响。在4种溶剂体系中,MTBE/水体系的改性效果最优,制备的MTBE—Pe接枝率高达20.36%,显著高于其他3种溶剂体系。这是由于MTBE相对较低的极性有利于脂肪酶“盖子”结构的打开,从而促进了没食子酸分子与果胶羧基的酯化反应。UV-Vis、XPS和FTIR表征证实,没食子酸分子中的酚羟基在酯化反应后得以保留,赋予了改性果胶优异的抗氧化和抑菌活性。DPPH自由基清除实验和β-胡萝卜素漂白实验结果表明,MTBE—Pe的抗氧化活性最高,DMSO—Pe次之,THF—Pe和DMF—Pe相近但均低于前两者。抑菌实验进一步证实,MTBE—Pe对E.coli和S.aureus的抑制效果最强,抑菌能力与接枝率呈正相关。综上所述,本研究通过溶剂效应调控,优化了脂肪酶催化合成没食子酸-果胶共聚物的工艺,获得了接枝率高、抗氧化和抑菌活性强的MTBE—Pe产物。这不仅拓展了多酚酸果胶酯衍生物的种类,也为高活性果胶基功能产品的开发提供了新的思路和方法。
[1] 刘敏, 罗国柳, 覃小丽, 等.果胶酯化度对酪蛋白-果胶相互作用及其复合物性能的影响[J].食品与发酵工业, 2023, 49(24):80-87.LIU M, LUO G L, QIN X L, et al.Interaction and properties of the noncovalent of casein-pectin complexes:Effect of esterified degree of pectin[J].Food and Fermentation Industries, 2023, 49(24):80-87.
[2] 马开元, 孙晓洋, 陈复生, 等.pH对豌豆蛋白-高酯果胶复合物理化和结构特性的影响[J].食品与发酵工业, 2024, 50(3):181-187.MA K Y, SUN X Y, CHEN F S, et al.Effect of pH on physicochemical and structural properties of pea protein-high methoxyl pectin complex[J].Food and Fermentation Industries, 2024, 50(3):181-187.
[3] FU L L, RU Y, HONG Q L, et al.Active packaging coatings based on agarose caffeate:Preparation, characterisation, and application in grass carp (Ctenopharyngodon idellus) preservation[J].Food Packaging and Shelf Life, 2023, 37:101089.
[4] FU L L, XIAO Q, RU Y, et al.Bio-based active packaging:Gallic acid modified agarose coatings in grass carp (Ctenopharyngodon idellus) preservation[J].International Journal of Biological Macromolecules, 2024, 255:128196.
[5] XU L J, YANG T, WANG J, et al.Immobilized lipase based on hollow mesoporous silicon spheres for efficient enzymatic synthesis of resveratrol ester derivatives[J].Journal of Agricultural and Food Chemistry, 2021, 69(32):9067-9075.
[6] LIU J N, ZHUANG Y H, HU Y H, et al.Improving the color stability and antioxidation activity of blueberry anthocyanins by enzymatic acylation with p-coumaric acid and caffeic acid[J].LWT, 2020, 130:109673.
[7] ZHANG G G, ZHENG C M, HUANG B Q, et al.Preparation of acylated pectin with gallic acid through enzymatic method and their emulsifying properties, antioxidation activities and antibacterial activities[J].International Journal of Biological Macromolecules, 2020, 165:198-204.
[8] LIU J N, WANG T L, HUANG B Q, et al.Pectin modified with phenolic acids:Evaluation of their emulsification properties, antioxidation activities, and antibacterial activities[J].International Journal of Biological Macromolecules, 2021, 174:485-493.
[9] LIU J N, CHEN B Q, HU Q Y, et al.Pectin grafted with resorcinol and 4-hexylresorcinol:Preparation, characterization and application in meat preservation[J].International Journal of Biological Macromolecules, 2023, 237:124212.
[10] YANG W, KORTESNIEMI M, YANG B R, et al.Enzymatic acylation of anthocyanins isolated from alpine bearberry (Arctostaphylos alpina) and lipophilic properties, thermostability, and antioxidant capacity of the derivatives[J].Journal of Agricultural and Food Chemistry, 2018, 66(11):2909-2916.
[11] WANG P K, FEI P, ZHOU C X, et al.Preparation of acylated pectins with phenolic acids through lipase-catalyzed reaction and evaluation of their preservation performance[J].LWT, 2021, 147:111615.
[12] NAJJAR A, HASSAN E A, ZABERMAWI N, et al.Optimizing the catalytic activities of methanol and thermotolerant Kocuria flava lipases for biodiesel production from cooking oil wastes[J].Scientific Reports, 2021, 11(1):13659.
[13] CEN Y X, SINGH W, ARKIN M, et al.Artificial cysteine-lipases with high activity and altered catalytic mechanism created by laboratory evolution[J].Nature Communications, 2019, 10(1):3198.
[14] IBEOGU I H, BAKO H K, YAR M S, et al.Gelatin-serum plasma film incorporated with curcumin for improvement of antioxidant and antibacterial properties for fresh pork packaging application[J].Food Hydrocolloids, 2024, 149:109617.
[15] XIANG Z D, GUAN H D, ZHAO X, et al.Dietary Gallic acid as an antioxidant:A review of its food industry applications, health benefits, bioavailability, nano-delivery systems, and drug interactions[J].Food Research International, 2024, 180:114068.