鹰嘴豆是全球消费量最大的豆类之一,鹰嘴豆分离蛋白(chickpea protein isolate,CPI)具有氨基酸比例均衡、易被人体消化吸收、低致敏性等优点[1-2],相较于其他植物蛋白有更广阔的应用潜力。但相关研究表明,CPI溶解度低、热稳定性差、乳化性能较差,这使得CPI在食品精深加工中的直接应用受到限制[3-5]。因此,改善CPI功能性质,提高其深加工利用成为亟待解决的问题。
目前,国内外学者将电子束[6]、高压均质[7]、超声波[3]、pH偏移[8]、TG酶交联[9]等方法应用到CPI改性中,使其理化功能性质得到一定程度改善。琥珀酰化改性是一种化学衍生技术,通过琥珀酸酐(succinic anhydride,SA)修饰蛋白质的氨基、羟基和硫醇基团来改变蛋白质的带电状态,影响蛋白质的结构、表面电荷密度和功能特性[10],具有价格低廉、高效、可控性强的优势,且SA可作为调味剂用于食品添加,被美国食品及药物管理局(Food and Drug Administration,FDA)认为是安全的[11]。研究表明酰化改性对蛋白质的溶解性、乳化特性、持油性等功能性质具有良好的改善效果。如豌豆蛋白经琥珀酰化修饰后其溶解度得到显著提升(P<0.05),从约20%提高到80%左右,即使在蛋白的等电点附近,改性后的豌豆蛋白也具有良好的溶解性(达到60%)[12]。MIEDZIANKA等[13]发现酰化改性使大米浓缩蛋白较差的乳化性能得到显著提高(P<0.05),其乳化活性提高8.03倍,同时持水和持油能力也有所改善。YIN等[14]报道了琥珀酰化显著改善了芸豆分离蛋白的乳化性能(P<0.05),且琥珀酰化改性效果优于乙酰化反应,改性后芸豆分离蛋白具有更高的体外消化率。WU等[15]研究发现酰化改性使蛋清蛋白的溶解度从23.2%提高到86.7%,乳化活性从10.5 m2/g提高到30.6 m2/g。此外,酰化改性使其热诱导凝胶的持水性得到改善,凝胶硬度与咀嚼性下降,表现出更好的质构特性。而目前关于CPI的琥珀酰化改性尚未有报道,琥珀酰化改性对其结构和性质的改善效果仍不得而知。
因此,本研究以CPI为研究对象,探究不同SA添加量对CPI的酰化改性效果,并重点分析了酰化改性对CPI理化结构(如酰化度、电位、红外光谱等)和功能特性(如溶解度、乳化特性等)的影响,为鹰嘴豆蛋白的应用奠定理论基础。
1 材料与方法
1.1 材料与试剂
鹰嘴豆分离蛋白,陕西帕尼尔生物科技有限公司;SA、8-苯氨基-1-萘磺酸铵盐(8-anilino-1-naphthalenesulfonic acid,ANS),上海毕得医药科技股份有限公司;透析袋(截留蛋白分子质量8 000~14 000 Da),北京怡康盛世生物科技有限公司,其余试剂均为分析纯。
1.2 仪器和设备
F-2500荧光分光光度计,日本日立公司;IRPrestige-21傅里叶变换红外光谱系统,日本岛津公司;ZEV3600电位分析仪,英国马尔文公司;Phenom Pro扫描电镜,荷兰Phenom World公司;UV-5100紫外分光光度计,上海元析仪器有限公司。
1.3 实验方法
1.3.1 CPI的琥珀酰化
参考LU等[16]的方法并略作修改,称取CPI溶于去离子水中,室温搅拌2 h使蛋白充分溶解,配成20 mg/mL的蛋白溶液,用2 mol/L的NaOH溶液调节pH值为11.00±0.02,将SA匀速分批次添加到200 mL的CPI溶液中,SA与蛋白的质量比为0.05∶1、0.08∶1、0.1∶1、0.2∶1、0.3∶1;磁力搅拌使CPI与SA充分接触,同时将反应体系的pH值稳定在8.0~9.0,当pH值稳定在8.0±0.1时,继续反应1 h,冰浴10 min,调节pH值至7.0±0.1以终止反应。所有样品置于4 ℃透析24 h,冷冻干燥48 h后得到琥珀酰化CPI样品。对照组除不添加SA外,其余操作与实验组完全一致。
1.3.2 酰化度的测定
1.3.2.1 N-酰化度
参照LU等[16]的方法并略作修改,将2 mL样品溶液(10 mg/mL)与2 mL茚三酮溶液(20 g/L)充分混匀,沸水浴加热20 min后取出,冰水冷却至室温。取1 mL冷却后的反应液加入40 mL碘酸钾溶液(2 mg/mL)中,充分混匀后静置15 min,使用紫外可见分光光度计测定570 nm处的吸光度。CPI的琥珀酰化程度按公式(1)计算:
(1)
式中:A0,未琥珀酰化样品溶液的吸光度;A,琥珀酰化后的样品溶液的吸光度。
1.3.2.2 O-酰化度
参考ZHAO等[17]的方法测定羟基酰化度,将3.5 mol/L的NaOH溶液、2 mol/L盐酸羟胺溶液(NH2OH-HCl)与去离子水以1∶2∶1的体积比混匀后作测试溶液。取1.0 mL样品溶液(5 mg/mL)加入到2.0 mL测试溶液中,40 ℃水浴锅中反应2 h,加入1.0 mL 3 mol/L HCl溶液终止反应,添加1.0 mL 0.37 mol/L FeCl3溶液显色(分散在0.1 mol/L HCl溶液中),室温静置20 min后,离心取上清液,测定540 nm处的吸光度表示羟基酰化度。
1.3.3 傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)的测定
将冻干的蛋白质样品与KBr粉末混合后研磨压片,在室温下测定蛋白样品的红外光谱,波数设置为400~4 000 cm-1。
1.3.4 粒径和zeta电位的测定
将冻干蛋白样品溶解在去离子水中,配制0.2 mg/mL的蛋白样品溶液,使用Zetasizer Nano ZS测定蛋白质样品的粒径,zeta电位分析仪测定蛋白质样品的zeta电位。
1.3.5 表面疏水性的测定
表面疏水性的测定参考HU等[18]的方法并作适当修改。将冻干蛋白粉末溶解在磷酸盐缓冲液(10 mmol/L,pH 7.0)中,配制成不同质量浓度的(0.02、0.04、0.06、0.08、0.10 mg/mL)蛋白样品溶液。然后将100 μL的ANS溶液(8 mmol/L,pH 7.0)加入到4 mL的样品溶液中,用涡旋振荡器充分混合,并在黑暗中放置15 min后测定其荧光强度,以蛋白浓度为横坐标,荧光强度值为纵坐标,荧光强度与蛋白质浓度曲线的初始斜率即为蛋白质的表面疏水性。
1.3.6 分子柔性的测定
参考SUN等[19]的方法并适当修改,将冻干蛋白溶解在磷酸盐缓冲液(10 mmol/L,pH 7.0)中,配制5 mg/mL的蛋白样品溶液,胰蛋白酶溶解在Tris-HCl缓冲液(0.05 mol/L,pH 8.0)中,配制成1 mg/mL的胰蛋白酶溶液,取250 μL的胰蛋白酶溶液与4 mL蛋白溶液充分混合,37 ℃水浴反应15 min,反应结束后加入4 mL 50 g/L的三氯乙酸溶液终止反应。以5 000 r/min的转速离心30 min,使用紫外可见分光光度计测定上清液在280 nm处的吸光度,吸光度表征为蛋白质的分子柔性。
1.3.7 荧光光谱的测定
将冻干蛋白样品溶解在磷酸盐缓冲液(10 mmol/L,pH 7.0)中,配制0.2 mg/mL的蛋白样品溶液,设定激发波长为290 nm,激发与发射狭缝宽度均为5 nm,扫描310~450 nm的发射光谱。
1.3.8 微观结构的测定
用扫描电子显微镜观察酰化鹰嘴豆蛋白的微观结构,将真空冷冻干燥后的蛋白样品黏附在导电胶表面并喷金处理,放大1 500、5 000倍后对鹰嘴豆蛋白样品的表面形貌进行扫描。
1.3.9 溶解度和浊度的测定
溶解度根据ZHU等[20]的方法测定。称取100 mg蛋白样品分散到20 mL的去离子水中,充分水合后以8 000 r/min的转速在室温下离心15 min,取上清液,采用双缩脲法测定上清液中的可溶性蛋白浓度。蛋白质的溶解度计算如公式(2)所示:
溶解度![]()
(2)
式中:C1,离心后CPI上清液中的可溶性蛋白浓度;C0,离心前CPI溶液中的总蛋白浓度。
将冻干蛋白溶解在去离子水中,配制2 mg/mL的蛋白样品溶液,以去离子水为空白对照,使用紫外可见分光光度计测定600 nm处的吸光度表示为浊度。
1.3.10 乳化活性和乳化稳定性的测定
将冻干蛋白溶解在去离子水中,配制5 mg/mL的蛋白样品溶液,取6.0 mL蛋白溶液与3.0 mL大豆油混合,使用高速匀浆机将混合物在15 000 r/min下匀浆30 s形成乳液,立即从离心管底部吸取50 μL的新鲜乳液转移到10 mL离心管中,加入5.0 mL的SDS溶液(1 g/L)稀释,测定500 nm处的吸光度记为A0。静置10 min后,重复上述操作,记为A10。乳化活性(emulsifying activity index,EAI)与乳化稳定性(emulsifying activity index,ESI)按公式(3)、公式(4)计算:
(3)
(4)
式中:N,稀释倍数;C,蛋白质浓度;φ,油相体积分数;A0,新鲜乳液的吸光度;A10,静置10 min乳液的吸光度。
1.3.11 持水性和持油性的测定
称取100 mg的样品记为m0,置于5 mL离心管中,记录离心管与样品的总质量m1,分别加入3.5 mL的去离子水和大豆油,涡旋30 s后置于摇床中,200 r/min下振荡30 min,10 000 r/min离心20 min,去除上清液后,使用滤纸条将管壁残余液体吸干,称重样品与离心管的总质量记为m2,持水性和持油性计算如公式(5)所示:
持水性/持油性![]()
(5)
1.4 数据处理
所有实验平行重复3次,结果以平均值±标准差表示。用SPSS 21.0进行显著性分析(P<0.05,差异显著),Origin 2021软件绘图。
2 结果与分析
2.1 SA添加量对CPI酰化度的影响
蛋白酰化反应包括氨基酰化和脂肪族羟基酰化。如图1所示,随着SA添加量增加,CPI的N-酰化度和O-酰化度均逐渐增加;当SA添加量为0~0.2 g/g pro时,N-酰化度显著增加(P<0.05);当SA添加量为0~0.1 g/g pro时,O-酰化度增加相对缓慢,超过0.1 g/g pro后显著增加(P<0.05),这与LIAN等[21]的研究结果相似。原因在于SA优先与CPI表面的氨基基团发生酰化反应,后期与CPI内部的氨基酰化反应速度则减缓;而羟基酰化则相反,前期羟基几乎未参与反应,当大部分氨基被琥珀酰化取代后,羟基开始参与反应,这是由于CPI发生酰化反应时,氨基与羟基存在竞争关系,赖氨酸ε-氨基由于具有较低pKa和较弱空间位阻而具有更高的反应活性,优先参与酰化反应,当大部分氨基被取代后,羟基才开始被酰化,这与酰化燕麦分离蛋白[17]一致。SCHWENKE等[22]也发现当蚕豆分离蛋白的N-酰化度达到80%后,羟基才开始发生有效的羟基酰化。
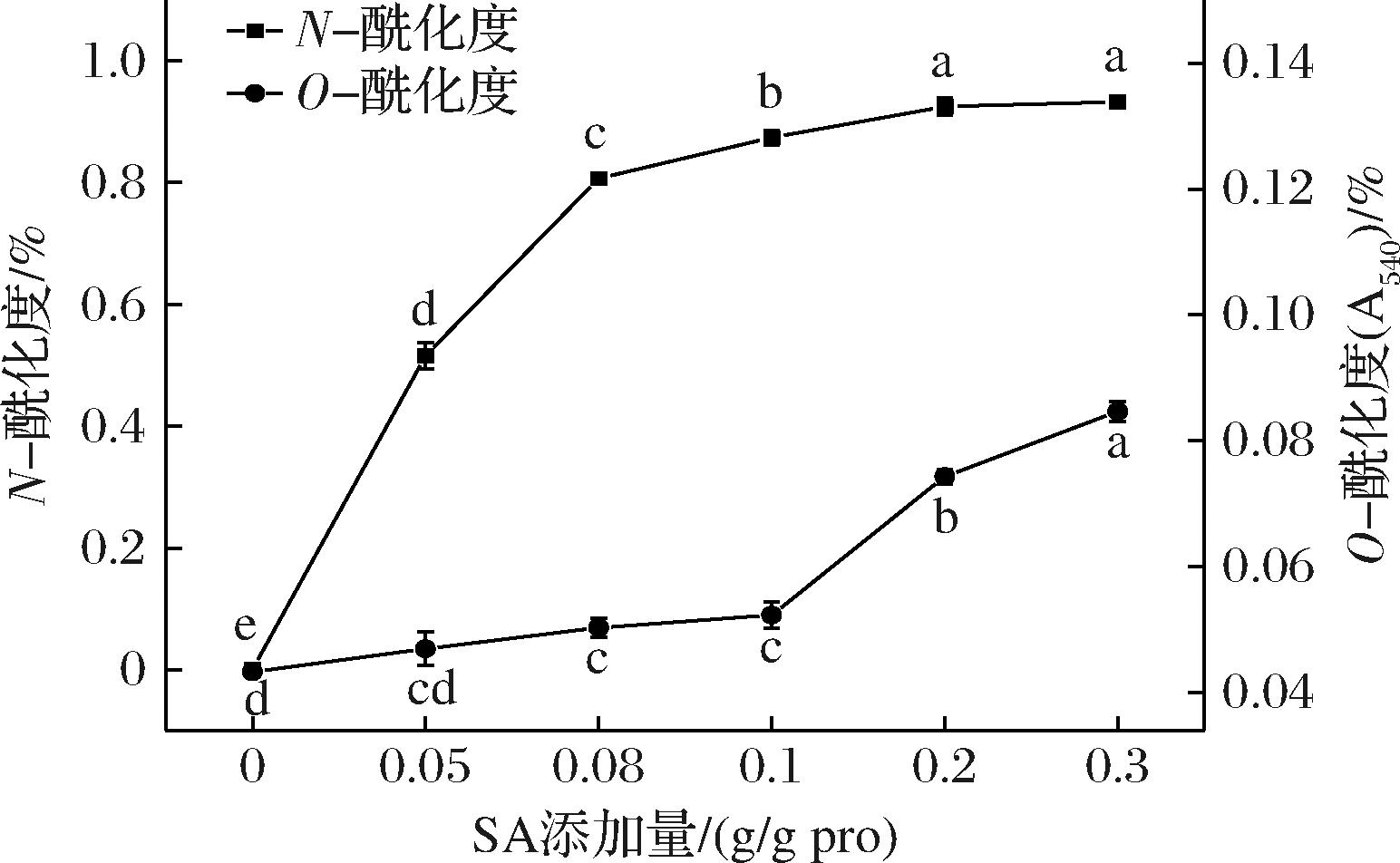
图1 SA添加量对CPI酰化度的影响
Fig.1 Effect of SA addition on acylation degree of CPI
注:不同小写字母表示差异显著(P<0.05),下同。
2.2 CPI的FTIR分析
琥珀酰化改性前后CPI的FTIR谱图如图2-a所示,琥珀酰化后的CPI在1 659、1 537 cm-1处的特征峰发生红移,分别归因于蛋白质的酰胺Ⅰ和酰胺Ⅱ条带,酰胺Ⅰ带对应C![]() O伸缩振动、C—N伸缩振动,酰胺Ⅱ带对应N—H弯曲振动、C—N伸缩振动;位于3 292 cm-1处的宽峰逐渐变窄是由于游离氨基与琥珀酰基反应后,N—H键转变为C—N键[21]。随着N-酰化度的提高,酰胺Ⅰ带和酰胺Ⅱ带的峰强度增强,酰胺Ⅲ带(1 300~1 200 cm-1)的特征峰从1 397 cm-1红移至1 403 cm-1;这些是CPI和SA反应过程中—NH2基团的丢失造成的。此外,1 397 cm-1处的特征峰峰强度随着琥珀酰化程度的增强而增强,与COO-基团的对称伸缩振动相对应[18]。以上结果表明,琥珀酰基与蛋白质—NH2之间以共价键的形式发生结合形成琥珀酰化产物,引入了新的O—H、C—N键和C
O伸缩振动、C—N伸缩振动,酰胺Ⅱ带对应N—H弯曲振动、C—N伸缩振动;位于3 292 cm-1处的宽峰逐渐变窄是由于游离氨基与琥珀酰基反应后,N—H键转变为C—N键[21]。随着N-酰化度的提高,酰胺Ⅰ带和酰胺Ⅱ带的峰强度增强,酰胺Ⅲ带(1 300~1 200 cm-1)的特征峰从1 397 cm-1红移至1 403 cm-1;这些是CPI和SA反应过程中—NH2基团的丢失造成的。此外,1 397 cm-1处的特征峰峰强度随着琥珀酰化程度的增强而增强,与COO-基团的对称伸缩振动相对应[18]。以上结果表明,琥珀酰基与蛋白质—NH2之间以共价键的形式发生结合形成琥珀酰化产物,引入了新的O—H、C—N键和C![]() O键。这与琥珀酰化改性南极磷虾蛋白[23]的研究结果相类似。
O键。这与琥珀酰化改性南极磷虾蛋白[23]的研究结果相类似。
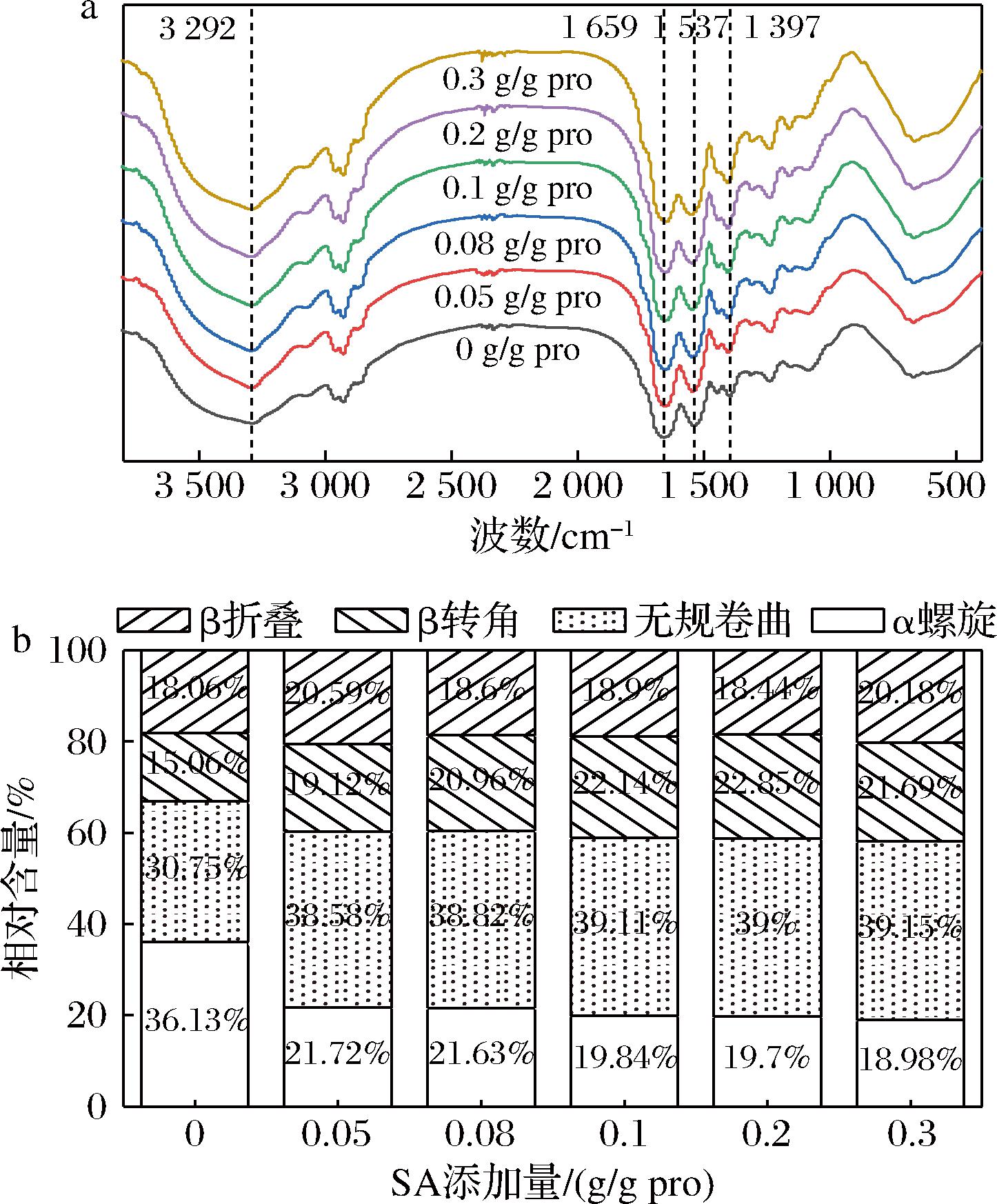
a-FTIR;b-二级结构
图2 SA添加量对CPI FTIR的影响
Fig.2 Effect of SA addition on FTIR of CPI
对酰胺Ⅰ带(1 600~1 700 cm-1)的特征吸收峰进行线性拟合,分析蛋白质二级结构的变化。如图2-b所示,随着SA的加入,α螺旋结构的相对含量减少,无规卷曲、β折叠和β转角的相对含量发生不同程度的提高,与WAN等[24]对大豆分离蛋白酰化改性类似,CPI中α螺旋结构向无规卷曲、β折叠和β转角转变,表明琥珀酰化改性促进了蛋白质分子的去折叠,使有序的空间结构向混乱无序的无规则结构转化,改善了蛋白分子的构象灵活性,与分子柔性(图4)结果对应。此外,琥珀酰化改性使蛋白多肽链拉伸,α螺旋结构的下降与无规卷曲的增加有利于增强蛋白质分子之间的相互作用,利于稳定与油滴结合形成的蛋白质膜,对CPI功能性质的改善具有积极作用[25]。
2.3 SA添加量对CPI粒径和zeta电位的影响
Zeta电位可以反映蛋白质溶液中带电粒子的表面电荷程度,电位绝对值越高,蛋白溶液稳定性越强[26]。所有CPI的zeta电位均为负值,表明CPI蛋白整体带负电荷。如图3-a所示,未改性的CPI的zeta电位最高,为-17.23 mV,随着SA添加量的增加,CPI的zeta电位整体呈现降低的趋势(P<0.05),这与N-酰化度趋势一致,是因为在琥珀酰化过程中带负电荷的酰基基团引入蛋白分子中,取代质子化的氨基基团,将负电荷转移到蛋白表面,使得CPI的净负电荷显著增加,增强了CPI的电负性[16]。此外,琥珀酰化使分子表面积增加,相同电荷间的电子排斥,可能也会造成zeta电位升高[11]。
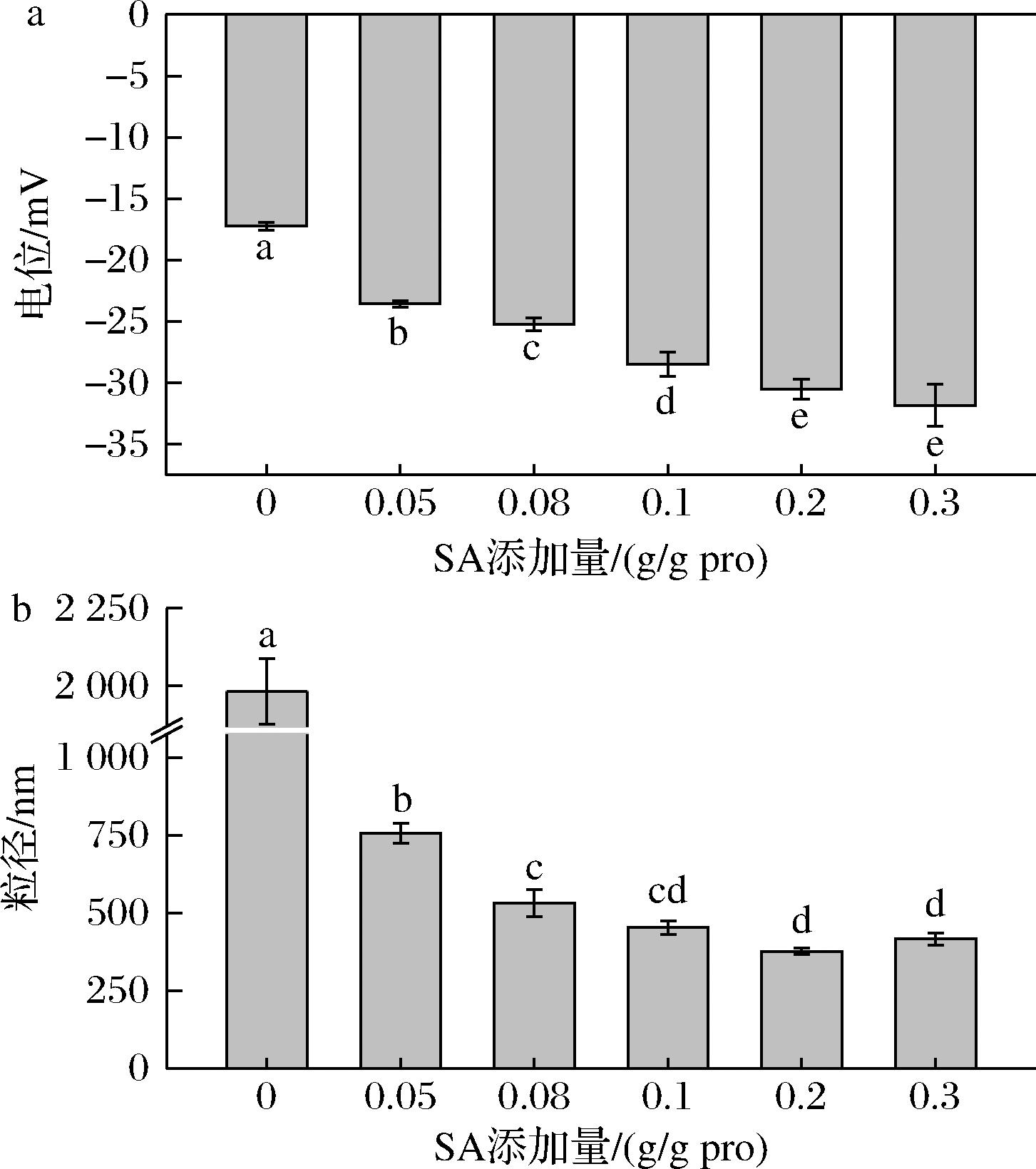
a-电位;b-粒径
图3 SA添加量对CPI粒径和电位的影响
Fig.3 Effect of SA addition on CPI particle size and potential
如图3-b所示,经琥珀酰化改性后的CPI蛋白粒径均显著低于未改性CPI,随着琥珀酰化程度的增加,CPI的粒径逐渐降低后趋于稳定(P<0.05)。在琥珀酰化过程中引入净负电荷,CPI蛋白分子间的静电排斥力增大,抑制蛋白质聚集,导致蛋白粒径减小。若继续增加SA,过量的SA与CPI反应,亲水羧基含量进一步增加使蛋白质溶胀[27],从而造成蛋白粒径略微增大。蛋白质粒径通常与蛋白质的功能特性有密切联系,直接影响着CPI的加工品质,酰化后蛋白平均粒径显著减小,表面积增加后与水分子的作用增强,有助于改善CPI的乳化性、持水性等功能性质。
2.4 SA添加量对CPI表面疏水性和分子柔性的影响
蛋白的表面疏水性是指分布在蛋白质分子表面可以发生疏水键合的基团数量,可以反映CPI结构的稳定性,影响蛋白质的功能特性。如图4-a所示,随着SA添加量的增加,CPI的表面疏水性显著降低(P<0.05),这与琥珀酰化改性乳清蛋白[28]的结果一致。可能是因为琥珀酰化改性引入亲水性的琥珀酰胺基团,诱导CPI蛋白分子的构象发生改变,影响蛋白表面氨基酸的掩埋与折叠,降低了蛋白表面疏水性。此外,由于琥珀酰化在蛋白表面引入净负电荷,分子间静电斥力增强,抑制了ANS荧光探针接近并结合暴露的疏水区域,也会导致表面疏水性较低。
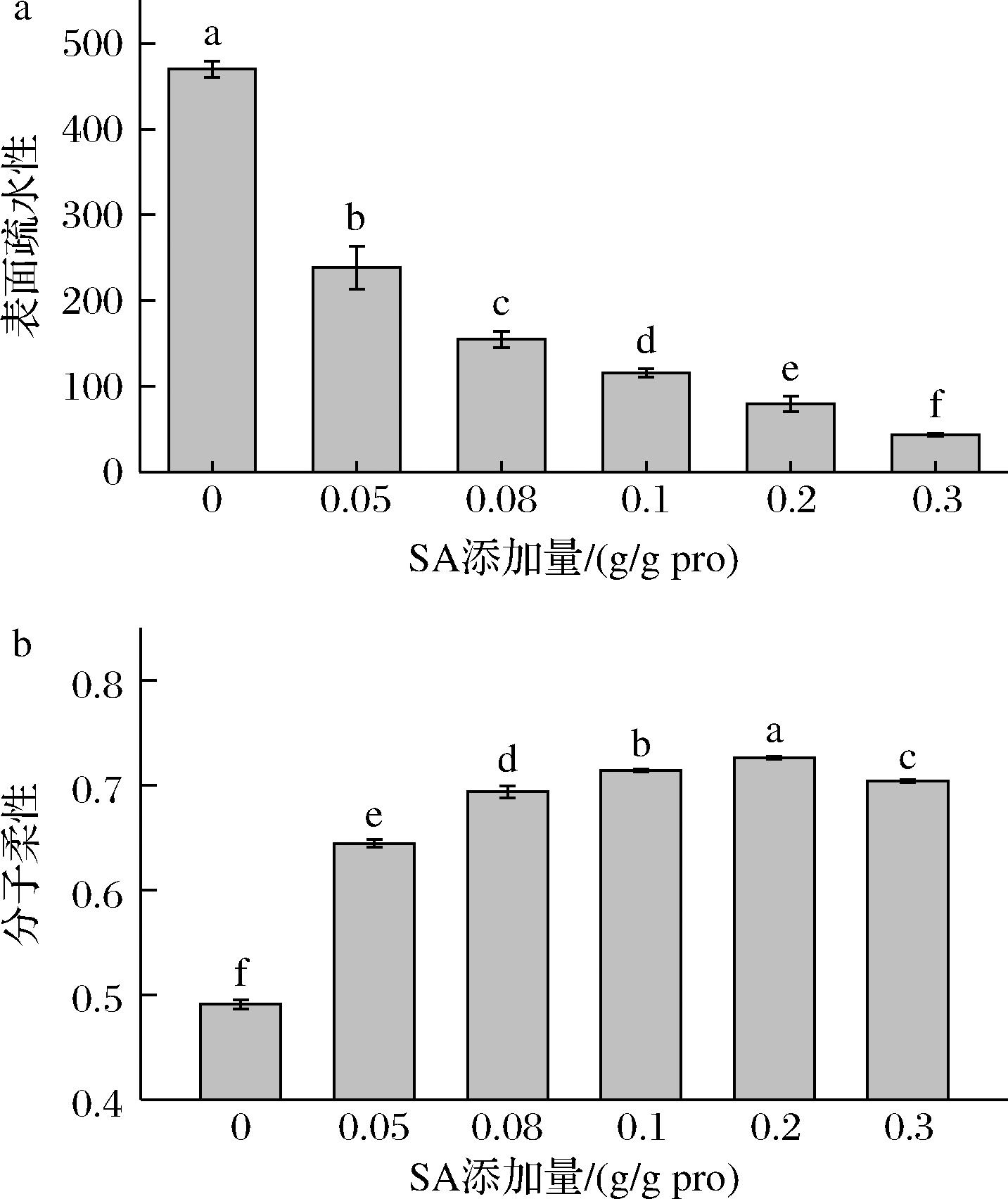
a-表面疏水性;b-分子柔性
图4 SA添加量对CPI表面疏水性和分子柔性的影响
Fig.4 Effect of SA addition on surface hydrophobicity and molecular flexibility of CPI
蛋白质的分子柔性是指分子结构的柔韧性,可以反应蛋白质的伸展情况,在蛋白表面性质中起着十分重要的作用[19]。如图4-b所示,未酰化的CPI具有较低柔性,随着酰化程度的升高,呈现出先增大而后减小的趋势(P<0.05),当SA添加量为0.2 g/g pro时,分子柔性达到最大。这表明CPI蛋白分子发生了不同程度的构象变化。蛋白质的分子柔性受氢键、范德华作用力、静电相互作用力以及疏水相互作用等影响[29]。未酰化蛋白结构紧密,分子柔性较低,琥珀酰化改性后CPI的蛋白结构展开,蛋白分子失去刚性的三级结构,形成更多的柔性区间,分子柔性增强。当SA添加量为0.3 g/g pro时,可能是由于SA的酰基基团与蛋白结合后,引入过多的负电荷使其蛋白表面静电斥力增强,酰基基团的长链结构在蛋白分子之间形成空间位阻,导致分子柔性略微下降[30]。
2.5 SA添加量对CPI荧光光谱的影响
蛋白质的三级结构可以通过其固有荧光发射光谱进行研究,反映了色氨酸残基周围微环境的极性变化[25]。如图5所示,随着SA添加量的增加,CPI的λmax从332.8 nm红移到339.8 nm,λmax与色氨酸残基在蛋白分子中的位置有关,表明琥珀酰化处理导致蛋白结构舒展,掩埋在蛋白内部的色氨酸随蛋白结构的展开暴露在更加亲水的环境中,导致λmax向高波长方向移动[31]。此外,由于在琥珀酰化改性过程中引入了额外的负电荷,静电斥力加强,导致色氨酸残基的暴露和蛋白质结构的进一步伸展[30],酰化后CPI的荧光强度增强,但随着N-酰化度的升高,链状的琥珀酰基基团逐渐增多,掩盖了蛋白表面的部分色氨酸,CPI分子内部的疏水相互作用遭到破坏,CPI的最大荧光强度逐渐降低。以上结果表明,琥珀酰化处理改变了CPI的三级结构,促使蛋白分子结构展开,构象更灵活,从而促进了CPI功能性质的改善。
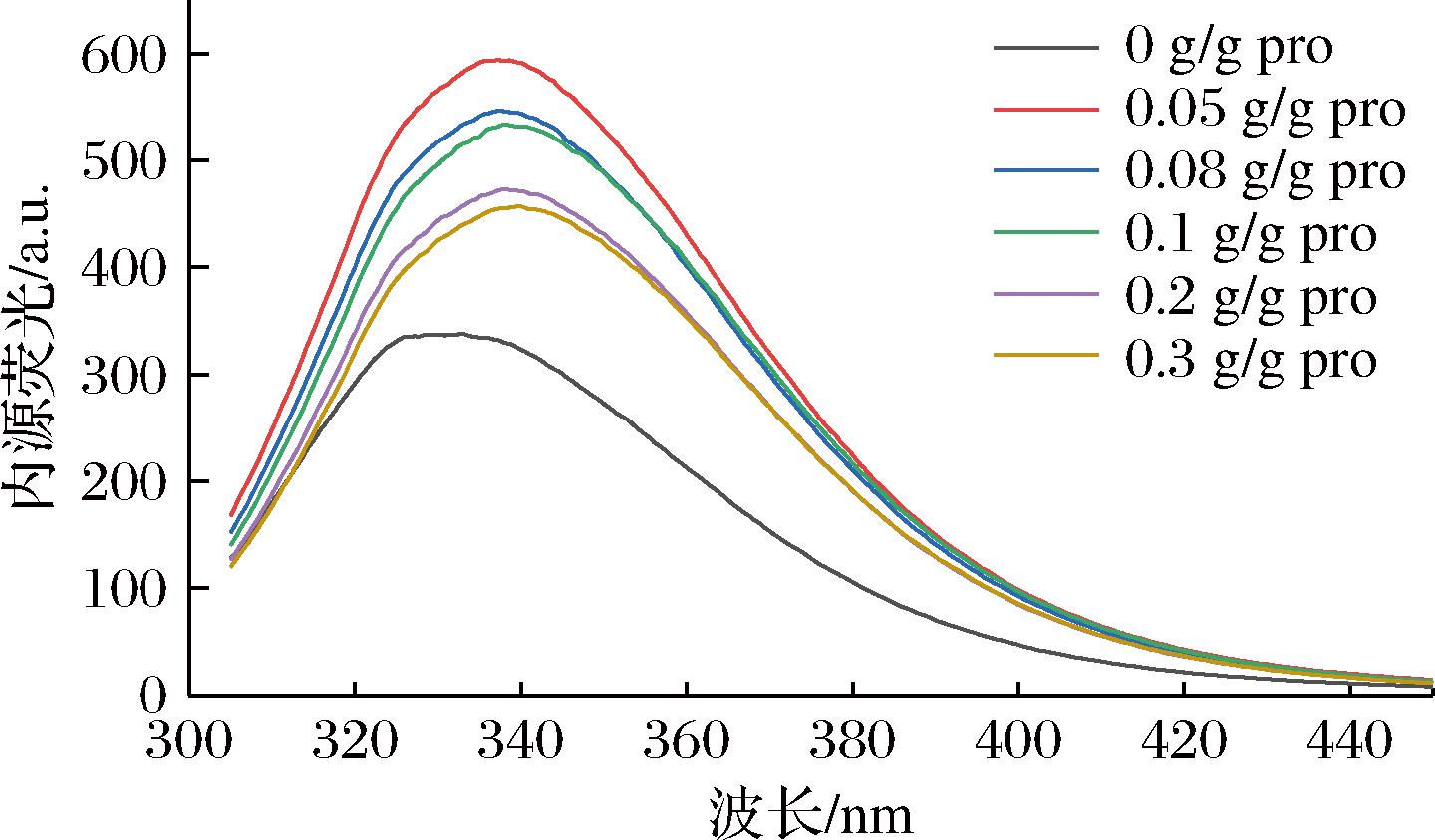
图5 SA添加量对CPI内源荧光的影响
Fig.5 Effect of SA addition on Fluorescence spectrum of CPI
2.6 SA添加量对CPI微观结构的影响
琥珀酰化CPI微观结构的变化如图6所示,未酰化处理的鹰嘴豆蛋白以大块的片状形式存在(1 500×),蛋白表面平整而光滑(5 000×),这与李可等[32]的观察结果相似。经琥珀酰化改性处理后,由于CPI发生亲核取代,亲水特性的改善使蛋白聚集体分散,使得CPI虽仍以片状的形式存在,但结构变得相对无序,表面更加粗糙,并出现不同程度的破碎。随着酰化度的提高,蛋白变得细碎,表面出现细小的孔穴,形成更加疏松的片层结构。这进一步证实随着酰化反应的深入,琥珀酰基从取代蛋白表面游离—NH2转向取代蛋白内部的—NH2,形成更加松散的蛋白结构,有利于促进CPI向油水界面的快速吸附,提高琥珀酰化改善CPI溶解性和乳化性的潜力。

图6 SA添加量对CPI微观结构的影响
Fig.6 Effect of SA addition on Microstructure of CPI
2.7 SA添加量对CPI溶解度和浊度的影响
溶解性与蛋白质其他功能性质密切相关,受蛋白质变性程度、聚集状态等的影响。浊度可以反应蛋白的聚集状态以及蛋白颗粒的大小,与蛋白聚集程度成正比。如图7所示,未经酰化处理的蛋白溶解度最低,随着SA添加量的增加,CPI的溶解度呈先上升后降低的趋势(P<0.05)。
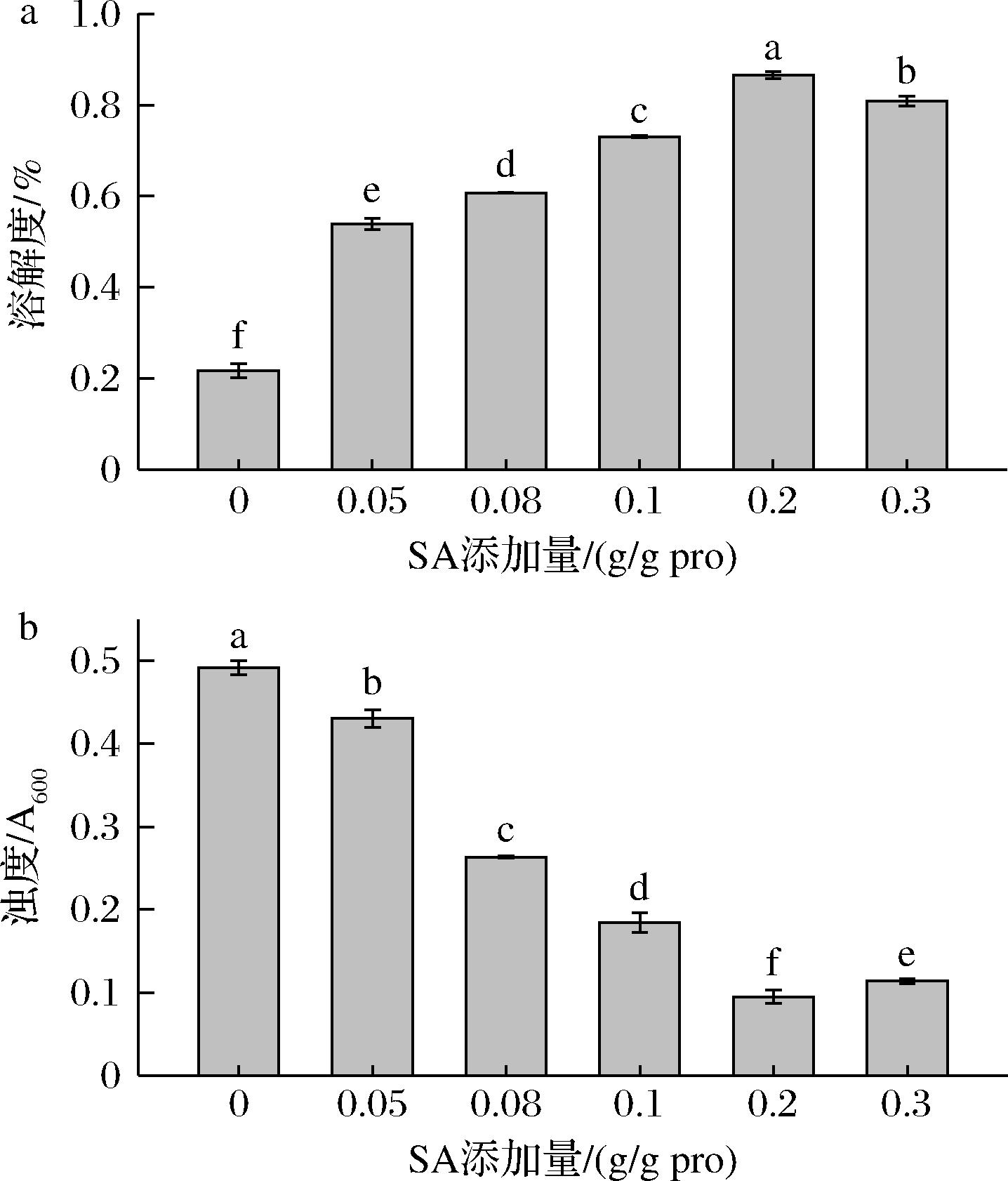
a-溶解度;b-浊度
图7 SA添加量对CPI溶解度和浊度的影响
Fig.7 Effect of SA addition on solubility and turbidity of CPI
当SA添加量为0.2 g/g pro时,CPI溶解度达到最大(86.52%)。这是由于CPI引入带负电的亲水性琥珀酰基后,蛋白分子间静电斥力增强,破坏了蛋白质-蛋白质相互作用,疏松的蛋白结构增大了蛋白表面与水分子的接触面积,同时分子内部暴露出的亲水基团利于蛋白的水合,从而有效提高酰化后CPI的溶解度[15,18]。浊度与溶解度变化趋势相反,总体呈现降低的趋势(P<0.05),在SA添加量为0.2 g/g pro时达到最低。这是由于酰化改性破坏CPI的蛋白构象,带负电荷的酰基使蛋白质表面具有更高电荷,蛋白聚集体分散,光散射比表面积变大,导致CPI浊度降低。继续添加SA,小颗粒蛋白之间重新聚集,影响光散射,浊度略微升高[33]。
2.8 SA添加量对CPI乳化性和乳化稳定性的影响
蛋白质的乳化性质代表了其在油水界面的吸附能力,反映了蛋白质形成油水界面膜的能力及其抗变形性[34]。由图8可知,随着SA添加量的升高(0~0.2 g/g pro),CPI乳化活性逐渐增加然后趋于稳定(P<0.05),其中SA添加量为0.2 g/g pro时,CPI的乳化活性达到最大值(61.696 m2/g)。CPI的乳化稳定性变化趋势与乳化活性趋势相似,当SA添加量为0.2 g/g pro时达到最大。这是由于溶解度的提高加速了蛋白质分子向油水界面迁移,酰化引入羧基可促进蛋白分子与水相之间相互作用;同时,琥珀酰化改性使蛋白结构展开,增强了蛋白质-油界面的相互作用,利于乳化性能的改善。当蛋白在油水界面吸附后,柔性蛋白质经历相对快速的构象变化而具有更好的乳化性能[35],因此更高的分子柔性利于CPI的乳化性能的提高。若继续添加SA,过量的琥珀酰基链状结构在蛋白表面形成空间位阻,引入的净负电荷使静电斥力增强,破坏了界面蛋白质分子之间的作用力,降低了在油-水界面形成的蛋白质膜的稳定性,导致CPI的乳化性能略微下降[36]。

图8 SA添加量对CPI乳化活性和乳化稳定性的影响
Fig.8 Effect of SA addition on emulsification and emulsification stability of CPI
2.9 SA添加量对CPI持水性和持油性的影响
如图9所示,与未酰化CPI(2.36 g/g)相比,酰化后CPI的持水性发生显著提升(P<0.05),为5.37~8.96 g/g,提高了2.27~3.79倍。酰化后持水性的提升可能是因为反应过程中掺入了SA中的亲水基团,使得蛋白质更易于与水分子接触,导致持水性的增加。随SA添加量的升高,CPI的持油性呈现先上升而后降低的趋势(P<0.05),酰化后CPI的持油性提高了1.20~1.73倍。有研究表明,琥珀酰化后分子间间隙的扩大可以加强蛋白质与油相之间的物理相互作用[37],未酰化CPI结构紧凑、粒径较大,吸附油脂较少,经酰化改性后,蛋白粒径减小,分子结构展开,增加了蛋白活性表面面积,更有利于油相的物理保留,持油性升高。当SA添加量进一步增加,持油性降低,这可能是因为琥珀酰化引入的高电荷导致蛋白极性增加,较高的蛋白极性可能会影响极性/非极性脂质和氨基酸残基之间的吸引力-排斥相互作用,造成持油性的降低[38]。
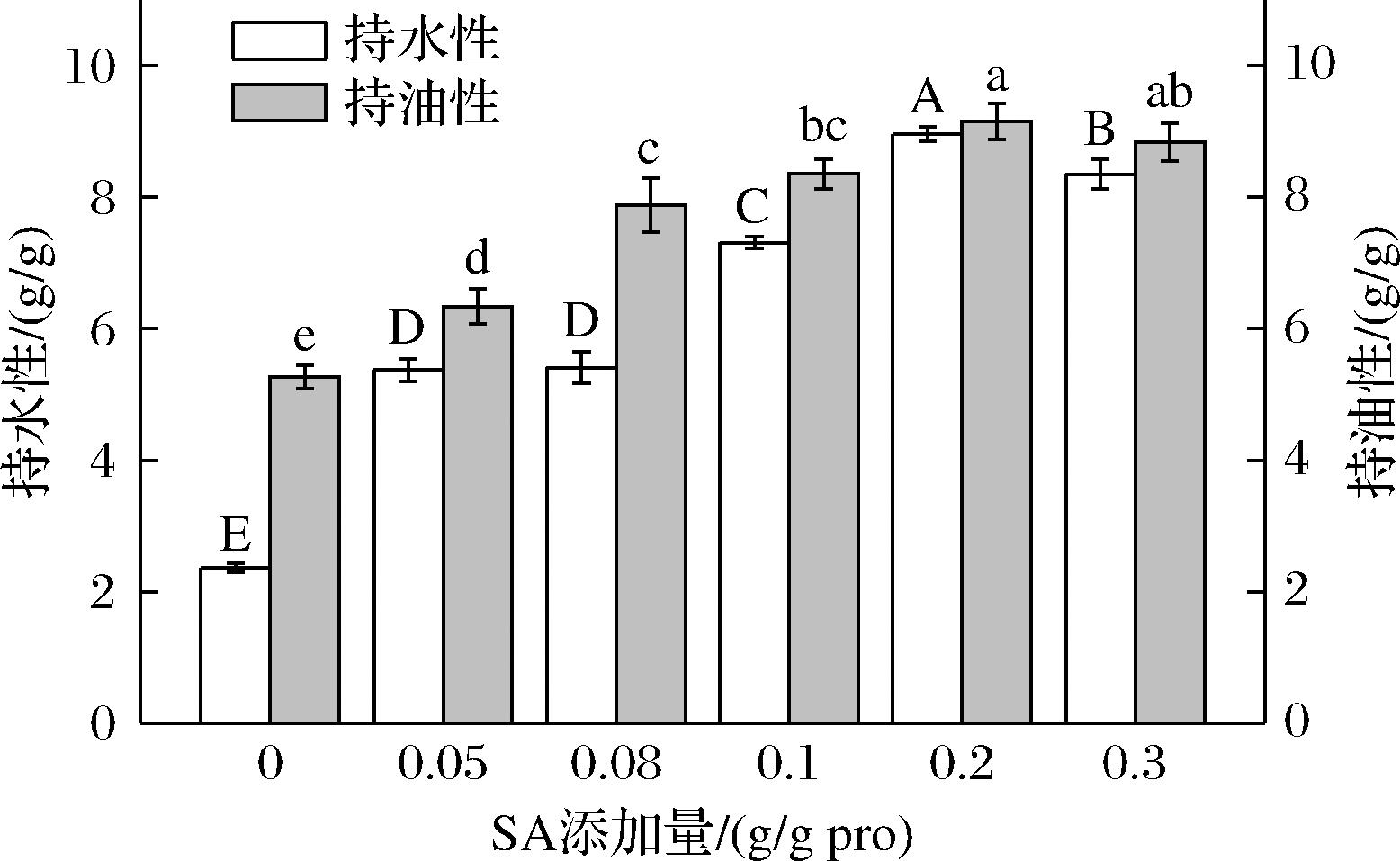
图9 SA添加量对CPI持水性和持油性的影响
Fig.9 Effect of SA addition on water and oil absorption capacity of CPI
3 结论
本文通过添加SA探究琥珀酰化改性对CPI功能特性的影响,并从理化结构变化阐释琥珀酰化改性对CPI功能特性的影响机制。结果表明,随着SA添加量的升高,SA优先与CPI表面氨基发生反应,然后逐渐深入到蛋白内部,带负电荷的琥珀酰基基团与CPI结合,蛋白结构由有序变得无序;改性后负电荷显著增加,平均粒径降低,CPI表面疏水性降低,蛋白分子柔性提高。荧光光谱出现红移,表明酰化修饰促使蛋白内部基团暴露,三级结构伸展,CPI处于更加亲水的环境中;改性后CPI表面变得粗糙,形成更加疏松的片层结构。综上所述,琥珀酰化反应改善了CPI表面电荷密度并使蛋白结构伸展,这有利于CPI功能性质的提升。当SA添加量为0.2 g/g pro时,CPI功能性质改善最佳,溶解度提高到86.52%,乳化性达到61.696 m2/g,持水性和持油性分别提高了3.79倍和1.73倍。本研究对CPI在食品工业中的广泛应用具有重要意义。
[1] WANG Y T, WANG Y J, LI K, et al.Effect of high intensity ultrasound on physicochemical, interfacial and gel properties of chickpea protein isolate[J].LWT, 2020, 129:109563.
[2] 郑雁, 林江涛, 岳清华.鹰嘴豆和鹰嘴豆蛋白的特性及应用研究进展[J].中国油脂, 2024, 49(4):20-27.ZHENG Y, LIN J T, YUE Q H.Research progress on characteristics and application of chickpea and chickpea protein[J].China Oils and Fats, 2024, 49(4):20-27.
[3] BI C H, CHI S Y, ZHOU T, et al.Effect of low-frequency high-intensity ultrasound (HIU) on the physicochemical properties of chickpea protein[J].Food Research International, 2022, 159:111474.
[4] GAO Y, HAO X Y, HU Y C, et al.Modification of the functional properties of chickpea proteins by ultrasonication treatment and alleviation of malnutrition in rat[J].Food &Function, 2023, 14(3):1773-1784.
[5] 刘昕, 金明良, 覃小丽, 等.超声处理对鹰嘴豆蛋白乳化性的影响[J].食品与发酵工业, 2018, 44(5):142-147.LIU X, JIN M L, QIN X L, et al.Effects of ultrasonic treatment on emulsifying properties of chickpea protein[J].Food and Fermentation Industries, 2018, 44(5):142-147.
[6] ZHANG Y Q, KONG Y F, XU W J, et al.Electron beam irradiation alters the physicochemical properties of chickpea proteins and the peptidomic profile of its digest[J].Molecules, 2023, 28(16):6161.
[7] HUANG Z G, WANG X Y, ZHANG J Y, et al.High-pressure homogenization modified chickpea protein:Rheological properties, thermal properties and microstructure[J].Journal of Food Engineering, 2022, 335:111196.
[8] ZHANG M, FAN L P, LIU Y F, et al.Effects of alkali treatment on structural and functional properties of chickpea protein isolate and its interaction with Gallic acid:To improve the physicochemical stability of water-in-oil emulsions[J].Food Hydrocolloids, 2023, 140:108601.
[9] GLUSAC J, ISASCHAR-OVDAT S, FISHMAN A.Transglutaminase modifies the physical stability and digestibility of chickpea protein-stabilized oil-in-water emulsions[J].Food Chemistry, 2020, 315:126301.
[10] BASAK S, SINGHAL R S.Succinylation of food proteins- a concise review[J].LWT, 2022, 154:112866.
[11] SHILPASHREE B G, ARORA S, CHAWLA P, et al.Effect of succinylation on physicochemical and functional properties of milk protein concentrate[J].Food Research International, 2015, 72:223-230.
[12] SHAH N N, UMESH K V, SINGHAL R S.Hydrophobically modified pea proteins:Synthesis, characterization and evaluation as emulsifiers in eggless cake[J].Journal of Food Engineering, 2019, 255:15-23.
[13] MIEDZIANKA J, WALKOWIAK K, ZIELI SKA-DAWIDZIAK M, et al.The functional and physicochemical properties of rice protein concentrate subjected to acetylation[J].Molecules, 2023, 28(2):770.
SKA-DAWIDZIAK M, et al.The functional and physicochemical properties of rice protein concentrate subjected to acetylation[J].Molecules, 2023, 28(2):770.
[14] YIN S W, TANG C H, WEN Q B, et al.Effects of acylation on the functional properties and in vitro trypsin digestibility of red kidney bean (Phaseolus vulgaris L.) protein isolate[J].Journal of Food Science, 2009, 74(9):E488-E494.
[15] WU Y Y, XIANG X L, LIU L, et al.Ultrasound-assisted succinylation comprehensively improved functional properties of egg white protein[J].LWT, 2022, 171:114155.
[16] LU Y Y, PAN D D, XIA Q, et al.Impact of pH-dependent succinylation on the structural features and emulsifying properties of chicken liver protein[J].Food Chemistry, 2021, 358:129868.
[17] ZHAO C B, ZHANG H, XU X Y, et al.Effect of acetylation and succinylation on physicochemical properties and structural characteristics of oat protein isolate[J].Process Biochemistry, 2017, 57:117-123.
[18] HU G, ZHANG J M, WANG Q, et al.Succinylation modified ovalbumin:Structural, interfacial, and functional properties[J].Foods, 2022, 11(18):2724.
[19] SUN X T, CUI Q, LI R, et al.Structural and emulsifying properties of soybean protein isolate glycated with glucose based on pH treatment[J].Journal of the Science of Food and Agriculture, 2022, 102(11):4462-4472.
[20] ZHU Z F, MAO X Y, WU Q Z, et al.Effects of oxidative modification of peroxyl radicals on the structure and foamability of chickpea protein isolates[J].Journal of Food Science, 2021, 86(3):824-833.
[21] LIAN Z T, YANG S, CHENG L, et al.Emulsifying properties and oil-water interface properties of succinylated soy protein isolate:Affected by conformational flexibility of the interfacial protein[J].Food Hydrocolloids, 2023, 136:108224.
[22] SCHWENKE K D, KNOPFE C, MIKHEEVA L M, et al.Structural changes of legumin from faba beans (Vicia faba L.) by succinylation[J].Journal of Agricultural and Food Chemistry, 1998, 46(6):2080-2086.
[23] 王融寒. 超声耦合琥珀酰化改性调控南极磷虾蛋白结构和功能的研究[D].上海:上海海洋大学, 2022.WANG R H.Study on the structure and function of the Antarctic krill proteins regulated by ultrasound-coupled succinylation modification[D].Shanghai:Shanghai Ocean University, 2022.
[24] WAN Y L, LIU J Y, GUO S T.Effects of succinylation on the structure and thermal aggregation of soy protein isolate[J].Food Chemistry, 2018, 245:542-550.
[25] ZHANG R Y, WANG Y, JIANG Y, et al.Effects of dual succinylation and ultrasonication modification on the structural and functional properties of ovalbumin[J].Food Research International, 2023, 165:112511.
[26] SCHMIDT J M, DAMGAARD H, GREVE-POULSEN M, et al.Foam and emulsion properties of potato protein isolate and purified fractions[J].Food Hydrocolloids, 2018, 74:367-378.
[27] 夏楠. 酰基化大豆分离蛋白包埋胡萝卜素乳液体系的制备及体外消化研究[D].合肥:合肥工业大学, 2021.XIA N.Preparation and in vitro digestion of acylated soy protein isolate embedded carotene emulsion system[D].Hefei:Hefei University of Technology, 2021.
[28] XU F Y, WEN Q H, WANG R, et al.Enhanced synthesis of succinylated whey protein isolate by pulsed electric field pretreatment[J].Food Chemistry, 2021, 363:129892.
[29] POON S, CLARKE A E, SCHULTZ C J.Effect of denaturants on the emulsifying activity of proteins[J].Journal of Agricultural and Food Chemistry, 2001, 49(1):281-286.
[30] 刘冠男, 胡淼, 杜晓倩, 等.琥珀酰化调控大豆分离蛋白电荷密度对其构象及乳化性的影响[J].食品科学, 2022, 43(4):39-45.LIU G N, HU M, DU X Q, et al.Effect of charge density modification of soy protein isolate by succinylation on its conformation and emulsifying properties[J].Food Science, 2022, 43(4):39-45.
[31] REN L Y, LIU J Y, ZHANG X Q, et al.Emulsion, gelation, physicochemical properties and microstructure of phosphorylated and succinylated egg yolk[J].LWT, 2020, 131:109675.
[32] 李可, 田金凤, 郑思雨, 等.等离子体对鹰嘴豆分离蛋白溶解性和乳化特性的影响[J].农业工程学报, 2021, 37(4):31-39.LI K, TIAN J F, ZHENG S Y, et al.Effect of plasma on solubility and emulsifying properties of chickpea protein isolates[J].Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(4):31-39.
[33] HE D B, LV Y, TONG Q G.Succinylation improves the thermal stability of egg white proteins[J].Molecules, 2019, 24(20):3783.
[34] LIAN Z T, YANG S, DAI S C, et al.Relationship between flexibility and interfacial functional properties of soy protein isolate:Succinylation modification[J].Journal of the Science of Food and Agriculture, 2022, 102(14):6454-6463.
[35] GHRIBI A M, GAFSI I M, BLECKER C, et al.Effect of drying methods on physico-chemical and functional properties of chickpea protein concentrates[J].Journal of Food Engineering, 2015, 165:179-188.
[36] MIRMOGHTADAIE L, KADIVAR M, SHAHEDI M.Effects of succinylation and deamidation on functional properties of oat protein isolate[J].Food Chemistry, 2009, 114(1):127-131.
[37] 张如意. 酰化改性调控卵清蛋白/ε:聚赖氨酸互作行为及百里香酚纳米凝胶性能研究[D].扬州:扬州大学, 2023.ZHANG R Y.Study on acylation modification regulating the interaction behavior of ovalbumin/ε-polylysine and the properties of thymol nanogel[D].Yangzhou:Yangzhou University, 2023.
[38] KARBASI M, ASKARI G, MADADLOU A.Effects of acetyl grafting on the structural and functional properties of whey protein microgels[J].Food Hydrocolloids, 2021, 112:106443.