花生粕是花生经榨油之后的副产物,年产量近1 000万t,其蛋白含量高达50%,但目前主要用作动物饲料,商品价值不高。近年来,为提高花生粕的利用价值,常对其进行酶解或发酵处理,以提高呈味效果或功效作用。一些商业化的蛋白酶如中性蛋白酶、碱性蛋白酶、木瓜蛋白酶或微生物(如米曲霉)已被用于改善花生粕的呈味、抗氧化、抑菌等效果,例如,SU等[1]利用米曲霉发酵花生粕以提高其呈味效果;韩杰等[2]通过碱性蛋白酶、木瓜蛋白水解花生粕制备兼备界面活性和抗氧化性的肽;陈彤等[3]使用中性蛋白酶水解花生粕提高了抑菌多肽得率。尽管目前从花生粕酶解物中分离出了鲜味肽、增鲜肽、抗氧化肽、抑菌肽等,但尚未见关于花生粕酶解物制备降尿酸肽的研究。
花生粕酶解物因具有一定的苦味而限制了其应用,尽管一些方法已经用于改善酶解物的苦味,如LIU等[4]对小麦面筋水解液脱酰胺改性,提升鲜味强度并抑制苦味传递;WEI等[5]将亚麻籽水解物进行美拉德反应获得增鲜去苦的肽段,但均具有一些缺点。目前,部分学者将蛋白酶解物进行了γ-谷氨酰基化反应,用以改善酶解物的苦味和提高产品厚味及鲜味等呈味特性,如大豆蛋白、面筋蛋白、猪血红蛋白、猪肉蛋白等酶解物经过γ-谷氨酰基化反应,能够将酶解物中的苦味氨基酸转化为厚味及增鲜、增咸作用的γ-谷氨酰肽,从而提高了产品的呈味特性[6-8]。
因此,本实验以花生粕为原料,结合感官分析和黄嘌呤氧化酶抑制率,优化碱性蛋白酶制备降尿酸肽的工艺条件,并在花生粕酶解的基础上研究了添加谷氨酰胺酶对花生粕水解产物的增鲜脱苦作用及黄嘌呤氧化酶抑制效果。本文将小分子肽的呈味特性与功能特性进行关联性研究,为健康功能型调味品的开发和功能因子的使用提供新的思路。
1 材料与方法
1.1 材料与试剂
花生粕,阳江市漠阳花业有限公司;碱性蛋白酶、谷氨酰胺酶,为实验室保存;盐酸,珠海市华成达化工有限公司;NaOH、KH2PO4、四硼酸钠、无水乙醇、Tris碱、冰乙酸、三氯乙酸、K2HPO4,广州化学试剂厂;邻苯二甲醛、二硫苏糖醇、甘氨酸、乙腈、甲醇,上海麦克林生化科技公司;食盐、味精、蔗糖,广州当地超市;黄嘌呤、黄嘌呤氧化酶,上海源叶公司;L-谷氨酰胺、柠檬酸,河南晟发科技有限公司。
1.2 仪器和设备
SP-02生化培养箱,黄石市恒丰医疗器械有限公司;Eppendorf 5810高速冷冻离心机,德国艾本德公司;FiveEasy PLus pH计,梅特勒-托利多公司;Repligen自动化切向流过滤系统,瑞普利金(上海)生物科技有限公司;LC-10N冷冻干燥机,上海力辰邦西仪器科技有限公司;1290 Infinity II超高效液相色谱仪、6545 Q-TOF LC/MS质谱仪,美国Agilent科技有限公司。
1.3 实验方法
1.3.1 碱性蛋白酶解产物黄嘌呤氧化酶抑制效果和滋味分析
取4.5 g花生粕加入30 mL的蒸馏水,85 ℃水浴10 min,冷却至55 ℃,调pH值至9.0,加入质量分数为0.75%碱性蛋白酶(以蛋白含量计),55 ℃酶解9 h。设置单因素试验,分别考察碱性蛋白酶的酶解时间(1、5、9、13、17 h)、酶添加量(质量分数为0.25%、0.50%、0.75%、1.0%、1.25%,以花生粕中蛋白质质量计算)、pH(6.0、7.0、8.0、9.0、10.0)、温度(25、35、45、55、65 ℃)。酶解结束后,沸水浴灭酶15 min。10 000 r/min 10 min离心,取上清液,冷冻干燥后,于-20 ℃贮藏。配制为20 mg/mL样液。以黄嘌呤氧化酶抑制率为主要指标,感官评定为辅助指标。
1.3.2 酶解液的γ-谷氨酰基化
参考文献[9-10]的方法略加修改,将花生粕水解液冻干样品以40 mg/mL配制成溶液,添加质量分数为5%谷氨酰胺,用3 mol NaOH溶液将花生粕水解物复溶液的pH值调制10.0。置于水浴锅中,37 ℃水浴10 min,添加质量分数为2%谷氨酰胺酶。37 ℃处理3 h,再经过沸水浴灭酶15 min。降至室温后,pH值调至7.0。4 ℃、10 000 r/min离心10 min,取上清液。比较添加谷氨酰胺与谷氨酰胺酶、不同处理时间(1.0、2.0、3.0、4.0、5.0 h)、不同酶添加量(1.00%、2.00%、3.00%、4.00%、5.00%,以花生粕中蛋白质质量计算)对花生粕水解物复溶液的影响。
1.3.3 感官分析
感官评价采用5分制评分法。选择7名经感官评价培训的食品专业成员(3男4女,年龄22~33岁)。对照标准品分别为3.5 g/L NaCl(咸味)、3.5 g/L味精(鲜味)、5 g/L L-异亮氨酸(苦味)的参比味觉物质。厚味特征评价方法参考文献[11]。取1 g冻干后的酶解物样品溶解于100 mL纯净水,并调节pH值至6.5。每个样品(10 mL)应保持在口腔中,直到感觉不到味道,然后要求评价人员用水冲洗口腔并休息30 s。每种标准品的味觉评分定义为2.5分。
1.3.4 黄嘌呤氧化酶抑制率测定
依次将磷酸缓冲液(pH=7.5)、底物黄嘌呤溶液(0.6 mmol/L)和肽置于试管中,25 ℃水浴20 min,最后加入25 ℃预热的酶溶液(0.05 U/mL),混匀,在特征吸收峰下进行测定,每1 s测定1次吸光度,连续测定5 min,每个样品重复测定3次。以反应时间为横坐标,吸光值为纵坐标作图,斜率表示反应速度(dA/min),斜率越大,酶活力越强。因此可以通过斜率表示酶活力。样品对黄嘌呤氧化酶的相对抑制率(I)按公式(1)计算:
(1)
式中:A,黄嘌呤溶液、黄嘌呤氧化酶及样品的吸光度值(以黄嘌呤溶液及样品溶液作为空白组扣除空白);B,缓冲液、黄嘌呤溶液及黄嘌呤氧化酶的吸光度值(以缓冲液和黄嘌呤溶液作为空白组扣除空白)。
1.3.5 氨基酸测定
采用全自动氨基酸分析仪测定花生粕水解前后各个反应液中游离氨基酸的含量。取适量样品溶解于超纯水中,振荡混合均匀后,常温下静置提取氨基酸 30 min,之后定容至50 mL容量瓶中;取定容后的样液4 mL,按V(样品)∶V(质量分数为15%磺基水杨酸)=4∶1,混合均匀,于4 ℃冰箱静置60 min;将上述溶液于4 ℃,1 000 r/min离心15 min,取离心后的上清液重复上述离心步骤;将上述离心液经0.22 μm的滤膜过滤后于氨基酸分析仪进行检测。
1.3.6 肽分子质量分析
为比较碱性蛋白酶对花生粕水解前后肽分子质量分布影响,测定其肽分子质量分布。标品为细胞色素C(12 384 Da)、抑酞酶(6 511 Da)、杆菌肽(1 423 Da)、氧化型谷胱甘肽(621 Da)和Gly-Gly-Gly(189 Da)。测定色谱柱为TSKGel-G2000-SWXL(7.8 mm×300 mm),流动相为乙腈∶水∶三氟乙酸=40∶60∶0.1(体积比),流速0.5 mL/min;柱温30 ℃,紫外检测波长 214 nm,进样量20 μL。
1.3.7 花生粕蛋白酶解液SDS-PAGE分析
将各样品以10 mg/mL,加入上样缓冲液,于100 ℃下煮沸5 min,12 000 r/min离心5 min。分离胶浓度为12%,浓缩胶浓度为5%。恒压电泳80 V,30 min,再调至120 V,通电60 min。停止电泳,加入固定液淹没浸泡10 min。加考马斯亮蓝染色液染色60 min,加脱色剂脱色,蛋白成像仪拍照。
1.3.8 γ-谷氨酰肽质谱鉴定
将所得冻干组分溶于屈臣氏蒸馏水中,混匀后经0.22 μm滤膜过滤后置于样品瓶中。采用安捷伦高效液相色谱串联质谱仪进行肽的定性鉴定。色谱柱为Waters C18柱(ACQUITY UPLC BEH C18)。流速0.3 mL/min。流动相A相0.1%的甲酸-水溶液(体积分数,下同),流动相B相0.1%的甲酸-乙腈溶液;梯度洗脱条件:0~2 min,0~15% B;2~5 min,15%~80% B;5~8 min,80% B;8~10 min,80%~15% B;10~12 min,15% B。质谱采用ESI正离子扫描模式,雾化气和干燥气为高纯度N2,干燥温度180 ℃,干燥气流速4.0 L/min, 扫描范围为:质荷比(m/z)50~1 000。待高分辨质谱仪进行AUTO MS/MS 数据采集后,得到各个离子组分的二级碎片谱,采用Agilent MassHunter Qualitative Analysis B.7.00 软件,结合自动数据库搜索解析主要峰的离子碎片,并推导氨基酸序列。
1.3.9 数据分析
实验均采取3次平行实验测定。使用SPSS 26.0软件分析实验数据,并使用Origin 2018软件进行作图。
2 结果与分析
2.1 花生粕酶解及产物的黄嘌呤氧化酶抑制率和感官分析
花生粕酶解物被报道具有呈味、抗氧化、抗菌等功效,但是目前尚未见关于黄嘌呤氧化酶抑制率的研究。因此,本文首先对花生粕酶解物的黄嘌呤氧化酶抑制率及滋味特性进行了分析,如图1所示,酶解可以同时提高花生粕的黄嘌呤氧化酶抑制率及呈味效果。其中,随着反应时间、pH值、温度、加酶量变化,花生粕酶解物均呈现先增加后降低的趋势。如图1-a可知,随着酶解时间增加(1~17 h),花生粕水解物的黄嘌呤氧化酶抑制率先增加后减少,酶解9 h的黄嘌呤抑制率最高(60.42±0.80)%。感官评价可知,在9~13 h,酶解物的鲜味和咸味得分最高,而苦味最低(图2-a)。因此选择较佳的酶解时间选择为9 h。
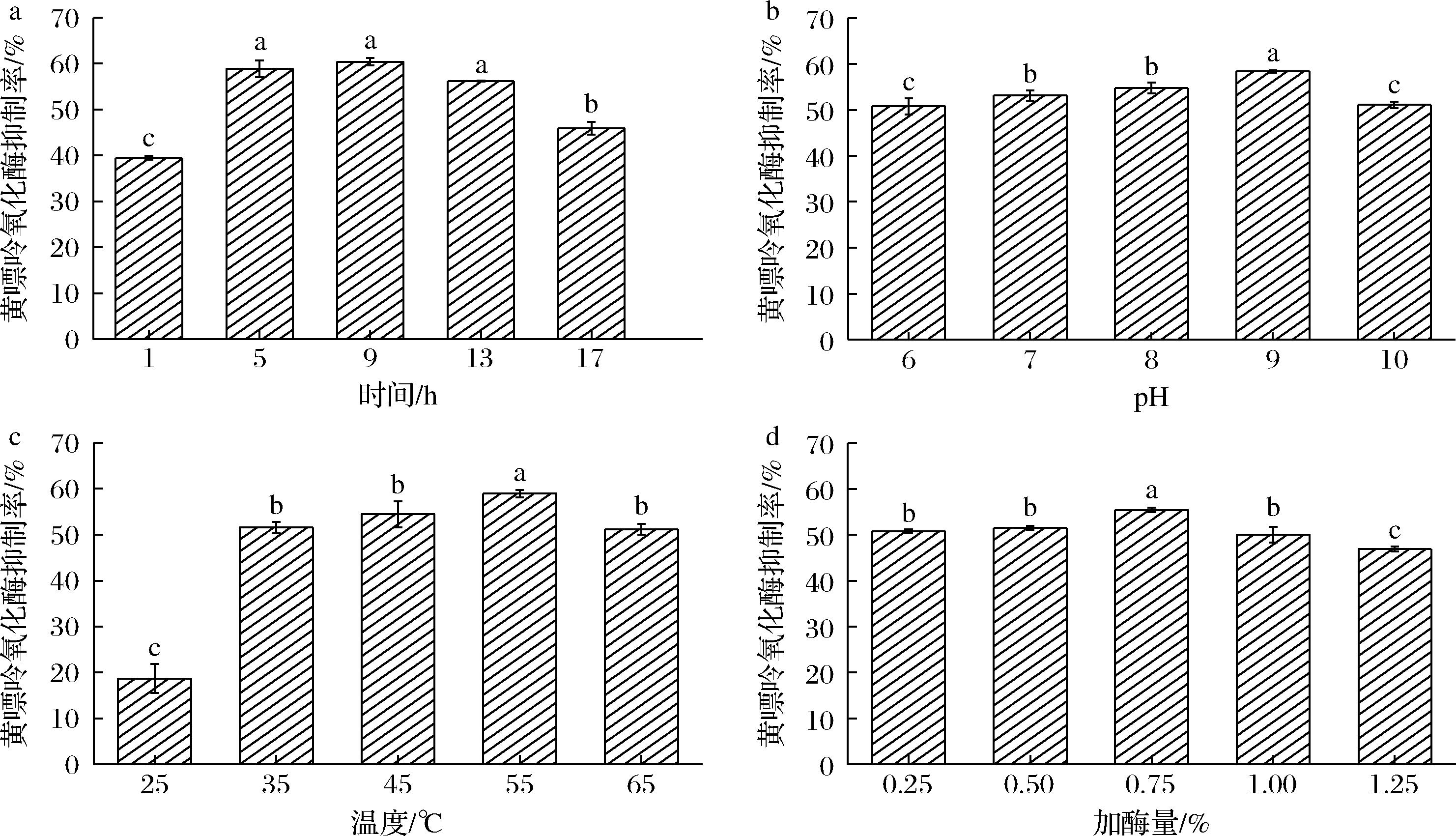
a-酶解时间;b-pH;c-酶解温度;d-加酶量
图1 碱性蛋白酶水解花生粕的单因素试验
Fig.1 Single factor experiment on alkaline protease hydrolysis of peanut meal
注:不同小写字母表示差异显著(P<0.05)(下同)。

a-酶解时间;b-pH;c-酶解温度;d-加酶量
图2 碱性蛋白酶水解花生粕单因素试验的感官评价
Fig.2 Sensory evaluation of single factor experiment on alkaline protease hydrolysis of peanut meal
如图1-b可知,当酶解反应pH值为9时,花生粕水解物的黄嘌呤抑制率显著高于其他反应pH值。结合感官分析,所有组别的鲜味和咸味均未有很突出表现,但是pH值为9时,苦味是最低的(图2-b)。原因为在适宜的pH范围内有助于稳定蛋白酶的催化位点,过高或过低的pH范围影响酶和蛋白质的结合与解离,降低酶催化活性[12]。因此,认为碱性蛋白水解花生粕的较优酶解pH值为9。
如图1-c可知,当酶解温度为55 ℃,黄嘌呤氧化酶抑制率显著高于其他温度下处理的结果。通过感官分析可知,55 ℃下的酶解物咸味及鲜味得分最高,苦味最低(图2-c)。因此,以55 ℃为最优温度。
如图1-d可知,当加酶量为0.75%时,花生粕酶解物的黄嘌呤氧化酶抑制率显著高于其他加酶量组的结果。结合感官分析可知,0.75%组的咸味和1%组的鲜味感官评分较高(图2-d)。原因可能为碱性蛋白酶的主要作用与苯丙氨酸、亮氨酸、缬氨酸等苦味氨基酸的肽键,酶浓度增加导致这类型不良口感氨基酸堆积[13]。综合考虑,选择0.75% 的加酶量为实验样品最优加酶量。
2.2 花生粕酶解产物的γ-谷氨酰基化及其黄嘌呤氧化酶抑制率和感官分析
γ-谷氨酰基化可以提高酶解物的呈味效果[14-15],而产物γ-谷氨酰肽被报道具有多种功能特性,如抗炎、促胆囊收缩素分泌、抗氧化等效果[16],因此,为了改善花生粕酶解物的苦味以及提高产品的黄嘌呤氧化酶抑制率效果,本文对花生粕酶解物进行了γ-谷氨酰基化。如图3和图4所示,随着谷氨酰胺酶的作用时间和添加量的增加,花生粕水解物的滋味和黄嘌呤氧化酶抑制率呈先增加后降低的趋势。原因可能为酶作用时间和添加量的增加促进γ-谷氨酰二肽向γ-谷氨酰三肽或四肽的生成,致使滋味和功能活性下降[9, 17]。谷氨酰胺酶作用时间为3~4 h内有较佳黄嘌呤氧化酶抑制效果,而感官分析显示谷氨酰胺酶作用4 h时感官效果明显优于其他处理时间。酶添加量在3%~4%范围内,能显著提高黄嘌呤氧化酶抑制率,感官分析显示对比其他添加量,4%的谷氨酰胺酶添加量的显著增强了花生粕水解物的鲜味、鲜味和厚味。综合来看,谷氨酰胺酶作用时间为4 h,添加量为4%是花生粕酶解液的谷氨酰化最佳反应条件,此条件下,花生粕酶解物的黄嘌呤氧化酶抑制率为(74.12±2.23)%,增加了花生粕酶解物的鲜味、咸味和厚味以及黄嘌呤氧化酶抑制率,与文献报道结果相似[6, 17]。

a-加酶量;b-酶解时间
图3 花生粕酶解液的谷氨酰化的单因素试验
Fig.3 Single factor experiment on glutamylation of peanut meal enzymatic hydrolysate

a-花生粕酶解液、谷氨酰胺和谷氨酰化处理后的感官评分;b-花生粕谷氨酰化的不同处理时间的感官评分;c-花生粕谷氨酰化的不同加酶量的感官评分
图4 花生粕酶解液、花生粕酶解液的谷氨酰化感官评价
Fig.4 Sensory evaluation of glutamylation of peanut meal enzymatic hydrolysate and peanut meal enzymatic hydrolysate
2.3 酶解及γ-谷氨酰基化反应前后花生粕的蛋白变化情况
2.3.1 蛋白质的降解
花生粕蛋白经过充分的酶解后,大分子肽可被水解为小分子肽和游离氨基酸[18]。从图5可知,花生粕水溶液的蛋白分子质量主要分布在10~66 kDa,经碱性蛋白酶处理后,花生粕溶液中多数的大分子蛋白质被水解成6.5 kDa以下的小分子物质。许多研究证实,生物酶解技术是开发食品调味料的关键技术[19-21],文献[2-3,10]表明以花生蛋白为原料,利用酶水解的方法可以获得有生物活性的肽分子,如韩杰等[2]使用酶水解花生粕制备抗氧化肽;张会翠等[22]发现碱性蛋白酶水解得到的花生肽段分子质量越小抗氧化能力越强;唐金鑫等[23]酶解花生蛋白制备α-淀粉酶抑制肽的研究中发现,<3 kDa的组分效果最佳;张瑞等[24]发现花生活性肽的抗氧化活性随着分子质量的减小而增大。
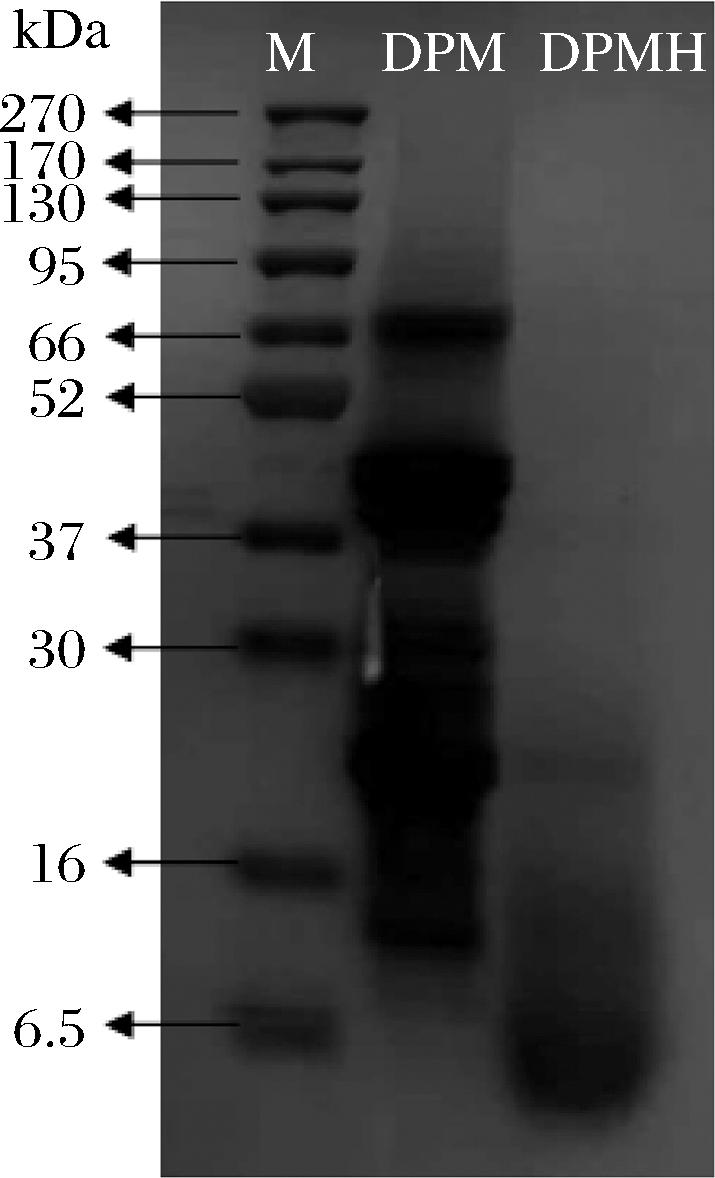
图5 碱性蛋白酶处理花生粕前后蛋白变化
Fig.5 Protein changes in peanut meal before and after alkaline protease treatment
注:M-蛋白标准品;DPM-花生粕未加酶蛋白;DPMH-花生粕碱性蛋白酶处理。
2.3.2 肽分子质量的变化
由图6可知,花生粕水溶液以大分子质量的蛋白质为主,>10 kDa占比高达72.42%,而经过酶解后>10 kDa的蛋白质大幅度下降,5~10、3~5、1~3、<1 kDa都有明显增加。有研究报道[25],分子质量>5 kDa的肽分子不容易刺激味蕾孔口,难以呈现感官滋味。可以增进或改善食品滋味的小分子肽通常小于5 kDa。同样的,低分子质量的肽段有更优良的生物活性,盛周煌[26]指出罗非鱼皮胶原蛋白酶解液中<3 kDa组分的黄嘌呤氧化酶抑制率最佳。
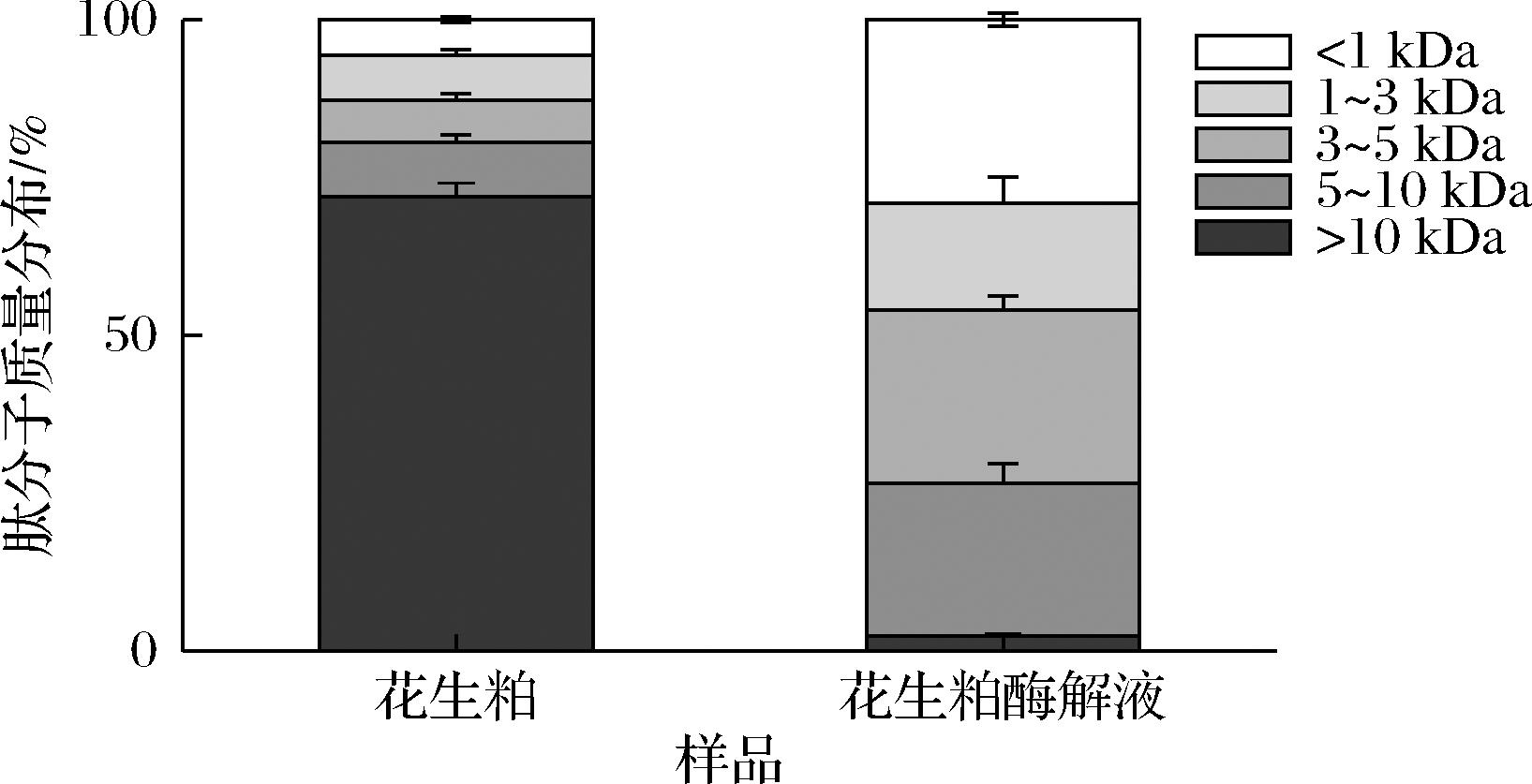
图6 花生粕水溶液及花生粕酶解产物的肽分子质量分布
Fig.6 Peptide molecular weight distribution of peanut meal aqueous solution and enzymatic hydrolysis products
2.3.3 氨基酸含量变化及潜在的γ-谷氨酰肽
对水解前后的花生粕溶液游离氨基酸进行测定,发现各种游离氨基酸含量均明显上升(图7)。花生粕水解后的总游离氨基酸(88.82±2.80) mg/g,显著高于水解前的(11.38±0.78) mg/g,经过谷氨酰化后,游离氨基酸有所消耗,含量为(74.86±7.49) mg/g显著低于酶解后,推测消耗的游离氨基酸转化为γ-谷氨酰肽。
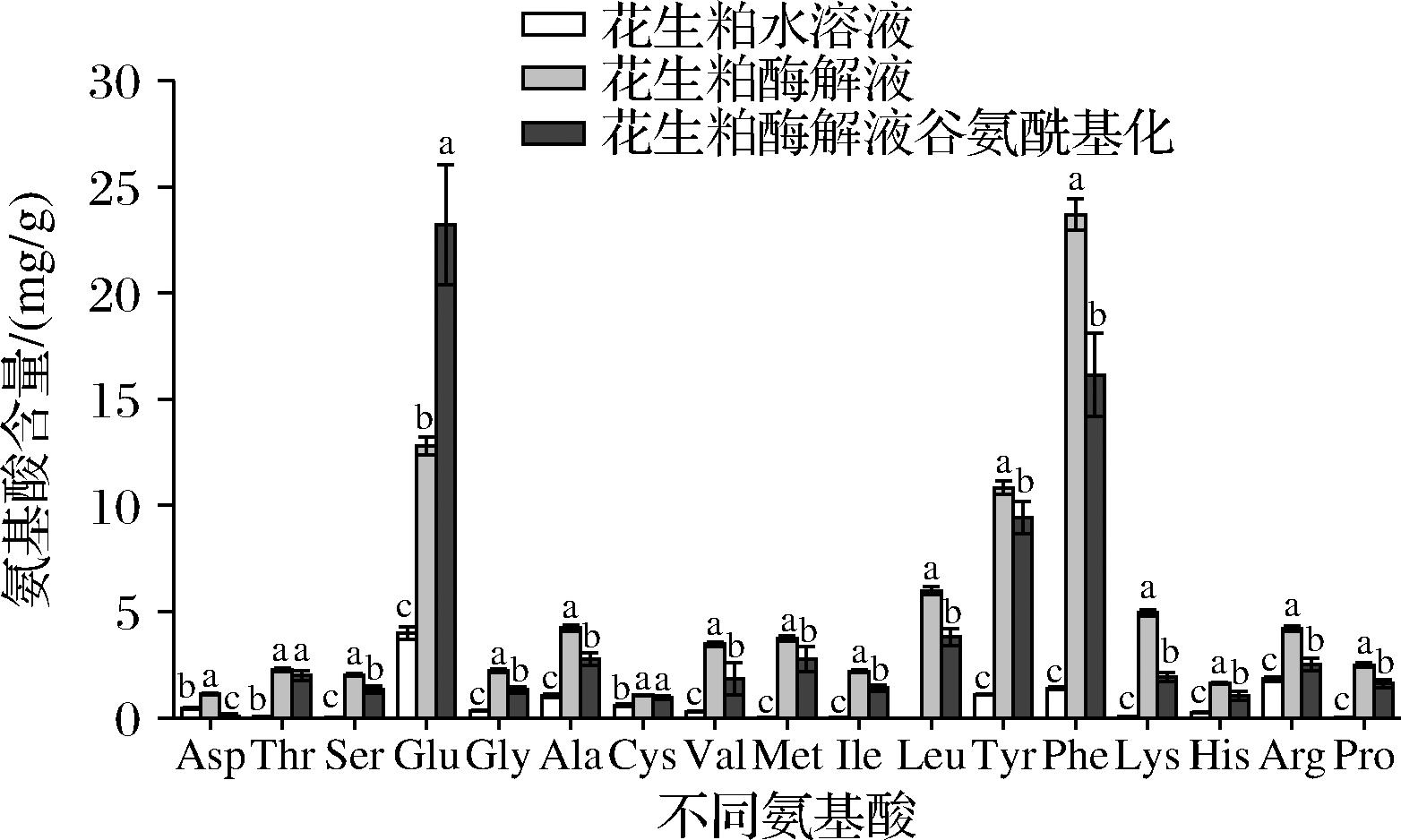
图7 花生粕酶解前后及谷氨酰化后的氨基酸含量变化情况
Fig.7 Changes in amino acid content of peanut meal before and after enzymatic hydrolysis and glutamylation
γ-谷氨酰肽是一种独特的小分子肽,与蛋白质的氨基酸形成的α-肽键不同,γ-谷氨酰肽是指在谷氨酸的γ位形成肽键的肽分子。GUHA等[16]研究发现γ-谷氨酰肽是细胞外的Ca2+敏感受体的激动剂,可以增加食物的呈味效果,同时有研究[7-8]证明了对食品原料酶解物酶进行γ-谷氨酰化修饰,可显著增加增味效果。谷氨酰胺酶以谷氨酰胺为供体底物,小肽或者氨基酸作为受体底物合成γ-谷氨酰肽,并获得更良好的生物活性功能[27-28]。花生粕酶解液中加入谷氨酰酶和谷氨酰胺后,在酶的作用下谷氨酰胺和各游离氨基酸反应生成γ-谷氨酰肽,其中以亮氨酸、苯丙氨酸和精氨酸等含量下降最为明显,推测生成相应的γ-谷氨酰肽。利用高效液相色谱串联质谱对γ-谷氨酰化后的花生粕酶解液进行分析,发现样品中检测出γ-Glu-Arg、γ-Glu-Leu、γ-Glu-Phe、γ-Glu-Met、γ-Glu-Trp、γ-Glu-Tyr和γ-Glu-Val存在,质谱结果见图8。以氨基酸减少量可推测出每克花生粕酶解液冻干样中Arg、Leu、Phe、Met、Tyr和Val等约转化成25.98 mg相应的γ-谷氨酰二肽。γ-谷氨酰化后酶解液中谷氨酸含量相对γ-谷氨酰化前有显著升高,原因可能为谷氨酰胺被水解成谷氨酸,导致谷氨酸含量上升[29-30]。

a-γ-Glu-Arg;b-γ-Glu-Leu;c-γ-Glu-Phe;d-γ- Glu-Met;e-γ-Glu-Trp;f-γ-Glu-Tyr;g-γ-Glu-Val
图8 样品中γ-谷氨酰基肽的二级质谱图
Fig.8 γ-Secondary mass spectrometry of glutamyl peptide
注:b1是谷氨酸残留特征指示离子;b1-CO2是b1离子脱羧反应得到;y1是对应氨基酸残留的特征指示离子。
3 结论
本研究探索了不同的酶解处理方式对花生粕产物的黄嘌呤氧化酶抑制率和滋味的作用,并进一步添加谷氨酰胺酶和谷氨酰胺,对花生粕酶解产物进行γ-谷氨酰化修饰。由实验结果可知,花生粕酶解后的产物随着分子质量的减少,提高了酶解物的黄嘌呤氧化酶抑制率。加入谷氨酰胺酶和谷氨酰胺既增加了花生粕酶解物的黄嘌呤氧化酶抑制率,同时具有增加咸鲜味以及厚味,降低酶解物的苦味特性。综上所述,酶解处理和γ-谷氨酰化修饰可对花生粕进行加工利用,增强了花生粕产物的生物利用价值。本文为花生粕精深加工的开发利用、制备高附加值的健康产品提供依据,值得应用和推广。
[1] SU G W, CUI C, ZHENG L, et al.Isolation and identification of two novel umami and umami-enhancing peptides from peanut hydrolysate by consecutive chromatography and MALDI-TOF/TOF MS[J].Food Chemistry, 2012, 135(2):479-485.
[2] 韩杰, 赵路苹, 王丹, 等.高温花生粕功能肽的酶法制备[J].食品研究与开发, 2023, 44(1):110-116.HAN J, ZHAO L P, WANG D, et al.Enzymatic preparation of functional peptides from hot-pressed peanut meal[J].Food Research and Development, 2023, 44(1):110-116.
[3] 陈彤, 王常青, 白云云, 等.花生饼粕酶解多肽抑菌作用的研究[J].农产品加工, 2015(4):23-25.CHEN T, WANG C Q, BAI Y Y, et al.Antibacterial actions of enzymolysis polypeptide of peanut meals[J].Farm Products Processing, 2015(4):23-25.
[4] LIU B Y, ZHU K X, GUO X N, et al.Effect of deamidation-induced modification on umami and bitter taste of wheat gluten hydrolysates[J].Journal of the Science of Food and Agriculture, 2017, 97(10):3181-3188.
[5] WEI C K, THAKUR K, LIU D H, et al.Enzymatic hydrolysis of flaxseed (Linum usitatissimum L.) protein and sensory characterization of Maillard reaction products[J].Food Chemistry, 2018, 263:186-193.
[6] SUZUKI H, NAKAFUJI Y, TAMURA T.New method to produce kokumi seasoning from protein hydrolysates using bacterial enzymes[J].Journal of Agricultural and Food Chemistry, 2017, 65(48):10514-10519.
[7] LI Q, LIU J, DE GOBBA C, et al.Production of taste enhancers from protein hydrolysates of porcine hemoglobin and meat using Bacillus amyloliquefaciens γ-glutamyltranspeptidase[J].Journal of Agricultural and Food Chemistry, 2020, 68(42):11782-11789.
[8] XIA X Z, FU Y, MA L, et al.Protein hydrolysates from Pleurotus geesteranus modified by Bacillus amyloliquefaciens γ-glutamyl transpeptidase exhibit a remarkable taste-enhancing effect[J].Journal of Agricultural and Food Chemistry, 2022, 70(38):12143-12155.
[9] YANG J, SUN-WATERHOUSE D, XIE J, et al.Comparison of kokumi γ-[Glu](n>1)-Val and γ-[Glu](n>1)-Met synthesized through transpeptidation catalyzed by glutaminase from Bacillus amyloliquefaciens[J].Food Chemistry, 2018, 247:89-97.
[10] SUZUKI H, KAJIMOTO Y, KUMAGAI H.Improvement of the bitter taste of amino acids through the transpeptidation reaction of bacterial gamma-glutamyltranspeptidase[J].Journal of Agricultural and Food Chemistry, 2002, 50(2):313-318.
[11] TU J C, GUO J, DONG H, et al.Novel umami-, salty-, and kokumi-enhancing γ-glutamyl tripeptides synthesized with the bitter dipeptides from defatted peanut meal protein hydrolysate[J].Journal of Agricultural and Food Chemistry, 2023, 71(20):7812-7819.
[12] 马涛, 刘德明.酶法制备花生多肽工艺条件优化的研究[J].中国粮油学报, 2011, 26(7):89-94.MA T, LIU D M.Study on process condition optimization for preparation of peanut polypeptide by enzyme hydrolysis[J].Journal of the Chinese Cereals and Oils Association, 2011, 26(7):89-94.
[13] 李学鹏, 刘晏玮, 谢晓霞, 等.热预处理对蓝蛤酶解及酶解液呈味特性的影响[J].食品科学, 2020, 41(2):133-140.LI X P, LIU Y W, XIE X X, et al.Effect of thermal pretreatment on enzymatic hydrolysis of clam(Aloididae aloidi) and flavor characteristics of hydrolysates[J].Food Science, 2020, 41(2):133-140.
[14] ZHANG L X, SUN X J, LU X, et al.Characterization of peanut protein hydrolysate and structural identification of umami-enhancing peptides[J].Molecules, 2022, 27(9):2853.
[15] ZHANG J N, ZHAO M M, SU G W, et al.Identification and taste characteristics of novel umami and umami-enhancing peptides separated from peanut protein isolate hydrolysate by consecutive chromatography and UPLC-ESI-QTOF-MS/MS[J].Food Chemistry, 2019, 278:674-682.
[16] GUHA S, MAJUMDER K.Comprehensive review of γ-glutamyl peptides (γ-GPs) and their effect on inflammation concerning cardiovascular health[J].Journal of Agricultural and Food Chemistry, 2022, 70(26):7851-7870.
[17] YANG J, SUN-WATERHOUSE D, CUI C, et al.Synthesis and sensory characteristics of kokumi γ-[glu]n-phe in the presence of glutamine and phenylalanine:Glutaminase from Bacillus amyloliquefaciens or Aspergillus oryzae as the catalyst[J].Journal of Agricultural and Food Chemistry, 2017, 65(39):8696-8703.
[18] 胡美欣, 杨志伟.啤酒酵母-花生粕酶解制备鲜味肽的研究[J].食品研究与开发, 2021, 42(10):135-142.HU M X, YANG Z W.Research on preparation of umami peptides by enzymatic hydrolysis of brewer’s yeast and peanut meal[J].Food Research and Development, 2021, 42(10):135-142.
[19] 律诗, 代晹鑫, 刘野, 等.食用菌鲜味强度评价及鲜味氨基酸和核苷酸提取工艺优化[J].食品科学技术学报, 2022, 40(1):100-108.LÜ S, DAI Y X, LIU Y, et al.Evaluation of umami intensity of edible fungi and optimization of umami amino acid and nucleotide extraction[J].Journal of Food Science and Technology, 2022, 40(1):100-108.
[20] 司蕊, 章超桦, 曹文红, 等.冻藏对水煮及酶解马氏珠母贝肉提取物呈味特性的影响[J].食品科学技术学报, 2021, 39(3):62-72.SI R, ZHANG C H, CAO W H, et al.Effect of frozen storage on flavor characteristics of aqueous and enzymolysis extract from Pinctada martensii[J].Journal of Food Science and Technology, 2021, 39(3):62-72.
[21] 步营, 何玮, 胡显杰, 等.超高压对蓝蛤酶解液风味及其蛋白质结构的影响[J].食品科学技术学报, 2021, 39(1):104-116.BU Y, HE W, HU X J, et al.Effects of ultra-high pressure on flavor and protein structure of enzymatic hydrolysates of Aloididae aloidi[J].Journal of Food Science and Technology, 2021, 39(1):104-116.
[22] 张会翠, 唐琳, 杨庆利, 等.超滤法分离花生肽及其抗氧化活性的研究[J].花生学报, 2012, 41(1):1-5.ZHANG H C, TANG L, YANG Q L, et al.Antioxidant activities of peanut protein separated by ultrafiltration[J].Journal of Peanut Science, 2012, 41(1):1-5.
[23] 唐金鑫, 由高飞, 李秋阳, 等.超声波辅助酶解花生蛋白制备α-淀粉酶抑制肽工艺优化[J].食品工业科技, 2022, 43(4):161-168.TANG J X, YOU G F, LI Q Y, et al.Ultrasonic-assisted ezymatic hydrolysis of peanut protein to prepare α-amylase inhibitory peptide[J].Science and Technology of Food Industry, 2022, 43(4):161-168.
[24] 张瑞, 范远景, 陈伟, 等.花生活性肽的分子量分布及抗氧化活性研究[J].安徽农业科学, 2012, 40(21):11041-11043.ZHANG R, FAN Y J, CHEN W, et al.Study on the molecular weight composition and antioxidant activity of peanut bioactive peptides[J].Journal of Anhui Agricultural Sciences, 2012, 40(21):11041-11043.
[25] 刘希, 侯莎.呈味肽的分类及呈味效果定量评价方法综述[J].食品安全导刊, 2022(31):141-145.LIU X, HOU S.The review of classification and analysis methods about quantitative evaluation of flavor peptides[J].China Food Safety Magazine, 2022(31):141-145.
[26] 盛周煌. 罗非鱼皮胶原蛋白降尿酸活性肽的研究[D].广州:华南理工大学, 2018.SHENG Z H.Study on uric acid-reducing peptide of tilapia skin collagen[D].Guangzhou:South China University of Technology, 2018.
[27] HE W J, HUANG X L, KELIMU A, et al.Streamlined efficient synthesis and antioxidant activity of γ-[glutamyl](n≥1)-tryptophan peptides by glutaminase from Bacillus amyloliquefaciens[J].Molecules, 2023, 28(13):4944.
[28] LU Y J, WANG J, SOLADOYE O P, et al.Preparation, receptors, bioactivity and bioavailability of γ-glutamyl peptides:A comprehensive review[J].Trends in Food Science &Technology, 2021, 113:301-314.
[29] YANG J, SUN-WATERHOUSE D, ZHOU W S, et al.Glutaminase-catalyzed γ-glutamylation to produce CCK secretion-stimulatory γ-[Glu]n-Trp peptides superior to tryptophan[J].Journal of Functional Foods, 2019, 60:103418.
[30] SOMMA V, CALVIO C, RABUFFETTI M, et al.An overall framework for the E.coli γ-glutamyltransferase-catalyzed transpeptidation reactions[J].Bioorganic Chemistry, 2021, 115:105217.