白茅根是禾本科植物白茅[Imperata cylindrical Beauv.var.major(Nees)C.E.Hubb.]的干燥根茎,又称为甜根草、茅草根、丝茅草等[1],春秋两季均可采收,是我国传统中药材之一,在全国各地均有野生分布。《本草纲目》第8卷,草部中记载白茅根可治疗劳伤虚羸、补中益气、除瘀血、利小便、下五淋、除肠胃热邪、止渴坚筋、妇人崩中等。近些年,科研工作者在白茅根中已发现多种具有药用价值的化合物,如多糖类、三萜类、黄酮类、木脂素、内酯、类固醇、有机酸等[2]。但对白茅根多糖(Rhizoma imperatae polysaccharides,RPS)的研究集中在提取工艺和结构分析方面,而对多糖降糖活性的研究却未见报道。
我国Ⅱ型糖尿病(diabetes mellitus type 2,T2DM)患者占总糖尿病患者的90%以上,T2DM发病机制尚不明确,普遍认为胰腺β细胞功能障碍和胰岛素抵抗是2个主要因素[3]。此外,氧化应激在T2DM的发病机制中发挥作用。通常用于治疗这种疾病的药物主要是西药,这些药物往往具有副作用大、选择有限和成本高等缺陷[4]。魏波等[5]发现胰岛素使用伴随常见的低血糖反应、肾上腺素增多或中枢神经功能紊乱;磺脲类药物对于胰岛功能损坏严重或者切除胰脏的病人无效,服用后伴随胃肠道反应,偶有血象改变、黄疸、荨麻疹;双胍类药物适用于病症轻,服用后伴有胃肠道反应和乳酸性酸中毒等副作用。植物多糖具有良好的生物调节能力和生物活性,包括免疫、抗氧化、抗肿瘤和降低血糖活性等[6]。随着消费者生活水平的提高和科技的进步,植物多糖被广泛地应用于食品[7]、医药[8]和材料[9]等领域。张拥军等[7]发现南瓜多糖具有降低血糖和降低血脂的功效,并将其运用到广式月饼的制作。于淑池等[10]通过实验性糖尿病小鼠实验,发现苦丁茶多糖具有辅助糖尿病患者降血糖的功效。董英等[11]发现苦瓜多糖对实验性糖尿病小鼠降糖效果明显。
本实验利用高温高压超声波辅助法提取白茅根多糖(Rhizoma imperatae polysaccharides,RPS), 并通过单因素和响应面法对RPS提取工艺进行优化。经Sevag法脱蛋白、DEAE-DE纤维素52层析柱和Sephadex G-100凝胶层析柱分离纯化RPS,所获得多糖进行了分子质量测定、单糖组成分析、紫外光谱分析、红外光谱分析、同步热分析以及降血糖等活性检测,为白茅根以及多糖的开发和应用提供参考和数据支撑。
1 材料与方法
1.1 材料与试剂
白茅根药材,中国福建省邵武市毫源百草中医药业;DEAE-DE纤维素52、Sephadex G-100凝胶、阿卡波糖、α-淀粉酶、噻唑蓝(thiazolyl blue,MTT),源叶生物科技有限公司;单糖标准品,美国Sigma公司;胎牛血清(fetal bovine serum,FBS),浙江天杭生物科技有限公司;DMEM培养基,MEM培养基,美国Gibco公司;二甲基亚砜(dimethyl sulfoxide,DMSO),Biosharp公司;葡萄糖试剂盒、糖原测定试剂盒、己糖激酶(hexokinase,HK)试剂盒、丙酮酸激酶(pyruvate kinase,PK)试剂盒、总蛋白定量测试盒(BCA法),南京建成生物工程研究所;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS),飞净生物科技有限公司;HepG2细胞,上海瑾元生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
HVE-50立式高压灭菌锅,日本HIRAYAMA;KQ-500DM静音超声波清洗器,昆山市超声仪器有限公司;HL-2B数显恒流泵,上海驰唐电子有限公司;UV-5500紫外分光光度计,上海元析仪器有限公司;IRAffinity-1傅里叶变换红外光谱,日本岛津公司;STA449F5同步热分析仪,德国耐驰公司;Reacti-thermo氮气吹扫仪、ICS5000+离子色谱仪,美国Thermo公司;HZQ-F全温振荡培养箱,哈尔滨东联电子技术有限公司;Infinite 200 PRO酶标仪,长沙泰肯生物技术有限公司。
1.3 RPS制备工艺优化
1.3.1 RPS的提取
白茅根药材于60 ℃烘干后,粉碎过20目筛后,室温存储备用。
精确称取上述白茅根粉末20 g于锥形瓶中,加入500 mL超纯水,在110 ℃高压灭菌锅中提取15 min,取出冷却至室温,继续在400 W超声波功率下提取25 min,收集滤液,在60 ℃减压浓缩至30 mL,再加入120 mL的无水乙醇,4 ℃静置24 h后, 8 000 r/min离心5 min,收集沉淀物,加入20 mL超纯水复溶,过滤后冻干,得到浅棕色的粗多糖。
1.3.2 RPS得率计算
以葡萄糖为标准品,采用苯酚-硫酸法测定多糖含量[12],其回归方程Y=6.825 5X+0.008 1(R2=0.991 8),测定RPS总多糖的质量浓度,并按公式(1)计算,得到RPS得率。
(1)
式中:Y,提取粗多糖RPS的得率,%;ρ,多糖质量浓度,mg/mL;n,稀释倍数;V,多糖溶液的体积,mL;m,样品烘干后质量,mg。
1.3.3 单因素试验
采用高温高压超声波辅助提取RPS,以多糖得率为指标,对提取各因素进行研究。
液料比:固定提取温度110 ℃,提取时间15 min,超声波功率400 W,超声波处理时间25 min,考察不同料液比对RPS得率的影响。
提取温度:固定液料比20∶1(mL∶g),提取时间15 min,超声波功率400 W,超声波处理时间25 min,考察不同提取温度对RPS得率的影响。
提取时间:固定液料比20∶1(mL∶g),提取温度115 ℃,超声波功率400 W,超声波处理时间25 min,考察不同提取时间对RPS得率的影响。
超声波功率:固定液料比20∶1(mL∶g),提取温度115 ℃,提取时间15 min,超声波处理时间25 min,考察不同超声波功率对RPS得率的影响。
超声波处理时间:固定液料比20∶1(mL∶g),提取温度115 ℃,提取时间15 min,超声波功率400 W,考察不同超声波处理时间对RPS得率的影响。
1.3.4 响应面优化实验
根据单因素试验结果,超声波处理时间固定为25 min。选取液料比、提取温度、提取时间和超声波处理时间4个因素,以RPS得率为响应值,运用Box-Behnken进行响应面实验优化设计。
1.4 RPS的分离纯化
1.4.1 RPS脱蛋白
采用Sevag试剂[V(三氯甲烷)∶V(正丁醇)=4∶1]脱除蛋白,将RPS溶液与Sevag试剂混合搅拌30 min,去除析出蛋白质,重复操作4次,至无白色沉淀。脱除蛋白的多糖溶液,经旋转蒸发除去残余Sevag试剂,收集RPS溶液,用1 000 Da透析袋流水透析24 h。透析后将多糖溶液进行浓缩、冻干,得到RPS。
1.4.2 纤维素层析柱分离RPS
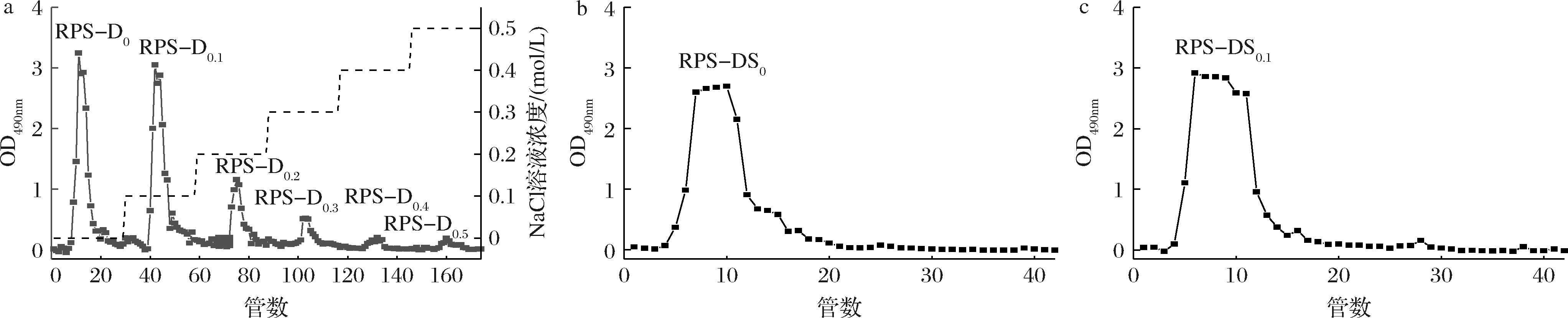
称取500 mg除蛋白的RPS溶于50 mL去离子水中,配制成质量浓度为10 mg/mL的多糖溶液,用0.45 μm水系膜过滤后备用。将多糖溶液缓慢注入DEAE-DE纤维素52层析柱中,依次用0、0.1、0.2、0.3、0.4、0.5 mol/L的NaCl溶液进行洗脱,流速1 mL/min,每管4 mL。采用苯酚-硫酸法对多糖含量进行检测,以收集管数为横坐标,490 nm处吸光值为纵坐标,绘制洗脱曲线。根据峰值段收集洗脱液,减压浓缩至10 mL,用1 000 Da透析袋流水透析24 h后冻干,得到6个多糖组分:RPS-D0、RPS-D0.1、RPS-D0.2、RPS-D0.3、RPS-D0.4和RPS-D0.5。
1.4.3 凝胶层析柱纯化RPS
采用Sephadex G-100凝胶层析柱对主要多糖成分RPS-D0和RPS-D0.1进一步分离纯化,上样质量浓度为10 mg/mL,缓慢注入Sephadex G-100凝胶层析柱,用流速为0.5 mL/min的去离子水进行洗脱,每管4 mL。采用苯酚-硫酸法测定洗脱液在490 nm处的吸光值,并绘制洗脱曲线。根据峰值段收集洗脱液,将收集洗脱液浓缩和冷冻干燥,得到2个纯化组分:RPS-DS0和RPS-DS0.1。
1.5 分子质量测定
参照文献[13]的方法,使用高效凝胶色谱法测定样品的相对分子质量。采用BRT105-103-101串联凝胶柱(8 mm I.D.×300 mm);流动相(0.2 mol/L NaCl溶液);流速0.8 mL/min;柱温40 ℃;进样量25 μL;检测器为示差检测器RID-10A。
1.6 单糖组成测定
参照文献[14]的方法,比较检测样品与单糖标准品在色谱图中保留时间,确定单糖组成。采用DionexTM CarboPacTM PA20(3.0 mm×150 mm,10 μm)液相色谱柱;进样量5 μL;流动相A(H2O),流动相B(0.1 mol/L NaOH溶液),流动相C(0.1 mol/L NaOH溶液,0.2 mol/L CH3COONa溶液),流速0.5 mL/min;柱温30 ℃。
1.7 紫外光谱分析
采用紫外光谱进一步分析纯化多糖中核酸和蛋白质。将纯化组分RPS-DS0和RPS-DS0.1用去离子水配制成质量浓度为1 mg/mL的多糖溶液,以去离子水为空白对照,在200~400 nm波长下进行紫外光谱扫描。
1.8 红外光谱分析
用KBr制片去除背景的干扰,再称取2 mg多糖样品(RPS-DS0和RPS-DS0.1),与200 mg的KBr充分研磨,压片机压成薄片。分辨率为4 cm-1在4 000~500 cm-1进行红外光谱扫描。
1.9 刚果红实验
采用刚果红法分析纯化多糖三螺旋结构[15]。取2 mL(2 mg/mL)纯化多糖溶液与2 mL(160 μmol/L)刚果红溶液混合,依次加入0、0.1、0.2、0.5、0.6、0.8 mol/L 的NaOH溶液,室温静置15 min,400~600 nm进行全波长扫描,测定溶液最大吸收波长。以NaOH浓度为横坐标,以最大吸收波长为纵坐标,并绘制曲线。
1.10 热重分析
采用同步热分析法分析纯化多糖的热稳定性。称取5 mg多糖样品(RPS-DS0和RPS-DS0.1),放于坩埚中,以10 ℃/min加热速率,在50~800 ℃进行热重分析。
1.11 α-淀粉酶抑制率测定
参照文献[15]的方法,对多糖RPS-DS0和RPS-DS0.1进行α-淀粉酶的抑制率测定。用去离子水将多糖配置成不同质量浓度的溶液。以阿卡波糖为阳性对照,取250 μL多糖液,与250 μL α-淀粉酶(1U)充分混合,37 ℃水浴10 min后,加入质量分数为1%可溶性淀粉溶液250 μL,继续37 ℃水浴10 min,取出后加入500 μL DNS试剂终止反应,并在沸水浴加热5 min,冷却至室温,加入去离子水至5 mL,540 nm处检测吸光值,按公式(2)计算α-淀粉酶的抑制率。
(2)
式中:Y,α-淀粉酶抑制率,%;A0,用去离子水代替样品的吸光值;A1,被测样品反应后的吸光值;A2,去离子水代替α-淀粉酶溶液混合后的吸光值。
1.12 细胞实验
1.12.1 细胞培养与分组
在37 ℃、5% CO2的培养条件下,用完全培养基(89% DMEM培养基、10% FBS和1%青霉素-链霉素,体积分数)培养HepG2细胞。当细胞贴壁80%后,用0.25%胰蛋白酶(质量分数,下同)进行消化传代,并选取对数生长期细胞进行实验。
取对数生长期HepG2细胞,用0.25%胰蛋白酶消化后,加入完全培养基调节成3×105个/mL的细胞悬液,接种于6孔板中每孔1 mL。将细胞分为6组:空白组(无血清培养基)、模型组(10-7 mol/L胰岛素)、阳性对照组(10-7 mol/L胰岛素+1 mg/mL二甲双胍)、RPS-DS0.1L组(10-7 mol/L胰岛素+2.5 mg/mL RPS-DS0.1)、RPS-DS0.1M组(10-7 mol/L胰岛素+5 mg/mL RPS-DS0.1)、RPS-DS0.1H组(10-7 mol/L胰岛素+10 mg/mL RPS-DS0.1)。
1.12.2 细胞存活率测定
采用MTT法测定多糖RPS-DS0.1对HepG2细胞存活率的影响。将RPS-DS0.1用DMEM培养基配置成不同质量浓度备用。将3×105个/mL的HepG2细胞悬液加入96孔板,每孔100 μL。放入37 ℃、5% CO2的培养箱中培养24 h后,加入100μL不同质量浓度(0、1.25、2.5、5、10、20、40、80 mg/mL)的RPS-DS0.1溶液继续培养24 h,加入20 μL 5 mg/mL的MTT溶液继续在培养箱中反应4 h,弃去上清液,加入100 μL DMSO溶液,充分振荡10 min,570 nm处检测吸光值[16]。并按照公式(3)计算HepG2细胞存活率。
(3)
式中:Y,细胞存活率,%;A0,无细胞孔的吸光值;A1,含有HepG2细胞和被测样品的吸光值;A2,含有HepG2细胞的吸光值。
1.12.3 胰岛素抵抗细胞模型的建立
取对数生长期的HepG2细胞,用0.25%胰蛋白酶进行消化,加入完全培养基调节成3×105个/mL的细胞悬液,接种于96孔板,每孔100 μL,细胞贴壁后,弃去培养基,加入10-7 mol/L胰岛素溶液100 μL,诱导36 h。
1.12.4 葡萄糖消耗量和糖原含量测定
按照1.12.1节的细胞分组进行培养,用0.25%胰蛋白酶消化,收集细胞离心,弃上清液,用等渗溶液清洗细胞1~2次,离心保留沉淀细胞。向沉淀细胞中加入0.1 mol/L pH=7.4的磷酸盐缓冲溶液,匀浆后冰水浴下超声波破碎。按照葡萄糖、糖原和总蛋白定量测试试剂盒说明进行检测。
1.12.5 HK和PK活性测定
实验分组同1.12.1节,用0.25%胰蛋白酶消化后,收集、离心、保留沉淀细胞待用,后续操作按照HK、PK和总蛋白定量测试试剂盒说明进行检测。
1.13 数据处理与分析
采用Excel 2019软件进行数据处理,每组数据测定3次,实验数据以平均值±标准偏差来表示。采用Origin 2019软件绘图,Design-Expert12软件进行响应面试验设计与数据处理,SPSS 27软件进行数据分析,单因素方差分析,P<0.05,差异显著;P<0.01,差异高度显著;P<0.001,差异极其显著。
2 结果与分析
2.1 单因素结果分析
如图1-a所示,RPS得率随着液料比的逐渐增加,在20∶1(mL∶g)时达到峰值。当液料比大于20∶1(mL∶g)时,液料比增大,RPS得率出现降低趋势。这可能是当液料比较小时,RPS溶出不完全;随着溶剂体积的增大白茅根粉末与溶剂接触充分,增加多糖的释放量。当RPS溶出量达到一定水平时,可能导致其他物质的溶出[17],从而使RPS得率降低。
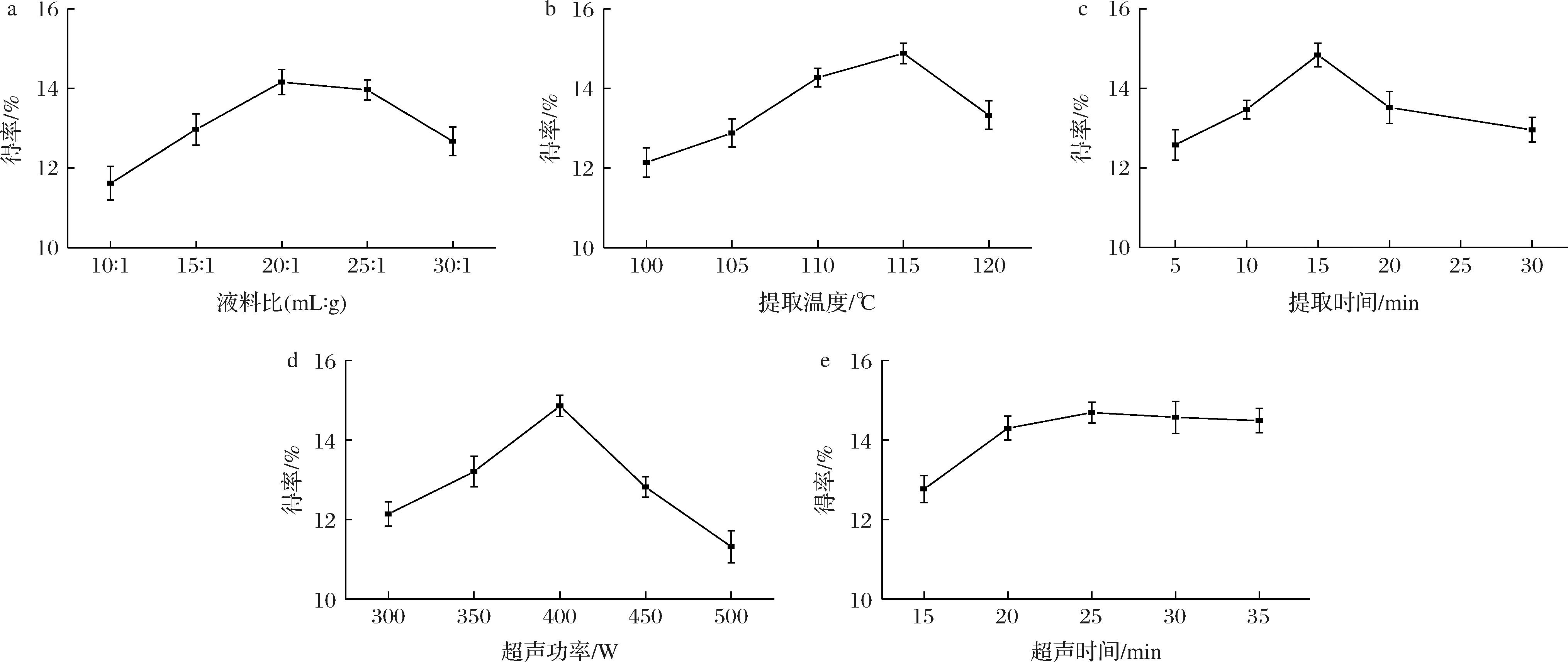
a-液料比;b-提取温度;c-提取时间;d-超声波功率;e-超声波处理时间
图1 单因素试验结果
Fig.1 Results of single factor experiment
如图1-b所示,在100~120 ℃,RPS得率呈现先增加后降低的趋势。在115 ℃时,RPS得率达到最大值,是因为随着提取温度的提高,植物细胞壁破裂加剧,RPS更快速溶解于溶剂中;但当提取温过高时,引起RPS糖苷键断裂,造成RPS水解[18],导致RPS得率有所降低。
如图1-c所示,当提取时间增加到15 min时,RPS得率达到最大值;当时间增加到30 min,RPS得率有所降低。这说明时间过短,细胞壁未能完全破坏,多糖溶出不完全。但长时间处于115 ℃的环境下提取,又会造成RPS糖苷键断裂,导致RPS得率下降[19]。
如图1-d所示,超声波功率在300~500 W时,RPS得率先增大后减小,当超声波功率达到400 W时,RPS得率达到最大值,这说明超声波功率在300~400 W时,随着超声波功率增强,产生的空化作用和机械振动效应增加,对细胞壁破坏作用也加剧,有利于RPS的溶出;超声波功率在400~500 W时,超声波功率过高,RPS水解加剧[20],RPS得率有所降低。
如图1-e所示,超声波处理时间在15~35 min,RPS得率先增加后趋于平稳,在25 min时达到最大值。可能是由于超声波使细胞壁裂解,从而提高RPS溶出率。但当超声波处理时间超过25 min后,RPS得率有下降趋势,这可能是由于超声波处理时间过长产生机械剪切力,使部分多糖结构被破坏[21]。因此,选定超声波处理时间为25 min进行后续实验。
2.2 响应面优化结果
基于单因素试验结果,考虑到超声波处理时间对RPS得率影响较小,故将超声波处理时间固定为25 min。以液料比、提取温度、提取时间和超声波功率4个因素为自变量, RPS得率为响应值,通过响应面分析法对RPS的提取工艺进行4因素3水平优化。响应面实验方案及结果见表1。通过Box-Behnken对比实验数据进行拟合,得到RPS得率的回归方程如下:
Y=14.81-0.1558×A-0.3367×B+0.0917×C+0.1908×D-0.0975×AB+0.0050×AC+0.1300×AD+0.0050×BC-0.0325×BD-0.0350×CD-0.5864×A2-0.4627×B2-0.5452×C2-0.5514×D2
(4)
表1 响应面实验设计与结果
Table 1 Experimental design and results for response surface analysis
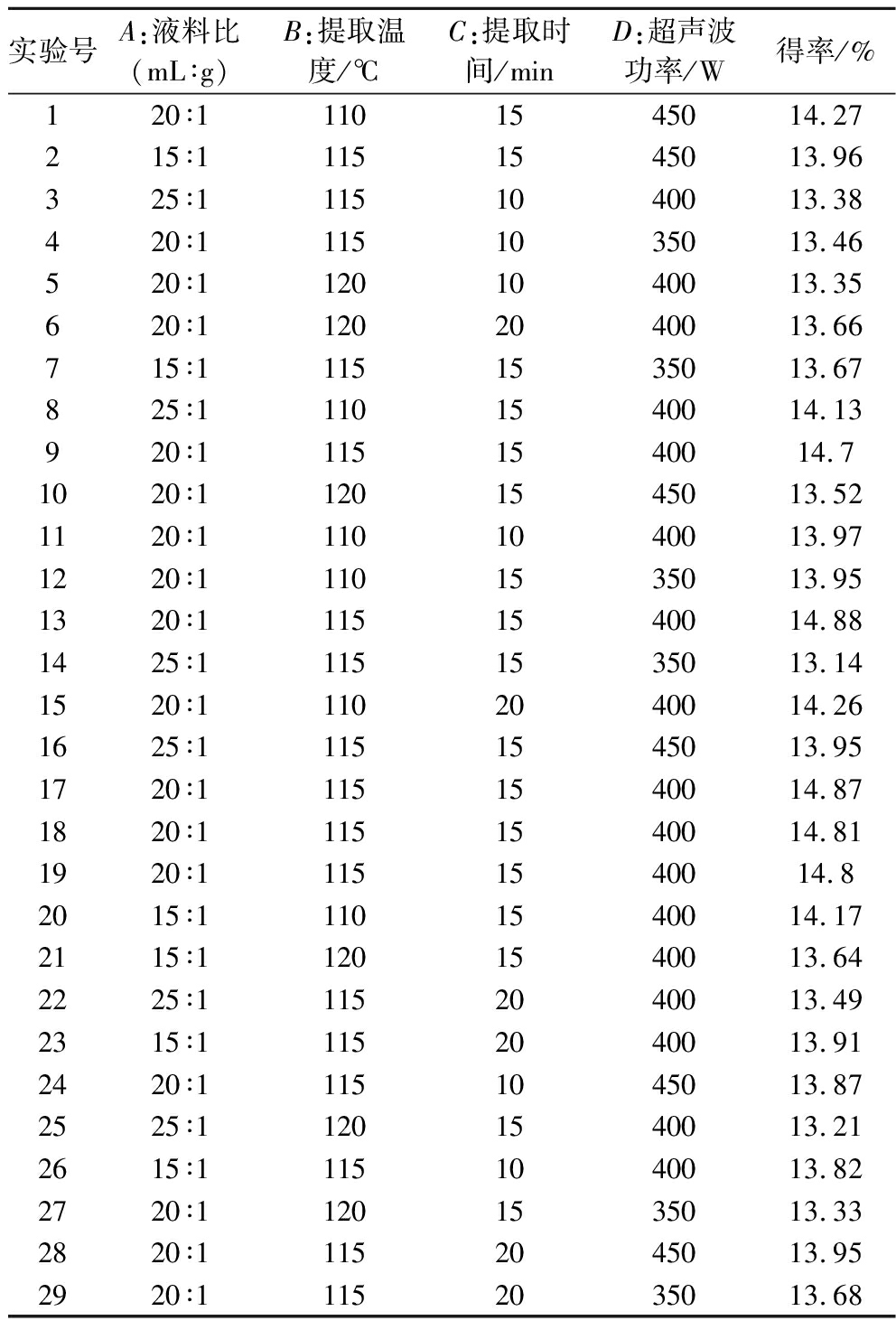
实验号A:液料比(mL∶g)B:提取温度/℃C:提取时间/minD:超声波功率/W得率/%120∶11101545014.27215∶11151545013.96325∶11151040013.38420∶11151035013.46520∶11201040013.35620∶11202040013.66715∶11151535013.67825∶11101540014.13920∶11151540014.71020∶11201545013.521120∶11101040013.971220∶11101535013.951320∶11151540014.881425∶11151535013.141520∶11102040014.261625∶11151545013.951720∶11151540014.871820∶11151540014.811920∶11151540014.82015∶11101540014.172115∶11201540013.642225∶11152040013.492315∶11152040013.912420∶11151045013.872525∶11201540013.212615∶11151040013.822720∶11201535013.332820∶11152045013.952920∶11152035013.68
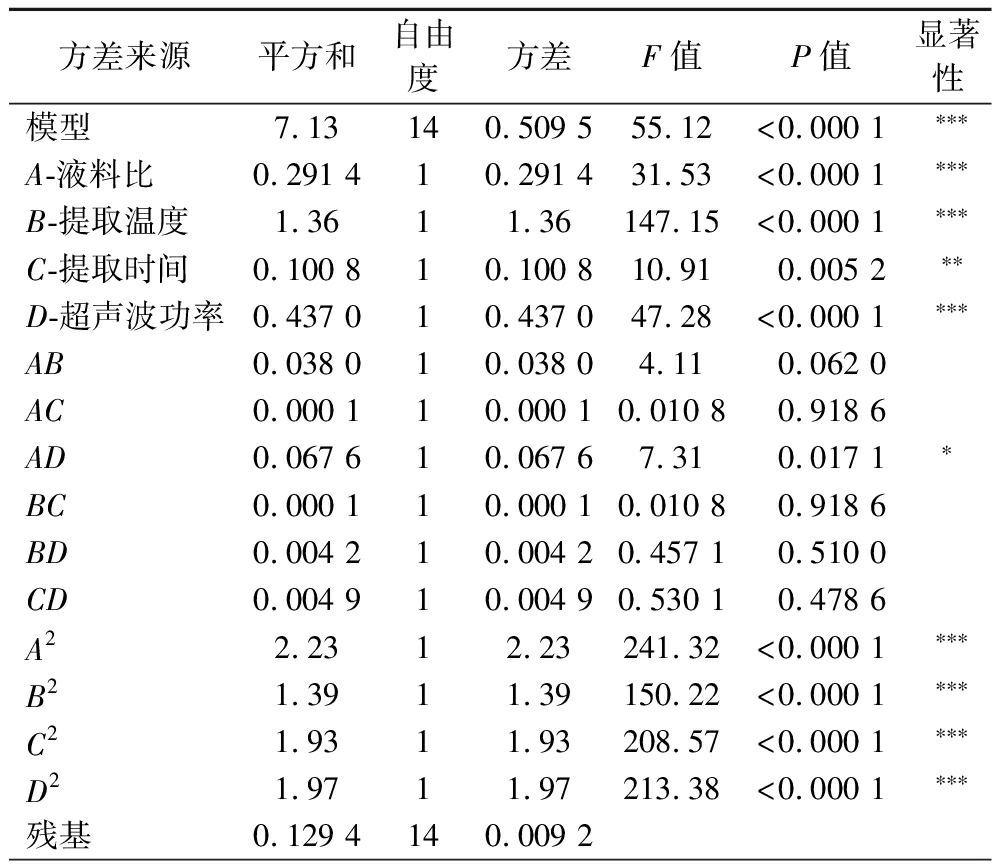
回归模型方差分析结果,见表2,该回归模型极其显著(P<0.000 1),失拟项P=0.246 8>0.05,说明失拟项差异不显著;决定系数R2=0.982 2,校正后Radj2=0.964 4,说明该回归方程拟合度良好,实验方法可信度较高[22],可用于RPS得率的分析和预测。由F值可知各因素对RPS得率影响程度为:提取温度>超声波功率>液料比>提取时间。
表2 回归模型方差分析结果
Table 2 Analysis of variance of quadratic polynomial model
方差来源平方和自由度方差F值P值显著性模型7.13140.509 555.12<0.000 1∗∗∗A-液料比0.291 410.291 431.53<0.000 1∗∗∗B-提取温度1.3611.36147.15<0.000 1∗∗∗C-提取时间0.100 810.100 810.910.005 2∗∗D-超声波功率0.437 010.437 047.28<0.000 1∗∗∗AB0.038 010.038 04.110.062 0AC0.000 110.000 10.010 80.918 6AD0.067 610.067 67.310.017 1∗BC0.000 110.000 10.010 80.918 6BD0.004 210.004 20.457 10.510 0CD0.004 910.004 90.530 10.478 6A22.2312.23241.32<0.000 1∗∗∗B21.3911.39150.22<0.000 1∗∗∗C21.9311.93208.57<0.000 1∗∗∗D21.9711.97213.38<0.000 1∗∗∗残基0.129 4140.009 2
续表2
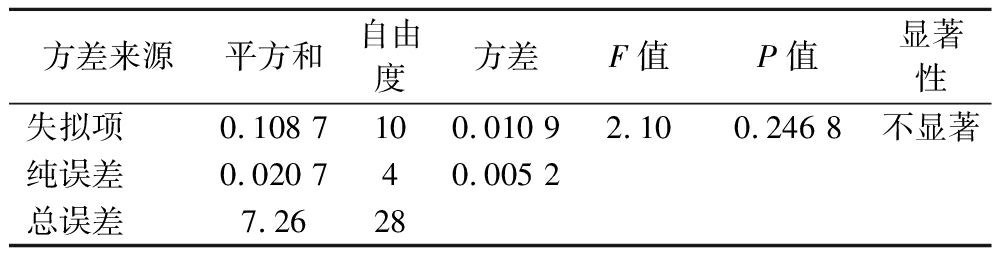
方差来源平方和自由度方差F值P值显著性失拟项0.108 7100.010 92.100.246 8不显著纯误差0.020 740.005 2总误差7.2628
注:***极其显著(P<0.001);**高度显著(P<0.01);*显著(P<0.05)。
依据回归模型,可预测RPS最佳提取工艺为:液料比20.11∶1(mL∶g)、提取温度112.33 ℃、提取时间15.26 min、超声波功率410.48 W,此时RPS得率的理论值为14.88%。考虑到实际可操作性,将最佳提取工艺参数调整为:液料比20∶1(mL∶g)、提取温度112 ℃、提取时间15 min、超声波功率410 W、超声波处理时间25 min,进行3次平行实验,RPS多糖平均质量分数得率为14.79%,这也与理论值相近,可见该模型能较好地预测试验结果。
2.3 RPS纯化结果
如图2-a所示,经DEAE-DE纤维素52阴离子交换柱对RPS进行纯化,RPS经由NaCl溶液洗脱,得到6个多糖组分(RPS-D0、RPS-D0.1、RPS-D0.2、RPS-D0.3、RPS-D0.4和RPS-D0.5)。将多糖含量较高的2个多糖组分浓缩、透析和冻干,得到2种初步纯化多糖RPS-D0和RPS-D0.1,用于Sephadex G-100凝胶层析柱进一步纯化。
a-DEAE-纤维素52阴离子交换柱纯化RPS;b-Sephadex G-100凝胶柱纯化出RPS-DS0;c-Sephadex G-100凝胶柱纯化出RPS-DS0.1
图2 RPS纯化结果
Fig.2 Purification resultsof RPS
Sephadex G-100凝胶层析柱是根据分子质量大小对多糖样品进行分离纯化,大分子质量的多糖分子先流出凝胶柱,而小分子质量的多糖分子后流出,从而实现分离。如图2-b、图2-c所示,RPS-D0和RPS-D0.1经由Sephadex G-100凝胶层析柱分离纯化均得到单一峰,这说明样品为纯度较高的均一多糖。将收集2种多糖组分进行浓缩、透析和冻干,得到RPS纯品RPS-DS0和RPS-DS0.1。成分测定结果表明, RPS-DS0中总糖和蛋白质质量分数分别为98.68%和0.01%;RPS-DS0.1中总糖和蛋白质质量分数分别为91.22%和0.02%。
2.4 分子质量分析
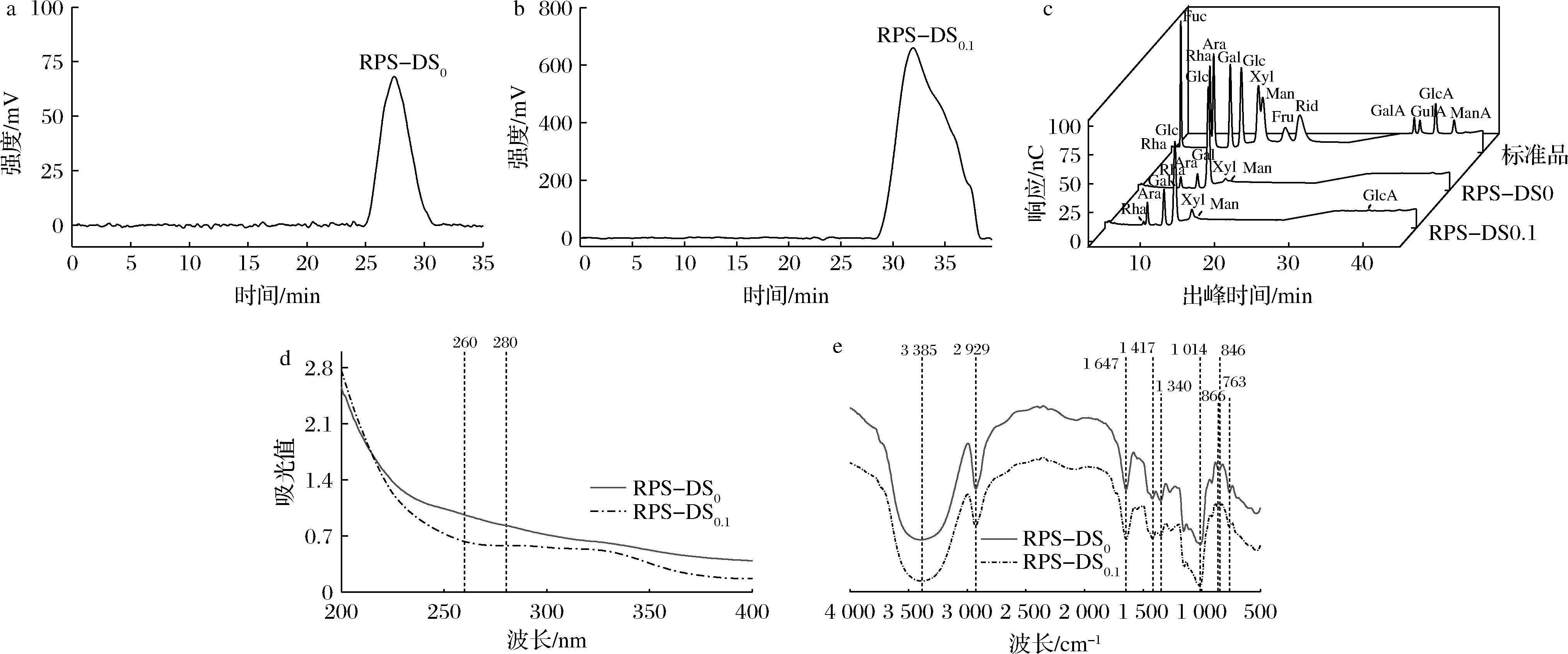
如图3-a和图3-b所示,RPS-DS0和RPS-DS0.1在凝胶渗透色谱图中呈现单一对称峰,表明RPS-DS0和RPS-DS0.1均是均一组分多糖。根据RPS-DS0和RPS-DS0.1的出峰时间分别为28.038和31.926 min,计算得到RPS-DS0和RPS-DS0.1的分子质量(Mw)为179.14和29.79 kDa。
a-纯化多糖RPS-DS0分子质量色谱图;b-纯化多糖RPS-DS0.1分子质量色谱图;c-单糖组成色谱图;d-紫外全波长扫描光谱图;e-傅里叶变换红外光谱图
图3 纯化多糖RPS-DS0分子质量色谱图、纯化多糖RPS-DS0.1分子质量色谱图、单糖组成色谱图、紫外全波长扫描光谱图和傅里叶变换红外光谱图
Fig.3 Purified polysaccharide RPS-DS0 molecular weight chromatogram, purified polysaccharide RPS-DS0.1molecular weight chromatogram, monosaccharide composition chromatogram, UV full-wavelength scanning spectroscopy and Fourier transform infrared (FTIR) spectroscopy
2.5 单糖组成分析
如图3-c所示,通过与标准品对比,RPS-DS0是由阿拉伯糖、半乳糖、葡萄糖、木糖和甘露糖组成,其物质的量比为6.79∶9.68∶75.52∶4.38∶1.88。RPS-DS0.1是由鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖和葡萄糖醛酸组成,其物质的量比为2.48∶11.76∶20.08∶50.92∶10.25∶2.08∶2.12。通过对比得出,RPS-DS0.1中含有的鼠李糖、阿拉伯糖、半乳糖、木糖、甘露糖和葡萄糖醛酸高于RPS-DS0。同时RPS-DS0.1和RPS-DS0中葡萄糖含量最高,这表明RPS-DS0和RPS-DS0.1分别是以葡萄糖含量为主的中性多糖、酸性多糖。邹一可等[23]研究发现,RPS由鼠李糖、木糖、甘露糖和葡萄糖等5种单糖组成,其物质的量比为1∶11.45∶1.02∶59.23。与本文分离纯化的单糖组成种类和物质的量比相类似,其中均是葡萄糖占比最高。
2.6 紫外光谱分析
通过多糖溶液200~400 nm的吸收峰,可以检验多糖溶液中是否含有核酸和蛋白质[16]。如图3-d所示,RPS-DS0和RPS-DS0.1在260 nm和280 nm处均无明显的吸收峰,这说明纯化多糖中几乎不含核酸和蛋白质,这也验证RPS-DS0和RPS-DS0.1有较高的纯度。
2.7 红外光谱分析
在RPS-DS0和RPS-DS0.1的红外光谱图(图3-e)中3 385和2 929 cm-1附近出现强吸收峰代表O—H和C—H伸缩振动吸收[24],为多糖类物质特征吸收峰。1 647和1 417 cm-1处的吸收峰是羧酸基的不对称和对称伸缩振动吸收峰,说明在RPS-DS0和RPS-DS0.1中存在糖醛酸[25]。1 340 cm-1处的吸收峰是烷基的C—H变角振动吸收峰;1 014 cm-1处的吸收峰表明在RPS-DS0和RPS-DS0.1中存在吡喃糖环[26];866和846 cm-1处的吸收峰,代表多糖中含有β-糖苷键和α-糖苷键[27-28];763 cm-1处的吸收峰是由D-木糖对称拉伸振动引起的[29]。
2.8 刚果红分析
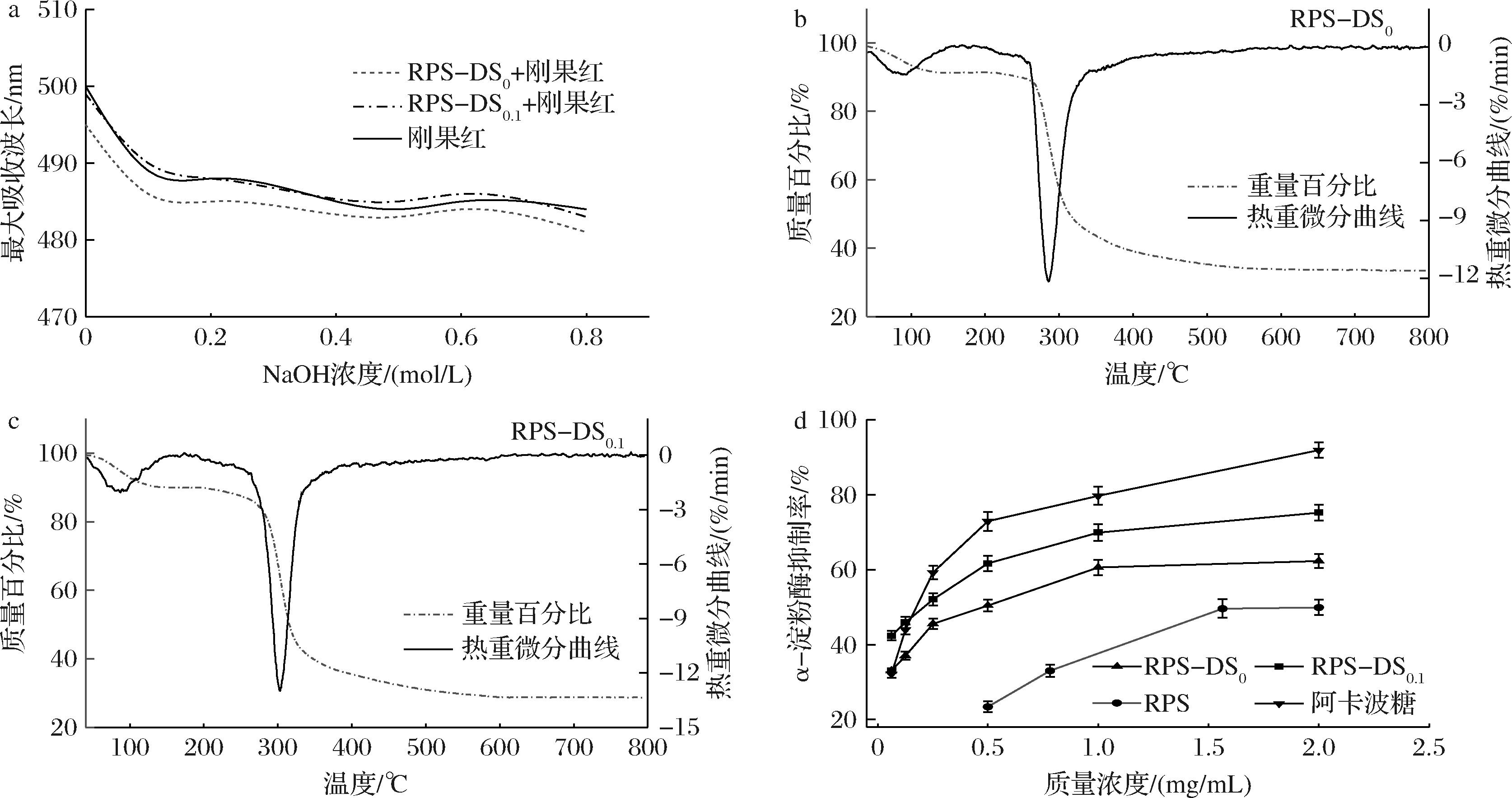
在碱性条件下,刚果红能与多糖的三螺旋结构形成复合物。随着NaOH浓度的增加,三螺旋结构被破坏,导致最大吸收峰降低[30]。如图4-a所示,随着NaOH浓度增大,RPS-DS0和RPS-DS0.1最大吸收波长不断减小。与刚果红溶液相比,未发生红移。由此推断,RPS-DS0和RPS-DS0.1不存在三股螺旋结构。
a-刚果红实验结果;b-RPS-DS0的TG-DTG 曲线;c-RPS-DS0.1的TG-DTG 曲线;d-对α-淀粉酶的抑制率影响
图4 刚果红实验结果、RPS-DS0的TG-DTG 曲线、RPS-DS0.1的TG-DTG 曲线、对α-淀粉酶的抑制率影响
Fig.4 Results of the Congo red assay, TG-DTG curves of RPS-DS0, TG-DTG curves of RPS-DS0.1, effect on the inhibition rate of α-amylase
2.9 热重分析
RPS-DS0和RPS-DS0.1的热分解曲线(图4-b、图4-c)大致呈现出3个不同的阶段,第1阶段从初始温度到150 ℃,质量损失代表多糖中的水分,表明2种多糖都具有一定的持水能力。第2阶段从200~400 ℃,在300 ℃两种多糖样品有最大热降解率,质量损失约为62%。第3阶段从400~800 ℃,两种多糖的最终残留质量均约为30%。热重结果表明RPS-DS0和RPS-DS0.1热稳定性基本相当。
2.10 α-淀粉酶抑制活性
α-淀粉酶抑制剂可以与体内的α-淀粉酶发生作用,阻止淀粉转化为葡萄糖,可以有效控制血糖水平和调节血脂。如图4-d所示,RPS-DS0、RPS-DS0.1和阿卡波糖的半抑制质量浓度分别为0.40、0.21、0.19 mg/mL。可以看出RPS-DS0.1展现出良好的α-淀粉酶抑制活性,其活性接近阿卡波糖。研究发现,具有降血糖活性的多糖的分子质量通常在3~150 kDa[31]。不同分子质量的多糖表现出不同的活性,其中分子质量较低反而具有较高的活性[32]。有研究表明,多糖降糖活性较高与其单糖组成中半乳糖、鼠李糖、甘露糖、葡萄糖醛酸和阿拉伯糖的含量有关[33-34]。由此推断,RPS-DS0.1含有的鼠李糖、阿拉伯糖、半乳糖、甘露糖、葡萄糖醛酸和适当分子质量(29.79 kDa)可能是其降糖活性较高的原因。在后续实验中,选取RPS-DS0.1进行HepG2细胞的降糖活性分析。
2.11 细胞实验结果分析
2.11.1 RPS-DS0.1对细胞毒性影响
采用MTT法检测RPS-DS0.1的HepG2细胞毒性,依据HepG2细胞存活率筛选出后续使用RPS-DS0.1安全剂量。不同质量浓度的RPS-DS0.1对HepG2细胞干预24 h后的细胞存活情况见图5-a,当RPS-DS0.1质量浓度从1.25 mg/mL增加到10 mg/mL时,HepG2细胞存活率都在80%以上;当RPS-DS0.1质量浓度达到20 mg/mL时,HepG2细胞存活率降低。可见,当RPS-DS0.1质量浓度超过一定范围时,对细胞存活产生抑制作用。因此,选取质量浓度2.5、5、10 mg/mL的RPS-DS0.1进行HepG2细胞体外降糖实验(即RPS-DS0.1L、RPS-DS0.1M和RPS-DS0.1H)。

a-细胞存活率;b-葡萄糖消耗量;c-糖原含量;d-HK活性;e-PK活性
图5 细胞实验结果
Fig.5 Results of cell experiment
注:与空白组相比,*P<0.05,**P<0.01,*** P<0.001;与模型组相比,#P<0.05,##P<0.01,###P<0.001。
2.11.2 RPS-DS0.1对IR-HepG2 细胞葡萄糖消耗量和糖原含量影响
正常机体内,细胞利用胰岛素将葡萄糖分解,为机体提供能量。当机体产生胰岛素抵抗时,细胞对胰岛素敏感性降低,导致细胞对葡萄糖摄取量下降。使用改善胰岛素抵抗的药物会提高细胞对葡萄糖的消耗量[35],进而达到降糖效果。不同质量浓度的RPS-DS0.1对IR-HepG2细胞的葡萄糖消耗量影响见图5-b。与空白组相比,模型组细胞的葡萄糖消耗量显著降低;与模型组相比,RPS-DS0.1M组、RPS-DS0.1H组和阳性对照组细胞的葡萄糖消耗量都有明显提高。空白组、RPS-DS0.1H组和阳性对照组细胞的葡萄糖消耗量无明显差异,这说明RPS-DS0.1能有效提高IR-HepG2细胞对葡萄糖的消耗量,表现出降糖作用。
此外,细胞摄取葡萄糖经各种酶作用合成糖原,糖原的合成与分解对维持血糖平衡极为重要[36]。不同质量浓度的RPS-DS0.1对IR-HepG2细胞合成糖原的影响见图5-c。与空白组相比,模型组细胞的糖原含量显著降低。与模型组相比,经由RPS-DS0.1(RPS-DS0.1L、RPS-DS0.1M和RPS-DS0.1H)和阳性药(二甲双胍)处理后的IR-HepG2细胞的糖原含量得到显著提高,这表明RPS-DS0.1能发挥改善IR-HepG2细胞糖代谢紊乱的作用。
2.11.3 RPS-DS0.1对IR-HepG2 细胞HK和PK活性影响
HK被认为是糖酵解途径中催化己糖磷酸化为磷酸己糖的一种重要的酶。PK是糖酵解中的另一种重要酶,胰岛素抵抗会降低HK、PK的活性和对葡萄糖的利用[37]。因此,调节HK和PK活性是促进葡萄糖代谢的关键因素[38],也是检验体外降糖作用的重要指标。如图5-d和图5-e所示,与空白组相比,模型组细胞的HK和PK活性显著降低;而阳性对照组细胞的HK和PK活性显著升高。与模型组相比,经RPS-DS0.1处理后,细胞的HK和PK活性显著提高,呈现与多糖剂量依赖关系。这说明RPS-DS0.1具有增强HK和PK活性,促进糖代谢作用,发挥降糖效果。
2 结论与讨论
通过单因素响应面实验对RPS的提取进行优化,并分离纯化出具有降血糖活性的多糖RPS-DS0和RPS-DS0.1,分别对2种多糖进行结构鉴定和α-淀粉酶的抑制活性测定。结果表明,在最佳提取条件为液料比20∶1(mL∶g)、提取温度112 ℃、提取时间15 min、超声波功率410 W、超声波处理时间25 min,验证RPS质量分数得率为14.79%。RPS-DS0分子质量为179.14 kDa,并由阿拉伯糖、半乳糖、葡萄糖、木糖和甘露糖组成,其物质的量比为6.79∶9.68∶75.52∶4.38∶1.88。RPS-DS0.1分子质量为29.79 kDa,由鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖和葡萄糖醛酸组成,其物质的量比为2.48∶11.76∶20.08∶50.92∶10.25∶2.08∶2.12。通过对α-淀粉酶的抑制活性测定,得出RPS-DS0.1抑制效果强于RPS-DS0。综上推断,RPS-DS0.1降糖活性较高的原因可能是其含有的鼠李糖、阿拉伯糖、半乳糖、甘露糖、葡萄糖醛酸和适当的分子质量(29.79 kDa)导致。对RPS-DS0.1进行HepG2细胞降糖作用研究,得出RPS-DS0.1可有效提高IR-HepG2细胞对葡萄糖的消耗和糖原合成,增强HK和PK活性可促进糖代谢,实现降血糖作用,研究结果将为植物RPS在功能性食品和药物中的研发、提取和应用奠定理论基础。
[1] 王伟, 郭庆梅, 周凤琴.白茅根的药效考证与现代研究比较[J].中国海洋药物, 2014, 33(5):92-96.WANG W, GUO Q M, ZHOU F Q.The comparison of textual research on the efficacy and the modern research of Imperatae Rhizoma[J].Chinese Journal of Marine Drugs, 2014, 33(5):92-96.
[2] 崔珏, 李超, 尤健, 等.白茅根多糖改善糖尿病小鼠糖脂代谢作用的研究[J].食品科学, 2012, 33(19):302-305.CUI J, LI C, YOU J, et al.Effects of Imperata cylindrica polysaccharides on glucose and lipid metabolism in diabetic mice[J].Food Science, 2012, 33(19):302-305.
[3] ZHU J, HAN J F, LIU L H, et al.Clinical expert consensus on the assessment and protection of pancreatic islet β-cell function in type 2 diabetes mellitus[J].Diabetes Research and Clinical Practice, 2023, 197:110568.
[4] WANG M J, CHEN M, GUO R, et al.The improvement of sulforaphane in type 2 diabetes mellitus (T2DM) and related complications:A review[J].Trends in Food Science &Technology, 2022, 129:397-407.
[5] 魏波, 陈玮婷, 刘腾, 等.注射胰岛素过量致低血糖昏迷一例[J].临床药物治疗杂志, 2021, 19(7):75-78.WEI B, CHEN W T, LIU T, et al.A case of hypoglycemic coma caused by excessive insulin injection[J].Clinical Medication Journal, 2021, 19(7):75-78.
[6] 武晓艳, 叶钰怡, 任文凯, 等.植物多糖研究进展:功能活性及潜在机制[J].中国科学:生命科学, 2023, 53(6):808-824.WU X Y, YE Y Y, REN W K, et al.Research progress of plant polysaccharides:Functional activities and potential mechanisms[J].Scientia Sinica (Vitae), 2023, 53(6):808-824.
[7] 张拥军, 姚惠源, 龚院生, 等.南瓜多糖的分离提取及其降血糖作用的研究[J].食品科技, 2001, 26(5):15-16;18.ZHANG Y J, YAO H Y, GONG Y S, et al.Study on extraction and separation of pumpkin polysaccharide and it’s glucatonic effect[J].Food Science and Technology, 2001, 26(5):15-16;18.
[8] 陈斌. 植物多糖在化妆品中的应用研究进展[J].中国野生植物资源, 2020, 39(4):44-47.CHEN B.Research progress on the application of plant polysaccharide in cosmetics[J].Chinese Wild Plant Resources, 2020, 39(4):44-47.
[9] 王亦欣, 陈茜, 匡映, 等.植物多糖气凝胶材料应用的研究进展[J].武汉工程大学学报, 2017, 39(5):443-449.WANG Y X, CHEN X, KUANG Y, et al.Progress in application of polysaccharide aerogels[J].Journal of Wuhan Institute of Technology, 2017, 39(5):443-449.
[10] 于淑池, 陈文, 杭瑜瑜, 等.海南苦丁茶多糖的降血糖功效评价[J].食品研究与开发, 2017, 38(4):161-164.YU S C, CHEN W, HANG Y Y, et al.An evaluation on the hypoglycemic efficacy of polysaccharide from Hainan Kudingtea[J].Food Research and Development, 2017, 38(4):161-164.
[11] 董英, 张慧慧.苦瓜多糖降血糖活性成分的研究[J].营养学报, 2008, 30(1):54-56.DONG Y, ZHANG H H.Studies on components with antihyperglycemic effect of Momordica charantia L.polysaccharides[J].Acta Nutrimenta Sinica, 2008, 30(1):54-56.
[12] ZENG C B, YE G Y, LI G C, et al.RID serve as a more appropriate measure than phenol sulfuric acid method for natural water-soluble polysaccharides quantification[J].Carbohydrate Polymers, 2022, 278:118928.
[13] XIE L, YAN H J, HAN L W, et al.Structural characterization and anti-inflammatory activity of neutral polysaccharides from American ginseng[J].International Journal of Biological Macromolecules, 2023, 248:125586.
[14] ZHU M Q, HUANG R M, WEN P, et al.Structural characterization and immunological activity of pectin polysaccharide from kiwano (Cucumis metuliferus) peels[J].Carbohydrate Polymers, 2021, 254:117371.
[15] 高浩天. 牛蒡子多糖的制备、结构鉴定及降糖活性研究[D].西安:陕西科技大学, 2021.GAO H T.Study on preparation, structure identification and hypoglycemic activity of Fructus Arctii polysaccharide[D].Xi’an:Shaanxi University of Science &Technology, 2021.
[16] YUN C, JI X C, CHEN Y W, et al.Ultrasound-assisted enzymatic extraction of Scutellaria baicalensis root polysaccharide and its hypoglycemic and immunomodulatory activities[J].International Journal of Biological Macromolecules, 2023, 227:134-145.
[17] 陈淑芳, 黎庆涛, 黄凯, 等.篱栏网多糖的提取工艺优化及抗氧化活性[J].应用化工, 2021, 50(11):3031-3035.CHEN S F, LI Q T, HUANG K, et al.Optimization of extraction process of polysaccharide from Merremia hederacea and its antioxidant activity[J].Applied Chemical Industry, 2021, 50(11):3031-3035.
[18] 黄明浩, 黄泰奇, 邓丽娟.响应面法优化白英粗多糖提取工艺及其体外抗氧化活性的分析[J].食品工业科技, 2023, 44(22):219-225.HUANG M H, HUANG T Q, DENG L J.Optimization of Solanum lyratum crude polysaccharide extraction process using response surface methodology and analysis of its in vitro antioxidant activity[J].Science and Technology of Food Industry, 2023, 44(22):219-225.
[19] 任薇. 沙棘多糖抗氧化、抗衰老、抗疲劳与免疫活性的研究[D].乌鲁木齐:新疆农业大学, 2019.REN W.Studies on Hippophae rhamnoides polysaccharides antioxidant, anti-aging and anti-fatigue and immune activity[D].Urumqi:Xinjiang Agricultural University, 2019.
[20] 李楠, 李桂芬, 刘亚琴, 等.响应面法优化超声提取柳罐枣多糖及其光谱性质研究[J].中国食品添加剂, 2022, 33(5):57-63.LI N, LI G F, LIU Y Q, et al.Optimization of ultrasonic extraction of polysaccharides from Liuguan jujube by response surface methodology and analysis of its spectral properties[J].China Food Additives, 2022, 33(5):57-63.
[21] 王博, 姚伦广, 鲁云风.山楂皮渣中果胶超声波辅助提取工艺优化与抗氧化性研究[J].粮油食品科技, 2023, 31(4):78-86.WANG B, YAO L G, LU Y F.Ultrasonic-assisted extraction process optimization and antioxidant activity of pectin from hawthorn peel dregs[J].Science and Technology of Cereals, Oils and Foods, 2023, 31(4):78-86.
[22] 吴金姗, 黄榕, 刘树英, 等.玉簪多糖对细胞氧化应激损伤的保护作用机制[J].食品科学, 2022, 43(17):138-146.WU J S, HUANG R, LIU S Y, et al.Protective mechanism of polysaccharide from Hosta ventricosa against oxidative damage in cells[J].Food Science, 2022, 43(17):138-146.
[23] 邹一可, 张明月, 王彩云, 等.白茅根多糖IC1的分离及其相对分子质量和单糖组成的测定[J].中国实验方剂学杂志, 2012, 18(2):80-82.ZOU Y K, ZHANG M Y, WANG C Y, et al.Determination of molecular weight and analysis of monosaccharide composition in isolation of polysaccharide from Imperata cylindrica[J].Chinese Journal of Experimental Traditional Medical Formulae, 2012, 18(2):80-82.
[24] JIANG L F.Cellulase-assisted extraction and antioxidant activity of polysaccharides from Rhizoma imperata[J].Carbohydrate Polymers, 2014, 108:99-102.
[25] 张慢, 潘丽军, 姜绍通, 等.响应面法优化酶-超声波辅助同步提取紫薯花青素工艺[J].食品科学, 2014, 35(10):23-28.ZHANG M, PAN L J, JIANG S T, et al.Optimization of ultrasonic-assisted enzymatic extraction of anthocyanins from purple sweet potato by response surface methodology[J].Food Science, 2014, 35(10):23-28.
[26] ZHANG Y, YAO L M, LIU Y F, et al.Acidic polysaccharide from corn silk:Structural &conformational properties and hepatoprotective activity[J].International Journal of Biological Macromolecules, 2023, 236:123851.
[27] PAN L, WANG L, ZHANG F, et al.Structural characterization and bifidogenic activity of polysaccharide from Dictyophora indusiata[J].Food Bioscience, 2023, 51:102297.
[28] LIU W J, LI Z Z, FENG C X, et al.The structures of two polysaccharides from Angelica sinensis and their effects on hepatic insulin resistance through blocking RAGE[J].Carbohydrate Polymers, 2022, 280:119001.
[29] KASIMU R, CHEN C L, XIE X Y, et al.Water-soluble polysaccharide from Erythronium sibiricum bulb:Structural characterisation and immunomodulating activity[J].International Journal of Biological Macromolecules, 2017, 105:452-462.
[30] ZLOBIN A A, MARTINSON E A, OVECHKINA I A, et al.Composition and properties of pectin polysaccharides of St.John’s wort Hypericum Perforatum L. [J].Russian Journal of Bioorganic Chemistry, 2012, 38(7):697-701.
[31] ZHANG S, LI X Z.Hypoglycemic activity in vitro of polysaccharides from Camellia oleifera Abel.seed cake[J].International Journal of Biological Macromolecules, 2018, 115:811-819.
[32] ZHANG Z S, WANG X M, MO X F, et al.Degradation and the antioxidant activity of polysaccharide from Enteromorpha linza[J].Carbohydrate Polymers, 2013, 92(2):2084-2087.
[33] 刘楠楠. 黑木耳多糖的提取纯化、结构表征及降糖活性研究[D].西安:陕西科技大学, 2022.LIU N N.Study on extraction, purification, structure characterization and hypoglycemic activity of auricularia auricularia polysaccharide[D].Xi’an:Shaanxi University of Science and Technology, 2022
[34] SHEN D, LU Y J, TIAN S H, et al.Effects of L-arabinose by hypoglycemic and modulating gut microbiome in a high-fat diet- and streptozotocin-induced mouse model of type 2 diabetes mellitus[J].Journal of Food Biochemistry, 2021, 45(12):e13991.
[35] TANG Y Y, HE X M, LIU G M, et al.Effects of different extraction methods on the structural, antioxidant and hypoglycemic properties of red pitaya stem polysaccharide[J].Food Chemistry, 2023, 405:134804.
[36] 王秋丹, 赵凯迪, 林长青.沙棘多糖对胰岛素抵抗HepG2细胞氧化应激的保护作用与机制[J].食品与机械, 2022, 38(3):167-172.WANG Q D, ZHAO K D, LIN C Q.Study on the protective effect and mechanism of seabuckthorn polysaccharides on insulin-resistant HepG2 cells from oxidative stress[J].Food &Machinery, 2022, 38(3):167-172.
[37] MA Y, MENG A L, DAI Y M, et al.Hypoglycemic activity of phenols from Pleioblastus amarus (Keng) shells and its main chemical constituents identificatied using UHPLC-Q-TOF-MS[J].Journal of Functional Foods, 2022, 97:105261.
[38] TIAN W T, ZHANG X W, LIU H P, et al.Structural characterization of an acid polysaccharide from Pinellia ternata and its induction effect on apoptosis of Hep G2 cells[J].International Journal of Biological Macromolecules, 2020, 153:451-460.