西梅又名欧洲李(Prunus domestica L.),是蔷薇科李属植物,原产于西亚和中亚,后传入欧洲并广泛种植于欧洲和美洲,21世纪初引进中国种植[1]。西梅果实口感顺滑、营养丰富,富含维生素、矿物质和膳食纤维等,不含胆固醇和脂肪,被称为第三代功能性食品[2]。研究表明,西梅具有抗氧化、润肠通便等功效,与其果肉中丰富的膳食纤维有关[3]。膳食纤维作为第七营养素,因其具有降低胆固醇含量、改善肠道菌群及预防心血管疾病等广泛的生理功能活性,在功能性食品和药品开发与利用方面引起广泛的关注[4]。西梅膳食纤维的提取方法主要有物理法、化学法、酶法及微生物发酵法等[5],然而这些方法提取得到的膳食纤维均为粗提膳食纤维,含有蛋白质和色素等杂质,影响膳食纤维生物活性分析和结构表征,故对西梅膳食纤维进行分离纯化具有重要意义。
目前,可溶性膳食纤维常用的纯化方法有分级沉淀法、超滤膜分离法、离子交换色谱法及凝胶色谱法等[6]。其中,凝胶色谱法是根据不同分子形状和大小的可溶性膳食纤维在层析柱中不同的移动速度达到分离纯化的目的[7],此方法具有较好的纯化效果,但上样量小,无法进行大量纯化。分级沉淀法是通过逐步提高醇、酮的体积分数来分离纯化可溶性膳食纤维,具有得率高的优点,但不适用于溶解度相差较小的可溶性膳食纤维[8]。超滤膜法则是通过膜两侧压力差,利用超滤膜截取小分子杂质,使其与可溶性膳食纤维分离,具有能耗低且分离效率高等优点[9],但分离时间长,膜在分离过程中易被污染,导致可溶性膳食纤维分离纯化受阻。离子交换色谱法是利用离子交换剂作为固定相,以含特定离子的溶液作为流动相,用于分离混合物各组分。相较于其他分离纯化方法,离子交换色谱法具有处理量大、高效、快速及操作简便等优点,已被广泛应用于多糖的分离纯化,其中最常用的填料是DEAE-52纤维素[10]。然而有关纯化西梅可溶性膳食纤维(prune soluble dietary fiber, PSDF)的报道较少,纯化过程中PSDF结构及功能活性变化未见报道。鉴于此,本研究以西梅为原料,采用超声波辅助酶法提取PSDF,利用DEAE-52纤维素柱层析进行纯化处理,探究纯化处理前后PSDF的结构、功能特性及抗氧化活性变化,以期提高西梅膳食纤维的开发、利用率,为膳食纤维的纯化加工提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
新鲜西梅,采摘于阿拉尔市团场;花生油,阿拉尔市塔里木超市;体积分数95%乙醇、苯酚、浓硫酸,天津市永大化学试剂有限公司;耐高温α-淀粉酶(3 700 U/g)、糖化酶(100 000 U/g)、木瓜蛋白酶(100 000 U/g)、单糖标准品、DEAE-52纤维素、透析袋,上海源叶有限公司。
1.1.2 试验设备
XS-04型高速粉碎机,兆申科技有限公司;EL-204-IC型分析天平,梅特勤-托利多上海科技有限公司;KQ 250-E型超声波清洗器,郑州长城科工贸有限公司;Pilot 3-6M型真空冷冻干燥机,北京博医康实验仪器有限公司;Synergy H1型酶标仪,岛津(上海)实验器材有限公司;Vector 33型傅里叶红外光谱仪,德国Bruker公司;7890B-7000B型GC-MS仪,安捷伦科技有限公司;FEI-APREOS型扫描电子显微镜(scanning electron microscope, SEM),美国赛默飞世尔科技有限公司。
1.2 实验方法
1.2.1 PSDF的提取
原料预处理:西梅洗净去核后打浆,平铺于托盘中,置于60 ℃电热鼓风干燥箱干燥,粉碎过筛即得到西梅粉,密封后置于4 ℃冷藏备用。
通过预实验得到最佳提取条件:取20 g西梅粉加入15倍体积蒸馏水溶解,在60 ℃、超声波功率360 W条件下超声波水浴1 h。调节pH值为5,加入西梅粉质量分数2.5%的复合酶[m(耐高温α-淀粉酶)∶m(糖化酶)=1∶3],60 ℃恒温水浴3.5 h除淀粉,煮沸灭酶10 min。调节pH值为6,加入西酶粉质量分数为0.8%的木瓜蛋白酶,55 ℃恒温水浴3 h除蛋白,再次煮沸灭酶10 min。将西梅酶解液5 000 r/min离心10 min,抽滤收集上清液。取上清液于旋蒸仪旋蒸至1/4体积后加入4倍体积分数为95%乙醇,4 ℃静置12 h后抽滤,收集絮状沉淀。真空冷冻干燥得到PSDF,命名为PSDF-Ⅰ。
1.2.2 PSDF的纯化
1.2.2.1 PSDF除蛋白
取一定量提取的PSDF溶于蒸馏水,加入1/4样品溶液体积的Sevag试剂[V(氯仿)∶V(正丁醇)=4∶1],振摇30 min,5 000 r/min离心10 min,除去下层Sevag溶液和中间变性蛋白质层,重复3次,真空冷冻干燥,待用。
1.2.2.2 离子交换柱层析
参考闫晓光[11]的方法,DEAE-52纤维素预处理后装柱(20 mm×300 mm),用去离子水平衡24 h。精确称取200 mg除蛋白后的PSDF-Ⅰ溶于5 mL蒸馏水中,将样品溶液上样至层析柱中,以蒸馏水、0.1、0.2、0.3、0.4、0.5 mol/L的NaCl溶液进行洗脱,流速为1 mL/min,使用自动部分收集器收集洗脱液,每管10 min,每个梯度浓度收集30管,共收集150管。将收集的洗脱液进行标记,采用苯酚-硫酸法在490 nm下检测洗脱液多糖含量并绘制洗脱曲线。3 500 Da透析袋透析48 h后合并各浓度洗脱液,真空冷冻干燥得到纯化PSDF命名为PSDF-Ⅱ。
1.2.3 基本成分的测定
灰分含量:参考GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》[12]的高温灼烧法测定。
水分含量:参考GB 5009.3—2016《食品安全国家标准 食品中水分的测定》[13]的直接干燥法测定。
脂肪含量:参考GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》[14]的索氏提取法测定。
蛋白质含量:参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》[15]的凯氏定氮法测定。
淀粉含量:参考GB 5009.9—2023《食品安全国家标准 食品中淀粉的测定》[16]的酸水解法测定。
1.2.4 单糖组成测定
参考陈飞等[17]的方法稍作修改,利用GC-MS进行分析。精确称取10 mg的PSDF样品于磨口试管中,加入5 mL 3 mol/L三氟乙酸溶液,密封后在110 ℃下反应6 h,水解后真空浓缩至干,加甲醇重复洗涤3~4次后真空浓缩至干,得到PSDF水解物。取PSDF水解液,加入3 mL吡啶于电热炉加热至80 ℃溶解,取出冷却至室温后分别与150 μL 0.5 mg/mL的肌醇溶液和N,O-双(三甲基硅烷基)三氟乙酰胺和三甲基氯硅烷(150 μL,体积比99∶1)混合,于80 ℃反应1 h,冷却,过0.4 μm滤膜后进行GC-MS测定。选用葡萄糖、果糖、阿拉伯糖、半乳糖、木糖、甘露糖6种标准品进行对照,混合单糖标品的衍生化、GC-MS测定同多糖中单糖的测定步骤。
色谱条件:HP-5毛细管色谱柱(30 m×0.25 mm×0.25 μm);色谱柱采用程序升温,起始温度140 ℃,保持5 min,以10 ℃/min升温至250 ℃,再以5 ℃升温至280 ℃保持5 min。进样量0.2 μL,进样口温度280 ℃,载气He流速1.2 mL/min,分流比20∶1,加热器280 ℃。
质谱条件:EI源,离子源温度230 ℃,接口温度250 ℃,电子能量65 eV,质量扫描30~550 amu,谱库:NIST。
1.2.5 SEM分析
将干燥后的PSDF固定在双面胶带上,喷金处理90 s取出,置于SEM中,使用SEM观察放大200、3 000、15 000×的PSDF表面结构。
1.2.6 紫外光谱扫描
取2 mg/mL的PSDF溶液于石英比色皿中,使用紫外可见分光光度计进行190~400 nm扫描,分析紫外可见吸收光谱。
1.2.7 红外光谱扫描
取2 mg真空冷冻干燥后的PSDF样品与200 mg干燥后的KBr混合,充分研磨均匀,使用压片机压成薄片。利用傅里叶变换红外光谱仪在4 000~400 cm-1波数范围内进行扫描。
1.2.8 抗氧化活性测定
1.2.8.1 DPPH自由基清除能力的测定
参考HUANG等[18]的方法稍作修改。取不同质量浓度(0.25~2 mg/mL)的PSDF样液于酶标板中,加入285 μL DPPH样液,在室温下避光反应30 min,使用酶标仪于517 nm处测定吸光度,以维生素C作为阳性对照,以蒸馏水为空白对照。DPPH自由基清除率的计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:A1,DPPH溶液和不同浓度PSDF样液或维生素C混合溶液的吸光度;A2,无水乙醇和不同浓度的PSDF样液或维生素C混合溶液的吸光度;A,DPPH溶液和蒸馏水混合溶液的吸光度。
1.2.8.2 ABTS阳离子自由基清除能力的测定
参考ZIYAD等[19]的方法,取15 μL不同质量浓度(0.25~2.0 mg/mL)的PSDF样液于酶标板中,加入285 μL ABTS样液,在室温下避光反应30 min,使用酶标仪于734 nm处测定吸光度。以维生素C作为阳性对照,以蒸馏水为空白对照。ABTS阳离子自由基清除率的计算如公式(2)所示:
ABTS阳离子自由基清除率![]()
(2)
式中:A3,ABTS溶液和不同浓度PSDF样液或维生素C混合溶液的吸光度;A4,无水乙醇和不同浓度的PSDF样液或维生素C混合溶液的吸光度;A0,ABTS溶液和蒸馏水混合溶液的吸光度。
1.2.8.3 超氧阴离子自由基(·O2-)清除能力的测定
取1.8 mL 0.05 mol/L的Tris-HCl缓冲液于试管中,加入0.2 mL不同质量浓度(0.5~2.0 mg/mL)的PSDF溶液,然后再加入2 mL 2.5 mmol/L焦性没食子酸溶液,振荡均匀后,将其置于室温环境中反应5 min,试验结束后加入0.5 mL浓盐酸,以5 000 r/min离心20 min,使用酶标仪于320 nm处测定溶液的吸光值,用维生素C作对照组。·O2-清除的计算如公式(3)所示:
·O2-清除率![]()
(3)
式中:A5,空白吸光值;A6,添加PSDF的吸光值。
1.2.9 理化性质研究
1.2.9.1 持油力测定
参考AKMEEMANA等[20]的方法稍作修改,准确称取0.50 g PSDF样品,加花生油5 g后振荡均匀,在37 ℃水浴搅拌30 min。以4 000 r/min,离心15 min后弃去上层花生油,对固体部分进行称量,PSDF持油力的计算如公式(4)所示:
持油力![]()
(4)
式中:m0,PSDF样品干重,g;m1,结合油后PSDF的质量,g。
1.2.9.2 持水力测定
准确称量0.5 g PSDF样品,加水10 mL后振荡均匀,在37 ℃水浴中搅拌30 min,以4 000 r/min,离心15 min后,弃去上层液体,对固体部分进行称量,PSDF持水力的计算如公式(5)所示:
持水力![]()
(5)
式中:m0,PSDF样品干重,g;m2,持水后PSDF的湿重,g。
1.2.9.3 膨胀力测定
准确称量1.00 g PSDF样品,放置于50 mL量筒中,加入纯净水30 mL,充分混合后,记录初始刻度。在4 ℃下放置24 h,记录PSDF吸水体积膨胀后对应的刻度。PSDF膨胀力的计算如公式(6)所示:
膨胀力![]()
(6)
式中:m0,PSDF的干重,g;V1,PSDF吸水膨胀后体系所对应的刻度,mL;V0,体系的初始刻度,mL。
1.2.9.4 胆固醇吸附能力测定
取新鲜鸡蛋去蛋黄,加入9倍质量的蒸馏水并搅拌均匀。取PSDF各1.0 g与25 mL蛋黄乳液混合,分别调节至pH值为2和pH值为7,在37 ℃下振荡2 h。将混合物以5 000 r/min离心20 min,取上清液,用邻苯二甲醛法测定胆固醇含量。胆固醇吸附能力的计算如公式(7)所示:
胆固醇吸附量![]()
(7)
式中:m0,PSDF质量,g;m4,吸附前蛋黄中胆固醇含量,mg;m3,上清液中胆固醇含量,mg。
1.2.9.5 葡萄糖吸附能力测定
0.5 g的PSDF与50 mL质量浓度为100 μg/mL的葡萄糖溶液混匀,37 ℃下振荡6 h,5 000 r/min 离心20 min,吸取上清液,采用苯酚-硫酸法测定葡萄糖含量。葡萄糖吸附能力的计算如公式(8)所示:
葡萄糖吸附量![]()
(8)
式中:m0,PSDF质量,g;ρ1,吸附葡萄糖质量浓度,μg/mL;ρ2,吸附上清液中葡萄糖质量浓度,μg/mL;V,吸附液体积,mL。
2 结果与分析
2.1 膳食纤维的洗脱曲线
如图1所示,PSDF-Ⅰ经柱层析后得到4个单一组分,且洗脱曲线无明显拖尾和多峰出现,表明纯化组分无明显杂质,纯化效果较好。其中,以蒸馏水洗脱液得到的组分为中性多糖,以NaCl溶液洗脱得到的组分为酸性多糖,分别占总多糖比为33.61%和58.48%。随着洗脱液离子强度的增加,各组分得率呈下降趋势,可能是因为多糖分子质量随洗脱液浓度升高而减小,PSDF中小分子多糖含量少,导致高浓度洗脱液中洗脱组分得率下降[21]。收集蒸馏水、0.1、0.2、0.3 mol/L NaCl洗脱组分,透析处理后合并洗脱液进行浓缩处理,浓缩液真空冷冻24 h,得到纯化组分PSDF-Ⅱ。
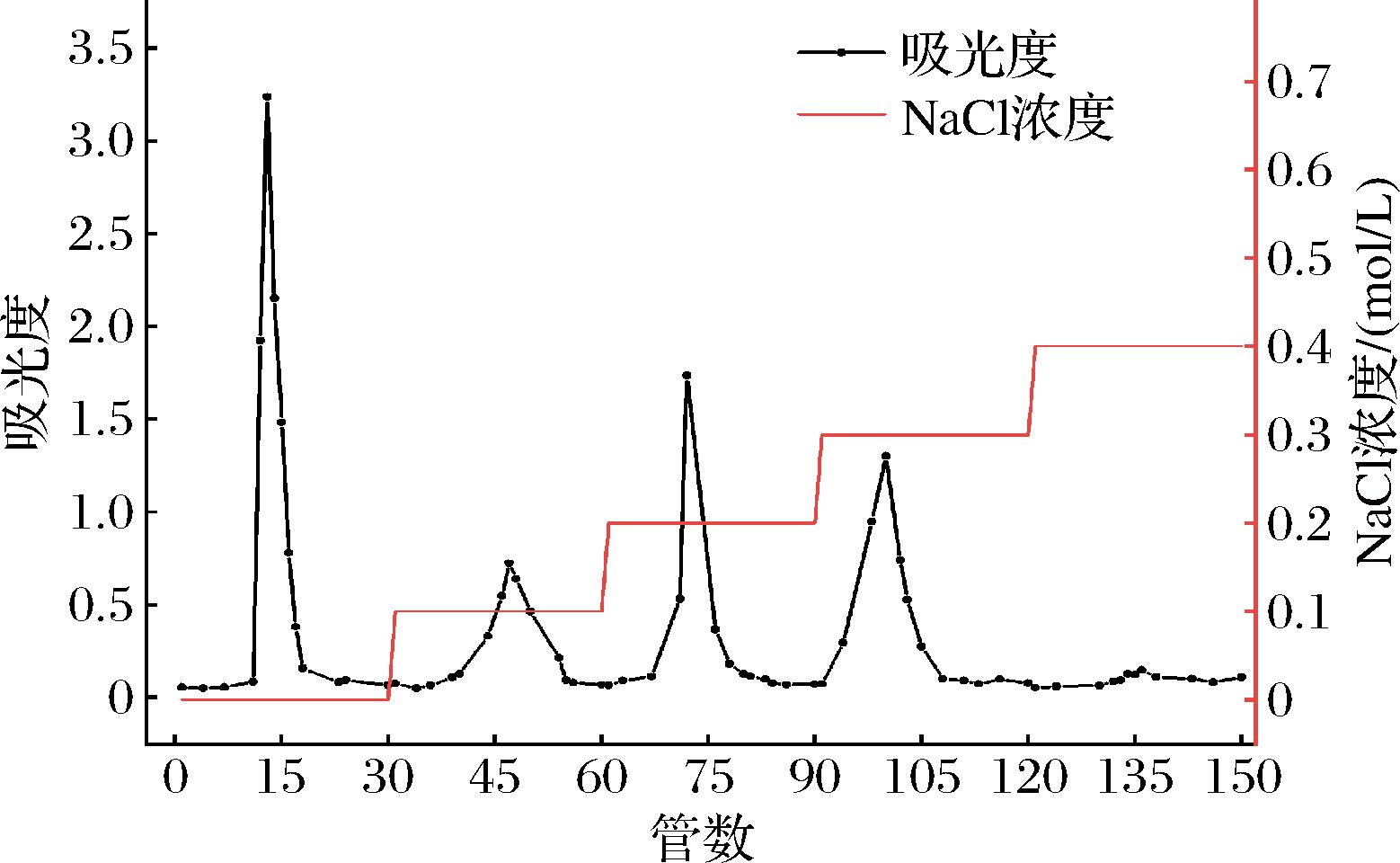
图1 DEAE-52层析柱洗脱曲线
Fig.1 DEAE-52 column elution curve
2.2 组成成分分析
由表1纯化处理前后的PSDF基本成分可知,PSDF不含脂肪,这与张红[2]对新疆西梅营养成分测定的结果一致。相较于PSDF-Ⅰ,PSDF-Ⅱ纯度提高15.62%,达93.16%,且差异显著(P<0.05)。纯化前后PSDF的水分含量无明显区别(P>0.05),蛋白质、淀粉、灰分含量经过纯化处理后显著降低(P<0.05),这与其分离纯化可溶性膳食纤维的原理有关,DEAE-52纤维素通过电荷差异将不同带电荷膳食纤维与杂质进行分离[10],从而得到较高纯度的可溶性膳食纤维。综上所述,说明PSDF达到了较好的纯化效果,可用于后续结构组成和理化特性研究。
表1 PSDF纯化前后组成成分 单位:%
Table 1 Composition of PSDF before and after purification

成分水分蛋白质脂肪淀粉灰分膳食纤维PSDF-Ⅰ5.33±0.11a6.76±0.19a—0.81±0.06a8.71±0.21a77.54±0.52bPSDF-Ⅱ4.84±0.26a0.23±0.13b—0.09±0.05b1.23±0.15b93.16±0.44a
注:同列不同字母表示差异性显著(P<0.05)(下同),“—”表示未检测到。
2.3 单糖组成分析
各单糖标准品和多糖经过水解、衍生后进行GC-MS分析,得到混合标准品和样品的总离子流图。通过各峰的保留时间,对照NIST分析确定图2混合单糖标准品,从左到右依次为:阿拉伯糖、木糖、果糖、甘露糖、葡萄糖和半乳糖。PSDF-Ⅱ的单糖衍生产物GC-MS分析结果如图3所示,与标准单糖衍生产物的GC-MS标准糖谱(图2)及NIST分析对比,可以判断各色谱峰对应的单糖物质,结果如表2所示。综上可知,PSDF-Ⅱ是由葡萄糖、果糖、甘露糖和阿拉伯糖组成的杂多糖。
表2 PSDF-Ⅱ单糖成分出峰时间
Table 2 Peak-time of PSDF-Ⅱ monosaccharide components

保留时间/min单糖种类峰面积/%相对比例10.468阿拉伯糖24.373.4216.876果糖6.25117.484甘露糖18.632.8718.26葡萄糖50.758.71
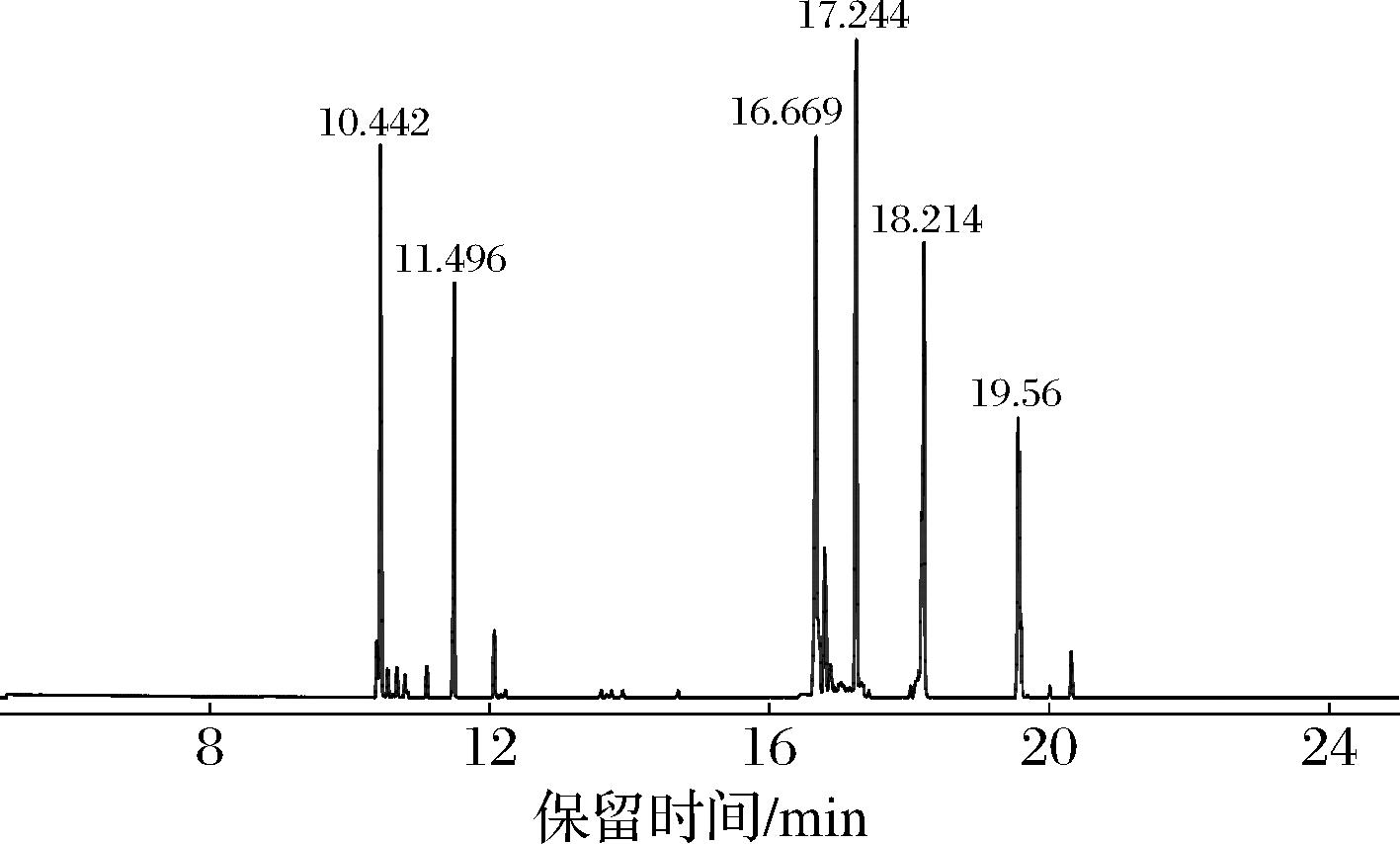
图2 混合标准单糖硅烷化衍生物GC-MS总离子谱
Fig.2 Total ion spectra of mixed standard monosaccharide silanized derivatives by GC-MS
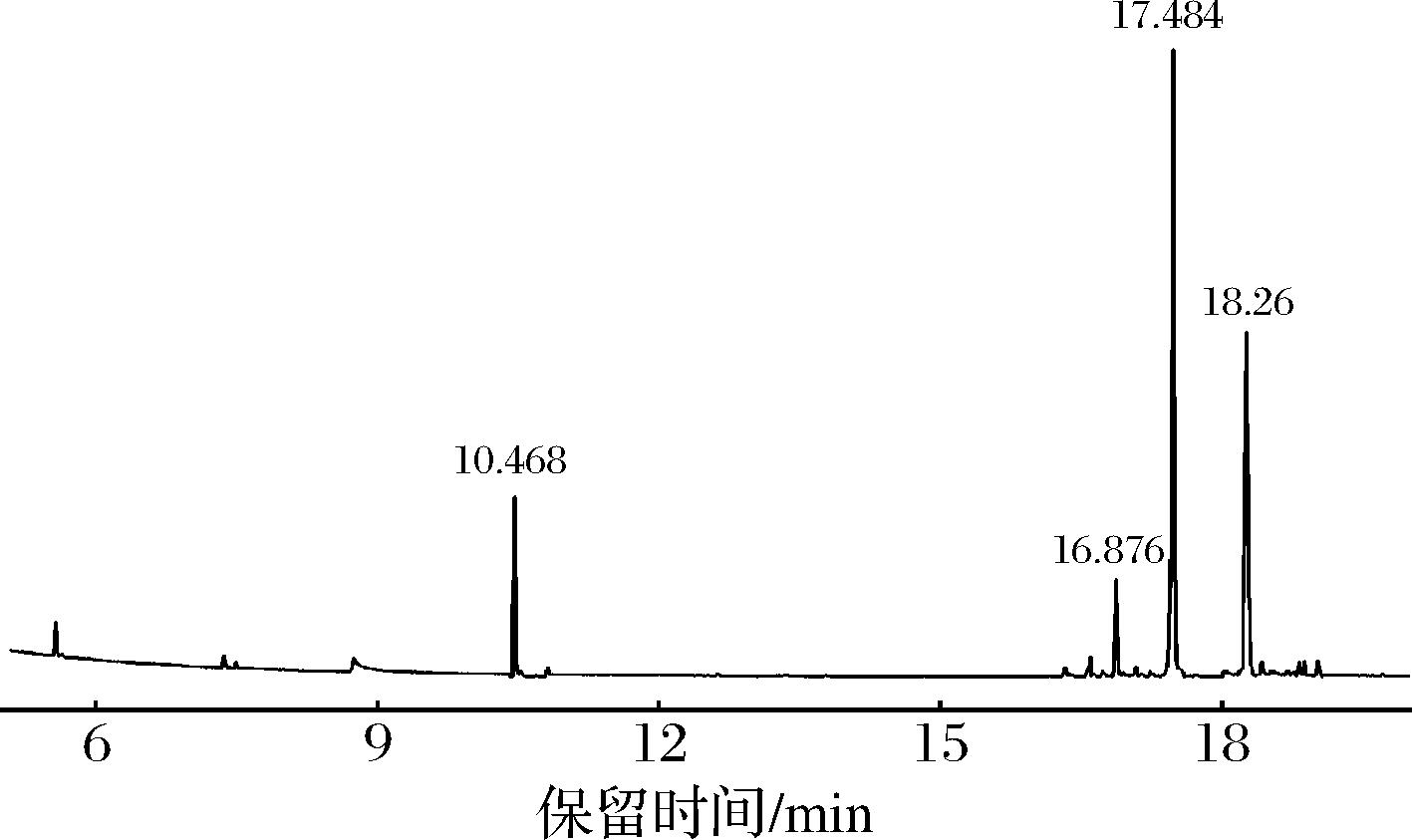
图3 PSDF-Ⅱ各组分总离子
Fig.3 Total ion of purified Prune PSDF-Ⅱ components
2.4 SEM分析
如图4所示,2种PSDF表观结构完全不同,200×时,PSDF-Ⅰ较PSDF-Ⅱ颗粒更大,3 000×和15 000×时,PSDF-Ⅰ表面结构相对光滑平坦,较为光滑致密,表面呈片状伴有沟壑和层状结构;纯化后的PSDF表面为蜂巢型的多孔网状结构,空间结构较为均匀。由于蜂巢小孔的增加,使得纯化PSDF表面积更大,造就了良好的亲水性[22],因此相比粗提PSDF具有更好的持水力和持油力。

a1-PSDF-Ⅰ 200×;a2-PSDF-Ⅰ 3 000×;a3-PSDF-Ⅰ 15 000×;b1-PSDF-Ⅱ 200×;b2-PSDF-Ⅱ 3 000×;b3-PSDF-Ⅱ 15 000×
图4 纯化前后PSDF扫描电镜图
Fig.4 PSDF scanning electron microscopy before and after purification
2.5 紫外光谱分析
如图5所示,PSDF-Ⅰ和PSDF-Ⅱ溶液在260 nm处未出现紫外吸收峰,说明2种PSDF中均不含核酸,PSDF-Ⅰ在280 nm处出现紫外吸收峰,PSDF-Ⅱ则无明显特征峰,说明PSDF-Ⅰ中含有少量蛋白质,PSDF-Ⅱ则不含蛋白质,这与成分表中结果一致。
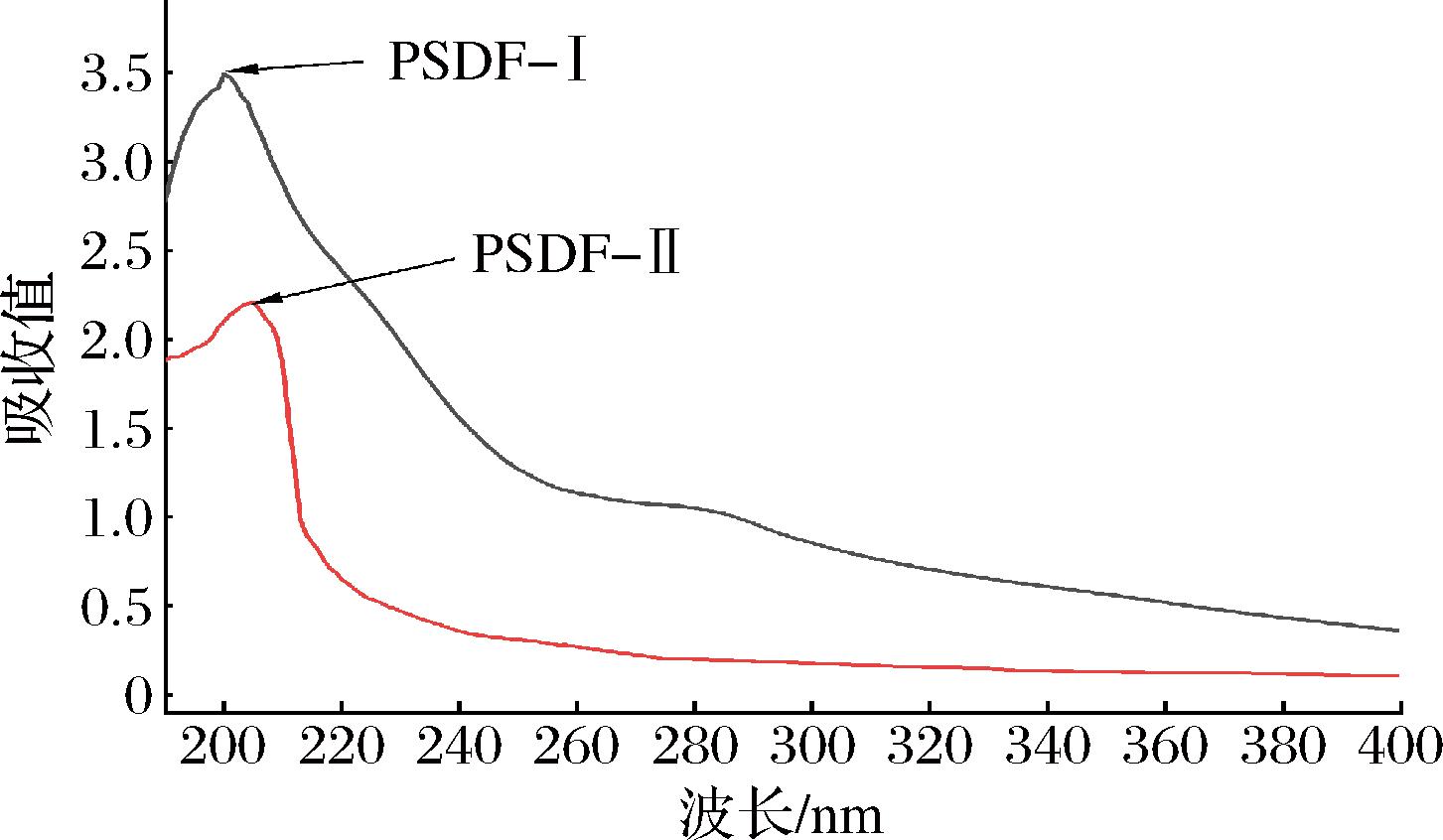
图5 纯化前后PSDF紫外吸收光谱
Fig.5 Ultraviolet absorption spectra of PSDF before and after purification
2.6 红外光谱分析
红外光谱图显示,2种PSDF均具有多糖的特征吸收峰。由图6可知,PSDF-Ⅰ和PSDF-Ⅱ主要区别为纯化前后峰的吸收强度不同,两者仍然在峰形和位置上保持高度一致。其中,3 400 cm-1有一个强宽吸收峰为纤维素和半纤维素中的O—H伸缩振动产生的,主要来源于甘露糖、木糖和阿拉伯糖等,此处PSDF-Ⅱ的峰强度明显强于PSDF-Ⅰ,说明PSDF-Ⅱ较PSDF-Ⅰ含更多缔合状态的氢键[23];在2 930 cm-1处附近吸收峰为糖类甲基和亚甲基C—H伸缩振动吸收峰,1 420 cm-1处有一个吸收峰为C—H弯曲震动吸收峰,可能为—CH2—;1 625 cm-1处附近的吸收峰是羰基中C![]() O的伸缩振动峰,表明存在多糖糖醛酸;1 240 cm-1处附近的吸收峰由吡喃环伸缩振动产生[24];1 000 cm-1处附近较强的吸收峰为糖环中醚键伸缩振动的特征峰;840 cm-1处附近处的尖峰是糖中α-型糖苷键的伸缩振动吸收峰[25],对比吸收强度发现PSDF-Ⅰ中糖苷键数量高于PSDF-Ⅱ,表明纯化过程中膳食纤维结构中的糖苷键被破坏较少;780 cm-1处附近的吸收峰也再次证实了含吡喃糖结构;620 cm-1处附近为C—H平面外弯曲伸缩振动吸收峰。因此,PSDF均是含有α-糖苷键且具有吡喃环的多糖。
O的伸缩振动峰,表明存在多糖糖醛酸;1 240 cm-1处附近的吸收峰由吡喃环伸缩振动产生[24];1 000 cm-1处附近较强的吸收峰为糖环中醚键伸缩振动的特征峰;840 cm-1处附近处的尖峰是糖中α-型糖苷键的伸缩振动吸收峰[25],对比吸收强度发现PSDF-Ⅰ中糖苷键数量高于PSDF-Ⅱ,表明纯化过程中膳食纤维结构中的糖苷键被破坏较少;780 cm-1处附近的吸收峰也再次证实了含吡喃糖结构;620 cm-1处附近为C—H平面外弯曲伸缩振动吸收峰。因此,PSDF均是含有α-糖苷键且具有吡喃环的多糖。
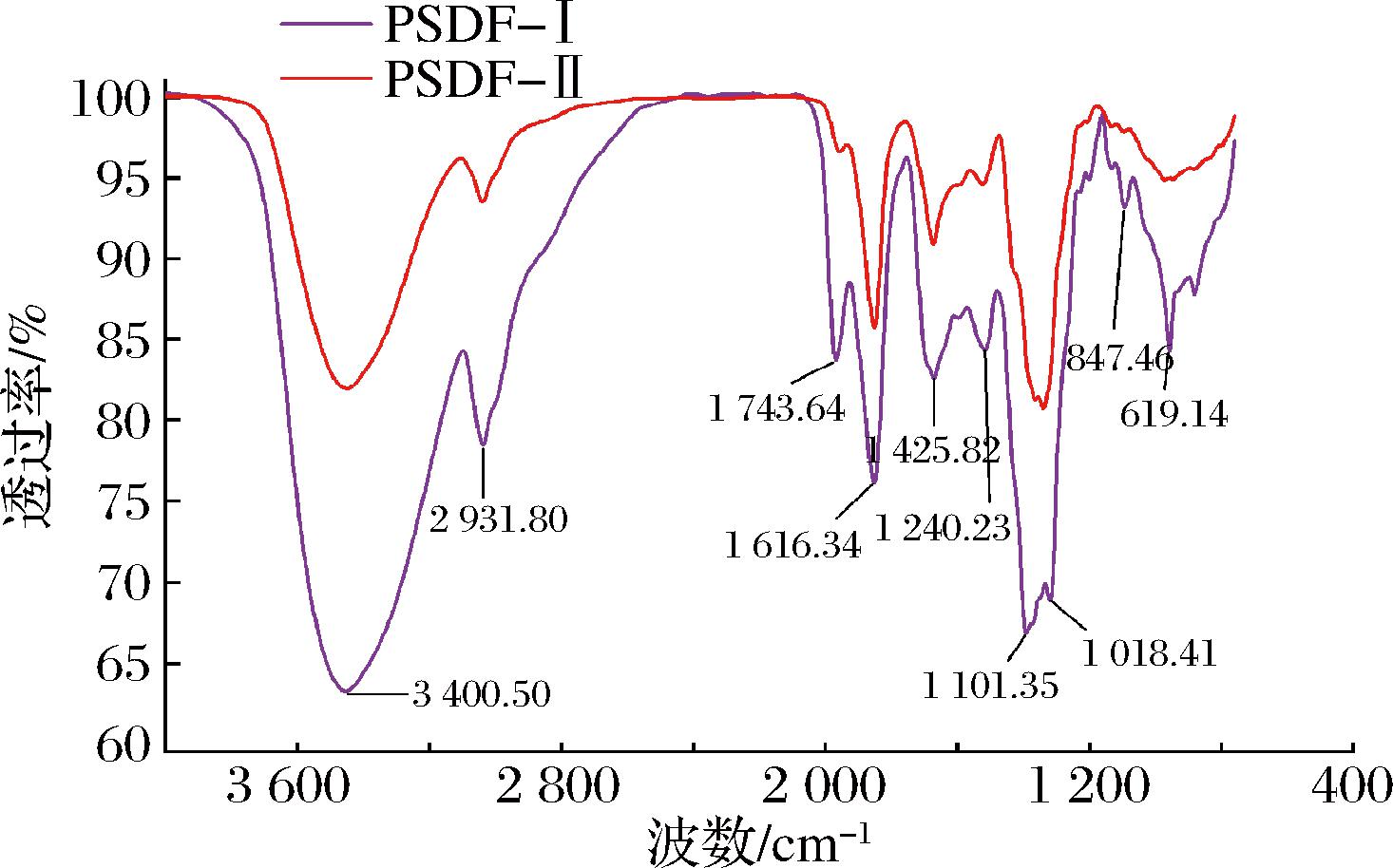
图6 纯化前后PSDF红外光谱
Fig.6 PSDF infrared spectra before and after purification
2.7 抗氧化活性分析
机体在代谢过程中产生多种自由基,通过氧化作用使大分子物质发生过氧化变性、断裂和交联,导致细胞结构与功能的破环,影响机体健康[26]。研究表明[27],自由基与动脉粥样硬化、衰老、阿尔茨海默病等疾病密切相关,而膳食纤维中的多酚、多糖类物质具有清除·O2-和羟自由基(·OH)的能力被证实,在治疗心血管病和老年性痴呆症方面独具疗效。图7反映了0~2.0 mg/mL质量浓度的PSDF分别对DPPH自由基、ABTS阳离子自由基和·O2-清除率的影响,以抗氧化剂维生素C为阳性对照。由图7-a可知,PSDF-Ⅰ及PSDF-Ⅱ均具有清除ABTS阳离子自由基的作用,且均存在剂量依赖效果,在0~2.0 mg/mL范围内,PSDF-Ⅰ、PSDF-Ⅱ对ABTS阳离子自由基清除率随着其质量浓度的增加呈不断升高趋势,当质量浓度达到1.5 mg/mL后,对ABTS阳离子自由基的清除能力增加较缓慢,当质量浓度为2.0 mg/mL时,对ABTS阳离子自由基清除率达到最高,分别为78.43%、63.54%,其IC50值分别为0.933、1.278 mg/mL。
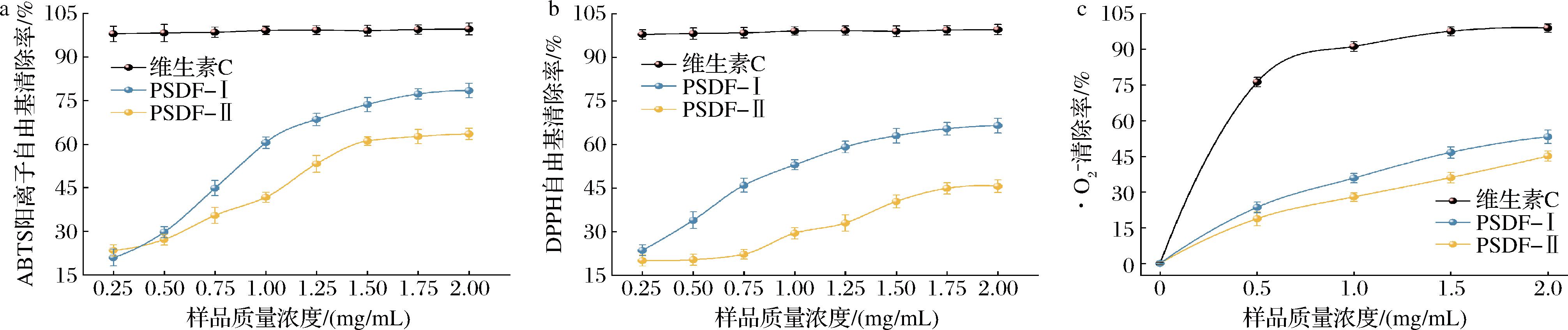
a-ABTS阳离子自由基清除率;b-DPPH自由基清除率;c-·O2-清除率
图7 PSDF-Ⅰ、PSDF-Ⅱ和维生素C对各种自由基清除率
Fig.7 Scavenging rate of PSDF-Ⅰ, PSDF-Ⅱ and Vc on various free radicals
DPPH是反应样品抗氧化强弱的重要指标之一,PSDF-Ⅰ、PSDF-Ⅱ对DPPH自由基清除率如图7-b所示,在0~2.0 mg/mL质量浓度范围内,随着样品浓度的增加,PSDF-Ⅰ对DPPH自由基的清除率平稳升高,PSDF-Ⅱ则在样品质量浓度0~0.75 mg/mL范围内较平缓,在0.75 mg/mL后呈上升趋势,较PSDF-Ⅰ自由基清除效果较差,且在样品质量浓度为2.0 mg/mL时,PSDF-Ⅰ和PSDF-Ⅱ自由基清除率最高,分别达66.524%、45.58%,IC50值分别为1.071、2.178 mg/mL。
由图7-c可知,相对于维生素C对·O2-清除率,PSDF-Ⅰ、PSDF-Ⅱ自由基清除率较低,且PSDF-Ⅰ和PSDF-Ⅱ自由基清除效果一致。在0~2.0 mg/mL质量浓度范围内,PSDF-Ⅰ、PSDF-Ⅱ对·O2-的清除率随着样品质量浓度的增加呈平稳上升趋势,并于2.0 mg/mL时具有最佳自由基清除率,其·O2-清除率分别为53.25%、45.114%,IC50值分别为1.826、2.243 mg/mL。结合图7-a~图7-c可知,3种样品对各自由基清除率由高到低依次均为:维生素C、PSDF-Ⅰ、PSDF-Ⅱ,表明纯化处理后PSDF对自由基清除率降低,这一结果与陈盈盈等[28]对刺糖多糖脱蛋白脱色处理前后多糖抗氧化结果相反,但与张俊生等[29]对节节草多糖纯化前后体外抗氧化试验得出的结论一致。分析原因可能是纯化处理方法不同所导致,PSDF抗氧化能力与纯度、结构和其单糖组成均有关,本研究采用的纯化方法相较于脱蛋白-脱色处理得到的PSDF纯化更为彻底,但纯化处理后的PSDF在去除杂质的同时还去除了PSDF上的结合酚,导致PSDF-Ⅱ抗氧化活性降低[30]。
2.8 理化特性结果分析
由图8可知,纯化处理前后的PSDF在pH值7.0的环境下对胆固醇的吸附能力强于pH值2.0,这与王司琪等[31]在对木耳膳食纤维结构特征和功能特性的研究结果一致。分析原因是酸性环境中,体系中存在较多的H+,导致膳食纤维和胆固醇均带部分正电荷并产生排斥力,从而削弱了胆固醇与PSDF直接的结合,导致吸附作用降低[32]。在pH值2.0环境下,PSDF-Ⅱ对胆固醇的吸附能力较PSDF-Ⅰ从3.28 mg/g提升至4.04 mg/g,提高23.17%;在pH值7.0环境下,PSDF-Ⅱ对胆固醇的吸附能力较PSDF-Ⅰ从10.25 mg/g提升至13.41 mg/g,提高30.83%。表明纯化处理提高了PSDF的胆固醇吸附能力,这可能与膳食纤维的结构有关,纤维的孔密度和比表面积的大小,对吸附效果影响较大,比表面积越大,空间障碍越小,吸附胆固醇的效果越好。
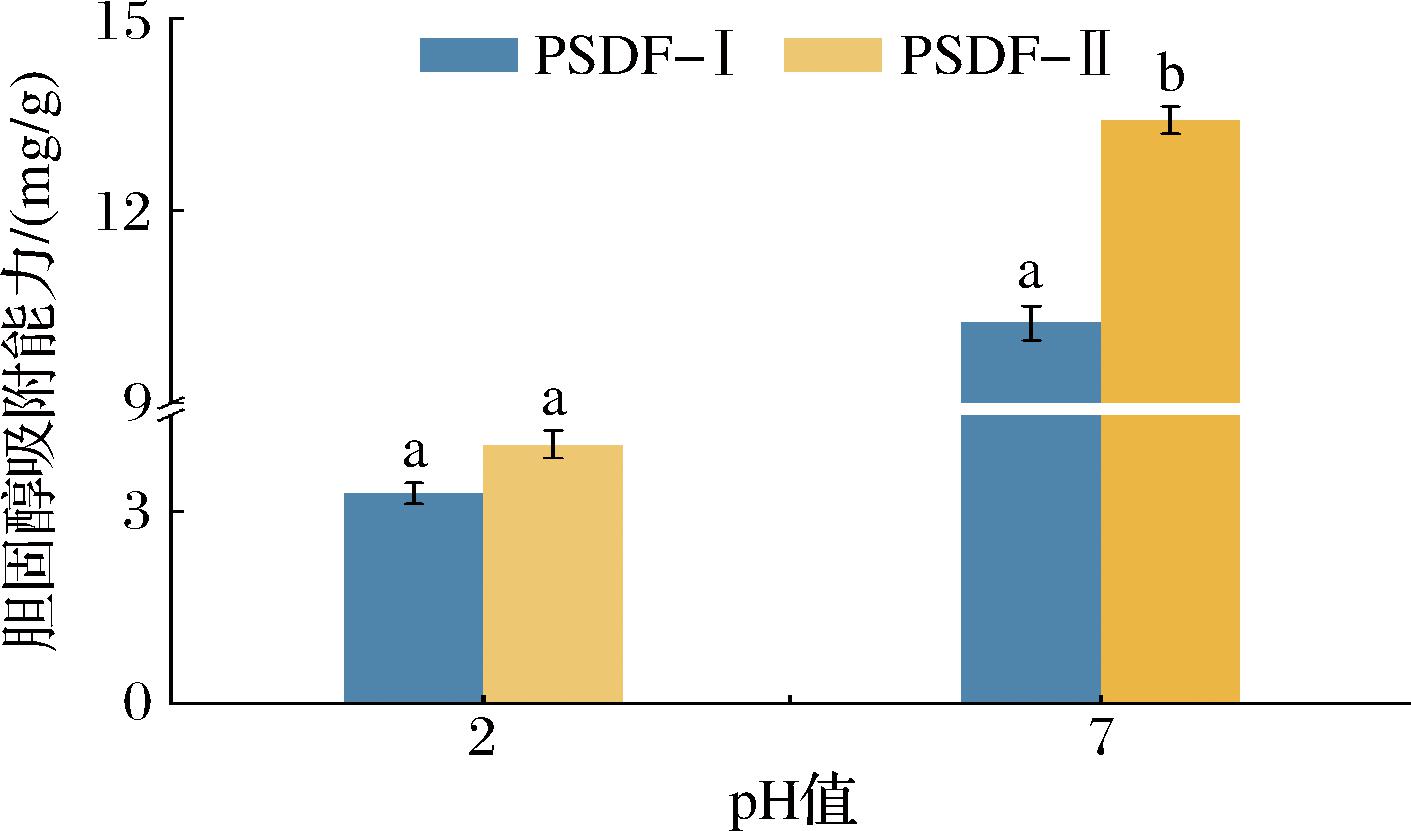
图8 PSDF-Ⅰ、PSDF-Ⅱ胆固醇吸附能力
Fig.8 Cholesterol adsorption capacity of PSDF-Ⅰ and PSDF-Ⅱ
注:同列不同字母表示差异性显著(P<0.05)。
膳食纤维持水力、持油力和膨胀力的大小与其粒径、孔隙率、比表面积和空间结构等密切相关。由表3可知,纯化处理后,PSDF的持水力、持油力、膨胀力显著增加(P<0.05),分别提高了48.52%、43.22%、51.85%,葡萄糖吸附力降低了27.30%。本研究纯化处理后的PSDF的理化性质与张智等[33]酶法提取得到的膳食纤维相比,品质有较大的提高,表现出良好的理化性质。结合图5可知,由于纯化后的PSDF颗粒度减小,结构疏松多孔增大了比表面积,导致更多的内部亲水基团和亲脂基团暴露,促进了其与水相和油相更好地结合[34]。王司琪等[31]研究表明,SDF的黏度越高,葡萄糖吸附能力越强。因此,纯化后PSDF葡萄糖吸附率的下降可能与其黏度降低有关。
表3 PSDF-Ⅰ、PSDF-Ⅱ理化特性
Table 3 Physicochemical properties of PSDF-Ⅰ and PSDF-Ⅱ

成分持水力/(g/g)持油力/(g/g)膨胀力/(mL/g)葡萄糖吸附能力/(mg/g)PSDF-Ⅰ5.73±0.18a3.54±0.03a9.18±0.26a6.63±0.12aPSDF-Ⅱ8.51±0.06b5.07±0.10b13.94±0.14b4.82±0.08b
3 结论
本试验研究了纯化处理对PSDF的结构、理化特性(持油力、持水力、膨胀力、胆固醇吸附能力及葡萄糖吸附能力)和抗氧化活性的影响。结果表明,纯化处理可显著提高PSDF纯度(93.16%)。初步表征纯化前后PSDF结构特征,GC-MS测定显示PSDF-Ⅱ是由葡萄糖、果糖、甘露糖及阿拉伯糖组成的杂多糖,紫外、红外光谱显示纯化处理可去除PSDF中蛋白质等杂质,并且对PSDF糖苷键破坏较小,2种PSDF均是含有α-糖苷键且具有吡喃环的多糖,SEM结果显示,纯化处理后PSDF表面结构由光滑平坦变为为蜂巢型的多孔网状结构,比表面积大幅度增大,有助于理化性质的提高。抗氧化活性结果表明,2种PSDF均对ABTS阳离子、DPPH、·O2-自由基具有较好的清除能力,且纯化PSDF抗氧化效果低于粗提PSDF,这是由于纯化处理去除了PSDF-Ⅰ上的结合酚,导致抗氧化活性降低。理化测定结果表明,纯化后PSDF持水力、持油力、膨胀力和胆固醇吸附力均有显著提高,这与PSDF比表面积增大有关,葡萄糖吸附能力出现下降,可能是由于纯化处理降低了PSDF的黏度。由上述结论可知,本研究采用的纯化方法可改善PSDF的结构、抗氧化活性和理化特性,对了解西梅膳食纤维结构和功能性食品加工提供了理论依据,且对提高西梅资源利用率和产品附加值具有重要意义。
[1] 王艺菡, 王永刚, 王剑瑞, 等.欧洲李(西梅)的原产地与保护利用[J].新疆林业, 2021(4):29-31.WANG Y H, WANG Y G, WANG J R, et al.Origin, protection and utilization of European plum (Prunus mume)[J].Forestry of Xinjiang, 2021(4):29-31.
[2] 张红. 新疆西梅营养成分分析及贮藏加工技术研究[D]. 乌鲁木齐:新疆农业大学, 2015.ZHANG H. Study on nutrient composition analysis and storage and processing technology of Xinjiang Prune[D]. Urumqi:Xinjiang Agricultural University, 2015.
[3] TOMI J,
J,  TAMPAR F, GLI
TAMPAR F, GLI I
I I, et al.Phytochemical assessment of plum (Prunus domestica L.) cultivars selected in Serbia[J].Food Chemistry, 2019, 299:125113.
I, et al.Phytochemical assessment of plum (Prunus domestica L.) cultivars selected in Serbia[J].Food Chemistry, 2019, 299:125113.
[4] LUO X L, WANG Q, ZHENG B D, et al.Hydration properties and binding capacities of dietary fibers from bamboo shoot shell and its hypolipidemic effects in mice[J].Food and Chemical Toxicology:an International Journal Published for the British Industrial Biological Research Association, 2017, 109(Pt 2):1003-1009.
[5] ZHENG H, SUN Y, ZENG Y Q, et al.Effects of four extraction methods on structure and in vitro fermentation characteristics of soluble dietary fiber from rape bee pollen[J].Molecules, 2023, 28(12):4800.
[6] 何海, 赵沙沙, 张小荣, 等.大孔吸附树脂法富集纯化黄芪多糖的工艺优化及评价研究[J].中兽医医药杂志, 2022, 41(5):1-6.HE H, ZHAO S S, ZHANG X R, et al.Process optimization and evaluation of enrichment and purification of Astragalus polysaccharides by macroporous adsorption resin[J].Journal of Traditional Chinese Veterinary Medicine, 2022, 41(5):1-6.
[7] 杨莉, 陈文宁, 郑娟霞, 等.海藻多糖的提取、分离纯化及其在食品工业的应用[J].食品工业科技, 2021, 42(9):365-372.YANG L, CHEN W N, ZHENG J X, et al.Extraction, isolation and purification of seaweed polysaccharide and its application in food industry[J].Science and Technology of Food Industry, 2021, 42(9):365-372.
[8] XING S P, ZHANG X F, KE H N, et al.Physicochemical properties of polysaccharides from Dendrobium officinale by fractional precipitation and their preliminary antioxidant and anti-HepG2 cells activities in vitro[J].Chemistry Central Journal, 2018, 12(1):100.
[9] 高琦, 刘睿, 于弘弢, 等.花生壳膳食纤维制备及改性研究进展[J].中国粮油学报, 2022, 37(3):195-202.GAO Q, LIU R, YU H T, et al.Progress in preparation and modification of dietary fibers from peanut shell[J].Journal of the Chinese Cereals and Oils Association, 2022, 37(3):195-202.
[10] 何曙光. 以菊糖为碳源发酵解淀粉芽孢杆菌产生多糖的研究[D].芜湖:皖南医学院, 2021.HE S G.Study on production of new polysaccharide by Bacillus amyloliquefaciens with inulin as carbon source[D].Wuhu:Wannan Medical College, 2021.
[11] 闫晓光. 挤压处理麦麸提取膳食纤维的工艺及性质研究[D].天津:天津科技大学, 2016.YAN X G.Studies on extraction processing and properties of dietary fiber from wheat bran by extrusion[D].Tianjin:Tianjin University of Science &Technology, 2016.
[12] 中华人民共和国国家卫生和计划生育委员会. GB 5009.4—2016食品安全国家标准 食品中灰分的测定[S].北京:中国标准出版社, 2017.
[13] 中华人民共和国国家卫生和计划生育委员会. GB 5009.3—2016食品安全国家标准 食品中水分的测定[S].北京:中国标准出版社, 2017.
[14] 国家卫生和计划生育委员会, 国家食品药品监督管理总局.GB 5009.6—2016食品安全国家标准 食品中脂肪的测定[S].北京:中国标准出版社, 2017.
[15] 国家卫生和计划生育委员会, 国家食品药品监督管理总局.GB 5009.5—2016食品安全国家标准 食品中蛋白质的测定[S].北京:中国标准出版社, 2017.
[16] 国家卫生和计划生育委员会, 国家食品药品监督管理总局.GB 5009.9—2023食品安全国家标准 食品中淀粉的测定[S].北京:中国标准出版社, 2023.
[17] 陈飞, 陈宇昱, 何双, 等.3种常用剁椒加工品种的质构品质及果胶特性[J].中国食品学报, 2022, 22(11):103-113.CHEN F, CHEN Y Y, HE S, et al.Texture qualities and pectin characteristics of three pepper varieties for fermentation minced pepper processing[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(11):103-113.
[18] HUANG C Q, TANG X Y, LIU Z Y, et al.Enzymes-dependent antioxidant activity of sweet apricot kernel protein hydrolysates[J].LWT, 2022, 154:112825.
[19] ZIYAD B A, FATIHA H, MOHAMED Y, et al.Study of the antioxidant activity of Pistacia atlantica Desf.Gall extracts and evaluation of the responsible compounds[J].Biochemical Systematics and Ecology, 2022, 100:104358.
[20] AKMEEMANA C, WICKRAMASINGHE I, WANNIARACHCHI P C, et al.Effect of drying and frying pre-treatments on nutrient profile, antioxidant capacity, cooking time, and sensory acceptability of easy to cook jackfruit seeds[J].Applied Food Research, 2022, 2(2):100234.
[21] 梁杉, 王琨, 刘佩瑶, 等.山药多糖结构、生物活性及其机制研究进展[J].食品科学, 2022, 43(23):296-304.LIANG S, WANG K, LIU P Y, et al.Progress in understanding the structure, biological activity and mechanism of yam polysaccharides[J].Food Science, 2022, 43(23):296-304.
[22] GENG N N, SONG J F, ZHANG K Y, et al.Effect of dynamic high-pressure microfluidization on the physicochemical and structural properties of insoluble dietary fiber from fresh corn bract[J].Journal of Food Processing and Preservation, 2021, 45(9):e15710.
[23] 杜晓静, 白新鹏, 姜泽放, 等.脱脂椰蓉可溶性膳食纤维制备工艺及单糖组成和理化特性分析[J].食品科学, 2019, 40(2):245-251.DU X J, BAI X P, JIANG Z F, et al.Preparation, monosaccharide composition and physicochemical properties of soluble dietary fiber from defatted coconut meal[J].Food Science, 2019, 40(2):245-251.
[24] NAFIYA Q, AHMED W I.Physicochemical and functional characterization of dietary fibres from four Indian temperate rice cultivars[J].Bioactive Carbohydrates and Dietary Fibre, 2022, 28:100336.
[25] 宋新玲. 秀珍菇菌丝体多糖结构解析及其改善小鼠酒精性肝损伤的机制研究[D].泰安:山东农业大学, 2022.SONG X L.Characterizations of mycelium polysaccharides from pleurotus geesteranus and the mechanisms on improving the alcoholic liver disease in mice[D].Tai’an:Shandong Agricultural University, 2022.
[26] WANG C B, DING L, ZHAO J M, et al.Effect of composite nanoparticle CeO2 on myocardial ischemic re-infusion of cardio myocyte apoptosis in mouse[J].Journal of Nanoscience and Nanotechnology, 2021, 21(2):1397-1402.
[27] 才真, 王春革.天然药物抗氧化、抗衰老的研究进展[J].医学综述, 2014, 20(16):2994-2995.CAI Z, WANG C G.Reaserch progress in natural drug’s properties of anti-oxidation and anti-aging[J].Medical Recapitulate, 2014, 20(16):2994-2995.
[28] 陈盈盈, 李杰, 宋建忠, 等.刺糖多糖脱色脱蛋白工艺及抗氧化活性研究[J].化学试剂, 2023, 45(1):46-53.CHEN Y Y, LI J, SONG J Z, et al.Study on decolorization and deproteinization process and antioxidant activity of Alhagi-honey polysaccharide[J].Chemical Reagents, 2023, 45(1):46-53.
[29] 张俊生, 陈莉华, 朱士龙, 等.节节草多糖的体外抗氧化活性[J].食品科学, 2013, 34(5):86-89.ZHANG J S, CHEN L H, ZHU S L, et al.In vitro antioxidant activity of polysaccharides from Equisetum ramosissimum Desf[J].Food Science, 2013, 34(5):86-89.
[30] 许涵婷, 唐语谦, 胡腾根, 等.荔枝果渣可溶性膳食纤维去结合酚前后结构和功能性质的比较[J].现代食品科技, 2023, 39(8):206-212.XU H T, TANG Y Q, HU T G, et al.Comparison of the structure and functional properties of soluble dietary fiber from lychee pomace before and after the removal of bound phenolics[J].Modern Food Science and Technology, 2023, 39(8):206-212.
[31] 王司琪, 王佳佳, 李泊铮, 等.提取方法对玉木耳膳食纤维结构特征和功能特性的影响[J].食品科学, 2022, 43(24):93-101.WANG S Q, WANG J J, LI B Z, et al.Effects of extraction methods on the structural and functional characteristics of dietary fiber from Auricularia cornea var.Li[J].Food Science, 2022, 43(24):93-101.
[32] 郭杰. 耳突麒麟菜不溶性膳食纤维的理化和功能特性[D].无锡:江南大学, 2022.GUO J.Physicochemical and functional properties of Eucheuma cottonii insoluble dietary fiber[D].Wuxi:Jiangnan University, 2022.
[33] 张智, 宋伟, 闫建英, 等.油茶粕膳食纤维的超声辅助酶法提取工艺优化及理化性质分析[J].食品工业科技, 2022, 43(18):162-169.ZHANG Z, SONG W, YAN J Y, et al.Optimization of ultrasonic assisted enzymatic extraction process and analysis of physicochemical properties of dietary fiber from Camellia oleifera meal[J].Science and Technology of Food Industry, 2022, 43(18):162-169.
[34] 张月, 汪楠, 钟金锋, 等.超声波协同高压均质处理对笋壳膳食纤维理化性质及结构的影响[J].粮食与油脂, 2022, 35(12):123-128.ZHANG Y, WANG N, ZHONG J F, et al.Effect of ultrasonic assisted high pressure homogenization on physicochemical properties and structure of bamboo shoot shell dietary fiber[J].Cereals &Oils, 2022, 35(12):123-128.