白及[Bletilla striata (Thunb.)Reichb.f.]是兰科(Orchidaceae)白及属(Bletilla)多年生草本植物,因其根白色,连及而生得名。白及多糖(Bletilla striata polysaccharide,BSP)是白及块茎中最主要的活性成分,约占干燥假鳞茎组织的40%~50%,研究发现BSP主要由甘露糖、葡萄糖、半乳糖醛酸以及半乳糖组成,其中含量最高的是甘露糖和葡萄糖,两者以1∶4的比例通过β-1,4-糖苷键组成[1]。ZHU等[2]对近年来BSP主要结构信息进行总结,发现BSP的分子质量分布范围较广,其平均相对分子质量为12.6~820 kDa。目前,相关研究证实BSP具有抗氧化、抗炎、抗肿瘤、免疫调节、止血及胃肠黏膜保护等作用[3]。
锌是人体必需微量矿物质元素之一,主要存在皮肤、肌肉和骨骼中,在体内酶和受体功能的调节中起着重要的作用[4]。因此,如果缺乏锌元素会导致机体免疫力下降、生长迟缓、发育不良、关节肿大,甚至会诱导机体器官癌变[5]。而人体自身不能合成锌,只能通过食物或补锌制剂来维持体内锌元素平衡。多糖锌是一种新型的补锌制剂,HOLEN等[6]研究发现,与无机锌相比,多糖锌具有更高的生物利用度,对胃肠道刺激减小,而且具有高效、易消化吸收的特点。同时,多糖锌还具有较好的抗氧化活性,能清除多种自由基,提高各种抗氧化酶的活性,进而增强机体总抗氧化能力[7]。黄玲玲等[8]研究发现,在相同浓度下,多糖锌的抗氧化活性强于多糖或无机锌,且表现出剂量依赖性。
常见的无机补锌剂(如ZnSO4)存在生物利用度低、具有胃肠道刺激性的不良反应等问题;有机锌补剂如葡萄糖酸锌口服液,生产需要大量葡萄糖为原料,且不适合糖尿病患者食用。研究发现,多糖锌复合物具有降血糖、抗氧化等活性。因此,将BSP与锌进行复合,开发一种高效、安全、无毒的且兼具抗氧化等活性的白及多糖锌(Bletilla striata polysaccharide-zinc,BSP-Zn)复合物,不仅可以提高BSP的抗氧化活性,促进对BSP的高效利用,而且可以作为锌的膳食补充剂实现补充锌的目的,同时可以解决市售补锌剂存在的各种问题,具有一定的研究意义。
本研究通过单因素试验,以BSP和ZnSO4为原料制备BSP-Zn,以锌的复合率为指标,考察各反应条件对其复合率的影响,并利用响应面实验优化BSP-Zn的制备工艺。在最优工艺条件下制备BSP-Zn,对其进行结构表征以及体外抗氧化活性研究。为进一步研究BSP在食品领域、医药领域的应用以及新型补锌剂的开发提供一定的理论基础。
紫花白及鳞茎,2021年9月购买于贵州省遵义市湄潭县白及基地;ZnSO4·7H2O,天津化学试剂有限公司;锌标准储备液,厦门海标科技有限公司;无水乙醇,天津市富宇精细化工有限公司;硝酸(优级纯),成都市科隆化学品有限公司;FeSO4,上海皓鸿生物医药科技有限公司;水杨酸钠,国药集团化学试剂有限公司;ABTS,北京索莱宝科技有限公司;DPPH,合肥巴斯夫生物科技有限公司;以上试剂除特殊说明外,其余均为分析纯。透析袋(MD44-5M,截留分子质量:3 500 Da),北京兰杰柯科技有限公司。
Agilent 7800 电感耦合等离子体质谱仪,美国Agilent科技公司;MARS6微波消解仪,美国CEM公司;HH-4恒温水浴锅,常州澳华仪器有限公司;101-OAB电热鼓风干燥箱,天津泰斯特有限公司;FD-1A-50冷冻干燥机,北京博医康实验仪器有限公司;PHS-3C酸度计,杭州齐威仪器有限公司;ReadMax 1500光吸收全波长酶标仪,上海闪普生物科技有限公司;Nicolet iS5傅里叶变换红外光谱,美国赛默飞公司;SU8010 场发射扫描电子显微镜,日本日立公司;TGA/DSC1热重分析仪,瑞士梅特勒公司;Ultima Ⅳ X射线多晶衍射,日本理学公司。
1.2.1 BSP-Zn的制备
按照王自凡等[9]的方法提取BSP。采用苯酚硫酸法测得其总糖含量为(59.78±1.20)%(质量分数)。参考张雅施等[10]的方法,用ZnSO4法制备BSP-Zn。将BSP和ZnSO4·7H2O溶于去离子水配制为不同质量浓度的多糖溶液和锌质量浓度为0.4 g/L ZnSO4溶液,设置不同的BSP与锌质量比,按照不同质量比等体积混合,用NaOH调节反应体系 pH,置于恒温水浴反应一定时间,反应结束,待反应液冷却,用 3倍体积的无水乙醇进行醇沉,离心,将沉淀复溶后用透析袋流水透析,除去其中的小分子无机盐等杂质。再以无水乙醇醇沉,离心,将沉淀真空冷冻干燥得到BSP-Zn。
1.2.2 锌元素的测定
1.2.2.1 锌标准曲线的绘制
取1 mL锌标准溶液(1 mg/mL)于100 mL容量瓶中,用2%硝酸(体积分数,下同)定容,即得10 μg/mL的锌标准中间液。分别移取锌标准中间液1、2、4、6、8、10 mL至100 mL容量瓶,用2%硝酸定容,即得质量浓度为100、200、400、600、800、1 000 ng/mL的锌标准系列溶液,用2%硝酸作为空白,电感耦合等离子体质谱(inductively coupled plasma mass spectrometry, ICP-MS)测定待测元素和内标元素的响应信号值,以锌元素的质量浓度(X,ng/mL)为横坐标,比率(Y)为纵坐标,绘制标准曲线。测得标准曲线方程为Y=0.012 2X+0.048 8,R2=0.999 3。
1.2.2.2 复合率的计算
参照李文文等[11]的方法计算复合率,精确移取5 mL 1.2.1节中制备完全的多糖锌反应液,然后加入 3 倍体积的无水乙醇醇沉,5 000 r/min 离心 10 min,吸取0.5 mL上清液于15 mL离心管,用 2%硝酸定容,ICP-MS 测定锌浓度,复合率计算如公式(1)所示:
复合率![]()
(1)
式中:ρ1,反应液中锌质量浓度,μg/mL;ρ2,复合后上清液中锌的质量浓度,μg/mL。
1.2.2.3 锌含量的测定
参考马涛等[12]的方法,分别称取BSP和BSP-Zn 各0.02 g于消解管中, 加入5 mL硝酸,室温下,保存过夜,使用微波消解仪消解样品,消解结束后冷却至室温,用2%硝酸定容至50 mL,ICP-MS 测定锌浓度,锌含量计算公式如公式(2)所示:
锌含量![]()
(2)
式中:ρ,所测得锌质量浓度,ng/mL;V,待测样溶液体积,mL;f,稀释倍数;m,称取多糖锌的质量,g。
1.2.3 单因素试验考察
配制锌质量浓度为0.4 g/L的ZnSO4溶液,按以下条件进行单因素试验。设置BSP与锌的质量比为10∶1、15∶1、20∶1、25∶1、30∶1等体积混合,在反应体系pH值为8、70 ℃反应2 h;按照BSP与锌的质量比为25∶1等体积混合,设置反应体系pH值为6、7、8、9、10五个反应体系,70 ℃反应2 h;按照BSP与锌的质量比为25∶1等体积混合,在反应体系pH值为8、70 ℃条件下,分别反应1.0、1.5、2.0、2.5、3.0 h;按照BSP与锌的质量比为25∶1等体积混合,设置温度50、60、70、80、90 ℃ 5个不同反应温度,在pH值为8的体系下反应2 h。反应结束后,分别取5 mL反应液,加入4倍无水乙醇,混匀和离心,取上清液测定锌含量,计算复合率。以复合率为考察指标考察各因素对BSP-Zn复合率的影响。
1.2.4 响应面优化设计
根据单因素试验结果,以BSP-Zn的复合率作为评价指标,固定反应时间为2 h,以BSP与锌的质量比、反应pH、反应温度为自变量,采用Design-Expert 8.0.6软件根据Box-Behnken响应曲面设计的中心组合实验设计原理设计实验,优化复合物的制备工艺。响应面试验设计因素与水平见表1。
表1 响应面实验设计因素和水平
Table 1 Independent variables and levels in the response surface methodology experimental design
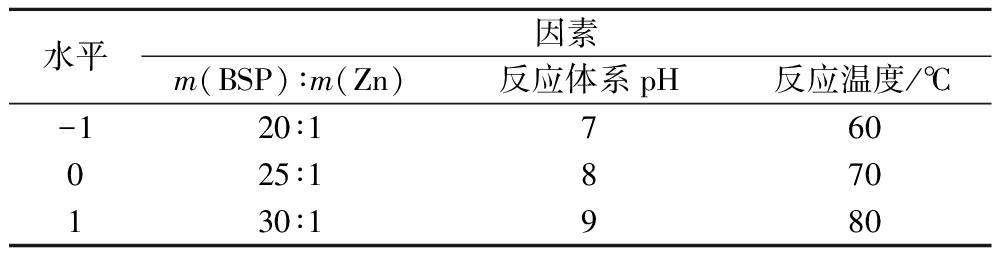
水平因素m(BSP)∶m(Zn)反应体系pH反应温度/℃-120∶1760025∶1870130∶1980
1.2.5 BSP-Zn的结构表征
1.2.5.1 红外光谱分析
取干燥的BSP、BSP-Zn样品,利用KBr压片法对其进行压片制样,在4 000~400 cm-1波数的范围内测定样品的红外吸收光谱。
1.2.5.2 热稳定性分析
分别取3~4 mg多糖样品装入Al2O3坩埚中,以N2为保护气,在热重分析仪上进行热分解,实验条件设置温度为40~600 ℃,升温速率为10 ℃/min。
1.2.5.3 X射线衍射检测
采用X-射线衍射仪进行扫描测定,分析多糖的晶体结构。测定范围为5°~ 90°,角度梯度0.02°、扫描速度为10 °/min。
1.2.5.4 扫描电子显微镜检测
将多糖样品固定到导电胶上,吹去多余粉末,在真空喷镀仪内喷上金膜,观察样品表面形态。
1.2.6 BSP-Zn的体外抗氧化作用
以相同浓度梯度的维生素C为阳性对照,参考ZHOU等[13]的方法测定各样品对DPPH自由基的清除能力;参考CHEN等[14]的方法测定各样品清除ABTS阳离子自由基的能力;参考CHEN等[15]的方法测定清除羟自由基(·OH)的能力。
使用Excel对实验数据进行处理和计算,实验数据均为3次独立重复实验结果的平均值±标准偏差表示,SPSS 18.0软件进行单因素方差分析,P<0.05为差异显著,并用OriginPro 2019b软件作图。
如图1-a所示,m(BSP)∶m(Zn)在15∶1~25∶1 范围内,复合率显著增加(P<0.05),可能是因为随着质量比的增加,BSP的浓度也随之增加,为锌提供了充足的结合位点;当质量比增加至30∶1,复合率出现降低趋势,可能是因为BSP浓度过大,反应体系黏度增加,结合位点暴露减少,不利于与锌结合,从而使复合率降低[16]。
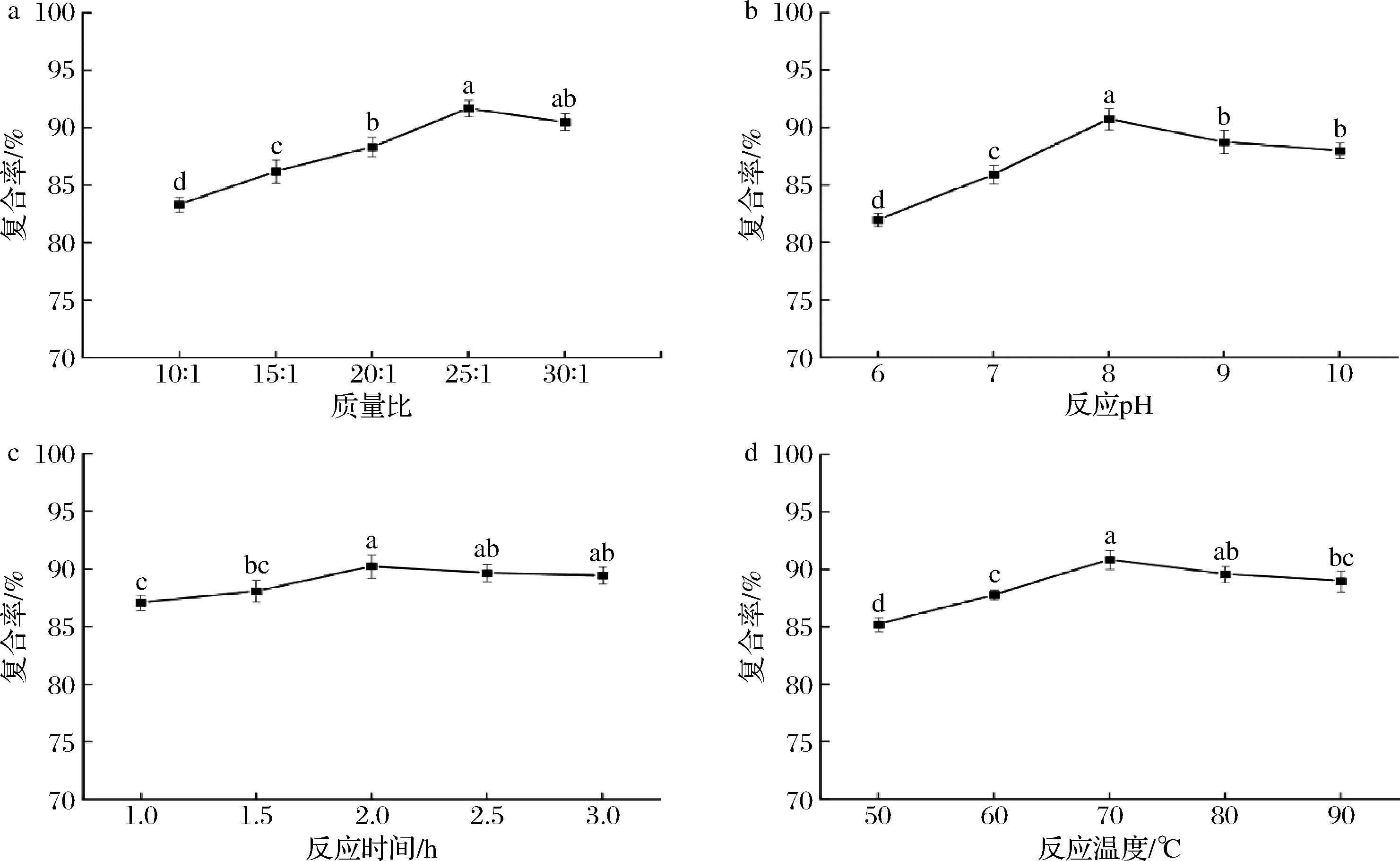
a-质量比;b-反应pH;c-反应时间;d-反应温度
图1 各反应因素对BSP-Zn的锌复合率的影响
Fig.1 Effect of reaction factors on zinc composite rate of BSP-Zn
由图1-b可知,反应体系pH对复合率的影响较为显著,随着反应pH的增加,复合率呈现出先上升后下降的趋势。当pH=8时复合率达到最大值90.77%,可能酸性条件含有的H+,阻碍了锌与多糖的结合,偏碱性条件下锌与OH-形成沉淀,从而降低复合率[17]。
由图1-c可知,在1.0~2.0 h内,随着反应时间的增长,复合率逐渐上升,复合时间达到2.0 h时,复合率达到最大值90.77%。但时间超过2.0 h后,随着复合时间的增长,复合率逐步表现出下降趋势。原因可能是随着复合时间的延长,BSP与锌两者充分接触,且在反应过程中吸附了一定量的锌,使得复合率不断升高,但是随着时间的延长,在一定程度上破坏了体系的稳定性,从而导致体系中锌复合率有所降低[18]。
由图1-d可知,反应温度在50~70 ℃范围内,复合率显著增加(P<0.05);在70 ℃时,复合率达到最大值为90.88%;但再继续升高温度,复合率出现下降趋势,原因可能是反应温度的升高会促进分子运动,使多糖分子与锌充分接触,有利于两者的结合,进而复合率也随之升高。但过高的温度使分子热运动过于激烈,多糖的结构被破坏,导致复合率下降[19]。
考虑到时间对复合率的影响较小,故选择最佳反应时间2 h作为固定因素,不作为响应面优化参数。因此,选择BSP与锌的质量比 20∶1~30∶1、反应体系pH 7~9、反应温度60~80 ℃进行后续响应面试验。
2.2.1 回归模型建立及分析
根据响应面试验设计原理,按照表1的设计进行三因素三水平的响应面实验,实验结果见表2。利用Design-Expert 8.0.6软件,将表2实验数据进行回归拟合,得回归方程为:
表2 BSP-Zn制备工艺响应面分析方案及实验结果
Table 2 The response surface experimental design and results of BSP-Zn
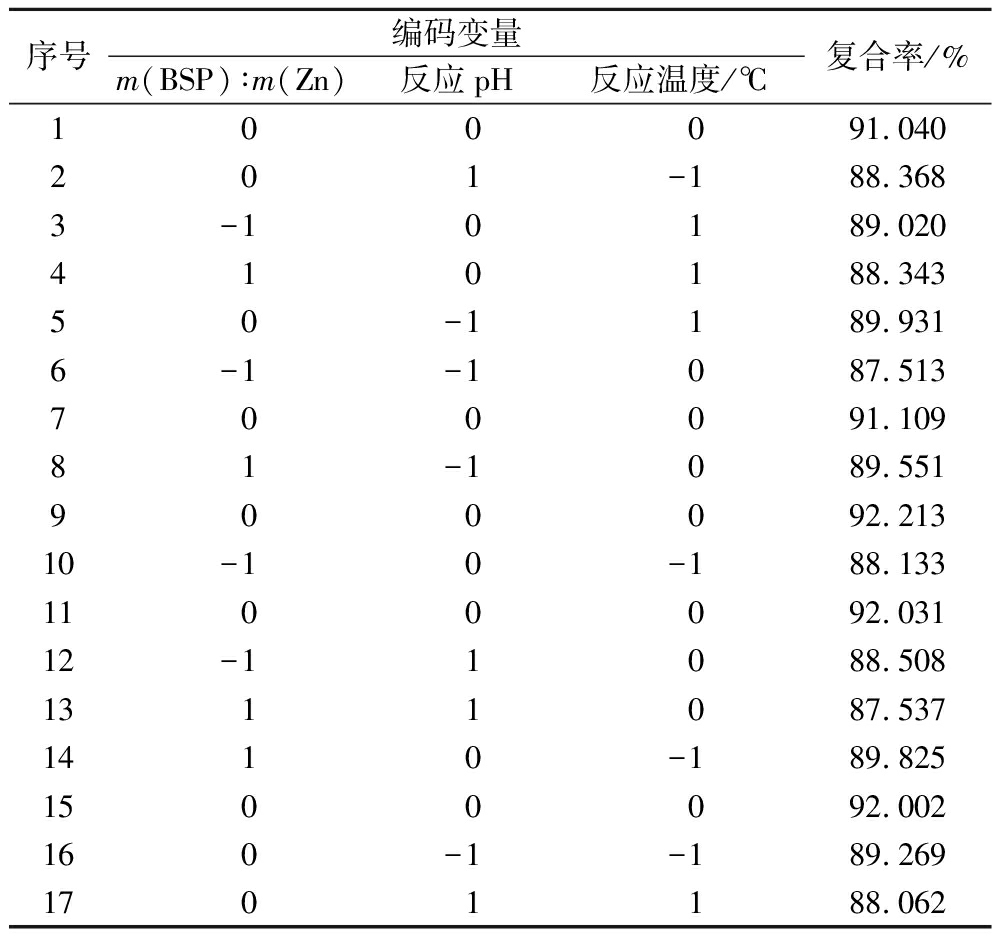
序号编码变量m(BSP)∶m(Zn)反应pH反应温度/℃复合率/%1 0 0 091.040201-188.3683-10189.020410188.34350-1189.9316-1-1087.513700091.10981-1089.551900092.21310-10-188.1331100092.03112-11088.5081311087.5371410-189.8251500092.002160-1-189.2691701188.062
Y=91.68+0.26A-0.47B-0.30C-0.75AB-0.59AC-0.24BC-1.74A2-1.66B2-1.11C2
方差分析结果见表3。实验所建立的模型复相关系数R2=0.957 3,模型P<0.000 1为极显著,说明此模型有意义;失拟项P=0.684 8>0.05,失拟项检验不显著,模型的拟合度良好;信噪比11.411>4,说明该模型可预测实验结果,而修正判定系数![]() 0.902 5与
0.902 5与![]() 的值相差<0.2,说明该响应面设计合理。模型中二次项A2、B2、C2为极显著(P<0.01),B、AB、AC为显著(P<0.05),根据F值可知,各因素对多糖锌复合率的影响程度为:B(反应pH)>A[m(BSP)∶m(Zn)]>C(反应温度)。综上所述,所建立的响应面模型可用来对BSP和锌的复合率进行预测。
的值相差<0.2,说明该响应面设计合理。模型中二次项A2、B2、C2为极显著(P<0.01),B、AB、AC为显著(P<0.05),根据F值可知,各因素对多糖锌复合率的影响程度为:B(反应pH)>A[m(BSP)∶m(Zn)]>C(反应温度)。综上所述,所建立的响应面模型可用来对BSP和锌的复合率进行预测。
表3 方差分析
Table 3 Analysis of variance
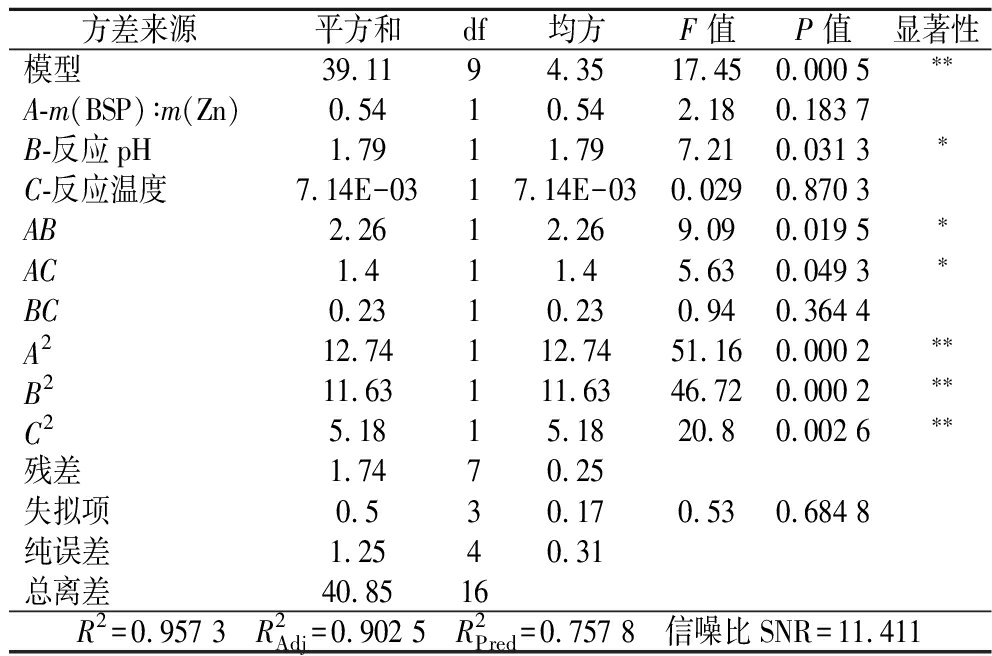
方差来源平方和df均方F 值P 值显著性模型39.1194.3517.450.000 5∗∗A-m(BSP)∶m(Zn)0.5410.542.180.183 7B-反应pH1.7911.797.210.031 3∗C-反应温度7.14E-0317.14E-030.0290.870 3AB2.2612.269.090.019 5∗AC1.411.45.630.049 3∗BC0.2310.230.940.364 4A212.74112.7451.160.000 2∗∗B211.63111.6346.720.000 2∗∗C25.1815.1820.80.002 6∗∗残差1.7470.25失拟项0.530.170.530.684 8纯误差1.2540.31总离差40.8516R2=0.957 3 R2Adj=0.902 5 R2Pred=0.757 8 信噪比SNR=11.411
注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05);未标注表示不显著(P>0.05)。
2.2.2 响应面图分析
用Design Expert 8.0软件对实验数据进行分析并绘制二维等高线图和三维图来直观展示反应质量比、反应 pH、反应温度3个因素两两之间交互作用对复合率的影响效果。如图2所示,从二维等高线中可以看出,在 AB、AC交互作用中等高线均呈椭圆形,AB等高线较密集,AC等高线较稀疏,由此判断AB、AC交互作用显著且AB>AC;在BC交互作用中等高线接近圆形且等高线较稀疏,判断BC交互作用相对不显著。同时由表3中的F值可判断两两之间交互作用对复合率影响程度分别为AB>AC>BC,可看出等高线图与 F 值代表的交互作用影响程度一致。从三维图中曲面陡峭程度可以看出各因素对复合率的影响程度分别为:B(反应pH)>A[m(BSP)∶m(Zn)]>C(反应温度),与表3中F值判断结果一致。
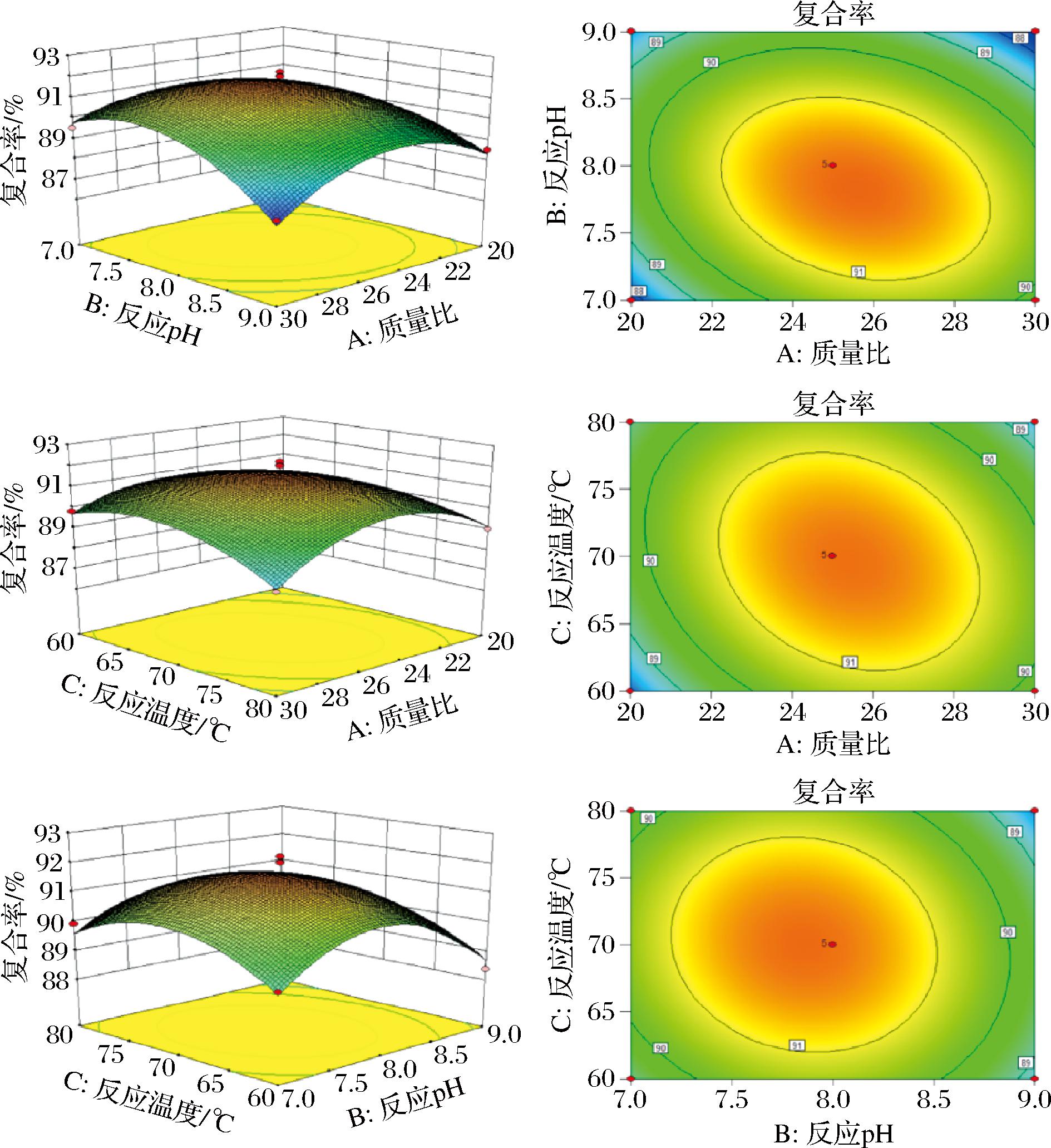
图2 各因素交互作用对BSP-Zn复合能力影响的响应面图
Fig.2 Response surface diagram of the interaction of various factors on the composite ability of BSP-Zn
2.2.3 模型验证
响应面数学模型得到BSP-Zn的最佳复合条件为m(BSP)∶m(Zn)=25.57∶1、反应pH值为7.83、反应温度69.74 ℃,该条件下复合率达到最大值为91.73%。考虑实验操作的可进行性,将实验条件调整为m(BSP)∶m(Zn)=25∶1、反应pH值为7.8、反应温度70 ℃,在此条件下进行3次工艺验证实验,最终得到BSP-Zn的复合率为(91.88±0.67)%,该结果与预测值误差为0.15%,可以看出实际值和预测值相差较小,可以认为本次实验通过响应曲面法得到的各项反应条件的优化参数具有可靠性和准确性。同时ICP-MS 测得BSP和BSP-Zn中锌含量分别为(0.34±0.03)、(27.96±0.84) mg/g。
锌补给量根据WS/T 578.3—2017 《中国居民膳食营养素参考摄入量 第3部分:微量元素》的推荐标准, 婴儿、儿童每天0.6~1.5 mg/kg,成人每天15~30 mg。一般高出摄入量2~3倍无毒性表现,而超过5~10倍时可刺激消化道出现症状,如腹痛、恶心、呕吐等[20]。如果以BSP-Zn为锌补充剂,考虑到其他食物中也含微量锌元素以及锌在体内的吸收情况,那么体重为5~20 kg的婴儿、儿童每天食用添加0.3~0.4 g BSP-Zn的食物,成人每天食用添加1 g左右BSP-Zn的食物,即可达到补充锌效果。
2.3.1 红外光谱
如图3所示,BSP和BSP-Zn的红外光谱均具有多糖典型的特征峰。与BSP相比,属于多糖分子间或分子内的O—H的伸缩振动引起的特征吸收峰由3 424.85 cm-1处移动到3 439.34 cm-1,推测锌与多糖结合是通过Zn—O键进行连接[21];2 925 cm-1处出现的弱吸收峰,是植物糖类不对称C—H的伸缩振动引起的,在1 736 cm-1处的强吸收峰属于C![]() O的伸缩振动,在1 375 cm-1左右的吸收峰为C—H的振动吸收峰,在1 246 cm-1及1 061 cm-1处的吸收峰属于C—O—C和C—O—H的伸缩振动。从图3中可以看出,相较于BSP,BSP-Zn在这几处的吸收峰都有所减弱,说明Zn2+的存在可能与这些基团之间形成了配位键,进而导致其吸收峰减弱;同时在668.341 cm-1处出现尖锐的吸收峰,这些峰形的变化和新吸收峰的出现都表明了锌与BSP形成了复合物[22]。
O的伸缩振动,在1 375 cm-1左右的吸收峰为C—H的振动吸收峰,在1 246 cm-1及1 061 cm-1处的吸收峰属于C—O—C和C—O—H的伸缩振动。从图3中可以看出,相较于BSP,BSP-Zn在这几处的吸收峰都有所减弱,说明Zn2+的存在可能与这些基团之间形成了配位键,进而导致其吸收峰减弱;同时在668.341 cm-1处出现尖锐的吸收峰,这些峰形的变化和新吸收峰的出现都表明了锌与BSP形成了复合物[22]。
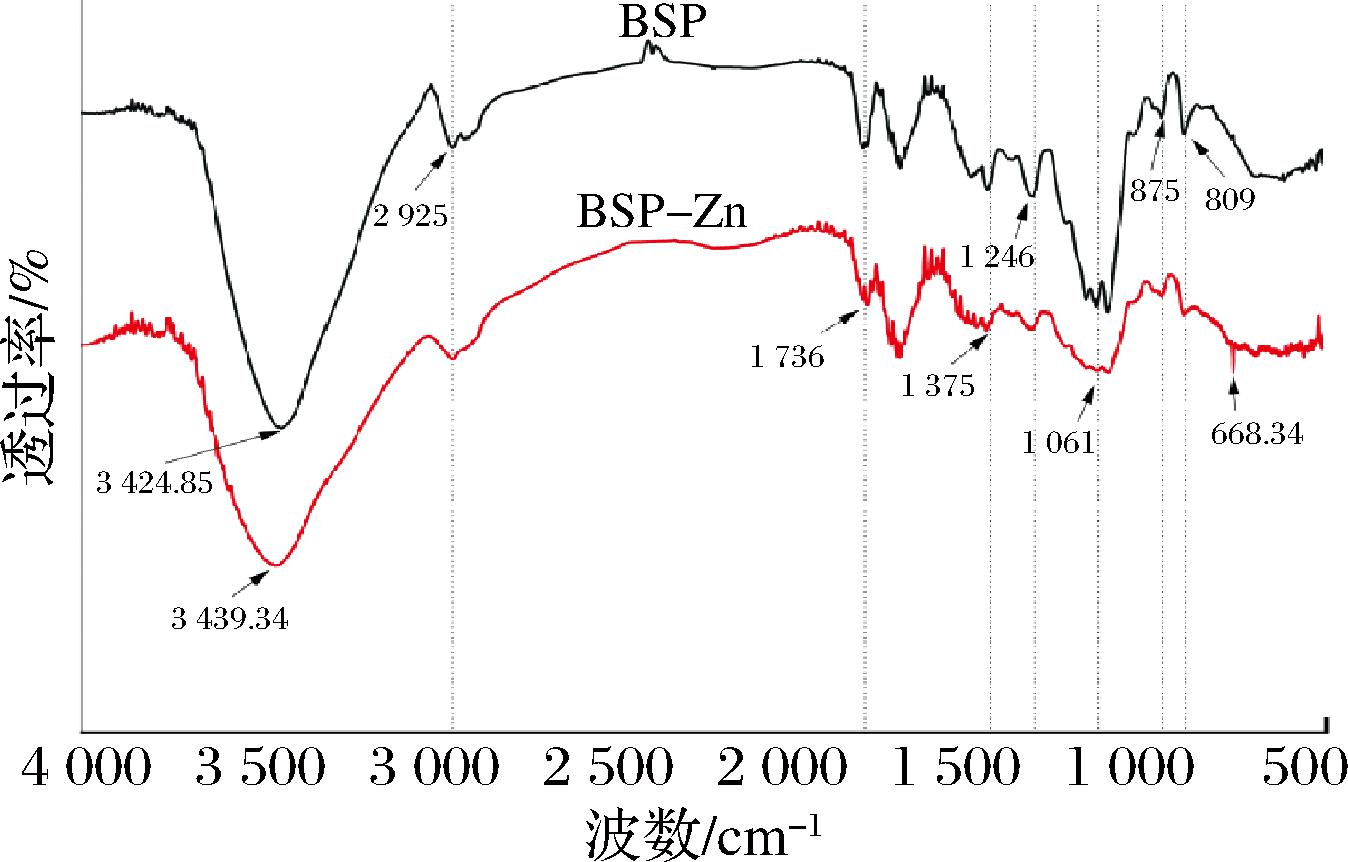
图3 BSP和BSP-Zn的红外光谱图
Fig.3 Fourier transform infrared spectrogram of BSP and BSP-Zn
2.3.2 热稳定性
如图4所示, BSP和BSP-Zn热重分析图较相似,均有2个较明显的失重峰,由此可知热分解过程有2个主要阶段。第一阶段在40~220 ℃范围内,其中BSP的失重率为12.34%,相比之下,BSP-Zn的失重率较小,为9.80%。此阶段的损失主要是由于多糖样品中自由水和结合水的损失,而BSP-Zn由于锌与多糖中含氢和氧的基团结合使这部分基团结构稳定,所以第一阶段BSP-Zn比BSP质量损失少[23]。第二阶段在温度由220 ℃升至700 ℃时,BSP和BSP-Zn的失重率分别为73.23%和71.10%。此阶段的损失主要是由于多糖的化学结构降解,以及单糖分解成水蒸气和CO2等,从微分热重分析(derivative thermogravimetry,DTG)的结果发现,BSP在321.08 ℃时质量损失速率达到最大,而BSP-Zn在312.87 ℃时质量损失速率达到最大,且质量损失速率大于BSP。可能是因为此阶段BSP-Zn碳链比BSP更容易热解,产物生成了耐高温的ZnO[24],所以此阶段的BSP-Zn的失重率小于BSP。上述结果说明BSP-Zn比BSP具有更高的热稳定性。
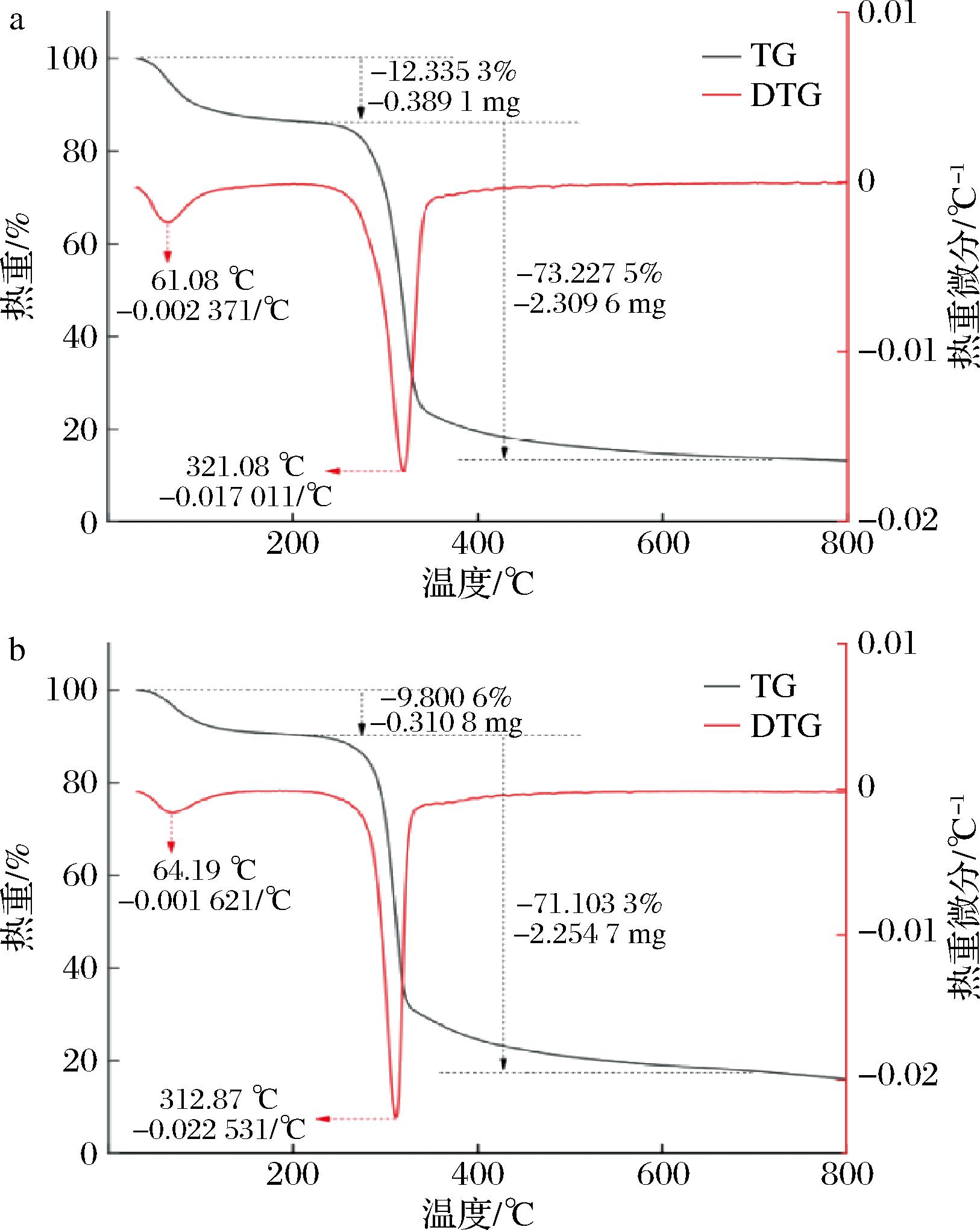
a-BSP;b-BSP-Zn
图4 BSP和BSP-Zn的热重分析
Fig.4 Thermogravimetric analysis of BSP and BSP-Zn
2.3.3 X射线衍射
通过X射线衍射可以测试多糖的晶体结构,根据衍射峰的形状、衍射位置及强度可判断多糖的结晶或无定型性质。图5显示BSP和BSP-Zn在2θ为10°~30°具有较宽且较强的衍射峰,表明它们本质上都是无定型材料。从图中可以看出,BSP经过与锌复合后其结晶性质保持不变,但衍射峰强度略微降低、峰形略微变窄。这可能是由于锌和多糖官能团的相互作用,影响了氢键相互作用,导致BSP的结晶略有所变化[25]。该结果与相关文献报道一致,即锌的引入会使多糖的结晶度发生变化,但是没有改变其原本的无定型形态[26]。
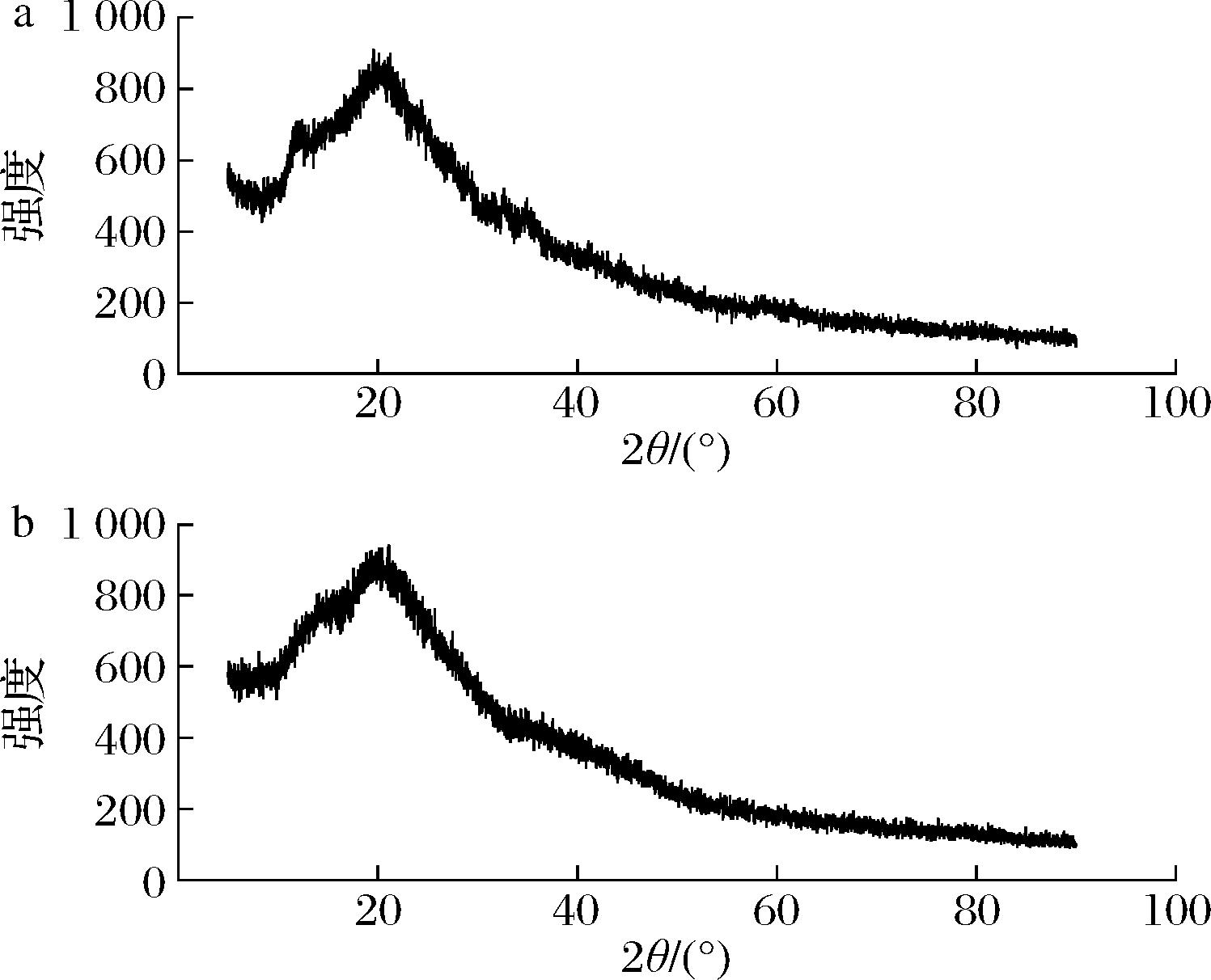
a-BSP-Zn;b-BSP
图5 BSP和BSP-Zn的 X-射线衍射光谱图
Fig.5 X-ray diffraction spectrum of BSP and BSP-Zn
2.3.4 扫描电镜
由图6可知,BSP与BSP-Zn的表面形态有明显的区别,BSP呈现光滑、致密的棒球型结构,略微有序地堆积在一起,可清晰看到团状连接紧密。而BSP-Zn的表面为不规则的片状堆积,可以看到表面略粗糙,在放大20 000倍和50 000倍的图中可以看到比较稀疏且大小不一的孔隙,而且这些片状结构之间出现明显的针尖结构。杜利月等[27]研究表明,多糖与锌复合后形成的配位键会干扰多糖中糖链的有序排列,进而改变多糖结构和形貌。因此,BSP-Zn不均匀结构以及外貌发生明显的变化,表明锌与多糖发生复合作用[28]。

a-BSP 5 000倍;b-BSP 20 000倍;c-BSP 50 000倍;d-BSP-Zn 5 000倍;e-BSP-Zn 20 000倍;f-BSP-Zn 50 000倍
图6 BSP和BSP-Zn的扫描电镜图
Fig.6 Scanning electron micrographs of BSP and BSP-Zn
如图7所示,ZnSO4、BSP和BSP-Zn三者均对3种自由基有一定的清除能力,且随着质量浓度的增加而增大,表现出剂量依赖关系。无论在高浓度还是低浓度下,与ZnSO4和BSP相比,BSP-Zn对各自由基的清除能力最强,显著高于BSP和ZnSO4。当质量浓度达到2.5 mg/mL时,自由基清除能力分析显示,BSP-Zn对DPPH自由基、ABTS阳离子自由基和·OH清除率分别为(46.72±0.74)%、(38.37±1.55)%和(78.47±0.91)%,明显高于BSP的清除率(36.42±0.99)%、(28.31±0.95)%和(61.14±1.62)% (P<0.05),表明多糖与锌的结合提高了BSP的抗氧化能力。这可能是因为微量元素锌也是一种抗氧化剂,与多糖复合后,两者相互协同,使得复合物抗氧化活性增强[17]。
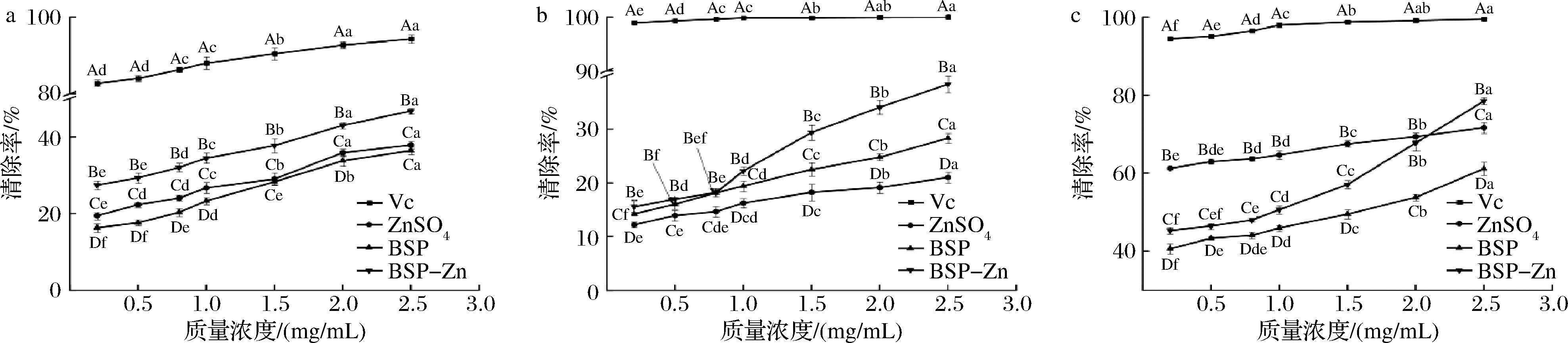
a-DPPH自由基清除率;b-ABTS阳离子自由基清除率;c-·OH清除率
图7 BSP和BSP-Zn体外抗氧化活性
Fig.7 Antioxidant activity in vitro of BSP and BSP-Zn
注:图中不同的大写字母代表各样品同一浓度下清除自由基的能力存在显著性差异(P<0.05);不同小写字母代表同一样品不同浓度下清除自由基的能力存在显著性差异(P<0.05)。
董金满[29]研究表明,通过将多糖与锌进行复合获得锌多糖后,其基本骨架没有改变,只有部分羟基和羰基发生改变。BSP与锌配位后,锌的引入会结合多糖上的羟基导致氢供体减少,但清除自由基的能力反而增大,可能是因为多糖与锌配合后, 导致配位部分增强与暴露的活性基团之间的作用, 进而促进与自由基的作用,使得BSP-Zn对自由基的清除率增大[30];也有可能是多糖与锌配合后,与自由基反应生成的中间体更加稳定,使清除自由基的能力增大[18]。
本研究采用单因素试验和响应面试验优化反应条件,获得了BSP-Zn的最佳制备工艺,在此条件下制备了BSP-Zn,ICP-MS测得其锌含量为(27.96±0.84) mg/g,对其进行结构表征发现,锌与多糖中O—H、C—H、C—O—C和C![]() O等官能团发生复合作用,锌的引入会使多糖的结晶度发生变化,同时在一定程度上增加了其热稳定性,但不会改变其原本的无定型形态。抗氧化实验结果显示,BSP和BSP-Zn 对DPPH自由基、ABTS阳离子自由基和·OH均有良好的清除作用,与BSP相比,BSP-Zn对各自由基的清除能力均有显著性增加,表明多糖与锌结合后,两者相互协同,显著增强其抗氧化活性。因此,将BSP与锌复合可潜在地作为锌的膳食补充剂、抗氧化剂或营养保健品配方的成分,这为BSP的高效利用以及BSP-Zn功能性膳食补充剂的开发提供一定的理论基础。
O等官能团发生复合作用,锌的引入会使多糖的结晶度发生变化,同时在一定程度上增加了其热稳定性,但不会改变其原本的无定型形态。抗氧化实验结果显示,BSP和BSP-Zn 对DPPH自由基、ABTS阳离子自由基和·OH均有良好的清除作用,与BSP相比,BSP-Zn对各自由基的清除能力均有显著性增加,表明多糖与锌结合后,两者相互协同,显著增强其抗氧化活性。因此,将BSP与锌复合可潜在地作为锌的膳食补充剂、抗氧化剂或营养保健品配方的成分,这为BSP的高效利用以及BSP-Zn功能性膳食补充剂的开发提供一定的理论基础。
[1] 王自凡. 白芨胶分级制备工艺及其功效研究[D].贵阳:贵州大学, 2022.WANG Z F.Study on grading preparation technology and efficacy of Bletilla striata gum[D].Guiyang:Guizhou University, 2022.
[2] ZHU Z M, LIANG T T, DAI G N, et al.Extraction, structural-activity relationships, bioactivities, and application prospects of Bletilla striata polysaccharides as ingredients for functional products:A review[J].International Journal of Biological Macromolecules, 2023, 245:125407.
[3] 祝贝贝. 白芨多糖分离纯化、化学性质及生物活性研究进展[J].食品与发酵工业, 2023, 49(10):343-350.ZHU B B.Research progress on separation, purification, chemical properties, and bioactivity of polysaccharide from Bletilla striata[J].Food and Fermentation Industries, 2023, 49(10):343-350.
[4] DEPCIUCH J, SOWA-KU MA M, NOWAK G, et al.The role of zinc deficiency-induced changes in the phospholipid-protein balance of blood serum in animal depression model by Raman, FTIR and UV-vis spectroscopy[J].Biomedecine &Pharmacotherapie, 2017, 89:549-558.
MA M, NOWAK G, et al.The role of zinc deficiency-induced changes in the phospholipid-protein balance of blood serum in animal depression model by Raman, FTIR and UV-vis spectroscopy[J].Biomedecine &Pharmacotherapie, 2017, 89:549-558.
[5] SKRAJNOWSKA D, KORCZAK B B, TOKARZ A, et al.The effect of zinc and phytoestrogen supplementation on the changes in mineral content of the femur of rats with chemically induced mammary carcinogenesis[J].Journal of Trace Elements in Medicine and Biology, 2015, 32:79-85.
[6] HOLEN J P, JOHNSTON L J, URRIOLA P E, et al.Comparative digestibility of polysaccharide-complexed zinc and zinc sulfate in diets for gestating and lactating sows[J].Journal of Animal Science, 2020, 98(4):skaa079.
[7] 袁心田, 陈华国, 赵超, 等.锌多糖的合成方法、结构特征和生物活性研究进展[J].食品与发酵工业, 2022, 48(14):336-344.YUAN X T, CHEN H G, ZHAO C, et al.Progress of synthesis methods, structural characteristics and biological activities of zinc polysaccharides[J].Food and Fermentation Industries, 2022, 48(14):336-344.
[8] 黄玲玲, 苏彩霞, 张宗申, 等.硒、锌元素对羊肚菌多糖抗氧化性的影响[J].食品与发酵工业, 2015, 41(7):122-125.HUANG L L, SU C X, ZHANG Z S, et al.Effects of selenium and zinc on the antioxidant activity of Morel polysaccharides[J].Food and Fermentation Industries, 2015, 41(7):122-125.
[9] 王自凡, 卢永仲, 张振.响应面优化白芨多糖提取工艺及流变性研究[J].中国调味品, 2022, 47(7):58-63.WANG Z F, LU Y Z, ZHANG Z.Optimization of extraction process of polysaccharide from Bletilla striata by response surface method and research on the rheological properties[J].China Condiment, 2022, 47(7):58-63.
[10] 张雅施, 李文文, 宗爱珍, 等.菊芋多糖锌的制备及其抗氧化活性评价[J].食品工业科技, 2023, 44(12):251-259.ZHANG Y S, LI W W, ZONG A Z, et al.Preparation and antioxidant activity evaluation of Jerusalem artichoke polysaccharide-Zn complex[J].Science and Technology of Food Industry, 2023, 44(12):251-259.
[11] 李文文, 王丹, 董淑君, 等.生姜皮多糖锌的制备及体外模拟消化研究[J].食品工业科技, 2022, 43(18):185-191.LI W W, WANG D, DONG S J, et al.Preparation of ginger peel polysaccharide-zinc complex and in vitro simulated digestion[J].Science and Technology of Food Industry, 2022, 43(18):185-191.
[12] 马涛, 宗鹏.微波消解-电感耦合等离子体质谱法测定灵芝中7种金属元素含量[J].中国当代医药, 2023, 30(3):57-60.MA T, ZONG P.Determination of 7 metal elements in Ganoderma by microwave digestion-inductively coupled plasma mass spectrometry[J].China Modern Medicine, 2023, 30(3):57-60.
[13] ZHOU S Y, HUANG G L.Extraction, structure characterization and biological activity of polysaccharide from coconut peel[J].Chemical and Biological Technologies in Agriculture, 2023, 10(1):15.
[14] CHEN C, ZHAO Z Y, MA S S, et al.Optimization of ultrasonic-assisted extraction, refinement and characterization of water-soluble polysaccharide from Dictyosphaerium sp.and evaluation of antioxidant activity in vitro[J].Journal of Food Measurement and Characterization, 2020, 14(2):963-977.
[15] CHEN H Y, ZENG J S, WANG B, et al.Structural characterization and antioxidant activities of Bletilla striata polysaccharide extracted by different methods[J].Carbohydrate Polymers, 2021, 266:118149.
[16] 刘阳, 孙晓晶, 陈锵, 等.牛蒡多糖锌的制备工艺优化及其抗氧化活性评价[J].食品工业科技, 2023, 44(11):179-186.LIU Y, SUN X J, CHEN Q, et al.Preparation process optimization and evaluation of antioxidant activity of burdock polysaccharide zinc complex[J].Science and Technology of Food Industry, 2023, 44(11):179-186.
[17] 董金满, 李鸿梅, 李炳东.罗耳阿太菌多糖锌的制备及其抗氧化活性研究[J].食品工业, 2018, 39(6):22-26.DONG J M, LI H M, LI B D.Preparation and antioxidant activities of Athelia rolfsii polysaccharide-zinc[J].The Food Industry, 2018, 39(6):22-26.
[18] 顾冰飞, 赵圆圆, 陈义勇.杏鲍菇多糖锌螯合物的制备工艺及其抗氧化活性[J].食品研究与开发, 2019, 40(4):97-103.GU B F, ZHAO Y Y, CHEN Y Y.Preparation technology of Pleurotus eryngii polysaccharides-zinc(Ⅱ)chelate and its antioxidant activities[J].Food Research and Development, 2019, 40(4):97-103.
[19] 李兴艳, 张丙云, 尚永彪.正交试验优化酵母多糖锌配合物的制备及其对尿素的吸附性能[J].食品科学, 2013, 34(14):57-62.LI X Y, ZHANG B Y, SHANG Y B.Preparation of yeast polysaccharide-Zn complex and its adsorption performance for urea[J].Food Science, 2013, 34(14):57-62.
[20] 向中兰. 补锌过量对人体的危害[J].现代医药卫生, 2001, 17(9):727.XIANG Z L.Harm of excessive zinc supplementation to human body[J].Modern Medicine Health, 2001, 17(9):727.
[21] WANG P P, HUANG Q, CHEN C, et al.The chemical structure and biological activities of a novel polysaccharide obtained from Fructus Mori and its zinc derivative[J].Journal of Functional Foods, 2019, 54:64-73.
[22] 李凯文, 王婕, 黄子贞, 等.当归多糖锌复合物的自组装形貌及抗氧化活性研究[J].化学研究, 2023, 34(6):496-504.LI K W, WANG J, HUANG Z Z, et al.Self-assembled morphology and antioxidant activity of Angelica polysaccharide-zinc complex[J].Chemical Research, 2023, 34(6):496-504.
[23] ZHANG M, ZHAO H, SHEN Y, et al.Preparation, characterization and antioxidant activity evaluation in vitro of Fritillaria ussuriensis polysaccharide-zinc complex[J].International Journal of Biological Macromolecules, 2020, 146:462-474.
[24] ZHANG Y, KHAN M Z H, YUAN T T, et al.Preparation and characterization of D.opposita Thunb polysaccharide-zinc inclusion complex and evaluation of anti-diabetic activities[J].International Journal of Biological Macromolecules, 2019, 121:1029-1036.
[25] LI W W, QIU Z C, MA Y, et al.Preparation and characterization of ginger peel polysaccharide-Zn (Ⅱ) complexes and evaluation of anti-inflammatory activity[J].Antioxidants, 2022, 11(12):2331.
[26] DING X, WU X Y, ZHANG Z, et al.Characterization, optimization of preparation process of an Inonotus obliquus polysaccharide-Zinc (Ⅱ) complex and its antioxidant activities[J].Biotechnology &Biotechnological Equipment, 2021, 35(1):1274-1283.
[27] 杜利月, 赵新如, 王飞.香菇多糖锌螯合物的制备及结构表征和体外抗氧化活性研究[J].食品安全质量检测学报, 2023, 14(4):290-298.DU L Y, ZHAO X R, WANG F.Preparation, structure characterization and in vitro antioxidant activity of lentinan-znic chelate[J].Journal of Food Safety &Quality, 2023, 14(4):290-298.
[28] XUE Y T, DING X, WU X Y, et al.Optimization of preparation process and antioxidant activity of the chelate of a Hericium erinaceus polysaccharide with zinc[J].Journal of Food Measurement and Characterization, 2021, 15(2):2039-2048.
[29] 董金满. 罗耳阿太菌多糖锌的制备、表征及其生物活性研究[D].长春:吉林农业大学, 2018.DONG J M.Preparation,characterization and bioactivities of Athelia rolfsii polysaccharide-zinc complex (AEPS-Zn)[D].Changchun:Jilin Agricultural University, 2018.
[30] 黄靖, 邹烨, 王未, 等.肉苁蓉多糖锌的制备、表征及抗氧化活性[J].化学研究, 2015, 26(6):584-589.HUANG J, ZOU Y, WANG W, et al.Preparation, characterization and antioxidant activity of Cistanche tubulosa Zn2+-polysaccharide complex[J].Chemical Research, 2015, 26(6):584-589.