明胶是来源于皮、骨或者结缔组织中的胶原蛋白通过一定方式降解形成的生物大分子[1]。目前,明胶主要从动物的皮肤或骨骼组织中提取,提取明胶时,胶原蛋白发生一定程度的降解,从而产生含有α链亚单元(80~125 kDa)、β链(α二聚体)和γ链(α三聚体)的Ⅰ型胶原亚基结构[2]。
明胶的预处理可分为酸处理、碱处理、酶处理、发酵处理和微波冻融耦合处理,提取工艺有热水提取法、微波萃取法、超高压诱导法、超声提取法和热蒸汽抽提法[3]。与其他提取方法相比,热水提取法具有成本低、效率高、得率高等优点。其中温度、时间和pH 值是影响明胶提取率、结构和理化性质的关键因素。随着提取温度的提高,明胶的提取率增加,但由于三螺旋结构的展开,α亚单元含量的增加,其凝胶强度、黏度等功能特性显著下降。明胶在最适提取温度 45~55 ℃下,提取率较高,并且理化性质受影响较小[4]。
我国水产资源丰富,水生动物的皮肤、骨骼、鳔、软组织等富含胶原蛋白。相比于陆生生物,水产生物由于特殊的生存环境,使得其明胶的氨基酸组成和序列具有特异性,且其具有胶原蛋白含量高、生物毒素与化学污染物残留量较少、溶胀能力良好和生物降解性、免疫原性低以及免受宗教束缚等优点[5],与市场上传统的商业猪源与牛源明胶相比,水生动物来源明胶的起泡性显著低于猪骨明胶,但其凝胶强度、乳化性、流变学性质相对较差,因此关于明胶改性手段及应用快速发展。通过酶法、物理化学法、复合修饰法改性,将明胶应用于食品工业可食性复合膜,从而延长食品货架期[6];作为载药的伤口敷料应用于医药行业[7];作为增稠剂及主要口服胶原补充剂应用于化妆品行业[8]。
裸体方格星虫(Sipunculus nudus),星虫动物门(Sipunculus),主要分布于我国山东沿海、广西等地。据统计,广西地区(1990年),方格星虫资源量估算约400万kg。近年来,随着方格星虫人工育苗技术的突破,年产量约超过200万kg[9]。方格星虫主要食用方式为鲜销和加工成干制品,近几年其深加工价值越来越受到重视,活性研究和应用也日益广泛。现代医学研究表明其具有抗氧化、抗疲劳、抗病毒、调节免疫、抗菌、抗炎和外周镇痛等功效[10]。团队前期研究发现[11],方格星虫含有丰富胶原蛋白,酸酶法提取方格星虫胶原蛋白为I型胶原蛋白,但酶法提取率较低,而采用热水法提取明胶并对其结构表征和功能特性相关研究鲜有报道。因此,本研究以热水法提取方格星虫体壁明胶(Sipunculus nudus body gelatine,SNBG),分析SNBG的结构与功能特性,为方格星虫在食品及化妆品领域的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
方格星虫,2022年9月购自湛江市霞山工农市场,去血去内脏取体壁,洗净沥干后,分装,于-20 ℃贮藏备用。BCA 蛋白含量测定试剂盒,南京市建成生物工程研究所;SDS-PAGE凝胶快速配制试剂盒、SDS-PAGE 蛋白上样缓冲液,上海碧云天生物技术有限公司;NaOH、盐酸等均为分析纯,西陇科学股份有限公司。
1.2 仪器与设备
BSA224S-CW分析天平,赛多利斯科学仪器(北京)有限公司;Thermo Serval LYNX 6000落地式超速离心机,美国热电公司;Varioskan Flash全自动酶标仪,美国Thermo Fisher Scientific公司;S10-3型恒温磁力搅拌器,上海司乐仪器有限公司;EYELA旋转蒸发仪,上海艾朗仪器有限公司;FD-551冷冻干燥机,日本东京理化公司;HR7628食品加工机,飞利浦(中国)投资有限公司;TU1901双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;TENSOR27傅里叶红外光谱仪,德国BRUKER公司;STA449F3同步热分析仪,德国耐驰公司;GelDoc XR+凝胶成像系统,美国伯乐公司。
1.3 实验方法
1.3.1 热水法提取SNBG
方格星虫体壁洗净后吸干水分,热水提取明胶方法参考柏昌旺等[12]的方法略作改动,修剪组织,加入1∶20(g∶mL)0.1 mol/L NaOH溶液,4 ℃磁力搅拌12 h,4层纱布过滤,蒸馏水洗涤沉淀至中性,1∶20(g∶mL)加蒸馏水,90 ℃热水提取,每隔 4 h 收集滤液并更换提取液直至样品全部溶解。8 000 r/min、4 ℃、离心20 min取上清液,旋蒸浓缩,冷冻干燥得方格星虫明胶冻干粉。
1.3.2 氨基酸组成
取适量冷冻干燥的明胶,在 6 mol/L盐酸中水解 22 h。按照 GB/T 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》采用氨基酸自动分析仪测定样品中氨基酸的含量。
1.3.3 聚丙烯凝胶电泳
参考郑志鸿[13]方法并略作改动。使用分离胶浓度为8%,浓缩胶浓度为5%。将SNBG冻干粉溶于蒸馏水中配制成5 mg/mL的明胶溶液,与5倍样品缓冲液混合,100 ℃下加热8 min,4 000 r/min离心5 min,取10 μL上清液上样。以100 V电压浓缩30 min,至样品在浓缩胶中浓缩成一条线后,电压调为120 V继续电泳60 min。电泳后用考马斯亮蓝R-250染色凝胶,并用脱色液脱色至分离胶背景无色,进行凝胶成像系统分析。
1.3.4 蛋白质质谱鉴定
参考沈明娟等[14]方法并略作改动。将电泳得到目标蛋白条带,切下需要分析的胶点,加入消化脱色液清洗,加入乙腈脱水,再加入10 mmol/L二硫苏糖醇(dithiothreitol,DTT),让胶粒完全吸收后,56 ℃水浴锅孵育1 h,加入55 mmol/L吲哚丙酮酸,暗室孵育45 min后,再加入25 mmol/L NH4HCO3溶液,清洗10 min,至胶粒完全变白。加入酶储液充分吸收后,再加入NH4HCO3,37 ℃水浴锅消化过夜。加入终浓度为0.1%(体积分数)的甲酸溶液终止消化。取10 μL样品上机,使用质谱检测。
肽段经UltiMate3000 RSLCnano超高效液相系统进行分离。流动相A为含0.1%甲酸(体积分数)的水溶液,流动相B为含0.1%甲酸和98%乙腈(体积分数)的水溶液。液相梯度设置:0~6 min 5%~8% B相;7~40 min 8%~30% B相;41~45 min 30%~60% B相;46~48 min 60%~80% B相,49~56 min 80% B相,56~58 min 80%~5% B相,58~65 min 5% B相,流速维持在400 nL/min。
肽段经Thermo ScientificTM Q ExactiveTM质谱分析。离子源电压设置为1.8 kV,肽段母离子及其二级碎片都使用高分辨的Orbitrap进行检测和分析。一级质谱扫描范围设置为350~2 000 Da,扫描分辨率设置为70 000。数据采集模式使用数据依赖型扫描(data-dependent acquisition,DDA)程序。二级质谱扫描范围依赖于一级母离子质荷比自动选择,分辨率设置为17 500。
二级质谱数据使用MASCOT2.3.0进行处理检索。数据库设置为myco_chelonae_un uni (25 692 sequences;8 306 730 residues),酶切方式设置为Trypsin;漏切位点设置为2;一级母离子质量误差容忍度设置为15 ppm;二级碎片离子的质量误差容忍度设置为20 mmu。
1.3.5 紫外全波长扫描
参考姚行行等[15]的方法并稍作改动。配制质量浓度为 1 mg/mL 的SNBG溶液,12 000 r/min 离心 15 min,取上清液进行扫描分析。扫描波段为 200~400 nm,速度为 2 nm/s,波长间隔 1 nm。以蒸馏水作为空白对照。
1.3.6 傅里叶红外变换光谱扫描
参考杨子帆等[16]的方法并略作修改。于120 ℃烘箱将KBr烘干4 h以上,保存备用。取适量冻干样品,以样品∶KBr=1∶20(质量比)的比例加入玛瑙钵中研磨后进行压片。红外光谱扫描分辨率4 cm-1,测定4 000~400 cm-1波数下样品透过率。
1.3.7 扫描电子显微镜
参考李晓敏等[17]的方法并略作改动。取冻干SNBG,固定在载物片上,用扫描电子显微镜观察其形态特性。使用10 kV的加速电压,以200×的放大倍数采集图像。
1.3.8 Zeta电位测定
参考冯建慧等[18]的方法并稍作改动。将SNBG冻干粉用蒸馏水溶解,37 ℃下搅拌1 h,使其最终质量浓度为 1 mg/mL。用1 mol/L的HCl和1 mol/L的NaOH溶液调节pH,分别测定不同pH值(4~5)下SNBG的zeta电位。
1.3.9 差示扫描量热法(differential scanning calorimetry, DSC)
参照鲍虹蕾等[19]的方法并略作改动。称取5~10 mg冻干样品于坩埚内,将坩埚底部完全且均匀覆盖,压盖密封后,放入DSC样品室,以空坩埚为参比进行分析。扫描温度范围20~100 ℃,升温速率5 ℃/min,样品室N2流量为20 mL/min。
1.3.10 SNBG的功能特性测定
1.3.10.1 起泡能力(foam capacity,FC)和泡沫稳定性(foam stability,FS)
FC和FS参考LI等[20]的方法略作改动。配制质量浓度20 mg/mL 的明胶溶液,用0.5 mol/L HCl或NaOH溶液调整pH值为2、4.37、6、8。22 000 r/min均质60 s。在0 min和3 h记录泡沫的体积。FC和FS按照公式(1)、公式(2)计算:
(1)
(2)
式中:V0,初始体积,mL;V1,均质化后0 min的体积,mL;V2,均质化后3 h的体积,mL。
1.3.10.2 乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsion stability index,ESI)
EAI和ESI的测定参考余东华等[21]的方法略作改动。具体步骤如下:配制质量浓度15 mg/mL 的明胶溶液,用0.5 mol/L HCl 或 NaOH溶液调整pH值为2、4.37、6、8,再加入5 mL葵花籽油,22 000 r/min均质 60 s,取下层乳化液20 μL,加入2.0 mL十二烷基硫酸钠溶液(0.1%体积分数)在500 nm波长处测定吸光度 A0。
乳化能力大小用EAI,ESI的测定。按照公式(3)、公式(4)计算:
(3)
(4)
式中:A0,均质后0分钟的吸光度;φ,由的体积分数(0.25);Δt,10 min;A10,均质10 min后的吸光度;m,样品蛋白质量,g。
1.3.10.3 持油性(oil holding capacity,OHC)
OHC的测定参考HUANG等[22]的方法略作改动。配制质量浓度20 mg/mL 的明胶溶液,用0.5 mol/L HCl或NaOH溶液调整pH值为2、4.37、6、8,取10 mL明胶溶液,再加入10 mL葵花籽油,25 ℃,12 000 r/min,离心10 min。记录游离油的体积。按照以下公式计算:
(5)
式中:V0,初始体积,mL;V1,游离油体积,mL;m,所需样品质量,g。
1.3.11 酪氨酸酶抑制率的测定
抑制酪氨酸酶体外活性实验方法参考HU等[23]的方法略作改动,阳性对照曲酸用PBS(pH=6.8,0.1 mol/L)稀释成不同质量浓度梯度溶液。方格星虫冻干粉样品用蒸馏水溶解,依次加入L-酪氨酸溶液、样品溶液/溶剂、PBS,充分混匀,置于37 ℃恒温环境下孵育10 min后依次在各孔加入20 μL的酪氨酸酶溶液,37 ℃混匀反应(300±5) s后即刻放入酶标仪,在475 nm波长处进行测定。酪氨酸酶活性抑制率计算如公式(6)所示:
(6)
式中:Y,酪氨酸酶活性抑制率,%;Ad,样品反应吸光度;Ac,样品本底吸光度;Ab,溶剂反应吸光度平均值;Aa,溶剂本底孔吸光度平均值。
1.3.12 DPPH自由基清除率的测定
采用南京建成生物工程研究所DPPH自由基清除能力测定试剂盒,根据说明书测定样品活性,计算样品DPPH自由基清除率。
1.4 数据分析
所有实验均重复3次,结果使用SPSS软件进行差异显著性分析(P<0.05),采用Origin 2021软件进行数据统计分析及绘图。
2 结果与分析
2.1 SNBG氨基酸组成与含量分析
明胶的氨基酸组成与其功能特性密切相关。研究表明,明胶含有大量重复的Gly-Pro-Hyp序列,形成凝胶过程中,Pro的—NH与其他氨基酸侧链基团及水分子可形成氢键,维持凝胶体系中三螺旋结构的稳定;Gly位于三重螺旋内部的交界处,其疏水特性是明胶具有良好界面特性的主要原因[24]。如表1所示,SNBG富含Gly(22.41%)和Pro(6.62%),说明SNBG具有稳定的凝胶特性与界面两亲性。此外,SNBG还富含Asp(8.34%)、Glu(17.59%)、Ala(7.47%)、Arg(11.02%),疏水性氨基酸的含量与氧化还原力具有显著的正相关性[25],因此SNBG具有较好的抗氧化潜力。
表1 SNBG氨基酸组成
Table 1 Amino acid composition of SNBG
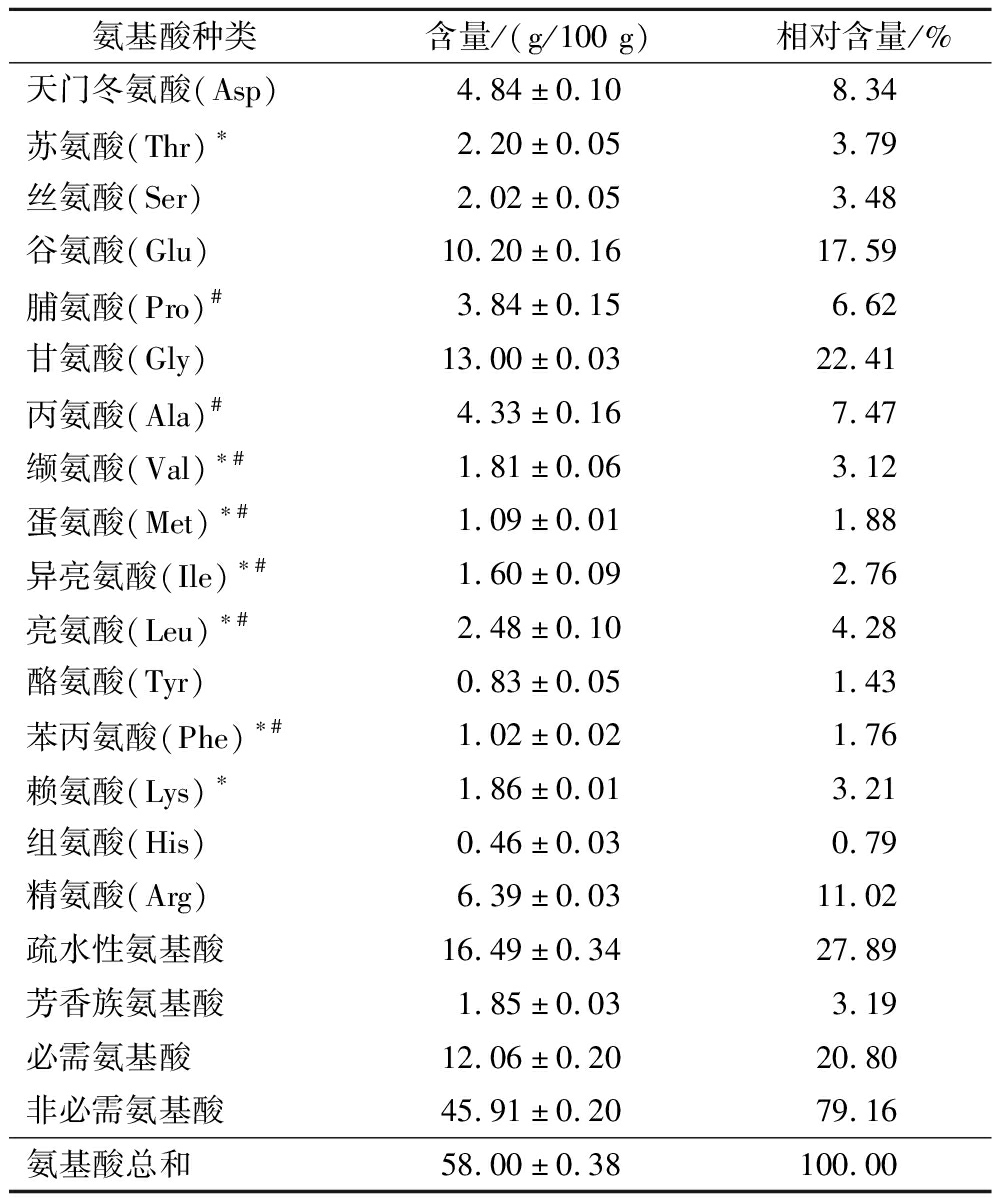
氨基酸种类含量/(g/100 g)相对含量/%天门冬氨酸(Asp)4.84±0.108.34苏氨酸(Thr)∗2.20±0.053.79丝氨酸(Ser)2.02±0.053.48谷氨酸(Glu)10.20±0.1617.59脯氨酸(Pro)#3.84±0.156.62甘氨酸(Gly)13.00±0.0322.41丙氨酸(Ala)#4.33±0.167.47缬氨酸(Val)∗#1.81±0.063.12蛋氨酸(Met)∗#1.09±0.011.88异亮氨酸(Ile)∗#1.60±0.092.76亮氨酸(Leu)∗#2.48±0.104.28酪氨酸(Tyr)0.83±0.051.43苯丙氨酸(Phe)∗#1.02±0.021.76赖氨酸(Lys)∗1.86±0.013.21组氨酸(His)0.46±0.030.79精氨酸(Arg)6.39±0.0311.02疏水性氨基酸16.49±0.3427.89芳香族氨基酸1.85±0.033.19必需氨基酸12.06±0.2020.80非必需氨基酸45.91±0.2079.16氨基酸总和58.00±0.38100.00
注:#表示疏水性氨基酸;*表示必需氨基酸。
2.2 聚丙烯凝胶电泳分析及质谱鉴定
通过凝胶电泳法分析热水提SNBG的亚基组成,结果如图1所示,SNBG是由α链(α1和α2)、γ链(α链三聚体)高分子亚基和小分子肽组成,与郑志鸿等[11]采用酸酶法提取的方格星虫Ⅰ型胶原蛋白组成相似,与传统酸法提取鱼皮明胶相比,热水提取使更多的三螺旋结构解旋产生更多的小分子亚基,更有利于疏水氨基酸暴露,提高明胶两亲性及起泡性,该结果与ZAMORANO-APODACA等[26]对鱼类副产物中的酸溶性胶原蛋白生物特性一致。
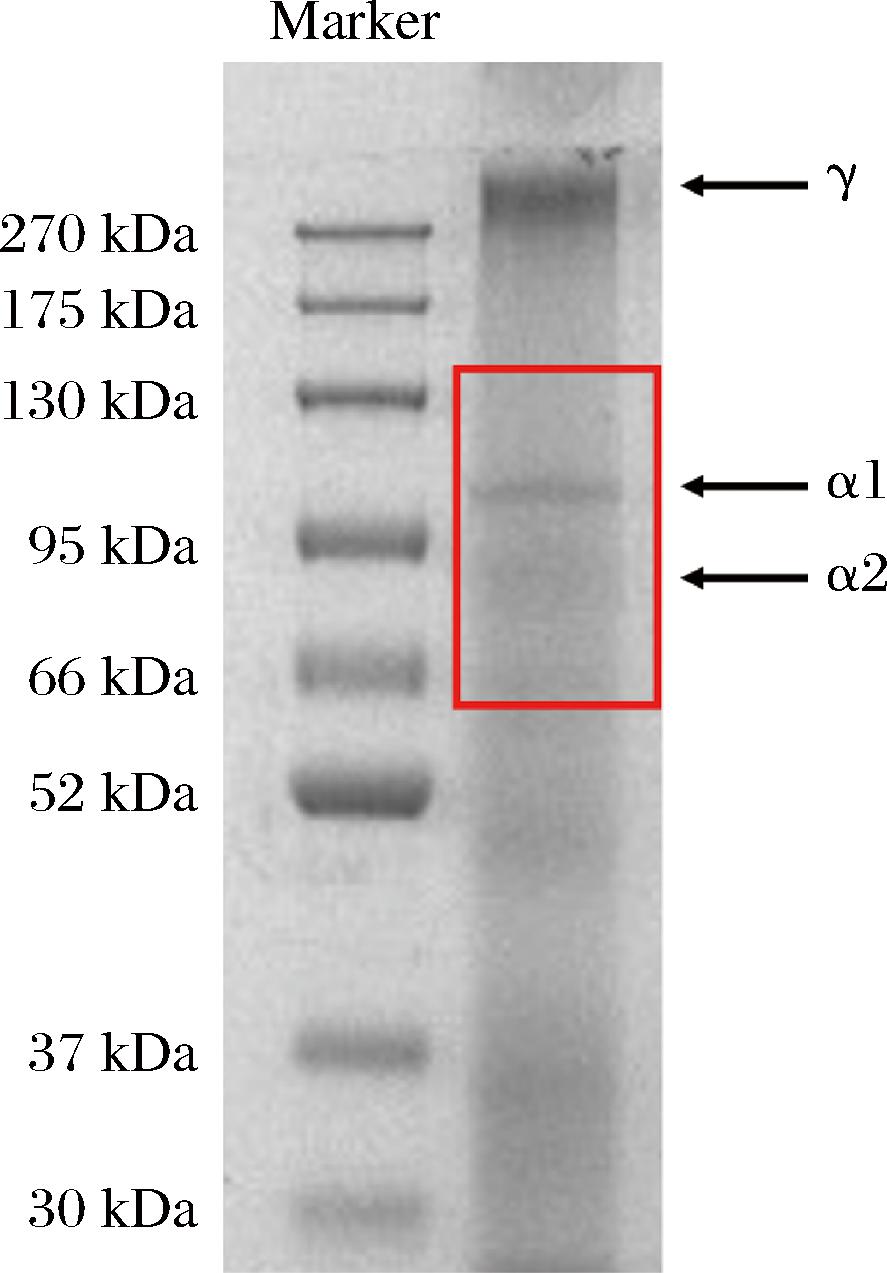
图1 SNBG的SDS-PAGE图谱
Fig.1 SDS-PAGE pattern of SNBG
将目标条带进行蛋白质质谱鉴定,结果如表2所示,根据分子质量大小,SNBG的α1链可能含有肌球蛋白重链Ⅱ型,该结果与CAO等[27]分离的方格星虫体壁蛋白的鉴定结果相似,其余小分子质量蛋白序列也进一步证明,热水高温提取使高分子亚基进一步降解。此外,低分子质量的肽组分具有更多的供电子/氢肽,可与自由基反应产生稳定的体系[28],有助于形成稳定的明胶溶液体系。
表2 SNBG的LC-MS/MS鉴定结果
Table 2 LC-MS/MS identification results of SNBG

序号蛋白序列号蛋白名称分子质量/Da蛋白覆盖率/%1F8TYQ5纤溶蛋白17 032642A0A678R5W4β-肌动蛋白42 089573E9KJQ8肌球蛋白重链 Ⅱ 型(片段)25 616144097339中间丝蛋白69 158105Q9XY85延伸因子 1-α (片段)42 2548
2.3 光谱分析
由图2-a可见,SNBG的最大吸收峰位于230 nm波长左右,应为氨基酸残基、氢键或与螺旋等构象有关的次级键以及肽键C![]() O的n→π*跃迁所致,证明明胶肽链中存在酰胺键;在250~280 nm波长处无明显吸收,说明SNBG的芳香族氨基酸含量较少,提取明胶纯度较高,与上文氨基酸组成含量结果一致。
O的n→π*跃迁所致,证明明胶肽链中存在酰胺键;在250~280 nm波长处无明显吸收,说明SNBG的芳香族氨基酸含量较少,提取明胶纯度较高,与上文氨基酸组成含量结果一致。
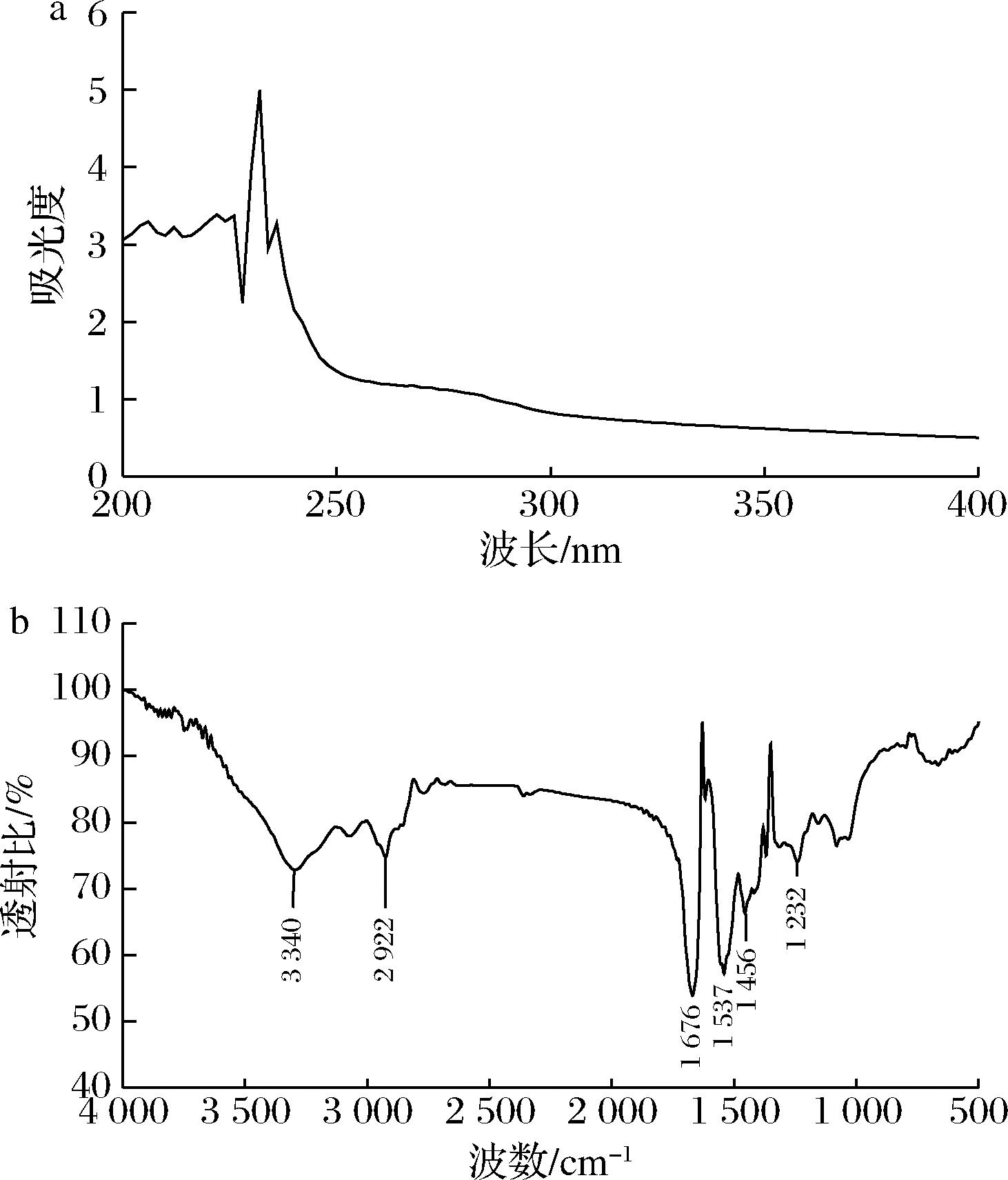
a-紫外全波长扫描;b-傅里叶红外光谱图
图2 SNBG的紫外全波长扫描和傅里叶红外光谱图
Fig.2 Ultraviolet absorption spectrum and Fourier infrared spectrogram of SNBG
傅里叶红外光谱是根据氢键和疏水作用等分子内或分子间相互作用力来评价蛋白质结构差异和变化的常规方法。3 400 cm-1处的峰值归因于酰胺A带的N—H与O—H中氢键的伸缩振动吸收,1 634 cm-1处的峰值归因于明胶的二级结构与蛋白多肽C![]() O拉伸振动、C—N伸展或N—H弯曲导致的特征酰胺I带,1 200~1 300 cm-1处的峰值可能归因于明胶酰胺Ⅲ带的N—H弯曲或C—N伸展振动,主要表征三螺旋结构的完整性[29]。
O拉伸振动、C—N伸展或N—H弯曲导致的特征酰胺I带,1 200~1 300 cm-1处的峰值可能归因于明胶酰胺Ⅲ带的N—H弯曲或C—N伸展振动,主要表征三螺旋结构的完整性[29]。
SNBG吸收峰如图2-b所示,酰胺A带向低波段(3 340 cm-1)移动,表明参与氢键形成的N—H基团较多,有利于凝胶过程中三螺旋结构的形成。SNBG的酰胺I带的峰值向高波段数(1 676 cm-1)处移动,表明SNBG的分子构象被破坏,形成更多分子内氢键,从而增加明胶的无序结构,更有利于明胶中疏水基团的暴露,提高两亲性。据现有报道[27],A酰胺Ⅲ/A 1 450 cm-1的值可以表征三螺旋结构完整性:<1.0表示不完整或不标准的三螺旋结构,而接近1.0表示明胶中含有较多的完整三螺旋结构。SNBG的酰胺Ⅲ带表现在1 232 cm-1处,与1 450 cm-1的比值为0.85,说明热水法提取的SNBG中含有不完整三螺旋结构。
2.4 扫描电子显微镜观察结果
图3-a为肉眼观察状态,质地疏松柔软,表面有微小孔隙,呈乳白色的海绵状;图3-b为扫描电子显微镜下的SNBG微观结构,表面有不规则孔隙,主要是冻干过程中水分升华所致,多处片状光滑结构可能是由大分子聚合物交联形成[30]。
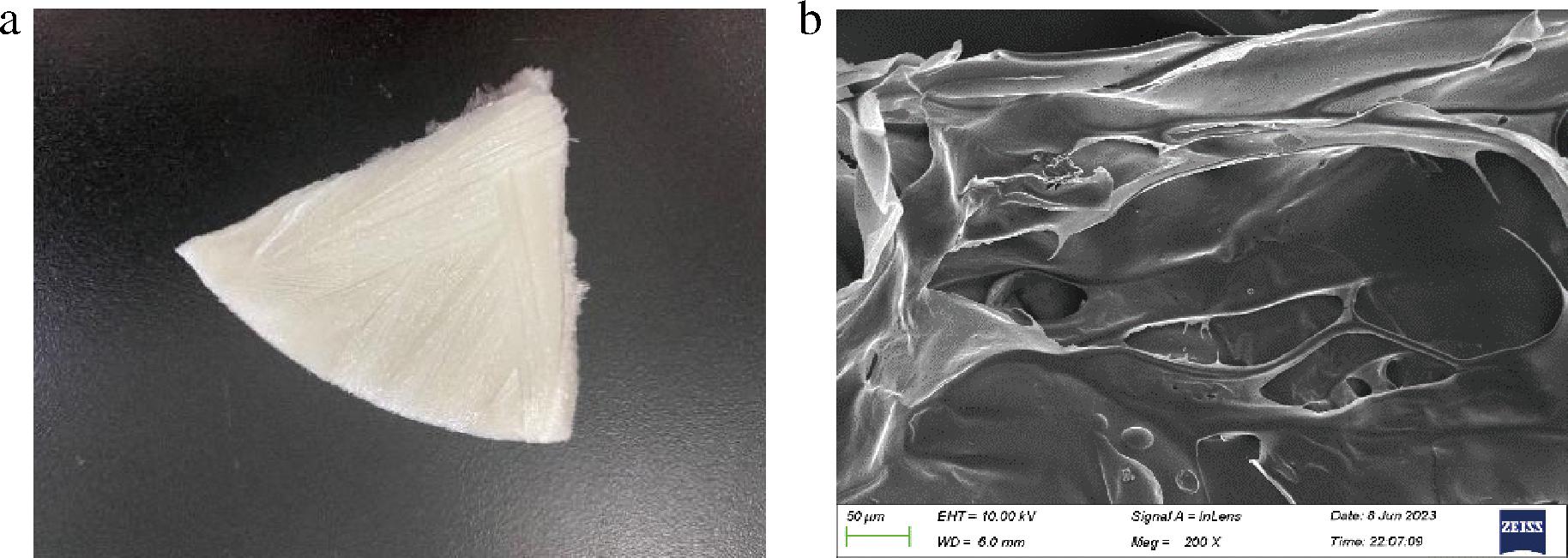
a-肉眼观察图;b-扫描电子显微镜观察图
图3 SNBG肉眼观察图和扫描电子显微镜观察图
Fig.3 Naked eye view and scanning electron microscope view of SNBG
与酸酶法提取河豚胶原蛋白[31]的光滑多孔网状结构相比,热水提取SNBG保留了部分大分子缠绕形成的卷曲结构,以新的片状结构交联,该结果与王珊珊等[32]在70 ℃提取的真鳕鱼鱼骨明胶的变化一致。
2.5 zeta电位测定和差示扫描量热法结果
在明胶溶液体系中,蛋白质的自聚集特性可影响连续相的形成,蛋白质自聚集特性在等电点处最强,弱的静电斥力,使明胶分子相互聚集,更易形成三螺旋结构[33]。为确定SNBG的等电点,测定了不同 pH 值(2~8)SNBG的Zeta电位值,结果如图4-a所示,SNBG在pH 2~4.37范围时带正电荷,在pH 4.37~7范围时带负电荷,等电点为4.37。

a-zeta 电位图;b-DSC曲线图
图4 不同pH值下SNBG的zeta电位图和DSC曲线图
Fig.4 Zeta potential and differential scanning calorimetry curves of SNBG
SNBG的DSC分析结果(图4-b)显示,其变性温度为42.7 ℃。研究表明,明胶分子的变性温度越高,其交联度越高,水产类典型Ⅰ型胶原蛋白类胶原变性温度一般在15~29 ℃,与之相比,SNBG变性温度较高,说明SNBG的热稳定性更好,这可能是由SNBG高含量的Gly-Pro-Hyp骨架影响,其中Pro和Hyp都配备了环状结构,可有效增强明胶结构的稳定性[34]。
2.6 功能特性
FC、FS[35]、EAI、ESI[36]和OHC[37]是明胶在食品加工中的重要参考指标,影响其在食品、制药、医疗等行业的进一步应用。如图5-a所示,pH值对FC和FS的影响相似,pH=4.37时的FC和FS表现较强,分别为90%和30.20%,随着pH的调节至6,FC和FS减弱。EAI和ESI的影响如图5-b所示,在pH为2~6之间呈V型,先减小后增大,并且在pH=4.37处有最低值,分别为98.35 m2/g和19.39 min。OHC与前者趋势相同,如图5-c所示,在等电点(isoelectric point,pI)处的OHC最低值为(11.3±0.59) g/g,当pH值为8时的OHC最大值为(15.56±1.07) g/g,大于猪皮明胶(13.14 g/g)[38]的持油性,该结果表明SNBG在pI处FC和FS表现良好,但EAI、ESI和OHC表现较差,主要原因是明胶溶液在pI处的蛋白低溶解度限制了蛋白质在水/空气界面的扩散,明胶溶液极性减小,明胶分子电荷减少,水化层厚度变薄,乳化颗粒间静电斥力减弱,导致明胶溶液不稳定,随着明胶大分子疏水基团暴露,溶液的表面张力减弱,形成界面,故起泡性增强,而乳化性减弱。尹朝阳等[2]发现,较高的提取温度会使明胶的亚基组分和分子构象显著降解,导致疏水基团的暴露,从而提高明胶的两亲性以及明胶分子在油滴表面的吸附性,使得油滴尺寸减小,持油能力显著增加。如图5-d所示,OHC和EAI呈显著正相关,EAI和FC呈显著负相关, ESI和FS呈显著正相关。蛋白分子质量越低,其发泡能力越低,由于低分子质量的蛋白质/肽无法在空气-水界面上重新排列结构,因此不能形成泡沫;蛋白低分子质量却可以使疏水基团充分暴露,增加蛋白溶液的表面张力,因此SNBG的EAI和ESI表现更强。
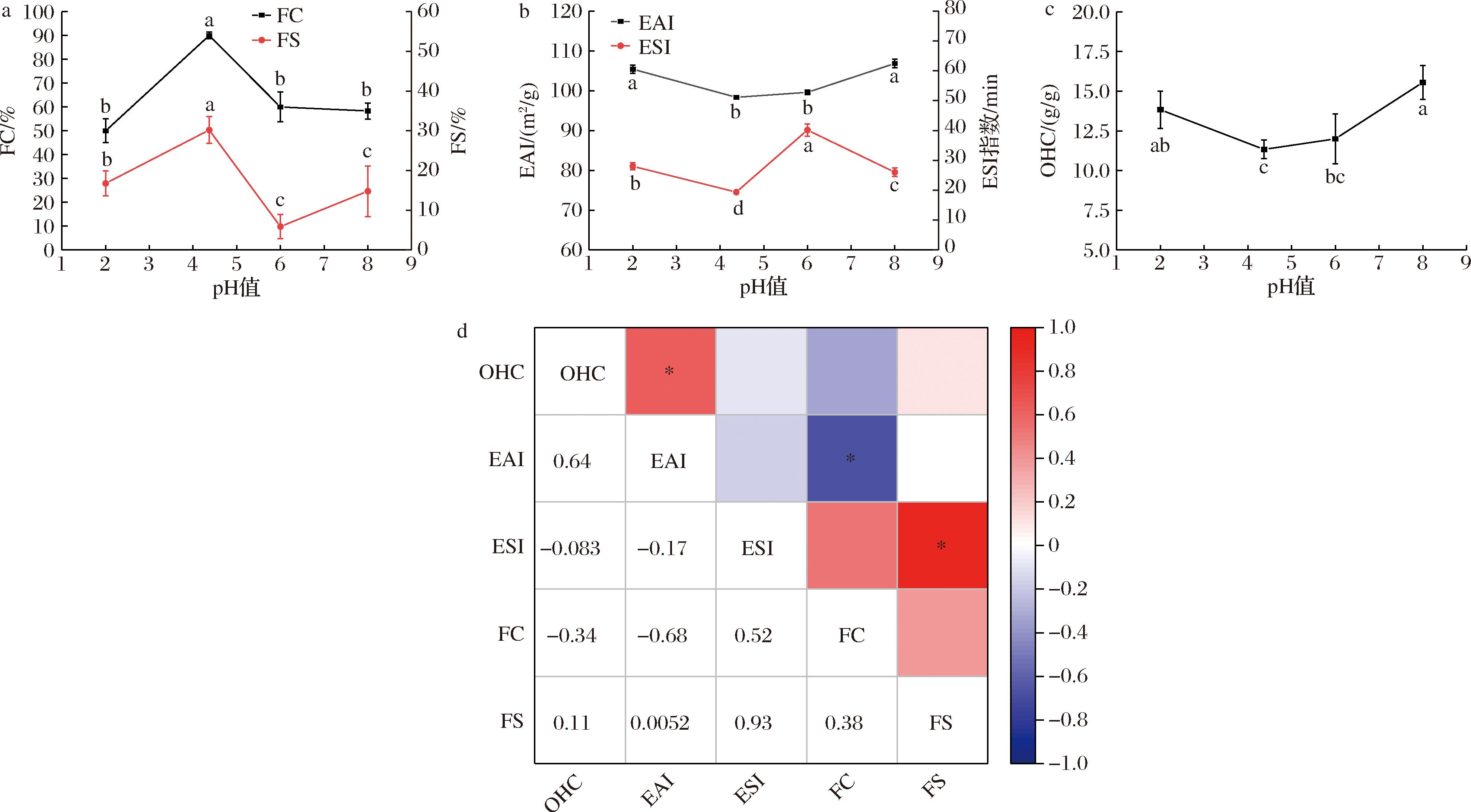
a-FC和FS;b-EAI和ESI;c-OHC;d-功能特性的相关系数
图5 SNBG在不同pH值下,FC和FS、EAI和ESI、OHC、功能特性的相关系数图
Fig.5 SNBG at different pH levels, foam capacity and foam stability, emulsification activity index and emulsification stability index, oil holding capacity and correlation coefficient plot for functional properties
注:同组数据肩标不同,具有显著性差异(P<0.05);含相同字母则无显著性差异(下同);图5-d中*表示具有显著性差异。
2.7 DPPH自由基清除率和体外抑制酪氨酸酶活力的测定
由图6可知,在质量浓度为1~5 mg/mL范围内,其清除率为11.75%~30.46%,抑制酪氨酸酶活力趋势相同,其抑制率为16.34%~78.61%,二者均呈浓度依赖关系,因此抗氧化活性与抑制酪氨酸酶活力呈正相关关系。据现有报道,DPPH自由基清除率与疏水性氨基酸含量相关,芳香族氨基酸中Tyr有着较强的自由基清除能力[38],酪氨酸残基可以对酪氨酸酶形成竞争性抑制[39]。极性氨基酸中Ser、Asp残基的存在,可能与黑色素生成过程中的中间产物半醌基形成共轭而进一步抑制黑色素的形成[40],因此随着SNBG质量浓度的增加,其抑制酪氨酸酶活力增强。
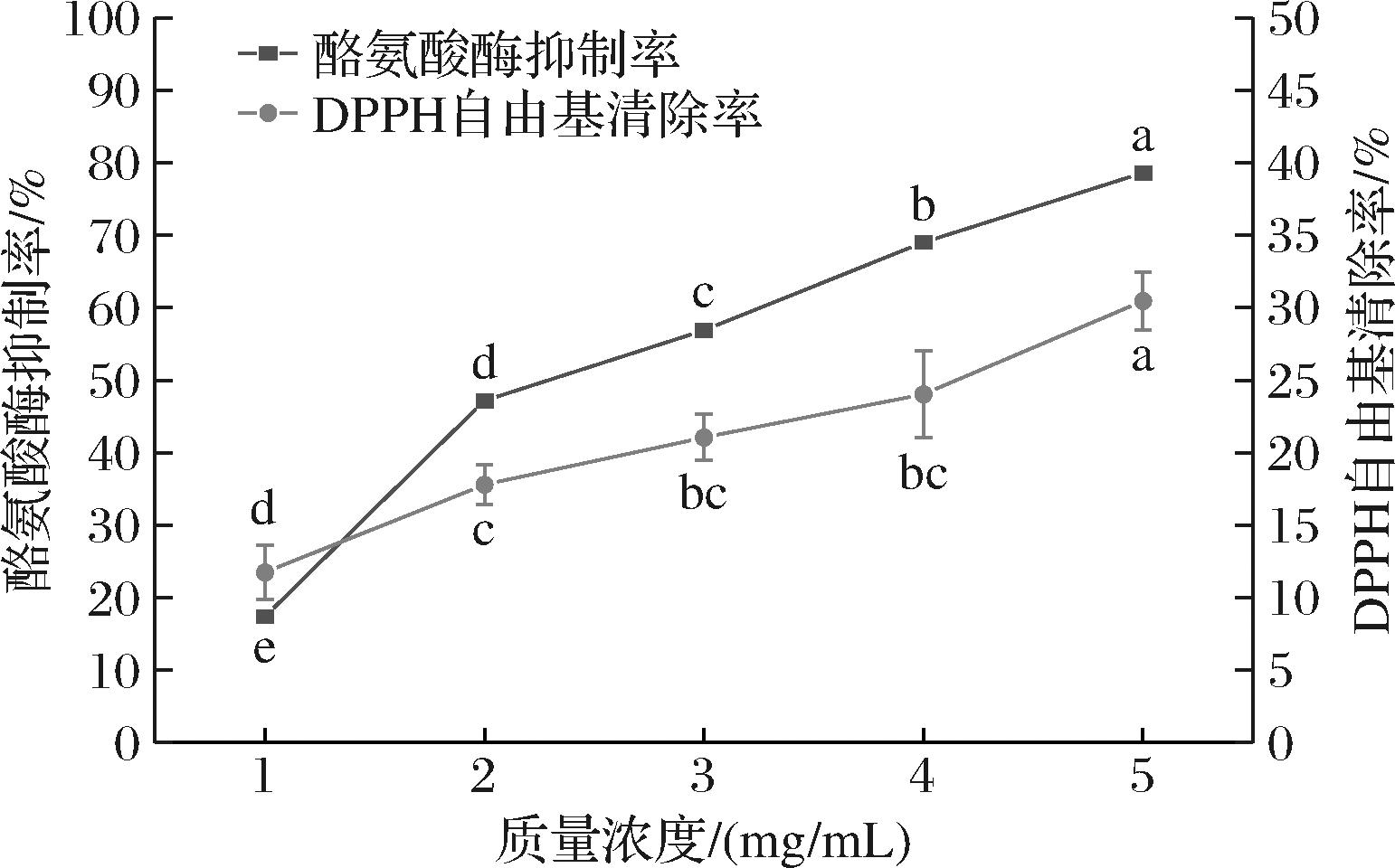
图6 SNBG的酪氨酸酶抑制活性和DPPH自由基清除率
Fig.6 Tyrosinase inhibitory activity and DPPH free radical scavenging of SNBG
3 结论
本文采用热水法提取SNBG,对SNBG结构特性及功能特性进行研究得出:SNBG富含Gly、Pro,亚氨基酸含量符合明胶加工特性,其27.89%的疏水性氨基酸和3.19%的芳香族氨基酸相对含量表现出抗氧化和抑制酪氨酸酶活力的潜力。通过蛋白二级结构表征,聚丙烯凝胶电泳、质谱鉴定分析和扫描电镜观察证实了热水提取SNBG具有部分三螺旋结构,大部分高分子亚基已降解为小分子肽并以光滑片状结构重新交联;SNBG热变性温度为42.70 ℃,PI为4.37。10 mg/mL的SNBG,pH值为6时,EAI、ESI、FC、FS和OHC分别为99 m2/g、40 min、60%、5.88%和12.67 g/g;SNBG质量浓度为5 mg/mL时,抗氧化性和抑制酪氨酸酶活力分别为30.46%和78.61%。综上所述,SNBG部分三螺旋结构解旋以光滑片状结构交联,具有抗氧化和酪氨酸酶抑制活性且功能特性较好,该研究可为SNBG在食品及化妆品领域的应用提供理论依据。
[1] 王珊珊, 刘楠, 孙永, 等.水产蛋白源明胶的研究进展[J].食品研究与开发, 2020, 41(10):207-213.WANG S S, LIU N, SUN Y, et al.The research progress of aquatic protein-derived gelatins[J].Food Research and Development, 2020, 41(10):207-213.
[2] 尹朝阳, 石文琪, 李卫东, 等.水产品源明胶的制备工艺、理化性质及结构的研究进展[J].食品研究与开发, 2023, 44(7):193-203.YIN Z Y, SHI W Q, LI W D, et al.Preparation technology, physicochemical properties and structure of aquatic product-derived gelatin[J].Food Research and Development, 2023, 44(7):193-203.
[3] 云观, 郭朝阳, 张萌.胶原蛋白提取及检测方法研究进展[J].山东化工, 2022, 51(7):70-72.YUN G, GUO C Y, ZHANG M.Research progress on extraction methods and detection methods of collagen[J].Shandong Chemical Industry, 2022, 51(7):70-72.
[4] 杨慧娟, 赵巧灵, 王萍亚, 等.鱼明胶替代哺乳动物明胶的研究进展[J].中国食品学报, 2021, 21(10):334-342.YANG H J, ZHAO Q L, WANG P Y, et al.Research progress of fish gelatin as a substitute for mammalian gelatin[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(10):334-342.
[5] 张婷, 许嘉敏, 黄淑丹, 等.鱼皮明胶在食品加工业中的应用[J].水产学报, 2022, 46(11):2241-2255.ZHANG T, XU J M, HUANG S D, et al.Application progress of fish skin gelatins in food processing industry[J].Journal of Fisheries of China, 2022, 46(11):2241-2255.
[6] 胡熠, 唐艳, 周伟, 等.可食性明胶复合膜及其在食品包装上的应用研究进展[J].食品工业科技, 2017, 38(20):341-346.HU Y, TANG Y, ZHOU W, et al.Research progress of composite edible gelatin films and its application in food packaging[J].Science and Technology of Food Industry, 2017, 38(20):341-346.
[7] 王灵霜, 肖波, 杨潇.载药黏附性高分子水凝胶在创伤修复中的应用研究进展[J].药学进展, 2022, 46(7):527-534.WANG L S, XIAO B, YANG X.Research progress in application of drug-loaded polymeric adhesive hydrogels in wound healing[J].Progress in Pharmaceutical Sciences, 2022, 46(7):527-534.
[8] 张珊, 赵华, 邓颖妹, 等.化妆品增稠剂的流变学特性研究进展[J].当代化工, 2014, 43(4):580-583;610.ZHANG S, ZHAO H, DENG Y M, et al.Research progress in rheological properties of cosmetic thickeners[J].Contemporary Chemical Industry, 2014, 43(4):580-583;610.
[9] 李凤鲁, 孔庆兰, 史贵田, 等.中国沿海方格星虫属(星虫动物门)的研究[J].青岛海洋大学学报, 1990, 20(1):93-99.LI F L, KONG Q L, SHI G T, et al.Studies on the genus Sipunculus (Sipuncula) off the China coasts[J].Journal of Ocean University of Qingdao, 1990, 20(1):93-99.
[10] 葛雅辉, 刘欣, 唐于平, 等.星虫动物门活性物质及药理作用研究[J].氨基酸和生物资源, 2015, 37(3):7-14.GE Y H, LIU X, TANG Y P, et al.Progress of active substance and pharmacological activity in sipuncula[J].Amino Acids &Biotic Resources, 2015, 37(3):7-14.
[11] 郑志鸿, 章超桦, 林海生, 等.方格星虫酶解物对小鼠皮肤创伤修复的作用[J].广东海洋大学学报, 2020, 40(1):97-103.ZHENG Z H, ZHANG C H, LIN H S, et al.Promoting the skin wound healing in mice using Sipunculus nudus hydrolysate[J].Journal of Guangdong Ocean University, 2020, 40(1):97-103.
[12] 柏昌旺, 章超桦, 林海生, 等.响应面法优化制备牡蛎短肽工艺[J].广东海洋大学学报, 2019, 39(6):85-92.BAI C W, ZHANG C H, LIN H S, et al.Optimization of preparation process of oyster oligopeptides by response surface methodology[J].Journal of Guangdong Ocean University, 2019, 39(6):85-92.
[13] 郑志鸿. 方格星虫促小鼠皮肤创伤愈合及作用机制的研究[D].湛江:广东海洋大学, 2019.ZHENG Z H.Study of Sipunculus nudus accelerating wound healing of mice skin and its mechanism[D].Zhanjiang:Guangdong Ocean University, 2019.
[14] 沈明娟, 李云嵌, 杨曦, 等.核桃主要致敏蛋白Jugr1的分离纯化、鉴定与分析[J].食品科学, 2023, 44(20):127-135.SHEN M J, LI Y Q, YANG X, et al.Isolation, purification, identification, and analysis of Jugr1, a main allergenic protein in walnut[J].Food Science, 2023, 44(20):127-135.
[15] 姚行行, 郭妍, 庄永亮.云南鲷鱼骨胶原蛋白的制备及其理化性质[J].食品科学, 2018, 39(13):35-40.YAO H H, GUO Y, ZHUANG Y L.Preparation and physicochemical properties of collagen from bone of Yunnan bream[J].Food Science, 2018, 39(13):35-40.
[16] 杨子帆, 张科, 刘莹, 等.鲟鱼和草鱼鱼鳔酶溶性胶原蛋白的理化性质比较[J].食品工业科技, 2021, 42(15):27-32.YANG Z F, ZHANG K, LIU Y, et al.Comparison of physicochemical properties of pepsin-soluble collagens from swim bladders of sturgeon(Acipenser schrenckii) and grass carp(Ctenopharyngodon idella)[J].Science and Technology of Food Industry, 2021, 42(15):27-32.
[17] 李晓敏, 杨晨宇, 邓云, 等.日本鳗鱼皮胶原蛋白提取工艺优化及理化性质分析[J].上海海洋大学学报, 2023, 32(6):1144-1154.LI X M, YANG C Y, DENG Y, et al.Optimization of Japanese eel skin collagen extraction process and analysis of physicochemical properties[J].Journal of Shanghai Ocean University, 2023, 32(6):1144-1154.
[18] 冯建慧, 吴晓洒, 蔡路昀, 等.鲢鱼鱼皮和鱼骨胶原蛋白的提取及理化性质分析[J].中国食品学报, 2017, 17(7):102-108.FENG J H, WU X S, CAI L Y, et al.Extraction and characterization of collagens from skin and bone of silver carp[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(7):102-108.
[19] 鲍虹蕾, 杨敏, 刘文文, 等.乙酸溶胀-挤压提取对罗非鱼真皮胶原蛋白理化性质的影响[J].食品科学, 2017, 38(19):100-106.BAO H L, YANG M, LIU W W, et al.Physical and chemical properties of tilapia(Oreochromis niloticus) dermis collagen acetic acid swelling and extrusion[J].Food Science, 2017, 38(19):100-106.
[20] LI Y S, YANG L H, WU S J, et al.Structural, functional, rheological, and biological properties of the swim bladder collagen extracted from grass carp (Ctenopharyngodon idella)[J].LWT, 2022, 153:112518.
[21] 余东华, 徐志宏, 魏振承, 等.不同分子质量段猪皮胶原蛋白酶解物乳化性质[J].食品科学, 2011, 32(15):10-13.YU D H, XU Z H, WEI Z C, et al.Emulsifying properties of pigskin collagen peptides with different molecular weights[J].Food Science, 2011, 32(15):10-13.
[22] HUANG T, TU Z C, SHANGGUAN X C, et al.Rheological behavior, emulsifying properties and structural characterization of phosphorylated fish gelatin[J].Food Chemistry, 2018, 246:428-436.
[23] HU Z Z, MA T X, SHA X M, et al.Improving tyrosinase inhibitory activity of grass carp fish scale gelatin hydrolysate by gastrointestinal digestion:Purification, identification and action mechanism[J].LWT, 2022, 159:113205.
[24] 程勇杰, 陈小伟, 张沙沙, 等.柘树植物酵素中氨基酸分析及抗氧化性能研究[J].食品工业科技, 2018, 39(6):1-7;12.CHENG Y J, CHEN X W, ZHANG S S, et al.Analysis of amino acids and in vitro antioxidant activity of Cudrania tricuspidata Jiaosu[J].Science and Technology of Food Industry, 2018, 39(6):1-7;12.
[25] 傅宝尚, 侯红漫, 张公亮, 等.刺参体壁酶促溶性胶原蛋白的热变性[J].食品科学, 2022, 43(10):29-35.FU B S, HOU H M, ZHANG G L, et al.Thermal denaturation of pepsin-solubilized collagen from sea cucumber body wall[J].Food Science, 2022, 43(10):29-35.
[26] ZAMORANO-APODACA J C, GARC A-SIFUENTES C O, CARVAJAL-MILL
A-SIFUENTES C O, CARVAJAL-MILL N E, et al.Biological and functional properties of peptide fractions obtained from collagen hydrolysate derived from mixed by-products of different fish species[J].Food Chemistry, 2020, 331:127350.
N E, et al.Biological and functional properties of peptide fractions obtained from collagen hydrolysate derived from mixed by-products of different fish species[J].Food Chemistry, 2020, 331:127350.
[27] CAO Y P, LU X L, DAI Y P, et al.Proteomic analysis of body wall and coelomic fluid in Sipunculus nudus[J].Fish &Shellfish Immunology, 2021, 111:16-24.
[28] FENG X, DAI H J, MA L, et al.Effect of microwave extraction temperature on the chemical structure and oil-water interface properties of fish skin gelatin[J].Innovative Food Science &Emerging Technologies, 2021, 74:102835.
[29] AN Y Q, XIONG S B, LIU R, et al.The effect of cross-linking degree on physicochemical properties of surimi gel as affected by MTGase[J].Journal of the Science of Food and Agriculture, 2021, 101(15):6228-6238.
[30] 黄丽金, 闻怡凡, 罗美玲, 等. 提取温度对乌鱼鱼鳞明胶功能性质和结构特性的影响[J].食品工业科技, 2024, 45(9): 83-90.HUANG L J, WEN Y F, LUO M L, et al. Effect of extraction temperature on the functional and structural properties of mullet scale gelatin[J]. Science and Technology of Food Industry, 2024, 45(9): 83-90.
[31] 徐卉, 顾依梦, 陶宁萍, 等.河豚鱼皮胶原蛋白理化特性和体外抗氧化性能[J].食品与发酵工业, 2023, 49(7):225-231.XU H, GU Y M, TAO N P, et al.Physicochemical properties and in vitro antioxidant activity of collagen in puffer fish skin[J].Food and Fermentation Industries, 2023, 49(7):225-231.
[32] 王珊珊, 卢玉坤, 杨霞, 等.提取温度与提取时间对真鳕鱼骨明胶理化性质的影响[J].食品工业科技, 2013, 34(13):53-57.WANG S S, LU Y K, YANG X, et al.Properties of gelatin from the bone of Pacific cod (Gadus macrocephalus) as influenced by extraction temperature and time[J].Science and Technology of Food Industry, 2013, 34(13):53-57.
[33] 史睿, 何静, 吉日木图.超声波辅助提取骆驼皮胶原蛋白的工艺及结构表征[J].中国食品学报, 2022, 22(2):213-223.SHI R, HE J, JI R.Ultrasonic-assisted extraction and structure characterization of collagen from camel skin[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(2):213-223.
[34] KONIECZNY P, TOMASZEWSKA-GRAS J, ANDRZEJEWSKI W, et al.DSC and electrophoretic studies on protein denaturation of Anodonta woodiana (Lea, 1834)[J].Journal of Thermal Analysis and Calorimetry, 2016, 126(1):69-75.
[35] 杨晖, 马良, 于玮, 等.兔皮明胶功能特性及其影响因素[J].食品科学, 2016, 37(23):7-12.YANG H, MA L, YU W, et al.Functional characteristics and influencing factors of rabbit skin gelatin[J].Food Science, 2016, 37(23):7-12.
[36] 王琪, 张延镇, 郭前婉, 等.水/水乳液的形成、稳定及功能特性研究进展[J].中国食品学报, 2022, 22(6):333-343.WANG Q, ZHANG Y Z, GUO Q W, et al.Research progress in the formation, stabilization and functional properties of water-in-water emulsion[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(6):333-343.
[37] 杨恒, 时海波, 邹烨, 等.超声波辅助酸提鸡肺胶原蛋白的持油性和乳化性[J].江苏农业学报, 2019, 35(4):940-947.YANG H, SHI H B, ZOU Y, et al.The oil-holding capacity and emulsifying properties of collagen from chicken lung extracted by ultrasonic-assisted acid method[J].Jiangsu Journal of Agricultural Sciences, 2019, 35(4):940-947.
[38] 黄正芬, 夏宁, 滕建文, 等.猪皮蛋白粉的理化和功能特性研究[J].食品科技, 2014, 39(6):145-150.HUANG Z F, XIA N, TENG J W, et al.Physicochemical and functional properties of pigskin protein powder[J].Food Science and Technology, 2014, 39(6):145-150.
[39] 吴燕荣. 具有美白活性的明胶肽的制备及应用特性研究[D].无锡:江南大学, 2017.WU Y R.Preparation and application of gelatin peptides with whitening activity[D].Wuxi:Jiangnan University, 2017.
[40] PENG Z Y, WANG G C, ZENG Q H, et al.A systematic review of synthetic tyrosinase inhibitors and their structure-activity relationship[J].Critical Reviews in Food Science and Nutrition, 2022, 62(15):4053-4094.