随着食品工业的快速发展以及环境可持续发展要求的提高,低成本、高效率、无污染地处理食品工业废水成为当前的研究热点。我国食品行业产品种类繁多,如酿造产品、果蔬制品、肉制品、乳制品、豆制品等,因此食品废水来源十分广泛。由于食品废水的成分复杂且种类繁多,如果不经处理直接排放将会带来需氧有机物污染、富营养化污染、无机物(酸、碱、盐)污染、恶臭等问题,给环境带来巨大的污染,同时也会加剧可利用水资源的短缺。目前,大多食品废水富含蛋白质、碳水化合物、脂肪、尿素、氨氮、P等物质[1-3],因此,处理食品废水需要将大量营养物分离,或者氧化。常见的食品废水处理法主要有物理法、化学法、生物法等3种方法[4-5]。离心、过滤等物理法虽然成本较低、操作简便,但是常用于分离废水中不溶解的悬浮固体和漂浮物质。化学法可以去除食品废水中大部分难溶解的营养性物质,但会带来新的化学试剂污染。生物法指通过微生物将废水中的各种微细悬浮物和已经溶解的物质吸附或者降解,进而去除水中化合物[6-8]。
与传统的食品废水净化处理方法相比,生物法具有成本低、效率高、无污染、可生物降解等优点。目前,生物法主要采用细菌和丝状真菌[9-12]。其中细菌主要包含硝化细菌属、反硝化细菌属、芽孢杆菌属、假单胞菌属等6个属共50多种细菌。多种细菌复合有利于处理废水中多种营养物,达到去除总氮(total nitrogen,TN)、总磷(total phosphorus,TP)、降低化学需氧量(chemical oxygen demand,COD)的效果。此外,多种丝状真菌也广泛存在于废水处理的环节中。这是因为丝状真菌在液体培养环境下会出现菌丝体环绕,形成菌丝球。菌丝球不但具有生物活性高、沉降速度快、易于固液分离的特点[13],而且能产生降解废水中化学物质的多种酶[14],有利于简化废水处理工艺。如ZHANG等[15]以黑曲霉Y3菌丝球为生物质载体,固定化苯胺降解菌、钙酸不动杆菌JH-9和COD快速降解菌的混合培养,对工业废水中苯胺和COD生物去除量分别为0.9和1 200 mg/L。而MOHD HANAFIAH等[16]使用Ganoderma lucidum菌株可以对生活废水中的COD和NH3-N有较好的去除效果,COD和NH3-N去除率分别为96.0%和93.2%。此外,还有研究人员将菌丝球投加于藻类中,并将菌-藻体作为载体形成的藻-真菌颗粒污泥系统用于城市废水的净化处理,城市废水废水中有机物、TN和TP的平均去除率分别为97.8%、80.0%和84.4%[17]。在多种丝状真菌菌丝球中,黑曲霉菌丝球由于其培养成本较低、生物活力较好、菌丝结构稳定、易于形成菌丝球的特点[18-19],已经被用做丝状真菌菌丝球形成机理的模式菌株。黑曲霉菌丝球属于凝聚型,即孢子在接种的6~8 h内聚集,然后萌发成菌丝,相互缠绕,进而形成菌丝球[20]。黑曲霉菌丝球可以吸附废水中重金属和悬浮颗粒以及不溶性物质,目前已经广泛应用于重金属废水和印染废水的净化处理[21]。
微藻因富含多不饱和脂肪酸、蛋白质、多糖、维生素、β-胡萝卜素和矿物质等营养物质[22-24],在食品领域非常具有潜力。例如,微藻已经成为单细胞蛋白(single cell protein,SCP)的重要来源[25-26]。微藻还具有培养条件简单、光合作用效率高等优点。其中,小球藻的繁殖速度快、广泛用于食品原料的生产,成为目前主要研究和应用的藻种[27]。本研究将小球藻与黑曲霉菌丝球共培养,利用黑曲霉菌丝的吸附性将小球藻固定在菌丝球上,去除食品废水中COD、TN、TP,有效改善食品废水的水质。该方法具有微生物生物量收获步骤简便、处理废水效果好、效率高、成本低等优点,为菌丝球-微藻共培养在食品废水处理中的应用提供理论基础。
1 材料与方法
1.1 材料与设备
黑曲霉(Aspergillus niger)ATCC 1015,美国典型微生物保藏中心;普通小球藻(Chlorella vulgaris)FACHB-8,中国科学院淡水藻种库;豆制品废水,上海清美绿色食品有限公司;K2HPO4·3H2O、MgSO4·7H2O、CaCl2·2H2O、柠檬酸、柠檬酸铁铵、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、NaNO3、Na2CO3、KNO3、KH2PO4、FeSO4·7H2O、H3BO3 、KCl、MnCl2·4H2O、ZnSO4·7H2O、Na2MoO4·2H2O、CuSO4·5H2O、CoCl2·6H2O、KI, 均为分析纯,国药化学试剂上海公司;葡萄糖、马玲薯葡萄糖琼脂(potato dextrose agar,PDA)培养基, 上海源叶生物科技有限公司;酵母抽提物、蛋白胨,赛默飞世尔科技公司。
722S紫外分光光度计,上海精密科学仪器有限公司;THZ-312全温振荡摇床,上海精宏实验设备有限公司;DR 6000紫外可见光分光光度计、DRB 200消解仪,哈希水质分析仪器(上海)有限公司。
1.2 培养基与溶液
PDA培养基:称取3.7 g PDA固体溶于100.0 mL去离子水,121 ℃、15 min灭菌后备用。
改良BG-11培养基配方(g/L):葡萄糖2.0、K2HPO4·3H2O 0.04、MgSO4·7H2O 0.075、CaCl2·2H2O 0.036、柠檬酸0.006、柠檬酸铁铵0.006、EDTA 0.001、NaNO3 1.5、Na2CO3 0.02、微量元素混合物A(1.0 mL),115 ℃、20 min灭菌后备用。
培养基A(g/L):KNO3 1.0、KH2PO4 0.075、K2HPO4 0.1、MgSO4·7H2O 0.5、CaCl2·4H2O 0.062 5、FeSO4·7H2O 0.01、酵母抽提物 0.5、微量元素混合物A(1.0 mL),经过115 ℃、20 min高温灭菌后备用。
肉汤培养基(g/L):酵母抽提物10.0、蛋白胨10.0、NaCl 5.0,经过115 ℃、20 min高温灭菌后备用。
察氏培养基(g/L):NaNO3 30.0、K2HPO4·3H2O 10.0、KCl 5.0、MgSO4·7H2O 5.0、FeSO4·7H2O 0.1、葡萄糖 25.0,调节pH值为5.6,经过115 ℃、20 min高温灭菌后备用。
CCM培养基(co-culture medium,g/L):葡萄糖10.0、NH4Cl 2.0、KH2PO4 2.0、MgSO4·7H2O 0.5、FeSO4·7H2O 0.02,微量元素混合物A(1.0 mL),115 ℃、20 min灭菌后备用。
微量元素混合物A(g/L):H3BO3 2.86、MnCl2·4H2O 1.81、ZnSO4·7H2O 0.222、Na2MoO4·2H2O 0.39、CuSO4·5H2O 0.079、CoCl2·6H2O 0.05,用1 mol/L盐酸溶液调pH值为7.1。
人工复配废水(g/L):NaHCO3 0.2、MgSO4·7H2O 0.01、FeSO4·7H2O 0.01、CaCl2·2H2O 0.01、微量元素B(1.0 mL),不同浓度的人工复配废水的葡萄糖、乙酸钠、NH4Cl、KH2PO4添加量如表1所示,所有营养废水115 ℃、20 min灭菌后备用。
表1 人工复配废水中的葡萄糖、乙酸钠、NH4CI、KH2PO4的质量 单位:g/L
Table 1 Concentrations of glucose, sodium acetate, NH4Cl and KH2PO4 in artificial wastewater
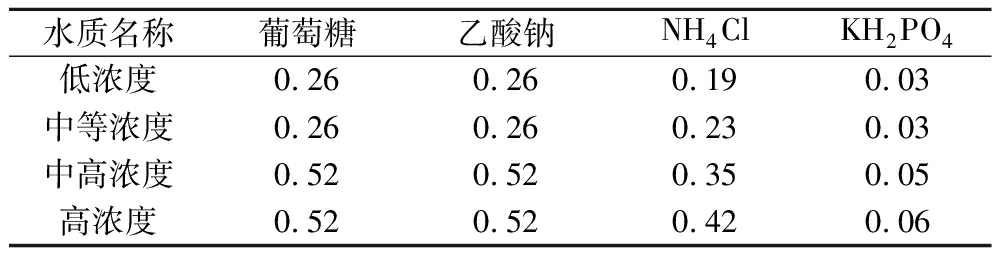
水质名称葡萄糖乙酸钠NH4ClKH2PO4低浓度0.260.260.190.03中等浓度0.260.260.230.03中高浓度0.520.520.350.05高浓度0.520.520.420.06
葡萄糖溶液(g/L):称取20.0 g葡萄糖溶于100.0 mL去离子水, 115 ℃、20 min灭菌后备用。
微量元素混合物B(g/L):H3BO3 0.15、CuSO4·5H2O 0.03、KI 0.18、MnCl2·4H2O 0.12、Na2MoO4·2H2O 0.06、ZnSO4·7H2O 0.12、CoCl2·6H2O 0.15、FeSO4·7H2O 10、CaCl2·2H2O 10、EDTA 10.0。
1.3 普通小球藻培养
将小球藻划线于固体培养基A,在25 ℃、光照条件下培养7 d。进而接种到装有100 mL改良BG-11培养基的三角瓶(250 mL)内,在100 r/min、25 ℃的条件下培养7~14 d。如需转接,以20%的接种量转接至新鲜BG-11培养基中,仍以上述条件培养。
1.4 黑曲霉孢子液的制备
使用一次性接种环(10 μL,ABS材质)将冷藏的黑曲霉孢子接种至PDA平板上,后放入28 ℃恒温培养箱中,培养7 d。将10 mL无菌水倒入黑曲霉的PDA平板上,轻轻振摇后使用涂布棒(三角棒头20 mm,玻璃,6 mm × 200 mm)进行刮取,然后将刮取孢子后的溶液倒入灭好菌的250 mL锥形瓶中。重复3次,即得到高浓度的孢子悬液,在锥形瓶中加10~20 mL无菌水稀释并超声振荡1 min,使孢子均匀分布,在波长620 nm处用可见分光光度计测定孢子液的吸光度。
1.5 黑曲霉菌丝球的制备
取1 mL黑曲霉孢子悬浮液(1.26 OD620)接种至100 mL的改良BG-11培养基、培养基A、肉汤培养基、察氏培养基、CCM培养基中,28 ℃、150 r/min摇床中培养48 h后,观察其是否形成均一的菌丝球,收获后用去离子水洗涤2次。
1.6 黑曲霉孢子液或者菌丝球与普通小球藻共培养
孢子液与普通小球藻共培养:取20 mL新鲜藻液于50 mL离心管,4 ℃,8 000 r/min离心5 min,弃上清液,将离心后的藻细胞加入改良BG-11培养基、培养基A、CCM培养基中,在波长680 nm处测定吸光度,再取稀释好的孢子悬浮液(1.26 OD620)加入培养基中。培养温度28 ℃,0~24 h,转速130 r/min,24~48 h,转速150 r/min,共培养24 h后再添加200 g/L葡萄糖溶液5 mL至培养基内,48 h后收集吸附了小球藻的菌丝球,在680 nm处测定溶液的吸光度,并按公式(1)计算收获率。
收获率![]()
(1)
菌丝球吸附普通小球藻:按1.5节的黑曲霉菌丝球的制备方法制备菌丝球,再选取不同培养基形成的菌丝球(Ф=2~8 mm)与100 mL普通小球藻液(6.48 × 1010个/L)混合。28 ℃,200 r/min,摇床培养24 h后收集吸附小球藻的菌丝球,在680 nm处测定溶液的吸光度,并按公式(1)计算收获率。
1.7 COD、TN、TP的检测方法
COD的测定方法参考HJ/T 399—2007《水质 化学需氧量的测定 快速消解分光光度法》;TN的测定方法参考HJ 636—2012《水质 总氮的测定 碱性过硫酸钾消解紫外分光光度法》;TP的测定方法参考GB 11893—1989《水质 总磷的测定 钼酸铵分光光度法》。
1.8 营养废水的配制与净化
按表1的废水配方配制不同浓度的废水,分别取100 mL 废水于250 mL三角瓶内,添加20个吸附了普通小球藻的不同直径的菌丝球进行培养。28 ℃,150 r/min,培养2 d,间隔24 h取水样检测其中的COD、TN、TP变化。
1.9 食品废水净化处理
取100 mL食品废水于250 mL三角瓶内,添加吸附了普通小球藻的不同直径的菌丝球和单一菌丝球于瓶中,进行培养净化实验。28 ℃,150 r/min,培养2 d,间隔24 h取水样检测其中的COD、TN、TP。
1.10 数据分析
本研究所有实验均进行3次平行实验,利用Microsoft 2016绘制所有图。
2 结果与分析
2.1 不同培养基对菌丝球形态的影响
黑曲霉作为一种在自然界中广泛分布的丝状真菌,对生长所需的营养要求较低,当培养基中含有碳源、氮源及P、K、Mg、S等元素即可生长良好。如图1所示,黑曲霉孢子在改良BG-11培养基、培养基A、肉汤培养基、察氏培养基、CCM培养基中均能萌发形成菌丝球。其中孢子在CCM培养基、培养基A、改良BG-11培养基中都能萌发形成大量均匀的菌丝球,并且形成的菌丝球大小和形态各不相同。如孢子在CCM培养基中形成的菌丝球直径约1~3 mm;在培养基A中生成的菌丝球形态较为饱满,直径约3~5 mm;在改良BG-11培养基中形成的菌丝球形态较为松散,直径约5~8 mm。虽然孢子在CCM培养基、培养基A、改良BG-11培养基中有较好的成球效果,但孢子在肉汤培养基和察氏培养基中的成球效果则较差,形成的菌丝较多,菌丝球数量较少。并且孢子在肉汤培养基中萌发形成较少的菌丝球,直径约2~5 mm;而在察氏培养基中并不萌发形成菌丝球,大量菌丝聚集形成长条状的菌体,长度约1~5 mm。造成这个结果的原因是在黑曲霉孢子培养形成菌丝球的过程中,菌丝球大小与培养基中Fe2+有关,菌丝球数量与培养基中Mg2+有关,肉汤培养基中由于缺乏2种金属离子,因此萌发形成的菌丝球较少,成球效果较差。而在察氏培养基中则由于Mg2+过量,抑制了Fe2+对菌丝生长的促进作用。因此,察氏培养基与肉汤培养基并不适用于黑曲霉孢子萌发形成菌丝球,而改良BG-11培养基、培养基A、CCM培养基等则适用于黑曲霉孢子萌发形成菌丝球。

图1 黑曲霉孢子在不同培养基形成的菌丝球形态
Fig.1 Morphology of mycelium pellets formed by A.niger spores in different media
2.2 不同收获方式对黑曲霉收获小球藻的影响
丝状真菌收获微藻的方法根据其形态主要有孢子和菌丝球2种方法。孢子收获微藻是通过孢子和微藻共培养对微藻进行收获的方法;而菌丝球收获微藻是指先将孢子通过成球培养基培养形成菌丝球再对微藻进行收获的方法。如图2所示,使用菌丝球收获小球藻时对小球藻能有较高的收获率,其中孢子在培养基A、CCM培养基、改良BG-11培养基培养形成菌丝球对小球藻的收获率分别为95.04%、92.9%、89.95%。而当使用孢子和小球藻共培养时,只有在CCM培养基能获得较高的收获率,为87.94%,形成的菌藻体结构也较为稳定;其次为培养基A,收获率为32.84%,形成的菌-藻体数量也较少,结构也较为松散;使用改良BG-11培养基进行共培养时,收获率仅为2.01%,无菌-藻体结构形成。造成这个结果的原因是改良BG-11培养基更适合小球藻的生长,小球藻消耗了过多的碳源,剩下的碳源不足以支撑黑曲霉孢子形成菌丝球收获小球藻,所以无菌-藻体结构形成,小球藻的收获率较低。而孢子在培养基A中形成的菌丝球收获率较低的原因则是由于碳源含量较低,黑曲霉孢子无法形成足够的菌丝球对小球藻进行收获,形成的菌-藻体数量也较少,收获率也较低。
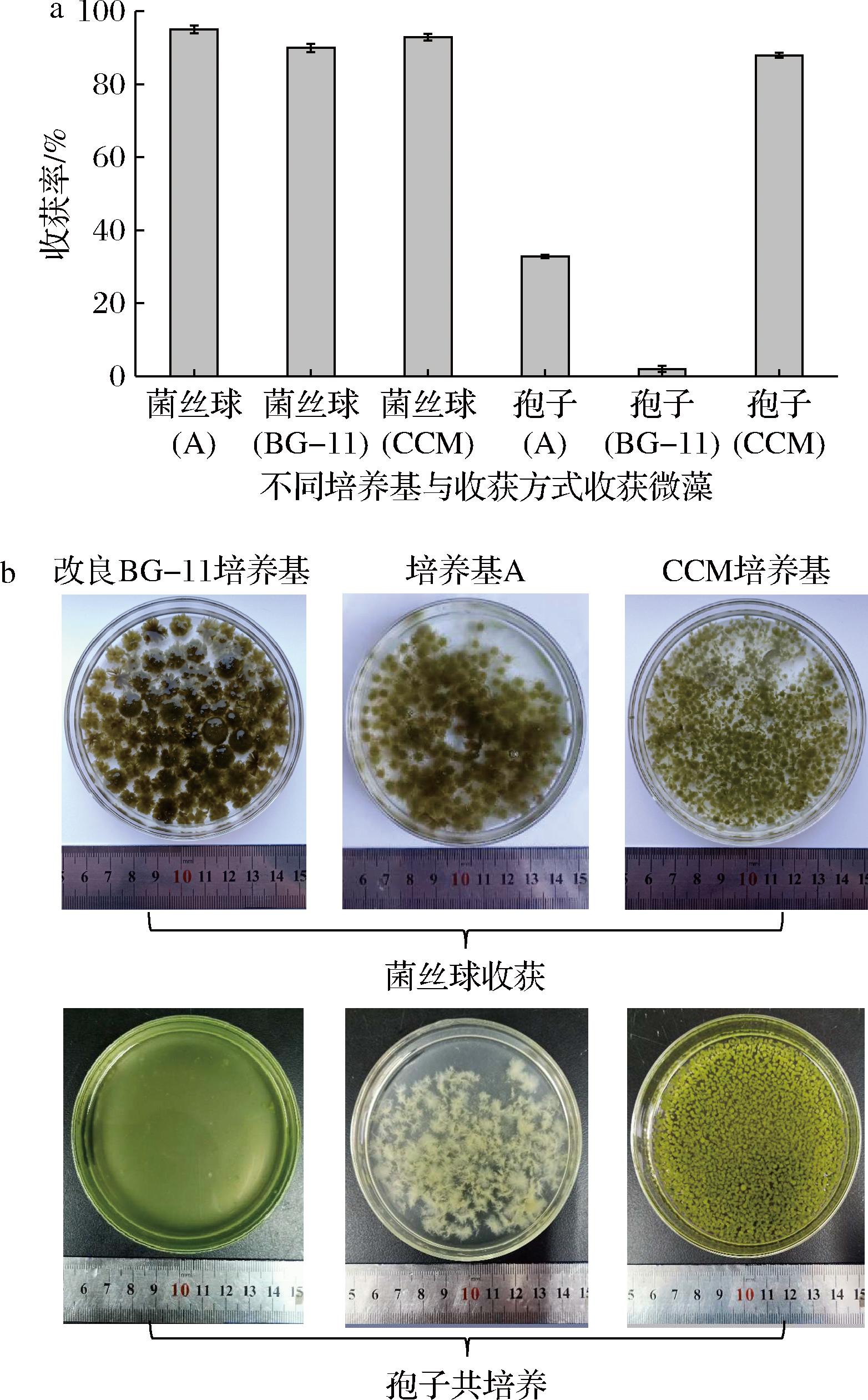
a-孢子悬液与菌丝球对微藻的收获率;b-不同收获方式收获微藻的形态比较
图2 黑曲霉孢子悬液与菌丝球对微藻收获的影响
Fig.2 Effects of A.niger spore suspension and mycelium pellets on microalgae harvest
2.3 配制营养废水的净化处理
为了更好地分析单位量黑曲霉菌丝球和小球藻所能净化营养废水的最高处理量,因此配制了相同量不同浓度的营养废水用于菌丝球和小球藻的净化处理。如图3所示,当菌丝球和小球藻在人工配制的营养废水中培养48 h后,结果表明菌丝球和小球藻对中等浓度的营养废水的净化处理效果最好。并且菌丝球和小球藻对不同浓度营养废水中的COD、TP、TN的净化处理效果也大致相同,其中,COD的净化处理效果最好,其次为TP、TN。当然,菌丝球和小球藻对不同浓度营养废水中的COD、TP、TN的净化处理效果也存在不同。其中,营养废水中的COD下降最为明显,COD去除率均大于68%,COD去除率从高到低分别为中等浓度、低浓度、中高浓度、高浓度,对应的COD去除率为85%、77.5%、73.3%、68.75%。造成这一结果的原因是小球藻通过异养方式利用了营养废水的部分碳源用于自身生长繁殖[28-29],但由于单位菌丝球上所吸附的小球藻数量有限,因此COD的去除量也有限,所以小球藻的COD去除率占总去除率的20%。而黑曲霉菌丝球由于其菌丝球数量较多,单位菌丝球的菌丝数量也较多,菌丝球的生长会消耗营养废水中的大量碳源[30-31],因此COD的去除率较高,黑曲霉菌丝球的COD去除率占总去除率的80%。而对于营养废水中的TN而言,不同浓度的营养废水的去除率并不高,低浓度和中高浓度废水的TN去除率仅为1%和0.56%,TN含量并未明显下降;而中等浓度和高浓度废水的TN去除率分别为10%和11.2%,TN含量只有部分下降。因此菌丝球和小球藻并不能对TN浓度较低的营养废水有一个较好的净化处理效果。造成这个结果的原因是氮含量只会影响藻细胞中蛋白质和油脂的比例,低氮的营养环境有利于藻细胞合成蛋白质,相反,高氮的营养环境则会使藻细胞积累油脂。而小球藻在生长繁殖过程中仅需少量的氮源即可生长良好,对氮的营养需求相对较低,因此对营养废水中的TN利用量不高,TN去除率较低。此外,黑曲霉菌丝球和小球藻对于营养废水中的TP含量去除也较为明显。菌丝球和小球藻对不同浓度的营养废水的TP去除率均超过15%。其中,中等浓度的TP去除率最高,为30%;其次为中高浓度,TP去除率为20%;低浓度和高浓度的TP去除率分别为16%和17%。相比于营养废水中的TN,其TP含量下降较为显著。这是由于磷是藻细胞正常生长发育所必需的重要成分,微藻主要通过同化作用吸收营养废水中的P元素。在微藻的生长代谢繁殖过程中,营养废水中的P主要以无机态(H2PO4-和HPO42-)形式存在的,而微藻是通过P酸化作用对废水中的P吸收,大部分的P会参与由ADP合成为ATP的途径[32-33]。并且微藻还具有富集和存储磷的特性,可以吸收过量的P存储于细胞内[34]。当环境中P的浓度较高时,会优先利用环境中的P完成细胞的生长和繁殖,并将多余的P以多磷酸盐的形式贮存于细胞内。而当环境中缺乏P营养时,微藻可以利用自身的有机磷源,通过细胞表面的磷酸酶将其转化为正磷酸盐后再利用,消耗自身存储的磷源。因此TP含量下降较为明显。因此,单位量的黑曲霉菌丝球和小球藻对中等浓度的营养废水的处理效果最好。
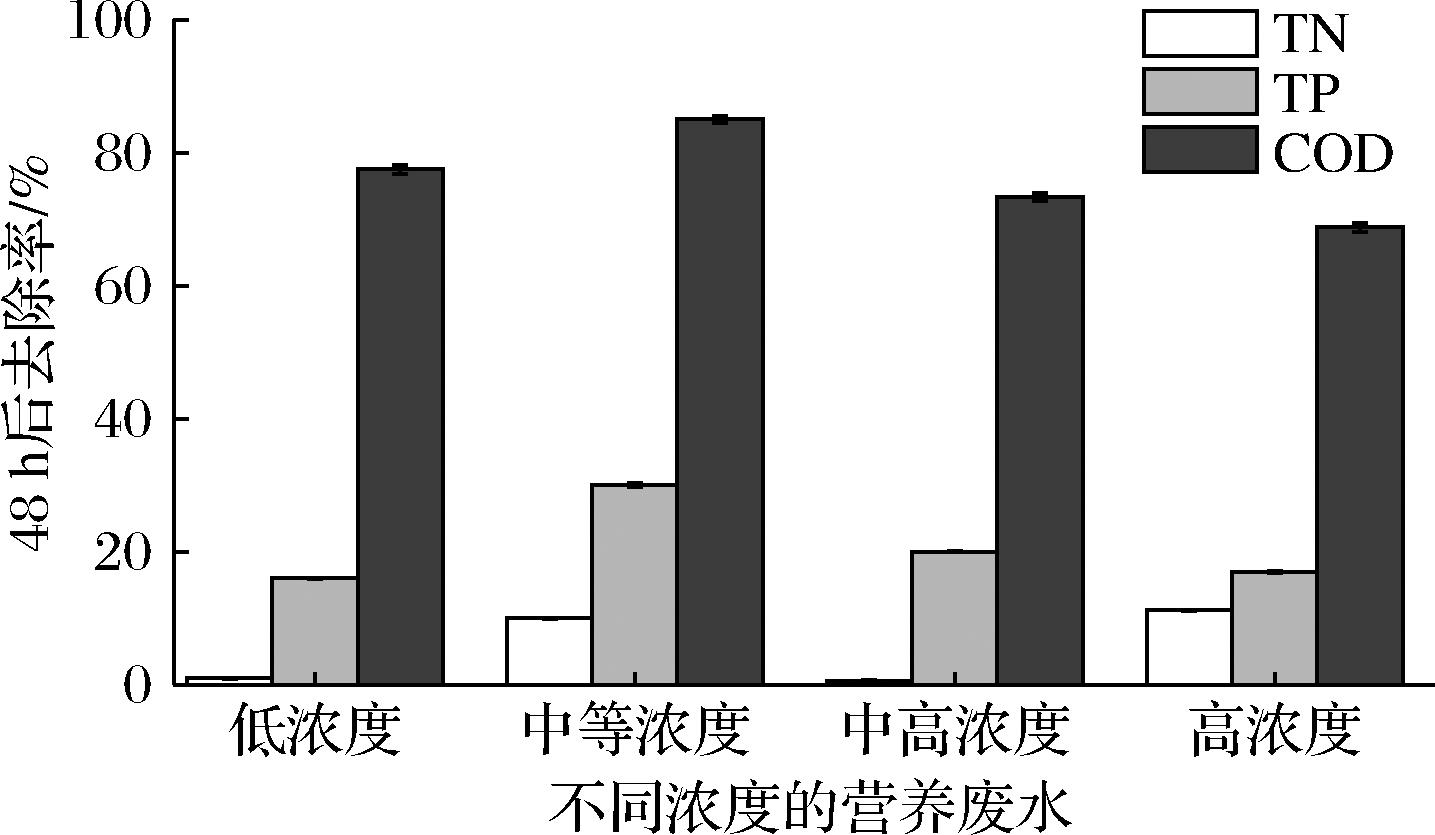
图3 使用菌-藻体(CCM培养基)对营养废水处理48 h的TN、TP、COD变化
Fig.3 Changes of TN, TP and COD in nutrient wastewater treated for 48 h using fungi-algal (CCM medium)
2.4 食品废水的净化处理
通过丝状真菌不同收获方式收获小球藻的结果分析可知,使用菌丝球收获小球藻可以获得较高的收获率。而黑曲霉菌丝球不仅可以用于吸附废水中重金属和悬浮颗粒以及不溶性物质,还可用于重金属废水和印染废水的净化处理。因此使用菌丝球和小球藻的组合对食品废水会有更好的净化处理效果。图4为孢子在不同培养基形成的菌丝球、菌丝球和小球藻对食品废水中COD、TP、TN的去除比例结果。当菌丝球、菌丝球和小球藻对食品废水净化处理48 h后,通过对食品废水中的COD、TP、TN含量测定分析可知,孢子在不同培养基形成的菌丝球和小球藻对食品废水的净化处理效果是优于孢子在不同培养基所形成的菌丝球。造成这个结果的原因是由于菌丝球不仅可以吸附食品废水中的悬浮颗粒以及不溶性物质,还可利用食品废水中的营养物质用于自身菌丝的生长,在净化食品废水的过程中可以为小球藻的生长提供一个良好的生存环境,利于小球藻的生长。而小球藻可以通过异养方式利用食品废水中的多种碳源以及其他营养物质用于自身的生长繁殖,因此当使用菌丝球和小球藻协同净化处理食品废水的效果是优于单一菌丝球的。当然,孢子在不同培养基形成的菌丝球、菌丝球和小球藻对食品废水中的COD、TP、TN的净化处理效果也存在不同。对于食品废水中的TN而言,当净化处理24 h时,孢子在培养基A和改良BG-11培养基中形成的菌丝球对食品废水的处理效果优于菌丝球+小球藻;而孢子在CCM培养基中形成的菌丝球对食品废水的净化处理效果相比菌丝球和小球藻则较差,并且孢子在培养基A形成的菌丝球和小球藻对TN去除率最高,为43.53%。此外,当净化处理48 h时,孢子在CCM培养基和培养基A中形成的菌丝球和小球藻对食品废水的处理效果优于单一菌丝球,而孢子在改良BG-11培养基中则为菌丝球对食品废水的处理效果优于菌丝球和小球藻。造成这一结果的原因为孢子在改良BG-11培养基中形成的菌丝球直径较长,菌丝球结构较为松散。当小球藻吸附在其表面菌丝上时,随着净化食品废水过程不断进行,吸附了小球藻的菌丝更易脱落,因此孢子在改良BG-11培养基中形成的菌丝球对食品废水的处理效果优于菌丝球和小球藻。
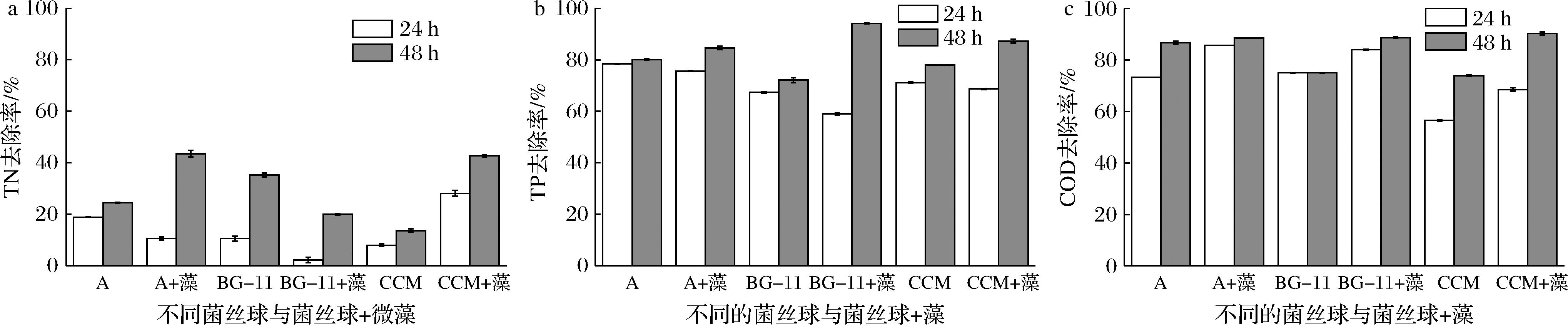
a-24、48 h的TN去除比例;b-24、48 h的TP去除比例;c-24、48 h的COD去除比例
图4 培养24、48 h后的TN、TP、COD去除比例
Fig.4 TN, TP and COD removal ratio after 24 h and 48 h culture
此外,孢子在不同培养基形成的菌丝球、菌丝球和小球藻对食品废水中的TP和COD均有较好的去除效果,其中孢子在改良BG-11培养基形成的菌丝球和小球藻的TP去除率最高,为94.2%;而孢子在改良BG-11培养基中形成的单一菌丝的TP去除率最低,为72.11%。当净化处理24 h时,孢子在培养基A、CCM培养基、改良BG-11培养基中形成的的单一菌丝球对TP的净化处理效果优于菌丝球和小球藻,当净化处理48 h时,孢子在培养基A、CCM培养基、改良BG-11培养基中形成的菌丝球和小球藻对TP的净化处理效果则优于单一菌丝球。造成这一结果的原因是在培养初期,菌丝球由于其自身对食品废水具有较好的净化处理效果,因此在对食品废水净化处理24 h后,菌丝球的净化处理效果优于菌丝球和小球藻。随着食品废水的净化处理过程的不断进行,小球藻的生长繁殖消耗了P元素,因此菌丝球和小球藻的净化效果是优于菌丝球的。而对于食品废水中的COD,其中,孢子在CCM培养基形成的菌丝球和小球藻的去除率最高,为90.25%;CCM培养基的单一菌丝球COD去除率最低为73.91%。当净化处理24 h、48 h时,孢子在培养基A、CCM培养基、改良BG-11培养基中形成的菌丝球和小球藻对COD的处理效果优于单一菌丝球。造成这一结果的原因是小球藻的生长繁殖消耗了食品废水中较多的营养物质,COD含量下降较为明显,所以菌丝球和小球藻对食品废水的处理效果均优于单一菌丝球。
如图5所示,当净化处理48 h后,菌丝球的颜色由白色变为黄色,菌丝球和小球藻则由绿色变为黄色。其原因可能是随着培养过程的进行,食品废水中的大量COD被消耗,培养基pH改变,菌丝球吸附了食品废水中的不溶性杂质导致菌丝球渐渐老化变为黄色,而菌丝球和小球藻则是由于小球藻进行异养生长,缺乏光照导致叶绿素无法合成,因此小球藻逐渐变为黄色,菌丝球和小球藻也随之由绿色变为黄色。并且,根据孢子在不同培养基形成的菌丝球和小球藻对食品废水中COD、TP、TN的净化处理结果分析可知。孢子在培养基A中形成的菌丝球和小球藻对TN的处理效果较好;在改良BG-11培养基中形成的菌丝球和小球藻对TP的处理效果较好;在CCM培养基中形成的菌丝球和小球藻对COD的处理效果较好。因此,菌丝球和小球藻对食品废水中不同营养物质的净化处理是和菌丝球的直径以及形态密切相关的。
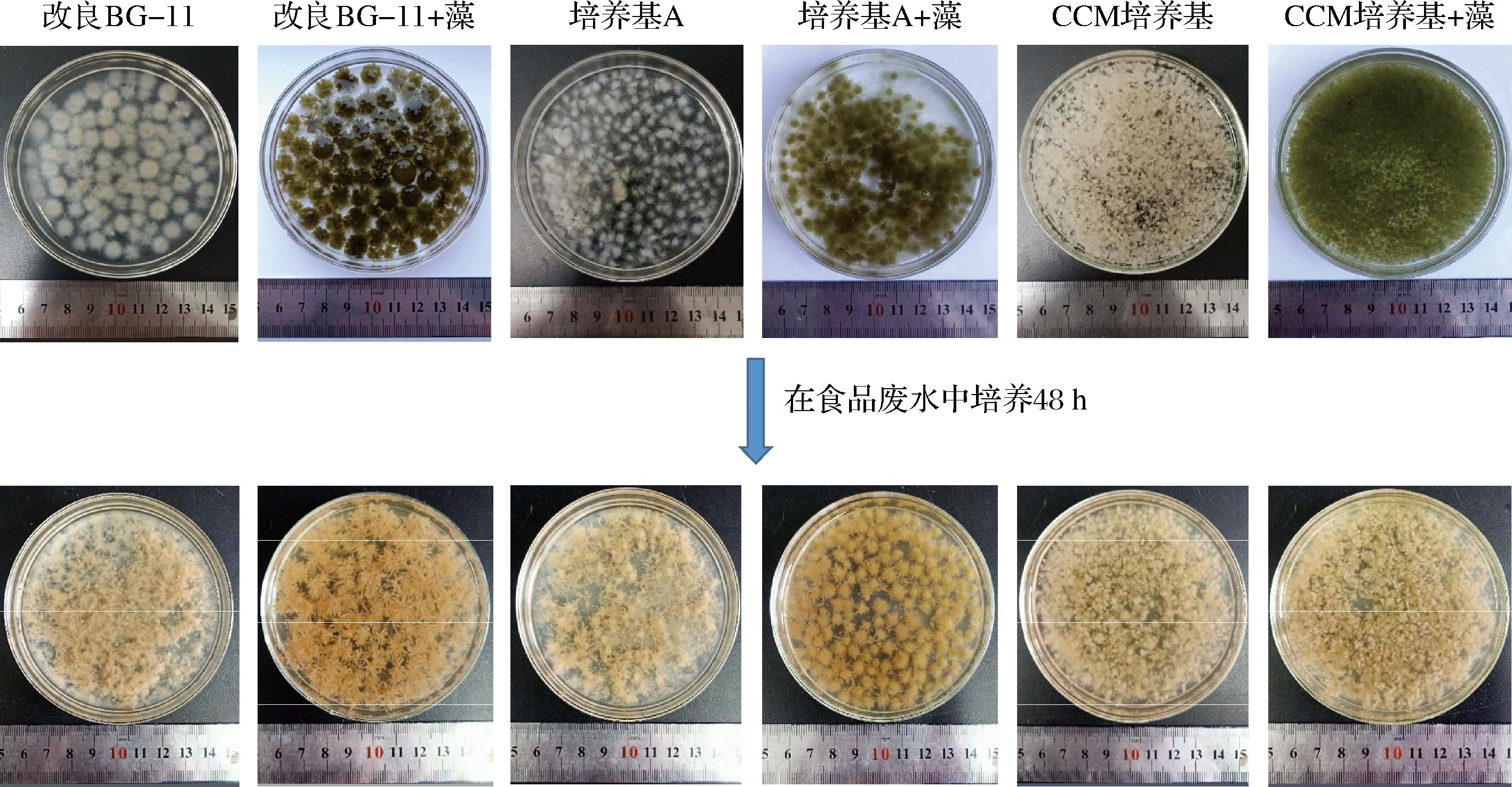
图5 不同菌丝球与菌丝球+微藻在豆制品废水中培养48 h后的形态
Fig.5 Morphology of different mycelium pellets and mycelium pellets with microalgae cultured in soybean wastewater for 48 h
3 结论
本研究通过优化黑曲霉孢子的成球培养基以及使用不同的方式收获小球藻使菌-藻体来应用于食品废水的净化处理,以此提高菌-藻体在食品废水的工业应用能力。首先,通过成球培养基的优化筛选出CCM培养基(直径为1~3 mm)、培养基A(直径为3~5 mm)、改良BG-11培养基(直径为5~8 mm)等3种成球效果良好的成球培养基。其次,使用菌丝球和孢子等2种收获方式对小球藻进行固定化收获时,只有使用菌丝球收获小球藻能对小球藻有较高的收获率,而使用孢子和小球藻共培养收获小球藻时,只有在CCM培养基中能获得较高的收获率。最后将孢子在不同培养基中形成的菌丝球、菌丝球和小球藻应用于食品废水的进化处理。结果表明,孢子在不同培养基形成的单一菌丝球与菌丝球和小球藻均对营养废水以及食品废水中的COD与TP都有较好的净化处理效果,对TN的净化处理效果则较差,且菌丝球和小球藻的处理效果优于单一菌丝球。并且菌丝球和小球藻对食品废水中的不同营养物质的净化处理也和菌丝球的直径和形态息息相关。综上,使用菌丝球吸附小球藻净化食品废水可以有效改善食品废水的水质,降低食品废水的处理成本,使其对食品废水的净化处理能力提高。目前菌-藻体已经逐渐的应用于食品工业废水的净化处理,因此,未来可对菌-藻体的直径和形态进行调控,使其可以对不同类型的食品废水进行净化处理,提高菌-藻体在食品废水的工业应用能力。此外,还可将菌-藻体进行快速冻干,使其便于长期稳定储存,可以全天候地应用于食品废水的净化处理,扩大菌-藻体的工业应用潜力。
[1] 李磊. 综合食品废水处理技术研究进展[J].皮革制作与环保科技, 2022(17):13-15.LI L.Research progress of integrated food wastewater treatment technology[J].Leather Manufacture and Environmental Technology, 2022(17):13-15.
[2] 赵敏. 食品工业废水处理技术研究[J].现代食品, 2020(17):122-124.ZHAO M.Study on wastewater treatment technology of food industry[J].Modern Food, 2020(17):122-124.
[3] 张智, 周健.食品工业高盐高氮磷有机废水处理技术发展趋势[J].给水排水, 2012, 38(9):1;51.ZHANG Z, ZHOU J.Development trend of organic wastewater treatment technology with high salt, nitrogen and phosphorus in food industry[J].Water &Wastewater Engineering, 2012, 38(9):1;51.
[4] 邓永飞, 刘涛, 吴海铨, 等.食品工业废水处理技术研究进展[J].工业水处理, 2021, 41(10):1-7;13.DENG Y F, LIU T, WU H Q, et al.Research progress of wastewater treatment technology in food industry[J].Industrial Water Treatment, 2021, 41(10):1-7;13.
[5] 陈柳州, 赵泉林, 叶正芳.食品工业废水处理技术研究进展[J].应用化工, 2022, 51(8):2332-2336.CHEN L Z, ZHAO Q L, YE Z F.Research progress of wastewater treatment technology in food industry[J].Applied Chemical Industry, 2022, 51(8):2332-2336.
[6] ZHUANG L L, LI M T, HAO NGO H.Non-suspended microalgae cultivation for wastewater refinery and biomass production[J].Bioresource Technology, 2020, 308:123320.
[7] PHONG V H N, HAO N H, GUO W S, et al.Microalgae for saline wastewater treatment:A critical review[J].Critical Reviews in Environmental Science and Technology, 2020, 50(12):1224-1265.
[8] ROMERO VILLEGAS G I, FIAMENGO M, ACIÉN FERN NDEZ F G, et al.Outdoor production of microalgae biomass at pilot-scale in seawater using centrate as the nutrient source[J].Algal Research, 2017, 25:538-548.
NDEZ F G, et al.Outdoor production of microalgae biomass at pilot-scale in seawater using centrate as the nutrient source[J].Algal Research, 2017, 25:538-548.
[9] WREDE D, TAHA M, MIRANDA A F, et al.Co-cultivation of fungal and microalgal cells as an efficient system for harvesting microalgal cells, lipid production and wastewater treatment[J].PLoS One, 2014, 9(11):e113497.
[10] CHO H U, KIM Y M, PARK J M.Enhanced microalgal biomass and lipid production from a consortium of indigenous microalgae and bacteria present in municipal wastewater under gradually mixotrophic culture conditions[J].Bioresource Technology, 2017, 228:290-297.
[11] LIU H, LU Q, WANG Q, et al.Isolation of a bacterial strain, Acinetobacter sp.from centrate wastewater and study of its cooperation with algae in nutrients removal[J].Bioresource Technology, 2017, 235:59-69.
[12] NASIR N M, BAKAR N S, LANANAN F, et al.Treatment of African catfish, Clarias gariepinus wastewater utilizing phytoremediation of microalgae, Chlorella sp.with Aspergillus niger bio-harvesting[J].Bioresource Technology, 2015, 190:492-498.
[13] QIU Z D, YE Y X, YIN H, et al.An easily available biocarrier material mycelium pellet assembled with oms-2 for dye degradation[J].International Journal of Environmental Research, 2021, 15(1):93-103.
[14] EL-GENDI H, SALEH A K, BADIERAH R, et al.A comprehensive insight into fungal enzymes:Structure, classification, and their role in mankind’s challenges[J].Journal of Fungi, 2021, 8(1):23.
[15] ZHANG S, LI A, CUI D, et al.Performance of enhanced biological SBR process for aniline treatment by mycelial pellet as biomass carrier[J].Bioresource Technology, 2011, 102(6):4360-4365.
[16] MOHD HANAFIAH Z, WAN MOHTAR W H M, ABU HASAN H, et al.Performance of wild-Serbian Ganoderma lucidum mycelium in treating synthetic sewage loading using batch bioreactor[J].Scientific Reports, 2019, 9(1):16109.
[17] ZHANG B, WU L, GUO Y, et al.Rapid establishment of algal-bacterial granular sludge system by applying mycelial pellets in a lab-scale photo-reactor under low aeration conditions:Performance and mechanism analysis[J].Environmental Pollution, 2023, 322:121183.
[18] WANG Q R, HONG Y, LI L H.Insights into differences between spore-assisted and pellet-assisted microalgae harvesting using a highly efficient fungus:Efficiency, high-value substances, and mechanisms[J].The Science of the Total Environment, 2023, 877:162945.
[19] 郑潇, 周化岚, GULTOM Sarman Oktovianus, 等.黑曲霉快速高效收获异养小球藻的条件优化[J].食品与发酵工业, 2021, 47(23):16-23.ZHENG X, ZHOU H L, OKTOVIANUS G, et al.Efficiently harvesting heterotrophic Chlorella vulgaris through co-culture and mixed mycelium of Aspergillus niger[J].Food and Fermentation Industries, 2021, 47(23):16-23.
[20] ZHANG J G, ZHANG J N.The filamentous fungal pellet and forces driving its formation[J].Critical Reviews in Biotechnology, 2016, 36(6):1066-1077.
[21] KURNIAWAN T A, LO W H, LIANG X, et al.Heavy metal removal from aqueous solutions using biomaterials and/or functional composites:Recent advances and the way forward in wastewater treatment using digitalization[J].Journal of Composites Science, 2023, 7(2):84.
[22] 吴思伟, 李思雨, 孙寒, 等.一株产胞外多糖微藻的分离鉴定及其多糖抗氧化活性的研究[J].食品与发酵工业, 2021, 47(24):193-200.WU S W, LI S Y, SUN H, et al.Isolation and identification of an exopolysaccharide-producing microalgae strain and its antioxidant activity[J].Food and Fermentation Industries, 2021, 47(24):193-200.
[23] 孟丹阳, 杜艳, 陈复生.微藻中蛋白质的提取方法研究进展[J].食品与发酵工业, 2023, 49(21):346-357.MENG D Y, DU Y, CHEN F S.Research progress on extraction methods of proteins from microalgae[J].Food and Fermentation Industries, 2023, 49(21):346-357.
[24] 孙建瑞, 姚琳琳, 李菁岚, 等.LED光质影响微藻生长和代谢产物积累的研究进展[J].食品与发酵工业, 2024, 50(2):321-328.SUN J R, YAO L L, LI J L, et al.Effects of LED light quality on growth and metabolite accumulation in microalgae:A review[J].Food and Fermentation Industries, 2024, 50(2):321-328.
[25] NYYSSÖL A, SUHONEN A, RITALA A, et al.The role of single cell protein in cellular agriculture[J].Current Opinion in Biotechnology, 2022, 75:102686.
A, SUHONEN A, RITALA A, et al.The role of single cell protein in cellular agriculture[J].Current Opinion in Biotechnology, 2022, 75:102686.
[26] RITALA A, H KKINEN S T, TOIVARI M, et al.Single cell protein-state-of-the-art, industrial landscape and patents 2001-2016[J].Frontiers in Microbiology, 2017, 8:2009.
KKINEN S T, TOIVARI M, et al.Single cell protein-state-of-the-art, industrial landscape and patents 2001-2016[J].Frontiers in Microbiology, 2017, 8:2009.
[27] KARPAGAM R, RAJ K J, ASHOKKUMAR B, et al.Characterization and fatty acid profiling in two fresh water microalgae for biodiesel production:Lipid enhancement methods and media optimization using response surface methodology[J].Bioresource Technology, 2015, 188:177-184.
[28] SONG Y L, WANG L J, QIANG X, et al.The promising way to treat wastewater by microalgae:Approaches, mechanisms, applications and challenges[J].Journal of Water Process Engineering, 2022, 49:103012.
[29] WAN Y J, YAN N, ZHAO J Q, et al.Trends and progress in Microalgae-based wastewater treatment technologies:A review[J].E3S Web of Conferences, 2021, 308:01014.
[30] LIU Y X, HU T T, ZHAO J, et al.Simultaneous removal of carbon and nitrogen by mycelial pellets of a heterotrophic nitrifying fungus-Penicillium sp.L1[J].Journal of Bioscience and Bioengineering, 2017, 123(2):223-229.
[31] WANG J J, TIAN Q H, ZENG W M, et al.Insights about fungus-microalgae symbiotic system in microalgae harvesting and wastewater treatment:A review[J].Renewable and Sustainable Energy Reviews, 2023, 182:113408.
[32] 李亚丽, 赵国强, 武双, 等.基于废水培养微藻及微藻资源化利用的研究[J].现代化工, 2021, 41(4):48-51.LI Y L, ZHAO G Q, WU S, et al.Cultivation of microalage based on wastewater and utilization of microalage[J].Modern Chemical Industry, 2021, 41(4):48-51.
[33] CHAI W S, TAN W G, HALIMATUL MUNAWAROH H S, et al.Multifaceted roles of microalgae in the application of wastewater biotreatment:A review[J].Environmental Pollution, 2021, 269:116236.
[34] BROWN N, SHILTON A.Luxury uptake of phosphorus by microalgae in waste stabilisation ponds:Current understanding and future direction[J].Reviews in Environmental Science and Bio/Technology, 2014, 13(3):321-328.