中国上下五千年历史,食文化仅一千多年,而汤文化却长达三千年之久。我国南京鸭血粉丝汤、淮南牛肉汤、洛阳驴肉汤、单县羊汤等皆享盛名,其中,羊汤风味独特、口感顺滑,在汤系菜肴中独具特色,深受消费者喜爱。《本草纲目》中记载:“羊肉能暖中补虚,补中益气”。羊汤能够御风寒补[1],对气血两虚有辅助治疗作用,长期饮用有助于提高免疫力。
汤中含有丰富的蛋白质、脂质、碳水化合物、核酸、矿物质、生物活性物质等营养物质,越来越多的研究发现,这些物质不是独立存在于汤中的,而是以胶体颗粒的形式存在并发挥其功能作用[2]。传统的处理(如乳化、加热或冷却)可以产生多种多尺度的胶体结构,如胶束、乳剂、泡沫、凝胶或分散体。这种微纳米尺度的胶体纳米颗粒(colloidal nanoparticles,CNPs)功能属性取决于它们的组成、大小、形状和电荷等因素[3],由于CNPs的多功能性,从纳米医学到食品工业均有其应用。
随着经济的繁荣和互联网的不断发展以及人们生活节奏的加快,大众的生活方式和消费观念发生了巨大变化,对方便快速食品的需求量逐渐升高,预制菜产业在近年得到迅速发展,冷冻速食产品的需求量也随之增大。传统熬制汤的过程耗时较长、工艺较为繁琐[4],预制汤品具有快速简便、味美营养等特点,符合现代人的生活方式和饮食需求。目前,冷冻干燥成粉是预制汤类产品最常用的贮藏方式[5],但其成本较高,而冻藏方式较为便捷经济,所以了解汤类产品的冻藏稳定性是十分必要的。CNPs作为汤类产品的存在状态,其稳定性与汤类产品的品质息息相关。从食材中迁移出来的蛋白质、脂质、多糖、矿物质等营养成分会通过各种次级键相互作用形成更稳定的聚集体,进而组装为微/纳米尺寸的结构[6],这对产品的稳定性是一个重大技术挑战。现有的CNPs分离和检测技术较为成熟,主要为微滤技术与超滤技术[7]。KE等[8]通过超滤法和尺寸排阻色谱法从猪骨汤中分离出两种粒径的CNPs,利用马尔文激光粒度仪确定其尺寸在248、170 nm左右。
目前对羊汤的研究大多集中在功能探究和风味评价上,其原料选择和冻藏特性的报道较少。而且从胶体纳米的角度对汤进行研究,可以将研究视角从混乱的汤系聚焦到颗粒结构,由繁入简。本研究对熬制3 h的羊骨汤、羊肉汤、羊骨肉汤3个不同原料组分离出的CNPs进行蛋白质、甘油三酯、总糖的营养成分含量分析,并采用马尔文激光粒度仪对其胶体学性质,如平均粒径、聚合物分散性指数(polymer dispersity index,PDI)值、zeta电位和光散射强度进行检测,结合扫描电子显微镜(scanning electron microscope,SEM)的形貌观察与傅里叶近红外光谱(Fourier transform near-infrared spectroscopy,FT-NIR)的结构分析,确定冻藏稳定性最优的CNPs原料组。旨在比较不同原料制备羊汤中CNPs的冻藏稳定性,为预制菜中羊汤原料的选择提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
羊肉、羊骨,宁夏西鲜记科技有限公司提供。本实验采用宁夏滩羊的后腿骨肉,为保证实验结果不受骨肉批次的影响,大量采购同一批次羊后腿骨肉,用聚乙烯袋分装后保存在-20 ℃冰箱。
蛋白定量测定试剂盒、甘油三酯测试盒,南京建成生物工程研究所;葡萄糖GOPOD氧化酶法试剂盒,苏州格锐思生物科技有限公司;所有试剂均为分析纯。
1.2 仪器与设备
Spark多功能酶标仪,瑞士Tecan公司;Nano-ZS马尔文激光粒度仪,英国Malvern仪器公司;Neo15R高速离心机,上海力申科学仪器有限公司;KH7200DE超声波清洗机,昆山禾创超声仪器有限公司;HL-C20R福满家电磁炉,中山市翰林电器有限公司;HWS-24恒温水浴锅、SIM-F140BDL全自动制冰机,北京天林恒泰科技有限公司;Vortex Geniu2 SI-0246旋涡振荡器,美国Scientific公司;SU-8010常规扫描电子显微镜,日本日立公司;TENSOR 27傅里叶变换近红外光谱仪,德国Bruker公司;恒温培养箱,天津市中环实验电炉有限公司;ML802T电子分析天平,上海梅特勒-托利多仪器有限公司。
1.3 实验方法
1.3.1 样品制备
羊汤的制备采用MENG等[9]的方法并加以修改。羊后腿瘦肉切成(15±0.5) g的小块,体积约为3 cm×3 cm×3 cm,羊后腿骨和羊肉提前1 h浸泡在水中,出血水之后用纯净水清洗3次,食材和纯净水按质量比1∶5加入,分为3个原料组,纯羊骨组、纯羊肉组、羊肉骨混合组(骨肉质量比1∶1)。羊汤用电磁炉进行炖煮(功率2 200 W),为防止失水以及挥发性化合物的损失,在烹饪过程中盖锅。熬制的过程中,将出现的浮沫全部撇掉。功率2 200 W炖煮15 min后转至1 000 W,保证温度在99.6~100.5 ℃内波动。用玻璃棒在锅内标记初始水位,每次取样前加沸水至锅内的初始水位,确保取样前羊汤的总量不变。食材炖煮3 h后每个原料组分别取500 mL的汤,收集3个样本。向取出的样品中添加0.5%(质量分数)的食盐混匀,放置常温后离心,25 ℃,4 000×g,20 min,中间清液过0.45 μm滤膜,保存至洁净管中以备进一步分离。羊汤在相同的烹饪条件下重复3次,采用3只羊的后腿骨肉做平行实验。
1.3.2 CNPs的分离
CNPs的分离采用超滤法[10]。取15 mL羊汤于100 kDa的超滤管中,在5 000×g离心40 min,全程控温25 ℃。用等体积水将截留在内管中的胶粒从滤膜冲下,超声波辅助冲洗5 min,即为截留液组分,将截留组分用纯净水定容至15 mL,得到的样品分装于2 mL冻存管内,在-20 ℃冷冻保存0、7、14 d后解冻,再次加热至沸腾,放置室温后进行指标检测。
1.4 基本营养成分
1.4.1 蛋白质质量浓度
采用双吡啶甲酸(bicinchoninic acid,BCA)法检测羊汤CNPs中蛋白质质量浓度[11],碱性条件下,蛋白将Cu2+还原为Cu+,Cu+与BCA试剂形成紫色的络合物,562 nm处有最大吸收峰,依据吸光度与浓度成正比,通过测吸光度值(optical density,OD)即可计算待测样品的蛋白质质量浓度。分别取50 μL羊汤CNPs样品按试剂盒实验步骤进行操作,并绘制牛血清白蛋白标准曲线,根据标准曲线计算羊汤CNPs中蛋白质的质量浓度。
1.4.2 甘油三酯物质的量浓度
实验采用GPO-PAP酶法(分光光度法)检测羊汤CNPs中甘油三酯浓度[12],生成的醌类化合物颜色深浅与甘油三酯浓度成正比,测定范围为0.2~11.4 mmol/L,按照试剂盒的实验步骤加样,于旋涡振荡器上混匀,37 ℃下孵育10 min,于500 nm波长、0.5 cm光径下测定反应物吸光度值(OD值),蒸馏水调零,试剂盒内提供的标准品为甘油。羊汤CNPs甘油三酯浓度按公式(1)计算:
甘油三酯浓度![]() 标准品浓度
标准品浓度
(1)
式中:OD汤,羊汤CNPs的吸光度值;OD空白,纯水样品的吸光度值;OD标准,试剂盒标准样品的吸光度值。
1.4.3 总糖质量浓度
实验采用GOPOD氧化酶法检测羊汤CNPs中总糖的质量浓度[13],CNPs中的葡萄糖被特异性氧化后会生成与显色剂反应的红色产物,从而被定量。将羊汤CNPs溶液与工作液按试剂盒中药品比例混合均匀,在37 ℃避光反应30 min,在520 nm处读取OD值,蒸馏水调零,0.5 mg/mL的葡萄糖溶液作为标准品。反应生成物颜色的深浅与葡萄糖含量呈正相关性,可通过公式(2)计算:
葡萄糖质量浓度![]() 标准品质量浓度
标准品质量浓度
(2)
1.5 胶体学性质检测
通过动态光散射技术确定羊汤CNPs的胶体学性质[14],用马尔文激光粒度仪Nano-ZS检测CNPs的平均粒径、PDI值、zeta电位及光散射强度。仪器预热15 min后,打开Zetasizer Software,取1 mL样品,加入干净的检测皿内,测定条件:25 ℃,平衡时间120 s,扫描波长633 nm,散射角173°。
1.6 SEM观察
分别取15 μL羊汤CNPs样品滴在干净的硅片表面,室温放置干燥后,对样品进行喷金处理,用SEM在8.9~9.0 mm焦距下找到合适位置对样品进行形貌拍摄,加速电压为10 kV。
1.7 FT-NIR分析
采用ZHAO等[15]的方法并加以修改,利用傅里叶变换近红外光谱仪。将羊汤CNPs样品滴入液体池,形成液体膜后即可测量,蒸馏水作为空白对照,于4 000~400 cm-1范围内进行64次扫描。
1.8 数据统计与分析
本研究中所有实验结果均采用3次独立重复试验的平均值表示。使用Excel 2019软件、SPSS 2021软件、GraphPad 9.5软件、Adobe Photoshop 2020软件和Origin 2022软件进行数据处理分析和图表制作。实验结果采用双因素方差分析(ANOVA)和Duncan多重比较分析进行差异显著性分析,当P<0.05时,差异显著。
2 结果与分析
2.1 CNPs的基本营养成分
2.1.1 蛋白质质量浓度
图1是根据牛血清白蛋白标准曲线计算出不同冻藏时间3组羊汤CNPs蛋白质质量浓度的比较。随着冻藏时间延长,羊骨汤(sheep bone soup,BS)和羊肉汤(sheep meat soup,MS)组CNPs蛋白质质量浓度下降显著(P<0.05),羊骨肉汤(sheep bone and meat soup,BMS)组CNPs无显著变化(P>0.05)。在相同冻藏时间中,BMS组CNPs蛋白质质量浓度始终保持最高,而MS组CNPs蛋白质质量浓度始终最低。卞欢等[2]发现,速冻和缓冻鸭汤与新鲜鸭汤对比蛋白含量降低,因为汤冷冻形成的冰晶可以破坏蛋白质的结合水层和分子内的化学键,从而导致蛋白质溶解性降低,最终造成可溶性蛋白质含量降低。这与本研究BS和MS组CNPs蛋白质质量浓度随冻藏时间的增加而降低的结果一致。而BMS组CNPs蛋白质质量浓度无显著性差异(P<0.05),说明其蛋白质冻藏稳定性较好,这可能是由于肉肌原纤维蛋白与骨的成分形成更稳定聚集体。此外,不同原料组的CNPs营养成分浓度的差异是羊骨和羊肉的配比、营养成分含量及其溶出水平不同造成的[16-17]。
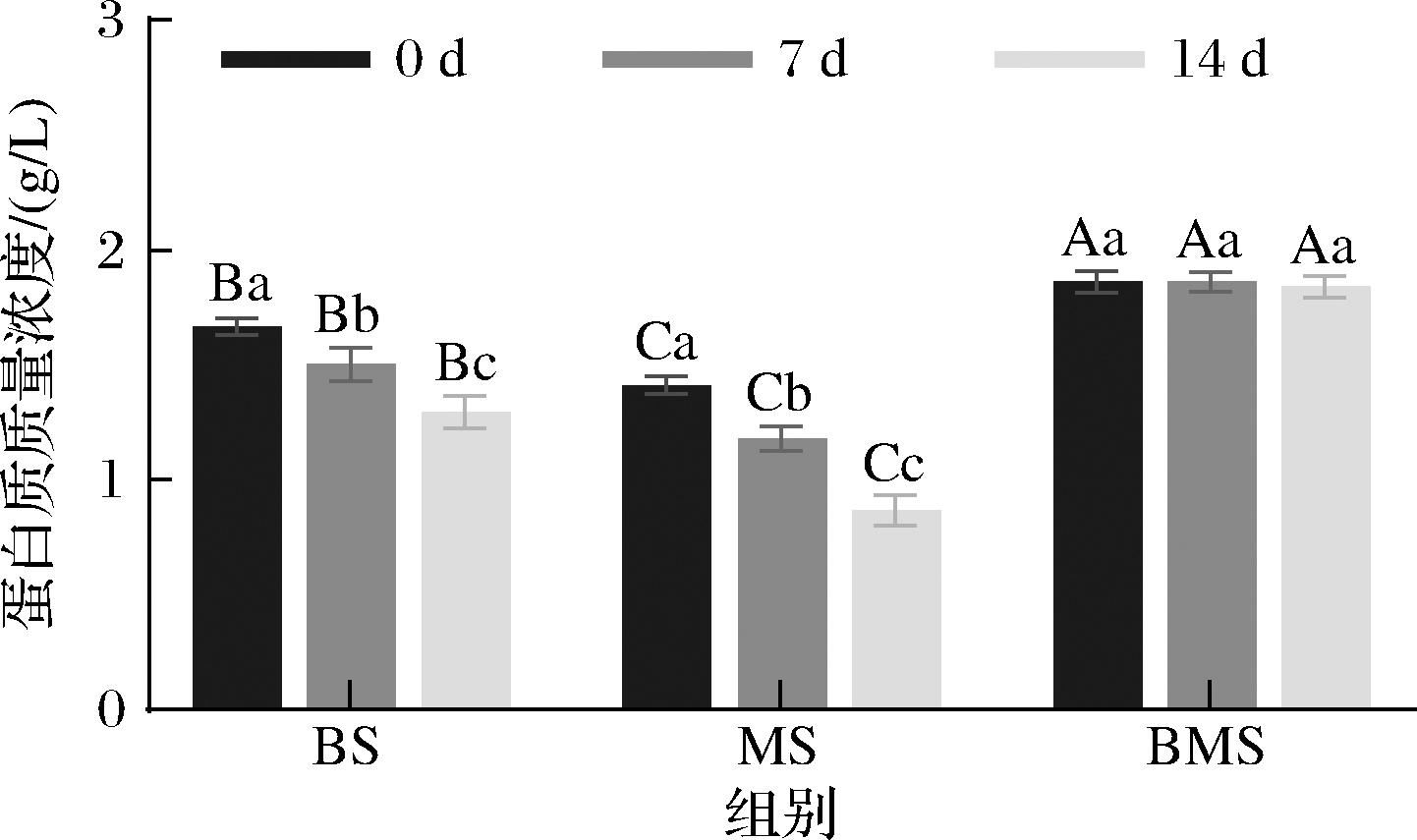
图1 不同冻藏时间3组羊汤CNPs蛋白质质量浓度的比较
Fig.1 Comparison of the mass concentration of proteins in three groups of sheep soup CNPs at different storage period
注:A~C代表相同冻藏时间不同原料组之间指标的差异性,a~c代表同一原料组中冻藏时间之间指标的差异性(下同)。
2.1.2 甘油三酯浓度
脂质对羊汤风味有重要作用,进而影响消费者的感官体验[18],因此监测甘油三酯浓度的变化是十分重要的。如图2所示,羊组织中的脂质迁移至汤中后,在冻藏过程中会分解为甘油和脂肪酸。BS和MS组CNPs甘油三酯浓度均有所下降,而BMS组CNPs无显著变化(P>0.05)。BS组CNPs甘油三酯浓度最高,其下降差值也最大,由2.14 mmol/L下降至1.31 mmol/L。冻藏7 d后,BMS组CNPs甘油三酯浓度始终保持最高。在相同冻藏时间中,MS组CNPs甘油三酯浓度始终最低。BS组CNPs甘油三酯浓度下降差值最大,说明骨汤体系中的脂质的冻藏稳定性最差。吴红洋等[19]发现,母乳中的蛋白质和脂质含量随冻藏时间的增加呈缓慢下降趋势,这与本实验结果相一致。
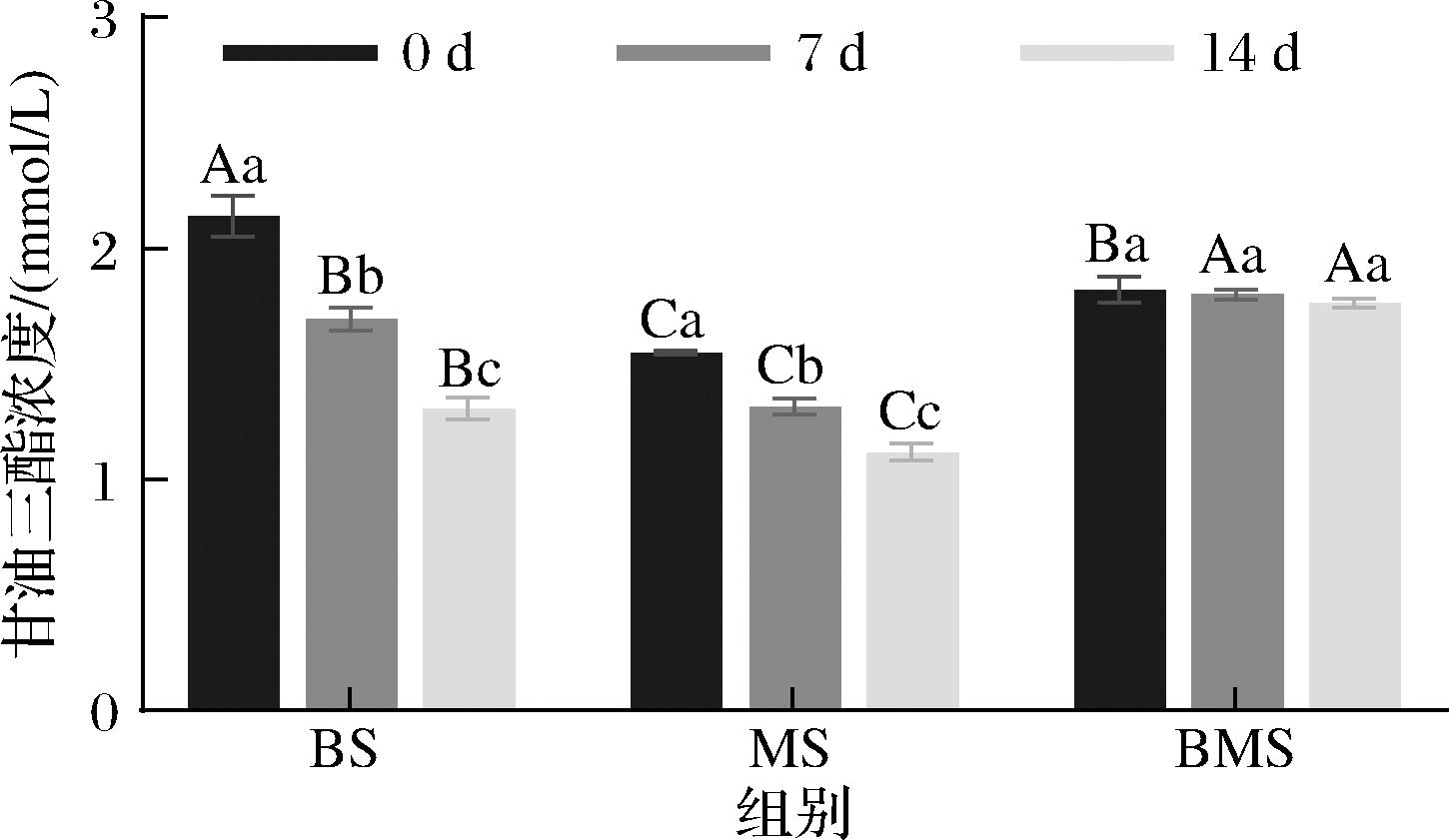
图2 不同冻藏时间3组羊汤CNPs甘油三酯浓度的比较
Fig.2 Comparison of the triglyceride concentration of CNPs in sheep soup in three groups at different storage period
2.1.3 总糖质量浓度
滋味与肉中的糖类呈味物质有关[20],如图3所示,3组CNPs总糖质量浓度均显著增加(P<0.05),对比蛋白质和脂质,汤体系中总糖的稳定性最差。其中,MS组总糖质量浓度由0.08 g/L上升到0.20 g/L,在3组中上升最多。在相同冻藏时间中,MS组CNPs总糖质量浓度始终保持最高。冻藏7 d时,BS组和BMS组CNPs总糖质量浓度无显著性差异(P>0.05)。冻藏14 d时,BS组CNPs总糖质量浓度显著高于BMS组(P<0.05)。MS组总糖质量浓度上升最多,说明肉汤体系中的总糖的冻藏稳定性最差。王彧瑶[21]发现随着冻藏时间的增加,淀粉可以转化为葡萄糖,进而导致总糖含量的增加,这与本实验中总糖质量浓度随冻藏时间的增加而增加的结果相一致。综上所述,BMS组CNPs的营养成分冻藏稳定性最优。
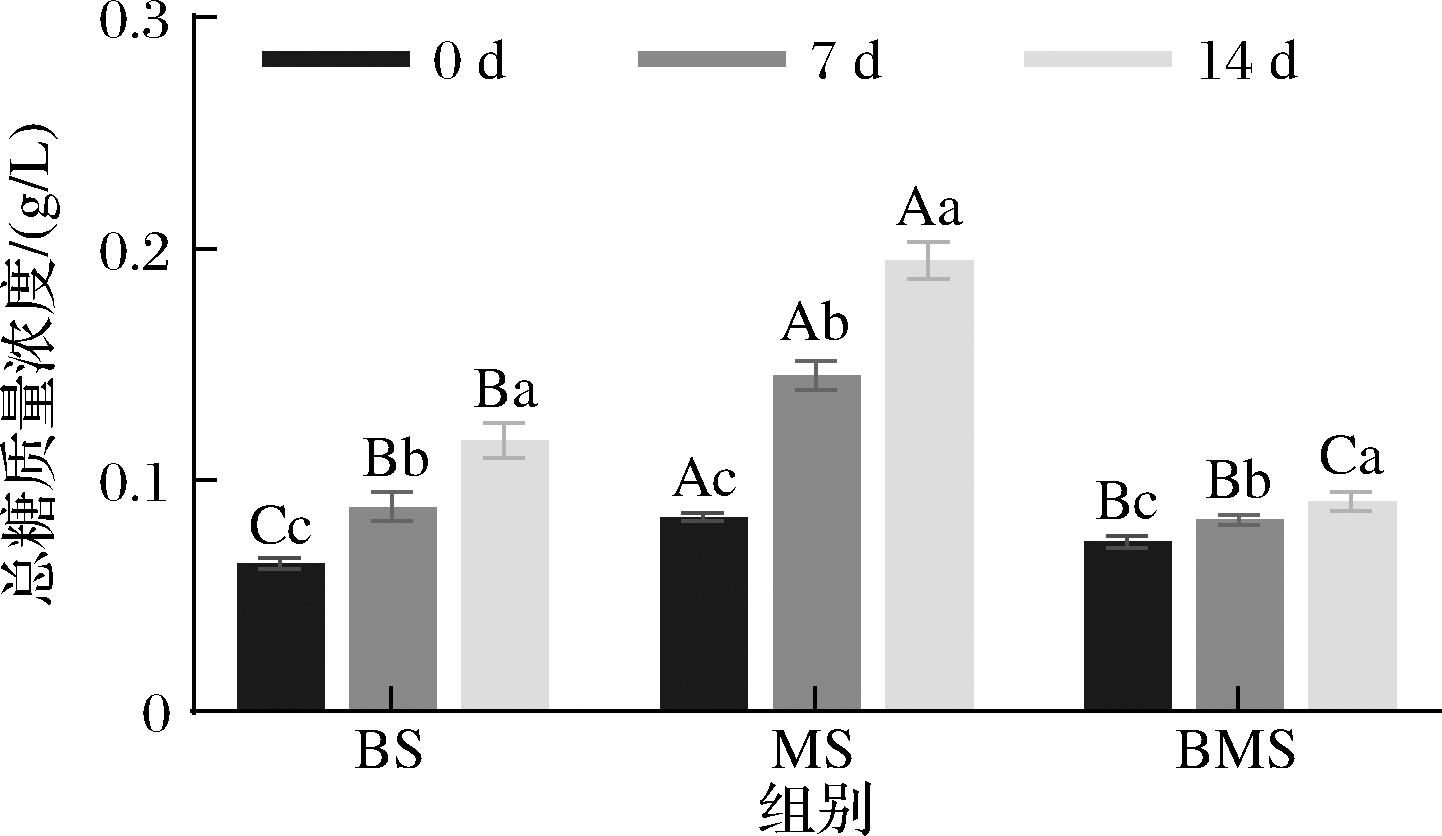
图3 不同冻藏时间3组羊汤CNPs总糖质量浓度的比较
Fig.3 Comparison of the mass concentration of total sugars in three groups of sheep soup CNPs at different storage period
2.2 CNPs的胶体学性质
平均粒径主要用于表征纳米颗粒的大小。如图4-a所示,随着冻藏时间的增加,BS和MS组的CNPs颗粒尺寸显著增加(P<0.05),BMS组CNPs颗粒尺寸无显著差异(P>0.05)。粒径结果说明3组CNPs的颗粒尺寸均有所增大,这可能是由于冻结使冰晶和油脂部分结晶,脂肪球膜破坏,油滴易结合变大。
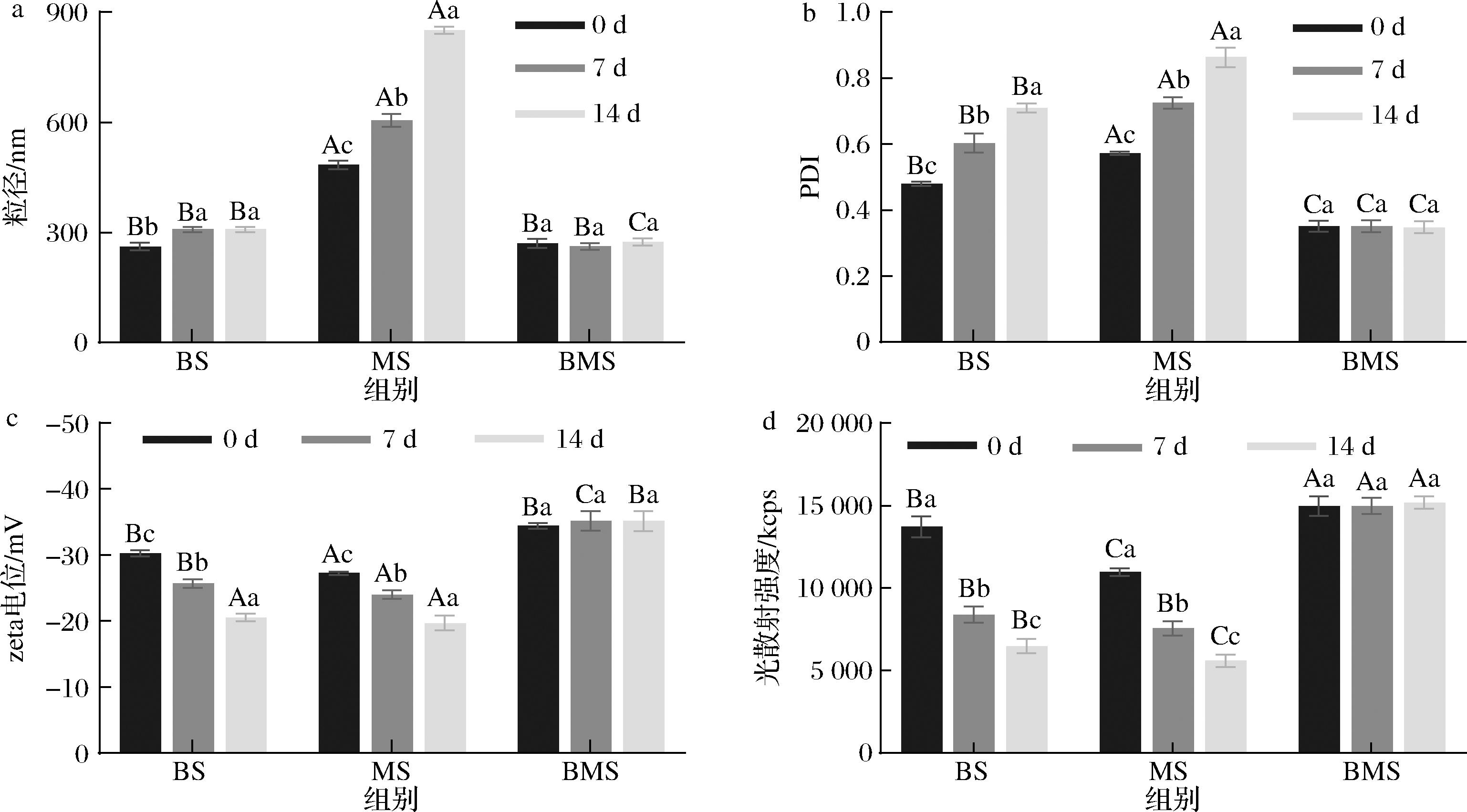
a-粒径;b-PDI值;c-zeta电位;d-光散射强度
图4 不同冻藏时间3组羊汤CNPs的胶体学性质比较
Fig.4 Comparison of colloidal properties of CNPs in three groups at different frozen period
PDI值是是衡量粒径分布,表征溶液体系均一性的重要指标。PDI值越小,粒子间距越均匀,表明溶液体系的分散性越好,如图4-b所示。随着冻藏时间的增加,BS和MS组的CNPs PDI值显著增加(P<0.05),而BMS组CNPs PDI值无显著变化(P>0.05)。PDI结果说明BS和MS组CNPs分散性随冻藏时间的增加而变差,结合粒径数据推测是由于BS和MS组的CNPs发生了一定程度的聚集;而BMS组CNPs PDI值始终在0.35左右,颗粒分散性良好。
Zeta电位值用来表征溶液中粒子带电荷数目的多少,代表着带同种电荷的两粒子之间的斥力大小,是对颗粒之间相互排斥或吸引强度的度量,也是衡量溶液体系稳定性的重要指标。Zeta电位绝对值越高,溶液体系状态越稳定,即溶解或分散的粒子远大于聚集的。反之,zeta电位绝对值越低,分散粒子越倾向于凝结,即粒子之间的吸引力超过排斥力,聚集的粒子数量远大于溶解或分散的。如图4-c所示,随着冻藏时间的增加,BS和MS组CNPs 的zeta电位绝对值显著减小(P<0.05),BMS组CNPs zeta电位绝对值无显著差异(P>0.05)。Zeta电位结果说明BS和MS组CNPs的絮凝倾向性随冻藏时间的增加而增加,这与其颗粒尺寸和PDI值增加结果相符,说明其稳定性变差;BMS组CNPs zeta电位绝对值无显著差异(P>0.05),且始终保持在-34 mV左右,说明其稳定性良好。
光散射强度是马尔文激光粒度仪中衡量粒子状态的重要指标,光散射强度增加意味着粒子聚集,光散射强度减弱则意味着粒子沉淀或溶解。如图4-d所示,随着冻藏时间的增加,BS和MS组的CNPs光散射强度显著减小(P<0.05),BMS组光散射强度无显著差异(P>0.05)。BS和MS组CNPs光散射强度与蛋白质和脂质变化趋势一致,说明光散射强度的减小可能是营养物质降解导致;BMS组CNPs光散射强度无显著差异(P>0.05),说明其稳定性良好。综上所述,BMS组CNPs的胶体学性质冻藏稳定性最优。
2.3 CNPs的形貌观察
SEM是利用电子束轰击样品表面,通过其相互作用产生的电子来观察和分析样品形貌的一种观察仪器。将冻藏0、7、14 d的3组羊汤CNPs于SEM下观察形貌,如图5所示,BS组CNPs形貌无较大改变,仍为灰白色偏方球形颗粒,但随着冻藏时间的增加发生了严重的聚集和堆叠,同时颗粒尺寸有所增加;羊肉汤CNPs形貌发生较大改变,从球形颗粒聚集成连片珊瑚状,这可能是导致其粒径增大的原因;羊骨肉汤CNPs形貌几乎无变化,仍为球形颗粒且分散性良好。这3组CNPs的SEM形貌观察结果与其胶体学性质冻藏稳定性结果一致,进一步说明BMS组的CNPs冻藏稳定性最优。GAO等[22]观察到圆球形貌的猪骨汤胶体纳米颗粒,与本实验羊骨汤中观察到的方形形貌不同,这为骨汤胶体纳米颗粒的形貌提供了图片线索。

图5 不同冻藏时间3组羊汤CNPs的SEM图
Fig.5 SEM images of CNPs in three groups at different frozen period
2.4 CNPs的结构表征
FT-NIR被用来评估蛋白质的二级结构,具有高灵敏度和高测量精度的优势。如图6所示,3组羊汤CNPs在3 500~500 cm-1范围具有特征红外吸收峰,3 500~3 100 cm-1处出现的吸收峰表示分子内或分子间的O—H伸缩振动和/或—NH/—NH3+的N—H键伸缩振动,存在着分子间和分子内的氢键[23-24];在2 920~2 860 cm-1处出现的吸收峰是—CH2或—CH3的C—H反对称伸缩振动[25];在1 420~1 360 cm-1处出现的吸收峰是C—H的弯曲振动,这是蛋白质—CH3 和—CH2的对称变形[26-28];在1 090~1 020 cm-1处出现的吸收峰是C—N的伸缩振动[29]。
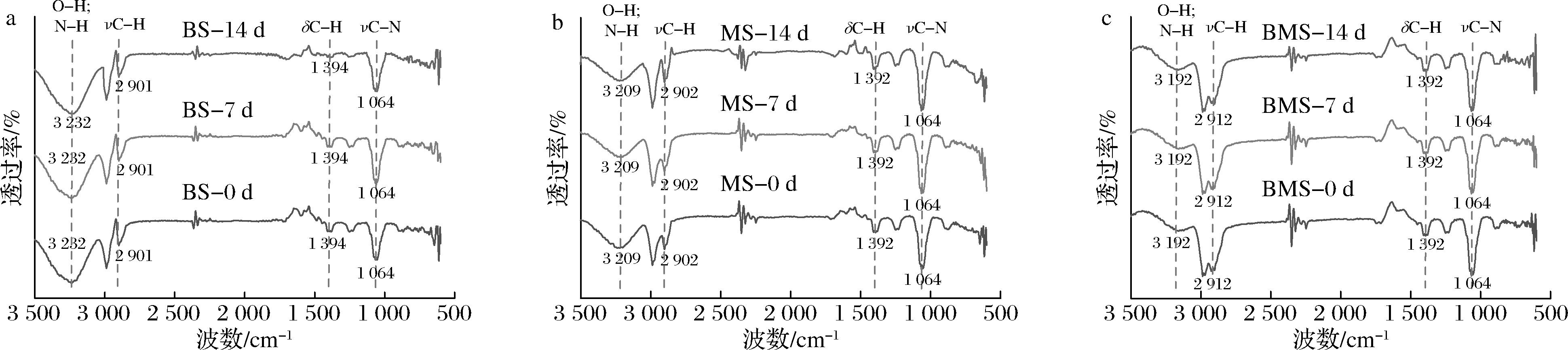
图6 不同冻藏时间3组羊汤CNPs的FT-NIR光谱图
Fig.6 FT-NIR spectroscopy of CNPs in three groups at different frozen period
如图6-a所示,BS组CNPs出现的吸收峰有3 238、2 899、1 392、1 062 cm-1,其中1 062 cm-1处出现的C—N的伸缩振动的峰高随冻藏时间的增加而增大。如图6-b所示,其中3 217 cm-1处出现的分子内或分子间O—H伸缩振动和/或N—H键伸缩振动的峰高随冻藏时间的增加而增大。如图6-c所示,其吸收峰位置与高度均无显著变化。FTIR结果说明冻藏时间对CNPs的官能团种类无影响,但由于在冻藏过程中营养物质的分解使得更多基团暴露,会导致红外吸收强度增大。HU等[30]发现羊骨胶原蛋白在3 422、2 920、1 416 cm-1处出现吸收峰,这与本实验测出的红外吸收峰一致。
3 结论
通过营养成分和胶体学性质分析,结合SEM形貌观察和FT-NIR结构表征评价了不同原料组羊汤CNPs在不同冻藏时间下的变化。营养成分分析表明,随着冻藏时间的增加,3组羊汤CNPs的蛋白质质量浓度和甘油三酯浓度随之减少,其中BS和MS组减少较为显著(P<0.05);总糖质量浓度随之增加,3组羊汤CNPs增加均显著(P<0.05);其中,BMS组CNPs的营养成分变化最小。胶体学性质表明,BS和MS组的CNPs颗粒尺寸和PDI值随冻藏时间的增加而增加,zeta电位绝对值和光散射强度随之减小;而BMS组CNPs的胶体学性质无显著性变化(P>0.05)。SEM表明,BS和MS组的CNPs颗粒尺寸增大并出现了聚集,与胶体学性质结果一致,而BMS组CNPs的颗粒形貌及尺寸无明显变化且分散良好。FT-NIR表明,3组CNPs的官能团无变化,但BS和MS组CNPs的透过率有所增加。综上所述,在3个原料组中BMS组分离出的CNPs冻藏稳定性最佳,即在短期冻藏过程中羊汤类预制菜中采用羊骨和羊肉结合的原料组最优,研究结果对预制菜中羊汤原料的选择提供了理论参考。
[1] 陈春梅. 超声波辅助炖煮羊肉汤的工艺优化及风味分析[D].扬州:扬州大学, 2021.CHEN C M.Optimization of the technology and flavor analysis of the stewed sheep meat soup with ultrasonic-assisted[D].Yangzhou:Yangzhou University, 2021.
[2] 卞欢, 张新笑, 陈琳, 等.不同贮藏方法对鸭汤营养成分和感官品质的影响[J].食品工业科技, 2017, 38(14):258-262.BIAN H, ZHANG X X, CHEN L, et al.Influence of different storage methods on nutritional ingredient and sensory quality of duck soup[J].Science and Technology of Food Industry, 2017, 38(14):258-262.
[3] BARANOWSKA-W JCIK E, SZWAJGIER D, OLESZCZUK P, et al.Effects of titanium dioxide nanoparticles exposure on human health: A review[J].Biological Trace Element Research, 2020, 193(1):118-129.
JCIK E, SZWAJGIER D, OLESZCZUK P, et al.Effects of titanium dioxide nanoparticles exposure on human health: A review[J].Biological Trace Element Research, 2020, 193(1):118-129.
[4] 王汉玲. 鲫鱼汤的加工工艺及风味物质研究[D].南昌:江西科技师范大学, 2020.WANG H L.Study on the processing technology and flavor substances of crucian carp soup[D].Nanchang:Jiangxi Science and Technology Normal University, 2020.
[5] 张玉斌, 余群力, 聂志刚, 等.浓缩牦牛骨汤真空冷冻干燥工艺实验研究[J].食品工业科技, 2014, 35(1):259-263;362.ZHANG Y B, YU Q L, NIE Z G, et al.Experimental study on technology of vacuum freeze-drying of concentrated soup of yak bone[J].Science and Technology of Food Industry, 2014, 35(1):259-263;362.
[6] ZHANG J, LIN L, TAO N P, et al.Effect of big eye tuna (Thunnus obesus) head soup with different colloidal particle size on TG and TC deposition in FFA-exposed HepG2 cells[J].Food Science &Nutrition, 2020, 9(2):1143-1151.
[7] 刘杰. 红茶中微纳米胶粒对茶汤滋味影响的探索性研究[D].杭州:浙江工商大学, 2017.LIU J.Exploratory study on the relationship between micro-nanoparticles and taste of black tea[D].Hangzhou:Zhejiang Gongshang University, 2017.
[8] KE L J, WANG H Q, GAO G Z, et al.Direct interaction of food derived colloidal micro/nano-particles with oral macrophages[J].NPJ Science of Food, 2017, 1:3.
[9] MENG Q, ZHOU J W, GAO D, et al.Desorption of nutrients and flavor compounds formation during the cooking of bone soup[J].Food Control, 2022, 132:108408.
[10] 金永洋. 猪骨汤微纳米颗粒的分离表征及其生物效应[D].杭州:浙江工商大学, 2017.JIN Y Y.Separation, characterization and biological effect of micro-nanoparticles from porcine none soup[D].Hangzhou:Zhejiang Gongshang University, 2017.
[11] REICHELT W N, WALDSCHITZ D, HERWIG C, et al.Bioprocess monitoring:Minimizing sample matrix effects for total protein quantification with bicinchoninic acid assay[J].Journal of Industrial Microbiology &Biotechnology, 2016, 43(9):1271-1280.
[12] KONG M W, GAO Y, XIE Y Y, et al.Mechanism of GLP-1 receptor agonists-mediated attenuation of palmitic acid-induced lipotoxicity in L6 myoblasts[J].BioMed Research International, 2022, 2022:6237405.
[13] EHINGER F J, NEFF A, KOSCIOW K, et al.Rapid, real-time sucrase characterization:Showcasing the feasibility of a one-pot activity assay[J].Journal of Biotechnology, 2022, 354:21-33.
[14] LIU Q Y, CHEN J J, QIN Y, et al.Zein/fucoidan-based composite nanoparticles for the encapsulation of pterostilbene:Preparation, characterization, physicochemical stability, and formation mechanism[J].International Journal of Biological Macromolecules, 2020, 158:461-470.
[15] ZHAO T, YANG B W, JI S Y, et al.Effects of the structure and interaction force of phytosterol/whey protein isolate self-assembly complex on phytosterol digestion properties[J].Food Chemistry, 2023, 403:134311.
[16] 罗云方. 预制调理羊骨高汤的研制[D].长沙:湖南农业大学, 2021.LUO Y F.Development of prefabricated mutton bone broth[D].Changsha:Hunan Agricultural University, 2021.
[17] 孙杰. 高品质方便羊肉汤锅加工新工艺的研究[D].成都:成都大学, 2020.SUN J.Studies on new processing technology of convenient mutton soup with high quality[D].Chengdu:Chengdu University, 2020.
[18] ZHAO B, SUN B G, WANG S W, et al.Effect of different cooking water on flavor characteristics of mutton soup[J].Food Science &Nutrition, 2021, 9(11):6047-6059.
[19] 吴红洋, 江敏, 曾宪澜, 等.母乳在冷冻贮藏过程中营养成分的变化研究[J].现代食品, 2021(10):124-128.WU H Y, JIANG M, ZENG X L, et al.Study on the changes of nutrients of breast milk during freezing storage[J].Modern Food, 2021(10):124-128.
[20] 朱琪, 师希雄, 韩玲, 等.祁连清泉清炖羊肉汤挥发性化合物的检测[J].食品与发酵科技, 2017, 53(4):109-114.ZHU Q, SHI X X, HAN L, et al.Detection of volatile compounds in stewed lamb soup of Qilian qingquan[J].Food and Fermentation Sciences &Technology, 2017, 53(4):109-114.
[21] 王彧瑶. 不同贮藏时间和温度对谷子和小米营养成分的影响[D].太谷:山西农业大学, 2020.WANG Y Y.The effect of the storage times and temperatures on nutritional composition of foxtail millet and millet[D].Taigu:Shanxi Agricultural University, 2020.
[22] GAO G Z, ZHOU J W, JIN Y Y, et al.Nanoparticles derived from porcine bone soup attenuate oxidative stress-induced intestinal barrier injury in Caco-2 cell monolayer model[J].Journal of Functional Foods, 2021, 83:104573.
[23] 闫馨月, 贾亦佳, 孙诗艳, 等.大豆蛋白-黄芩素的结合机制及蛋白构象和功能变化[J].食品科学, 2023, 44(4):91-98.YAN X Y, JIA Y J, SUN S Y, et al.Binding mechanism and conformation and functional changes of soybean protein-baicalein complexes[J].Food Science, 2023, 44(4):91-98.
[24] ANDRADE L A, NUNES C A, PEREIRA J.Relationship between the chemical components of taro rhizome mucilage and its emulsifying property[J].Food Chemistry, 2015, 178:331-338.
[25] ZHAN F C, YANG J C, LI J, et al.Characteristics of the interaction mechanism between tannic acid and sodium caseinate using multispectroscopic and thermodynamics methods[J].Food Hydrocolloids, 2018, 75:81-87.
[26] 马高兴, 王晗, 杨文建, 等.不同提取工艺对杏鲍菇多糖结构特征及免疫活性的影响[J].食品科学, 2022, 43(17):42-49.MA G X, WANG H, YANG W J, et al.Effects of different extraction processes on structural characteristic and immunomodulatory activity of Pleurotus eryngii polysaccharide[J].Food Science, 2022, 43(17):42-49.
[27] LIN L H, XIE J H, LIU S C, et al.Polysaccharide from Mesona chinensis: Extraction optimization, physicochemical characterizations and antioxidant activities[J].International Journal of Biological Macromolecules, 2017, 99:665-673.
[28] YANG D D, LIN F D, HUANG Y Y, et al.Separation, purification, structural analysis and immune-enhancing activity of sulfated polysaccharide isolated from sea cucumber viscera[J].International Journal of Biological Macromolecules, 2020, 155:1003-1018.
[29] SOTO-MADRID D, PÉREZ N, GUTIÉRREZ-CUTI O M, et al.Structural and physicochemical characterization of extracted proteins fractions from chickpea (Cicer arietinum L.) as a potential food ingredient to replace ovalbumin in foams and emulsions[J].Polymers, 2022, 15(1):110.
O M, et al.Structural and physicochemical characterization of extracted proteins fractions from chickpea (Cicer arietinum L.) as a potential food ingredient to replace ovalbumin in foams and emulsions[J].Polymers, 2022, 15(1):110.
[30] HU G H, LI X T, SU R N, et al.Effects of ultrasound on the structural and functional properties of sheep bone collagen[J].Ultrasonics Sonochemistry, 2023, 95:106366.