淀粉在食品工业中被广泛用作稳定剂、乳化剂、增稠剂和胶凝剂,但天然淀粉由于高黏度、加热不稳定和易回生等问题而限制了其在食品加工中的应用。现已使用物理、化学或生物方法来尝试改善淀粉的此类问题[1],如不同种类淀粉复配便可有效改善淀粉基食品流变性质和质地[2],复配淀粉的性质与淀粉中直链淀粉含量、不同淀粉的复配比例有关。蜡质马铃薯淀粉和蜡质大米淀粉以20∶80(质量比)复配时其共混物凝胶蜂窝状孔径最小,结构最致密,消化水平较低[3];高直链玉米淀粉和小麦淀粉1∶1复配后,可使回生率降低,胶凝和增稠能力增强[4]。玉米植株基因突变后的不同品种可产出蜡质玉米淀粉、普通玉米淀粉和高直链玉米淀粉,蜡质玉米淀粉的直链淀粉含量为0~8%,普通玉米淀粉的直链淀粉含量为25%~28%,高直链玉米淀粉的直链淀粉含量大于50%(以上均为质量分数)[5]。这些淀粉因为直链/支链比例不同,在颗粒结构、理化性质等方面存在差异。与普通玉米淀粉相比,蜡质玉米淀粉含有少量或不含直链淀粉,糊化黏度更高,回生趋势更低,常用作食品工业中的填充剂、增稠剂和稳定剂,如生产布丁、酱汁和面包[6]。高直链玉米淀粉直链淀粉含量较高,糊化温度高,回生快,可用于薄膜、涂料、纺织品、纸张和可生物降解的软包装[7]。将蜡质玉米淀粉加入普通玉米淀粉可降低其凝胶强度和热稳定性[8];高直链玉米淀粉添加到蜡质木薯淀粉中其糊化黏度降低、凝胶硬度增加[9]。因此复配淀粉的理化性质因体系中直链淀粉含量不同而异。
超高压(high hydrostatic pressure,HHP)处理主要是通过破坏或改变淀粉分子内部或分子之间的非共价相互作用(如氢键和范德华力[10-11]),改变淀粉分子结构,改善淀粉理化性质(如回生值和黏度降低,凝胶性能和冻融稳定性增强)[11-12]。HHP处理可以实现淀粉非热糊化,但其对高直链玉米淀粉和蜡质玉米淀粉的糊化特性影响不同。前述已有将不同直链/支链含量的玉米淀粉复配的研究,但将HHP处理应用于高直链玉米淀粉-蜡质玉米淀粉复配体系的研究较少。为此,本研究以高直链玉米淀粉、蜡质玉米淀粉为实验对象,构建不同直链淀粉含量的复配体系,探究复配比例及HHP处理对其多尺度结构和理化性质(如流变学、消化特性)的影响,以期为超高压处理改性复配淀粉提供理论依据。
1 材料与方法
1.1 材料与试剂
高直链玉米淀粉(直链淀粉质量分数为63%),上海源叶生物科技有限公司;蜡质玉米淀粉(支链淀粉质量分数为99%),Ingredion公司。
1.2 仪器与设备
SHPP-2L超高压设备,山西力德福科技有限公司;FA2104型高精数显电子天平,上海舜宇恒平科学仪器有限公司;TA.XT Plus物性测定仪,英国Stable Micro System公司;BX43正置显微镜,日本OLYMPUS公司;RVA-TecMaster快速黏度分析仪,瑞典波通仪器有限公司;DHR-1流变仪,美国TA公司;Phenom Pro10102扫描电镜,荷兰Phenom World公司;Mastersizer 3000激光粒度仪,英国马尔文仪器有限公司;XRD-7000 X射线衍射分析仪,日本岛津公司;Spectrum100傅里叶红外光谱仪,美国PerkinElmer公司;DHG-9245A电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司。
1.3 实验方法
1.3.1 样品制备
以直链淀粉含量为参考,为使复配淀粉中直链淀粉相对含量分别为63%、50%、25%、0%(质量分数),因此将高直链玉米淀粉与蜡质玉米淀粉分别设置为质量比5∶0,4∶1,2∶3,0∶5,将每种比例的复配淀粉配制成150 g/L的悬浮液,取300 mL置于聚乙烯袋内真空密封,随后将样品放入超高压设备中,设置参数为600 MPa、30 min进行HHP处理,分别命名为H5∶0,H4∶1,H2∶3,H0∶5。处理完成后于40 ℃烘箱中干燥,打粉过100目筛备用。同时以不进行HHP处理的复配淀粉作为对照,分别命名为Y5∶0,Y4∶1,Y2∶3,Y0∶5。
1.3.2 粒径分析
称取1.0 g样品,置于激光粒度分析仪的样品池中,加入蒸馏水,用超声波振荡2 min,使淀粉颗粒均匀分布,当遮光率达到8%~20%时,测定粒径范围及分布。测试条件:颗粒折射率1.520;分析模式通用;分散剂蒸馏水;分散剂折射率1.33。
1.3.3 凝胶质构特性的测定
参考游刚等[13]的方法略作修改,配制100 g/L的淀粉溶液沸水浴30 min后装入固定容器,于4 ℃冷藏24 h。在质地剖面分析模式下,探头采用P/0.5,测前、测试和测后速率2 mm/s,形变量50%,触发力5.0 g,触发时间5 s。
1.3.4 溶解度和膨胀力的测定
参考LEI等[14]的方法略作修改,制备20 g/L淀粉悬液,在沸水浴中振荡30 min。冷却后,3 500 r/min离心10 min,上清液在105 ℃干燥至恒重。溶解度(solubility,S)和膨胀度(swelling capacity,B)按公式(1)和公式(2)计算:
(1)
(2)
式中:P,沉淀质量,g;A,上清液干重,g;W,淀粉质量(干基),g。
1.3.5 流变学特性的测定
1.3.5.1 静态流变特性
参考YANG等[15]的方法略作修改。使用快速黏度分析仪制备的淀粉糊,平板直径40 mm,设置间隙1 000 μm,温度50 ℃。剪切速率在0.1~300 s-1增加,再降至0.1 s-1,使用幂律方程(Power-Law)对数据进行建模,如公式(3)所示:
δ=Kγn
(3)
式中:δ,剪切应力,Pa;K,稠度系数,Pa·sn;γ,剪切速率,s-1;n,流体指数。
1.3.5.2 动态黏弹特性
频率扫描:以角频率0~100 rad/s、温度50 ℃、应变1%,进行频率扫描。
温度扫描:以应变1%、5 ℃/min的速率从50 ℃升至95 ℃,进行温度扫描。
1.3.6 糊化特性的测定
参考LEI等[14]的方法略作修改,取3.0 g样品放入快速黏度分析仪(rapid visco analyser,RVA)专用铝盒中,加入25.0 g蒸馏水,设置初始温度为50 ℃并保持1 min,以12 ℃/min将温度升至95 ℃,保持2.5 min,以12 ℃/min将温度降至50 ℃,保持2 min。
1.3.7 X射线衍射分析
参考李奎等[16]的方法略作修改。X射线源为Cu-Kα射线,管电压40 kV,管电流40 mA,扫描速率5°/min,步长0.02°,扫描范围4°~50°。用Jade 6.0计算相对结晶度(relative crystallinity,RC)。
1.3.8 傅里叶红外光谱分析
参考YANG等[15]的方法略作修改,将提前烘干的KBr与淀粉以30∶1(质量比)混合,研磨成细粉,采用压片法置于红外光谱仪上进行扫描。扫描光谱范围为4 000~400 cm-1,分辨率为0.4 cm-1,扫描次数64,记录样品的红外光谱。
1.3.9 颗粒形貌观察
将干燥后的样品粉末配制成淀粉悬浮液,置于普通光学显微镜下观察。
将干燥后的样品粉末固定在扫描电子显微镜(scanning electron microscopy,SEM)的样品台上,再喷一层金薄膜,在5 kV加速电压下观察淀粉颗粒的表观形貌,放大倍数为12 000倍。
1.3.10 淀粉体外消化特性的测定
参考ZENG等[17]的方法略作修改,进行淀粉体外消化特性的测定。
标准曲线绘制:取葡萄糖配制成0.0、0.2、0.4、0.6、0.8、1.0 mg/mL系列梯度标准溶液,用DNS法测定还原糖含量,绘制标准曲线。
称取0.5 g样品,加入10 mL 0.1 mol/L醋酸钠缓冲液(pH 5.2),沸水浴糊化20 min,冷却后加入5 mL混合酶液[取9 U/mg猪胰α-淀粉酶和100 000 U/mL淀粉葡糖苷酶共同加入0.1 mol/L醋酸钠缓冲液(pH 5.2),使猪胰α-淀粉酶浓度为290 U/mL,淀粉葡糖苷酶为15 U/mL],于37 ℃水浴锅加热振荡,分别在0、20和120 min时吸取0.1 mL酶解样品,加入0.9 mL无水乙醇灭酶,离心取上清液,用DNS法测定还原糖含量,快消化淀粉(rapidly digestible starch,RDS)、慢消化淀粉(slowly digestible starch,SDS)、抗性淀粉(resistant starch,RS)相对含量的计算如公式(4)~公式(6)所示:
(4)
(5)
RS/%=(1-RDS-SDS)×100
(6)
式中:G20,样品酶解20 min后产生的葡萄糖含量,mg;G120,样品酶解120 min后产生的葡萄糖含量,mg;FG,酶解前样品中葡萄糖含量,mg;m,淀粉质量,mg。
1.4 数据处理与分析
所有实验均重复3次,数据按平均值±标准差表示,P<0.05表示差异显著。采用SPSS 26.0软件对结果进行统计分析,采用OriginPro 2021软件绘图。
2 结果与分析
2.1 不同复配比例及HHP处理对淀粉粒径的影响
HHP处理前后复配淀粉的粒度分布如表1所示。Y0∶5的D90和D(4,3)分别为87.53 μm、50.73 μm;Y5∶0的D90和D(4,3)分别为23.97 μm、13.57 μm,蜡质玉米淀粉粒径>高直链玉米淀粉,与TAN等[18]测得此淀粉的粒径一致。复配淀粉平均粒径随着蜡质玉米淀粉占比增加而增大。HHP处理后,含有蜡质玉米淀粉的复配淀粉粒径显著增加,蜡质玉米淀粉的D90从87.53 μm增加到330.00 μm,D(4,3)从50.73 μm增加到162.67 μm。使用HHP处理豌豆淀粉也发现粒径增加[19]。
表1 不同复配比例及HHP处理对淀粉粒径的影响 单位:μm
Table 1 Effects of different compounding ratios and HHP treatment on starch particle size
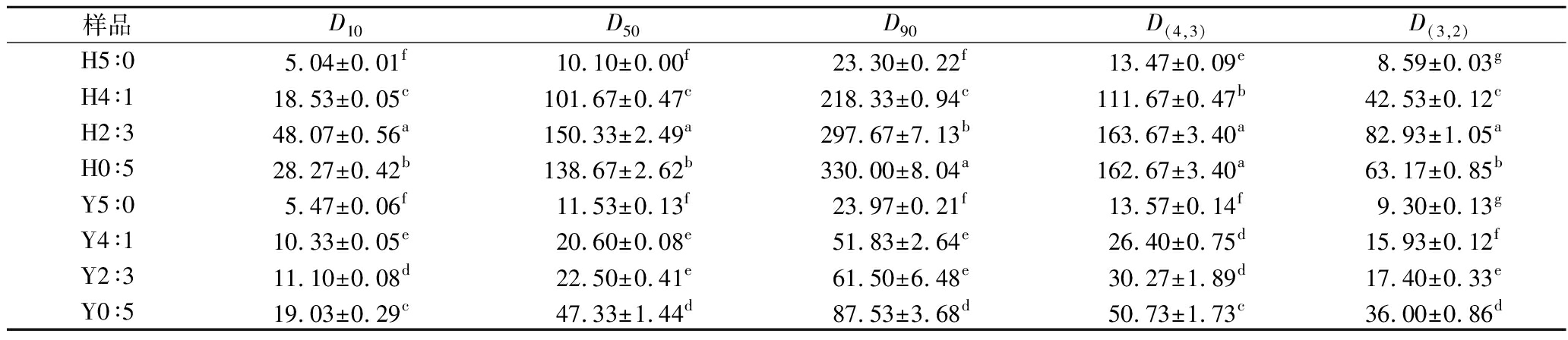
样品D10D50D90D(4,3)D(3,2)H5∶05.04±0.01f10.10±0.00f23.30±0.22f13.47±0.09e8.59±0.03gH4∶118.53±0.05c101.67±0.47c218.33±0.94c111.67±0.47b42.53±0.12cH2∶348.07±0.56a150.33±2.49a297.67±7.13b163.67±3.40a82.93±1.05aH0∶528.27±0.42b138.67±2.62b330.00±8.04a162.67±3.40a63.17±0.85bY5∶05.47±0.06f11.53±0.13f23.97±0.21f13.57±0.14f9.30±0.13gY4∶110.33±0.05e20.60±0.08e51.83±2.64e26.40±0.75d15.93±0.12fY2∶311.10±0.08d22.50±0.41e61.50±6.48e30.27±1.89d17.40±0.33eY0∶519.03±0.29c47.33±1.44d87.53±3.68d50.73±1.73c36.00±0.86d
注:不同小写字母代表差异显著,P<0.05(下同)。
由图1可知高直链玉米淀粉颗粒体积呈双峰曲线分布,而蜡质玉米淀粉呈单峰曲线分布。HHP处理后,体积分布曲线向右移动,峰型变宽,峰值下降,D(4,3)和D(3,2)显著增加。在压力作用下水分子进入淀粉颗粒的无定形区域以氢键结合并使其膨胀,发生糊化和颗粒黏附,粒径增加[20]。高直链淀粉通过再缔合作用形成更有组织的淀粉聚合物从而表现出较好的耐压性能[21],因此HHP(600 MPa/30 min)处理对高直链玉米淀粉颗粒粒径几乎没有影响。
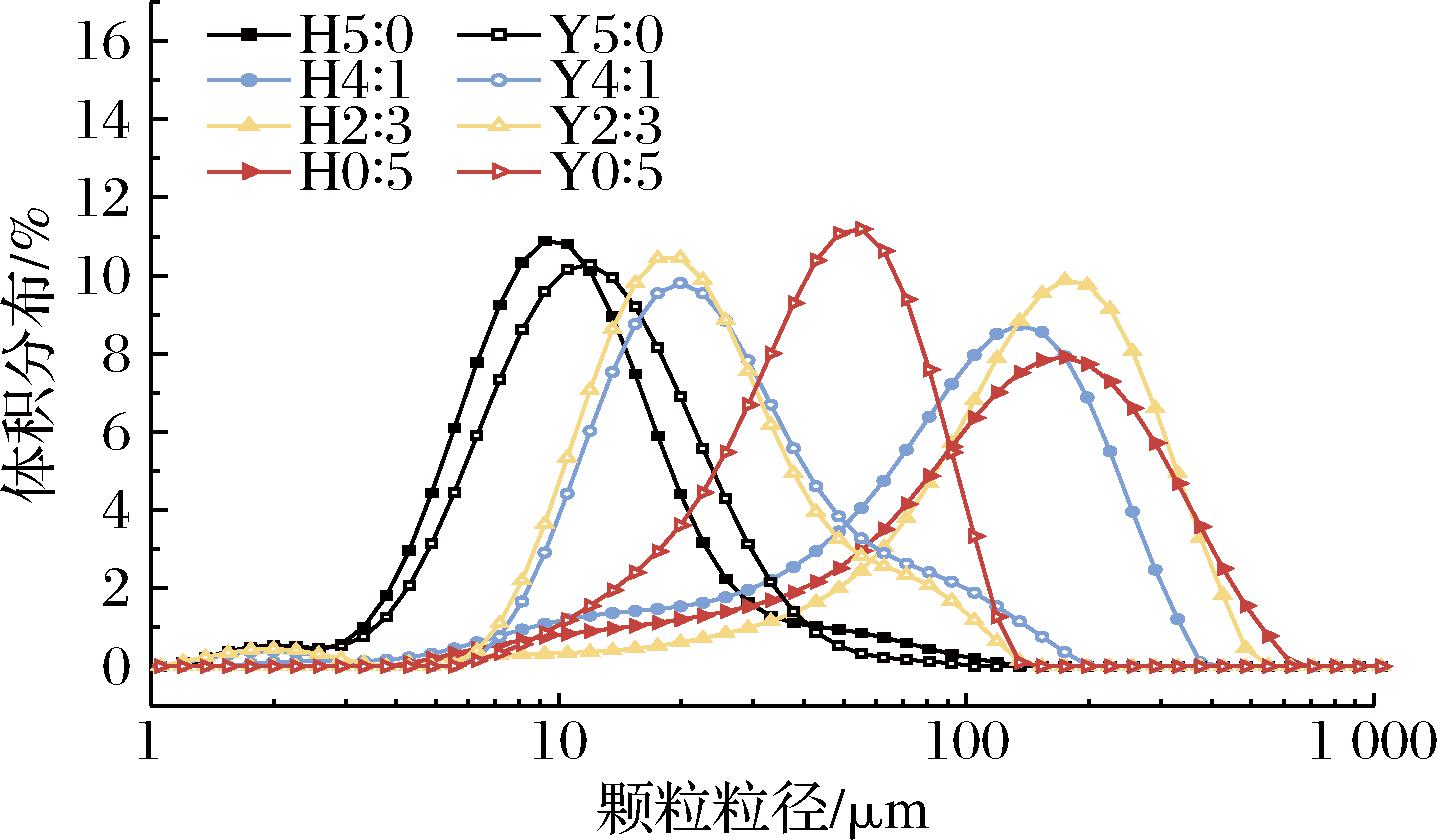
图1 不同复配比例及HHP处理对淀粉粒径的影响
Fig.1 Effects of different compounding ratios and HHP treatment on starch particle size
2.2 不同复配比例及HHP处理对淀粉凝胶质构特性的影响
复配淀粉凝胶的硬度、黏附性、内聚性、胶着性和咀嚼性均随着蜡质玉米淀粉增加而逐渐增大;HHP处理后,除了H0∶5,其他复配比例的淀粉凝胶硬度、黏附性、内聚性、胶着性和咀嚼性均降低(表2)。高直链玉米淀粉糊化温度高于100 ℃,沸水浴30 min无法形成良好凝胶;而蜡质玉米淀粉糊化后,支链淀粉交织排列,能产生成型凝胶。蜡质玉米淀粉的凝胶硬度低可能是由于缺乏直链淀粉分子,其支链淀粉分子的交联主要在外链之间产生,导致交联较少,硬度较低[22]。HHP处理使蜡质玉米淀粉糊化,支链断裂后不利于其重排,且体系中未糊化的高直链玉米淀粉分散在这些支链形成的凝胶网络结构中削弱了凝胶的性能强度。
表2 不同复配比例及HHP处理对淀粉凝胶质构特性的影响
Table 2 Effects of different compounding ratios and HHP treatment on the texture characteristics of starch gels
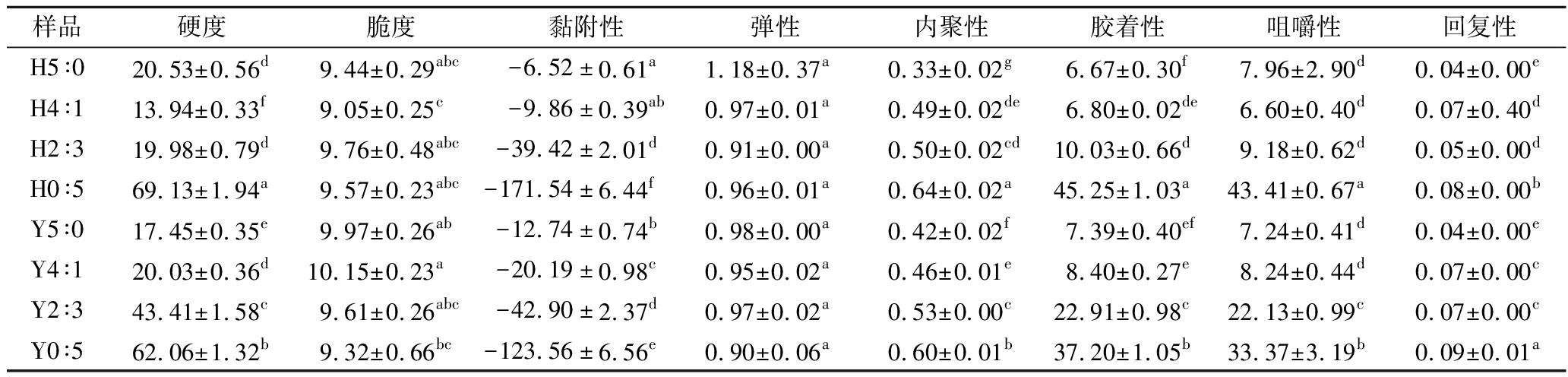
样品硬度脆度黏附性弹性内聚性胶着性咀嚼性回复性H5∶020.53±0.56d9.44±0.29abc-6.52±0.61a1.18±0.37a0.33±0.02g6.67±0.30f7.96±2.90d0.04±0.00eH4∶113.94±0.33f9.05±0.25c-9.86±0.39ab0.97±0.01a0.49±0.02de6.80±0.02de6.60±0.40d0.07±0.40dH2∶319.98±0.79d9.76±0.48abc-39.42±2.01d0.91±0.00a0.50±0.02cd10.03±0.66d9.18±0.62d0.05±0.00dH0∶569.13±1.94a9.57±0.23abc-171.54±6.44f0.96±0.01a0.64±0.02a45.25±1.03a43.41±0.67a0.08±0.00bY5∶017.45±0.35e9.97±0.26ab-12.74±0.74b0.98±0.00a0.42±0.02f7.39±0.40ef7.24±0.41d0.04±0.00eY4∶120.03±0.36d10.15±0.23a-20.19±0.98c0.95±0.02a0.46±0.01e8.40±0.27e8.24±0.44d0.07±0.00cY2∶343.41±1.58c9.61±0.26abc-42.90±2.37d0.97±0.02a0.53±0.00c22.91±0.98c22.13±0.99c0.07±0.00cY0∶562.06±1.32b9.32±0.66bc-123.56±6.56e0.90±0.06a0.60±0.01b37.20±1.05b33.37±3.19b0.09±0.01a
2.3 不同复配比例及HHP处理对淀粉溶解度和膨胀力的影响
溶解度和膨胀力可以评估淀粉颗粒的无定形和结晶域内淀粉分子链之间的相互作用程度。不同复配比例及HHP处理对淀粉溶解度和膨胀力的影响如表3所示。
表3 不同复配比例及HHP处理对淀粉溶解度和膨胀力的影响 单位:%
Table 3 Effects of different compounding ratios and HHP treatment on starch solubility and expansion capacity
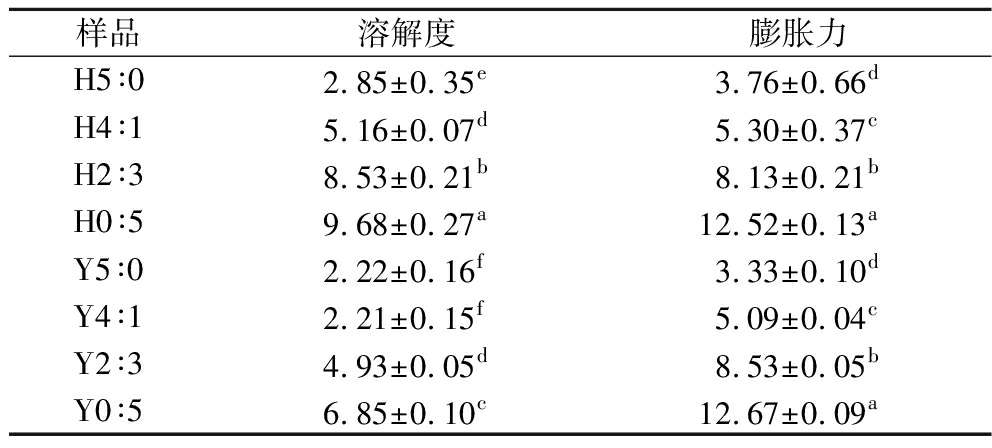
样品溶解度膨胀力H5∶02.85±0.35e3.76±0.66dH4∶15.16±0.07d5.30±0.37cH2∶38.53±0.21b8.13±0.21bH0∶59.68±0.27a12.52±0.13aY5∶02.22±0.16f3.33±0.10dY4∶12.21±0.15f5.09±0.04cY2∶34.93±0.05d8.53±0.05bY0∶56.85±0.10c12.67±0.09a
Y5∶0、Y0∶5的溶解度分别为2.22%、6.85%,膨胀力分别为3.33%、12.67%,随着蜡质玉米淀粉含量增加,复配淀粉溶解度和膨胀力逐渐增加,两者呈正相关。HHP处理后,H0∶5、H4∶1、H2∶3和H0∶5的溶解度较未处理前分别增加了28.38%、133.48%、73.02%和41.31%。蜡质淀粉中支链不如直链淀粉中直链排列紧密,在水中膨胀和溶解的能力比直链淀粉强[23]。HHP处理破坏淀粉分子结构,长链直链淀粉解聚和支链淀粉脱支导致短链淀粉链的形成,增加了溶解度[14]。HHP处理前后,复配淀粉的膨胀力未见明显差异,可能是HHP处理后糊化的蜡质玉米淀粉凝胶中一些淀粉分子在回生过程中重结晶形成晶体结构,使其在加热时不易膨胀[24]。
2.4 不同复配比例及HHP处理对淀粉流变学特性的影响
2.4.1 静态流变特性的影响
2.4.1.1 表观黏度
HHP处理前后复配淀粉凝胶黏度与剪切速率的关系如图2所示。
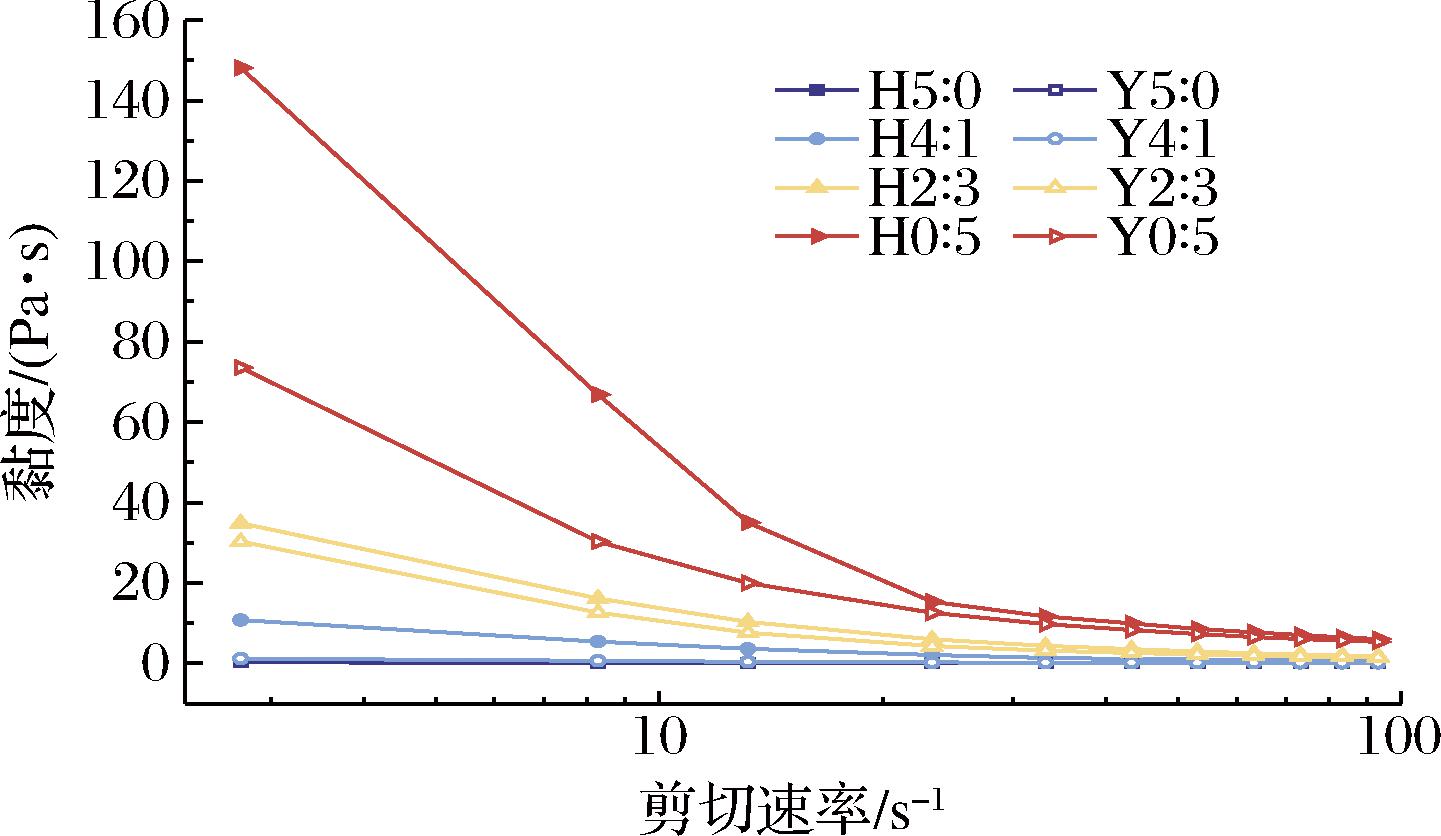
图2 不同复配比例及HHP处理对淀粉凝胶表观黏度的影响
Fig.2 Effects of different compounding ratios and HHP treatment on the apparent viscosity of starch gels
复配淀粉凝胶黏度均随着剪切速率增加而减小,表现出剪切稀化行为。这种现象是假塑性流体的典型特征,淀粉链的构象转变和剪切过程中缠结淀粉链段的损失导致淀粉大分子链间的分子间力减弱和黏度降低,体系从混沌状态过渡到均匀流动状态[25]。复配淀粉凝胶的表观黏度随着高直链玉米淀粉添加量的增加而降低。HHP处理后,含有蜡质玉米淀粉的复配淀粉凝胶的表观黏度有所增加。使用RVA糊化时,高直链玉米淀粉颗粒更耐热且耐机械剪切,其有限的膨胀和轻微糊化不利于产生高黏度,这表明高直链玉米淀粉可以增加体系的流动性。而支链淀粉糊化温度低,颗粒易破碎,支链淀粉分子容易交联缠结产生较高黏度。蜡质玉米淀粉在HHP处理后发生非热糊化,淀粉颗粒膨胀和黏附导致黏度增加。此外,破碎的支链淀粉分子链可能会缠绕包裹高直链玉米淀粉颗粒,致使分子流动性降低,体系黏度增加。
2.4.1.2 触变性
复配淀粉凝胶剪切应力和剪切速率的关系如图3所示,剪切应力均随剪切速率的增加而增大,表现出非牛顿流体特征。Y0∶5的剪切应力最大,但随着复配淀粉中高直链玉米淀粉含量增加,剪切应力逐渐减小。HHP处理使蜡质玉米淀粉糊化后其抗剪切性有所下降。同时,观察到剪切应力与剪切速率关系中出现滞后现象,即剪切对凝胶网络的破坏比其结构恢复更快,表观黏度下降,产生滞后回路,表现出触变性。较大的触变环面积表明凝胶结构的破坏程度更大,Y0∶5的触变环面积为1 323.29 Pa.s,而Y5∶0的触变环面积为61.89 Pa·s,这是由于蜡质玉米淀粉在95 ℃时已经糊化分解,分子间相互作用更容易被破坏,因此随着支链淀粉含量增加复配淀粉凝胶触变环面积增加,触变性增强。HHP处理后复配淀粉凝胶的触变环面积均增大,H2∶3和H0∶5分别增加了5倍和4倍,可能是直链淀粉和支链淀粉分子在高压下的交织导致的[26]。剪切应力和剪切速率数据通过幂律模型拟合,幂律常数K和n如表4所示。R2范围为0.947~0.999,n均小于1,所有复配淀粉凝胶表现出假塑性流体行为。随着蜡质玉米淀粉含量的增加,n值减小,K值增大。HHP处理后n值减小,K值增大。HHP处理后淀粉颗粒完整性受损,直链淀粉浸出增加,假塑性增强。
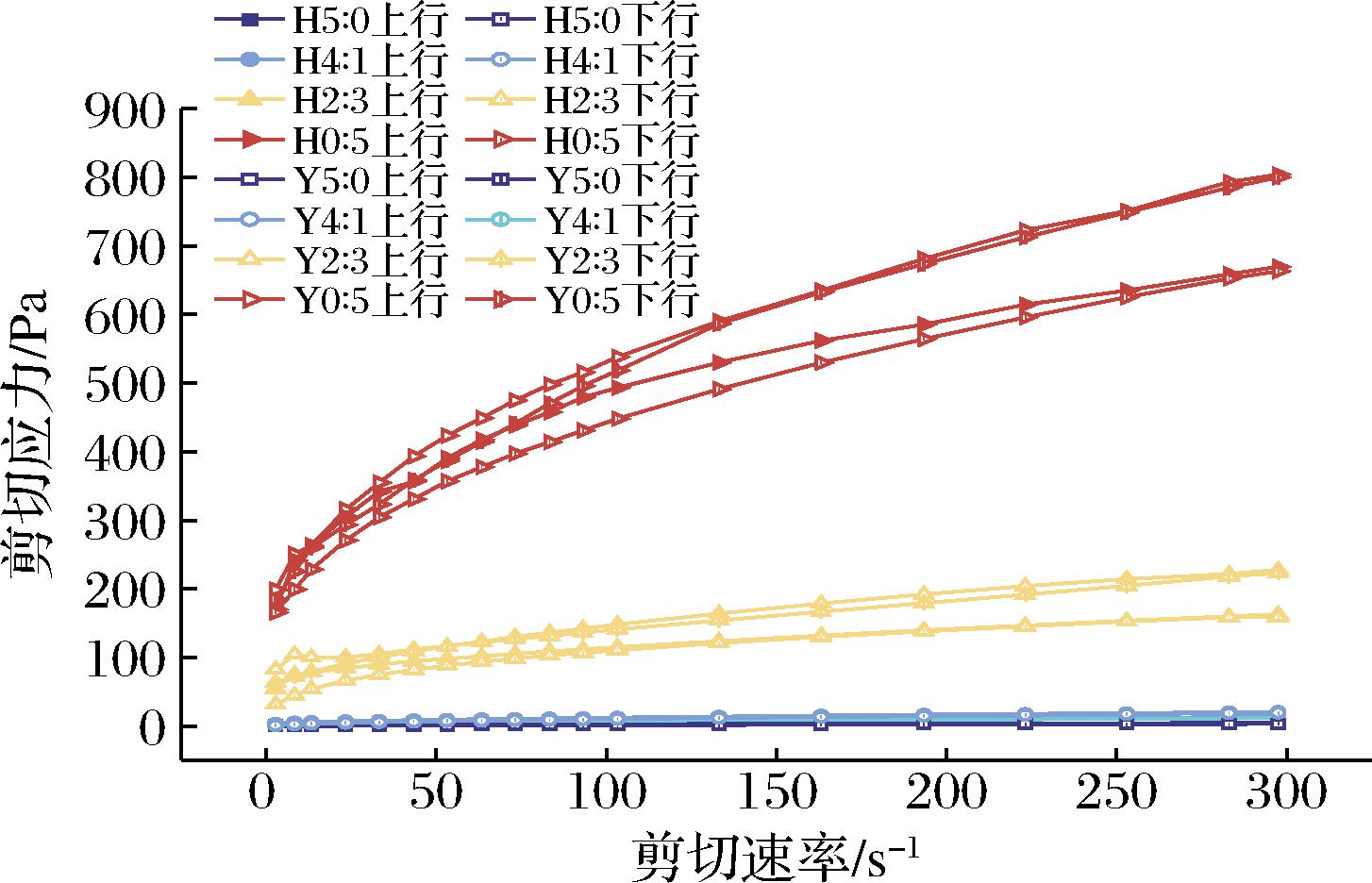
图3 不同复配比例及HHP处理对淀粉凝胶触变性的影响
Fig.3 Effects of different compounding ratios and HHP treatment on starch gels thixotropy
表4 不同复配比例及HHP处理后淀粉凝胶流变曲线的拟合参数
Table 4 Fitting parameters of starch gels rheological curves after different compounding ratios and HHP treatment
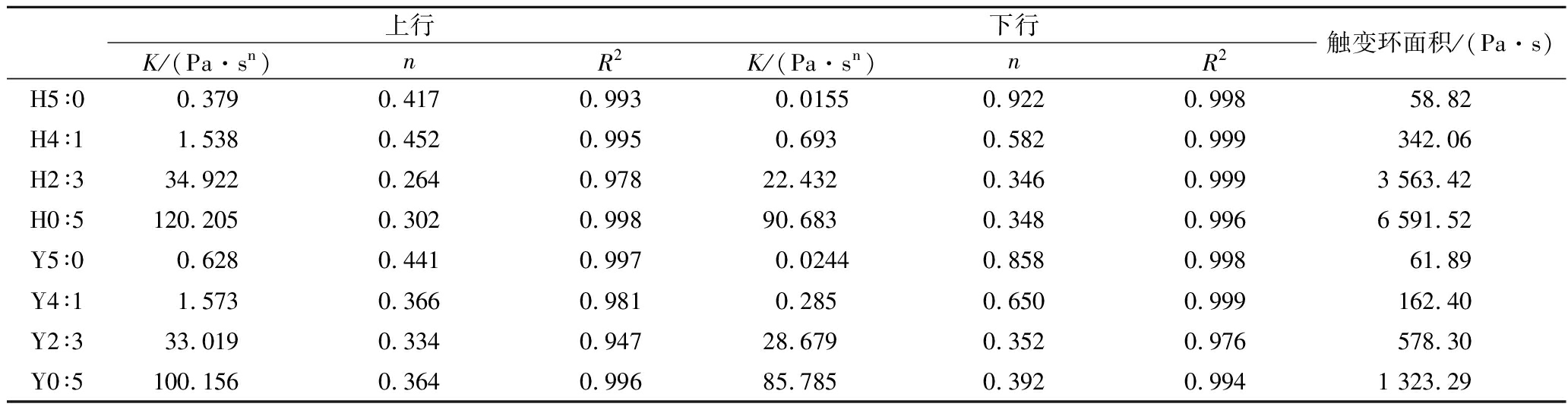
上行下行K/(Pa·sn)nR2K/(Pa·sn)nR2触变环面积/(Pa·s)H5∶00.379 0.417 0.9930.01550.922 0.99858.82H4∶11.538 0.452 0.9950.6930.582 0.999342.06H2∶334.922 0.264 0.97822.432 0.346 0.9993 563.42H0∶5120.205 0.302 0.99890.683 0.348 0.9966 591.52Y5∶00.628 0.441 0.9970.0244 0.858 0.99861.89Y4∶11.573 0.366 0.9810.285 0.650 0.999162.40Y2∶333.019 0.334 0.94728.679 0.3520.976578.30Y0∶5100.156 0.364 0.99685.785 0.3920.9941 323.29
2.4.2 动态黏弹特性的影响
2.4.2.1 频率扫描
储能模量(G′)表示每个变形循环中样品存储或回收的能量,可以反映弹性;损耗模量(G″)代表每个变形循环中样品耗尽或损失的能量,可以反映黏性。复配淀粉凝胶的G′和G″见图4,Y5∶0和H5∶0在95 ℃时未发生糊化,其体系接近于液体。其余复配淀粉凝胶G′和G″随角频率的增加而增大,且G′值始终大于G″值,表明凝胶体系主要为弹性并表现出典型的弱凝胶行为。复配淀粉凝胶G′和G″随蜡质玉米淀粉含量的增加而逐渐增大,说明支链淀粉可显著增加复配淀粉凝胶黏弹性和类固体特性。MOREIRA等[27]也表明直链淀粉/支链淀粉的比例可显著改变淀粉凝胶的黏弹性。与相同比例的复配淀粉凝胶相比,HHP处理后G′和G″显著增加,表明压力对淀粉形成有序凝胶结构有积极影响。HHP处理后蜡质玉米淀粉晶体结构受损,增加了淀粉颗粒在水溶液中受热剪切作用下的破裂程度,直链淀粉和支链淀粉释放增多,凝胶的黏弹性增强[26]。
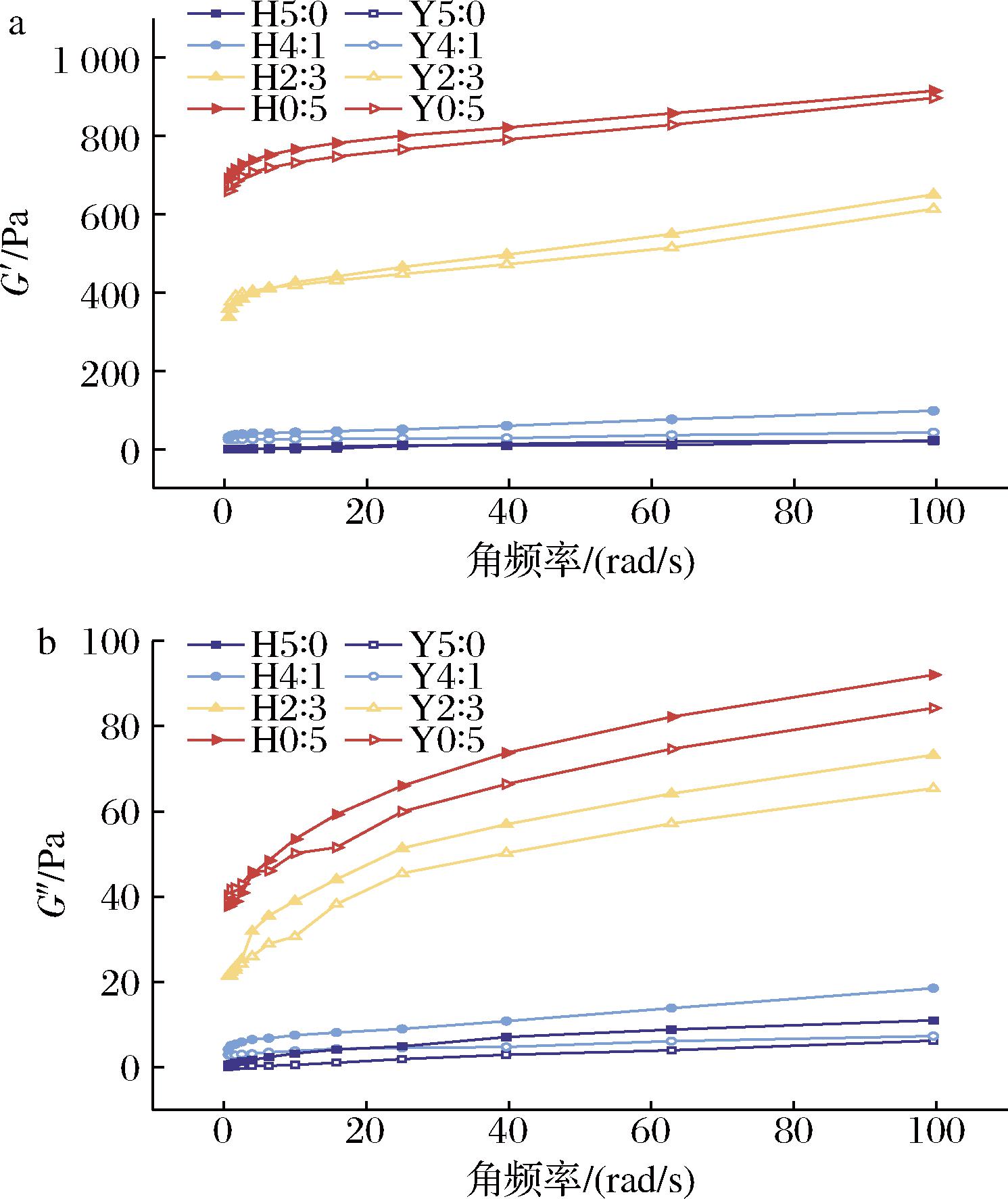
a-G′;b-G″
图4 不同复配比例及HHP处理后淀粉凝胶G′、G″随角频率的变化
Fig.4 Changes of G′ and G″ in starch gels with angular frequency after different compounding ratios and HHP treatment
2.4.2.2 温度扫描
G′随温度升高先增大后减小,在75 ℃左右达到最大值(图5);G″则在升温过程中保持增大的趋势,复配淀粉凝胶的黏性增加;同时,RVA处理时高直链玉米淀粉并未糊化,因此Y0∶5的G′、G″远大于Y5∶0。HHP处理显著增强了复配淀粉凝胶在相同温度下的G′和G″,HHP处理使复配淀粉颗粒刚性增强,变形性减弱[28]。温度升高的初始阶段,G′增加是可能是回生的支链淀粉双螺旋被破坏吸收能量[29],但当温度达到75 ℃后,连续加热和膨胀使凝胶网络结构开始崩溃,G′降低。高压使糊化后的蜡质玉米淀粉释放出支链淀粉与其颗粒或高直链玉米淀粉的相互作用增强,致使G′和G″增加。
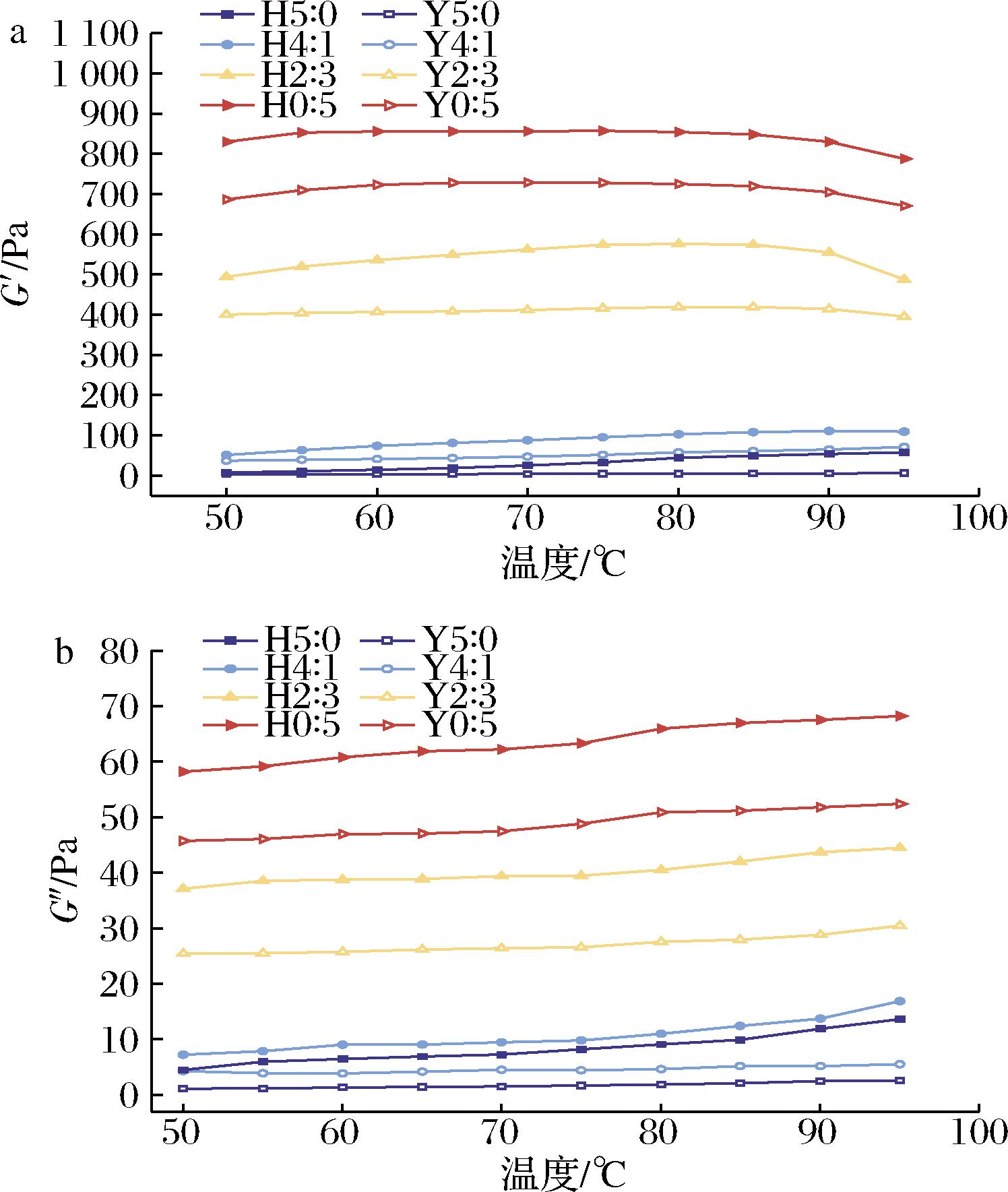
图5 不同复配比例及HHP处理后淀粉凝胶G′、G″随温度的变化
Fig.5 Changes of G′ and G″ in starch gels with temperature after different compounding ratios and HHP treatment
2.5 不同复配比例及HHP处理对淀粉糊化特性的影响
用RVA测定HHP处理前后复配淀粉糊化性能的变化如图6和表5所示。复配淀粉的糊化特征值随着支链淀粉含量增加而增加。Y0∶5的峰值黏度和最终黏度是Y2∶3的3倍;Y0∶5的糊化温度为66.22 ℃,Y2∶3为68.30 ℃,表明直链淀粉含量高则淀粉糊化温度高。HHP处理后,H0∶5和H2∶3的峰值黏度、最低黏度和最终黏度显著增加,回生值降低。H2∶3回生值为579.33 cp,较Y2∶3降低了34.6%,H0∶5的降低幅度则为18.8%。高直链玉米淀粉中直链淀粉分子相互作用形成结晶和无定形薄片,在加热后仍保持层状结构,导致其糊化温度高于100 ℃[30],这也解释了5∶0和4∶1的复配淀粉在最高温度为95 ℃的RVA测试中未发生明显的糊化行为。HHP处理破坏了支链淀粉颗粒完整性,支链淀粉膨胀溶出包裹高直链玉米淀粉,引起淀粉凝胶网络结构变化,黏度、衰减值增加,抗剪切性能降低。HHP处理后高直链玉米淀粉在蜡质玉米淀粉凝胶网络中分散,阻碍了冷却过程中淀粉分子重新聚集,抑制复配淀粉回生。
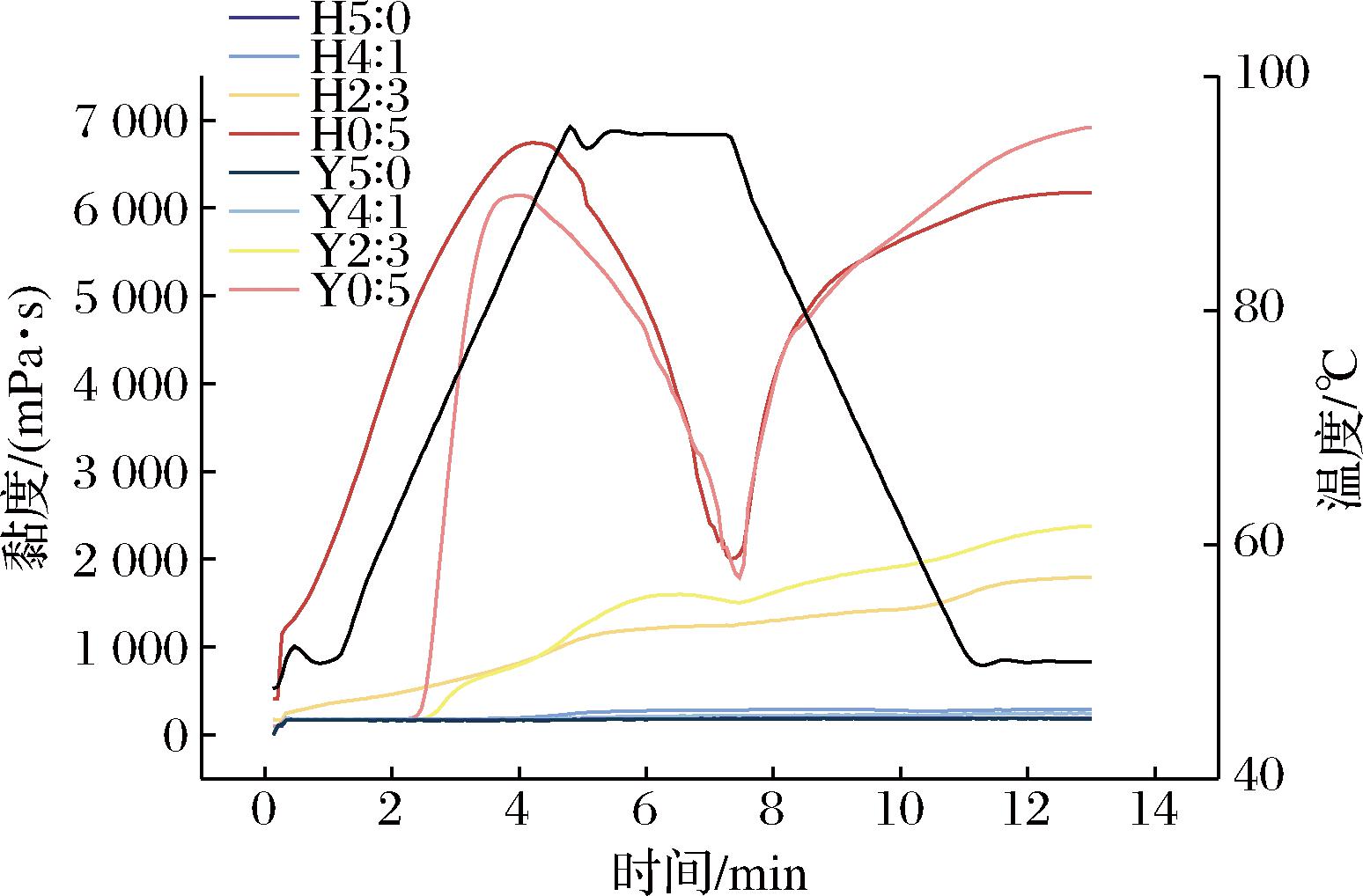
图6 不同复配比例及HHP处理对淀粉糊化特性的影响
Fig.6 Effects of different compounding ratios and HHP treatment on starch pasting properties
表5 不同复配比例及HHP处理后淀粉的糊化参数
Table 5 Pasting parameters of starch after different compounding ratios and HHP treatments
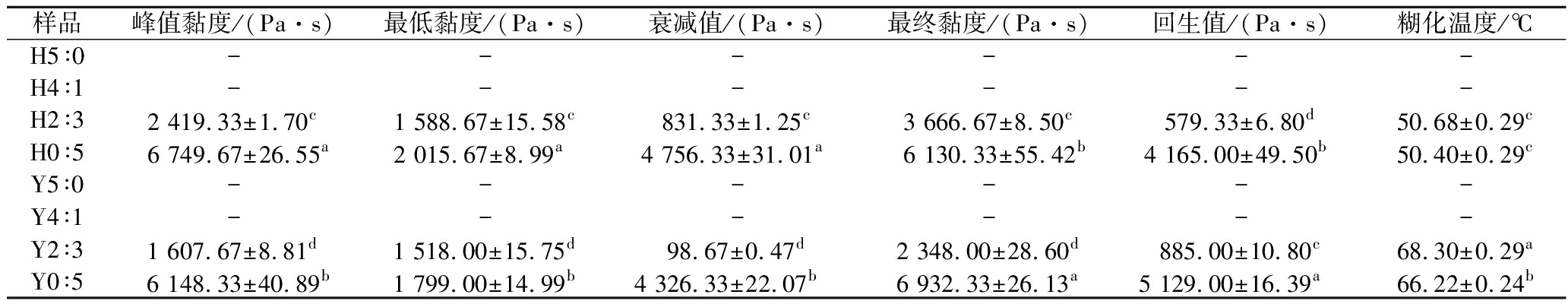
样品峰值黏度/(Pa·s)最低黏度/(Pa·s)衰减值/(Pa·s)最终黏度/(Pa·s)回生值/(Pa·s)糊化温度/℃H5∶0------H4∶1------H2∶32 419.33±1.70c1 588.67±15.58c831.33±1.25c3 666.67±8.50c579.33±6.80d50.68±0.29cH0∶56 749.67±26.55a2 015.67±8.99a4 756.33±31.01a6 130.33±55.42b4 165.00±49.50b50.40±0.29cY5∶0------Y4∶1------Y2∶31 607.67±8.81d1 518.00±15.75d98.67±0.47d2 348.00±28.60d885.00±10.80c68.30±0.29aY0∶56 148.33±40.89b1 799.00±14.99b4 326.33±22.07b6 932.33±26.13a5 129.00±16.39a66.22±0.24b
注:“-”表示未测到具体数值。
2.6 不同复配比例及HHP处理对淀粉长程有序结构的影响
HHP处理前后复配淀粉的长程有序结构如图7所示。高直链玉米淀粉在5.5°、17.0°、19.9°、22.2°和23.9°处具有衍射峰,表明高直链玉米淀粉由B+V多晶型组成,与SHEN等[21]对高直链淀粉的研究一致。蜡质玉米淀粉在15.0°、17.1°、18.0°和23.0°处具有特征衍射峰值,为A型结晶。复配淀粉呈现出混合晶型衍射图谱,Y5∶0的RC(18.90%)低于Y0∶5(41.32%)。HHP处理后高直链玉米淀粉的晶型没有变化,含有蜡质玉米淀粉的复配淀粉其晶型却趋于弱B型。压力导致蜡质玉米淀粉在15.0°和23.0°处的峰消失,17.1°和18.0°处合并为更宽的峰。HHP处理后复配淀粉RC显著降低,Y5∶0的RC从18.90%降低至16.73%(H5∶0),Y0∶5的RC从41.32%降低至17.53%(H0∶5)。直链淀粉促进无定形区域的形成而不利于长程有序结构的产生,因此RC与直链淀粉含量呈负相关。水分子在高压力作用下进入淀粉颗粒,使结晶区域中双螺旋结构受损打开后降低RC;蜡质玉米淀粉支链结构松散且易被破坏,在压力作用下双螺旋结构重排后晶体结构发生变化,也使RC降低[31]。同时也发现HHP处理后高直链玉米淀粉的RC降低远小于蜡质玉米淀粉,表明高直链玉米淀粉耐高压能力强。
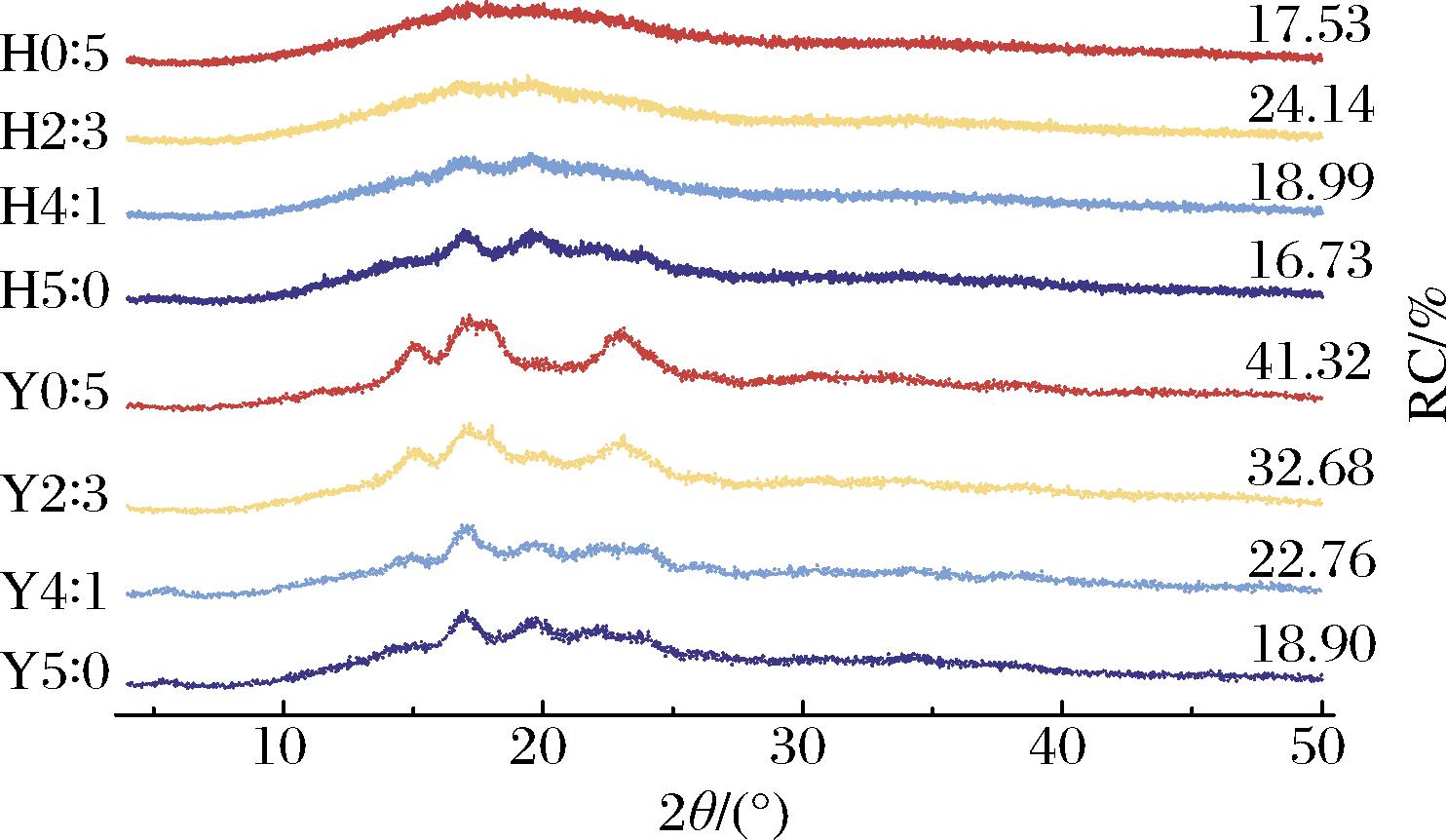
图7 不同复配比例及HHP处理对淀粉X射线衍射的影响
Fig.7 Effects of different compounding ratios and HHP treatment on X-ray diffraction of starch
2.7 不同复配比例及HHP处理对淀粉短程有序结构的影响
HHP处理前后复配淀粉的红外光谱如图8所示,没有消失峰值和产生新峰值,表明复配以及HHP处理未改变淀粉的化学结构,但峰值强度和宽度的变化也说明HHP处理改变了复配淀粉的短程有序结构。红外光谱中1 045、1 022、991 cm-1处的吸收峰分别与淀粉结晶区域、无定形区域和螺旋结构有关,可分别用比值R1 045/1 022和R1 022/991来表征淀粉的短程有序度和双螺旋结构[32],计算得到短程有序结构参数见表6。Y5∶0到Y0∶5的R1 045/1 022和R1 022/991分别从0.823增加到0.993和从1.185增加到1.435,支链淀粉含量增加有利于双螺旋结构的形成。HHP处理后的R1 045/1 022和R1 022/991呈现下降的趋势,表明淀粉的短程结构有序性降低以及双螺旋结构减少,LIU等[33]也发现HHP处理破坏玉米淀粉短程结构有序性。高直链玉米淀粉中的直链淀粉链可能通过在无定形薄片内定向聚集或与结晶薄片内的支链淀粉侧链共结晶降低淀粉的短程结构有序性,而蜡质玉米淀粉中连续分散的短支链则有助于形成双螺旋、微晶和结晶,提高短程结构有序性[34]。HHP处理诱导蜡质玉米淀粉糊化后促进了支链淀粉链重排以及水和淀粉分子的结合,导致双螺旋结构破坏、堆积密度降低[33]。此外,HHP处理后高直链玉米淀粉的R1 045/1 022从0.823上升至0.871,SHEN等[21]也发现600 MPa压力处理可能有利于高直链玉米淀粉内部分子链重新结合以形成更有序的结构。
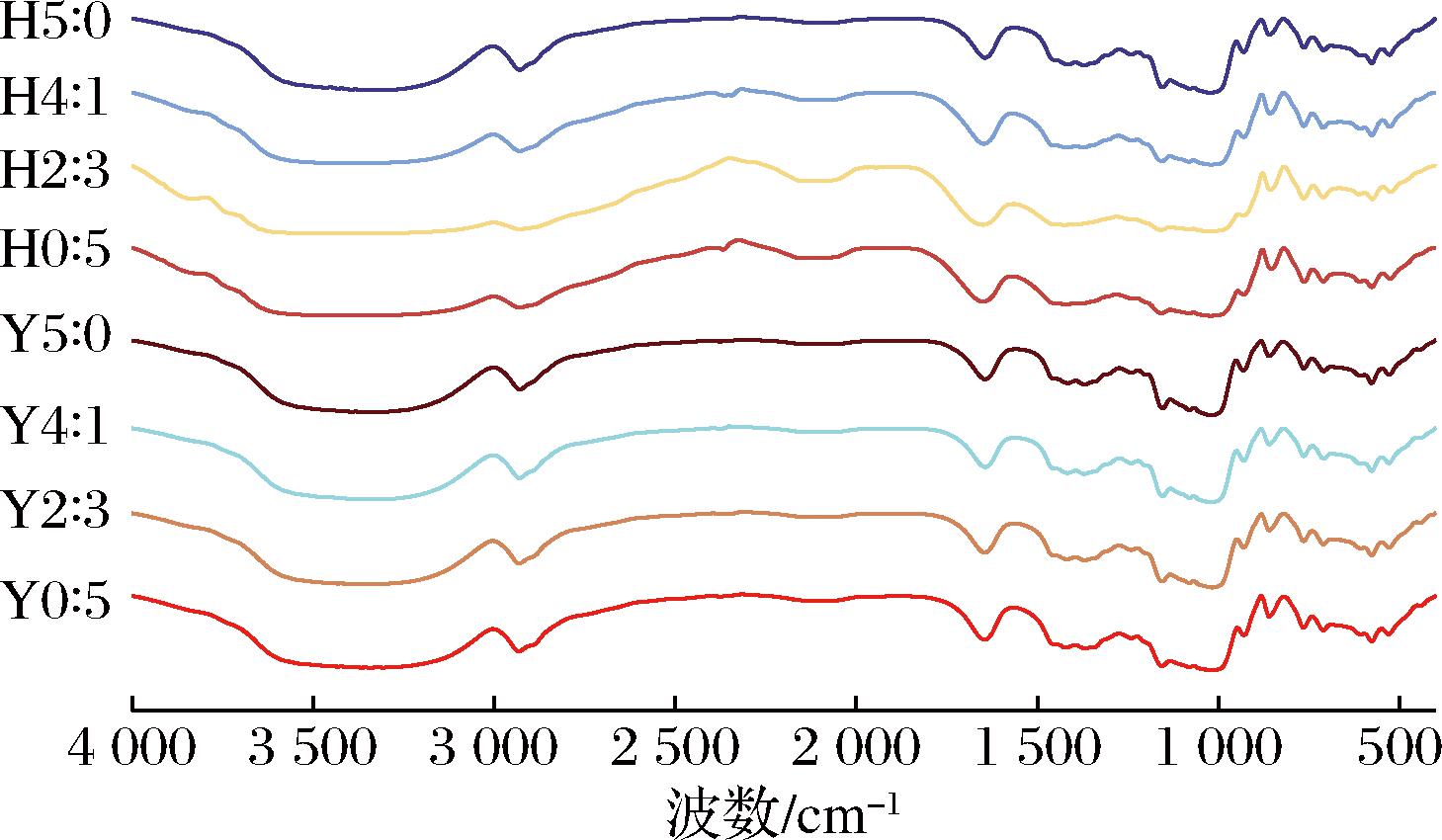
图8 不同复配比例及HHP处理对淀粉短程有序结构的影响
Fig.8 Effects of different compounding ratios and HHP treatment on the short-range ordered structure of starch
表6 不同复配比例及HHP处理后淀粉的傅里叶红外光谱分析
Table 6 Fourier infrared spectroscopy analysis of starch after different compounding ratios and HHP treatment
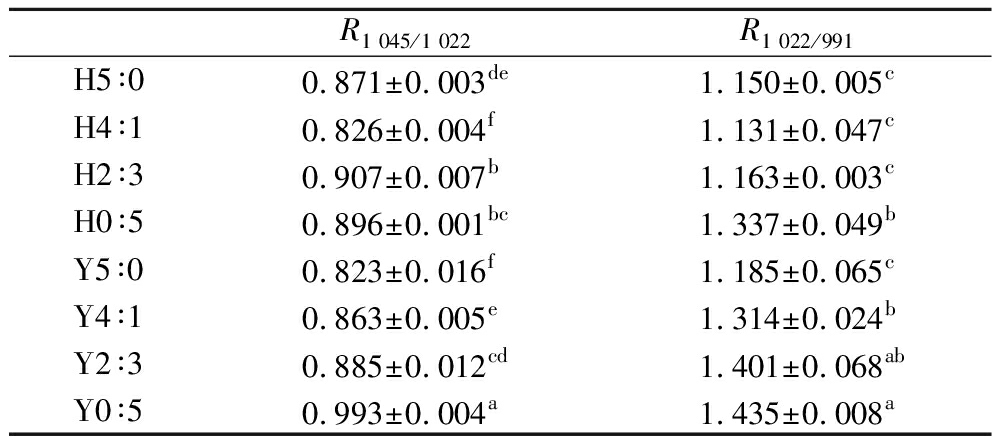
R1 045/1 022R1 022/991H5∶00.871±0.003de1.150±0.005cH4∶10.826±0.004f1.131±0.047cH2∶30.907±0.007b1.163±0.003cH0∶50.896±0.001bc1.337±0.049bY5∶00.823±0.016f1.185±0.065cY4∶10.863±0.005e1.314±0.024bY2∶30.885±0.012cd1.401±0.068abY0∶50.993±0.004a1.435±0.008a
2.8 不同复配比例及HHP处理对淀粉颗粒形貌的影响
通过光学显微镜和SEM观察了HHP处理前后复配淀粉的微观形态(图9)。天然高直链玉米淀粉颗粒呈球形、多边形等不规则形状,表面光滑;蜡质玉米淀粉颗粒主要为球形,大多数天然淀粉都保持结构完整性。当体系中两种淀粉共存时,可观察到高直链玉米淀粉颗粒体积小于蜡质玉米淀粉,与粒径分析结果一致。HHP处理后,在光学显微镜下观察到含有蜡质玉米淀粉的复配淀粉颗粒逐渐消失,出现聚集成团的块状物。SEM显示,HHP处理后含蜡质玉米淀粉的复配淀粉中淀粉颗粒膨胀并产生明显裂纹。ALMEIDA等[35]用HHP处理大米淀粉也发现了淀粉颗粒被破坏。但在压力作用下高直链玉米淀粉颗粒形状并未产生明显改变,说明直链淀粉含量高的淀粉耐压性强。HHP处理使蜡质玉米淀粉糊化聚集并将高直链玉米淀粉包裹,增大了颗粒粒径。

图9 不同复配比例及HHP处理的淀粉颗粒光学显微镜图(100×)和SEM图(12 000×)
Fig.9 Light microscopy of starch particles (100×) and SEM images (12 000×) for different compounding ratios and HHP treatment
注:a~d和A~D表示光学显微镜图;e~h和E~H表示SEM图。
2.9 不同复配比例及HHP处理对淀粉体外消化的影响
HHP处理前后复配淀粉中RDS、SDS和RS的含量如表7所示。Y5∶0的RDS、SDS和RS含量分别为22.17%、13.32%和64.51%,而随着蜡质玉米淀粉含量增加,复配淀粉RDS、SDS含量增加,RS含量降低。HHP处理后含蜡质玉米淀粉的复配淀粉RDS、RS含量降低,但SDS含量显著增加,其中H0∶5的SDS含量从40.43%增加到51.09%,H2∶3的SDS含量从23.39%增加到34.96%。在苋菜、藜麦和小麦淀粉中也发现HHP处理使SDS含量增加[36]。高直链玉米淀粉中的直链淀粉分子在加热时仍保持交叉极化,抑制颗粒在高温下破裂而降低淀粉酶解的速率[37],因此高直链玉米淀粉在复配淀粉中的比例显著影响了体系的RS含量。HHP处理破坏蜡质玉米淀粉颗粒的结晶区域,使双螺旋结构分解,降低RS含量;HHP改变了蜡质玉米淀粉凝胶中水分子和其他组分的分布,导致其在回生过程中形成具有更多无定形截面的不完美微晶,可能使SDS含量增加[38]。与RDS相比,SDS具有使餐后血糖水平上升较慢的优点,并且随着时间的推移而持续存在,可有助于预防高血糖相关疾病。
表7 不同复配比例及HHP处理对淀粉体外消化特性的影响
Table 7 Effects of different compounding ratios and HHP treatment on the in vitro digestion characteristics of starch
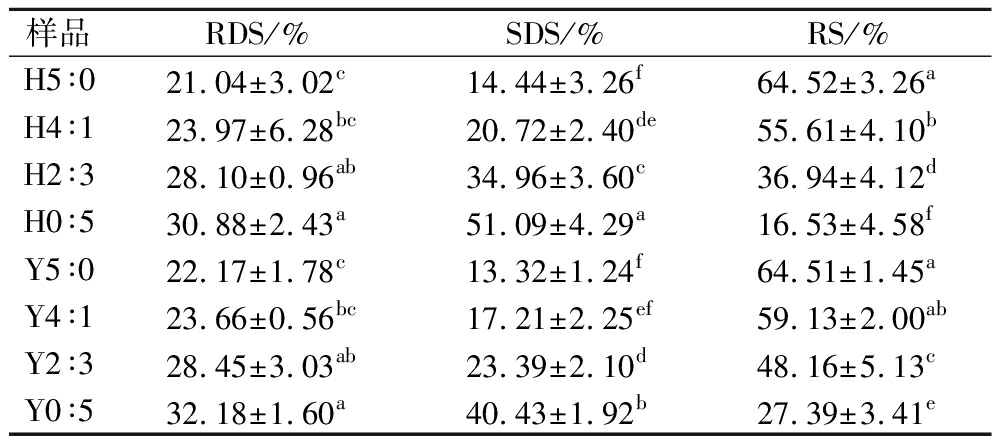
样品RDS/%SDS/%RS/%H5∶021.04±3.02c14.44±3.26f64.52±3.26aH4∶123.97±6.28bc20.72±2.40de55.61±4.10bH2∶328.10±0.96ab34.96±3.60c36.94±4.12dH0∶530.88±2.43a51.09±4.29a16.53±4.58fY5∶022.17±1.78c13.32±1.24f64.51±1.45aY4∶123.66±0.56bc17.21±2.25ef59.13±2.00abY2∶328.45±3.03ab23.39±2.10d48.16±5.13cY0∶532.18±1.60a40.43±1.92b27.39±3.41e
3 结论
随着蜡质玉米淀粉比例增加,复配淀粉溶解度、黏度、相对结晶度增加,糊化温度降低;其中Y2∶3复配淀粉具有较低回生值,可添加到面包中延缓回生并解决高直链淀粉过多造成硬度上升过大的问题;Y5∶0和Y4∶1的溶解度低、糊化温度高,可用于酱类罐头食品中使其在加热初期保持流动性与传热。HHP处理后蜡质玉米淀粉糊化,复配淀粉相对结晶度、短程结构有序性降低,溶解度增加;糊化的蜡质玉米淀粉包裹高直链玉米淀粉形成特殊凝胶网络,复配淀粉粒径、黏度、触变性增加,凝胶性能下降,可制成预糊化淀粉添加到食品中赋予其浆状或粒状组织;Y0∶5快消化性强,Y5∶0抗消化性强,HHP处理能显著增加复配淀粉中慢消化淀粉含量,可依此制备饱腹感强并降低血糖生成速率的复配淀粉。高直链玉米淀粉与蜡质玉米淀粉复配及HHP处理均可有效改善淀粉的理化和加工特性,这将为复配淀粉非热改性及其在食品、医药等领域应用提供技术参考。后续还可对不同复配比例细化探究,同时提高温度将高直链玉米淀粉糊化后探究复配淀粉的凝胶和热性能,这将为复配淀粉应用开发提供更多参考。
[1] PUNIA BANGAR S, ASHOGBON A O, SINGH A, et al.Enzymatic modification of starch:A green approach for starch applications[J].Carbohydrate Polymers, 2022, 287:119265.
[2] PUNIA S, SIROHA A K, SANDHU K S, et al.Rheological behavior of wheat starch and barley resistant starch (type IV) blends and their starch noodles making potential[J].International Journal of Biological Macromolecules, 2019, 130:595-604.
[3] MA M T, LIU Y, CHEN X J, et al.Thermal and pasting properties and digestibility of blends of potato and rice starches differing in amylose content[J].International Journal of Biological Macromolecules, 2020, 165(Pt A):321-332.
[4] YUAN T Z, AI Y F.Pasting and gelation behaviors and in vitro digestibility of high-amylose maize starch blended with wheat or potato starch evaluated at different heating temperatures[J].Food Hydrocolloids, 2022, 131:107783.
[5] WAN S M, LIU Q, YANG D M, et al.Characterization of high amylose corn starch-cinnamaldehyde inclusion films for food packaging[J].Food Chemistry, 2023, 403:134219.
[6] ZHANG Y W, JUNEJO S A, ZHANG B, et al.Multi-scale structures and physicochemical properties of waxy starches from different botanical origins[J].International Journal of Biological Macromolecules, 2022, 220:692-702.
[7] LI H T, DHITAL S, FLANAGAN B M, et al.High-amylose wheat and maize starches have distinctly different granule organization and annealing behaviour:A key role for chain mobility[J].Food Hydrocolloids, 2020, 105:105820.
[8] XIAO W H, SHEN M Y, REN Y M, et al.Controlling the pasting, rheological, gel, and structural properties of corn starch by incorporation of debranched waxy corn starch[J].Food Hydrocolloids, 2022, 123:107136.
[9] WANG H, ZHU Q M, WU T, et al.Glass transition temperature, rheological, and gelatinization properties of high amylose corn starch and waxy cassava starch blends[J].Journal of Food Processing and Preservation, 2020, 44(9):e14682.
[10] CHEN Z G, HUANG J R, PU H Y, et al.The effects of HHP (high hydrostatic pressure) on the interchain interaction and the conformation of amylopectin and double-amylose molecules[J].International Journal of Biological Macromolecules, 2020, 155:91-102.
[11] CASTRO L M G, ALEXANDRE E M C, SARAIVA J A, et al.Impact of high pressure on starch properties:A review[J].Food Hydrocolloids, 2020, 106:105877.
[12] 张静林, 刘桂玲, 陶阳, 等.超高压处理对发芽糙米淀粉凝胶特性的影响[J].食品与发酵工业, 2018, 44(4):82-88.ZHANG J L, LIU G L, TAO Y, et al.Effect of high hydrostatic pressure processing on the gel properties of germinated brown rice starch[J].Food and Fermentation Industries, 2018, 44(4):82-88.
[13] 游刚, 赖玉坪, 牛改改, 等.仙草胶对淀粉-鱼糜凝胶特性和体外消化性的影响[J].食品与发酵工业, 2022, 48(18):81-87.YOU G, LAI Y P, NIU G G, et al.Effects of hsian-tsao gum on the gel properties and in vitro digestibility of starch-added surimi gel[J].Food and Fermentation Industries, 2022, 48(18):81-87.
[14] LEI X Q, YU J T, HU Y Y, et al.Comparative investigation of the effects of electron beam and X-ray irradiation on potato starch:Structure and functional properties[J].International Journal of Biological Macromolecules, 2023, 236:123909.
[15] YANG K, LUO X H, ZHAI Y H, et al.Influence of sodium alginate on the gelatinization, rheological, and retrogradation properties of rice starch[J].International Journal of Biological Macromolecules, 2021, 185:708-715.
[16] 李奎, 魏代巍, 李姝琪, 等.欧李原花青素对马铃薯淀粉消化的影响[J].食品与发酵工业, 2023, 49(2):212-217.LI K, WEI D W, LI S Q, et al.Study on the effect of prunus proanthocyanidins on the digestion of potato starch[J].Food and Fermentation Industries, 2023, 49(2):212-217.
[17] ZENG F, LI T, GAO Q Y, et al.Physicochemical properties and in vitro digestibility of high hydrostatic pressure treated waxy rice starch[J].International Journal of Biological Macromolecules, 2018, 120(Pt A):1030-1038.
[18] TAN X Y, ZHANG B J, CHEN L, et al.Effect of planetary ball-milling on multi-scale structures and pasting properties of waxy and high-amylose cornstarches[J].Innovative Food Science &Emerging Technologies, 2015, 30:198-207.
[19] LEITE T S, DE JESUS A L T, SCHMIELE M, et al.High pressure processing (HPP) of pea starch:Effect on the gelatinization properties[J].LWT-Food Science and Technology, 2017, 76:361-369.
[20] YANG Z, CHAIB S, GU Q F, et al.Impact of pressure on physicochemical properties of starch dispersions[J].Food Hydrocolloids, 2017, 68:164-177.
[21] SHEN X Y, SHANG W, STRAPPE P, et al.Manipulation of the internal structure of high amylose maize starch by high pressure treatment and its diverse influence on digestion[J].Food Hydrocolloids, 2017, 77:40-48.
[22] PAN W T, LIU W M, LI J W, et al.The role of guar gum in improving the gel and structural characteristics of germinated highland barley starch[J].International Journal of Biological Macromolecules, 2023, 238:124052.
[23] HSIEH C F, LIU W C, WHALEY J K, et al.Structure, properties, and potential applications of waxy tapioca starches-A review[J].Trends in Food Science &Technology, 2019, 83:225-234.
[24] LI W H, TIAN X L, WANG P, et al.Recrystallization characteristics of high hydrostatic pressure gelatinized normal and waxy corn starch[J].International Journal of Biological Macromolecules, 2016, 83:171-177.
[25] GE Z Z, GAO S S, XU M Y, et al.Effects of deacetylated konjac glucomannan on the pasting, rheological and retrogradation properties of wheat starch[J].Food Bioscience, 2023, 52:102465.
[26] JIANG B, LI W H, HU X S, et al.Rheology of mung bean starch treated by high hydrostatic pressure[J].International Journal of Food Properties, 2015, 18(1):81-92.
[27] MOREIRA R, CHENLO F, TORRES M, et al.Rheological properties of gelatinized chestnut starch dispersions:Effect of concentration and temperature[J].Journal of Food Engineering, 2012, 112(1-2):94-99.
[28] ZHAO X Y, LI X X, GUO R T, et al.Different oil-modified cross-linked starches:In vitro digestibility and its relationship with their structural and rheological characteristics[J].Food Chemistry, 2023, 418:135991.
[29] FANG F, MARTINEZ M M, CAMPANELLA O H, et al.Long-term low shear-induced highly viscous waxy potato starch gel formed through intermolecular double helices[J].Carbohydrate Polymers, 2020, 232:115815.
[30] CAI C H, ZHAO L X, HUANG J, et al.Morphology, structure and gelatinization properties of heterogeneous starch granules from high-amylose maize[J].Carbohydrate Polymers, 2014, 102:606-614.
[31] LIU H, FAN H H, CAO R, et al.Physicochemical properties and in vitro digestibility of sorghum starch altered by high hydrostatic pressure[J].International Journal of Biological Macromolecules, 2016, 92:753-760.
[32] WANG N, DONG Y, DAI Y Y, et al.Influences of high hydrostatic pressure on structures and properties of mung bean starch and quality of cationic starch[J].Food Research International, 2023, 165:112532.
[33] LIU Z Y, WANG C, LIAO X J, et al.Measurement and comparison of multi-scale structure in heat and pressure treated corn starch granule under the same degree of gelatinization[J].Food Hydrocolloids, 2020, 108:106081.
[34] ZHONG Y Y, LIU L S, QU J Z, et al.Amylose content and specific fine structures affect lamellar structure and digestibility of maize starches[J].Food Hydrocolloids, 2020, 108:105994.
[35] ALMEIDA R L J, SANTOS N C, FEITOZA J V F, et al.Evaluation of the technological properties of rice starch modified by high hydrostatic pressure (HHP)[J].Innovative Food Science &Emerging Technologies, 2023, 83:103241.
[36] LINSBERGER-MARTIN G, LUKASCH B, BERGHOFER E.Effects of high hydrostatic pressure on the RS content of amaranth, quinoa and wheat starch[J].Starch - Stärke, 2012, 64(2):157-165.
[37] LYU X X, HONG Y, ZHOU Q W, et al.Structural features and digestibility of corn starch with different amylose content[J].Frontiers in Nutrition, 2021, 8:692673.
[38] TIAN Y Q, LI D D, ZHAO J W, et al.Effect of high hydrostatic pressure (HHP) on slowly digestible properties of rice starches[J].Food Chemistry, 2014, 152:225-229.