副溶血性弧菌(Vibrio parahaemolyticus)是一种革兰氏阴性细菌,能够感染水产品,在世界范围内引起海源性肠胃炎[1]。在我国一些沿海城市(江苏、浙江、上海等)食源性疾病事件中,副溶血性弧菌的检出率高达37.88%[2-5]。牡蛎具有良好的营养价值和风味,但由于牡蛎的生活方式和自身特性,导致其容易携带病原菌造成食源性疾病:第一:牡蛎的滤食生活方式使得病原菌容易在牡蛎体内积累,危害人体健康[6];第二:牡蛎外壳含有丰富的几丁质,副溶血性弧菌所分泌的几丁质酶能够轻松地帮助副溶血性弧菌在牡蛎外壳定植,逐渐形成类似堡垒一样的生物被膜[7],从而抵御抗菌剂的侵袭,使得其中的细菌存活下来[8]。因此,清除牡蛎中的副溶血性弧菌,保障食品安全和人民健康是非常重要。
与传统的热处理相比,光动力灭活(photodynamic inactivation, PDI)技术是一种新型的非热杀菌技术,具有安全高效、成本低、环境友好等优点[9]。目前,本课题组已经证明姜黄素介导的PDI对单核增生李斯特菌、副溶血性弧菌、腐败希瓦氏菌、大肠杆菌、金黄色葡萄球菌浮游菌及其生物被膜均具有良好的清除效果[10-13]。但大多是清除生长在实验室环境(商业培养基)中的细菌生物被膜,较少是清除基于食物而生长的细菌生物被膜,因此本文以牡蛎汁为副溶血性弧菌生长环境,模拟副溶血性弧菌在牡蛎上的生物被膜形成情况,监测其生长过程中生物被膜量、细胞活力以及胞外聚合物(extracellular polymeric substances, EPS)的动态变化,并应用姜黄素介导的PDI技术清除牡蛎汁中形成的生物被膜,分析PDI技术对副溶血性弧菌生物被膜的清除效果和作用机制。
1 材料与方法
1.1 菌株
本实验所用的4株副溶血性弧菌VP17802、VPC17、VPC36和VPC49分离自不同的食物中毒事件中。
1.2 材料与试剂
胰蛋白胨大豆肉汤(trypticase soy broth, TSB),北京陆桥科技有限公司;磷酸盐缓冲液(phosphate buffered saline, PBS)、体积分数为2.5%的戊二醛电镜固定液、SYBR Green Ⅰ 染色剂、噻唑蓝[3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-di- phenytetrazoliumromide,MTT]试剂,上海生工生物工程有限公司;姜黄素(纯度≥98%),美国Sigma公司;DNA提取试剂盒,北京天根生化科技有限公司;细菌RNA提取试剂盒、HiScript®RT SuperMix试剂盒,中国诺唯赞生物科技有限公司;dsDNA试剂盒,上海赛默飞世尔科技有限公司。
1.3 实验设备
蓝色LED(10 W,455~460 nm,功率密度为3.80 mW/cm2),深圳市格天光电有限公司;SynergyTM2多功能酶标仪,美国伯腾仪器有限公司;Nova NanoSEM 450扫描电子显微镜,美国FEI公司;LSM710型激光共聚焦扫描显微镜(confocal laser scanning microscope,CLSM),德国Carl Zeiss公司;拉曼显微镜,德国Bruker Optics公司。
1.4 实验方法
1.4.1 牡蛎汁的收集
将从上海菜市场上购买的牡蛎置于-20 ℃冰箱保存,称取每份约(10±0.2) g的牡蛎在室温下解冻,将得到的渗出液离心并收集上清液,用0.2 μm的滤膜过滤以防止细菌污染,最后把处理完毕的牡蛎汁放在-20 ℃冰箱保存备用[14]。
1.4.2 副溶血性弧菌生物被膜的培养
将-80 ℃下冻存的4株副溶血性弧菌用TSB培养基活化后稀释至OD600nm的值为0.6~0.7(此时经平板计数测得菌液中的细胞数量约为8 lg CFU/mL),将稀释后的4株副溶血性弧菌溶液混合。将混合菌液用PBS稀释10倍,使其终浓度约为7 lg CFU/mL,吸取10 μL菌液到含有990 μL的TSB液体培养基(添加30 g/L NaCl)、体积分数为50%的牡蛎汁(445 μL牡蛎汁+445 μL TSB培养基溶液)和100%牡蛎汁的24孔板中,最后在25 ℃恒温培养箱中静置培养以形成生物被膜。
1.4.3 结晶紫染色定量生物被膜
生物被膜培养结束后移除悬浮液,用PBS缓缓清洗3遍以去除浮游菌,随后将形成生物被膜的24孔板放在55 ℃烘箱内干燥固定。每孔加入1 mL质量分数为0.1%的结晶紫染色30 min,再用PBS溶液清洗多余的结晶紫溶液,加入1 mL体积分数为95%的乙醇溶解结晶紫,30 min后每孔吸取200 μL到96孔板中,用酶标仪测定OD600nm值,其数值大小表示副溶血性弧菌生物被膜量[15]。
1.4.4 MTT法检测生物被膜细胞活力
形成生物被膜后移除浮游菌,每孔加入1 mL 含有NaCl(30 g/L)的TSB培养基和100 μL MTT溶液(5 mg/mL),将24孔板放置在25 ℃恒温培养箱中静置2 h以上。移除悬浮液,PBS清洗后加入1 mL的DMSO溶液,静置30 min充分溶解后每孔吸取200 μL到96孔板上,用酶标仪检测570 nm处的OD值[16]。
1.4.5 EPS的提取和定量
形成48 h的生物被膜后用PBS清洗3遍去除浮游菌,每孔加入1 mL的KCl溶液(0.01 mol/mL),充分吹打后转移至离心管中,超声5 s、暂停5 s,功率45 W,共计60 s。超声波结束后4 000 r/min、4 ℃离心20 min,随后用0.22 μm的滤膜过滤,收集滤液,获得EPS溶液[17]。
胞外蛋白的含量按照Lowry试剂盒的说明方法进行测定,胞外多糖的含量使用苯酚-硫酸法检测,eDNA的含量用dsDNA试剂盒进行测定。
1.4.6 PDI处理副溶血性弧菌生物被膜
形成的48 h副溶血性弧菌生物被膜用PBS清洗3遍,再加入1 mL的PBS溶液和20 μmol/L的姜黄素,室温下避光孵育20 min,随后用蓝色LED灯(灯管距离24孔板5 cm)分别光照30和60 min,没有添加姜黄素和光照处理的作为对照组。PDI处理结束后使用结晶紫染色检测生物被膜的清除效果。
1.4.7 SEM观察生物被膜
在48 h副溶血性弧菌生物被膜形成后,进行PDI处理,随后每孔加入1 mL体积分数为2.5%的戊二醛固定液,将24孔板放在4 ℃冰箱中静置过夜。再次用PBS清洗后用不同体积分数的乙醇(30%、50%、70%、90%、100%)进行脱水处理10 min,待样品干燥后喷金,每个样品随机选择3个位置放大5 000倍观察SEM图像[18]。
1.4.8 CLSM观察生物被膜
将24孔板中的生物被膜清洗3遍后每孔加入1 mL体积分数为2.5%的戊二醛固定液,4 ℃下静置30 min,加入200 μL的SYBR Green Ⅰ染色剂染色30 min,PBS清洗3遍,干燥后用CLSM观察生物被膜图像(40倍物镜,激发波长488 nm,吸收波长500~550 nm),使用ISA-2软件(由美国蒙大纳州立大学生物被膜工程中心的生物被膜结构和功能研究小组开发提供)分析生物被膜图像,计算生物体积、厚度、质构熵和均一性[19]。
1.4.9 RNA提取、反转录和实时荧光定量PCR(quantitative real-time-PCR,RT-qPCR)
PDI处理生物被膜后,每孔加入1 mL PBS并用移液枪枪头反复吹打刮擦,收集溶液到离心管中,在4 ℃、12 000 r/min条件下离心2 min,收集菌体。按照细菌RNA提取试剂盒的说明提取RNA。将RNA悬浮在50 μL的DEPC水中。利用HiScript®RT SuperMix试剂盒和生物被膜氧化应激基因(grx A、ahp C和sod C)及SOS反应基因(lex A和sul A)的引物,将RNA反转录为cDNA。
用rec A基因作为副溶血性弧菌的内参基因,寡核苷酸引物序列如表1所示。qPCR反应的总体系为20 μL,在7500 Fast RT-qPCR系统上进行qPCR反应。使用2-ΔΔCT法计算相对基因表达的变化。
表1 寡核苷酸引物序列
Table 1 The sequence of oligonucleotide primers

基因引物名称引物序列参考文献rec Arec A-FGGTAAAGGCTCTATCATGCGrec A-RCACCAGCACCCAAAGCGATA[20]lex Alex A-FATGAAGCCGTTAACGCCACGlex A-RCACGCGCAATCTCTGCACGA[20]sul Asul A-FGCCGTGAATGGGTACAGTCTsul A-RCGCTGTAATTTCCTGTACGC[21]grx Agrx A-FAGAACGCGACGATTTCAACTgrx A-RTCTGCGGTACGGTTTCTACA[21]ahp Cahp C-FGACTGAACTGGGTGACGTTGahp C-RATGCTTTGTGCGTGAAGTGA[20]sod Csod C-FCGGGAATGAAAGACGGTAAAsod C-RCCAAATGCCCTTTGTCATTA[21]
1.4.10 数据处理
实验设置3次重复,每个样品设置3个平行,通过SPSS 20.0软件的单因素方差分析,检验数据在P<0.05的统计学差异,通过Origin 2021软件作图。
2 结果与分析
2.1 不同培养条件下副溶血性弧菌生物被膜的形成
以结晶紫染色法监测副溶血性弧菌生物被膜的生长过程,可以看到生物被膜的形成是一个动态的过程,一般分为初始黏附、微菌落形成、生物被膜成熟和分散4个阶段[22]。在形成过程中,生物被膜量逐渐增多,并在成熟阶段达到最高峰,随后逐渐下降。在TSB培养液、50%牡蛎汁和100%牡蛎汁中副溶血性弧菌生物被膜形成情况如图1所示,3种培养环境中生物被膜均在48 h达到成熟阶段。相较于纯TSB培养基,50%牡蛎汁中的总生物被膜量增加了48.06%,100%牡蛎汁中的总生物被膜量增加了51.93%。从图1-b可知,生物被膜中的细胞活力在成熟阶段(48 h)达到最大值,并且100%牡蛎汁中的生物被膜细胞活力最强。以上结果表明牡蛎汁更利于副溶血性弧菌生物被膜的形成。
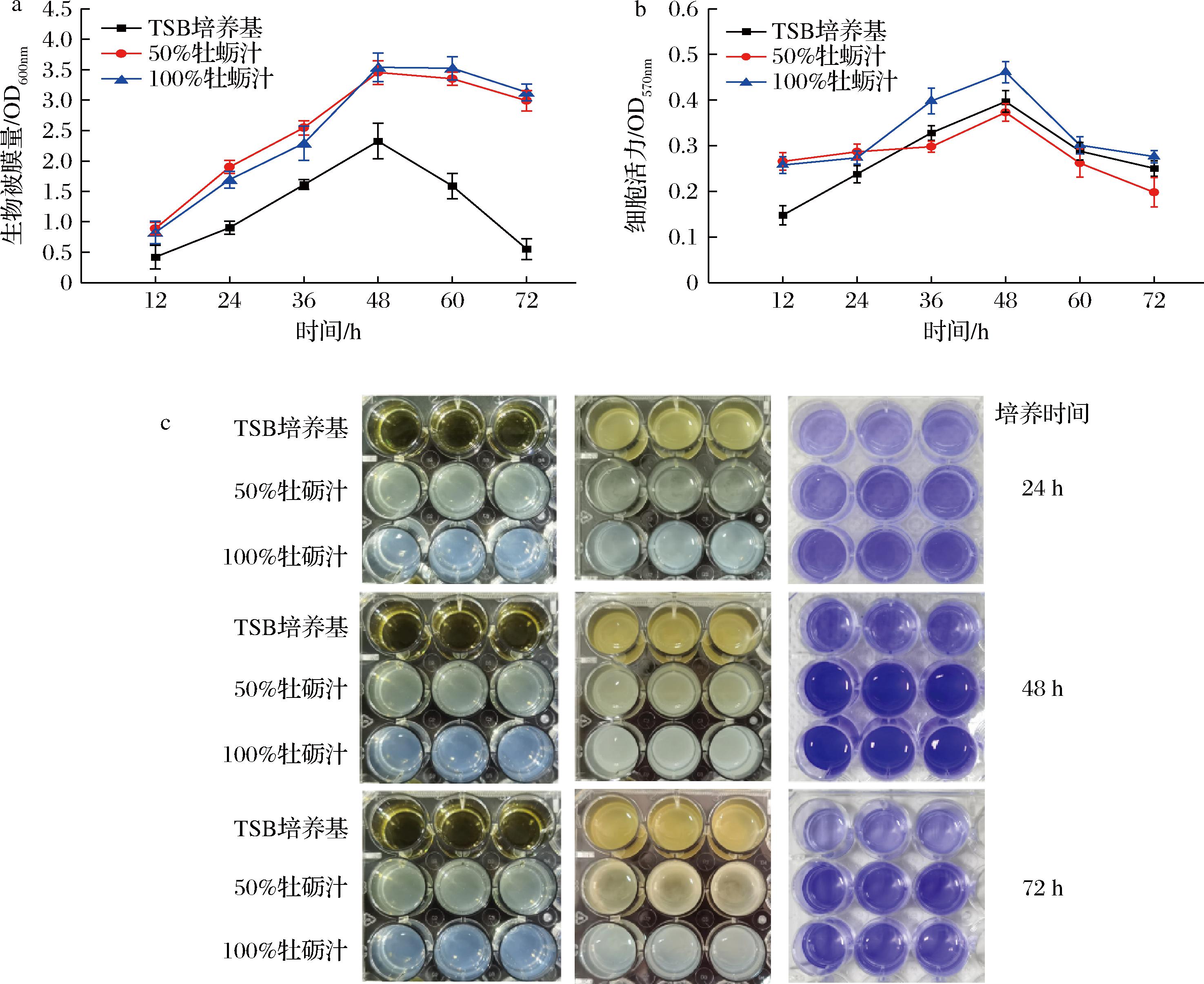
a-动态形成能力;b-细菌细胞活力;c-生物被膜的形成图像
图1 不同培养条件下副溶血弧菌生物被膜的动态形成能力、细菌细胞活力以及生物被膜的形成图像
Fig.1 The dynamic biofilm formation ability of V.parahaemolyticus under different culture conditions, bacterial cell viability and the picture of biofilms
2.2 副溶血性弧菌生物被膜EPS含量的变化
EPS主要包括胞外多糖、胞外蛋白和eDNA,是成熟生物被膜的重要组成部分。
如图2所示,胞外多糖、胞外蛋白和eDNA的含量随时间而不断变化,并在48 h生物被膜成熟阶段达到最大值,随后逐渐下降。这与上述结晶紫染色定量生物被膜和MTT法测定生物被膜细胞活力的结果一致,以上结果均表明在48 h时副溶血性弧菌生物被膜达到成熟阶段,并且在含有牡蛎渗出液的培养环境中形成生物被膜EPS的能力更强。因此,以活性最强的成熟阶段的生物被膜(培养48 h)作为研究对象,探究PDI对生物被膜的清除效果。
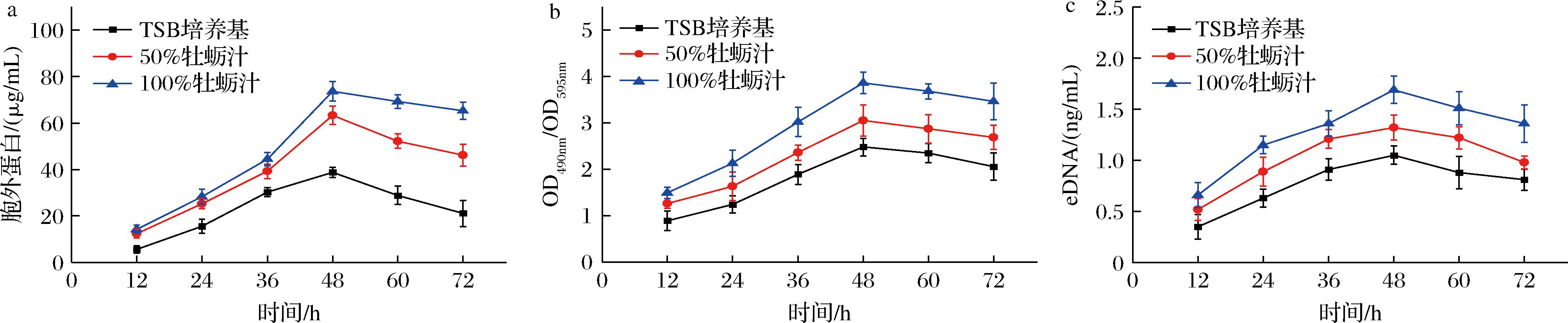
a-胞外蛋白;b-胞外多糖;c-eDNA含量
图2 不同培养条件下副溶血性弧菌生物被膜的胞外蛋白、胞外多糖和eDNA含量
Fig.2 The extracellular protein, exopolysaccharide and eDNA content of V.parahaemolyticus biofilm under different culture conditions
2.3 姜黄素介导的PDI处理对副溶血性弧菌生物被膜的影响
采用不同浓度、不同光照时间的PDI处理副溶血性弧菌生物被膜,并通过结晶紫染色法检测清除效果(图3)。研究发现,不同培养环境下副溶血性弧菌生物被膜清除难易程度由简到易依次为:100%牡蛎汁培养组>50%牡蛎汁培养组>TSB培养基培养组,采用20 μmol/L的姜黄素、PDI处理60 min(13.68 J/cm2)对生物被膜的清除效果最佳。以上结果表明,姜黄素介导的PDI对牡蛎汁中形成的副溶血性弧菌生物被膜具有优异的清除效果。
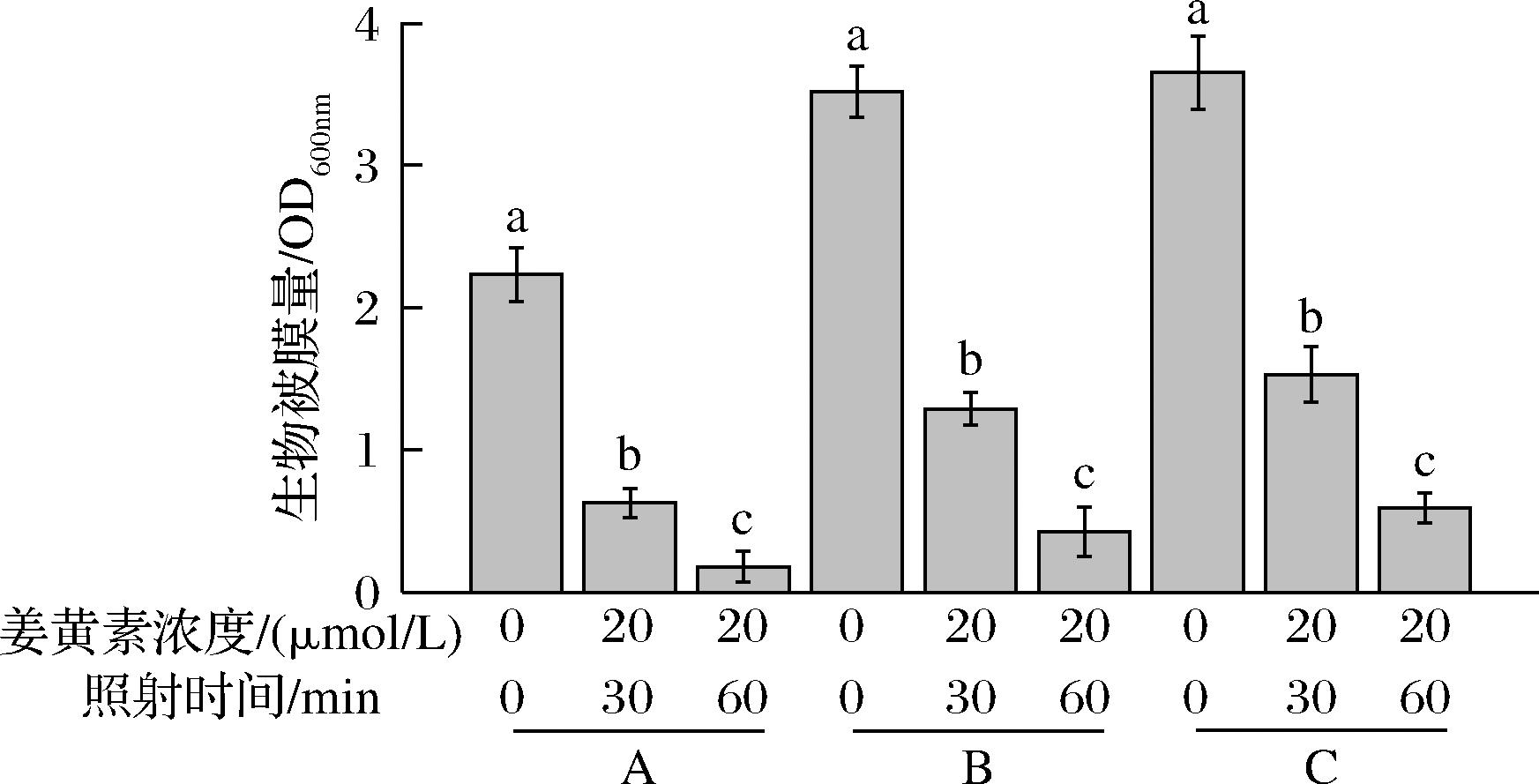
A-TSB培养基;B-50%牡蛎汁;C-100%牡蛎汁
图3 不同PDI处理条件对副溶血性弧菌生物被膜的清除效果
Fig.3 Inactivation efficacy of V. parahaemolyticusbiofilm under different PDI treatment conditions
注:相同培养环境条件下的条形柱子上不同字母表明具有显著性差异(P<0.05)。
为了进一步了解PDI处理对生物被膜在基因层面的影响,测定了生物被膜氧化应激基因和SOS反应基因的表达量变化。从图4可以发现,与SOS反应相关的基因lex A下调0.61倍(P<0.05),与生物被膜氧化应激反应相关的基因grx A、sod C分别上调2.50倍和3.07倍(P<0.05),这表明PDI产生的ROS激发了细胞的抗氧化反应,以抵御PDI的杀菌效果。
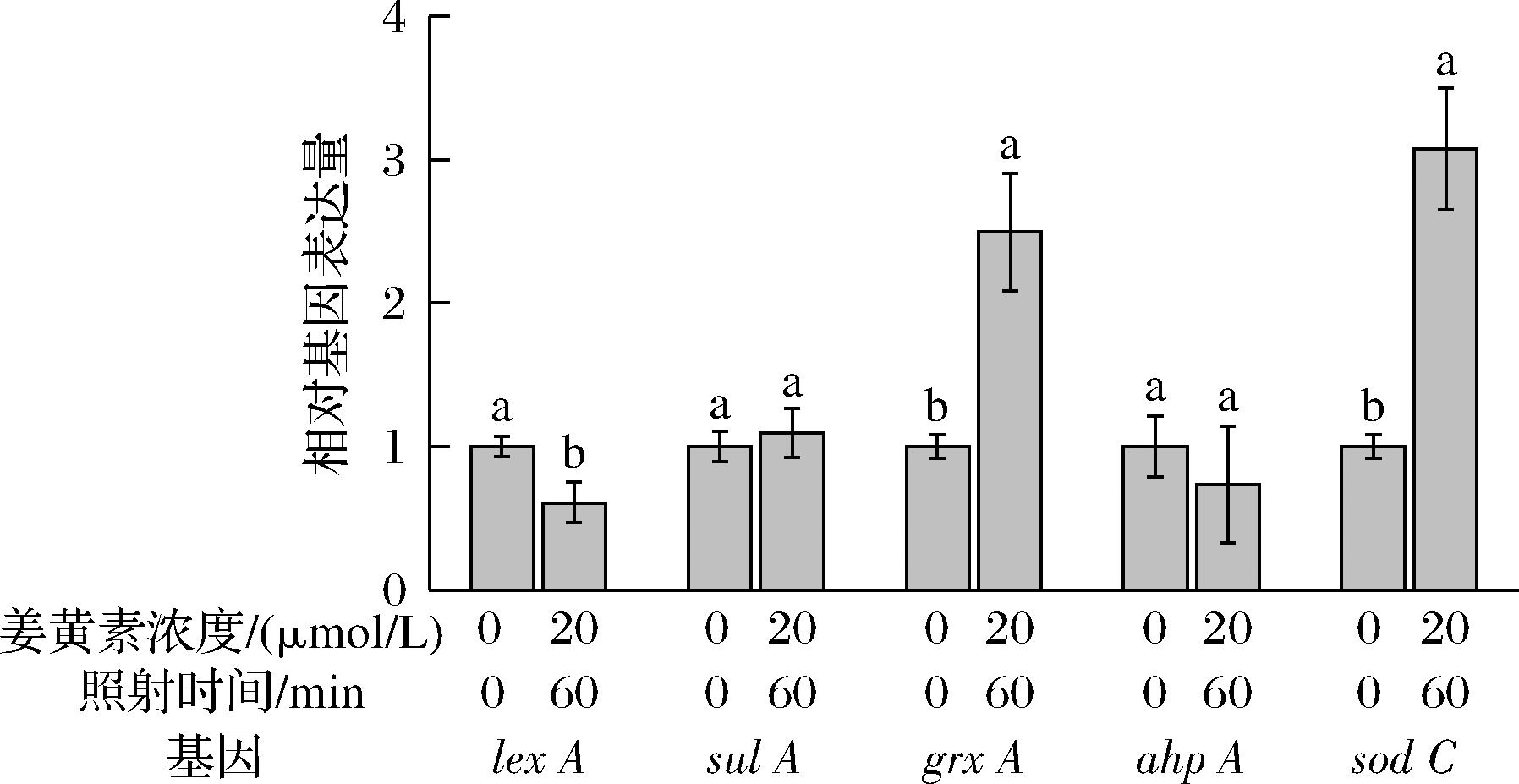
图4 生物被膜氧化应激反应相关基因和SOS反应基因在PDI处理时的表达量变化
Fig.4 Expression level changes of biofilm oxidative stress-related genes and SOS response genes during PDI treatment
注:相同基因条件下两个柱子之间的不同字母代表有显著性差异(P<0.05)。
2.4 PDI处理对副溶血性弧菌生物被膜形态的影响
通过SEM观察经过PDI处理后副溶血性弧菌生物被膜表面形态的变化。未经PDI处理的生物被膜(图5-a1、图5-b1和图5-c1)均呈现致密紧凑、圆润饱满的特点,尤其是100%牡蛎汁中形成的生物被膜更是呈现黏连、致密的状态。经PDI处理60 min(13.68 J/cm2)后,生物被膜结构变得稀疏松散,EPS明显减少,并且部分细胞出现干瘪皱缩的现象(图5-a2、图5-b2、图5-c2)。这意味着,姜黄素介导的PDI可以破坏被膜态细胞的结构形态,同时瓦解被膜形成的三维结构,从而清除副溶血性弧菌生物被膜。此外,生物被膜中EPS的减少也进一步验证了上述结晶紫染色的结果。
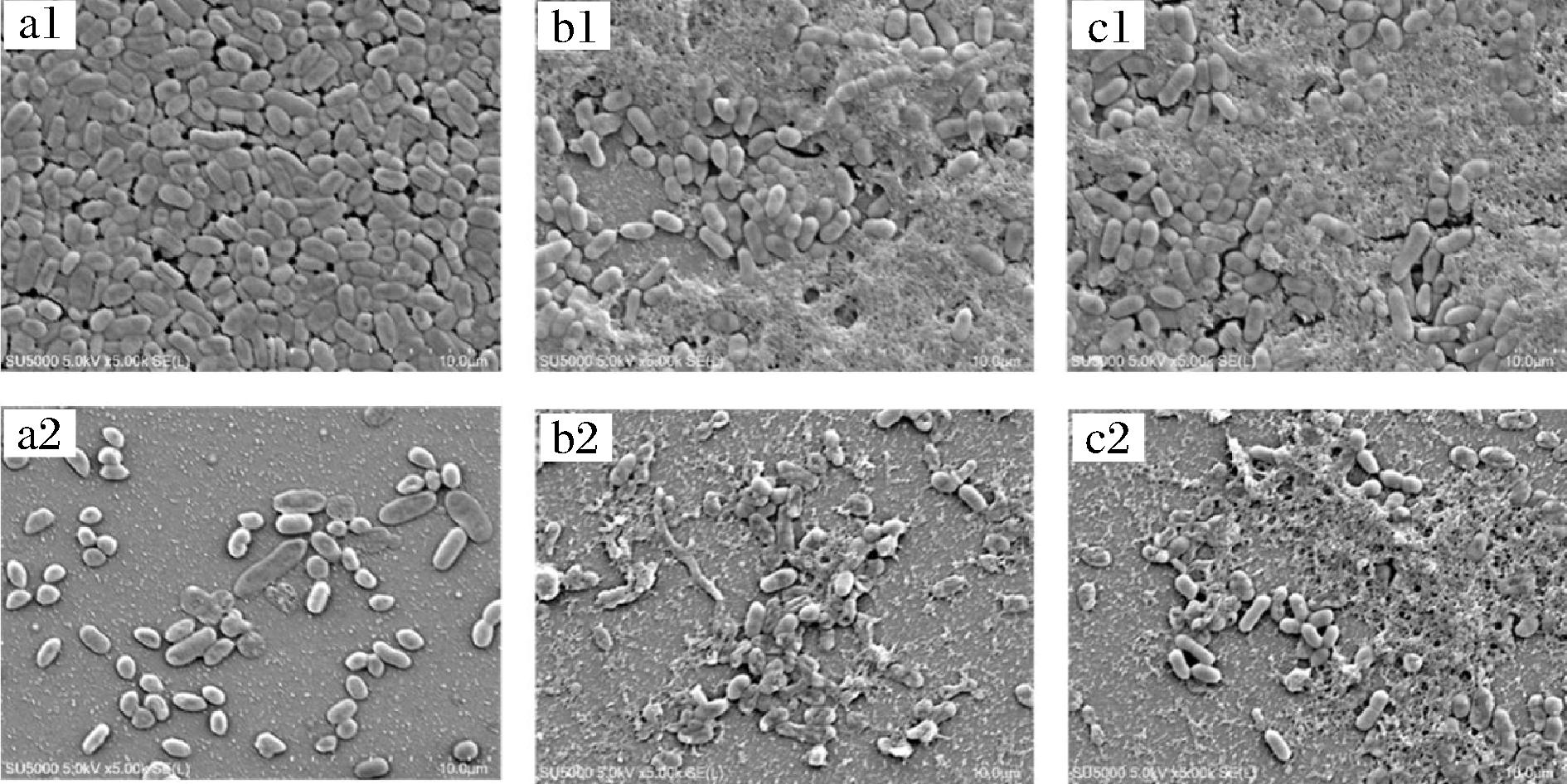
a-TSB培养基中的生物被膜;b-50%牡蛎汁中培养的生物被膜;c-100%牡蛎汁中培养的生物被膜
图5 姜黄素介导的PDI后副溶血弧菌生物被膜的SEM图像(×5 000倍)
Fig.5 SEM images (×5 000) of V. parahaemolyticusbiofilm after treated by curcumin-mediated PDI
注:L:60 min照射,C:20 μmol/L姜黄素,L-为未光照,L+为光照处理,C-为未添加姜黄素,C+为添加姜黄素组(下同),a1、b1、c1为对照组L- C-,a2、b2、c2为PDI处理组L+C+
2.5 CLSM观察PDI处理对副溶血性弧菌生物被膜结构的影响
通过CLSM进一步验证了PDI处理对副溶血性弧菌生物被膜的清除效果。未经光照处理的对照组(图6-a1、图6-b1、图6-c1)荧光强度较高,这表明此时副溶血性弧菌生物被膜呈现致密紧凑的结构特点。而PDI处理组(图6-a2、图6-b2、图6-c2)中的荧光强度相较于对照组急剧降低,其生物被膜均呈现稀疏、分散的特点,这意味着PDI处理60 min(13.68 J/cm2)后,生物被膜均大幅度减少。通过ISA软件进一步对CLSM生物被膜图像进行定量分析,发现PDI处理降低了生物被膜的生物体积、厚度、质构熵,同时均一性提高。一般而言,生物被膜的结构越简单,均一性就越大,质构熵越低,这表明经过PDI处理后复杂的生物被膜结构被严重破坏。

a1、b1、c1为对照组L- C-,a2、b2、c2为PDI处理组L+C+;d-生物被膜的生物体积;e-生物被膜的厚度;f-质构熵;g-均一性的变化
图6 通过CLSM分析姜黄素介导的 PDI对副溶血性弧菌生物被膜的清除情况
Fig.6 Analysis of the inactivation effects of curcumin-mediated PDI against V. parahaemolyticus biofilm by CLSM
3 讨论与分析
副溶血性弧菌生物被膜形成的强弱与许多因素有关,除了菌株本身的异质性,还有环境温度、pH和培养基成分等[23]。BROWN等[14]发现在培养基中添加鸡胸肉渗出液后,其中的鸡胸肉颗粒覆盖并调节非生物表面的性质,促进空肠弯曲菌的表面附着,增强生物被膜的形成能力。同样地,在本研究中,牡蛎汁培养液中形成的副溶血性弧菌生物被膜更强,这有可能是牡蛎汁中的牡蛎颗粒覆盖在接触面,初始黏附得到加强[14]。有研究表明,副溶血性弧菌在胁迫下(冷藏、干燥和杀菌剂处理等)能够形成更强的生物被膜,以增强其生存能力[24]。牡蛎汁成分复杂,其中更是存在着TSB培养液所没有的微量天然抗菌肽[25],这些天然抗菌肽增强了生物被膜的形成。然而,牡蛎汁增强副溶血性弧菌生物被膜形成的机制还需要进一步探究。
在绝大多数的细菌生物被膜中,EPS所占的比例超过90%,对内部的被膜态细胞起着重要的保护作用[26]。因此瓦解EPS组分是杀菌剂清除生物被膜的关键。结晶紫染色是定量生物被膜的经典方法,从宏观角度观察到PDI处理能够降低生物被膜量(图3)。SEM和CLSM是本文分析生物被膜变化的2种微观技术,二者互为补充:SEM提供了高分辨率的生物被膜表面图像,能够直观地观察到,经过PDI处理后,SEM图像显示被膜态细胞出现明显的分离,细胞外的EPS成分显著减少(图5);CLSM则借助荧光染料间接观察生物被膜的分布情况,并应用ISA软件对生物被膜的结构参数进行定量分析,在经过PDI处理后生物被膜的生物体积和厚度都表现出明显的减少,这与SEM图像的结果一致。不仅如此,质构熵作为一个衡量生物被膜随机性的指标[27],也在PDI处理后有所下降。这意味着经PDI处理的生物被膜结构显得更为均匀,与此相吻合的是生物被膜的均一性也呈现上升趋势(图6)。总的来说,姜黄素介导的PDI通过瓦解EPS组分,破坏生物被膜的结构,清除副溶血性弧菌生物被膜。
在自然界中细菌遭受DNA损伤时会触发SOS反应机制以修复受损DNA,容易导致细菌产生耐药性[28],而DNA是PDI的主要攻击靶点之一。基于此,本文探究了SOS反应相关基因和氧化应激基因表达量的变化情况。图4中lex A基因表达量下调,sul A基因表达量不变,这表明PDI处理没有触发细菌SOS反应。而氧化应激基因grx A和sod C的表达量显著上升(P<0.05),这表明PDI释放出的ROS激发了细胞的抗氧化防御机制[20]。在氧化应激发生时,ahp C基因表达量往往会上调,修复破坏的硫醇/二硫化物平衡[29],但本研究中ahp C基因表达量并未上调,推测是PDI处理能够轻微抑制细胞的氧化应激反应。因此,姜黄素介导的PDI能够有效避免细胞SOS反应机制,防止副溶血性弧菌耐药菌株的形成,避免清除难度加大。
4 结论
综上,本文首先探究了牡蛎汁中副溶血性弧菌的生物被膜形成能力,以结晶紫染色、CLSM、SEM等技术手段分析了姜黄素介导的PDI对副溶血性弧菌生物被膜的清除效果,并且进一步通过RT-PCR研究了PDI处理后细菌细胞的氧化应激反应。结果表明,牡蛎汁能促进生物被膜的形成,20 μmol/L姜黄素PDI处理60 min对生物被膜的清除效果最好。PDI处理大大降低了被膜EPS的含量,破坏了生物被膜的结构,在基因层面下调了SOS反应基因lex A,上调了氧化应激基因grx A和sod C。姜黄素介导的PDI能够清除牡蛎汁中形成的生物被膜,然而,高浓度的姜黄素会在一定程度上改变食品的颜色,影响消费者的接受度。因此,要降低姜黄素使用的浓度,提高姜黄素介导的PDI对食品中形成的生物被膜清除效率,如结合其他杀菌策略、改进姜黄素化学结构、增强姜黄素在食品基质中的靶向能力等。本文已经证明,姜黄素介导的PDI对牡蛎汁中形成的副溶血性弧菌生物被膜具有较好的清除效果,但对牡蛎感官、理化等品质的影响需要进一步的研究。本文为清除水产品中形成的生物被膜提供了新思路和新策略,从而有效降低水产品在储存运输过程中的安全风险,保障食品安全。
[1] GU D, ZHANG Y B, WANG Q Y, et al.S-nitrosylation-mediated activation of a histidine kinase represses the type 3 secretion system and promotes virulence of an enteric pathogen[J].Nature Communications, 2020, 11(1):5777.
[2] 陈莉莉, 陈江, 孙亮, 等.新冠疫情下浙江省食源性疾病暴发事件流行病学特征分析[J].中国食品卫生杂志, 2023, 35(4):613-618.CHEN L L, CHEN J, SUN L, et al.Epidemiological characteristics of foodborne disease outbreaks in Zhejiang Province during the COVID-19 pandemic[J].Chinese Journal of Food Hygiene, 2023, 35(4):613-618.
[3] 蔡泽瑜, 张明, 张春雨.2012—2020年南京市鼓楼区食源性疾病暴发事件流行病学分析[J].江苏预防医学, 2021, 32(3):345-346;371.CAI Z Y, ZHANG M, ZHANG C Y.Epidemiological analysis of food-borne disease outbreaks in Gulou district of Nanjing from 2012 to 2020[J].Jiangsu Journal of Preventive Medicine, 2021, 32(3):345-346;371.
[4] 金淋奇, 陈笑南, 金晓敏, 等.温州市瓯海区食源性疾病监测结果分析[J].中国卫生检验杂志, 2022, 32(17):2164-2168.JIN L Q, CHEN X N, JIN X M, et al.Surveillance results analysis of foodborne diseases in Ouhai District, Wenzhou City[J].Chinese Journal of Health Laboratory Technology, 2022, 32(17):2164-2168.
[5] 吕静, 赵黎芳, 刘芸, 等.2016—2020年上海市闵行区食源性疾病主动监测病原学及流行病学特征分析[J].上海预防医学, 2023, 35(2):169-174.LYU J, ZHAO L F, LIU Y, et al.Epidemiologic and etiologic characteristics of foodborne diseases in Minhang, Shanghai 2016—2020[J].Shanghai Journal of Preventive Medicine, 2023, 35(2):169-174.
[6] DINER R E, ZIMMER-FAUST A, COOKSEY E, et al.Host and water microbiota are differentially linked to potential human pathogen accumulation in oysters[J].Applied and Environmental Microbiology, 2023, 89(7):e0031823.
[7] WANG D, FLINT S H, PALMER J S, et al.Global expansion of Vibrio parahaemolyticus threatens the seafood industry:Perspective on controlling its biofilm formation[J].LWT, 2022, 158:113182.
[8] FLEMMING H C, WINGENDER J, SZEWZYK U, et al.Biofilms:An emergent form of bacterial life[J].Nature Reviews.Microbiology, 2016, 14(9):563-575.
[9] SEIDI DAMYEH M, MEREDDY R, NETZEL M E, et al.An insight into curcumin-based photosensitization as a promising and green food preservation technology[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(4):1727-1759.
[10] HUANG J M, CHEN B W, LI H H, et al.Enhanced antibacterial and antibiofilm functions of the curcumin-mediated photodynamic inactivation against Listeria monocytogenes[J].Food Control, 2020, 108:106886.
[11] CHEN B W, HUANG J M, LI H H, et al.Eradication of planktonic Vibrio parahaemolyticus and its sessile biofilm by curcumin-mediated photodynamic inactivation[J].Food Control, 2020, 113:107181.
[12] CHEN L, DONG Q F, SHI Q D, et al.Novel 2, 3-dialdehyde cellulose-based films with photodynamic inactivation potency by incorporating the β-cyclodextrin/curcumin inclusion complex[J].Biomacromolecules, 2021, 22(7):2790-2801.
[13] YAN Y Y, TAN L J, LI H H, et al.Photodynamic inactivation of planktonic Staphylococcus aureus by sodium magnesium chlorophyllin and its effect on the storage quality of lettuce[J].Photochemical &Photobiological Sciences:Official Journal of the European Photochemistry Association and the European Society for Photobiology, 2021, 20(6):761-771.
[14] BROWN H L, REUTER M, SALT L J, et al.Chicken juice enhances surface attachment and biofilm formation of Campylobacter jejuni[J].Applied and Environmental Microbiology, 2014, 80(22):7053-7060.
[15] TAN L J, LI H H, CHEN B W, et al.Dual-species biofilms formation of Vibrio parahaemolyticus and Shewanella putrefaciens and their tolerance to photodynamic inactivation[J].Food Control, 2021, 125:107983.
[16] HAN Q, SONG X Y, ZHANG Z H, et al.Removal of foodborne pathogen biofilms by acidic electrolyzed water[J].Frontiers in Microbiology, 2017, 8:988.
[17] KIM H S, PARK H D.Ginger extract inhibits biofilm formation by Pseudomonas aeruginosa PA14[J].PLoS One, 2013, 8(9):e76106.
[18] CHEN P, WANG J J, HONG B, et al.Characterization of mixed-species biofilm formed by Vibrio parahaemolyticus and Listeria monocytogenes[J].Frontiers in Microbiology, 2019, 10:2543.
[19] BEYENAL H, LEWANDOWSKI Z, HARKIN G.Quantifying biofilm structure:Facts and fiction[J].Biofouling, 2004, 20(1):1-23.
[20] HAMAMOTO A, BANDOU C, NAKANO M, et al.Differences in stress response after UVC or UVA irradiation in Vibrio parahaemolyticus[J].Environmental Microbiology Reports, 2010, 2(5):660-666.
[21] BUCHOVEC I, ![]() V, KOKSTAITE R, et al.Inactivation of Gram (-) bacteria Salmonella enterica by chlorophyllin-based photosensitization:Mechanism of action and new strategies to enhance the inactivation efficiency[J].Journal of Photochemistry and Photobiology.B: Biology, 2017, 172:1-10.
V, KOKSTAITE R, et al.Inactivation of Gram (-) bacteria Salmonella enterica by chlorophyllin-based photosensitization:Mechanism of action and new strategies to enhance the inactivation efficiency[J].Journal of Photochemistry and Photobiology.B: Biology, 2017, 172:1-10.
[22] FLEMMING H C, WINGENDER J.The biofilm matrix[J].Nature Reviews Microbiology, 2010, 8(9):623-633.
[23] 渠宏雁, 孟良玉, 刘锦峰, 等.副溶血性弧菌生物被膜的形成与优化[J].中国食品学报, 2013, 13(9):56-61.QU H Y, MENG L Y, LIU J F, et al.Research on the formation and optimization of Vibrio parahaemolyticus biofilm[J].Journal of Chinese Institute of Food Science and Technology, 2013, 13(9):56-61.
[24] 高璐, 欧阳敏, 张辉, 等.胁迫生长条件下副溶血性弧菌的生物特性分析[J].食品科学, 2018, 39(6):177-182.GAO L, OUYANG M, ZHANG H, et al.Biological characteristics of Vibrio parahaemolyticus during growth in adverse environment[J].Food Science, 2018, 39(6):177-182.
[25] MAO F, BAO Y B, WONG N K, et al.Large-scale plasma peptidomic profiling reveals a novel, nontoxic, Crassostrea hongkongensis-derived antimicrobial peptide against foodborne pathogens[J].Marine Drugs, 2021, 19(8):420.
[26] FULAZ S, VITALE S, QUINN L, et al.Nanoparticle-biofilm interactions:The role of the EPS matrix[J].Trends in Microbiology, 2019, 27(11):915-926.
[27] 檀利军, 胡钰梅, 陈博文, 等.姜黄素介导的光动力技术对副溶血性弧菌与腐败希瓦氏菌的杀灭效果[J].食品科学, 2022, 43(3):83-91.TAN L J, HU Y M, CHEN B W, et al.Inactivation of curcumin-mediated photodynamic technology on Vibrio parahaemolyticus and Shewanella putrefaciens[J].Food Science, 2022, 43(3):83-91.
[28] KAUSHIK V, TIWARI M, TIWARI V.Interaction of RecA mediated SOS response with bacterial persistence, biofilm formation, and host response[J].International Journal of Biological Macromolecules, 2022, 217:931-943.
[29] TAO K.oxyR-dependent induction of Escherichia coli grx gene expression by peroxide stress[J].Journal of Bacteriology, 1997, 179(18):5967-5970.