双酰胺类杀虫剂是一类高效低风险的新型杀虫剂,近年来得到越来越多的应用和关注。该类杀虫剂主要以昆虫鱼尼丁受体为靶标,通过让昆虫体内Ca2+不受控制的释放使其肌肉持续紧缩痉挛,进而影响昆虫的生物活性,尤其对鳞翅目类昆虫防治效果显著。溴虫氟苯双酰胺具有广谱、高效、内吸性强等特点,与现有的杀虫剂无交互抗性,能有效防治对氯虫苯甲酰胺、氟虫腈等杀虫剂产生耐药性的害虫[1-5],2019年12月首次在澳大利亚取得登记,2020年在我国获得登记[6]。从溴虫氟苯双酰胺的分子结构式(图1)可以看出,由于其带有F、Br等多个卤素原子,油水分配系数比较高,在动植物体内的脂肪中容易产生富集[7-8];据文献报道,溴虫氟苯双酰胺在土壤中具有比较强的迁移性且较难降解,在环境中残留时间比较长[9]。随着溴虫氟苯双酰胺在我国的快速上市及在农业生产中的使用,溴虫氟苯双酰胺残留一方面可通过雨水的冲刷使得土壤中的残留流入水体进而在水生动物体内富集,另一方面也可能直接通过田间播撒在饲料原料粮谷类作物的表面以及其通过根系吸收在作物本身富集,作物被制作成饲料后经由家禽家畜摄入在其体内富集,最终通过食用富集了该型农药的家禽家畜以及水产品转移至人体,可能会对人体健康存在一定风险。
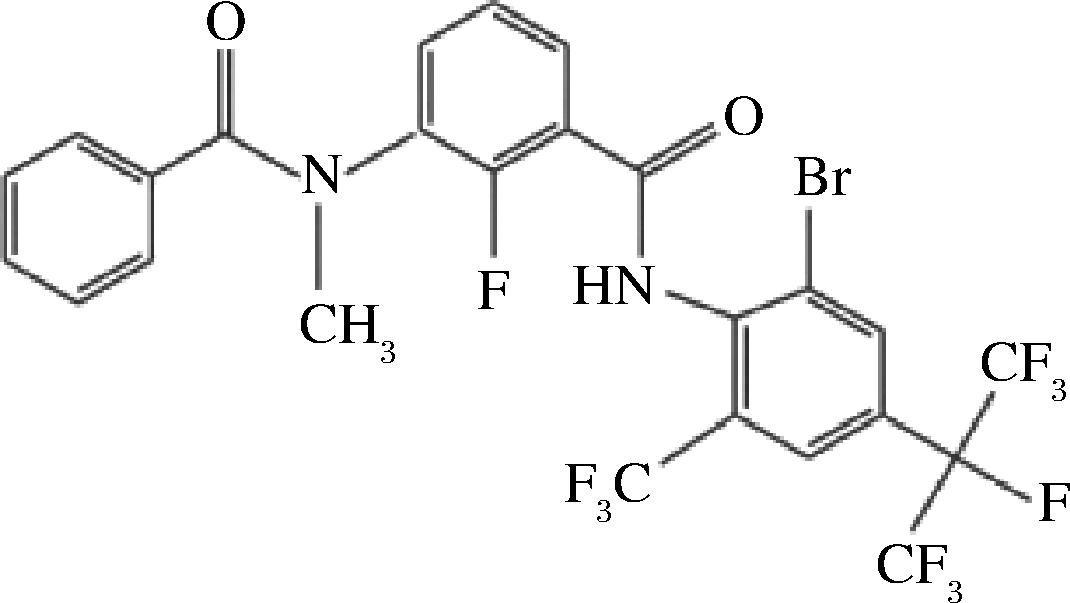
图1 溴虫氟苯双酰胺的分子结构式
Fig.1 Molecular structural formula of broflanilide
目前,美国国家环境保护局和加拿大卫生部均已制定其在动物源性食品中的最大残留限量。其已经在我国登记上市,但该型农药在国内的主要研究还集中在田间试验防治虫害的研究,其在我国使用后在动植物体内的残留情况尚未可知,因此,亟需首先建立动植物源性食品中的检测方法对其残留情况进行监测。
目前关于其检测方法主要有气相色谱法[10-11]、液相色谱法[12]及高效液相色谱-串联质谱法[13-14],相比上述检测对象动物源性样品相对基质更为复杂,样品的净化难度更大,因此,目前在动物源性食品中该型农药残留分析方法尚未见报道。本研究采用的QuEChERS净化法,前处理简单高效快捷,能针对复杂基质进行高效净化,同时结合超高效液相色谱-串联质谱法(ultra performance liquid chromatography tandem mass spectrometry, UPLC-MS/MS)能更快速准确的对该型农药进行检测。本文以动物源性食品为研究对象,用基质标曲外标法定量,QuEChERS净化,建立了QuEChERS净化结合UPLC-MS/MS法检测动物源性食品中溴虫氟苯双酰胺残留的方法,旨在为我国动物源性食品中溴虫氟苯双酰胺最大残留量限值的制定和相关监管部门日常有效监控提供技术支撑,也为研究溴虫氟苯双酰胺在动物体内的残留降解奠定基础。
1 材料与方法
1.1 仪器、试剂与材料
1.1.1 标准物质、试剂与材料
溴虫氟苯双酰胺(CAS:1207727-04-5),纯度98.4%,天津阿尔塔科技有限公司;乙腈、甲醇、甲酸、乙酸铵(色谱纯),美国Tedia公司;MgSO4、NaCl(分析纯),国药集团化学试剂有限公司;C18填料(50 μm)、N-丙基乙二胺(primary secondary amine,PSA)(50 μm),北京科德诺思技术有限公司;实验用水:Millipore系统超纯水;本实验采用动物源性样品均购置于湖南地区农贸市场。
1.1.2 仪器与设备
1290-G6470A液质联用仪,美国Agilent公司;Elix® Essential 3超纯水仪,Millipore公司;DHS-220均质器,北京莱伯泰科公司;SIGMA3-30KS冷冻离心机,美国Sigma公司;ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),美国Waters公司。
1.2 试验方法
1.2.1 样品制备
取约500 g肌肉内脏样品,切碎后经研磨仪搅碎混匀成肉糜,用塑料器封装,于-20 ℃下冷冻保存。取20枚蛋类,去壳后经研磨仪充分混匀,用塑料容器封装;取约500 g牛奶样品充分混匀,用塑料容器封装,于0~4 ℃冷藏保存。
1.2.2 溴虫氟苯双酰胺标准溶液的配制
称取适量溴虫氟苯双酰胺标样用甲醇配制成1.0 mg/mL标准储备液,于0~4 ℃储存;吸取适量溴虫氟苯双酰胺标准储备液用乙腈稀释成1.0 μg/mL标准使用液,于0~4 ℃储存;吸取适量溴虫氟苯双酰胺标准使用液用动物源性食品的空白基质溶液稀释成0.2、0.5、2.0、5.0、10、20、50、100 μg/L的系列基质标液,现配现用。
1.2.3 样品前处理
准确称取5 g样品于50 mL离心管,加5 mL水(仅畜禽肉、内脏),涡旋混匀;加入10 mL乙腈(含体积分数为0.1%甲酸),混匀1 min,加入1 g MgSO4和2 g NaCl,混匀2 min,9 000 r/min离心3 min。取3 mL上清液于15 mL QuEChERS净化管(100 mg MgSO4、150 mg PSA、150 mg C18)涡混2 min,5 000 r/min离心3 min,上清液过0.22 μm有机滤膜后上机测定;加标样品称取5 g阴性基质样品,加入适量标准工作液,涡旋混匀后处理过程同上。
1.2.4 仪器条件
1.2.4.1 色谱条件
色谱柱:ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);柱温40 ℃;进样体积2 μL;流动相:A为乙腈;B为5 mmol/L乙酸铵0.1%甲酸水溶液,梯度洗脱程序见表1。
表1 溴虫氟苯双酰胺梯度洗脱程序
Table 1 The gradient elution procedure for broflanilide
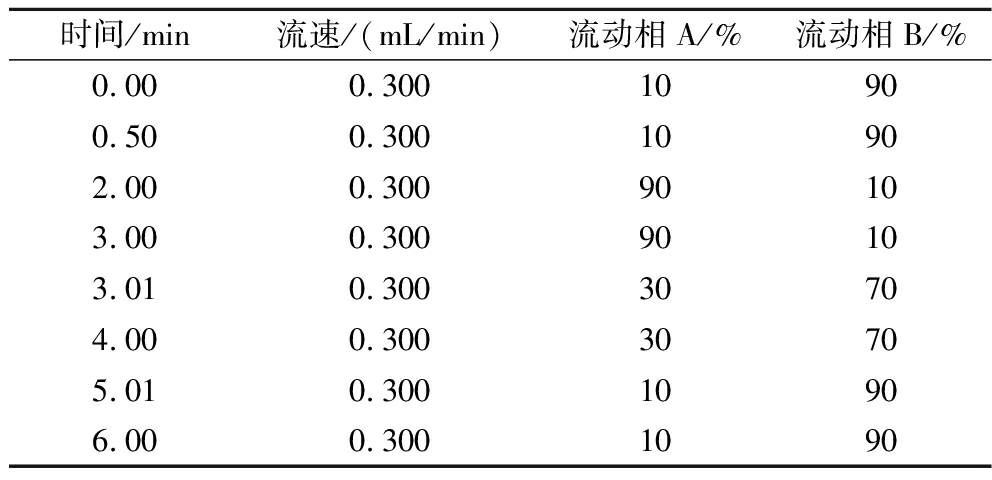
时间/min流速/(mL/min)流动相A/%流动相B/%0.000.30010900.500.30010902.000.30090103.000.30090103.010.30030704.000.30030705.010.30010906.000.3001090
1.2.4.2 质谱参数
电喷雾离子源,正离子模式;多反应监测模式扫描;毛细管电压3 500 V;干燥气温度200 ℃,流速6 L/min;鞘气温度300 ℃,流速3 L/min;雾化气压力128 kPa。质谱参数见表2。
表2 溴虫氟苯双酰胺质谱参数
Table 2 Mass spectrometric parameters of broflanilide

目标化合物母离子(m/z)子离子(m/z)去簇电压/V碰撞能量/eV溴虫氟苯双酰胺663.1256.216025208.9∗16060
注:*为定量离子。
1.3 数据处理
采用Masshunter 数据处理系统进行图谱采集及数据定量分析,采用OriginLab 2019进行图像处理,采用SPSS Statistics 24.0软件进行统计分析。
1.4 测定方法
1.4.1 基质效应测定方法
采用MATUSZEWSKI等[15]方法,按照公式(1)计算基质效应。
基质效应![]()
(1)
式中:AA1,基质标液中目标物峰面积;AA2,溶剂标液中目标物峰面积。
1.4.2 定量限测定方法
选取10种动物源性样品的空白基质,加入适量的1.2.2节中标准溶液,以10倍信噪比(S/N≥10)计算方法定量限。
2 结果与讨论
2.1 前处理条件优化
2.1.1 提取试剂优化
动物源性食品中主要的干扰类杂质为蛋白质以及脂肪,研究考虑乙腈对油脂、色素类杂质的溶解能力较弱且相较其他有机溶剂具有更强的破壁作用是一种优秀的蛋白质沉淀试剂[16-17]。本实验室前期研究发现采用乙腈作为提取溶剂时,提取效率高,提取效果好[11],故本研究将乙腈作为提取试剂的首选。在此基础上,为尽可能提高方法的灵敏度,本研究采用阴性猪肉、猪肝、鸡蛋和牛奶为研究对象,在10.0 μg/kg的添加水平下结合基质效应考察了乙腈、含0.1%(体积分数)甲酸的乙腈溶液及含1%(体积分数)甲酸乙腈溶液的提取效果。按照1.4.1节的测定动物源性食品中溴虫氟苯双酰胺的基质效应。
由图2可知,在上述4种不同基质中溴虫氟苯双酰胺均表现出不同程度的基质抑制效应,乙腈酸化后能够有效地去除基质抑制效应使基质抑制效应逐渐减弱,同时研究发现,随着提取试剂中甲酸添加量的增加,提取液颜色逐步加深,说明提取液中色素类杂质随着甲酸含量的增大被更多的提取出来,导致净化难度增大,因此,本研究选择含0.1%(体积分数)甲酸的乙腈溶液作为动物源性食品中溴虫氟苯双酰胺的提取溶剂。
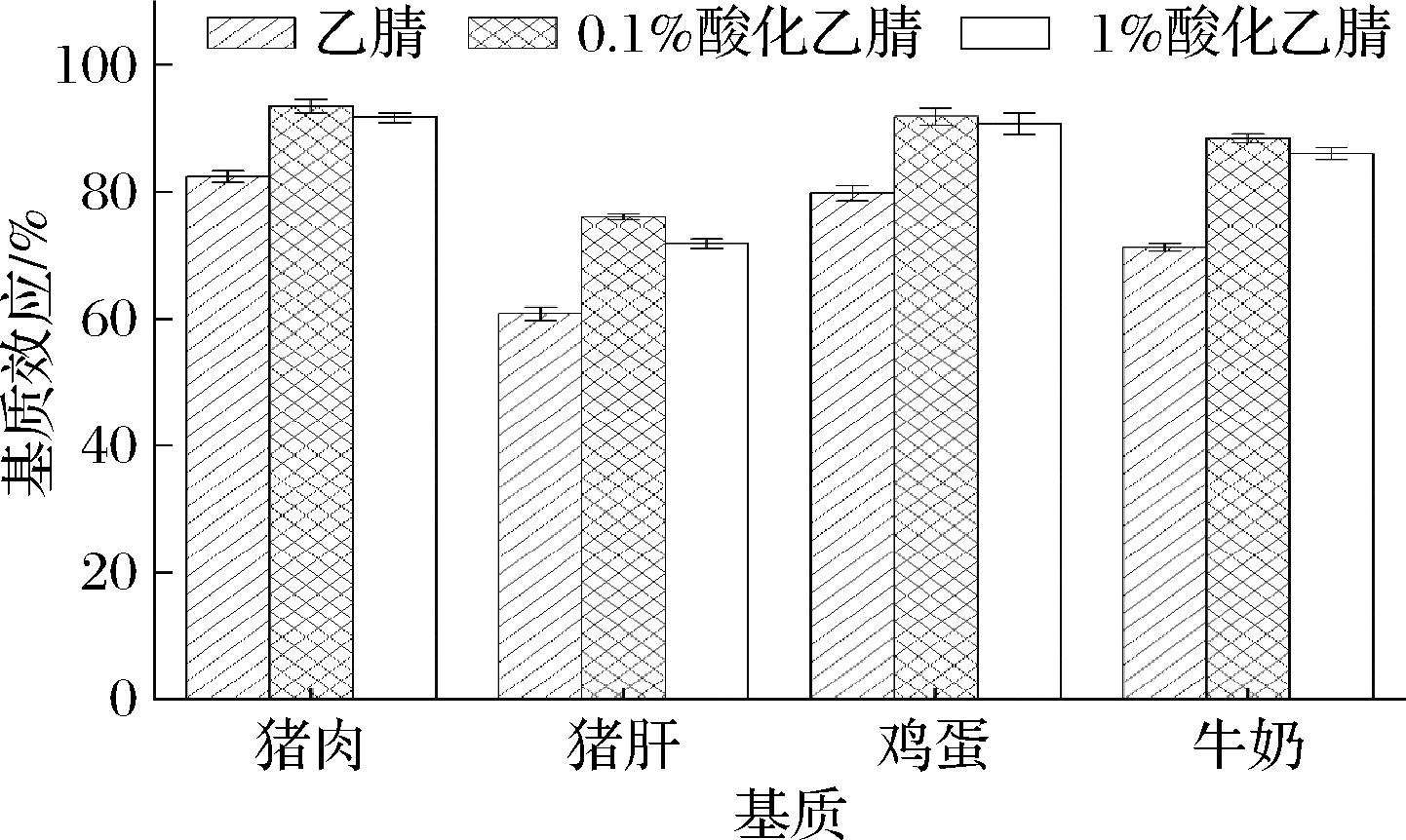
图2 提取溶剂对溴虫氟苯双酰胺基质效应的的影响(n=3)
Fig.2 Effect of extraction solvent on matrix effect of broflanilide(n=3)
2.1.2 QuEChERS净化条件的优化
动物源性样品含有较高的蛋白质、脂肪、色素、甾醇、脂肪酸等杂质,如果不进行充分净化,杂质进入色谱柱会影响色谱柱的柱效同时还会污染质谱系统进而干扰目标化合物的检测影响定量结果的准确性。QuEChERS方法常用PSA除去糖类、脂肪酸和亲脂性色素,PSA的有效成分为其表面键合的氨基,具有弱阴离子交换能力,可通过氢键作用吸附脂肪酸、有机酸、糖类、花青素等小分子化合物[18]。非极性吸附剂C18,能吸附脂肪类化合物、甾醇类、色素和其他非极性干扰物质。结合这两种吸附剂的作用机理,考虑动物源性样品基质较为复杂,为使得净化效果达到最佳化,本研究决定研究单一吸附剂和两两配比的形式结合C18和PSA两种吸附剂进行净化的效果。以上述4种动物源性食品为研究对象,结合基质效应,研究不同吸附剂含量配比对样品中溴虫氟苯双酰胺净化效果的影响。
如图3所示,和使用单个吸附剂的效果相比,C18和PSA相结合使用时的净化效果更好,随着C18和PSA含量的增加,净化效果逐渐增强,当C18和PSA的含量分别为150 mg 时,猪肝、鸡蛋基质样品中溴虫氟苯双酰胺的基质影响最小,净化效果最好,基质效应分别为76.1%和91.8%,继续增加C18和PSA的含量其基质效应并没有明显的变化;对于猪肉和牛奶基质样品,当添加C18和PSA的含量分别为100 mg和150 mg时,净化效果最好,溴虫氟苯双酰胺的基质抑制效应最小,基质效应分别为93.5%和88.4%,继续增加C18和PSA的含量其基质效应无明显的变化。同时,通过对比净化前后的提取样液的质谱图(图4),发现相比进化前的提取液净化后的提取液背景干净无杂峰干扰,说明该配比下净化效果明显。为了进一步减小基质效应的影响,本研究净化吸附剂最终选择C18和PSA的含量分别为150 mg。
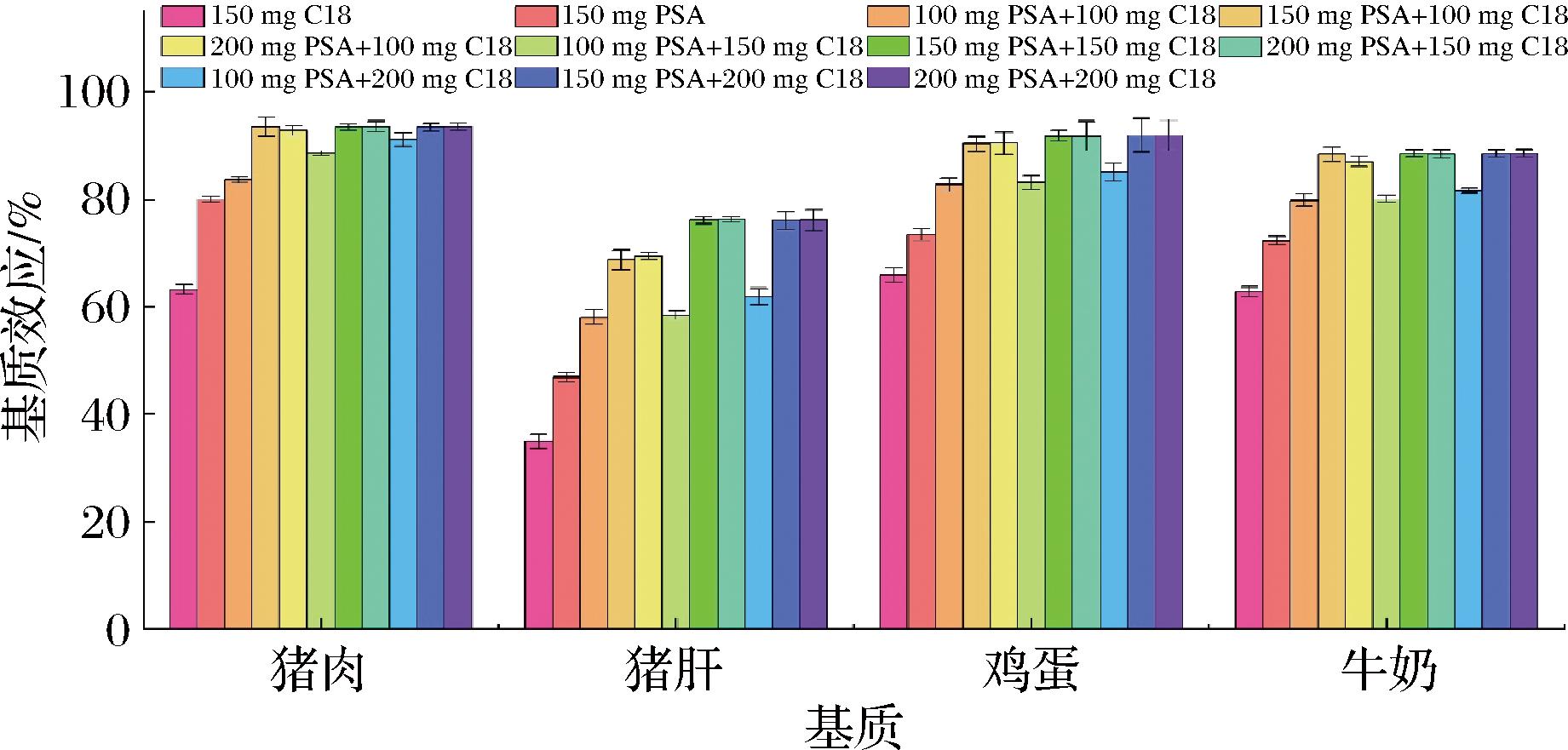
图3 吸附剂对溴虫氟苯双酰胺基质效应的影响(n=3)
Fig.3 Effect of adsorbent on matrix effect of broflanilide(n=3)
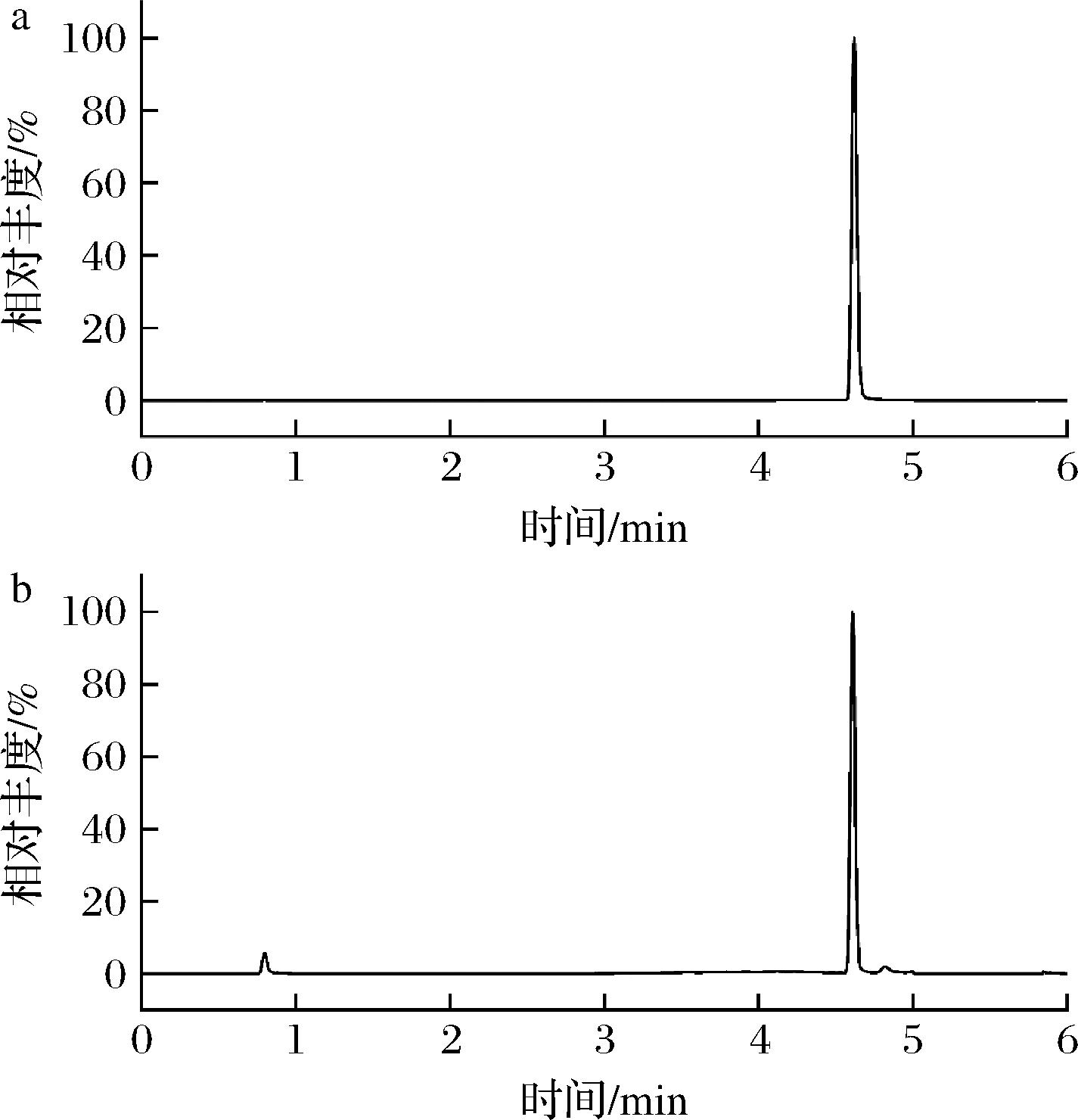
图4 经QuEChERS净化后(a)和净化前(b)提取液的提取离子流图
Fig.4 Extraction ion chromatograms of extracts purified by QuEChERS (a) and unpurified (b)
2.2 色谱条件优化
2.2.1 色谱柱的选择
色谱柱对样品的分离至关重要,不同色谱柱填料对同一物质有不同的分离效果和灵敏度。研究对比了溴虫氟苯双酰胺在ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm)、ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.7 μm)和CORTECS UPLC C18(100 mm×2.1 mm,1.6 μm)3种色谱柱上的出峰情况,结果见图5。在阴性基质样品猪肉中加标,加标量为50 μg/kg,采用5 mmol/L乙酸铵-0.1%甲酸水溶液和乙腈作为流动相,采用1.2.4.1节中洗脱程序。结果表明,3种不同色谱柱出峰时间有所差异,但是采用ACQUITY UPLC BEH C18柱时,较CORTECS UPLC C18色谱柱峰宽更小峰型更尖锐,较ACQUITY UPLC HSS T3色谱柱溴虫氟苯双酰胺峰面积响应值更高,灵敏度更高。因此,选择ACQUITY UPLC BEH C18柱用以分析溴虫氟苯双酰胺。
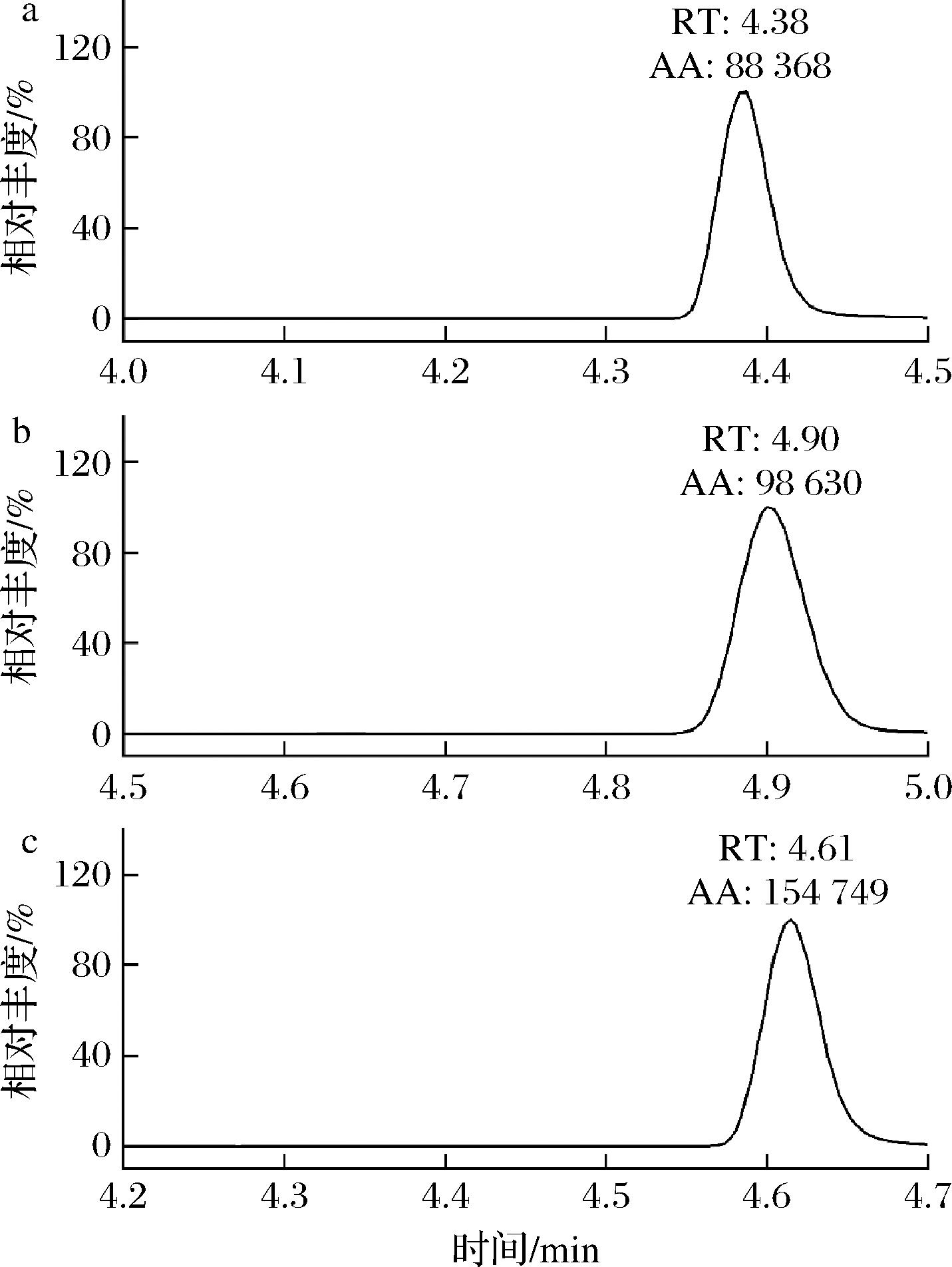
a-ACQUITY UPLC HSS T3柱;b-CORTECS UPLC C18柱;c-ACQUITY UPLC BEH C18柱
图5 采用不同色谱柱时加标猪肉样品中溴虫氟苯双酰胺(50 μg/kg)的提取离子流图
Fig.5 Extraction ion flow diagrams of broflanilide(50 μg/kg) spiked in pork samples using different chromatographic columns
注:RT-保留时间;AA-峰面积(下同)。
2.2.2 流动相体系的优化
本研究对比了相同质量浓度的溴虫氟苯双酰胺标准溶液(100 μg/L)下甲醇和乙腈与水结合作为流动相体系的效果,结果见图6,乙腈流动相体系下,溴虫氟苯双酰胺的出峰时间适中、峰宽更小,灵敏度更高。进一步研究乙腈体系下,水、5 mmol/L乙酸铵和5 mmol/L乙酸铵(含体积分数0.1%甲酸)对溴虫氟苯双酰胺离子化程度的影响。结果表明,5 mmol/L乙酸铵(含0.1%甲酸)结合乙腈流动相体系中,溴虫氟苯双酰胺的峰面积响应明显高于其他2种流动相。考虑乙酸铵(含0.1%甲酸)可提供更为稳定的酸碱环境,最终确定流动相为乙腈-5 mmol/L乙酸铵(含0.1%甲酸)。
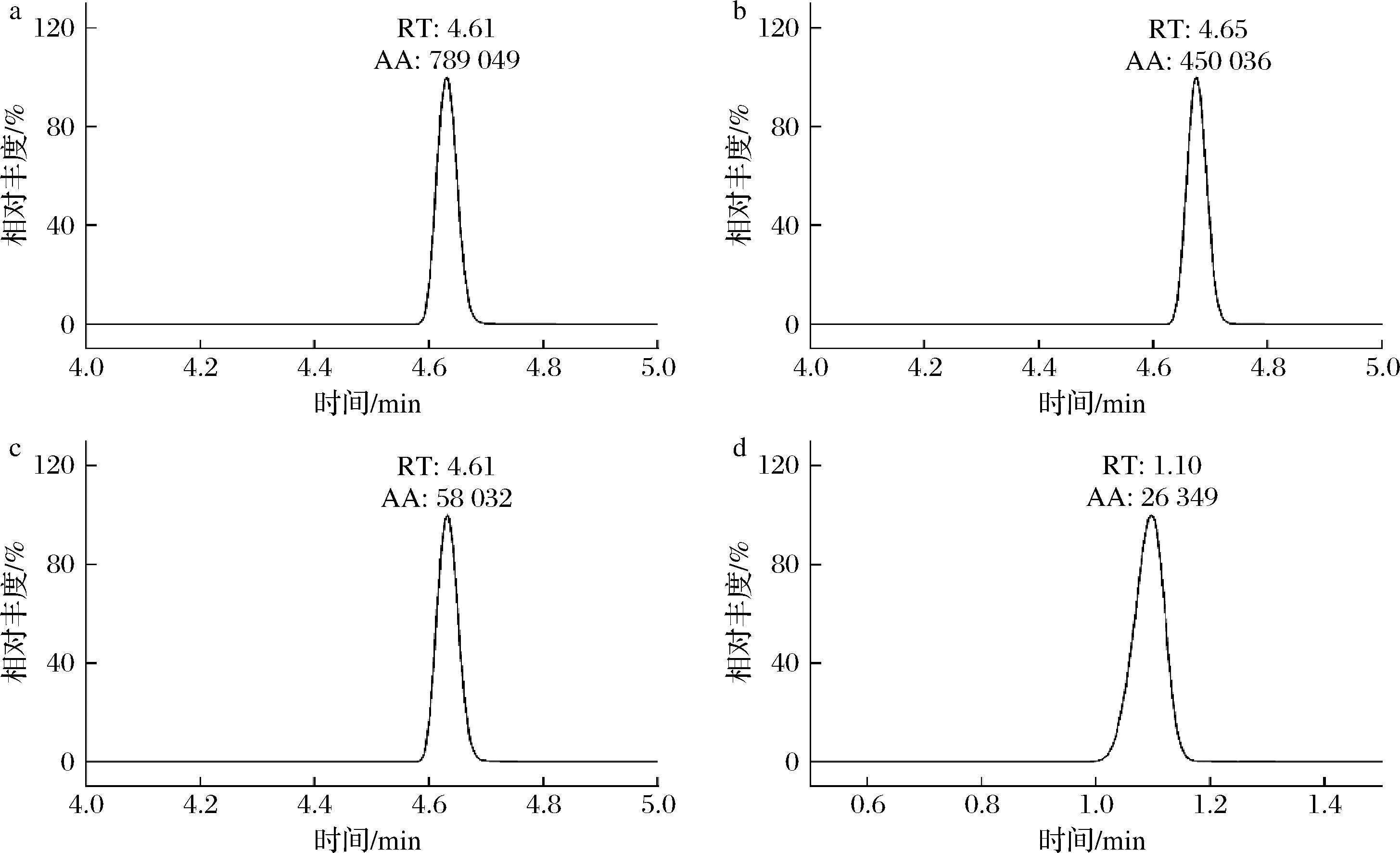
a-乙腈-5 mmol/L乙酸铵(含0.1%甲酸)水溶液;b-乙腈-5 mmol/L乙酸铵水溶液;c-乙腈-水;d-甲醇-水
图6 不同流动相体系下溴虫氟苯双酰胺标准溶液的选择离子流图
Fig.6 Elective ion flow diagram of broflanilide standard solution in different mobile phase systems
2.3 方法学评价
2.3.1 基质效应
在动物源性食品的检测中,样品对大部分待测物质存在或是增强或是抑制的一定程度的基质效应,由此对检测结果定量的准确性产生负面影响[19-20]。本研究考察了10种阴性动物源性样品的基质效应影响,按照1.4.1节基质效应测定方法,其基质效应如图7所示。
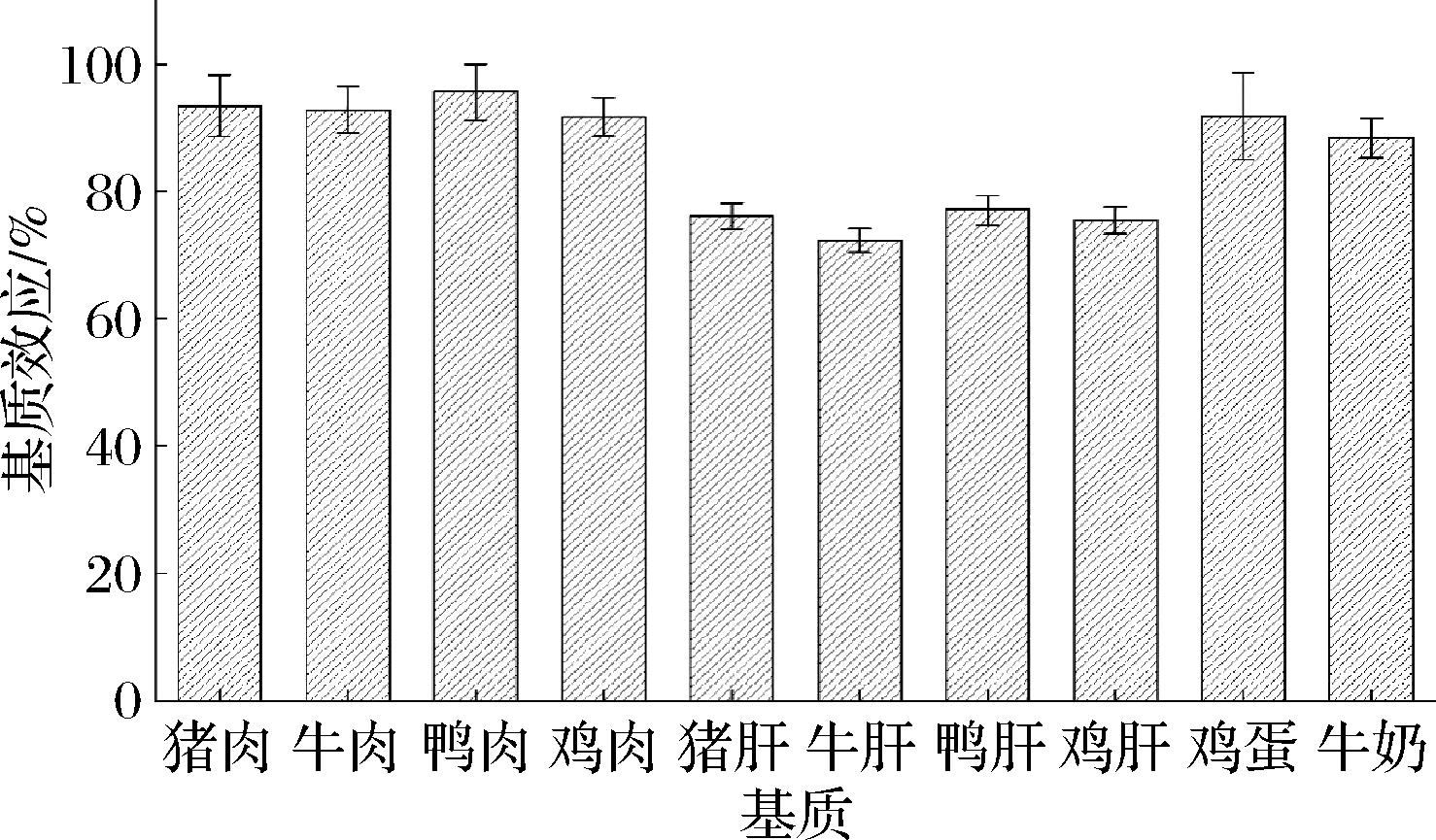
图7 不同基质中溴虫氟苯双酰胺的基质效应
Fig.7 Matrix effect of broflanilide in different matrices
研究结果表明,溴虫氟苯双酰胺在10种阴性动物源性样品中均存在不同程度的基质抑制效应,其在肉类、鸡蛋样品中90%<基质效应<100% 存在弱基质抑制效应,在牛奶及肝脏类样品中50%<基质效应<90%存在中等基质抑制效应。为了尽可能消除基质效应对结果定量的影响,使用基质标准曲线进行定量。
2.3.2 方法的线性范围及定量限
选取10种动物源性样品的空白基质溶液,配制成0.2、0.5、2.0、5.0、10、20、50、100 μg/L的基质匹配系列标准溶液,按照1.4.2节的方法测定定量限,以定量离子的峰面积为纵坐标,质量浓度为横坐标,绘制标准曲线,线性方程及相关系数(R2),结果见表3。溴虫氟苯双酰胺在0.2~100 μg/L范围内线性关系良好,相关系数均大于0.99。在阴性样品中添加溴虫氟苯双酰胺,按照1.2节的方法进行前处理和上机测定。研究结果表明,方法定量限满足加拿大卫生部及美国国家环境保护局对动物源性食品中溴虫氟苯双酰胺最大残留限量要求。
表3 不同基质中溴虫氟苯双酰胺的线性方程、相关系数、定量限及加标回收率和精密度(n=6)
Table 3 Linear equations, correlation coefficients(R2), limit of quantification, spiked recoveries and precisions of broflanilide in different matrices(n=6)
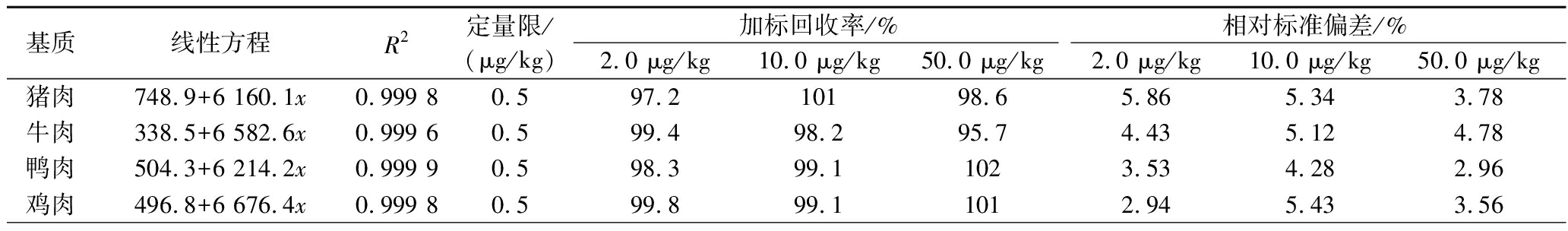
基质线性方程R2定量限/(μg/kg)加标回收率/%相对标准偏差/%2.0 μg/kg10.0 μg/kg50.0 μg/kg2.0 μg/kg10.0 μg/kg50.0 μg/kg猪肉748.9+6 160.1x0.999 80.597.210198.65.865.343.78牛肉338.5+6 582.6x0.999 60.599.498.295.74.435.124.78鸭肉504.3+6 214.2x0.999 90.598.399.11023.534.282.96鸡肉496.8+6 676.4x0.999 80.599.899.11012.945.433.56
续表3
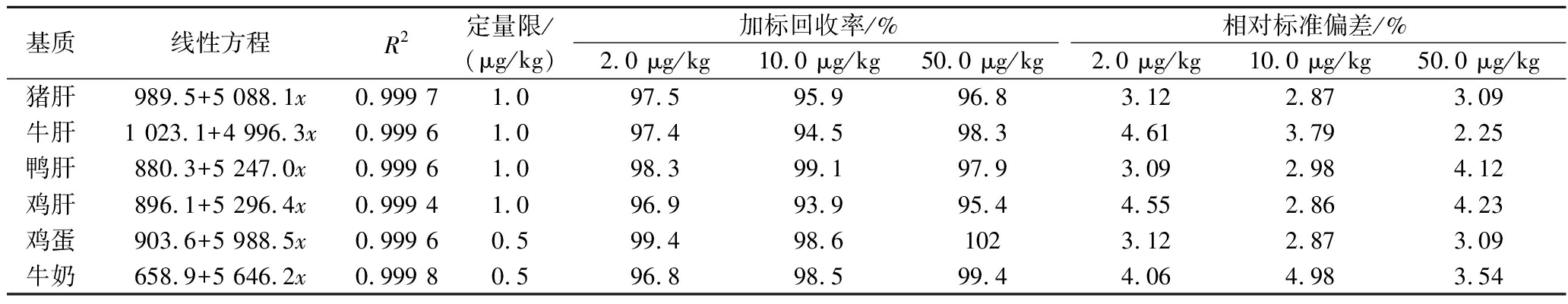
基质线性方程R2定量限/(μg/kg)加标回收率/%相对标准偏差/%2.0 μg/kg10.0 μg/kg50.0 μg/kg2.0 μg/kg10.0 μg/kg50.0 μg/kg猪肝989.5+5 088.1x0.999 71.097.595.996.83.122.873.09牛肝1 023.1+4 996.3x0.999 61.097.494.598.34.613.792.25鸭肝880.3+5 247.0x0.999 61.098.399.197.93.092.984.12鸡肝896.1+5 296.4x0.999 41.096.993.995.44.552.864.23鸡蛋903.6+5 988.5x0.999 60.599.498.61023.122.873.09牛奶658.9+5 646.2x0.999 80.596.898.599.44.064.983.54
2.3.3 准确度与精密度
分别在10种阴性动物源性样品中添加定量的溴虫氟苯双酰胺,按照1.2.4节的方法进行加标回收试验,添加水平:2.0、10.0、50.0 μg/kg,进行6次平行试验,结果见表3。研究结果显示,在3个加标水平下,10种动物源性样品中溴虫氟苯双酰胺的平均回收率为93.9%~102%,相对标准偏差为2.25%~5.86%,说明方法的准确度高,通用性好。加标回收率及精密度完全满足动物源性食品中农药残留检测的要求。
2.4 实际样品的检测
在湖南地区的农贸市场采购的猪肉、鸭肉、鸡肉、牛肉、鱼肉、驴肉、猪肝、牛肝、鸭肝、鸡肝、驴肝、鸡蛋、鸭蛋和牛奶等58份畜禽肉及肝脏、蛋类、牛奶样品中使用本研究所建立方法进行溴虫氟苯双酰胺的残留检测,所有样品均未检出溴虫氟苯双酰胺。可能因为溴虫氟苯双酰胺在国内新登记上市,率先在云南地区使用,湖南地区尚未大量使用,且动物源性食品中溴虫氟苯双酰胺的残留需通过一定的食物链与生物富集。由于美国和加拿大已经对动物源性食品(畜禽肉、鸡蛋、牛奶)制定了限量标准,因此,本研究可为国内相关标准的制定提供参考和技术支撑。
3 结论
本研究建立的QuEChERS结合UPLC-MS/MS快速测定动物源性食品中溴虫氟苯双酰胺残留的分析方法简单便捷,净化效果好,经过方法学验证,在3个加标水平(2.0、10.0、50.0 μg/kg)下,10种动物源性样品中溴虫氟苯双酰胺的平均回收率为93.9%~102%,相对标准偏差为2.25%~5.86%,说明方法的准确度高,通用性好,方便快捷,可用于动物源性样品中溴虫氟苯双酰胺的检测。本研究能够填补国内溴虫氟苯双酰胺在动物源性样品中检测方法方面的技术空白,为监管部门对动物源性食品中溴虫氟苯双酰胺残留的有效监测提供技术支撑。
[1] 郇志博, 于世幸, 王明月, 等.几种杀虫剂对香蕉黄胸蓟马的防治效果及其在香蕉果实中的残留[J].农药学学报, 2023, 25(5):1147-1154.HUAN Z B, YU S X, WANG M Y, et al.Control efficacy of several insecticides against Thrips hawaiiensis and their residue in banana fruits[J].Chinese Journal of Pesticide Science, 2023, 25(5):1147-1154.
[2] NAKAO T, BANBA S.Broflanilide:A meta-diamide insecticide with a novel mode of action[J].Bioorganic &Medicinal Chemistry, 2016, 24(3):372-377.
[3] 齐浩亮, 崔丽, 王芹芹, 等.溴虫氟苯双酰胺对小菜蛾的毒力及相关酶活性的影响[J].植物保护, 2017, 43(1):112-116;130.QI H L, CUI L, WANG Q Q, et al.Toxicity of broflanilide to Plutella xylostella and its influence on the activities of related enzymes in P.xylostella[J].Plant Protection, 2017, 43(1):112-116;130.
[4] SUN X, WEI R, LI L H, et al.Resistance and fitness costs in diamondback moths after selection using broflanilide, a novel meta-diamide insecticide[J].Insect Science, 2022, 29(1):188-198.
[5] 汪杰, 秦帅, 盛祝波, 等.新型杀虫剂broflanilide的合成及其杀虫活性测定[J].现代农药, 2020, 19(3):20-24;29.WANG J, QIN S, SHENG Z B, et al.Synthesis and insecticidal activity of broflanilide[J].Modern Agrochemicals, 2020, 19(3):20-24;29.
[6] 白小宁, 李友顺, 杨锚, 等.2020年我国登记的新农药[J].农药, 2021, 60(2):79-82.BAI X N, LI Y S, YANG M, et al.New pesticides registered in China in 2020[J].Agrochemicals, 2021, 60(2):79-82.
[7] JESCHKE P.Latest generation of halogen-containing pesticides[J].Pest Management Science, 2017, 73(6):1053-1066.
[8] HUUB WATERVAL W A, SCHEIJEN J L J M, ORTMANS-PLOEMEN M M J C, et al.Quantitative UPLC-MS/MS analysis of underivatised amino acids in body fluids is a reliable tool for the diagnosis and follow-up of patients with inborn errors of metabolism[J].Clinica Chimica Acta, 2009, 407(1-2):36-42.
[9] XIE G, LI B T, TANG L M, et al.Adsorption-desorption and leaching behaviors of broflanilide in four texturally different agricultural soils from China[J].Journal of Soils and Sediments, 2021, 21(2):724-735.
[10] 朱洪伟, 王胜翔, 郭海霞.溴虫氟苯双酰胺悬浮剂毛细管气相色谱分析方法研究[J].农药科学与管理, 2015, 36(S1):1-3.ZHU H W, WANG S X, GUO H X.Analytical method of broflanlide SC by capillarygas chromatography[J].Pesticide Science and Administration, 2015, 36(S1):1-3.
[11] 朱礼, 邓航, 薛敏敏, 等.固相萃取-气相色谱法测定果蔬中新型杀虫剂溴虫氟苯双酰胺残留[J].农药, 2023, 62(2):134-138.ZHU L, DENG H, XUE M M, et al.Determination of residues of new insecticide broflanilide in fruit and vegetables by solid phase extraction and gas chromatography[J].Agrochemicals, 2023, 62(2):134-138.
[12] 徐赛, 韩冲冲, 李飞, 等.5%溴虫氟苯双酰胺悬浮剂的高效液相色谱分析方法[J].农药, 2018, 57(1):29-30;36.XU S, HAN C C, LI F, et al.Analysis of broflanilide 5% SC by HPLC[J].Agrochemicals, 2018, 57(1):29-30;36.
[13] 曹莉, 许静, 宋宁慧, 等.分散固相萃取-液相色谱质谱法测定环境介质中的溴虫氟苯双酰胺及其代谢物[J].农药, 2023, 62(6):448-452.CAO L, XU J, SONG N H, et al.Determination of broflanilide and its metabolite in environmental media by dispersive solid phase extraction and ultra performance liquid chromatography-mass spectrometry[J].Agrochemicals, 2023, 62(6):448-452.
[14] 贺敏, 景子伟, 贾春虹, 等.超高效液相色谱-串联质谱法检测番茄和甘蓝中溴虫氟苯双酰胺的残留[J].农药, 2019, 58(4):279-281, 284.HE M, JING Z W, JIA C H, et al.Simultaneous determination of broflanilide residues in tomato and cabbage by UPLC-MS/MS[J].Agrochemicals, 2019, 58(4):279-281, 284.
[15] MATUSZEWSKI B K, CONSTANZER M L, CHAVEZ-ENG C M.Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS[J].Analytical Chemistry, 2003, 75(13):3019-3030.
[16] 肖泳, 邓航, 潘照, 等.QuEChERS-超高效液相色谱-串联质谱法快速测定动物源性食品中矮壮素残留[J].食品与发酵工业, 2022, 48(10):272-277.XIAO Y, DENG H, PAN Z, et al.Rapid determination of chlormequat residues in animal derived food by QuEChERS-UPLC-MS/MS[J].Food and Fermentation Industries, 2022, 48(10):272-277.
[17] 刘松南, 田旭, 高晶, 等.快速滤过型净化结合液相色谱-质谱联用法测定茶叶中特丁硫磷及其5种代谢产物[J].食品科学, 2022, 43(4):284-290.LIU S N, TIAN X, GAO J, et al.Determination of terbufos and its five metabolites in tea by multi-plug filtration cleanup method combined with liquid chromatography-tandem mass spectrometry[J].Food Science, 2022, 43(4):284-290.
[18] ANASTASSIADES M, LEHOTAY S J, STAJNBAHER D, et al.Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residues in produce[J].Journal of AOAC International, 2003, 86(2):412-431.
[19] UCLÉS S, LOZANO A, SOSA A, et al.Matrix interference evaluation employing GC and LC coupled to triple quadrupole tandem mass spectrometry[J].Talanta, 2017, 174:72-81.
[20] LY T K, HO T D, BEHRA P, et al.Determination of 400 pesticide residues in green tea leaves by UPLC-MS/MS and GC-MS/MS combined with QuEChERS extraction and mixed-mode SPE clean-up method[J].Food Chemistry, 2020, 326:126928.