脂肪酶是食品油脂生产和利用过程中催化酯交换反应形成脂肪酸酯的有效、安全的生物催化剂。相比反应条件苛刻、易腐蚀反应设备、存在“三废”等问题的酸碱化学催化剂[1],利用脂肪酶的生物催化方法,符合绿色生产需求,其反应条件温和、选择性高,能减少油脂转化工艺中的资源浪费和能源输入,在可持续油脂转化方面极具潜力。尽管南极假丝酵母[2]、lipozyme TL100L等[3]脂肪酶催化获得脂肪酸酯产率最高可达98.8%,但脂肪酶在油脂转化过程中稳定性差、酶回收率低、成本高[4],在工业应用上仍有较大阻碍。因此,提高脂肪酶在油脂转化过程中的稳定性和重复使用性,是油脂工业绿色生产工艺的迫切需求。
固定化酶是提高酶稳定性和回收率的重要且实用途径。载体的结构和性能对酶的性质有显著影响[5],例如不均匀的载体固定化脂肪酶后会导致催化效率低下,热稳定性降低,或酶被浸出而导致酶活力损失,甚至失活[6]。目前固定化脂肪酶的主要载体有水凝胶、有机微粒、溶胶凝胶和介孔二氧化硅等多孔材料[7],具有比表面积大、酶负载量大、性能稳定等优点。然而水凝胶和有机微粒膨胀或降解、溶胶凝胶限制部分大尺寸酶进入等弊端,易引起酶浸出和变性,使其底物交换受限。酶负载在介孔二氧化硅上使其表面电荷减少从而影响酶活[8]。因此,作为固定化载体的多孔材料不仅需要具有契合酶尺寸的多孔结构以负载大量酶,而且要保持酶催化活性,提高酶稳定性。此外,鉴于脂肪酶活性中心部位所覆盖的氨基酸多肽链具有两亲性[9],载体的结构和亲疏水性对构建脂肪酶界面催化所需的微环境、提高催化效率和稳定性至关重要。
金属有机框架(metal-organic frameworks,MOFs)最初由YAGHI等[10]在1995年发现并命名,是一种由有机配体和金属离子(金属簇)通过配位键自组装而成的拓扑结构,具有孔径均匀、比表面积大、生物相容性良好的优点,已被证明是优异的酶载体,可显著提高酶的可重复使用性、催化活性和稳定性[11]。由于金属位点和有机配体有多种几何形状和连通形式,MOFs的结构可针对特定功能进行设计和定制,例如:通过改变支链配体构建具有亲/疏水性的MOFs载体,以契合脂肪酶的催化微环境,进而提高MOFs-脂肪酶的催化活性和稳定性。
鉴于MOFs固定化脂肪酶在油脂转化方面的巨大前景,本文对近年来酶促反应中MOFs-脂肪酶的研究进展进行了总结。从常见的MOFs载体种类入手,重点介绍了MOFs的合成方法、MOFs-脂肪酶合成策略及MOFs-脂肪酶催化剂的特点。详述了MOFs-脂肪酶在酯交换反应中的应用,总结了MOFs-脂肪酶固定化条件、酯交换反应条件对酶活和脂肪酸酯产率的影响,从催化活性和稳定性的角度讨论了MOFs-脂肪酶在油脂转化过程中的优势,并展望了其大规模工业化应用的前景。
1 MOFs载体的制备
1.1 常用的MOFs载体
1.1.1 沸石咪唑酯骨架结构(zeolitic imidazolate frameworks,ZIFs)类材料
ZIFs材料主要是以过渡金属离子(如Co2+、Zn2+)为中心原子位点,以咪唑或咪唑的衍生物为有机配体结合而形成的结构,类似于沸石的MOFs材料[12]。通常,沸石结构以铝氧四面体或者硅氧四面体作为最基本的单元,由有机配体与金属离子通过同一个氧原子形成桥氧键相互连接,形成疏松多孔的立体结构。ZIFs类材料则是在沸石结构基础上,用Zn2+和Co2+替换Al3+和Si4+,并且把沸石里的桥氧键替换为咪唑及其衍生物[13]。新制的ZIFs类材料具备了沸石材料的多孔状结构,还能够弥补传统MOFs材料的低耐热性与化学不稳定性。ZIF-8和ZIF-67是最为常见的ZIFs类材料,是以二甲基咪唑为有机配体,分别与Zn2+和Co2+配位形成的,合成温度温和,在室温下即可结晶。其中,ZIF-8在沸水、苯、甲醇中浸泡数天也能保持优良的稳定性[14]。
1.1.2 拉瓦希尔骨架系列(materials of institute Lavoisier frameworks,MILs)类材料
MILs材料是利用戊二酸、琥珀酸等二羧酸为配体与过渡金属离子或镧系离子结合,或由对苯二甲酸、均苯三甲酸等羧酸与Fe3+、Cr3+、Al3+等金属合成的MOFs材料[15]。与其他MOFs材料相比,MILs具有孔径数量更多、比表面积更大、不饱和金属配位点更多等优点[16]。此外,MILs最为显著的特点是“呼吸现象”,即其孔径大小会随着吸附的分子大小或性质改变[17-18]而变化。MIL-100类材料具有极好的热稳定性,通过将均苯三甲酸分别与Fe3+或Cr3+配位连接形成。其中应用最广的MIL-100 (Fe)主要由不同的铁离子溶液合成[19],如图1所示,除高热稳定性外,其比表面积最高可达3 100 m2/g[20]。此外,通过利用对苯二甲酸和不同过渡金属离子反应形成的MIL-101,其比表面积比MIL-100更高,可达5 900 m2/g[21]。
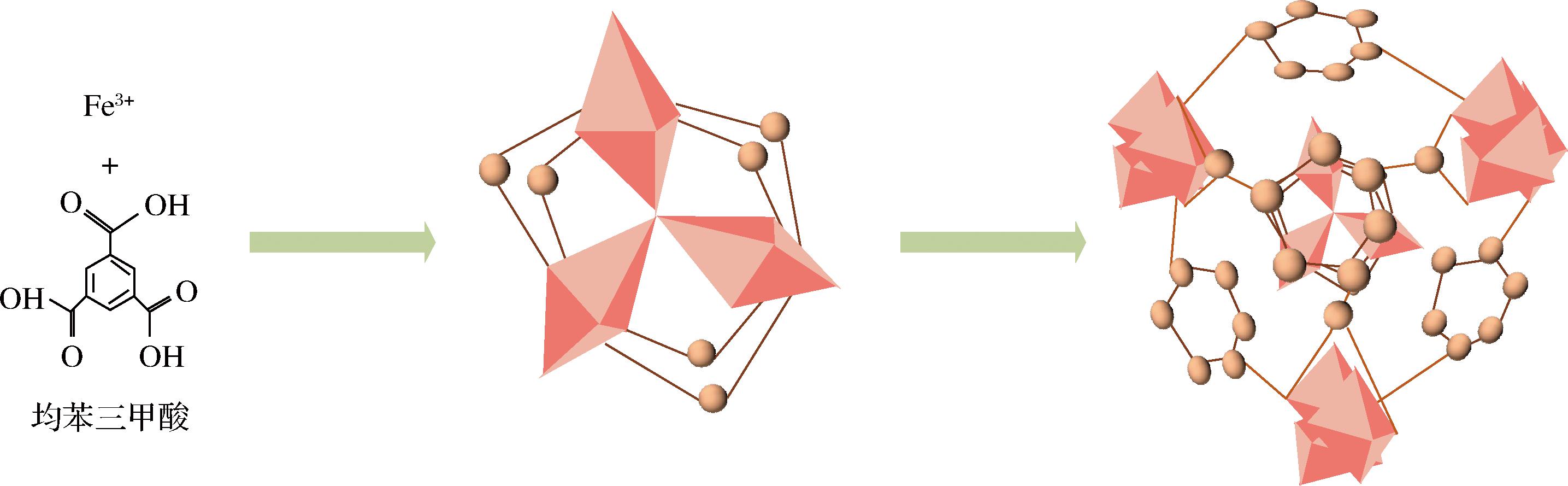
图1 不同MILs-100(Fe)金属有机框架的合成示意图
Fig.1 Schematic diagram of synthesis of different MILs-100 (Fe) metal-organic frameworks
1.1.3 自组装类材料
一般情况下,通过普通溶剂热合成法合成的MOFs由无机偶联单元与有机连接剂结合形成分子笼,合成条件较为苛刻,且这类沸石材料在分子水平上的功能控制范围是有限的。而自组装类材料是通过有机配体和金属离子或团簇进行逐步自我组装形成的一类MOFs材料[22],更易控制其孔径大小,反应条件更加温和[23-24]。SHEKHAH等[25]通过逐层法在有机表面上沉积苯三羧酸配体和Cu2+离子形成自组装MOFs,该方法可获得可控、高度定向的自组装MOFs。
1.2 MOFs载体合成方法
1.2.1 溶剂热合成法
溶剂热合成法是在有机溶剂或者水的环境下,通过高压釜等密闭容器产生的压强与反应底物之间的作用生成目标产物的方法。该方法依靠反应物在高压高温环境中的溶剂热反应或水热反应而产生结晶,从而得到单晶产物或者MOFs微结晶物[26]。MILs、ZIFs、UiO等常见的MOFs材料都是用溶剂热合成法制备[27]。如BANERJEE等[28]利用溶剂热合成法在0.2 mol/L底物浓度、85~100 ℃的温度反应72 h合成ZIFs类材料。溶剂热反应利用的是较高的温度环境来降低有机溶剂的黏度,促使反应底物充分混合,但也会导致合成的MOFs纯度低,后续的活化程序也因MOFs材料纯度的提高而变得复杂[28]。
1.2.2 微波合成法
微波合成法是利用电磁辐射促使物质分子中偶极矩发生反应。与一般的加热法不同,微波合成法会使物质内的温度迅速增加而产生内热效应,在极短时间内使生成的MOFs材料浓度更高,结构更加稳定[29-30]。在制备MIL-100 (Cr)方面,相较于传统合成方法,微波合成法因合成时间更短而具有较大优势[31]。LIANG等[32]将微波合成法应用于MIL-140A-MW和MIL-140B-MW的合成,建立了一种新型的氨基功能化类似物的MOFs材料。在反应过程中,反应时间能够从传统电加热所需的6 h显著缩短到15 min,并且制备出来的MOFs类材料纯度更高。此外,微波合成法大多应用于合成尺寸较小的MOFs类材料。
1.2.3 机械合成法
机械合成法具有快速、简便等优点,通常用于合成分散性较高的化合物。该方法主要是在高能球磨机中加入盐添加剂,使磨球充分和底物颗粒研磨而增加其比表面积。用该方法合成MOFs时会降低反应的自由能,使反应温度降低并提高MOFs的稳定性[33]。KATSENIS等[34]采用机械合成法将ZnO与二甲基咪唑反应,再加入一定量的乙酸来合成ZIF-8材料。结果发现,从衍射多晶图案中可以看见结晶核的产生和结晶形成过程。机械合成法的优点在于无溶剂干扰,成本低并且过程简单,能够满足MOFs类材料的大规模生产需求,有着广泛的应用前景。
1.2.4 超声化学合成法
超声化学合成法主要是利用超声波在溶剂中传播时,在反应液中发生气泡碰撞、爆破、产生超声空化现象来逐渐提高环境温度和压力[35]。经过超声化学合成法合成的MOFs类材料结晶时间短、晶核较小且均匀[36]。QIU等[37]把均苯三甲酸和醋酸锌溶解在乙醇中,利用超声化学合成法反应5 min后,获得MOFs类材料的产率为75.3%。尽管超声化学合成法制备MOFs类材料所用时间短,但是在合成过程中MOFs的孔径大小不均匀,从而导致目标MOFs的结晶度发生改变。
综上,金属位点与合成方式的多样性使得MOFs具有不同的孔隙结构和催化性能。常见的MOFs材料如ZIFs和MILs,其合成方法简单且能形成稳定的拓扑结构。溶剂热合成法操作简便并且适用于合成各类MOFs材料,但合成时间较长。微波合成法和超声合成法可有效地缩短合成时间,但是对产物的晶粒尺寸有一定的限制。目前,普遍采用溶剂热合成法制备MOFs材料,未来可同时结合微波或者超声辅助来缩短合成时间,提高合成效率。
1.3 MOFs-脂肪酶的合成策略
1.3.1 吸附法
表面吸附法是常见的MOFs-脂肪酶固定的方法,该方法是利用底物分子之间的弱相互作用力连接MOFs材料与酶分子(如图2-a),这些作用力(如范德华力、疏水作用、静电作用等)可以很好地保护酶分子的自身结构不被破坏,同时防止因酶之间团聚黏连而造成的底物与催化剂接触面积减少[38]。LIU等[39]将猪胰脂酶(porcinepancreas lipase,PPL)通过吸附法固定在MOFs载体上,即将该MOFs在含有二甲基亚砜的猪胰脂酶-甲醇溶液中浸泡搅拌1 h,离心干燥后获得PPL@MOFs粉末。SEM、FTIR等表征结果显示,猪胰脂酶已被成功固定。所制备的PPL@ MOFs在48 ℃下储存35 d后,相对酶活力仍大于65%。同样地,NOBAKHT等[40]采用吸附法制备2种固定化猪胰脂酶PPL@HKUST-1和PPL@MIL-100(Fe),在室温下保存20 d后,二者的相对酶活力分别为78%和90%。吸附法因对载体材料的结构和性能要求不高而具广泛适用性,但易受环境因素干扰而使脂肪酶从MOFs载体上脱离,影响后续催化效果[41]。

a-表面吸附法;b-封装法
图2 脂肪酶与MOFs物理连接方法
Fig.2 Physical connection methods between lipase and MOFs
1.3.2 封装法
对于尺寸大于MOFs孔径的脂肪酶,往往采用封装法将大尺寸的活性分子限制在MOFs材料构成的“笼”中进行固定化(如图2-b)。封装法制备的MOFs-脂肪酶催化剂不仅可以防止酶浸出,还可以避免脂肪酶在极端反应条件下失活[42]。HE等[43]利用封装法把嗜热脂肪酶封装到ZIF-8中,得到的lipase@ZIF-8显示出对高温、弱酸性及碱性环境的耐受性,在70 ℃条件下存放5 min后依旧保持63%的活性,大大高于游离脂肪酶(相对酶活性为5%)。原因在于ZIF-8孔径明显小于脂肪酶的尺寸,可以有效降低反应时甲醇或者高温带来的影响,防止脂肪酶结构被破坏,从而保持了脂肪酶的生物活性。
仿生矿化法是一种新型的封装方法,受到自然界生物矿化原理的启发,将生物活性分子封装在MOFs载体中以显著增加功能性生物大分子的环境稳定性和重复使用性[44]。虽然封装法制备MOFs-脂肪酶操作简单快速,但形成的MOFs载体的孔径尺寸会限制反应底物与脂肪酶接触而降低催化效率。
1.3.3 共价键合法
共价键合法主要是通过MOFs载体表面多种官能团(如羧基、氨基、羟基等)与脂肪酶分子的活性位点相结合的方式完成固定化的方法[45]。当前常见的共价键合法可以分为两大类。第一类是通过MOFs载体上的官能团与脂肪酶之间形成共价键,将酶分子固定在MOFs的表面(如图3-a)。第二类是首先利用一些可以透过MOFs孔径的小分子物质与MOFs通过π-π键连接,再将小分子物质另一端与酶分子通过氢键相互连接,从而达到将酶分子固定在MOFs上的效果。由于这种小分子物质可以进入MOFs的孔径之中,因此酶分子可以漂浮在MOFs表面构成MOFs-酶。为方便标记,可采用荧光染料类标记物作为小分子物质连接酶与MOFs载体[46]。如LIU等[46]将异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的胰蛋白酶与MIL-101载体充分混合,最终得到在MOFs上固定化的胰蛋白酶,为标记MOFs-脂肪酶提供了方法。
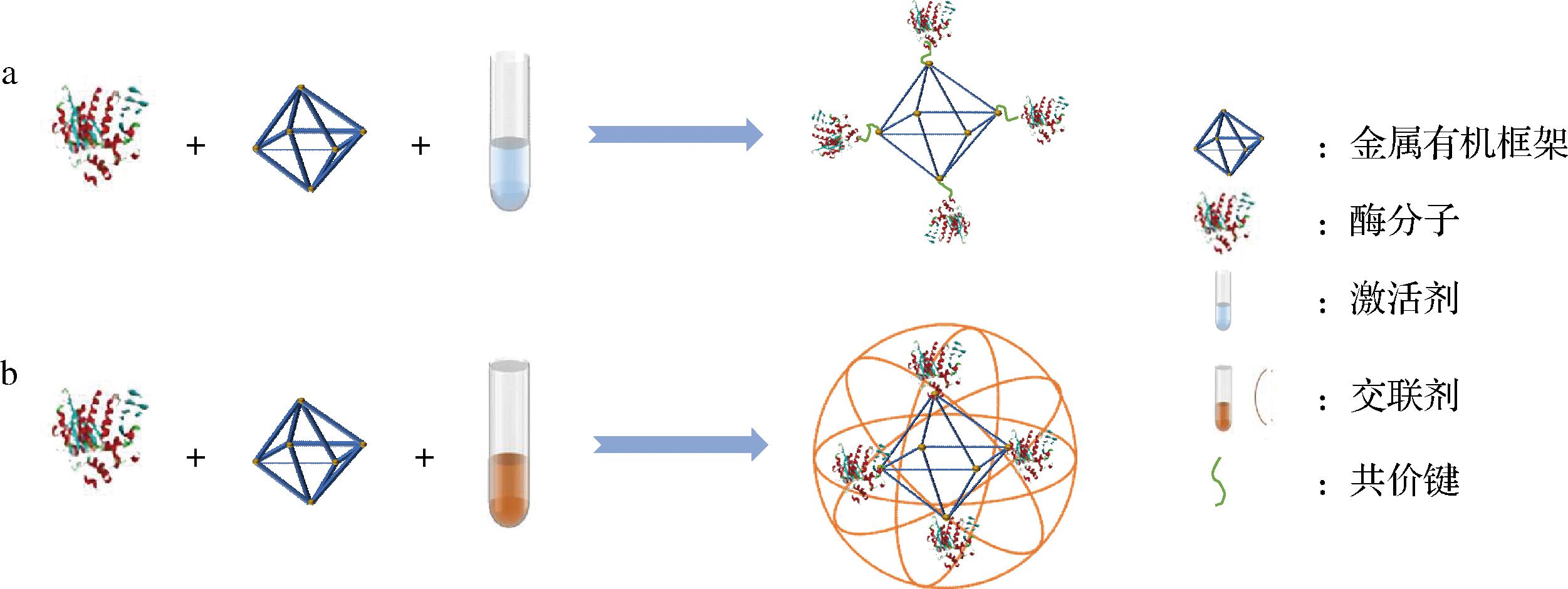
a-共价键合法;b-交联法
图3 脂肪酶与MOFs化学连接方法
Fig.3 Chemical ligation methods of lipase to MOFs
1.3.4 交联法
交联法是利用携带有双功能团的交联剂将酶的结构基团与MOFs载体进行交联,形成不溶于水的网状结构,该过程可以在有机溶剂体系中完成[47],具体结构见图3-b。戊二醛是常见的交联剂之一,可在5~40 ℃下完成交联反应,同时避免交联时蛋白分子三级结构发生改变。CHEN等[48]利用戊二醛作为交联剂,将PPL固定在UiO-66-NH2上以形成PPL@UiO-66-NH2催化剂,结果表明PPL的固定化量高达98.31 mg/g,酶的相对活性为104.4%。此外,BADOEI-DALFARD等[49]也利用戊二醛作为交联剂将脂肪酶MG10固定于新型锆基MOFs载体上。结果表明,该脂肪酶在新型锆基MOFs上固定化效率可达93%,固定化后的酶催化剂在60 ℃条件下孵育180 min后依然保持良好的稳定性。
交联法所用的交联剂种类多,选择性广。然而,相比于表面吸附法、封装法等,交联法的酶固定化成本更高,尤其需要考虑交联剂对酶分子活性的影响,避免交联剂浓度过高而导致酶分子失活。
表1对国内外现有典型的MOFs-脂肪酶的合成方式进行了分类汇总。鉴于不同脂肪酶和MOFs的结构性质差异,需要有针对性地设计MOFs载体的孔道结构和脂肪酶固定化方法。总之,吸附法是最简便的合成方法,缺点在于通过分子间相互作用力固定化酶的稳定性较弱,易在后续实验中使酶分子从载体上脱落。封装法和共价键合法是效果最佳的两大类MOFs-脂肪酶合成方法。其中封装法能使酶分子被MOFs紧紧包围,依靠MOFs的空隙与底物进行反应从而提高催化效率。共价键合法依靠官能团将MOFs和脂肪酶进行连接,还可以利用荧光标记物将两者进行连接,有利于后续结果的判定统计。
表1 不同MOFs-脂肪酶的合成方式
Table 1 Summary of synthesis strategies for different MOFs-lipases
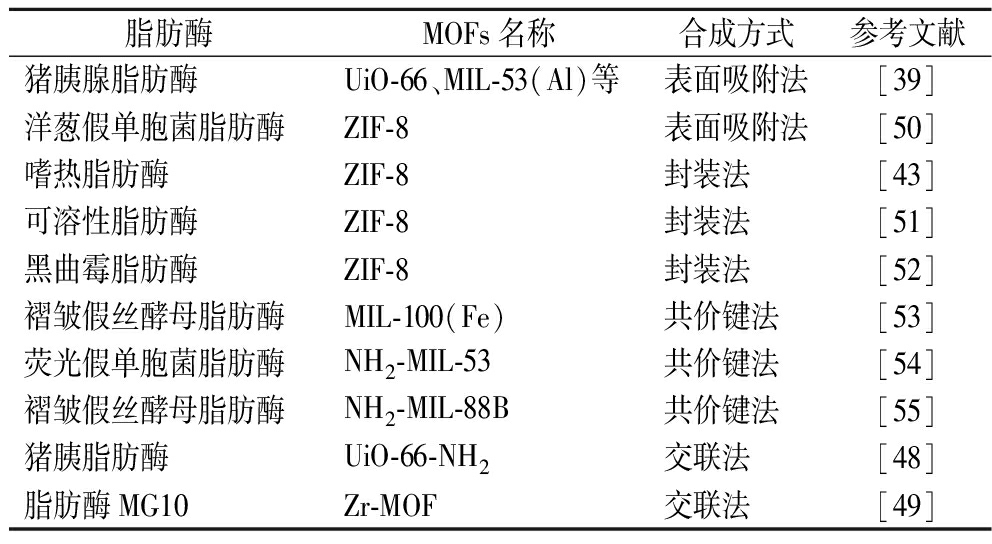
脂肪酶MOFs名称合成方式参考文献猪胰腺脂肪酶UiO-66、MIL-53(Al)等表面吸附法[39]洋葱假单胞菌脂肪酶ZIF-8表面吸附法[50]嗜热脂肪酶ZIF-8封装法[43]可溶性脂肪酶ZIF-8封装法[51]黑曲霉脂肪酶ZIF-8封装法[52]褶皱假丝酵母脂肪酶MIL-100(Fe)共价键法[53]荧光假单胞菌脂肪酶NH2-MIL-53共价键法[54]褶皱假丝酵母脂肪酶NH2-MIL-88B共价键法[55]猪胰脂肪酶UiO-66-NH2交联法[48]脂肪酶MG10Zr-MOF交联法[49]
1.4 MOFs-脂肪酶催化剂
相较于酸性或碱性催化剂,脂肪酶催化剂不仅能降低油脂转化过程中的能源消耗,而且即使在低温条件下也能进行酯交换反应,且具有较高的选择性。此外,脂肪酶对低品质原料油中的杂质成分(如脂肪酸和水)的适应能力强,反应过程中无副产物生成,可得到纯度更高的脂肪酸酯[56]。然而,未经固定的游离酶对于醇类溶剂的耐受性差,难以从产品中分离,重复使用性不理想。利用MOFs作为载体固定脂肪酶已成为当前研究热点。ADNAN等[57]将洋葱伯克霍尔德菌脂肪酶(Burkholderia cepacia lipase,BCL)置于含有ZIF-8的磷酸盐缓冲液中,充分混合后获得固定化的BCL@ZIF-8催化剂,催化大豆油和乙醇进行酯交换反应,结果表明固定化酶的催化活性比游离酶提高了12倍。HU等[58]将聚二甲基硅氧烷包覆在UiO-66上以构建疏水性载体用于固定化黑曲霉脂肪酶(Aspergillus niger lipase,ANL),催化大豆油和甲醇进行酯交换反应生产生物柴油。研究发现UiO-66表面的疏水性对ANL的负载效率和相对酶活力有明显提高,尤其是相对酶活性提高到94%,而未经疏水性处理的、以原始UiO-66为载体的催化剂相对酶活力不到50%。
MOFs所具有的多孔率和高比表面积的特性,可使其比其他传统载体负载更多的酶分子,有利于降低传质限制并提高催化活性。综上,以MOFs为载体固定化脂肪酶所制得的催化剂在反应条件、后处理和重复使用性能方面都比传统酸碱催化剂更具优势。
2 MOFs-脂肪酶在酯交换反应中的应用
酶促酯交换反应具有反应条件温和、产品纯度高、绿色无污染等优势[59],以废弃油脂为原料进行酶促酯交换反应制备脂肪酸酯越来越受关注。例如,脂肪酸甲酯是生物柴油的主要成分,被认为是一种可替代型生物质燃料,具有无毒、可生物降解、温室气体排放少等优点[60]。使用固定化酶催化制备生物柴油可实现酶催化剂与产品分离,提高酶催化剂的重复使用率和稳定性,进而提升工业废弃油脂的转化效率,降低生产成本[61]。尤其是以MOFs为载体固定化脂肪酶所形成的MOFs-脂肪酶表现出优良的活性和稳定性,表2总结了近年来不同MOFs-脂肪酶催化剂在酯交换反应中的研究结果。XIE等[53]用四氧化三铁纳米颗粒包裹MIL-100(Fe),形成Fe3O4@MIL-100(Fe)复合材料作为载体,利用共价键合法固定褶皱假丝酵母脂肪酶,用于大豆油的酯交换反应制备生物柴油。实验结果表明,脂肪酶在Fe3O4@MIL-100(Fe)上的固定效率达83.1%,脂肪酶相对酶活力达63.5%。将固定后的脂肪酶催化剂用于酯交换反应中,在甲醇和油的摩尔质量比为4∶1、反应温度为40 ℃时,油脂转化为脂肪酸甲酯的最高转化率为92.3%。此外,具备核壳结构的Fe3O4@MIL-100(Fe)载体具有较强的磁性(磁饱和强度为19.17 emu/g),可分离回收该磁性酶催化剂。循环使用5次后,油脂转化率仍高于80%。
表2 不同MOFs-脂肪酶在酯交换反应中的性能
Table 2 Performance of different MOFs-lipases in transesterification reaction
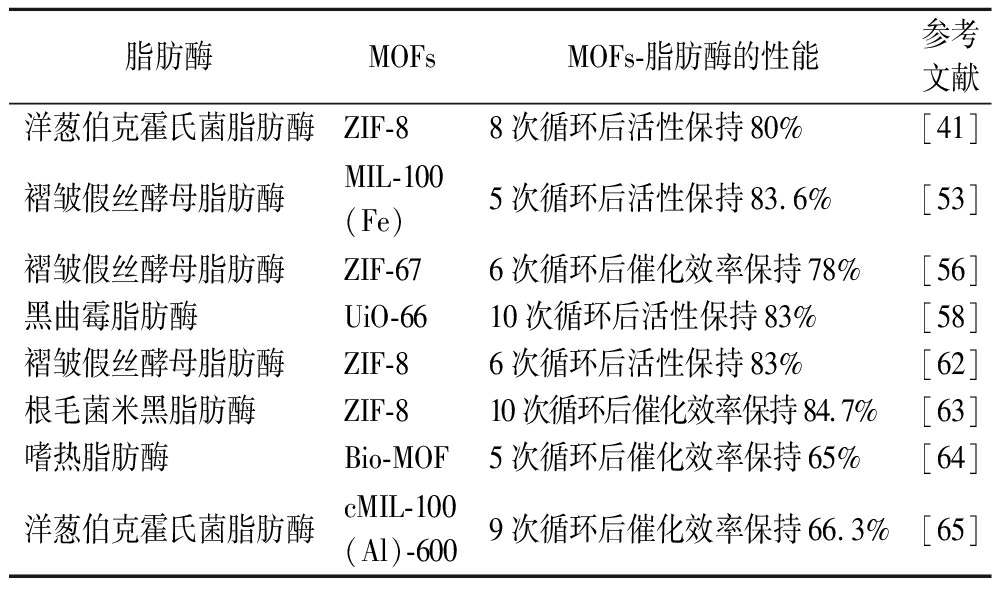
脂肪酶MOFsMOFs-脂肪酶的性能参考文献洋葱伯克霍氏菌脂肪酶ZIF-88次循环后活性保持80%[41]褶皱假丝酵母脂肪酶MIL-100(Fe)5次循环后活性保持83.6%[53]褶皱假丝酵母脂肪酶 ZIF-676次循环后催化效率保持78%[56]黑曲霉脂肪酶UiO-6610次循环后活性保持83%[58]褶皱假丝酵母脂肪酶 ZIF-86次循环后活性保持83%[62]根毛菌米黑脂肪酶ZIF-810次循环后催化效率保持84.7%[63]嗜热脂肪酶Bio-MOF5次循环后催化效率保持65%[64]洋葱伯克霍氏菌脂肪酶cMIL-100(Al)-6009次循环后催化效率保持66.3%[65]
RAFIEI等[56]用“船外造瓶法”将念珠菌脂肪酶(Candida rugosa lipase, CRL)封装到微孔ZIF-67中制得一种新型多相生物催化剂。ZIF-67载体提供的强支撑力显著提高了脂肪酶的热稳定性、贮存稳定性和重复使用性,在无溶剂催化大豆油生成生物柴油的酯交换反应中,CRL@ZIF-67循环使用6次仍具有优良的催化活性。
OZYILMAZ等[62]将Zn2+与二甲基咪唑进行共沉淀制备出ZIF-8,用于固定化预处理完毕的脂肪酶CRL,制得MOFs-脂肪酶催化剂CRL@Calix-ZIF-8。实验表明,与游离酶相比,CRL@Calix-ZIF-8具有更高的耐碱性和耐热性;在大豆油和甲醇酯交换反应中,经过60 ℃、100 min反应后,游离脂肪酶完全失去催化活性,而CRL@Calix-ZIF-8仍保留约84%的活性。经循环6次使用后,CRL@Calix-ZIF-8的催化活性依旧保持在83%。
ADNAN等[63]以ZIF-8为载体,利用封装法固定米赫根毛霉脂肪酶(Rhizomucor miehei lipase, RML),制得脂肪酶催化剂RML@ZIF-8。特别的是,该ZIF-8载体具有X型结构,可减少反应过程中脂肪酶泄漏,为酶促酯交换反应提供更好的稳定性。在甲醇和油的摩尔质量比为4∶1、含水量9%(质量分数)、45 ℃条件下反应24 h后,脂肪酸酯的产率可达到95%。经过10次循环酯交换反应后,脂肪酸甲酯的产率仍能保持84.7%。
LIU等[65]利用MOFs形成纳米多孔碳,用于固定洋葱伯克霍氏菌脂肪酶,其制备过程见图4。脂肪酶固定在修饰后的cMIL-100(Al)-600上表现出更高的催化活性,酯交换反应后脂肪酸酯的产率为72.6%,9次循环使用后,脂肪酸酯产率为66.3%。实验表明MOFs载体的孔径大小、亲疏水性、金属氧化物种类等,是影响脂肪酶在MOFs上固定化效率的关键因素。修饰后的MOFs载体不仅可以提高酶负载效率,而且能提高对油脂酯交换反应的催化能力。

图4 BCL@cMIL-100(Al)催化制备生物柴油示意图
Fig.4 Biodiesel production with BCL@cMIL-100(Al)
3 总结与展望
综上,利用MOFs材料为载体固定脂肪酶,不仅能提高酶的活性和稳定性,还有利于催化剂的回收和重复利用,提高油脂的转化率和脂肪酸酯的产率。MOFs载体的结构和亲疏水性对构建脂肪酶界面催化所需的微环境、提高催化效率和稳定性至关重要。然而,对MOFs-脂肪酶作催化剂的研究还处于相对早期的阶段,仍需进一步针对脂肪酶特性设计相应的载体,提高MOFs与脂肪酶的适配性。因此,合理设计多孔MOFs载体的结构以适应酶分子尺寸,构建脂肪酶界面催化所需要的亲疏水性微环境,进一步提高固定化酶的稳定性和重复使用性,是未来脂肪酶应用于工业油脂转化的重要方向。
[1] SINGH S P, SINGH D.Biodiesel production through the use of different sources and characterization of oils and their esters as the substitute of diesel:A review[J].Renewable and Sustainable Energy Reviews, 2010, 14(1):200-216.
[2] GUO J J, SUN S D, LIU J M.Conversion of waste frying palm oil into biodiesel using free lipase A from Candida antarctica as a novel catalyst[J].Fuel, 2020, 267:117323.
[3] SUN S D, LI K Y.Biodiesel production from Phoenix tree seed oil catalyzed by liquid lipozyme TL100L[J].Renewable Energy, 2020, 151:152-160.
[4] LOH J M, AMELIA, GOURICH W, et al.Improved biodiesel production from sludge palm oil catalyzed by a low-cost liquid lipase under low-input process conditions[J].Renewable Energy, 2021, 177:348-358.
[5] 张灿, 姜国芳, 杨江楠, 等.多孔材料固定化脂肪酶的研究进展[J].分子催化, 2020, 34(4):378-396.ZHANG C, JIANG G F, YANG J N, et al.Research progress of immobilized lipase on porous materials[J].Journal of Molecular Catalysis (China), 2020, 34(4):378-396.
[6] 曹诗林, 徐培, 马永正, 等.纳米载体固定化酶的最新研究进展[J].催化学报, 2016, 37(11):1814-1823.CAO S L, XU P, MA Y Z, et al.Recent advances in immobilized enzymes on nanocarriers[J].Chinese Journal of Catalysis, 2016, 37(11):1814-1823.
[7] DONG Z, LIU Z S, SHI J, et al.Carbon nanoparticle-stabilized Pickering emulsion as a sustainable and high-performance interfacial catalysis platform for enzymatic esterification/transesterification[J].ACS Sustainable Chemistry &Engineering, 2019, 7(8):7619-7629.
[8] IMAM H T, MARR P C, MARR A C.Enzyme entrapment, biocatalyst immobilization without covalent attachment[J].Green Chemistry, 2021, 23(14):4980-5005.
[9] ZHONG L, FENG Y X, WANG G Y, et al.Production and use of immobilized lipases in/on nanomaterials:A review from the waste to biodiesel production[J].International Journal of Biological Macromolecules, 2020, 152:207-222.
[10] YAGHI O M, LI G M, LI H L.Selective binding and removal of guests in a microporous metal-organic framework[J].Nature, 1995, 378:703-706.
[11] CHAI M, RAZAVI BAZAZ S, DAIYAN R, et al.Biocatalytic micromixer coated with enzyme-MOF thin film for CO2 conversion to formic acid[J].Chemical Engineering Journal, 2021, 426:130856.
[12] PHAN A, DOONAN C J, URIBE-ROMO F J, et al.Synthesis, structure, and carbon dioxide capture properties of zeolitic imidazolate frameworks[J].Accounts of Chemical Research, 2010, 43(1):58-67.
[13] 刘漫, 鲁晓明, 冯俊鹤, 等.美国沸石咪唑酯骨架结构材料的研究进展[J].现代化工, 2008, 28(6):81-84;86.LIU M, LU X M, FENG J H, et al.Research advances in zeolitic imidazolate frameworks(ZIFs) in America[J].Modern Chemical Industry, 2008, 28(6):81-84;86.
[14] 尹作娟, 高翔, 孙兆林, 等.金属有机骨架的合成及应用[J].化学与粘合, 2009, 31(3):61-65.YIN Z J, GAO X, SUN Z L, et al.Synthesis and applications of metal-organic frameworks[J].Chemistry and Adhesion, 2009, 31(3):61-65.
[15] LEE J, FARHA O K, ROBERTS J, et al.Metal-organic framework materials as catalysts[J].Chemical Society Reviews, 2009, 38(5):1450-1459.
[16] 李庆远, 季生福, 郝志谋.金属-有机骨架材料及其在催化反应中的应用[J].化学进展, 2012, 24(8):1506-1518.LI Q Y, JI S F, HAO Z M.Metal-organic framework materials and their applications in catalysis[J].Progress in Chemistry, 2012, 24(8):1506-1518.
[17] LIN R B, LI F, LIU S Y, et al.A noble-metal-free porous coordination framework with exceptional sensing efficiency for oxygen[J].Angewandte Chemie (International Ed), 2013, 52(50):13429-13433.
[18] FARRUSSENG D, AGUADO S, PINEL C.Metal-organic frameworks:Opportunities for catalysis[J].Angewandte Chemie (International Ed), 2009, 48(41):7502-7513.
[19] MAHMOODI N M, ABDI J, OVEISI M, et al.Metal-organic framework (MIL-100 (Fe)):Synthesis, detailed photocatalytic dye degradation ability in colored textile wastewater and recycling[J].Materials Research Bulletin, 2018, 100:357-366.
[20] KURMOO M.Magnetic metal-organic frameworks[J].Chemical Society Reviews, 2009, 38(5):1353-1379.
[21] MEEK S T, GREATHOUSE J A, ALLENDORF M D.Metal-organic frameworks:A rapidly growing class of versatile nanoporous materials[J].Advanced Materials, 2011, 23(2):249-267.
[22] WANG J F, FENG T, LI Y J, et al.Novel structurally characterized Co(II) metal-organic framework and Cd(II) coordination polymer self-assembled from a pyridine-terminal salamo-like ligand bearing various coordination modes[J].Journal of Molecular Structure, 2021, 1231:129950.
[23] CHOI K M, JEON H J, KANG J K, et al.Heterogeneity within order in crystals of a porous metal-organic framework[J].Journal of the American Chemical Society, 2011, 133(31):11920-11923.
[24] DENG H X, GRUNDER S, CORDOVA K E, et al.Large-pore apertures in a series of metal-organic frameworks[J].Science, 2012, 336(6084):1018-1023.
[25] SHEKHAH O, WANG H, KOWARIK S, et al.Step-by-step route for the synthesis of metal-organic frameworks[J].Journal of the American Chemical Society, 2007, 129(49):15118-15119.
[26] DECOSTE J B, PETERSON G W, SCHINDLER B J, et al.The effect of water adsorption on the structure of the carboxylate containing metal-organic frameworks Cu-BTC, Mg-MOF-74, and UiO-66[J].Journal of Materials Chemistry A, 2013, 1(38):11922-11932.
[27] HAQUE E, JEONG J H, JHUNG S H.Synthesis of isostructural porous metal-benzenedicarboxylates:Effect of metal ions on the kinetics of synthesis[J].CrystEngComm, 2010, 12(10):2749-2754.
[28] BANERJEE R, PHAN A, WANG B, et al.High-throughput synthesis of zeolitic imidazolate frameworks and application to CO2 capture[J].Science, 2008, 319(5865):939-943.
[29] MURRAY L J, DINC M, LONG J R.Hydrogen storage in metal-organic frameworks[J].Chemical Society Reviews, 2009, 38(5):1294-1314.
M, LONG J R.Hydrogen storage in metal-organic frameworks[J].Chemical Society Reviews, 2009, 38(5):1294-1314.
[30] LEE E J, BAE J, CHOI K M, et al.Exploiting microwave chemistry for activation of metal-organic frameworks[J].ACS Applied Materials &Interfaces, 2019, 11(38):35155-35161.
[31] KLINOWSKI J, ALMEIDA PAZ F A, SILVA P, et al.Microwave-assisted synthesis of metal-organic frameworks[J].Dalton Transactions, 2011, 40(2):321-330.
[32] LIANG W B, D’ALESSANDRO D M.Microwave-assisted solvothermal synthesis of zirconium oxide based metal-organic frameworks[J].Chemical Communications, 2013, 49(35):3706-3708.
[33] BELDON P J, F BI
BI N L, STEIN R S, et al.Rapid room-temperature synthesis of zeolitic imidazolate frameworks by using mechanochemistry[J].Angewandte Chemie (International Ed), 2010, 49(50):9640-9643.
N L, STEIN R S, et al.Rapid room-temperature synthesis of zeolitic imidazolate frameworks by using mechanochemistry[J].Angewandte Chemie (International Ed), 2010, 49(50):9640-9643.
[34] KATSENIS A D, PU KARI
KARI A,
A,  TRUKIL V, et al.In situ X-ray diffraction monitoring of a mechanochemical reaction reveals a unique topology metal-organic framework[J].Nature Communications, 2015, 6:6662.
TRUKIL V, et al.In situ X-ray diffraction monitoring of a mechanochemical reaction reveals a unique topology metal-organic framework[J].Nature Communications, 2015, 6:6662.
[35] SON W J, KIM J, KIM J, et al.Sonochemical synthesis of MOF-5[J].Chemical Communications, 2008(47):6336-6338.
[36] MUELLER U, SCHUBERT M, TEICH F, et al.Metal-organic frameworks—prospective industrial applications[J].Journal of Materials Chemistry, 2006, 16(7):626-636.
[37] QIU L G, LI Z Q, WU Y, et al.Facile synthesis of nanocrystals of a microporous metal-organic framework by an ultrasonic method and selective sensing of organoamines[J].Chemical Communications, 2008(31):3642-3644.
[38] RAJA D S, LIU W L, HUANG H Y, et al.Immobilization of protein on nanoporous metal-organic framework materials[J].Comments on Inorganic Chemistry, 2015, 35(6):331-349.
[39] LIU W L, YANG N S, CHEN Y T, et al.Lipase-supported metal-organic framework bioreactor catalyzes warfarin synthesis[J].Chemistry, 2015, 21(1):115-119.
[40] NOBAKHT N, ALI FARAMARZI M, SHAFIEE A, et al.Polyoxometalate-metal organic framework-lipase:An efficient green catalyst for synthesis of benzyl cinnamate by enzymatic esterification of cinnamic acid[J].International Journal of Biological Macromolecules, 2018, 113:8-19.
[41] CHEONG L Z, WEI Y Y, WANG H B, et al.Facile fabrication of a stable and recyclable lipase@amine-functionalized ZIF-8 nanoparticles for esters hydrolysis and transesterification[J].Journal of Nanoparticle Research, 2017, 19(8):280.
[42] NADAR S S, RATHOD V K.Immobilization of proline activated lipase within metal organic framework (MOF)[J].International Journal of Biological Macromolecules, 2020, 152:1108-1112.
[43] HE H M, HAN H B, SHI H, et al.Construction of thermophilic lipase-embedded metal-organic frameworks via biomimetic mineralization:A biocatalyst for ester hydrolysis and kinetic resolution[J].ACS Applied Materials &Interfaces, 2016, 8(37):24517-24524.
[44] LIANG K, RICCO R, DOHERTY C M, et al.Biomimetic mineralization of metal-organic frameworks as protective coatings for biomacromolecules[J].Nature Communications, 2015, 6:7240.
[45] WU X L, HOU M, GE J.Metal-organic frameworks and inorganic nanoflowers:A type of emerging inorganic crystal nanocarrier for enzyme immobilization[J].Catalysis Science &Technology, 2015, 5(12):5077-5085.
[46] LIU W L, LO S H, SINGCO B, et al.Novel trypsin-FITC@MOF bioreactor efficiently catalyzes protein digestion[J].Journal of Materials Chemistry B, 2013, 1(7):928-932.
[47] 陈军, 陆新, 华兆哲, 等.固定化过氧化氢酶的制备及其抗氧化作用[J].化学研究与应用, 2006, 18(6):737-740.CHEN J, LU X, HUA Z Z, et al.Preparation of immobilized catalase and its anti-oxidation[J].Chemical Research and Application, 2006, 18(6):737-740.
[48] CHEN X L, XUE S, LIN Y L, et al.Immobilization of porcine pancreatic lipase onto a metal-organic framework, PPL@MOF:A new platform for efficient ligand discovery from natural herbs[J].Analytica Chimica Acta, 2020, 1099:94-102.
[49] BADOEI-DALFARD A, SHAHBA A, ZAARE F, et al.Lipase immobilization on a novel class of Zr-MOF/electrospun nanofibrous polymers:Biochemical characterization and efficient biodiesel production[J].International Journal of Biological Macromolecules, 2021, 192:1292-1303.
[50] OU J, YUAN X, LIU Y, et al.Lipase from Pseudomonas cepacia immobilized into ZIF-8 as bio-catalyst for enantioselective hydrolysis and transesterification[J].Process Biochemistry, 2021, 102:132-140.
[51] AL-MANSOURI R, DU W, AL-ZUHAIR S.Reaction-diffusion model to describe biodiesel production using lipase encapsulated in ZIF-8[J].Fuel, 2022, 311:122630.
[52] NADAR S S, RATHOD V K.Encapsulation of lipase within metal-organic framework (MOF) with enhanced activity intensified under ultrasound[J].Enzyme and Microbial Technology, 2018, 108:11-20.
[53] XIE W L, HUANG M Y.Enzymatic production of biodiesel using immobilized lipase on core-shell structured Fe3O4@MIL-100(Fe) composites[J].Catalysts, 2019, 9(10):850.
[54] YUAN X, OU J, ZHANG P L, et al.PEG-modified lipase immobilized onto NH2-MIL-53 MOF for efficient resolution of 4-fluoromandelic acid enantiomers[J].International Journal of Biological Macromolecules, 2020, 165:1793-1802.
[55] SAMUI A, CHOWDHURI A R, MAHTO T K, et al.Fabrication of a magnetic nanoparticle embedded NH2-MIL-88B MOF hybrid for highly efficient covalent immobilization of lipase[J].RSC Advances, 2016, 6(71):66385-66393.
[56] RAFIEI S, TANGESTANINEJAD S, HORCAJADA P, et al.Efficient biodiesel production using a lipase@ZIF-67 nanobioreactor[J].Chemical Engineering Journal, 2018, 334:1233-1241.
[57] ADNAN M, LI K, WANG J H, et al.Hierarchical ZIF-8 toward immobilizing Burkholderia cepacia lipase for application in biodiesel preparation[J].International Journal of Molecular Sciences, 2018, 19(5):1424.
[58] HU Y L, DAI L M, LIU D H, et al.Rationally designing hydrophobic UiO-66 support for the enhanced enzymatic performance of immobilized lipase[J].Green Chemistry, 2018, 20(19):4500-4506.
[59] CHEN J W, WU W T.Regeneration of immobilized Candida antarctica lipase for transesterification[J].Journal of Bioscience and Bioengineering, 2003, 95(5):466-469.
[60] ATABANI A E, SILITONGA A S, BADRUDDIN I A, et al.A comprehensive review on biodiesel as an alternative energy resource and its characteristics[J].Renewable and Sustainable Energy Reviews, 2012, 16(4):2070-2093.
[61] AMINI Z, ILHAM Z, ONG H C, et al.State of the art and prospective of lipase-catalyzed transesterification reaction for biodiesel production[J].Energy Conversion and Management, 2017, 141:339-353.
[62] OZYILMAZ E, ASCIOGLU S, YILMAZ M.Calix arene tetracarboxylic acid-treated lipase immobilized onto metal-organic framework:Biocatalyst for ester hydrolysis and kinetic resolution[J].International Journal of Biological Macromolecules, 2021, 175:79-86.
[63] ADNAN M, LI K, XU L, et al.X-shaped ZIF-8 for immobilization Rhizomucor miehei lipase via encapsulation and its application toward biodiesel production[J].Catalysts, 2018, 8(3):96.
[64] LI Q, CHEN Y X, BAI S W, et al.Immobilized lipase in bio-based metal-organic frameworks constructed by biomimetic mineralization:A sustainable biocatalyst for biodiesel synthesis[J].Colloids and Surfaces B:Biointerfaces, 2020, 188:110812.
[65] LIU L H, SHIH Y H, LIU W L, et al.Enzyme immobilized on nanoporous carbon derived from metal-organic framework:A new support for biodiesel synthesis[J].ChemSusChem, 2017, 10(7):1364-1369.