γ-氨基丁酸(γ-aminobutyric acid, GABA)又名γ-氨酪酸,分子式为C4H9NO2,由α-氨基戊二酸脱羧形成,是一种广泛存在于微生物、植物、脊椎动物中的四碳非蛋白质氨基酸[1]。在哺乳动物中,GABA主要作为抑制性神经递质发挥重要生理功效,对失眠、抑郁、焦虑、阿尔兹海默症等症状具有缓解作用,并且可以改善大脑的记忆功能[2],除此之外,GABA还具备降血脂、预防肥胖症、维持机体肠胃健康的功能[3-4]。随着年龄增长和精神压力的增大,人体内GABA含量逐渐降低,近来研究表明,外源GABA可以通过口服的方式被摄入[5],因此,开发富含GABA的功能性食品成为食品行业研究的热点之一。
GABA合成方法主要包括化学合成法、微生物发酵法以及植物代谢法,植物代谢是指茶叶、谷物、豆类等在发芽、机械损伤及其他条件下累积GABA的一种方式[6],其中,谷物萌芽相较于化学合成及微生物发酵更加天然绿色,符合对GABA安全适量的要求。糙米、大麦、青稞、藜麦等多种谷物中均含有GABA,近年来已作为GABA富集原料进行生产利用。谷物萌芽包括自然萌芽和胁迫萌芽,自然萌芽可以改善谷物的粗糙口感,并且能够在一定程度上提高谷物GABA、维生素、多酚等生物活性物质的含量[7];胁迫萌芽指对处于发芽状态的谷物施加外界环境压力(盐胁迫、低温刺激、微波处理等),使其出现应激反应从而大量富集GABA的过程。目前研究人员对于优化谷物萌芽富集GABA工艺条件方面已有许多研究,但是关于胁迫萌芽影响谷物积累GABA的调控机理研究尚不全面,因此,本文主要围绕萌芽谷物中GABA的代谢途径、与GABA代谢相关的重要因素以及逆境胁迫萌芽富集GABA机制几个方面进行综述,阐述了萌芽谷物中GABA的研究现状,以期为谷物富集GABA的深入研究与开发应用提供理论参考。
1 GABA的合成与代谢途径
GABA在谷物的萌芽过程中进行合成和积累,其产生途径主要由谷氨酸通过谷氨酸脱羧酶(glutamate decarboxylase,GAD)的不可逆反应及多胺降解途径组成,如图1所示。
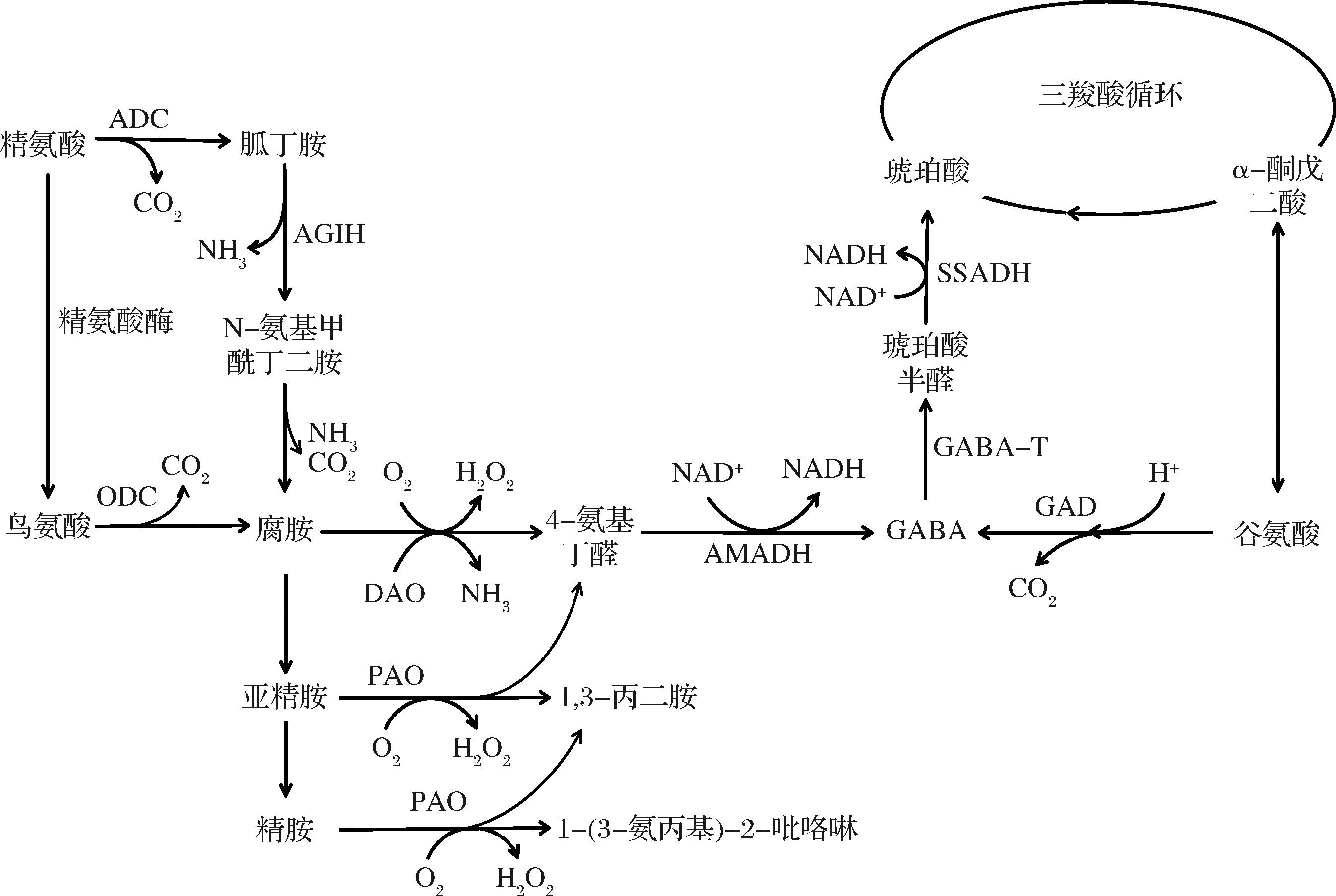
图1 GABA的代谢途径
Fig.1 Metabolic pathway of GABA
注:ADC:精氨酸脱羧酶;AGIH:胍丁胺亚氨基水解酶;ODC:鸟氨酸脱羧酶;DAO:二胺氧化酶;PAO:多胺氧化酶;AMADH:氨基醛脱氢酶;GABA:γ-氨基丁酸;GAD:谷氨酸脱羧酶;GABA-T:γ-氨基丁酸转氨酶;SSADH:琥珀酸半醛脱氢酶。
1.1 GABA支路
GABA支路又称为GABA旁路,是GABA在谷物中的主要合成代谢途径。在细胞质中,谷氨酸在胞浆GAD的作用下不可逆反应生成GABA,随后,GABA在γ-氨基丁酸转氨酶(γ-aminobutyric acid transaminase,GABA-T)和丙酮酸的共同作用下生成琥珀酸半醛,经过琥珀酸半醛脱氢酶(succinic semialdehyde dehydrogenase,SSADH)催化生成琥珀酸,紧接着,产物进入三羧酸(tricarboxylic acid,TCA)循环,而TCA循环的另一产物α-酮戊二酸能够可逆的生成谷氨酸,以此形成整个GABA支路[8]。目前,大多数研究主要集中于谷物萌芽过程中GABA支路合成酶活性及GABA含量之间关系的研究。
1.2 多胺降解途径
第二种途径是多胺降解途径,又称为腐胺降解途径[9]。多胺包括腐胺(putrescine,Put)、精胺(spermine,Spm)和亚精胺(spermidine,Spd),均为植物中主要的多胺,以游离形式存在,或者与酚酸、可溶性核糖核酸和不溶性蛋白质相结合[10]。Put的首要来源为鸟氨酸经鸟氨酸脱羧酶反应形成,其次可由精氨酸在精氨酸脱羧酶作用下产生。Put经亚精胺合酶和精胺合酶分别转化为Spd和Spm,或者在二胺氧化酶(diamine oxidase,DAO)的作用下生成4-氨基丁醛,而Spd则在多胺氧化酶(polyamine oxidases,PAO)的作用下同样生成4-氨基丁醛,进而被4-氨基丁醛脱氢酶转化生成GABA,之后进入GABA支路途径和TCA循环,被催化分解[11]。
多胺降解途径虽然是合成GABA的另一途径,但是在禾本科植物中,此途径只在豆类作物中表现出较明显的GABA合成作用,因此对萌芽过程中多胺降解途径多以豆类为研究对象,这也造成对谷物中多胺降解途径与GABA合成关系缺乏系统的研究。
2 GABA代谢的影响因素
在GABA的两条代谢途径中,无论是GABA支路或是多胺降解途径,均存在许多酶发挥不同的作用,共同形成完整的GABA代谢循环,其中,对GABA积累影响最为关键的酶主要为GAD、GABA-T、PAO及DAO。
2.1 GAD
GAD以谷氨酸为底物,具有高度专一性,在GABA合成中起到催化脱羧的关键作用。谷物中GAD在pH范围为5.5~6.0时能发挥最大活性,只有少部分GAD最适pH值为碱性[12]。在萌芽谷物中,GABA含量与GAD活性密切相关。KHWANCHAI等[13]研究了浸泡和发芽后5个泰国水稻品种样品中GABA含量以及GAD活性的变化,浸泡和发芽后GABA含量和GAD活性分别增加750倍和10~100倍;高粱萌芽过程中GAD活性的变化与GABA含量成正相关[14]。
GABA含量与GAD基因表达水平存在正相关性,谷物可以通过提高GAD基因表达水平,进而促进GAD活性增强,调控GABA的形成。目前,已经从水稻中成功鉴定出5种GAD基因[15],分别是OsGAD1、OsGAD2、OsGAD3、OsGAD4以及OsGAD5,大部分研究主要围绕OsGAD1、OsGAD2、OsGAD3与GAD活性及GABA含量之间的关系进行,在稻米浸水后,OsGAD3的表达水平明显高于OsGAD1和OsGAD2基因,表明OsGAD3的表达可能对提高稻米浸水后GABA含量的作用更显著[16]。在糙米中,采用荧光定量PCR扩增并进行荧光定量分析法检测基因的表达情况,发现糙米GAD的OsGAD1、OsGAD2基因在稻米胚芽中表达增高,发芽期间GABA含量呈增长趋势[17]。2017年,ZHAO等[18]分析了OsGAD4及OsGAD5在发芽糙米中的表达水平,结果发现OsGAD4在5种GAD基因中的表达水平最高。因此,不同基因在不同谷物中的调控作用存在差异,目前已有运用基因工程技术对水稻进行品质改良、生产高GABA食用原料的研究。
Ca2+/CaM通道对GAD的活性具有调控作用。1980年,钙调素(calmodulin,CaM)从菠菜叶中被分离并进行了表征[19],1994年,蚕豆幼苗CaM结合蛋白(calmodulin binding proteins,CaM-BP)的特性被测定,并表明Ca2+与CaM结合域(calmodulin binding domain,CaMBD)形成的Ca2+/CaM复合体可激活植物中的GAD[20],这些证实了Ca2+和CaM是植物细胞内的调节因子。CaMBD存在于GAD的C端结构域[21],能够对Ca2+信号产生反应,当谷物处于非生物胁迫环境,体内细胞的Ca2+浓度显著升高,并与CaM结合形成Ca2+/CaM结合体,进而激活GAD活性,提高GABA含量。王宪青等[22]研究发现,绿豆中提取的CaM能在一定程度上显著提升绿豆GAD的相对活性。
然而,ARAZI等[23]以矮牵牛为对象,采用不同处理方式研究GAD的活性,结果证明在Ca2+存在的情况下,不含CaM的重组矮牵牛中GAD不具备活性,只有Ca2+和CaM同时存在的情况下才使GAD活性激活。因此,单独的Ca2+或者CaM处理均不会影响GABA合成,必须由Ca2+和CaM共同与GAD中的CaMBD相结合形成复合物,从而使GAD活性激活,方可促使GABA合成。
综上所述,GAD活性对GABA的富集影响十分关键,而其酶活性的变化则与多方面因素有关,也正是由于不同因素对GAD活性具有调控作用,使得谷物能够对外界环境变化作出响应,最终提高GABA含量保证自身的生长发育。
2.2 GABA-T
在GABA支路途径中,GABA-T是GABA降解的关键酶,负责催化GABA分解转化为琥珀酸半醛,发生场所主要在谷物细胞的线粒体基质,GABA-T分为GABA-α-酮戊二酸转氨酶和丙酮酸转氨酶两种类型,最适作用pH为8.7,且其对温度十分敏感,当处于25 ℃以上时便开始失活[24]。
孙莹[25]分析了不同品种藜麦GABA-T基因的多态性,并研究其与GABA含量的相关性,结果表明GABA低含量的藜麦品种中更易呈现出较多的GABA-T基因序列差异,推测原因可能是藜麦品种在不同生长环境及遗传因素下,GABA-T基因选择性表达的水平不同,而GABA-T基因表达水平越高则越容易促使其体内的GABA降解,导致GABA含量降低。周露等[26]采用RNA技术,向粳稻品种宁粳1号中转入由水稻基因构建的GABA转氨酶1基因(OsGABA-T1)的干扰载体,进一步研究OsGABA-T1基因表达对GABA含量的影响,数据显示,实验组糙米的OsGABA-T1和OsGABA-T2基因表达均降低,且其中GABA含量相比对照组增加了13倍。这些研究表明GABA-T的基因表达水平及其酶活性的高低与GABA含量存在相应关系,在后续生产中可以通过采用适当的技术降低GABA-T活性,以达到提高谷物内GABA含量的目的。
相比于现有对GABA支路中GAD的研究,对GABA-T的研究报道十分有限,且近五年来对GABA-T的研究内容主要为基因方面,关于GABA-T抑制剂的研究也较少。由于GABA支路是各种酶共同形成的系统且完整的过程,仅仅对GAD进行研究不能全面了解GABA富集的机制,因此后续可加强对GABA-T活性与基因表达、外界及细胞环境等因素的研究,并综合研究GAD与GABA-T对GABA代谢的影响作用,进而探明萌芽谷物通过GABA支路富集GABA的机制。
2.3 DAO和PAO
DAO和PAO是多胺降解途径中催化胺类物质初级氨基的关键酶,广泛存在于细菌、动物、植物细胞中。温度、pH、金属离子、金属螯合剂可影响其活性,氨基胍、氨基脲或者β-羟乙基酰肼等也能够抑制两者的酶活性[27]。多胺降解不仅发生在谷物正常萌发过程中,也在盐渍、干旱、低氧和热胁迫等胁迫环境下起着重要作用。此时,DAO和PAO将分别氧化不同种类的多胺,产生前体物质4-氨基丁醛,进而生成GABA,以提高谷物的抗逆能力,完成对非生物逆境的响应。盐胁迫下发芽大豆的DAO、PAO活力显著提高,使GABA富集,然而在相同的盐胁迫环境,向发芽大豆中额外添加氨基胍,则显示发芽大豆的DAO、PAO活力显著降低,GABA含量也显著降低,证明了环境胁迫能够提高DAO、PAO的活力以富集GABA[21]。
目前,PAO基因已经在小麦、水稻、玉米、拟南芥等植物中被鉴定出来,但编码DAO的基因只有少数发现,有待进一步探究[28]。总之,在萌芽谷物的GABA总量中多胺降解途径贡献占比可能较低,而且现有对此途径的研究内容较少,关于此途径富集GABA的机制研究尚不多见,因此,对DAO及PAO在逆境条件下富集GABA的机制还需深入研究。
3 GABA的应激与积累
3.1 GABA应对胁迫环境的作用
GABA在谷物种子的生长发育等过程参与信号传递及分子调节,当谷物处于不利环境中,依靠GABA进行压力调控,维持正常状态。GABA能够使谷物应对盐渍、缺氧、机械损伤、干旱等非生物胁迫的原因在于它可改善光合作用、激活抗氧化酶、调节气孔开放等[29]。另外,由于逆境条件对谷物造成的损害效果并不相同,从而使诱导GABA积累的作用机制也存在差异。目前,谷物胁迫萌发富集GABA技术通常包括盐渍、低氧、低温刺激、微波处理、紫外照射等。
3.2 逆境胁迫下GABA的积累机制
3.2.1 盐浓度
在长期处于盐分较高的环境中,谷物经受离子胁迫,细胞水分流失,蛋白质合成及酶活性受到影响,导致细胞膜损伤或者细胞死亡,其中Na+对谷物细胞的有害作用最为明显,因此,谷物将进行生理调节以提高耐盐性。在盐溶液中,青稞籽粒生长发育受限,但提高了萌发后青稞GABA的含量[30],这表明谷物在盐胁迫条件下可提高GABA的量以缓解生长压力。在大麦发芽过程中,低浓度的NaCl溶液不仅促进生长,还刺激内源性GABA合成并调节GABA代谢[31];发芽糙米在盐胁迫下生长速率减缓,但呼吸速率加快,大分子蛋白降解为小分子亚基,GABA含量及GAD活性均增加[32],这些研究表明盐胁迫能够提高GAD活性,使GABA含量增加。XING等[33]研究证明,随着盐浓度的增加,大豆所含Put、Spd、尸胺显著降低,原因是盐浓度的升高促进了DAO的活性,促使多胺降解,GABA含量为未处理组的11~17倍,并且证实多胺降解途径对GABA的贡献率达到了39%,除此之外,NaCl能够促进发芽大豆GAD和DAO基因组的表达,增加GABA合成底物的量以及合成途径关键酶的活性,从而提高GABA含量[34]。
上述研究主要探讨了谷物在盐胁迫下GABA支路所发挥的作用,但是目前对盐胁迫下谷物多胺降解途径积累GABA的研究较少,且根据对豆类作物的研究,可知豆类与其他类谷物富集GABA的机制并不相同,对此差异进行研究的文章也并不多见,有待进一步探索。
3.2.2 低氧
当谷物处于低浓度氧环境,细胞呼吸被抑制,无氧呼吸逐渐占据主导位置,经糖酵解途径生成的丙酮酸不断增多,进而积累大量乳酸和乙醇,使细胞内pH值下降,激活GAD,最后富集GABA以缓解压力[27,35]。DU等[36]研究指出在缺氧条件下青稞经发芽后,其GABA含量可由40 mg/100 g增加至80.47 mg/100 g,显著高于未发芽青稞,并且其营养成分、理化性质以及蒸煮特性均发生显著变化,为生产高GABA含量萌发青稞提供了参考依据。陈晓嫚[37]通过控制大麦发芽期间的氧浓度,得出了发芽大麦在氧气含量为13%~21%时的变化规律,在氧气含量达到17%时,其GABA含量可达到88.44 mg/100 g,证明低氧条件下大麦可以通过改变GABA浓度来缓解自身应对的环境压力。小麦在常氧条件下发芽后,GABA含量最高可增加50.7%,而在缺氧条件下,发芽小麦GABA含量可提高88.73%,富集作用更加明显[38]。
近年来,对低氧胁迫富集GABA的研究不再囿于茶叶及豆类作物,涉及谷物的缺氧胁迫研究也逐渐增多,且谷物表现出较好的富集效果,表明谷物也可通过低氧处理生产出高GABA营养食品。
3.2.3 低温
当谷物萌芽处于低温环境时,细胞内会形成冰晶,改变细胞结构,损害细胞膜,随后Ca2+以及H+外流,激活细胞中的CaMBD,GAD活性增强,GABA合成速度加快。GABA的增加提高了谷物的耐寒性,保护其免受冷害[39]。青稞籽粒在-20 ℃的低温中发芽不仅可以富集GABA,而且能够抑制生物活性物质β-葡聚糖的降解,是一种很好的保留β-葡聚糖且提高GABA含量的萌发技术[40]。将小米放置于-18 ℃的环境中进行冷刺激8 h,经此处理后的小米样品GABA含量是未处理组的3.08倍,表明冷刺激能对发芽谷物产生显著影响[41]。可见,GABA在谷物冷冻的过程中发生大量积累,同样地,冷冻-解冻处理也对谷物积累GABA具有明显促进作用[42],原因可能是谷物的组织和细胞膜被破坏,GABA合成酶和底物之间充分接触,促使GABA含量提高[43]。此外,当温度降至0 ℃以下时,谷物能够诱导GABA合成基因的表达,导致GABA的积累[44]。不同谷物对低温的耐受性存在差异,在冷冻和非冷冻状态下引起谷物的一系列生理反应可能也不尽相同,与其他胁迫萌芽方式相比,低温胁迫刺激GABA积累的机制可能更加复杂,针对这方面的深层次研究较少。
3.2.4 超声波
超声波是一种频率大于20 kHz的机械波,可对种子及幼芽产生热作用与力作用,引起谷物中生物活性物质的活化,打破谷物休眠状态,促进新陈代谢,从而提高GABA含量。据报道,小麦种子经超声波处理后,其发芽率明显提高,证明超声波处理可以激活谷物的生理生化过程,加快谷物生长速度及物质合成[45]。张祎等[46]以有机糙米为原料,在其发芽时进行超声波处理,发现不同频率超声波对发芽糙米富集GABA均起到积极作用,而低频率超声波处理要优于高频率超声波对GABA的富集,为通过物理法富集糙米GABA提供了新的理论支撑。在25 kHz超声波处理下,发芽红米的GABA含量是对照组的1.46倍[47],而小麦发芽后GABA含量增加30.69%,显著提高了小麦的营养价值[48]。YANG等[49]在大豆浸泡时用40 kHz超声波处理30 min,随后使其发芽,结果显示大豆发芽后GABA含量比原料增多43.4%。这些研究结果表明,超声波正逐步运用于谷物萌芽领域,并且经超声波处理的谷物,其富集GABA的效果显著,说明超声波技术在生产高GABA谷物食品中具有良好的应用前景。
3.2.5 其他非热加工技术
一些传统的食品热加工技术可能会使食品中的营养和生物活性成分减少,而冷常压等离子体、紫外线照射与超高压技术等均属于非热加工技术,是近年来逐步运用于食品领域的新型加工技术,这些加工方式可以改善谷物种子发芽特性,优点是对环境友好、效率高、减少对谷物有效成分的破坏。CHEN等[50]利用不同频率的冷常压等离子体胁迫处理荞麦,得到的发芽荞麦GABA含量是原料的2.64倍。另外,其他加工方式也可提高谷物中的GABA含量,例如改变谷物的发芽条件、酶处理、添加外源物质等方法[51-52]。
综合来看,谷物萌芽富集GABA的处理方式逐渐增多,但是目前对新型加工方式的研究仅限于促使谷物GABA含量提高,关于新型加工技术如何诱导谷物富集GABA则有待深入研究。
4 总结
随着人们健康意识的提高,谷物食品中附加的营养价值和健康性成为食品行业关注的热点,在水稻、小麦、大豆、玉米等谷物经过萌芽处理后,GABA含量均有提高,因此,有针对性的开发富含GABA谷物食品成为一个普遍目标。当前国内外对GABA富集工艺的研究工作逐渐增多,也已有部分对GABA合成酶活性的研究,但是联合现有研究结论,目前关于胁迫萌芽仍存在许多问题亟待探讨:多胺降解途径对谷物富集GABA的贡献率尚不清楚;谷物胁迫萌芽过程中涉及GABA合成代谢内源酶活性的整体变化尚不清晰;多胺降解途径在谷物应对逆境时所发挥的作用及调控机制尚不清楚;需要对GABA合成代谢关键基因等深入挖掘。在解决问题的同时,还应考虑到生产的角度,根据市场及消费者的目标需求,进一步开发高营养、低成本、环保的GABA食品。
[1] 张伊迪. 青稞发芽过程中营养成分含量变化的研究[D].上海:上海交通大学, 2016.ZHANG Y D.Exploration of content change of several nutritional ingredients in germination process of highland barley[D].Shanghai:Shanghai Jiao Tong University, 2016.
[2] BOLNEO E, CHAU P Y S, NOAKES P G, et al.Investigating the role of GABA in neural development and disease using mice lacking GAD67 or VGAT genes[J].International Journal of Molecular Sciences, 2022, 23(14):7965.
[3] GEISLER C E, GHIMIRE S, BRUGGINK S M, et al.A critical role of hepatic GABA in the metabolic dysfunction and hyperphagia of obesity[J].Cell Reports, 2021, 35(13):109301.
[4] ZHAO N, SHU Y, JIAN C X, et al.Lactobacillus ameliorates SD-induced stress responses and gut dysbiosis by increasing the absorption of gut-derived GABA in rhesus monkeys[J].Frontiers in Immunology, 2022, 13:915393.
[5] 何维, 宋贺, 扬子彪, 等.外源γ-氨基丁酸通过调节肠道菌群改善神经系统疾病研究进展[J].食品工业科技, 2023, 44(6):432-440.HE W, SONG H, YANG Z B, et al.Research progress of exogenous γ-aminobutyric acid in improving neurological diseases by regulating intestinal flora[J].Science and Technology of Food Industry, 2023, 44(6):432-440.
[6] 姜秀杰, 许庆鹏, 张爱武, 等.植物代谢法富集粮食中γ-氨基丁酸的研究进展[J].黑龙江八一农垦大学学报, 2021, 33(1):33-39.JIANG X J, XU Q P, ZHANG A W, et al.Research progress on γ-aminobutyric acid accumulation in grain by plant metabolism method[J].Journal of Heilongjiang Bayi Agricultural University, 2021, 33(1):33-39.
[7] ISLAM M Z, AN H G, KANG S J, et al.Physicochemical and bioactive properties of a high β-glucan barley variety ‘Betaone’ affected by germination processing[J].International Journal of Biological Macromolecules, 2021, 177:129-134.
[8] RAMOS-RUIZ R, MARTINEZ F, KNAUF-BEITER G.The effects of GABA in plants[J].Cogent Food &Agriculture, 2019, 5(1):1670553.
[9] SHELP B J, BOZZO G G, TROBACHER C P, et al.Hypothesis/review:Contribution of putrescine to γ-aminobutyrate (GABA) production in response to abiotic stress[J].Plant Science:an International Journal of Experimental Plant Biology, 2012, 193-194:130-135.
[10] BAGNI N, TASSONI A.Biosynthesis, oxidation and conjugation of aliphatic polyamines in higher plants[J].Amino Acids, 2001, 20(3):301-317.
[11] P L M, SZALAI G, JANDA T.Speculation:Polyamines are important in abiotic stress signaling[J].Plant Science:an International Journal of Experimental Plant Biology, 2015, 237:16-23.
L M, SZALAI G, JANDA T.Speculation:Polyamines are important in abiotic stress signaling[J].Plant Science:an International Journal of Experimental Plant Biology, 2015, 237:16-23.
[12] 孙磊, 王苑, 柏映国, 等.谷氨酸脱羧酶结构及催化机制的研究概述[J].微生物学通报, 2020, 47(7):2236-2244.SUN L, WANG Y, BAI Y G, et al.Structure and catalytic mechanism of glutamate decarboxylase:A review[J].Microbiology China, 2020, 47(7):2236-2244.
[13] KHWANCHAI P, CHINPRAHAST N, PICHYANGKURA R, et al.Gamma-aminobutyric acid and glutamic acid contents, and the GAD activity in germinated brown rice (Oryza sativa L.):Effect of rice cultivars[J].Food Science and Biotechnology, 2014, 23(2):373-379.
[14] ELBALOULA M F, HASSAN A B.Effect of different salt concentrations on the gamma-aminobutyric-acid content and glutamate decarboxylase activity in germinated sorghum (Sorghum bicolor L.Moench) grain[J].Food Science &Nutrition, 2022, 10(6):2050-2056.
[15] 周露. 富含γ-氨基丁酸(GABA)转基因水稻的研究[D].南京:南京农业大学, 2015.ZHOU L.Study on transgenic rice rich in γ-aminobutyric acid (GABA)[D].Nanjing:Nanjing Agricultural University, 2015.
[16] 刘玲珑. 稻米浸水后γ-氨基丁酸(GABA)的积累及其分子机制研究[D].南京:南京农业大学, 2005.LIU L L.Accumulation of γ-aminobutyric acid (GABA) in rice after soaking and its molecular mechanism[D].Nanjing:Nanjing Agricultural University, 2005.
[17] 刘丽妹. 发芽糙米γ-氨基丁酸富集及关键酶基因的表达分析[D].厦门:集美大学, 2015.LIU L M.Accumulation of γ-aminobutyric acid in germinated brown rice and key enzyme gene expression analysis[D].Xiamen:Jimei University, 2015.
[18] ZHAO G C, XIE M X, WANG Y C, et al.Molecular mechanisms underlying γ-aminobutyric acid (GABA) accumulation in giant embryo rice seeds[J].Journal of Agricultural and Food Chemistry, 2017, 65(24):4883-4889.
[19] WATTERSON D M, IVERSON D B, VAN ELDIK L J.Spinach calmodulin:Isolation, characterization, and comparison with vertebrate calmodulins[J].Biochemistry, 1980, 19(25):5762-5768.
[20] LING V, SNEDDEN W A, SHELP B J, et al.Analysis of a soluble calmodulin binding protein from fava bean roots:Identification of glutamate decarboxylase as a calmodulin-activated enzyme[J].The Plant Cell, 1994, 6(8):1135-1143.
[21] 尹永祺. NaCl及其联合Ca~(2+)处理下发芽大豆生理变化与GABA富集调控机理[D].南京:南京农业大学, 2014.YIN Y Q.Study on the physiological change and the regulation mechanism of GABA accumulation in germinating soybean under NaCl and NaCl-Ca2+ treatment[D].Nanjing:Nanjing Agricultural University, 2014.
[22] 王宪青, 魏彤, 石彦国.绿豆钙调素的分离纯化及其对谷氨酸脱羧酶的调节作用[J].粮食与油脂, 2020, 33(9):39-43.WANG X Q, WEI T, SHI Y G.Extraction and purification of mung bean calmodulin and its regulation on glutamate decarboxylase[J].Cereals &Oils, 2020, 33(9):39-43.
[23] ARAZI T, BAUM G, SNEDDEN W A, et al.Molecular and biochemical analysis of calmodulin interactions with the calmodulin-binding domain of plant glutamate decarboxylase[J].Plant Physiology, 1995, 108(2):551-561.
[24] 鲍佐宝. 发芽苦荞GABA-T的酶学特性、基因克隆及序列分析[D].滁州:安徽科技学院, 2019.BAO Z B.Study on enzymatic characteristics, gene cloning and sequence analysis of GABA-T from germinated tartary buckwheat[D].Chuzhou:Anhui Science and Technology University, 2019.
[25] 孙莹. 藜麦再生体系的构建与γ-氨基丁酸转氨酶(GABA-T)多态性分析及含量测定[D].济南:山东师范大学, 2019.SUN Y.Construction of quinoa regeneration system with γ-aminobutyric acid transaminase (GABA-T) polymorphism analysis and determination of its content[D].Jinan:Shandong Normal University, 2019.
[26] 周露, 沈贝贝, 白苏阳, 等.以RNA干扰γ-氨基丁酸转氨酶1基因(OsGABA-T1)表达提高稻米γ-氨基丁酸(GABA)含量[J].作物学报, 2015, 41(9):1305-1312.ZHOU L, SHEN B B, BAI S Y, et al.RNA interference of OsGABA-T1Gene expression induced GABA accumula-tion in rice grain[J].Acta Agronomica Sinica, 2015, 41(9):1305-1312.
[27] 苏国兴. 多胺分解代谢在大豆生长发育和耐盐生理中的作用[D].南京:南京农业大学, 2006.SU G X.The roles of polyamine catabolism in development and salt tolerance of soybean seedlings[D].Nanjing:Nanjing Agricultural University, 2006.
[28] 张瀚竹. 大豆多胺氧化酶基因GmPAO1的克隆及耐盐功能分析[D].长春:吉林农业大学, 2022.ZHANG H Z.Cloning and salt tolerance analysis of soybean polyamine oxidase gene GmPAO1[D].Changchun:Jilin Agricultural University, 2022.
[29] LI L, DOU N, ZHANG H, et al.The versatile GABA in plants[J].Plant Signaling &Behavior, 2021, 16(3):1862565.
[30] 李婷玉, 杜艳, 陈正行, 等.胁迫萌发对青稞籽粒中β-葡聚糖和γ-氨基丁酸含量的影响[J].中国粮油学报, 2021, 36(6):30-35.LI T Y, DU Y, CHEN Z X, et al.Effects of highland barley seed germination under stress on contents of β-glucan and γ-aminobutyric acid[J].Journal of the Chinese Cereals and Oils Association, 2021, 36(6):30-35.
[31] WANG M, ZHU Y H, WANG P, et al.Effect of γ-aminobutyric acid on phenolics metabolism in barley seedlings under low NaCl treatment[J].Antioxidants, 2021, 10(9):1421.
[32] 陈春旭, 王利勤, 郭元新, 等.盐胁迫对发芽糙米富集γ-氨基丁酸及蛋白组分变化的影响[J].食品科学, 2018, 39(5):87-92.CHEN C X, WANG L Q, GUO Y X, et al.Effect of salt stress on γ-aminobutyric acid accumulation and protein composition in germinated brown rice[J].Food Science, 2018, 39(5):87-92.
[33] XING S G, JUN Y B, HAU Z W, et al.Higher accumulation of gamma-aminobutyric acid induced by salt stress through stimulating the activity of diamine oxidases in Glycine max (L.) Merr.roots[J].Plant Physiology and Biochemistry:PPB, 2007, 45(8):560-566.
[34] 齐菲. 外源Spd调控NaCl胁迫下发芽大豆生理代谢及GABA富集研究[D].扬州:扬州大学, 2019.QI F.Exogenous Spd regulates physiological metabolism and GABA accumulation research of germinated soybean under NaCl stress[D].Yangzhou:Yangzhou University, 2019.
[35] G MEZ-
MEZ- LVAREZ E M, PUCCIARIELLO C.Cereal germination under low oxygen:Molecular processes[J].Plants, 2022, 11(3):460.
LVAREZ E M, PUCCIARIELLO C.Cereal germination under low oxygen:Molecular processes[J].Plants, 2022, 11(3):460.
[36] DU Y, CHEN Z X, LIANG F, et al.Effects of hypoxia stress germination on nutrients, physicochemical properties and cooking characteristics of highland barley[J].Journal of Cereal Science, 2022, 103:103411.
[37] 陈晓嫚. 低温联合低氧胁迫下发芽大麦γ-氨基丁酸富集技术及产品开发研究[D].滁州:安徽科技学院, 2017.CHEN X M.Accumulation mechanism of γ-aminobutyric acid under the condition of low temperature joint and hypoxia stress in germination barley and product development[D].Chuzhou:Anhui Science and Technology University, 2017.
[38] WANG P, LIU K X, GU Z X, et al.Enhanced γ-aminobutyric acid accumulation, alleviated componential deterioration and technofunctionality loss of germinated wheat by hypoxia stress[J].Food Chemistry, 2018, 269:473-479.
[39] 王凯凯, 孙朦, 宋佳敏, 等.γ-氨基丁酸(GABA)形成机理及富集方法的研究进展[J].食品工业科技, 2018, 39(14):323-329.WANG K K, SUN M, SONG J M, et al.Research progress in the formation mechanism and accumulation methods of γ-aminobutyric acid(GABA)[J].Science and Technology of Food Industry, 2018, 39(14):323-329.
[40] 李婷玉. 萌发青稞降糖、降脂、降压活性研究及其理化性质研究[D].无锡:江南大学, 2021.LI T Y.Study on hypoglycemic, hypolipidemic, hypotensive Activities and physicochemical property of germinated highland barley[D].Wuxi:Jiangnan University, 2021.
[41] 彭红满. 胁迫法富集小米糙米中γ-氨基丁酸的研究[D].石家庄:河北科技大学, 2016.PENG H M.Accumulation of γ-aminobutyric acid in millet brown rice in response to soak stress and cold shock stress[D].Shijiazhuang:Hebei University of Science &Technology, 2016.
[42] YANG R Q, FENG L, WANG S F, et al.Accumulation of γ-aminobutyric acid in soybean by hypoxia germination and freeze-thawing incubation[J].Journal of the Science of Food and Agriculture, 2016, 96(6):2090-2096.
[43] YANG R Q, HUI Q R, FENG X Y, et al.The mechanism of freeze-thawing induced accumulation of γ-aminobutyric acid in germinated soybean[J].Journal of the Science of Food and Agriculture, 2020, 100(3):1099-1105.
[44] MAZZUCOTELLI E, TARTARI A, CATTIVELLI L, et al.Metabolism of gamma-aminobutyric acid during cold acclimation and freezing and its relationship to frost tolerance in barley and wheat[J].Journal of Experimental Botany, 2006, 57(14):3755-3766.
[45] DING J Z, HOU G G, DONG M Y, et al.Physicochemical properties of germinated dehulled rice flour and energy requirement in germination as affected by ultrasound treatment[J].Ultrasonics Sonochemistry, 2018, 41:484-491.
[46] 张祎, 赵婷婷, 申娟利, 等.超声波处理对发芽糙米GABA积累及抗氧化能力影响的研究[J].食品工业科技, 2016, 37(2):130-133;137.ZHANG Y, ZHAO T T, SHEN J L, et al.Study on effect of ultrasonic treatment on GABA accumulation and antioxidant capacity in germinated brown rice[J].Science and Technology of Food Industry, 2016, 37(2):130-133;137.
[47] DING J Z, ULANOV A V, DONG M Y, et al.Enhancement of gama-aminobutyric acid (GABA) and other health-related metabolites in germinated red rice (Oryza sativa L.) by ultrasonication[J].Ultrasonics Sonochemistry, 2018, 40(Pt A):791-797.
[48] DING J Z, HOU G G, NEMZER B V, et al.Effects of controlled germination on selected physicochemical and functional properties of whole-wheat flour and enhanced γ-aminobutyric acid accumulation by ultrasonication[J].Food Chemistry, 2018, 243:214-221.
[49] YANG H, GAO J Y, YANG A S, et al.The ultrasound-treated soybean seeds improve edibility and nutritional quality of soybean sprouts[J].Food Research International, 2015, 77:704-710.
[50] CHEN G Y, WANG Y S, ZHANG M Y, et al.Cold atmospheric plasma treatment improves the γ-aminobutyric acid content of buckwheat seeds providing a new anti-hypertensive functional ingredient[J].Food Chemistry, 2022, 388:133064.
[51] HIJAZ F, KILLINY N.Exogenous GABA is quickly metabolized to succinic acid and fed into the plant TCA cycle[J].Plant Signaling &Behavior, 2019, 14(3):e1573096.
[52] MA Y, WANG P, GU Z X, et al.Ca2+ involved in GABA signal transduction for phenolics accumulation in germinated hulless barley under NaCl stress[J].Food Chemistry:X, 2019, 2:100023.