随着人们对食品安全问题的日益重视,天然生物防腐剂替代化学合成防腐剂已成为食品工业发展的一个必然趋势。乳链菌肽(Nisin,C143H230N42O37S7)是由乳酸乳球菌亚种(Lactococcus lactis subsp.lactis)某些菌株分泌的一类环肽型细菌素,具有抗菌谱广、免疫原性低、耐热性好、可完全消化吸收等优点。Nisin是目前联合国粮食及农业组织/世界卫生组织唯一批准用于食品保鲜的细菌素。由于L.lactis细胞代谢的三羧酸循环途径并不完整,同型乳酸发酵过程中Nisin合成的阈值浓度很低[1]。Nisin是L.lactis细胞间自发诱导的激活信号分子,但其大量分泌会对菌体细胞的生长产生抑制作用[2]。合成效率低和发酵过程菌体活力下降快是限制Nisin工业生产的主要问题。
为了解决Nisin合成效率低的问题,目前较为常用的方法是基因修饰和培养条件优化。NI等[3]研究表明,增加直接参与Nisin生物合成基因(nisA、nisRK和nisFEG)的拷贝数,能够促进前体肽的产生和转录调节,Nisin效价为4 857.0 IU/mL,较对照组提高52.6%。然而,这些基因的过多复制和表达会增加工程菌的代谢负担,能量供应不足会导致菌体细胞过早进入稳定期。在实际生产过程中,L.lactis的生长代谢容易受到盐、酸、O2等多种环境胁迫因子的影响。利用微生物代谢工程优化培养条件,能够增强菌体细胞对胁迫因子的抵抗能力。研究表明添加谷胱甘肽能够缓解L.lactis细胞因缺乏过氧化氢酶而引起的氧化应激损伤,缩短发酵适应期,促进Nisin的生物合成[4]。由于基因工程菌应用于食品原料生产存在一定的安全风险,运用发酵工程策略提高Nisin合成效率更具积极意义。
稀土元素是一组特殊的金属元素(原子序数21、39和57~71),具有良好的磁性、超导性及催化活性,被誉为“工业维生素”。近年来,稀土元素的生物效应越来越受到人们的关注。研究发现,镧元素可以替代Ca2+促进扭脱甲基杆菌突变株的生长,并且镧元素增强了Ca2+依赖型甲醇脱氢酶的活性,提出稀土元素可以作为改善微生物代谢的辅因子[5]。稀土元素对L-酪氨酸发酵具有显著影响,添加80 mg/L镧元素、2 mg/L铈元素和0.3 mg/L钕元素能够缩短菌体生长的延滞期,最大生物量和L-酪氨酸产量较对照组分别提高了10.8%和9.7%[6]。因此,适量添加稀土元素有助于维持较高的菌体生长速率和代谢活力,从而提高产物合成效率。
为了解决发酵过程菌体活力下降问题,最常用的方法为补加新鲜料液和分离代谢产物[7-8]。然而,补料操作受到罐体容积限制,只能在较短的发酵周期内改善菌体代谢。目前,从发酵液中分离Nisin的方法主要包括盐析法、溶剂萃取法、超滤法、离子交换色谱法和泡沫分离法[9-10]。以上分离方法的优缺点如表1所示。泡沫分离法因具有设备简单、操作条件温和(例如:室温、常压和惰性气体)、吸附介质无需再生等优点,在生物分离领域具有良好的应用前景。该技术依据表面吸附原理,以气泡作为吸附介质,能够高效富集溶液中微量的溶质。进行泡沫分离操作需要同时具备2个必要条件:第一是目标溶质应能够直接或是借助与表面活性剂的相互作用间接地吸附在气-液界面上;第二是生成的泡沫层能够在分离塔内连续向上运动,并通过重力作用排出内部夹带的液体。此外,通过鼓入无菌空气,将泡沫分离与发酵耦合操作,不仅有助于提高发酵液溶氧量,而且能够原位回收代谢产物[11]。Nisin是一种短肽,其C-末端含有2个β-甲基羊毛硫氨酸和带电荷的极性氨基酸(赖氨酸和组氨酸)残基能够表现出较强的亲水性,而N-末端存在大量含疏水侧链的非极性氨基酸残基。因此,Nisin具有一定的表面活性,能够利用泡沫分离实现浓缩分离。
表1 从发酵液中分离Nisin的方法对比
Table 1 Comparison of the methods for separating Nisin from fermentation broth

分离方法优点缺点盐析法工艺简单,不会引起蛋白质变性1.需将溶液pH调至蛋白质等电点附近;2.需过量加入中性盐;3.蛋白质灰分含量高溶剂萃取法分离速度快,可连续化操作1.有机溶剂用量大;2.蛋白质易发生变性超滤法操作条件温和,无需加入化学药剂1.分离过程超滤膜易受到污染;2.膜组件需要定期清洗和更换,维护成本高离子交换色谱法设备简单,蛋白质吸附量大,选择性好,分离效率高1.吸附剂前处理复杂,且需要定期活化和再生;2.耗盐量大,排出大量含盐废水易引起管道腐蚀泡沫分离法设备简单,操作条件温和,浓缩效率高,吸附介质无需再生,易工程放大1.影响因素较多;2.对高浓度料液的处理效率较低
本文拟利用稀土盐和泡沫分离强化L.lactis发酵生产Nisin。首先,以生物量和发酵液的Nisin效价为指标,确定刺激效果最强的稀土元素,并获得其最适浓度和添加时间。随后,研究发酵-泡沫分离初始耦合时间、气体分布器孔径和气体体积流率对L.lactis发酵生产Nisin的影响。最后,采用响应面优化试验优化发酵-泡沫分离耦合强化Nisin生产的工艺条件。本文围绕限制L.lactis发酵生产Nisin的主要问题展开研究,开发了一种集成强化工艺技术,以期为Nisin的工业生产提供理论指导。
1 材料与方法
1.1 菌株
Nisin的生产菌株为L.lactis ATCC 11454。效价检测的指示菌为藤黄八叠球菌(Micrococcus luteus) NCIB 8166。
1.2 材料与试剂
Nisin标准品(Z型,效价值1 000 IU/mg),上海麦克林生物化学有限公司;蛋白胨、胰蛋白胨、酵母浸粉、葡萄糖、蔗糖和琼脂,北京奥博星生物技术有限公司;NaH2PO4、Na2HPO4、KH2PO4、NaCl、MgSO4·7H2O、NaOH、CaCl2、HCl和吐温-20,分析纯,中国天津德运化学试剂有限公司;乙腈(色谱纯),德国Merck试剂公司;TmCl3、NdCl3、LaCl3、CeCl3、PrCl3、ErCl3、HoCl3和EuCl3,美国Sigma-Aldrich试剂公司。
1.3 实验方法
1.3.1 培养基的制备及菌种培养
菌种活化培养基(g/L):蔗糖15,蛋白胨15,酵母浸粉15,NaH2PO4 20,NaCl 2,MgSO4·7H2O 2,琼脂18,pH值为6.9。种子培养基为不含琼脂的菌种活化培养基。发酵培养基(g/L):蛋白胨15,酵母浸粉15,KH2PO4 15,NaCl 2,蔗糖42,MgSO4·7H2O 2,pH值为7.6。效价检测培养基(g/L):葡萄糖5,胰蛋白胨8,NaCl 5,酵母浸粉3,Na2HPO4 2,吐温-20 5 mL/L,琼脂10,pH值为7.2。以上培养基在使用前均需要在121 ℃高压蒸汽灭菌20 min。
菌种解冻后接种至活化培养基,于30 ℃培养18 h。挑取菌落接种至种子培养基,于30 ℃和150 r/min条件下培养18 h。种子液中菌体细胞密度约为108 CFU/mL。种子液以3%的接种量转接至含1.0 L发酵培养基的发酵罐,并于30 ℃和150 r/min条件下培养36 h。所有试验均需重复3次。
1.3.2 生物量测定
在固定采样时间点,准确吸取30 mL发酵液于预先称量的50 mL去盖离心管(m1)中,在4 000 r/min离心20 min,弃去上清液。加入20 mL超纯水重悬洗涤一次后离心弃去上清液保留菌泥。将离心管在80 ℃烘干至恒重(m2)。细胞干重M可根据公式(1)进行计算。
(1)
1.3.3 Nisin效价测定
样品溶液的Nisin效价可采用改良的双剂量琼脂扩散法进行测定[12]。将27 mL含有M.luteus NCIB 8166的效价检测培养基SI倒入无菌培养皿,于4 ℃静置30 min。随后利用无菌中空打孔器在凝固的培养基上钻出一定数量直径为7 mm的小孔。将135 μL的Nisin标准品溶液和样品溶液加入到小孔内。发酵液利用0.02 mol/L HCl溶液稀释300和600倍后获得样品溶液。将培养皿于35 ℃培养24 h,随后利用图像处理软件Image-Processing Software Option V2.5准确测量抑菌圈直径(X,mm)。样品溶液的效价(Is,IU/mL)根据公式(2)计算。
(2)
式中:Ib,Nisin标准品溶液的Nisin效价,IU/mL;Xbh、Xbl,Nisin标准品溶液稀释300倍和600倍的抑菌圈直径,mm;Xsh、Xsl,样品溶液稀释300倍和600倍的抑菌圈直径,mm;K,高剂量倍数与低剂量倍数的比值。
单位菌生产Nisin的效价(Ia)根据公式(3)计算。
(3)
式中:c′,样品溶液的活菌数,CFU/mL。
1.3.4 稀土盐的筛选
利用摇瓶发酵试验研究稀土盐对L.lactis ATCC 11454生长的影响,稀土盐的浓度范围为1×10-6~1×10-3 mol/L,添加量为1%(体积分数),稀土盐在配置培养基时加入,发酵过程中每3 h取样并测定吸光值。研究稀土盐对L.lactis ATCC 11454发酵生产Nisin的影响,稀土盐的浓度范围、添加量和添加时间同上,发酵时间为24 h。对照组培养基不添加稀土盐。
1.3.5 发酵-泡沫分离耦合操作
发酵-泡沫分馏耦合操作的实验装置如图1所示。本试验采用自主设计的1.8 L玻璃发酵罐生产Nisin,主体轮廓为圆柱形(0.10×0.18 m),上端开口。上封头高度0.05 m。两部分使用玻纤增强聚丙烯塑料法兰连接在一起。在玻璃发酵罐上封头的顶部,利用空心橡胶塞安装倒“L”形玻璃管(0.03×0.10 m),用作泡沫分离塔。发酵罐底部装有烧结玻璃制成的气体分布器,其上表面为砂芯多孔玻璃板。
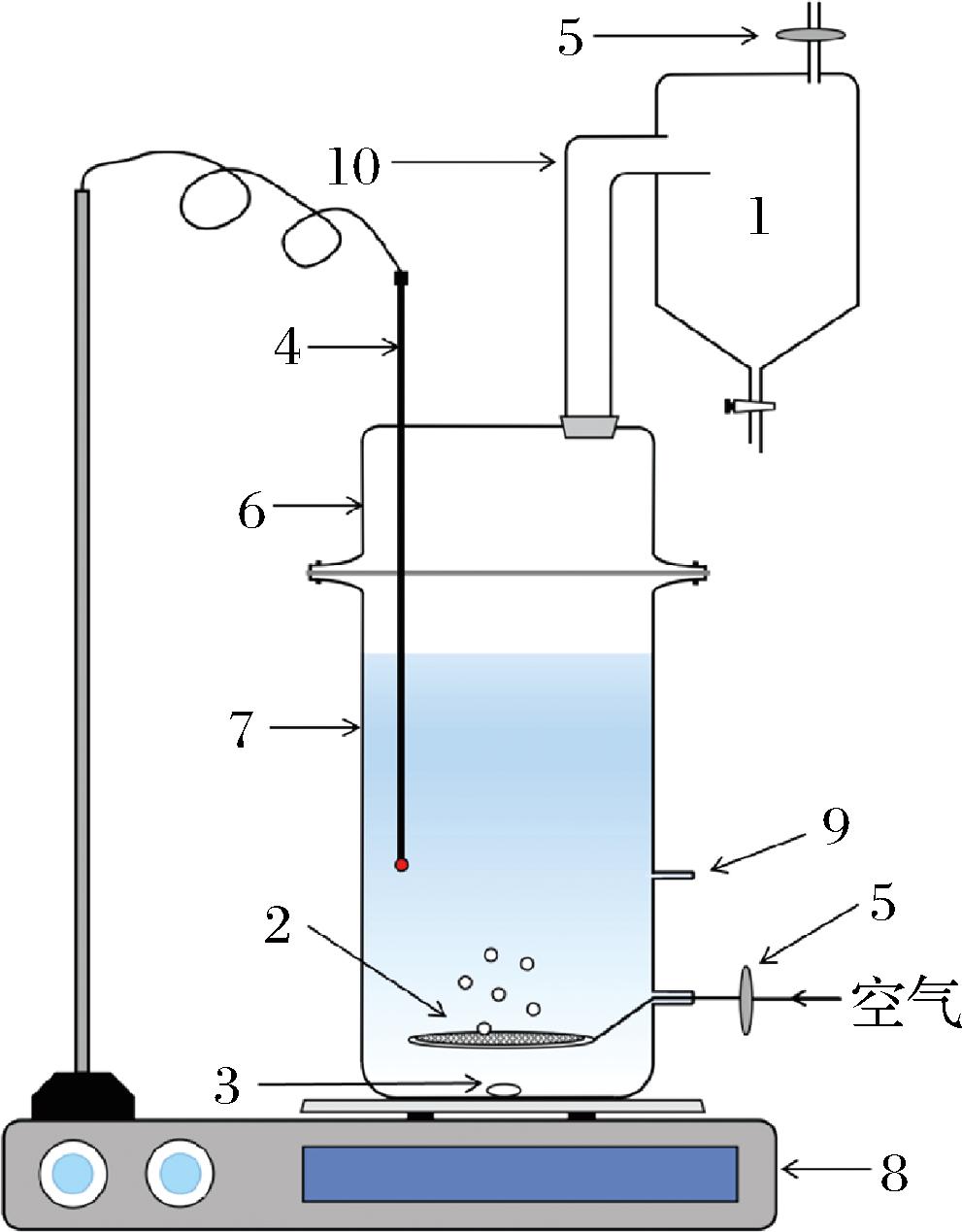
1-漏斗形泡沫收集器;2-气体分布器;3-磁子;4-温度传感器;5-0.45 μm滤膜;6-发酵罐上封头(0.10 m×0.05 m);7-发酵罐主体(0.10 m×0.18 m);8-恒温磁力搅拌器;9-取样口;10-泡沫分离塔
图1 试验装置示意图
Fig.1 Schematic diagram of experimental apparatus
首先,向发酵罐中加入1.0 L新鲜发酵培养基。随后,将种子液以3%接种量转接至发酵培养基。培养温度和搅拌速率分别为30 ℃和150 r/min。通过向发酵罐鼓入无菌空气进行泡沫分离操作。泡沫由分离塔顶部流入漏斗形泡沫收集器,破碎后获得消泡液。当泡沫不能连续流入收集器时,停止鼓入无菌空气。Nisin的回收率(R,%)和发酵液的总Nisin效价(It)按公式(4)和公式(5)计算。
(4)
(5)
式中:Cf、Ce,消泡液和罐内剩余发酵液中Nisin的质量浓度,g/L;Vf、Ve,消泡液和罐内剩余发酵液的体积,mL;If、Ie,消泡液和罐内剩余发酵液的Nisin效价,IU/mL。
1.3.6 L.lactis生产Nisin条件优化
首先,通过单因素试验研究了发酵与泡沫分离初始耦合时间、气体分布器孔径和气体体积流率对Nisin的回收率和发酵液的总Nisin效价的影响。研究发酵与泡沫分离初始耦合时间,实验条件为气体分布器孔径300 μm和气体体积流率120 mL/min。研究气体分布器孔径,实验条件为发酵与泡沫分离初始耦合时间18 h和气体体积流率120 mL/min。研究气体体积流率,实验条件为发酵与泡沫分离初始耦合时间18 h和气体分布器孔径300 μm。
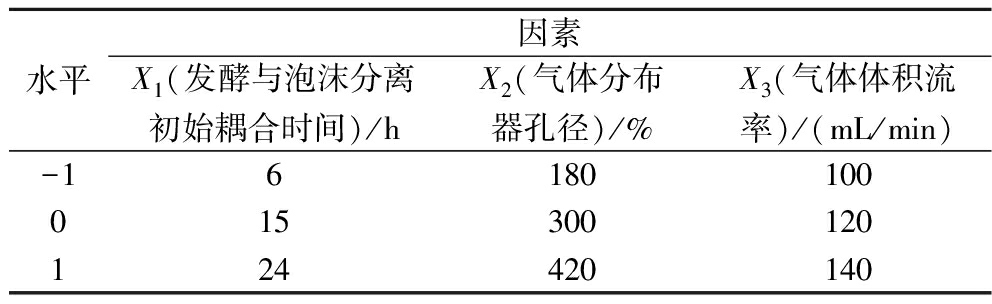
以发酵与泡沫分离初始耦合时间(X1)、气体分布器孔径(X2)和气体体积流率(X3)为自变量,Nisin的回收率(Y1)和发酵液的总Nisin效价(Y2)为响应值,采用Design-Expert V8.0.6 Trial软件,设计三因素三水平的Box-Behnken中心组合试验。因素水平设计见表2。
表2 Box-Behnken试验设计的因素和水平
Table 2 Factors and levels of Box-Behnken Design
水平因素X1(发酵与泡沫分离初始耦合时间)/hX2(气体分布器孔径)/%X3(气体体积流率)/(mL/min)-16180100015300120124420140
1.4 数据处理
每组试验重复3次,结果以平均值±标准差表示。采用SPSS 25.0进行显著性检测及方差分析,差异显著水平为P<0.05。利用Origin 2019软件进行图形绘制。
2 结果与分析
2.1 L.lactis ATCC 11454发酵生产Nisin
如图2所示,L.lactis ATCC 11454培养6 h后开始进入生长的对数期,生物量于18 h达到最大值(2.33±0.12) g/L,继续培养至30 h生物量逐渐降低,菌体生长进入衰亡期。随着培养时间的延长,发酵液效价快速增加,并于21 h达到最大值(4 020.07±100.51) IU/mL。Nisin是L.lactis ATCC 11454分泌的次级代谢产物,但其生物合成具有初级动力学特征,与菌体生长具有相关性[13]。菌体生长进入衰亡期后发酵液效价也随之降低,这是由于衰亡期菌体会分泌的一些蛋白酶会引起Nisin降解。此外,研究表明衰亡期菌体细胞对Nisin的耐受性降低,Nisin在细胞表面的吸附作用会造成发酵液效价降低[14]。由此可知,可以通过刺激L.lactis ATCC 11454生长来提高Nisin产量。
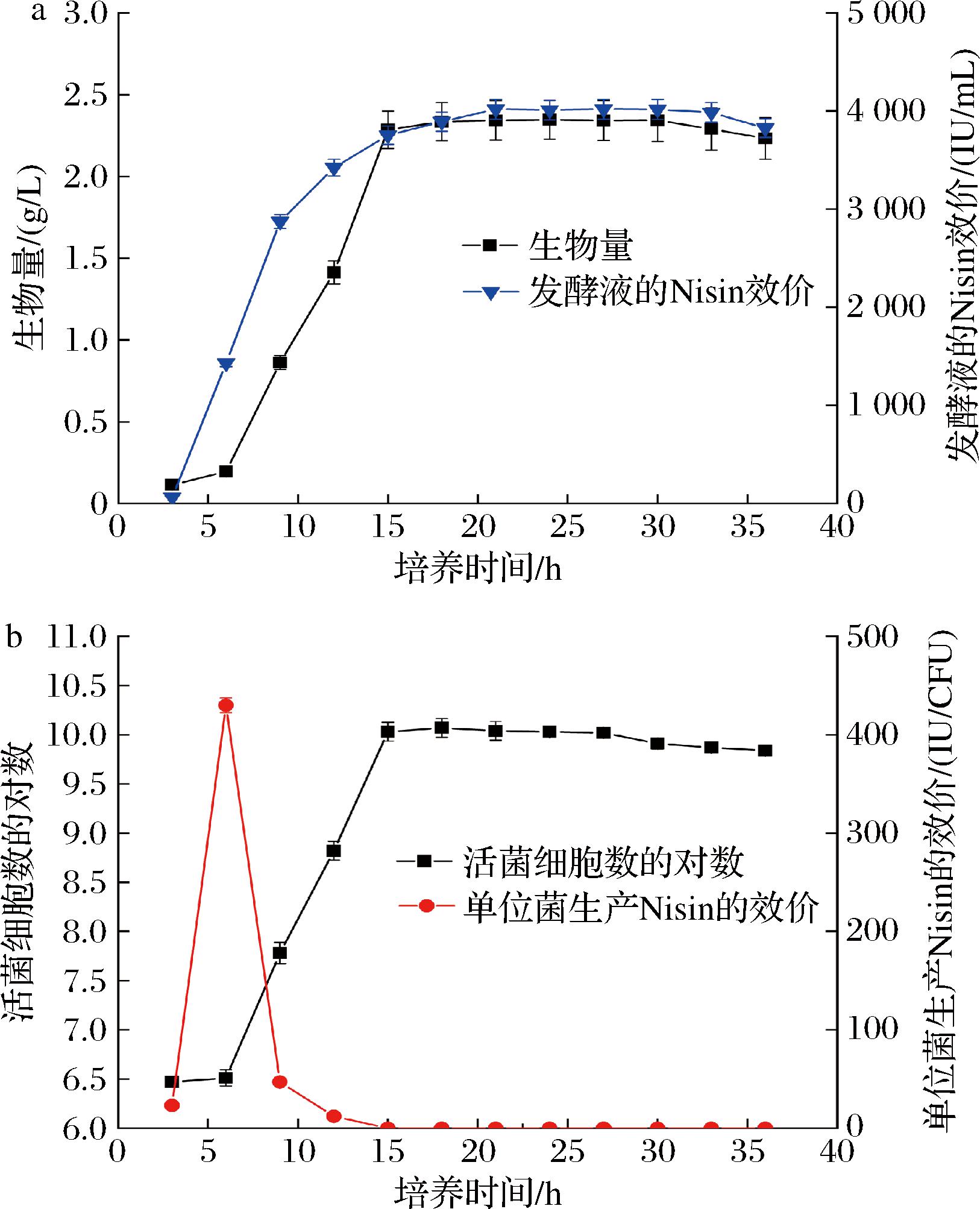
a-生物量和发酵液的Nisin的效价随时间的变化;b-活菌细胞数的对数和单位菌生产Nisin的效价随时间的变化
图2 L.lactis ATCC 11454发酵生产Nisin Fig.2 Nisin production by the fermentation ofL.lactis ATCC 11454
2.2 稀土盐对L. lactis ATCC 11454生长的影响
由表3可知,在1×10-6~1×10-3 mol/L浓度范围内,所有稀土盐对L.lactis ATCC 11454生长均表现为低浓度促进而高浓度抑制的赫米西斯(Hormesis)效应。其中,添加1×10-4 mol/L的TmCl3能够明显促进菌体细胞生长,最大生物量为(3.13±0.16) g/L。一些稀土元素能够与细菌细胞壁中肽聚糖的羧基、氨基和羟基发生缔合反应,使其交联网状结构变得松散[15]。CaCl2对L.lactis ATCC 11454生长的影响如表4所示。稀土元素的离子半径与Ca2+相近,但其与氧、氮和硫的配位能力强于Ca2+。因此,在低浓度条件下,稀土元素能够部分取代Ca2+与细胞膜上的钙调蛋白和磷酸根结合,改善细胞膜通透性和磷代谢,进而促进菌体细胞对营养物质的吸收。在细胞内部,少量钇元素能够发挥与超氧化物歧化酶相似的超氧阴离子自由基(·O2-)清除作用,减小细胞膜、蛋白质和核酸的氧化损伤[16]。研究发现镧元素可作为辅因子,与多种细胞代谢的关键酶(如过氧化氢酶、脱氢酶和氨解酶)结合,改变其构象,增强酶与底物的结合能力,从而提高营养物质的转化效率[17]。然而,研究发现稀土元素在细胞壁中大量积累会引起肽聚糖分子之间的肽键和氢键断裂,交联网状结构遭到破坏,菌体细胞会因内部高渗透压而发生变形或胀裂[18]。此外,高浓度的稀土元素可使DNA双螺旋结构变得紧密,碱基对自由移动困难,阻断DNA的复制与转录,从而抑制菌体细胞的生长和增殖。基于实验结果,可向发酵液中添加1×10-4 mol/L的TmCl3提高菌体生物量。
表3 不同稀土盐添加条件下的L.lactis ATCC 11454生物量 单位:g/L
Table 3 Biomass of L.lactis ATCC 11454 obtained at different adding conditions of rare earth salts

稀土盐浓度/(mol/L)不同取样时间/h369121518212427303336ErCl31×10-60.11±0.01a0.21±0.01a0.91±0.05a1.45±0.07a2.25±0.11a2.35±0.12a2.34±0.12a2.34±0.12a2.34±0.12a2.37±0.12a2.34±0.12b2.36±0.12a1×10-50.11±0.01a0.20±0.01a0.89±0.04a1.43±0.07a2.33±0.12a2.34±0.12a2.35±0.12a2.34±0.12a2.34±0.12a2.38±0.12a2.34±0.12b2.37±0.12a1×10-40.11±0.01a0.19±0.01a0.84±0.04a1.41±0.07a2.30±0.12a2.34±0.11a2.35±0.12a2.34±0.12a2.34±0.12a2.38±0.12a2.34±0.12b2.35±0.12a1×10-30.11±0.01a0.20±0.01a0.87±0.04a1.44±0.07a2.31±0.12a2.49±0.12a2.42±0.12a2.43±0.12a2.45±0.12a2.54±0.13a2.58±0.13a2.54±0.13aNdCl31×10-60.11±0.01a0.21±0.01a0.91±0.05a1.45±0.07a2.40±0.12a2.48±0.12a2.48±0.12a2.48±0.12a2.48±0.12a2.48±0.12a2.42±0.12a2.43±0.12a1×10-50.11±0.01a0.20±0.01a0.89±0.04a1.43±0.07a2.40±0.12a2.48±0.12a2.48±0.12a2.48±0.12a2.48±0.12a2.48±0.12a2.43±0.12a2.46±0.12a1×10-40.11±0.01a0.19±0.01a0.84±0.04a1.41±0.07a2.42±0.12a2.48±0.12a2.48±0.12a2.48±0.12a2.48±0.12a2.48±0.12a2.44±0.12a2.44±0.12a1×10-30.11±0.01a0.20±0.01a0.87±0.04a1.44±0.07a2.38±0.12a2.48±0.12a2.48±0.12a2.48±0.12a2.48±0.12a2.48±0.12a2.52±0.13a2.55±0.13aTmCl31×10-60.11±0.01a0.20±0.01a0.81±0.04a1.21±0.06b2.11±0.11b2.31±0.12bc2.36±0.12bc2.37±0.12b2.43±0.12b2.62±0.13b2.65±0.13b2.66±0.13b1×10-50.11±0.01a0.20±0.01a0.79±0.04a1.22±0.06b2.24±0.11b2.48±0.12b2.62±0.13b2.64±0.13b2.65±0.13b2.66±0.13b2.66±0.13b2.66±0.13b1×10-40.11±0.01a0.20±0.01a0.85±0.04a1.41±0.07a2.71±0.14a2.99±0.15a3.07±0.15a3.09±0.15a3.10±0.16a3.12±0.16a3.13±0.16a3.13±0.16a1×10-30.11±0.01a0.20±0.01a0.78±0.04a1.23±0.06b2.09±0.10b2.12±0.11c2.22±0.11c2.35±0.12b2.44±0.12b2.62±0.13b2.65±0.13b2.63±0.13bHoCl31×10-60.13±0.01a0.23±0.01b0.96±0.05a1.47±0.07a2.29±0.11a2.33±0.12a2.39±0.12a2.41±0.12a2.41±0.12a2.42±0.12a2.43±0.12a2.41±0.12a1×10-50.13±0.01a0.26±0.01a0.96±0.05a1.47±0.07a2.28±0.11a2.33±0.12a2.40±0.12a2.43±0.12a2.42±0.12a2.42±0.12a2.42±0.12a2.38±0.12a1×10-40.13±0.01a0.25±0.01ab0.96±0.05a1.49±0.07a2.28±0.11a2.33±0.12a2.36±0.12a2.37±0.12a2.35±0.12a2.36±0.12a2.32±0.12a2.30±0.11a1×10-30.10±0.01b0.16±0.01c0.81±0.04b1.25±0.06b2.25±0.11a2.30±0.12a2.31±0.12a2.30±0.12a2.28±0.11a2.28±0.11a2.26±0.11a2.23±0.11aEuCl31×10-60.11±0.01a0.20±0.01a0.42±0.02b1.02±0.05b1.99±0.10b2.18±0.11b2.25±0.11a2.34±0.12a2.42±0.12a2.61±0.13a2.63±0.13a2.50±0.12a1×10-50.11±0.01a0.20±0.01a0.50±0.02ab0.99±0.05b2.02±0.10b2.19±0.11b2.30±0.11a2.36±0.12a2.39±0.12a2.63±0.13a2.65±0.13a2.53±0.13a1×10-40.11±0.01a0.20±0.01a0.42±0.02b1.01±0.05b2.04±0.10b2.12±0.11b2.24±0.11a2.32±0.12a2.41±0.12a2.57±0.13a2.62±0.12a2.48±0.12a1×10-30.11±0.01b0.20±0.01a0.84±0.04a1.42±0.07a2.49±0.12a2.48±0.12a2.48±0.12a2.48±0.12a2.48±0.12a2.48±0.12a2.48±0.12a2.49±0.12aLaCl31×10-60.11±0.01a0.20±0.01a0.86±0.04a1.41±0.07a2.32±0.11a2.38±0.12a2.44±0.12a2.40±0.12a2.43±0.12a2.51±0.13a2.51±0.13a2.49±0.12a1×10-50.11±0.01a0.20±0.01a0.86±0.04a1.41±0.07a2.34±0.12a2.42±0.12a2.45±0.12a2.43±0.12a2.44±0.12a2.52±0.13a2.53±0.13a2.51±0.13a1×10-40.11±0.01a0.20±0.01a0.86±0.04a1.41±0.07a2.36±0.12a2.42±0.12a2.45±0.12a2.41±0.12a2.45±0.12a2.48±0.12a2.52±0.13a2.52±0.13a1×10-30.11±0.01b0.20±0.01a0.86±0.04a1.41±0.07a2.43±0.12a2.45±0.12a2.45±0.12a2.46±0.12a2.48±0.12a2.55±0.13a2.52±0.13a2.51±0.132aCeCl31×10-60.12±0.01b0.13±0.01b0.37±0.02b1.11±0.06b2.06±0.10b2.20±0.11b2.26±0.11b2.27±0.11b2.40±0.12a2.63±0.13a2.63±0.13a2.57±0.13a1×10-50.13±0.01b0.14±0.01b0.38±0.02b1.13±0.06b2.10±0.10b2.22±0.11b2.25±0.11b2.27±0.11b2.42±0.12a2.66±0.13a2.65±0.13a2.64±0.13a1×10-40.13±0.01b0.14±0.01b0.39±0.02b1.21±0.06b2.15±0.11b2.23±0.11b2.30±0.12b2.30±0.12b2.39±0.12a2.67±0.13a2.66±0.13a2.61±0.13a1×10-30.24±0.01a0.83±0.04a1.08±0.05a1.84±0.09a2.51±0.13a2.52±0.13a2.51±0.13a2.52±0.13a2.51±0.13a2.50±0.12a2.51±0.13a2.48±0.12aPrCl31×10-60.08±0.01b0.57±0.03ab1.18±0.06a1.86±0.10a2.48±0.12a2.47±0.12a2.46±0.12a2.46±0.12a2.47±0.12a2.53±0.13a2.55±0.13a2.55±0.13a1×10-50.09±0.01b0.52±0.03b1.22±0.06a1.86±0.10a2.48±0.12a2.45±0.12a2.46±0.12a2.46±0.12a2.47±0.12a2.56±0.13a2.57±0.13a2.56±0.13a1×10-40.10±0.01b0.51±0.03b1.20±0.06a1.86±0.10a2.49±0.12a2.44±0.12a2.45±0.12a2.46±0.12a2.47±0.12a2.54±0.13a2.56±0.13a2.54±0.13a1×10-30.18±0.01a0.62±0.03a1.05±0.05b1.88±0.10b2.37±0.12b2.46±0.12b2.43±0.12a2.45±0.12a2.47±0.12a2.51±0.13a2.53±0.13a2.53±0.13a
注:不同小写字母表示差异显著(P<0.05)(下同)。
表4 不同CaCl2浓度下L.lactis ATCC 11454的生物量 单位:g/L
Table 4 Biomass of L.lactis ATCC 11454 obtained at different CaCl2 concentrations
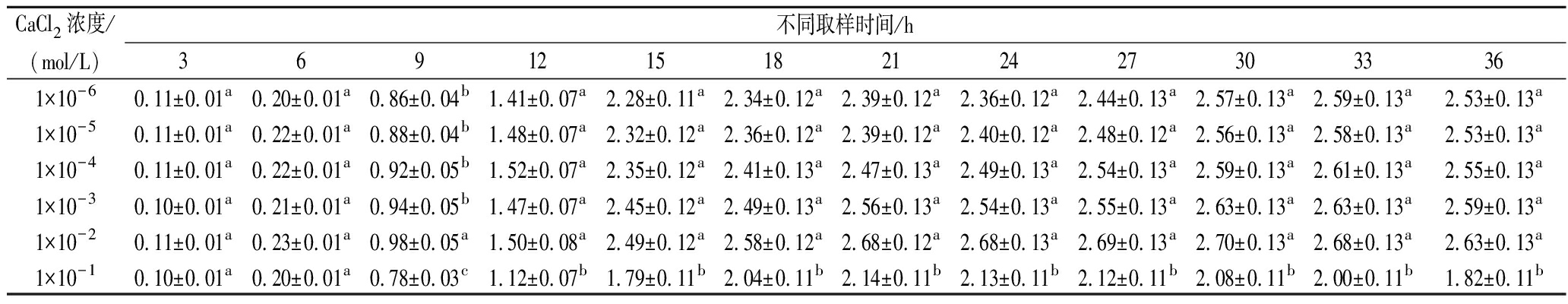
CaCl2浓度/(mol/L)不同取样时间/h3691215182124273033361×10-60.11±0.01a0.20±0.01a0.86±0.04b1.41±0.07a2.28±0.11a2.34±0.12a2.39±0.12a2.36±0.12a2.44±0.13a2.57±0.13a2.59±0.13a2.53±0.13a1×10-50.11±0.01a0.22±0.01a0.88±0.04b1.48±0.07a2.32±0.12a2.36±0.12a2.39±0.12a2.40±0.12a2.48±0.12a2.56±0.13a2.58±0.13a2.53±0.13a1×10-40.11±0.01a0.22±0.01a0.92±0.05b1.52±0.07a2.35±0.12a2.41±0.13a2.47±0.13a2.49±0.13a2.54±0.13a2.59±0.13a2.61±0.13a2.55±0.13a1×10-30.10±0.01a0.21±0.01a0.94±0.05b1.47±0.07a2.45±0.12a2.49±0.13a2.56±0.13a2.54±0.13a2.55±0.13a2.63±0.13a2.63±0.13a2.59±0.13a1×10-20.11±0.01a0.23±0.01a0.98±0.05a1.50±0.08a2.49±0.12a2.58±0.12a2.68±0.12a2.68±0.13a2.69±0.13a2.70±0.13a2.68±0.13a2.63±0.13a1×10-10.10±0.01a0.20±0.01a0.78±0.03c1.12±0.07b1.79±0.11b2.04±0.11b2.14±0.11b2.13±0.11b2.12±0.11b2.08±0.11b2.00±0.11b1.82±0.11b
2.3 稀土盐对L.lactis ATCC 11454发酵生产Nisin的影响
如图3、图4所示,随着稀土盐浓度由1×10-6 mol/L升高至1×10-3 mol/L,发酵液的Nisin效价出现先升高后降低的变化趋势。Nisin的生物合成由一段长度为14 kb的nisABTCIPRKFEG基因簇完成。其中,nisA基因编码一段由信号肽(N端的23个氨基酸残基)和核心肽组成Nisin前体肽。在细胞膜上,核心肽中的丝氨酸和苏氨酸在nisB基因编码的脱水酶作用下生成脱氢丙氨酸和脱氢酪氨酸。随后,在nisC基因编码的环化酶作用下,脱氢丙氨酸或脱氢酪氨酸内的双键与半胱氨酸的巯基发生共轭加成反应,生成羊毛硫氨酸或甲基羊毛硫氨酸的硫醚交联产物。修饰后的Nisin前体肽由nisT基因编码的ABC转运蛋白输送到细胞外。最后,在丝氨酸蛋白酶的催化下,前体肽脱去N端信号序列,生成具有活性的Nisin。其中,NisB和NisC的催化反应均需要Mg2+作为辅助因子。由表5可知,Mg2+的离子半径(0.720 Å)与重稀土元素的离子半径更加接近。因此,Er(Ⅲ)、Tm(Ⅲ)和Ho(Ⅲ)更容易替代Mg2+激活NisB和NisC,从而提高Nisin前体肽的修饰反应速率。研究表明Nisin通过组氨酸感应激酶和转录反应调节因子组成的双组分调节系统诱导自身合成[19]。当细胞外Nisin质量浓度达到一定值时,NisK开始自身磷酸化,并将一个磷酸基团转移到NisR的天冬氨酸中。激活的NisR可以上调Nisin结构基因nisA的转录表达,从而促进Nisin前体肽的合成。研究表明稀土元素可作为NisK的辅因子,触发其自身的磷酸化反应。显然,添加适量稀土盐能够缩短Nisin合成的启动时间。基于试验结果和上述分析,可向培养基中添加1×10-4 mol/L的TmCl3来促进L.lactis ATCC 11454发酵生产Nisin。
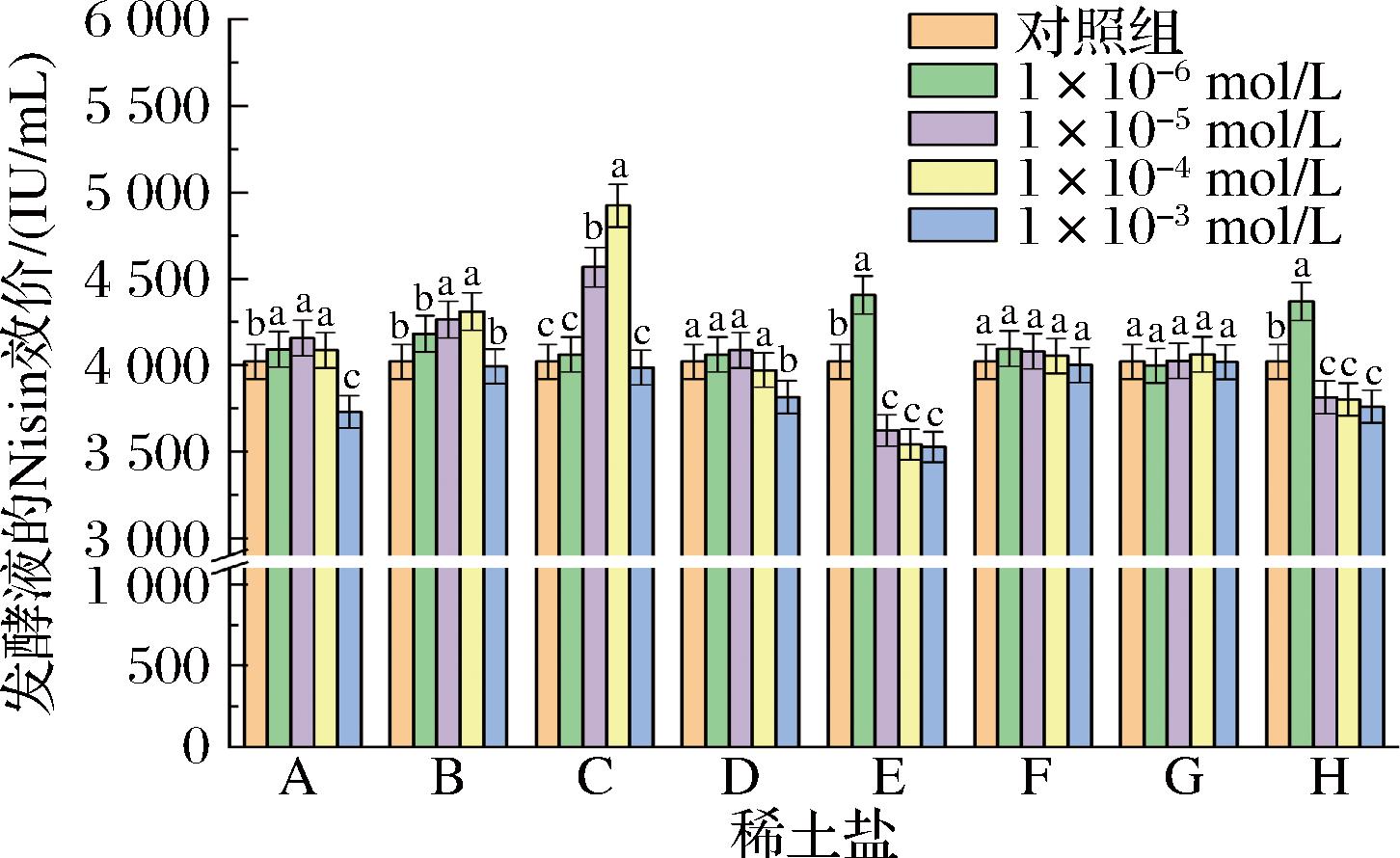
A-ErCl3;B- NdCl3;C-TmCl3;D-HoCl3;E-EuCl3;F- LaCl3;G-CeCl3;H-PrCl3
图3 稀土盐对L.lactis ATCC 11454发酵生产Nisin的影响
Fig.3 Effects of rare earth salts on Nisin production by L.lactis ATCC 11454
注:不同小写字母表示差异显著(P<0.05)(下同)。

a-ErCl3;b-NdCl3;c-TmCl3;d-HoCl3;e-EuCl3;f-LaCl3;g-CeCl3;h-PrCl3
图4 不同稀土盐浓度下发酵液的抑菌圈照片
Fig.4 Images of bacterial inhibition rings obtained from the fermentation broths with different rare earth salts concentrations
表5 稀土元素离子半径
Table 5 Ionic radius of rare earth elements
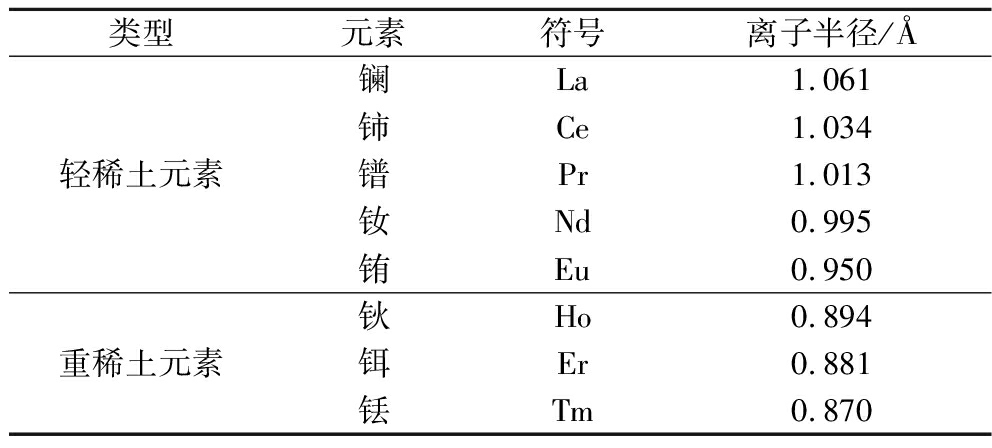
类型元素符号离子半径/Å轻稀土元素镧La1.061铈Ce1.034镨Pr1.013钕Nd0.995铕Eu0.950重稀土元素钬Ho0.894铒Er0.881铥Tm0.870
2.4 TmCl3添加时间对L.lactis ATCC 11454发酵生产Nisin的影响
如表6所示,在发酵的最初12 h内,培养基中添加TmCl3对L.lactis ATCC 11454生长的影响并不明显。这是由于发酵初期培养基中含有丰富的营养物质,菌体细胞能够快速生长。发酵15 h后,试验组的菌体生物量均高于对照组。当TmCl3的添加时间早于12 h时,试验组在18 h达到菌体生长的稳定期;而在12、15 h添加TmCl3,菌体生长的对数期在24 h结束。由图5可知,在发酵9 h时添加1×10-4 mol/L的TmCl3能够大幅促进Nisin的合成,发酵液的Nisin效价为(5 643.23±156.57) IU/mL。在固定稀土元素浓度条件下,发酵系统的菌体生物量越小,稀土元素在菌体细胞上的吸附量越大。TmCl3的添加时间越早,负载Tm(Ⅲ)的菌体细胞在达到稳定期之前经历的细胞分裂次数越多。因此,一部分Tm(Ⅲ)会保留在死亡细胞和细胞碎片表面。随着菌体生物量的增加,Tm(Ⅲ)对细胞生长和Nisin生物合成的促进作用降低。当TmCl3的添加时间接近稳定期时,虽然菌体生物量能够持续增加,但发酵液中Nisin的积累会降低菌体细胞的代谢活力,因此Tm(Ⅲ)对Nisin生物合成的促进作用较弱。综合以上试验结果,TmCl3的最佳添加时间为发酵9 h。
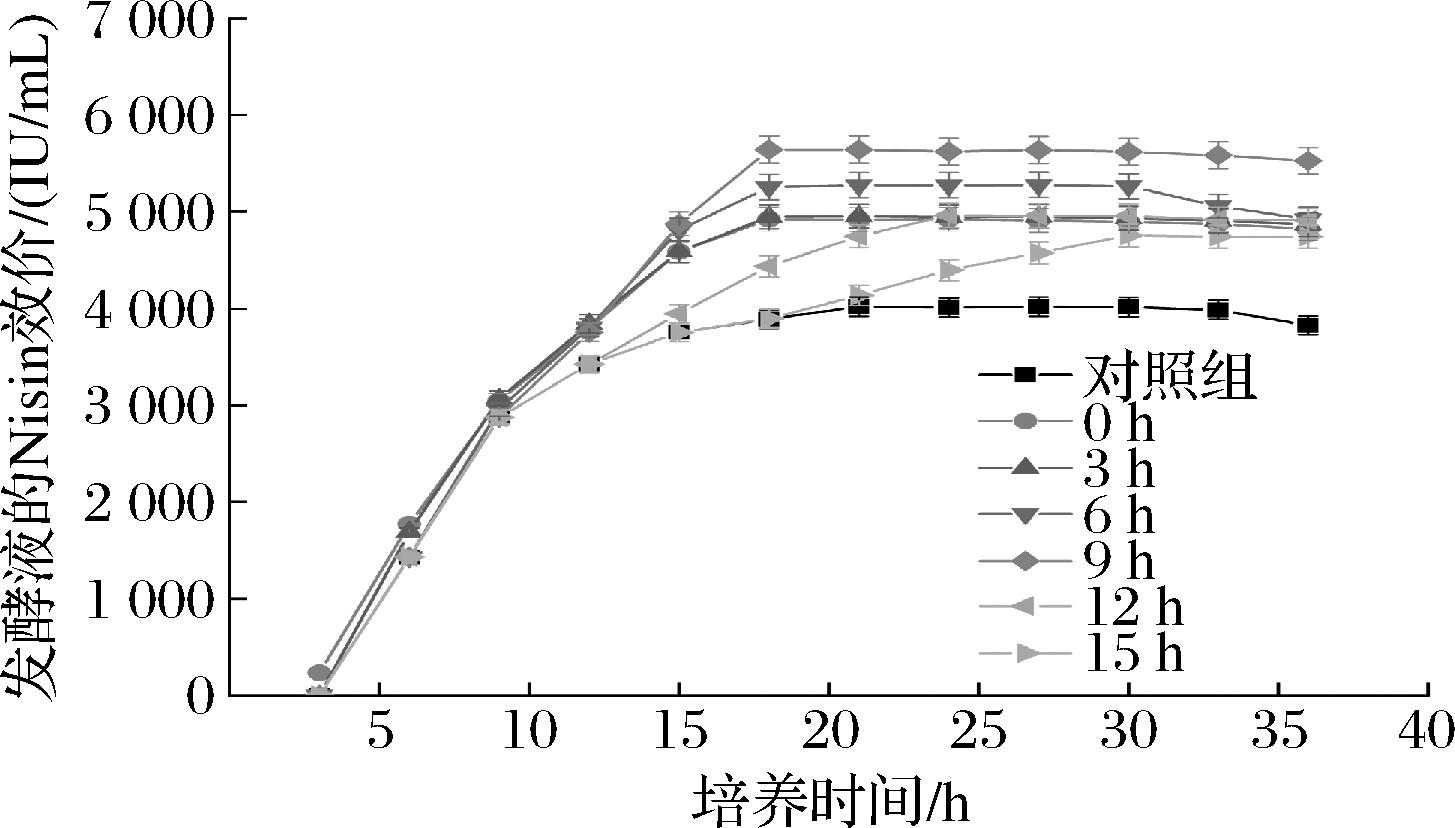
图5 TmCl3添加时间对L.lactis ATCC 11454发酵生产Nisin的影响
Fig.5 Effects of TmCl3 adding time on Nisin production by L.lactis ATCC 11454
表6 不同TmCl3添加时间下L.lactis ATCC 11454的生物量 单位:g/L
Table 6 Biomass of L.lactis ATCC 11454 obtained at different TmCl3 adding times
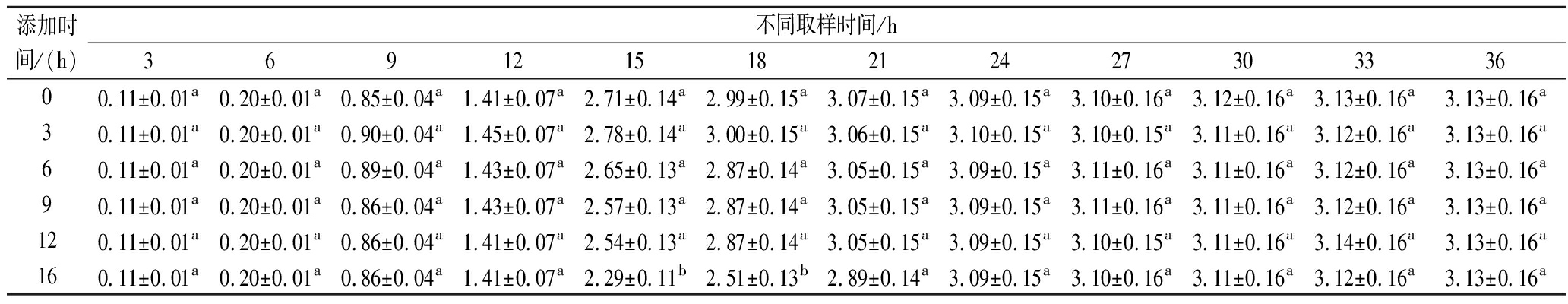
添加时间/(h)不同取样时间/h36912151821242730333600.11±0.01a0.20±0.01a0.85±0.04a1.41±0.07a2.71±0.14a2.99±0.15a3.07±0.15a3.09±0.15a3.10±0.16a3.12±0.16a3.13±0.16a3.13±0.16a30.11±0.01a0.20±0.01a0.90±0.04a1.45±0.07a2.78±0.14a3.00±0.15a3.06±0.15a3.10±0.15a3.10±0.15a3.11±0.16a3.12±0.16a3.13±0.16a60.11±0.01a0.20±0.01a0.89±0.04a1.43±0.07a2.65±0.13a2.87±0.14a3.05±0.15a3.09±0.15a3.11±0.16a3.11±0.16a3.12±0.16a3.13±0.16a90.11±0.01a0.20±0.01a0.86±0.04a1.43±0.07a2.57±0.13a2.87±0.14a3.05±0.15a3.09±0.15a3.11±0.16a3.11±0.16a3.12±0.16a3.13±0.16a120.11±0.01a0.20±0.01a0.86±0.04a1.41±0.07a2.54±0.13a2.87±0.14a3.05±0.15a3.09±0.15a3.10±0.15a3.11±0.16a3.14±0.16a3.13±0.16a160.11±0.01a0.20±0.01a0.86±0.04a1.41±0.07a2.29±0.11b2.51±0.13b2.89±0.14a3.09±0.15a3.10±0.16a3.11±0.16a3.12±0.16a3.13±0.16a
因此,稀土盐刺激L.lactis ATCC 11454发酵生产Nisin的最佳操作条件:TmCl3浓度为1×10-4 mol/L,添加量为1%(体积分数),添加时间为发酵9 h。
2.5 发酵-泡沫分离耦合操作强化Nisin生产的工艺条件优化
2.5.1 发酵与泡沫分离初始耦合时间
如图6所示,随着发酵与泡沫分离初始耦合时间从3 h增加至27 h,Nisin回收率和发酵液的总Nisin效价均呈现出先增加后减小的变化趋势。在对数生长阶段,随着发酵液中营养物质的快速消耗,菌体生物量不断增加。事实上,蛋白胨和酵母浸粉能够降低发酵培养基的表面张力,是发酵初期形成泡沫的主要物质[20]。在发酵前6 h进行泡沫分离操作,菌体细胞处于快速生长的初期,菌体生物量和发酵液效价均较低。此时,蛋白胨和酵母浸粉中的起泡成分(主要为蛋白质和多肽)会优先吸附在气泡表面,并从发酵液富集到泡沫相。这些起泡成分较高的吸附密度不仅增强了泡沫的持液率,而且降低了上升泡沫中Nisin的质量流率。并且,发酵液中较少的营养物质导致菌体细胞提前进入稳定期,降低了Nisin产量。因此,Nisin的回收率和发酵液的总Nisin效价都很低。随着发酵与泡沫分离初始耦合时间从9 h增加至18 h,Nisin的回收率和发酵液的总Nisin效价快速升高。此时,菌体细胞处于快速生长期,连续分离出发酵液中的Nisin有助于缓解产物抑制问题,促进菌体细胞持续合成Nisin。当发酵与泡沫分离初始耦合时间晚于18 h时,菌体生物量趋近于定值,Nisin的生物合成完全终止。由于营养物质的消耗和有害代谢产物的分泌,菌体细胞不能进行二次生长。此时,发酵液的总Nisin效价保持不变。由于Nisin分子结构中的亲水基团(C-端的6个氨基酸残基)较短,气-液界面上Nisin吸附密度的增加会降低气泡周围液膜的厚度,从而促进泡沫排液。较强的泡沫排液会引起气泡聚并和液膜破裂,降低泡沫的稳定性。泡沫无法连续流入收集器,Nisin的回收率较低。根据上述试验结果,发酵与泡沫分离的最适耦合时间为18 h。
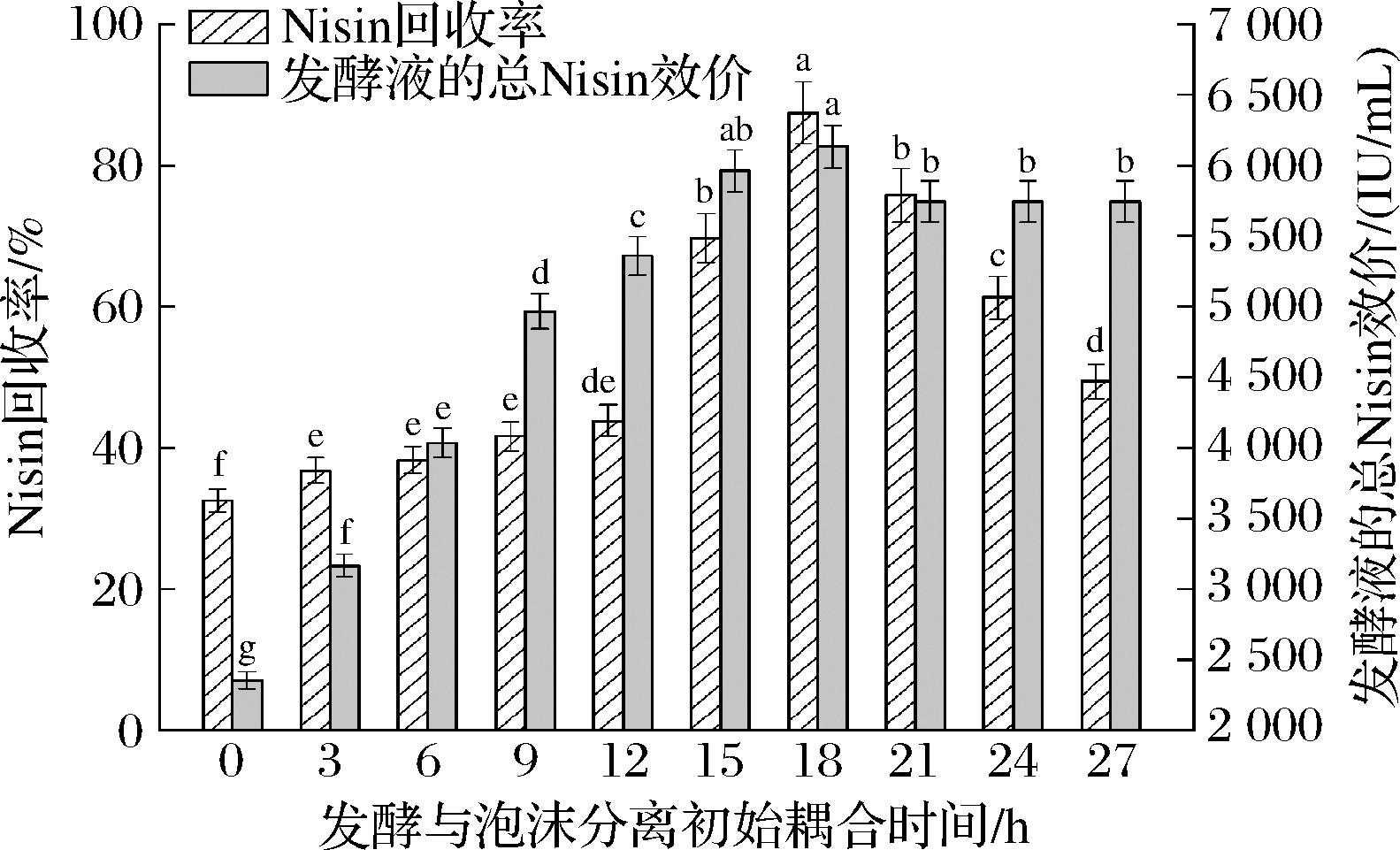
图6 发酵与泡沫分离初始耦合时间对Nisin回收率和发酵液的总Nisin效价的影响
Fig.6 Effects of initial coupling time of fermentation and foam fractionation on the recovery percentage of nisin and total Nisin titer of fermentation broth
2.5.2 气体分布器孔径
如图7所示,随着气体分布器孔径从180 μm增加到850 μm,Nisin回收率从(91.42±4.57)%下降到(56.41±2.80)%,而发酵液的总Nisin效价先由(4 514±112.83) IU/mL增至(6 243±156.09) IU/mL。气体分布器孔径直接影响溶液中气泡的尺寸和数量。气泡形成过程主要包括气体膨胀和脱离2个步骤。在气体膨胀过程中,气孔边缘的表面张力可以对抗气-液界面的拉伸变形,从而影响气泡在气体分布器表面的停留时间。研究表明孔口边缘的表面张力与气体分布器的孔径呈正相关。因此,在一定的气体体积流率条件下,气体分布器孔径越小,形成的气泡体积越小,气泡数量越多,气泡的分散效果越好。较大的气液相接触面积有利于强化传质过程。Nisin在泡沫中的吸附质量流率越大,其回收率越高。然而,小气泡会在泡沫内部产生大量的液膜和Plateau边界通道,从而增加泡沫排液阻力。较高的泡沫持液率引起发酵液体积快速降低,而菌体细胞密度升高。同时,气泡在发酵液中的停留时间缩短,系统的溶氧量降低。因此,菌体细胞代谢受到抑制,发酵液的总Nisin效价较低。随着气体分布器孔径的增大,气孔边缘较大的表面张力导致了大尺寸气泡的形成。大气泡受到的浮力更大,在溶液中的上升速度较快。胡滨等[21]研究表明,随着气体分布器孔径由23 μm增大到165 μm,十二烷基硫酸钠在泡沫中的吸附质量流率由14.2×10-6 kg/(m2·s)减小到6.1×10-6 kg/(m2·s)。此外,气泡越大,泡沫排液速率越快,泡沫的稳定性越差。因此,随着气体分布器孔径的增大,Nisin回收率降低,而发酵液的总Nisin效价升高。综合考虑Nisin回收率和发酵液的总Nisin效价,发酵-泡沫分离耦合生产Nisin的最适气体分布器孔径为300 μm。
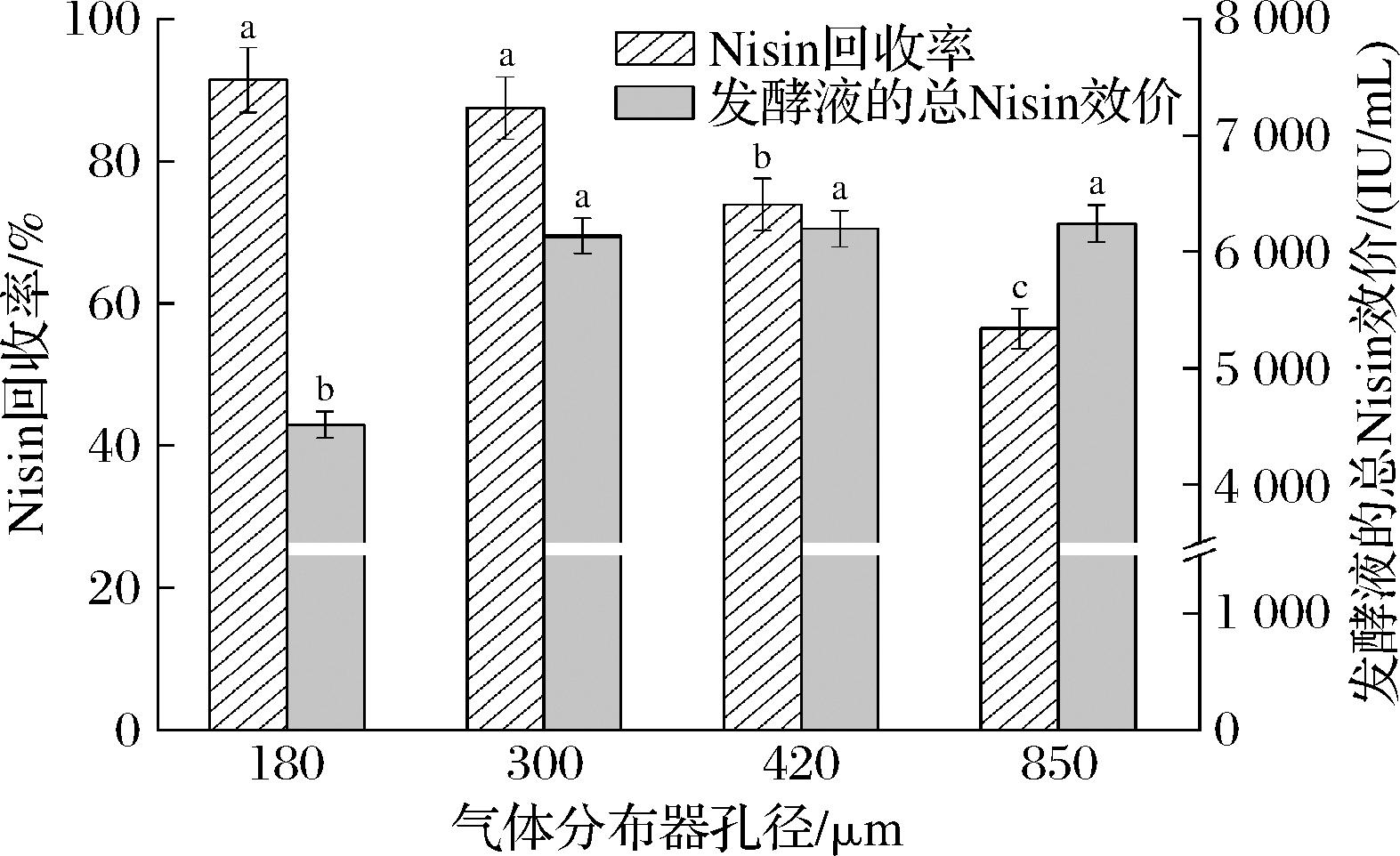
图7 气体分布器孔径对Nisin回收率和发酵液的总Nisin效价的影响
Fig.7 Effects of pore diameter of gas distributor on the recovery percentage of Nisin and total Nisin titer of fermentation broth
2.5.3 气体体积流率
如图8所示,随着气体体积流率从80 mL/min增加到220 mL/min,Nisin回收率由(63.86±3.19)%增加到(95.56±2.78)%,而发酵液的总Nisin效价先由(6 392.13±158.32) IU/mL降低至(5 625.19±140.57) IU/mL。气体体积流率是泡沫分离重要的操作参数之一,直接影响气泡的生成速率。气体体积流率越大,溶液中气泡的生成速率越快。气泡在发酵系统的停留时间较短,且泡沫的迅速积累增大了间隙液在Plateau边界通道内流动阻力,塔顶泡沫的持液率增大。然而,营养物质的大量流失抑制了菌体细胞的持续生长和代谢。并且,气体体积流率越大,发酵系统的含气率越高,气泡快速运动对菌体细胞造成的剪切破坏作用越强[22]。因此,随着气体体积流率的增加,Nisin回收率升高,而发酵液的总Nisin效价降低。当气体体积流率超过180 mL/min后,Nisin的生物合成受到抑制,发酵液的总效价几乎保持不变。综合上述试验结果,发酵-泡沫分离耦合生产Nisin的最适气体体积流率为120 mL/min。
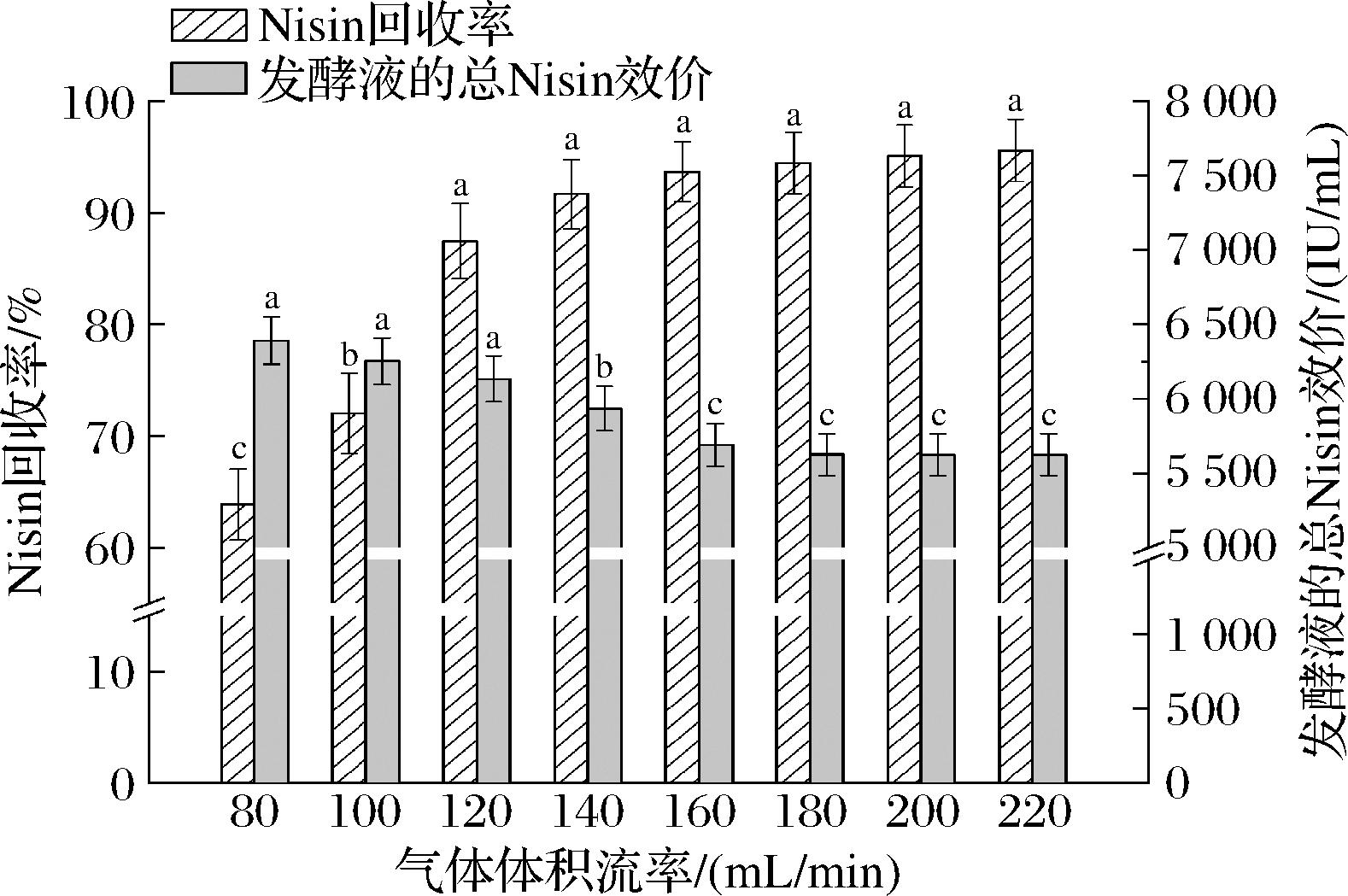
图8 气体体积流率对Nisin回收率和发酵液的总Nisin效价的影响
Fig.8 Effects of volumetric air flow rate on the recovery percentage of Nisin and total Nisin titer of fermentation broth
2.5.4 响应面优化试验结果
采用Box-Behnken试验模型,以发酵与泡沫分离初始耦合时间、气体分布器孔径和气体体积流率为自变量,共设计了17组试验。试验设计方案和结果如表7。利用Design-Expert V8.0.6 Trial软件对试验结果进行多元回归拟合,确定Nisin的回收率和发酵液的总Nisin效价。以上因素的二次多项回归方程,Y1=![]()
表7 三因素三水平Box-Behnken试验设计方案和结果
Table 7 Coded level combinations for a three-level-three-variable Box-Behnken design and experimental data
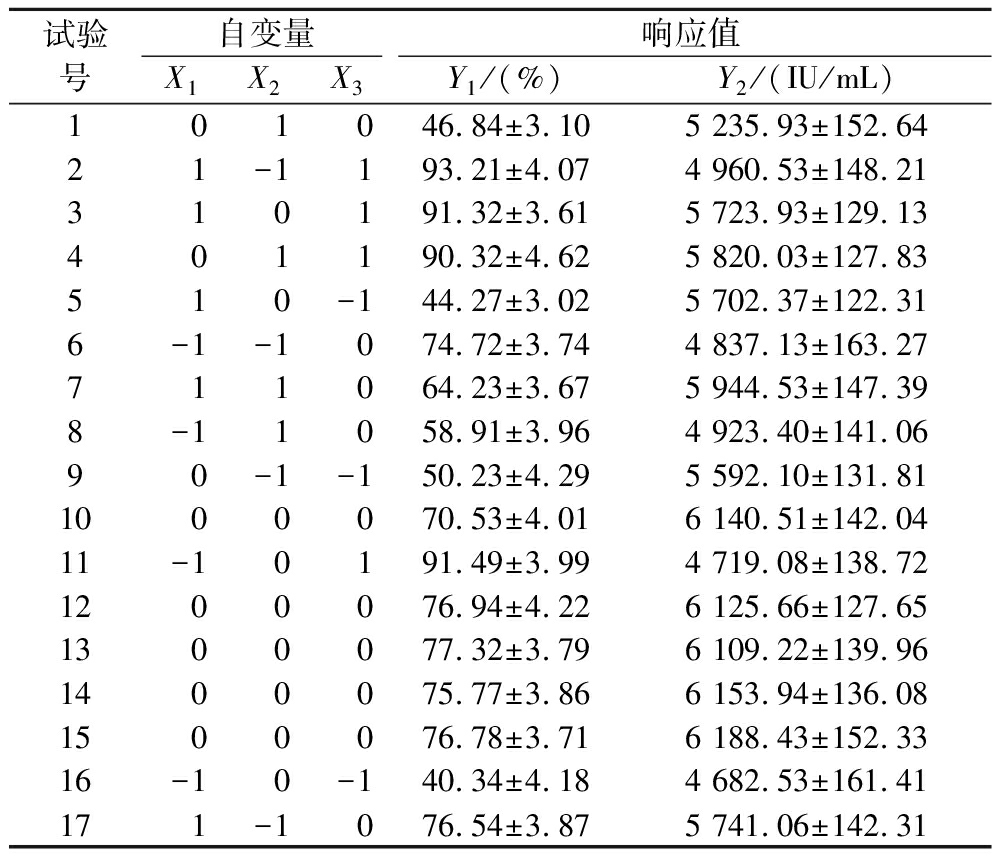
试验号自变量响应值X1X2X3Y1/(%)Y2/(IU/mL) 1 0 1 046.84±3.105 235.93±152.6421-1193.21±4.074 960.53±148.21310191.32±3.615 723.93±129.13401190.32±4.625 820.03±127.83510-144.27±3.025 702.37±122.316-1-1074.72±3.744 837.13±163.27711064.23±3.675 944.53±147.398-11058.91±3.964 923.40±141.0690-1-150.23±4.295 592.10±131.811000070.53±4.016 140.51±142.0411-10191.49±3.994 719.08±138.721200076.94±4.226 125.66±127.651300077.32±3.796 109.22±139.961400075.77±3.866 153.94±136.081500076.78±3.716 188.43±152.3316-10-140.34±4.184 682.53±161.41171-1076.54±3.875 741.06±142.31
分别对2个回归方程模型进行显著性校验,Nisin回收率和发酵液的总Nisin效价方差分析,结果见表8和表9。显然,2个模型均极显著(P值<0.000 1),失拟项均不显著(P值>0.05),表明回归方程模型显著可靠。2个模型的决定系数R2分别为0.976 7和0.997 5,矫正决定系数![]() 分别为0.946 7和0.994 4,表明试验值与对应的模型预测值匹配度高度一致,模型的稳定性和可靠性较高。通过设定Nisin回收率和发酵液的总效价的最大值为同等重要性,发酵-泡沫分离耦合生产Nisin的最佳工艺条件为发酵与泡沫分离初始耦合时间18.63 h,气体分布器孔径302.74 μm和气体体积流率134.96 mL/min,预测的Nisin回收率和发酵液的总Nisin效价分别为87.96%和6 115.92 IU/mL。为了方便实际操作,将最佳工艺条件调整为发酵与泡沫分离初始耦合时间18.50 h,气体分布器孔径300 μm和气体体积流率135 mL/min,在此条件下进行5次平行验证试验,获得Nisin回收率和发酵液的总Nisin效价分别为(89.43±2.35)%和(6 159.00±89.35) IU/mL,与预测值的相对标准偏差分别为1.05%和0.57%。
分别为0.946 7和0.994 4,表明试验值与对应的模型预测值匹配度高度一致,模型的稳定性和可靠性较高。通过设定Nisin回收率和发酵液的总效价的最大值为同等重要性,发酵-泡沫分离耦合生产Nisin的最佳工艺条件为发酵与泡沫分离初始耦合时间18.63 h,气体分布器孔径302.74 μm和气体体积流率134.96 mL/min,预测的Nisin回收率和发酵液的总Nisin效价分别为87.96%和6 115.92 IU/mL。为了方便实际操作,将最佳工艺条件调整为发酵与泡沫分离初始耦合时间18.50 h,气体分布器孔径300 μm和气体体积流率135 mL/min,在此条件下进行5次平行验证试验,获得Nisin回收率和发酵液的总Nisin效价分别为(89.43±2.35)%和(6 159.00±89.35) IU/mL,与预测值的相对标准偏差分别为1.05%和0.57%。
表8 Nisin回收率方差分析结果
Table 8 Variance analysis results of Nisin recovery percentage
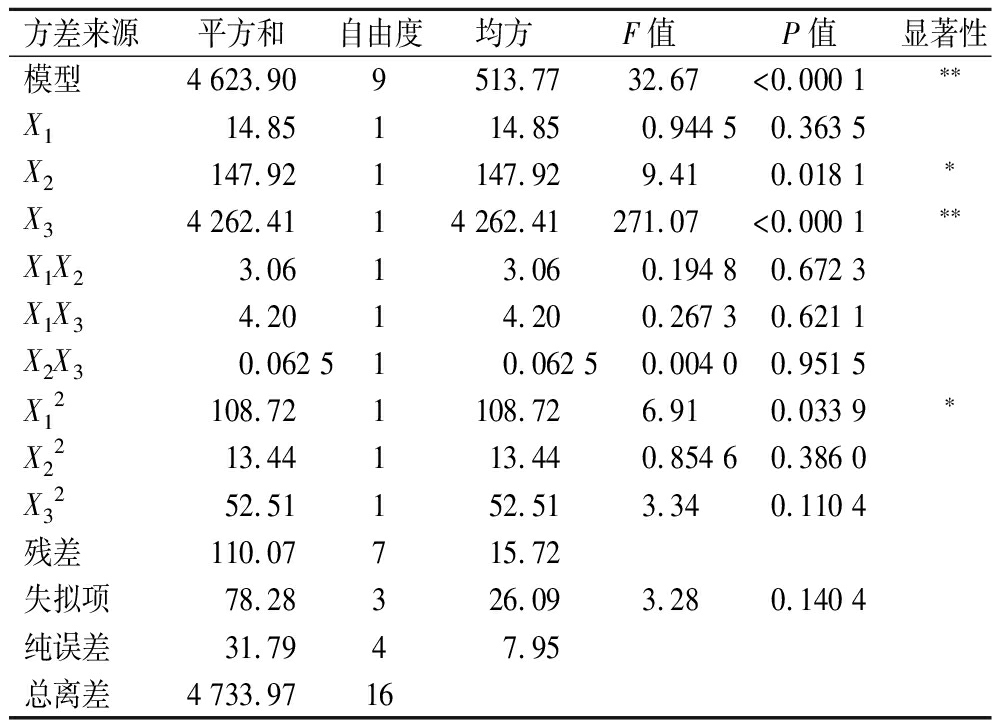
方差来源平方和自由度均方F值P值显著性模型4 623.909 513.77 32.67<0.000 1∗∗X114.85114.850.944 50.363 5X2147.921147.929.410.018 1∗X34 262.4114 262.41271.07<0.000 1∗∗X1X23.0613.060.194 80.672 3X1X34.2014.200.267 30.621 1X2X30.062 510.062 50.004 00.951 5X12108.721108.726.910.033 9∗X2213.44113.440.854 60.386 0X3252.51152.513.340.110 4残差110.07715.72失拟项78.28326.093.280.140 4纯误差31.7947.95总离差4 733.9716
注:*表示P值<0.05,差异显著;**表示P值<0.01,差异极显著(下同)。
表9 发酵液的总Nisin效价方差分析结果
Table 9 Variance analysis results of total Nisin titer of fermentation broth
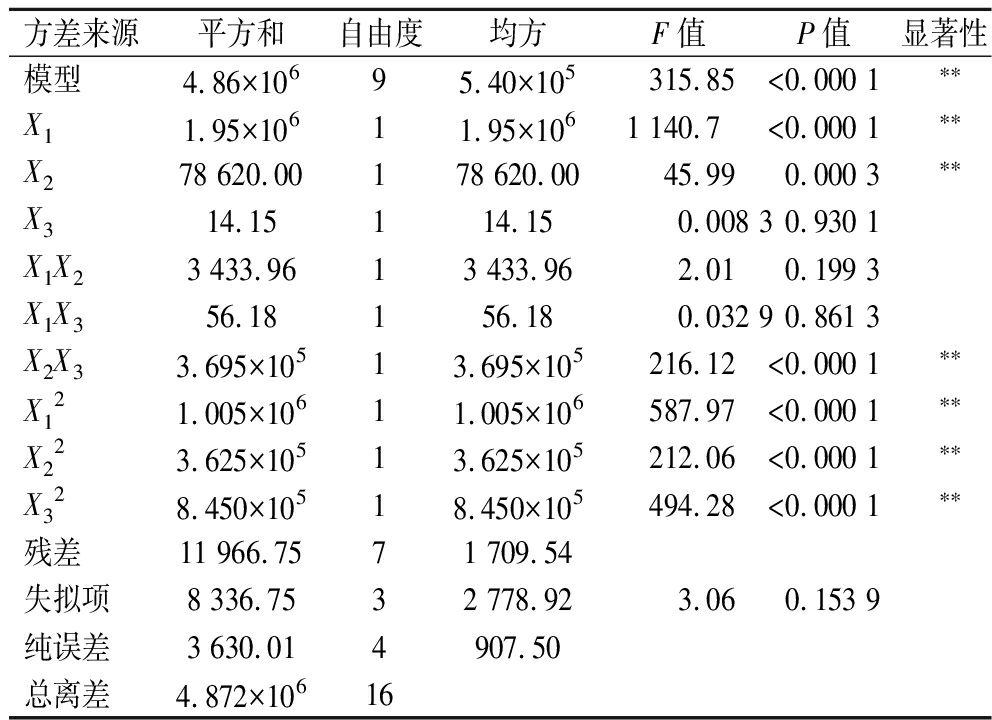
方差来源平方和自由度均方F值P值显著性模型4.86×10695.40×105 315.85<0.000 1∗∗X11.95×10611.95×1061 140.7<0.000 1∗∗X278 620.00178 620.0045.990.000 3∗∗X314.15114.150.008 30.930 1X1X23 433.9613 433.962.010.199 3X1X356.18156.180.032 90.861 3X2X33.695×10513.695×105216.12<0.000 1∗∗X121.005×10611.005×106587.97<0.000 1∗∗X223.625×10513.625×105212.06<0.000 1∗∗X328.450×10518.450×105494.28<0.000 1∗∗残差11 966.7571 709.54失拟项8 336.7532 778.923.060.153 9纯误差3 630.014907.50总离差4.872×10616
本文通过添加稀土盐刺激L.lactis ATCC 11454生长和代谢,并利用发酵与泡沫分离耦合在线分离发酵液中的Nisin来缓解产物抑制问题,最终发酵液的总Nisin效价为(6 159.00±89.35) IU/mL。近年来,研究者们对L.lactis发酵生产Nisin的过程强化和工艺开发开展了大量研究。WU等[23]在L.lactic F44中过表达PspC家族中与耐酸性相关的转录调控因子ythA,在致死性pH值为3.0的酸休克条件下,发酵液的Nisin效价为(3 380.2±135.4) IU/mL。该方法虽然能够提高Nisin的合成效率,但构建表达质粒的成本高,且工程细菌的遗传和生产稳定性差。KÖRDIKANLIO LU等[24]通过在培养基中添加血红素,将L.lactis N8的代谢途径重新定向为有氧呼吸,从而提升菌体细胞生长速率,发酵液的Nisin效价为5 410.0 IU/mL。但血红素的价格昂贵且稳定性差,不宜大量应用于好氧发酵系统。QIAO等[25]将L.lactis N8与大肠杆菌进行共培养发酵,基于微生物之间的群体感应和协同代谢作用,发酵液的Nisin效价提高至6 260 IU/mL。然而,共培养发酵需要严格控制操作条件,碳源消耗量增大,且发酵液中代谢产物复杂会对后续Nisin的分离造成不利影响。与以上研究相比,本文提出的强化策略具有操作简单、Nisin合成效率高、分离效果好等优点,可为促进Nisin的工业生产提供理论基础。
LU等[24]通过在培养基中添加血红素,将L.lactis N8的代谢途径重新定向为有氧呼吸,从而提升菌体细胞生长速率,发酵液的Nisin效价为5 410.0 IU/mL。但血红素的价格昂贵且稳定性差,不宜大量应用于好氧发酵系统。QIAO等[25]将L.lactis N8与大肠杆菌进行共培养发酵,基于微生物之间的群体感应和协同代谢作用,发酵液的Nisin效价提高至6 260 IU/mL。然而,共培养发酵需要严格控制操作条件,碳源消耗量增大,且发酵液中代谢产物复杂会对后续Nisin的分离造成不利影响。与以上研究相比,本文提出的强化策略具有操作简单、Nisin合成效率高、分离效果好等优点,可为促进Nisin的工业生产提供理论基础。
3 结论
本研究利用稀土盐和泡沫分离来解决L.lactis ATCC 11454发酵过程存在的Nisin合成效率低和菌体活力下降快问题。在发酵9 h向发酵液中添加1×10-4 mol/L的TmCl3,发酵液的Nisin效价可达到(5 643.23±156.57) IU/mL,较对照组提高(40.56±7.41)%。利用响应面优化试验对发酵-泡沫分离耦合操作进行了优化,在发酵与泡沫分离初始耦合时间18.50 h,气体分布器孔径300 μm和气体体积流率135 mL/min条件下,Nisin回收率和发酵液的总Nisin效价分别为(89.43±2.35)%和(6 159.00±89.35) IU/mL。在发酵液中,Nisin主要以阳离子状态存在。由于静电斥力作用,稀土离子不会与Nisin一同富集在消泡液中,因此分离得到的Nisin具有安全性。虽然稀土盐的价格较为昂贵,但在本研究中稀土盐的添加量很小,并不会大幅增加Nisin的生产成本。综上所述,本研究可为L.lactis发酵生产Nisin的过程强化提供新的研究方法,并为工业生产提供参考。
[1] 张阳玲, 吴昊, 乔建军, 等.乳酸链球菌肽的应用及研究进展[J].食品与发酵工业, 2020, 46(7):289-295.ZHANG Y L, WU H, QIAO J J, et al.Application and research progress of Nisin[J].Food and Fermentation Industries, 2020, 46(7):289-295.
[2] GORAIN C, SINGH A, BHATTACHARYYA S, et al.Mucosal delivery of live Lactococcus lactis expressing functionally active JlpA antigen induces potent local immune response and prevent enteric colonization of Campylobacter jejuni in chickens[J].Vaccine, 2020, 38(7):1630-1642.
[3] NI Z J, ZHANG X Y, LIU F, et al.Effect of co-overexpression of nisin key genes on nisin production improvement in Lactococcus lactis LS01[J].Probiotics and Antimicrobial Proteins, 2017, 9(2):204-212.
[4] GIRGIN ERSOY Z, KAYIHAN C, TUNCA S.Higher nisin yield is reached with glutathione and pyruvate compared with heme in Lactococcus lactis N8[J].Brazilian Journal of Microbiology, 2020, 51(3):1247-1257.
[5] NAKAGAWA T, MITSUI R, TANI A, et al.A catalytic role of XoxF1 as La3+-dependent methanol dehydrogenase in Methylobacterium extorquens strain AM1[J].PLoS One, 2012, 7(11):e50480.
[6] 王硕, 时唐恩, 赵春光, 等.稀土元素对L-酪氨酸发酵的影响研究[J].中国调味品, 2023, 48(2):1-6;24.WANG S, SHI T E, ZHAO C, et al.Study on effect of rare earth elements on fermentation of L-tyrosine[J].China Condiment, 2023, 48(2):1-6;24.
[7] 熊华仪, 陈曦, 刘月锋, 等.补料策略优化促进乳酸乳球菌HB03发酵合成Nisin[J].食品科学, 2023, 44(22):218-224.XIONG H Y, CHEN X, LIU Y F, et al.Optimization of fed-batch culture strategy for improved synthesis of nisin by Lactococcus lactis HB03[J].Food Science, 2023, 44(22):218-224.
[8] LEE S H, KIM S, KIM J Y, et al.Enhanced butanol fermentation using metabolically engineered Clostridium acetobutylicum with ex situ recovery of butanol[J].Bioresource Technology, 2016, 218:909-917.
[9] 鲁吉珂, 黎业娟, 吴霄玥, 等.有机溶剂沉淀法提取乳酸链球菌素的效果[J].食品科学, 2012, 33(10):84-86.LU J K, LI Y J, WU X Y, et al.Separation of nisin from fermentation broth concentrate by organic solvent precipitation[J].Food Science, 2012, 33(10):84-86.
[10] TAFRESHI S Y H, MIRDAMADI S, KHATAMI S.Comparison of different nisin separation and concentration methods:Industrial and cost-effective perspectives[J].Probiotics and Antimicrobial Proteins, 2020, 12(3):1226-1234.
[11] ORABY A, WEICKARDT I, ZIBEK S.Foam fractionation methods in aerobic fermentation processes[J].Biotechnology and Bioengineering, 2022, 119(7):1697-1711.
[12] HOU D D, YU W T, ZHANG D M, et al.Culture of yeast cells immobilized by alginate-chitosan microcapsules in aqueous-organic solvent biphasic system[J].Journal of Oceanology and Limnology, 2019, 37(3):863-870.
[13] CHENG Q Y, TAO J, LI Y, et al.Production of nisin and lactic acid from the starch of sweet potato by simultaneous saccharification and fermentation with two stage pH adjustment[J].3 Biotech, 2021, 11(7):320.
[14] ZHAO G, LIU J M, ZHAO J, et al.Efficient production of nisin A from low-value dairy side streams using a nonengineered dairy Lactococcus lactis strain with low lactate dehydrogenase activity[J].Journal of Agricultural and Food Chemistry, 2021, 69(9):2826-2835.
[15] KAZAK E S, KALITINA E G, KHARITONOVA N A, et al.Biosorption of rare-earth elements and yttrium by heterotrophic bacteria in an aqueous environment[J].Moscow University Geology Bulletin, 2018, 73(3):287-294.
[16] LYU K, WANG X, WANG L, et al.Rare-earth element yttrium enhances the tolerance of curly-leaf pondweed (Potamogeton crispus) to acute nickel toxicity[J].Environmental Pollution, 2019, 248:114-120.
[17] WEHRMANN M, BERTHELOT C, BILLARD P, et al.Rare earth element (REE)-dependent growth of Pseudomonas putida KT2440 relies on the ABC-transporter PedA1A2BC and is influenced by iron availability[J].Frontiers in Microbiology, 2019, 10:2494.
[18] 霍光华, 张冬艳, 张通.稀土离子(Nd3+)对金黄色葡萄球菌细胞壁结构的影响[J].分子细胞生物学报, 2007, 40(6):437-442.HUO G H, ZHANG D Y, ZHANG T.Some effects of the neodymium ion on the cell wall structure of staphyloccocus aruea[J].Journal of Molecular Cell Biology, 2007, 40(6):437-442.
[19] HEIDARI S, HAMEDI J, OLAD G, et al.Structural and functional evaluation of recombinant histidine phosphokinase NisK and response regulator NisR:In silico and experimental approach[J].World Journal of Microbiology &Biotechnology, 2019, 35(11):169.
[20] YANG C Y, SU Z W, LI Z F, et al.Harvest of nisin from fermentation broth using foam separation with the assistance of ultrasonic treatment:Foam property evaluation and antimicrobial activity retention[J].Separation and Purification Technology, 2023, 311:123253.
[21] 胡滨, 朱海兰, 吴兆亮.气体分布器孔径对泡沫分离过程影响的研究[J].高校化学工程学报, 2014, 28(2):246-251.HU B, ZHU H L, WU Z L.The effect of the pore size of gas distributor on foam separation process[J].Journal of Chemical Engineering of Chinese Universities, 2014, 28(2):246-251.
[22] KRIEGEL A T, DUCKER W A.Removal of bacteria from solids by bubbles:Effect of solid wettability, interaction geometry, and liquid-vapor interface velocity[J].Langmuir, 2019, 35(39):12817-12830.
[23] WU H, LIU J G, MIAO S, et al.Contribution of YthA, a PspC family transcriptional regulator of Lactococcus lactis F44 acid tolerance and nisin yield:A transcriptomic approach[J].Applied and Environmental Microbiology, 2018, 84(6):e02483-e02417.
[24] KÖRDIKANLIO LU B,
LU B,  IM
IM EK Ö, SARIS P E J.Nisin production of Lactococcus lactis N8 with hemin-stimulated cell respiration in fed-batch fermentation system[J].Biotechnology Progress, 2015, 31(3):678-685.
EK Ö, SARIS P E J.Nisin production of Lactococcus lactis N8 with hemin-stimulated cell respiration in fed-batch fermentation system[J].Biotechnology Progress, 2015, 31(3):678-685.
[25] QIAO W J, QIAO Y, GAO G, et al.A novel co-cultivation strategy to generate low-crystallinity bacterial cellulose and increase nisin yields[J].International Journal of Biological Macromolecules, 2022, 202:388-396.