磷脂是指含有磷酸的脂类,常与蛋白质、糖脂、胆固醇等其他分子共同构成磷脂双分子层,即细胞膜的结构,其主要来源是植物和动物,其他还包括藻类等,微生物来源的磷脂鲜有报道。不同来源的磷脂在组分和含量上存在差异[1],在医药[2-5]、食品[6-7]、化妆品[8-9]、饲料[10-11]等领域发挥不同作用。
酵母中磷脂的合成途径与高等真核生物类似,同时也受生长环境的影响。磷脂酸(phosphatidic acid, PA)是酵母胞内主要磷脂合成的源头[12],PA可以在胞苷二磷酸二酰基甘油(cytidine diphosphate diacyl glycerol, CDP-DAG)合成酶作用下合成CDP-DAG,CDP-DAG作为前体物质可以合成磷脂酰胆碱(phosphatidyl choline, PC)、磷脂酰乙醇胺(phosphatidyl ethanolamine, PE)、磷脂酰肌醇、磷脂酰丝氨酸、磷脂酰甘油和心磷脂;PA也可以在PA磷酸酶作用下合成二酰基甘油,二酰基甘油作为前体物质可以合成甘油三酯,也可以通过肯尼迪途径合成PC和PE。当酵母生长环境中缺乏胆碱或乙醇胺时,PC和PE主要通过CDP-DAG这一前体物质合成,当生长环境中存在胆碱或乙醇胺时,PC和PE也可以通过肯尼迪途径合成。酵母细胞的磷脂组成由脂质代谢过程决定,脂质成分和代谢高度依赖于培养条件,包括温度、生长期[13-14]、碳源[14-15]、培养基[16]的使用以及脂质的存在前体如肌醇等。
酵母是目前世界上唯一年产量超过百万吨的微生物,工业化产品主要包括活性干酵母、酵母抽提物、酵母水解物、酵母细胞壁等,其中市售酵母细胞壁[17]是酵母细胞经发酵培养、升温自溶、蛋白酶酶解、离心分离轻相酵母抽提物后,收集剩余重相干燥后得到,属于酵母抽提物生产过程中的副产品,经济价值相对低,其组成除了细胞壁,还有细胞膜、胞内细胞器、少量细胞质等,检测其成分包含15%~27%的蛋白质,甘露寡糖26%~30%,β-葡聚糖25%~40%,粗脂肪12%~17%,麦角甾醇0.5%~2.8%,无机盐及其他3%~5%。由于市售酵母抽提物中基本不含粗脂肪,而酵母细胞和酵母细胞壁中都含有粗脂肪,说明以酵母为原料制备酵母抽提物和酵母细胞壁工艺中,粗脂肪几乎都进入到酵母细胞壁中,其中也包含磷脂,因此酵母中磷脂的提取,可以直接用酵母细胞壁进行替代,工艺更简洁,成本更低,更适合工业化大生产。
酵母细胞目前已经得到了广泛的研究,但关于从酵母细胞壁中提取并获得目标产物磷脂并无相关报道。因此为实现酵母细胞壁的综合利用,选择对酵母细胞壁中的磷脂进行提取制备研究具有重要意义,既能避免资源浪费,减少环境污染,又能提高经济效益,拓宽产业链。本研究将以市售酵母细胞壁为原料,对磷脂的提取工艺做探讨。
1 材料与方法
1.1 材料与试剂
1.1.1 酵母菌种及细胞壁
市售酵母细胞壁,安琪酵母股份有限公司,菌种编号为酿酒酵母CCTCC M2016418。
1.1.2 试剂
市售大豆磷脂,广州添宝生物科技有限公司;石油醚、正己烷、环己烷、乙酸乙酯、乙醇、异丙醇、正丁醇,西陇科学股份有限公司。其他试剂均为分析级。
1.2 仪器与设备
7820气相色谱质谱联用仪、5977四极杆质谱检测系统,安捷伦科技(中国)有限公司;ACQUITY UPLC I-CLASS超高效液相色谱仪、XEVO TQ-S Micro串联四级杆质谱系统,美国Waters公司;JOYN-SXT-04索氏提取器,上海乔跃电子有限公司;旋转蒸发仪、恒温水浴锅,东京理化器械株式会社;ZXRD-A7230恒温鼓风干燥箱,上海智城分析仪器制造有限公司;ME204电子天平,梅特勒托利多国际有限公司;ECO-18瑞比全能试色机,厦门瑞比精密机械有限公司;DF-101T集热式恒温加热磁力搅拌器、LC-08可调式电热炉,上海力辰邦西仪器科技有限公司;L3S可见分光光度计,上海仪电(集团)有限公司;布氏漏斗、抽滤瓶、坩埚,上海垒固玻璃仪器有限公司。
1.3 分析方法
1.3.1 酵母细胞壁总磷、粗脂肪含量检测及提取率计算
为快速评价实验过程磷脂的提取率,通过检测提取前后酵母细胞壁中总磷和粗脂肪含量的变化进行分析。其中总磷含量测定参照GB 5009.87—2016《食品安全国家标准 食品中磷的测定》,粗脂肪含量测定参照GB/T 6433—2006《饲料中粗脂肪的测定》,粗脂肪提取率和磷提取率分别按公式(1)、公式(2)计算:
(1)
(2)
式中:R1,粗脂肪提取率,%;R2,磷提取率,%;m0,提取前酵母细胞壁质量,g;m1,提取后酵母细胞壁质量,g;a0,提取前酵母细胞壁粗脂肪含量,%;a1,提取后酵母细胞壁粗脂肪含量,%;b0,提取前酵母细胞壁总磷含量,%;b1,提取后酵母细胞壁总磷含量,%。
1.3.2 脂肪酸分析
色谱系统:采用的是安捷伦7820气相色谱系统,CP-Sil88(100 m×0.25 mm×0.25 μm,Agilent)气相色谱柱,进样量为1 μL,分流比10∶1,载气为高纯氦气,流速1.0 mL/min;柱温箱初始温度100 ℃保持5.0 min,以4 ℃/min程序升温至240 ℃,保持15 min。
质谱系统:采用的是美国安捷伦5977四极杆质谱检测系统,采用电子轰击离子源,分析物在单通道扫描(single ion monitoring,SIM)模式下进行检测。质谱分析条件:进样口温度260 ℃,四级杆温度150 ℃,质量扫描范围m/z 30~550。
样品处理:称取适量样品0.1~1 g于干净的10 mL离心管中,加入氯仿4 mL,涡旋30 s混匀。再加入质量分数0.9% NaCl溶液,涡旋混匀30 s,3 500 r/min室温离心15 min,取出静置。用吸液枪吸取下层液体,转移到另一个试管中,再加入2 mL二氯甲烷,涡旋30 s,离心15 min,取下层液体。合并下层液体,氮气吹干,氮吹干后加入2 mL甲醇(含体积分数5%硫酸),涡旋30 s,80 ℃水浴2 h,水浴后待冷却,加入正己烷2 mL,加水1 mL,涡旋30 s,2 000 r/min离心5 min。取上清液后加水1 mL,涡旋30 s,2 000 r/min离心5 min,取上清液氮吹干。根据样品浓度加入适当体积的异辛烷,涡旋30 s,静置5 min,将溶液转移至进样瓶,待检测。
1.3.3 磷脂组分分析
色谱系统:采用Waters ACQUITY UPLC I-CLASS超高效液相色谱仪,色谱柱为Waters UPLC BEH C8和Waters ACQUITY UPLC BEH C8,流动相为A[V(乙腈)∶V(水)=6∶4,0.1%甲酸,5 mmol/L甲酸铵]和B[V(乙腈)∶V(异丙醇)= 1∶9,0.1%甲酸,5 mmol/L甲酸铵],洗脱程序见表1,流速0.26 mL/min,进样量4.0 μL,柱温55 ℃。
表1 疏水代谢物洗脱梯度
Table 1 Elution gradient of hydrophobic metabolites
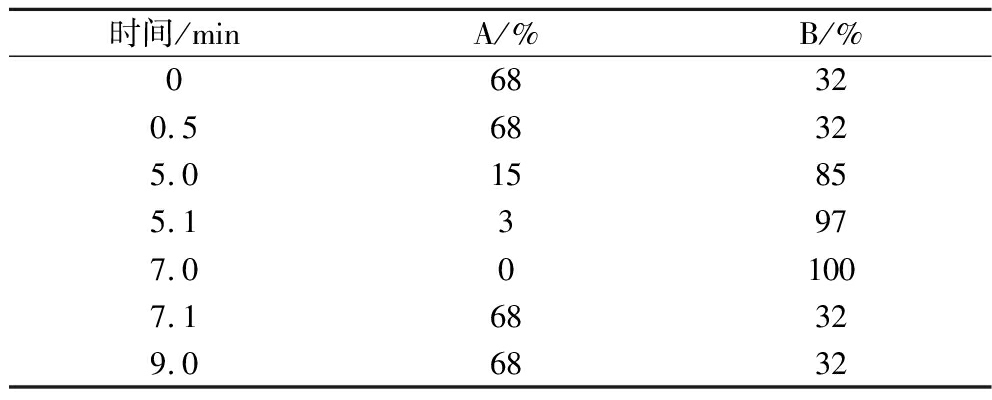
时间/minA/%B/%068320.568325.015855.13977.001007.168329.06832
质谱系统:采用Waters XEVO TQ-S Micro串联四级杆质谱系统进行质谱分析。采集模式为正、负离子(ESI+、ESI-),离子源电压3.0 kV,温度150 ℃,去溶剂化温度350 ℃,去溶剂化气体流速1 000 L/h,锥孔电压20.0 V,气体流速150 L/h。
样品处理:称取一定质量(30 mg左右)样本,加入300 μL的甲醇混匀,再加入1 000 μL甲基叔丁基醚,混匀,振摇提取1 h。加入250 μL去离子水,充分振荡10 s,12 000 r/min、4 ℃离心5 min。取上层溶液100 μL,置于1.5 mL离心管中,真空离心浓缩吹干。1 000 μL V(异丙醇)∶V(乙腈)=1∶1复溶(含内标),复溶液加入插有内衬管的2 mL进样瓶中,待测。
1.4 实验方法
以粉状酵母细胞壁为原料,先使用不同溶剂对细胞壁进行粗提,再利用正己烷对磷脂类溶解性强,丙酮对磷脂溶解性差但能溶解其他油脂和游离脂肪酸的性质对磷脂进行纯化,设计如图1的提取步骤。实验主要针对第一步有机溶剂萃取工艺进行了研究。
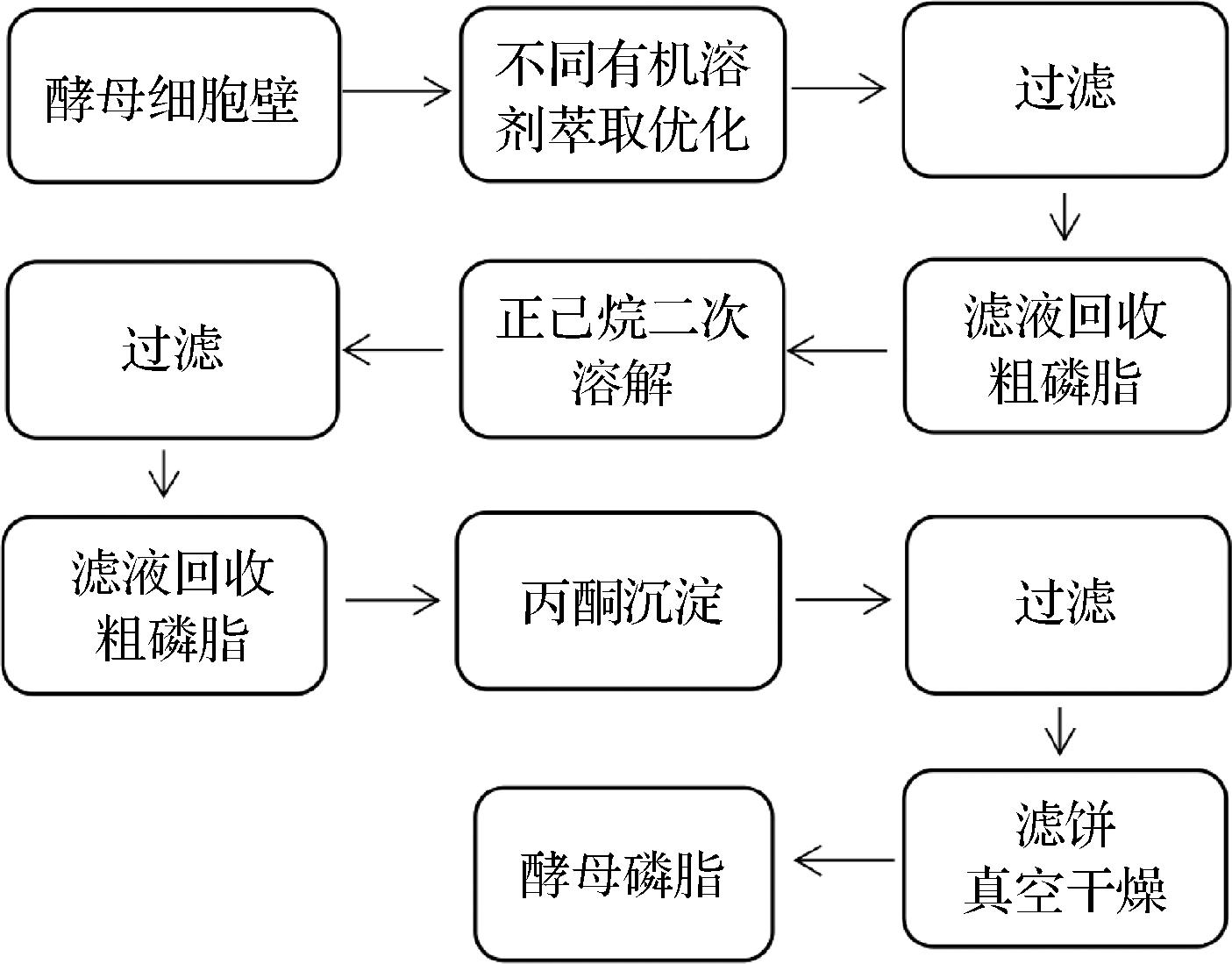
图1 酵母磷脂制备工艺设计
Fig.1 Preparation process design of yeast phospholipids
1.4.1 不同提取溶剂的筛选
氯仿/甲醇是经典的提取磷脂方法,但由于2种溶剂均有较大毒性,不能在食品领域使用,实验设计了对照组采用这种方式提取,与常规溶剂的提取效率做比较。为方便对比分析,提取溶剂按照极性分成高极性和低极性两组,低极性溶剂组包括石油醚、正己烷、环己烷、乙酸乙酯,高极性溶剂组包括乙醇、异丙醇、正丁醇。
对照组提取工艺:称取30 g酵母细胞壁,加入225 mL氯仿-甲醇(料液比1∶7.5,g∶mL)中,20 ℃下超声波处理40 min。将超声波处理后的料液置于磁力搅拌器上搅拌10 h。布氏漏斗抽滤,收集滤饼即为残留的酵母细胞壁,于鼓风干燥箱烘干至恒重,称质量,检测提取前后酵母细胞壁粗脂肪及总磷含量。
实验组提取工艺:分别称取30 g酵母细胞壁,各加入225 mL石油醚、正己烷、环己烷、乙酸乙酯、乙醇、异丙醇、正丁醇(料液比1∶7.5,g∶mL)中,密封,80 ℃试色机中保温提取4 h。布氏漏斗抽滤,收集滤饼即为残留的酵母细胞壁,于鼓风干燥箱烘干至恒重,称质量,检测提取前后酵母细胞壁粗脂肪及总磷含量。
1.4.2 不同料液比影响
分别称取60、40、30、24、20 g酵母细胞壁,加入300 mL乙醇中,80 ℃试色机中保温提取4 h。布氏漏斗抽滤,收集滤饼即为残留的酵母细胞壁,于鼓风干燥箱烘干至恒重,称重,检测提取前后酵母细胞壁粗脂肪及总磷含量。
1.4.3 混合溶剂提取影响
单一溶剂提取酵母细胞壁中磷脂效果较差,因此考察不同高、低极性溶剂提取细胞壁中磷脂的效率,筛选出最佳提取溶剂组合。
称取30 g酵母细胞壁,加入150 mL乙醇中,80 ℃试色机中保温提取2 h,布氏漏斗抽滤,收集滤饼,继续加入150 mL石油醚,80 ℃试色机中保温提取2 h,布氏漏斗抽滤,再次收集滤饼即为残留的酵母细胞壁;另称取30 g酵母细胞壁,加入300 mL(乙醇∶石油醚=1∶1,体积比)混合溶剂中,80 ℃试色机中保温提取4 h,布氏漏斗抽滤,收集滤饼即为残留的酵母细胞壁。两组残留酵母细胞壁于鼓风干燥箱分别烘干至恒重,称重,检测提取前后酵母细胞壁粗脂肪及总磷含量。
1.4.4 酵母磷脂的制备
基于萃取条件的优化,对酵母磷脂进行制备:称取2 500 g酵母细胞壁,加入12 500 mL乙醇中,80 ℃试色机中保温提取2 h,布氏漏斗抽滤,收集滤液1,滤饼即为残留酵母细胞壁,继续向滤饼中加入12 500 mL石油醚,80 ℃试色机中保温提取2 h,布氏漏斗抽滤,收集滤液2。滤液1和滤液2分别于45~50 ℃浓缩至黏稠膏状物,对溶剂进行回收,膏状物即为粗酵母磷脂,两组粗酵母磷脂进行混合后,按照料液比1∶3(g∶mL)加入正己烷进行溶解,过滤留上清液,滤液于45~50 ℃浓缩至黏稠膏状物,即纯化后的粗酵母磷脂,再按照料液比1∶3加入冷丙酮(-20 ℃)并搅拌30 min,沉淀酵母磷脂后过滤,滤饼用少量丙醇重复洗涤2次后,在常温下抽真空10 h,去除溶剂残留,40 ℃左右真空干燥即制备得高纯度酵母磷脂。对酵母磷脂组分进行分析。
2 结果与分析
2.1 酵母细胞壁组成
实验用酵母细胞壁来源于酿酒酵母CCTCC M2016418,对其主要组分进行了检测,其中β-葡聚糖含量(质量分数,下同)37.10%,甘露寡糖含量28.23%,蛋白质含量16.29%,粗脂肪含量12.50%,麦角甾醇含量2.18%,其他组分3.71%,另外还检测了酵母细胞壁中磷含量为0.125%。
2.2 不同溶剂的筛选
如表2所示,低极性溶剂组提取显示粗脂肪提取率为40%左右,无显著差异,而磷脂相对提取率最高为石油醚提取,提取率为24.05%;高极性溶剂组提取结果中显示粗脂肪提取率和磷脂提取率最高均为乙醇提取,提取率分别为73.92%、18.39%。粗脂肪的提取率并不能够准确的反映磷脂的提取效果,二者存在差异,说明酵母细胞壁脂肪组成中不仅含有磷脂,还含有大量其他类型的脂肪。经典的氯仿/甲醇提取磷脂方法在常温下酵母磷元素提取率只有4.48%,因此常见的氯仿/甲醇常温提取法不适用在酵母细胞壁上。推测以乙醇-石油醚高低极性搭配进行萃取,效果可能会更好。
表2 不同溶剂对粗脂肪和磷提取率的影响
Table 2 Effects of different solvents on extraction rates of crude fat and phosphorus
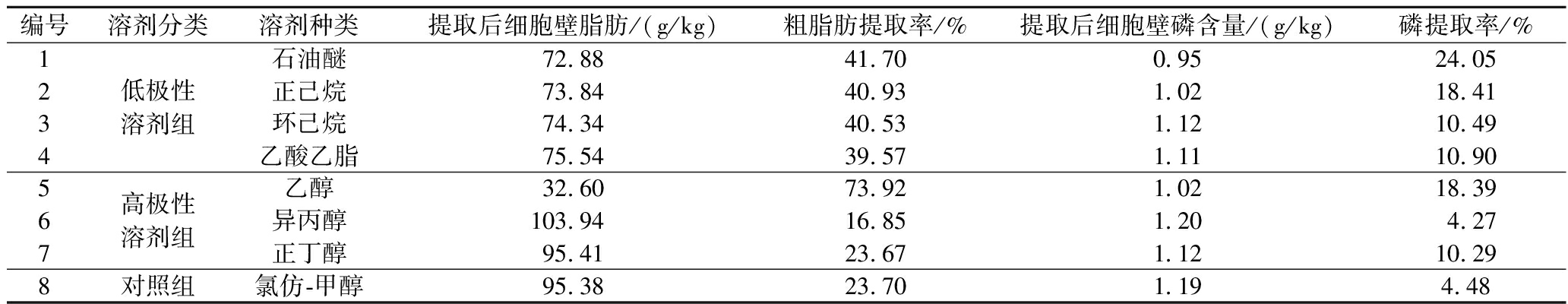
编号溶剂分类溶剂种类提取后细胞壁脂肪/(g/kg)粗脂肪提取率/%提取后细胞壁磷含量/(g/kg)磷提取率/%1234低极性溶剂组石油醚72.88 41.70 0.95 24.05正己烷73.84 40.93 1.02 18.41环己烷74.34 40.53 1.12 10.49乙酸乙脂75.54 39.57 1.11 10.90567高极性溶剂组乙醇32.60 73.92 1.02 18.39异丙醇103.94 16.85 1.20 4.27正丁醇95.41 23.67 1.12 10.298对照组氯仿-甲醇95.38 23.70 1.19 4.48
2.3 不同料液比的影响
如表3所示,乙醇作为单一溶剂提取,粗脂肪提取率随着料液比的增加而不断增加,当料液比达到1∶15(g∶mL)时,粗脂肪提取率达到79.85%。磷的提取率随着料液比的增加呈现先升高再降低的趋势,当料液比为1∶10(g∶mL)时,磷提取率达到最高为22.66%,分析增加溶剂量可提高溶解与析出,而当提取能力达到饱和后,磷脂含量不再增加,且溶剂量多,磷脂性质不稳定(水解或氧化),导致磷脂提取率下降。从乙醇单一溶剂提取结果看来,料液比在提取中影响率不显著,磷脂提取率总体偏低,可以尝试不同高极性溶剂和高低极性溶剂搭配提取。
表3 不同料液比对粗脂肪和磷提取率的影响
Table 3 Effects of solid-liquid ratio on extraction rates of crude fat and phosphorus
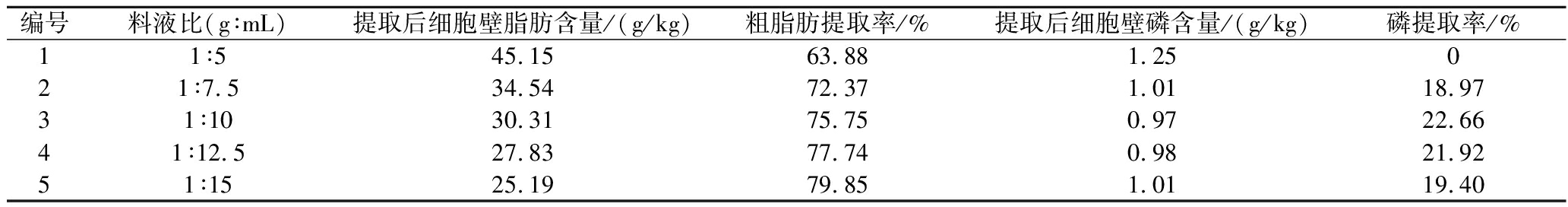
编号料液比(g∶mL)提取后细胞壁脂肪含量/(g/kg)粗脂肪提取率/%提取后细胞壁磷含量/(g/kg)磷提取率/%11∶545.1563.881.25021∶7.534.5472.371.0118.9731∶1030.3175.750.9722.6641∶12.527.8377.740.9821.9251∶1525.1979.851.0119.40
2.4 混合溶剂提取影响
如表4所示,先采用乙醇提取,再用石油醚提取效果优于单一或混合溶剂提取,在该工艺条件下,酵母细胞壁中粗脂肪提取率达到最高,为82.55%,磷提取率也达到最高,为31.09%。
表4 混合溶剂提取对粗脂肪和磷提取率的影响
Table 4 Effects of mixed solvent on extraction rates of crude fat and phosphorus

编号混合溶剂提取提取后细胞壁脂肪含量/(g/kg)粗脂肪提取率/%提取后细胞壁磷含量/(g/kg)磷提取率/%1乙醇-石油醚先后提取21.8182.550.8631.092乙醇-石油醚混合提取53.1357.500.9722.39
2.5 酵母磷脂组成分析
参照1.4.4节的方法对酵母细胞壁中磷脂进行提取和制备,得到高纯度酵母磷脂样品,并与市售大豆磷脂进行对比检测和分析。由于酵母磷脂与大豆磷脂样品在磷脂含量上存在差异,脂肪酸和单一磷脂的绝对含量不具有可比性,因此采用单一脂肪酸占检测总脂肪酸比例(简称:单一脂肪酸占比)和单一磷脂占检测总磷脂比例(简称:单一磷脂占比)进行分析,另外考虑到大豆磷脂和酵母磷脂中的主要成分均为PC、PE和鞘磷脂(sphingomyelin, SM),因此重点对PC、PE及SM相关组分进行了检测和分析。
如表5所示,酵母磷脂中饱和脂肪酸占比为15.52%,主要包含棕榈酸甲酯和硬酯酸甲酯,对比大豆磷脂中饱和脂肪酸占比为9.92%。酵母磷脂中单不饱和脂肪酸占比为82.64%,主要成分是棕榈油酸甲酯和油酸甲酯,对比大豆磷脂中单不饱和脂肪酸占比为64.93%,主要成分是油酸甲酯。酵母磷脂中多不饱和脂肪酸占比为1.84%,对比大豆磷脂中多不饱和脂肪酸占比为25.15%,主要成分是亚油酸甲酯。综上,大豆磷脂中多不饱和脂肪酸含量是酵母磷脂的13.67倍,而酵母磷脂中单不饱和脂肪酸含量是大豆磷脂的1.27倍,基于脂肪酸组成上的差异,磷脂的应用效果上会有不同。
表5 酵母磷脂和大豆磷脂的脂肪酸组成
Table 5 Fatty acid composition of phospholipids from yeast and soybean
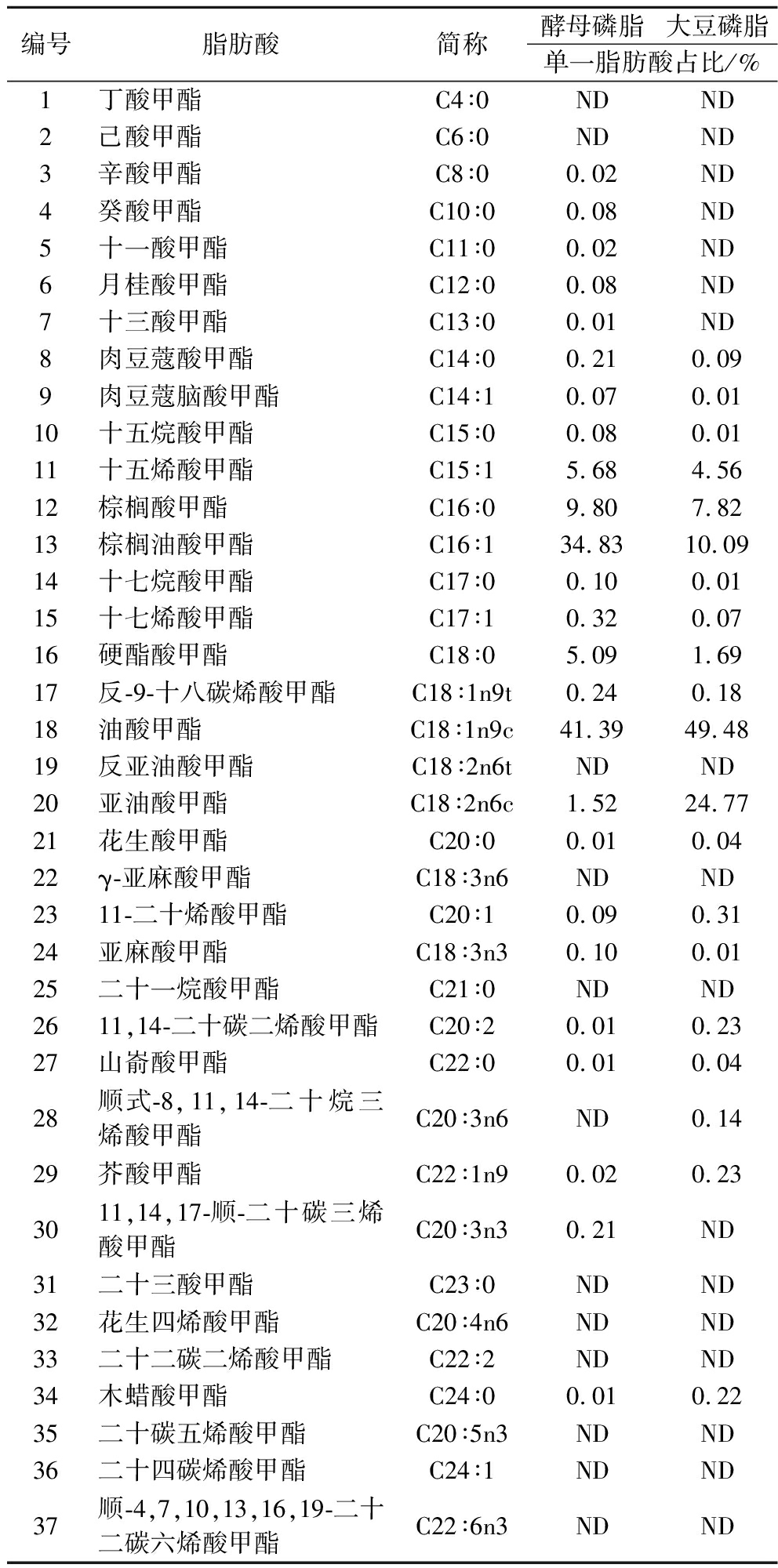
编号脂肪酸简称酵母磷脂大豆磷脂单一脂肪酸占比/%1丁酸甲酯C4∶0NDND2己酸甲酯C6∶0NDND3辛酸甲酯C8∶00.02ND4癸酸甲酯C10∶00.08ND5十一酸甲酯C11∶00.02ND6月桂酸甲酯C12∶00.08ND7十三酸甲酯C13∶00.01ND8肉豆蔻酸甲酯C14∶00.210.099肉豆蔻脑酸甲酯C14∶10.070.0110十五烷酸甲酯C15∶00.080.0111十五烯酸甲酯C15∶15.684.5612棕榈酸甲酯C16∶09.807.8213棕榈油酸甲酯C16∶134.8310.0914十七烷酸甲酯C17∶00.100.0115十七烯酸甲酯C17∶10.320.0716硬酯酸甲酯C18∶05.091.6917反-9-十八碳烯酸甲酯C18∶1n9t0.240.1818油酸甲酯C18∶1n9c41.3949.4819反亚油酸甲酯C18∶2n6tNDND20亚油酸甲酯C18∶2n6c1.5224.7721花生酸甲酯C20∶00.010.0422γ-亚麻酸甲酯C18∶3n6NDND2311-二十烯酸甲酯C20∶10.090.3124亚麻酸甲酯C18∶3n30.100.0125二十一烷酸甲酯C21∶0NDND2611,14-二十碳二烯酸甲酯C20∶20.010.2327山嵛酸甲酯C22∶00.010.0428顺式-8,11,14-二十烷三烯酸甲酯C20∶3n6ND0.1429芥酸甲酯C22∶1n90.020.233011,14,17-顺-二十碳三烯酸甲酯C20∶3n30.21ND31二十三酸甲酯C23∶0NDND32花生四烯酸甲酯C20∶4n6NDND33二十二碳二烯酸甲酯C22∶2NDND34木蜡酸甲酯C24∶00.010.2235二十碳五烯酸甲酯C20∶5n3NDND36二十四碳烯酸甲酯C24∶1NDND37顺-4,7,10,13,16,19-二十二碳六烯酸甲酯C22∶6n3NDND
注:ND表示未检出(下同)。
如表6所示,酵母磷脂中含有38种PC分子, 其中PC 36∶1和PC 34∶2占比分别达到17.45‰和14.06‰,总PC占比达到61.27‰,对比大豆磷脂中含有56种PC分子,其中PC 36∶4、PC 34∶2、PC 36∶2、PC 36∶3 占比分别为30.12‰、26.65‰、20.68‰、19.83‰,总PC占比达到134.72‰;酵母磷脂中含有12种PE分子, 其中PE 34∶2、PE 34∶1、PE 36∶2占比分别达到202.28‰、55.14‰、43.45‰,总PE占比达到327.52‰,对比大豆磷脂中含有16种PE分子,其中PE 34∶2和PE 36∶4占比分别为79.62‰和66.73‰,总PE占比达到225.36‰。因此从PC和PE的组成看,大豆磷脂中种类更丰富,大豆磷脂中PC含量是酵母磷脂的2.19倍,酵母磷脂中PE含量是大豆磷脂的1.45倍,具体到单一磷脂,大豆磷脂和酵母磷脂中PE 34∶2含量都是最高的。总LPC和LPE在酵母磷脂和大豆磷脂中占比均较低。
表6 酵母磷脂和大豆磷脂组成
Table 6 The composition of phospholipids from yeast and soybean
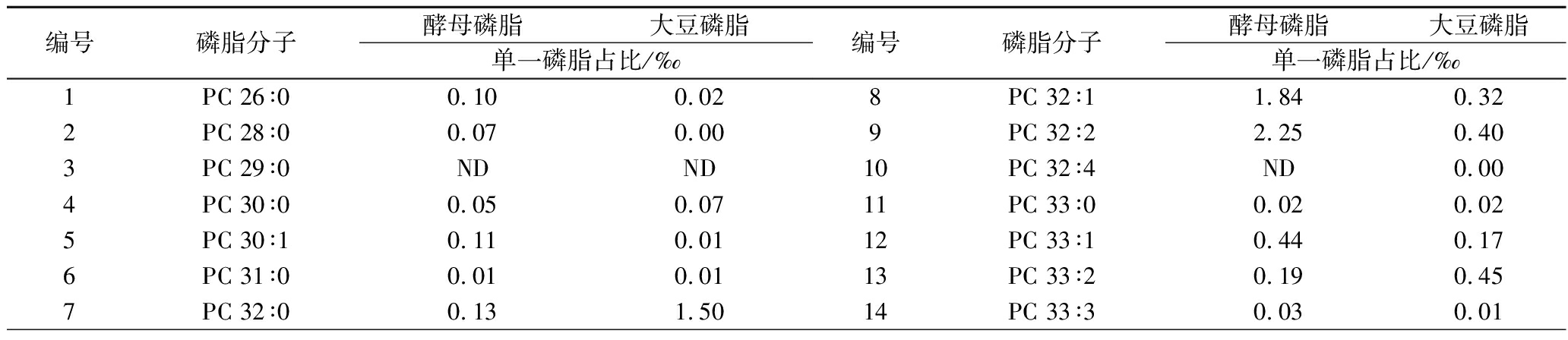
编号磷脂分子酵母磷脂大豆磷脂单一磷脂占比/‰编号磷脂分子酵母磷脂大豆磷脂单一磷脂占比/‰1PC 26∶00.100.022PC 28∶00.070.003PC 29∶0NDND4PC 30∶00.050.075PC 30∶10.110.016PC 31∶00.010.017PC 32∶00.131.508PC 32∶11.840.329PC 32∶22.250.4010PC 32∶4ND0.0011PC 33∶00.020.0212PC 33∶10.440.1713PC 33∶20.190.4514PC 33∶30.030.01
续表6

编号磷脂分子酵母磷脂大豆磷脂单一磷脂占比/‰编号磷脂分子酵母磷脂大豆磷脂单一磷脂占比/‰15PC 33∶40.140.0316PC 34∶00.970.3517PC 34∶110.1710.4318PC 34∶214.0626.6519PC 34∶30.212.6420PC 34∶40.020.1421PC 34∶5ND0.0122PC 35∶00.050.0023PC 35∶10.580.2224PC 35∶20.320.9825PC 35∶30.070.4226PC 35∶4ND0.1727PC 35∶5ND0.0428PC 36∶01.30ND29PC 36∶117.453.6830PC 36∶28.2220.6831PC 36∶31.1319.8332PC 36∶40.2330.1233PC 36∶50.0311.1834PC 36∶6ND1.5735PC 37∶0NDND36PC 37∶10.080.0137PC 37∶20.040.0838PC 37∶3ND0.2339PC 37∶4ND0.0740PC 37∶5ND0.0141PC 37∶6ND0.0042PC 38∶0NDND43PC 38∶10.200.0244PC 38∶20.550.6145PC 38∶30.020.5746PC 38∶4ND0.3347PC 38∶50.010.0548PC 38∶6ND0.0049PC 38∶70.020.0250PC 38∶8ND0.0851PC 39∶2ND0.0452PC 39∶3ND0.0153PC 40∶0ND0.0154PC 40∶1ND0.0555PC 40∶20.030.2156PC 40∶3ND0.0357PC 40∶4ND0.0058PC 41∶2ND0.0659PC 42∶10.10ND60PC 42∶20.010.0861PC 42∶3ND0.0162PE 34∶01.590.0363PE 34∶155.1415.3464PE 34∶2202.2879.6265PE 34∶3-20.657.0366PE 35∶11.240.1367PE 35∶21.360.4568PE 36∶00.47ND69PE 36∶116.911.1970PE 36∶243.4518.9671PE 36∶3-12.4324.2972PE 36∶41.3166.7373PE 36∶5-2ND9.7074PE 36∶6ND0.9475PE 38∶1NDND76PE 38∶20.700.3777PE 38∶3-1ND0.3778PE 38∶4-3ND0.1779PE 38∶5-1NDND80PE 38∶6NDND81PE 39∶6NDND82PE 40∶3ND0.0583LPE 16∶02.062.4184LPE 18∶00.500.2985LPE 18∶110.880.9486LPE 18∶20.485.2187LPE 20∶4NDND88LPE 22∶6NDND89LPC 14∶00.040.0690LPC 15∶0ND0.0291LPC 15∶1ND0.0392LPC 16∶01.084.6493LPC 16∶13.000.1294LPC 16∶2ND0.0295LPC 17∶00.030.0496LPC 17∶10.070.0297LPC 18∶01.111.2598LPC 18∶15.243.0699LPC 18∶20.2619.94100LPC 18∶30.033.53101LPC 19∶00.010.00102LPC 19∶1ND0.01103LPC 20∶0ND0.03104LPC 20∶10.050.04105LPC 20∶2ND0.02106LPC 22∶0ND0.02107LPC 24∶0ND0.01108SM 35∶0ND0.24109SM 35∶1NDND110SM 35∶2NDND111SM 36∶019.771.34112SM 36∶114.162.20113SM 36∶2ND0.29114SM 37∶11.652.04115SM 37∶2ND1.09116SM 38∶0208.4553.77117SM 38∶1174.03128.75118SM 38∶2ND12.40119SM 38∶3ND0.62120SM 38∶4ND0.03121SM 39∶12.824.10122SM 39∶20.262.22123SM 40∶1135.97105.36124SM 40∶213.5591.28125SM 40∶31.83170.31126SM 40∶5ND6.99
续表6
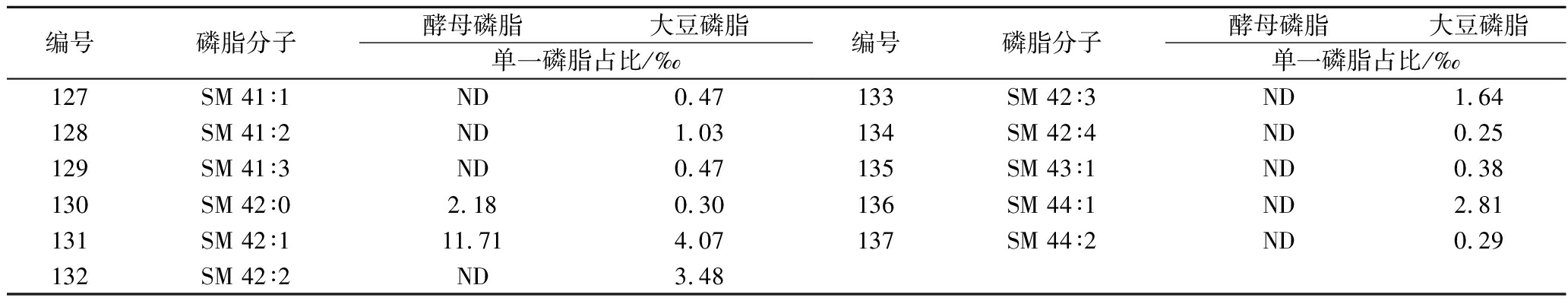
编号磷脂分子酵母磷脂大豆磷脂单一磷脂占比/‰编号磷脂分子酵母磷脂大豆磷脂单一磷脂占比/‰127SM 41∶1ND0.47128SM 41∶2ND1.03129SM 41∶3ND0.47130SM 42∶02.180.30131SM 42∶111.714.07132SM 42∶2ND3.48133SM 42∶3ND1.64134SM 42∶4ND0.25135SM 43∶1ND0.38136SM 44∶1ND2.81137SM 44∶2ND0.29
注:LPC,溶血磷脂酰胆碱;LPE,溶血磷脂酰乙醇胺。
从SM组成看,酵母磷脂中含有12种SM,其中SM 38∶0、SM 38∶1和SM 40∶1占比分别达到208.45‰、174.03‰和135.97‰,对比大豆磷脂中含有28种SM,其中SM40∶3、SM38∶1和SM40∶1占比分别为170.31‰、128.75‰和105.36‰。从总SM占比看,大豆磷脂和酵母磷脂相当,但大豆磷脂中SM组成较丰富。
酵母磷脂作为一种微生物源磷脂,相对于大豆磷脂拥有自己的优势:一是酵母作为微生物,生长周期短,工业化技术成熟,是一种高效、可持续的磷脂来源;二是酵母生长环境可控,在固定的酵母菌种、培养基、培养条件下,不同生产批次间酵母磷脂组分差异小,质量更稳定,而大豆生长的自然环境和质量不可控;三是通过菌种选育或发酵过程的代谢调控,酵母可以向富集某一种或某一类磷脂进行转化,满足差异化市场需求,而大豆优良品种选育周期长,生长过程调控难;四是大豆磷脂应用研究已比较全面,但酵母磷脂的应用研究尚是空白,可以针对酵母源磷脂或其中的优势磷脂组分开展医药、食品、化妆品、饲料等领域的应用研究,开发更多的产品配方和应用方案,拓展更多的应用领域。
3 总结
本研究建立了从酿酒酵母CCTCC M2016418中制备磷脂的工艺路线,得到了酵母磷脂,由于酵母细胞结构均类似,其他类型酵母中磷脂提取和制备工艺可以借鉴。组成分析结果表明,酵母磷脂组成与大豆磷脂不同,酵母磷脂中单不饱和脂肪酸的质量分数是大豆磷脂的1.27倍,大豆磷脂中多不饱和脂肪酸的质量分数是酵母磷脂13.67倍,大豆磷脂中PC质量分数是酵母磷脂的2.19倍,酵母磷脂中PE质量分数是大豆磷脂的1.45倍。预示着二者在应用效果上会存在差异,同时不同类型的酵母和发酵工艺,会导致细胞中磷脂组分发生改变,值得后续开展进一步的研究。
[1] 冉世前, 朱云芬, 徐淑玲, 等.磷脂结构、膳食来源及营养学研究进展[J].中国油脂, 2022, 47(1):68-74;88.RAN S Q, ZHU Y F, XU S L, et al.Progress on structure, dietary source and nutrition of phospholipid[J].China Oils and Fats, 2022, 47(1):68-74;88.
[2] JIA W, LI R T, WU X X, et al.UHPLC-Q-Orbitrap HRMS-based quantitative lipidomics reveals the chemical changes of phospholipids during thermal processing methods of Tan sheep meat[J].Food Chemistry, 2021, 360:130153.
[3] WU Y, CHEN Z, DARWISH W S, et al.Choline and ethanolamine plasmalogens prevent lead-induced cytotoxicity and lipid oxidation in HepG2 cells[J].Journal of Agricultural and Food Chemistry, 2019, 67(27):7716-7725.
[4] WANG S, MA R, ZHANG H Y, et al.Construction of a high affinity aptamer and an aptasensor with chitosan oligosaccharide-AuNPs@Fe2+ nanozyme for highly sensitive detection of phosphatidylserine[J].Sensors and Actuators B:Chemical, 2022, 362:131800.
[5] ZHANG T T, XU J, WANG Y M, et al.Health benefits of dietary marine DHA/EPA-enriched glycerophospholipids[J].Progress in Lipid Research, 2019, 75:100997.
[6] 吴劲轩, 夏文银, 夏川林, 等.磷脂与食品中蛋白质相互作用机制及对蛋白质特性的影响研究进展[J].食品工业科技, 2020, 41(17):345-351.WU J X, XIA W Y, XIA C L, et al.Interaction mechanism between phospholipids and food proteins and effect on protein properties:A review[J].Science and Technology of Food Industry, 2020, 41(17):345-351.
[7] 雷梦琳, 白卫东, 刘静宜, 等.磷脂降解对食品风味影响的研究进展[J].食品科技, 2021, 46(1):62-68.LEI M L, BAI W D, LIU J Y, et al.Research progress on effect of phospholipid degradation on food flavor[J].Food Science and Technology, 2021, 46(1):62-68.
[8] YIN H, QIANG J, JIA Y, et al.Characteristics of biosurfactant produced by Pseudomonas aeruginosa S6 isolated from oil-containing wastewater[J].Process Biochemistry, 2009, 44(3):302-308.
[9] 陈云波, 潘凤, 杨深鹏, 等.氢化卵磷脂在化妆品中的应用[J].广东化工, 2018, 45(5):152-153, 138.CHEN Y B, PAN F, YANG S P, et al.Research progress of hydrogenated lecithin[J].Guangdong Chemical Industry, 2018, 45(5):152-153, 138.
[10] 张玉, 龚埜, 李文飞, 等.饲料磷脂水平对乌鳢幼鱼生长性能、抗氧化能力及脂肪沉积的影响[J].广东海洋大学学报, 2023, 43(6):9-18.ZHANG Y, GONG Y, LI W F, et al.Effects of dietary phospholipid level on growth performance, antioxidant capacity and fat deposition of juvenile snakehead(Channa argus)[J].Journal of Guangdong Ocean University, 2023, 43(6):9-18.
[11] 袁融, 满敦蕊, 石伟帅, 等.饲料磷脂水平对中华绒螯蟹仔蟹存活、生长、消化酶活性、生化指标及Neverland基因表达的影响[J].饲料工业, 2023, 44(20):66-74.YUAN R, MAN D R, SHI W S, et al.Effects of dietary phospholipid levels on the survival, growth, digestive enzyme activity, biochemical indicators and neverland expression of Eriocheir sinensis[J].Feed Industry, 2023, 44(20):66-74.
[12] CARMAN G M, HAN G S.Regulation of phospholipid synthesis in yeast[J].Journal of Lipid Research, 2009, 50(Suppl):S69-S73.
[13] JANSSEN M J, KOORENGEVEL M C, DE KRUIJFF B, et al.The phosphatidylcholine to phosphatidylethanolamine ratio of Saccharomyces cerevisiae varies with the growth phase[J].Yeast, 2000, 16(7):641-650.
[14] KLOSE C, SURMA M A, GERL M J, et al.Flexibility of a eukaryotic lipidome:Insights from yeast lipidomics[J].PLoS One, 2012, 7(4):e35063.
[15] TULLER G, NEMEC T, HRASTNIK C, et al.Lipid composition of subcellular membranes of an FY1679-derived haploid yeast wild-type strain grown on different carbon sources[J].Yeast, 1999, 15(14):1555-1564.
[16] GASPAR M L, AREGULLIN M A, JESCH S A, et al.Inositol induces a profound alteration in the pattern and rate of synthesis and turnover of membrane lipids in Saccharomyces cerevisiae[J].The Journal of Biological Chemistry, 2006, 281(32):22773-22785.
[17] 廖灿青, 周小辉, 徐云强, 等.酵母细胞壁来源、作用机理及在动物养殖中的应用[J].中国饲料, 2024(7):168-172.LIAO C Q, ZHOU X H, XU Y Q, et al.Origin, mechanism and application of yeast cell wall in animal culture[J].China Feed, 2024(7):168-172.