糖尿病是一种由胰岛素分泌或作用不足而引起的全身性代谢疾病,多伴随着血管病变,诱发血管内皮细胞功能性损伤[1]。血管内皮细胞是血管腔内的细胞亚群,它与血液直接接触,对血液各类代谢物质/第一信使具有高敏感性[2-3]。当血管内皮细胞出现损伤,表层细胞结构被破坏,机体会迅速启动免疫应答,引发血管内皮细胞一系列生物学特性的改变,加速血管病理进程。近年来,寻找潜在的靶点修复血管内皮细胞功能损伤成为行之有效的方案[4]。国内外学者发现,特殊的补体分子可以与血管发生相互作用[5],在血管功能调节中可能扮演着重要的角色。
C1qa(Component 1, q Subcomponent, A chain)是构成C1q(Component 1, q Subcomponent)补体系统的关键补体亚组分[6],主要集中于胞浆,可参与调控多种血管细胞功能。然而当C1q或其关键组分过度激活,机体或组织将产生病理性损伤。已有研究报道,小鼠肺血管系统中,C1q可以与肺部成纤维细胞相互作用,诱导纤维化基因表达,进而加快小鼠肺纤维化[7]。另外一项研究则揭示,高血压动脉血管中C1qa基因的缺失减弱了血管平滑肌细胞的增殖和动脉病理性重构,有利于缓解高血压患者动脉硬化[8]。以上报道皆证实C1q家族有望成为心血管疾病潜在治疗靶标。但目前关于该补体系统与血管内皮细胞的研究相对较少。
有趣的是,本课题组前期单细胞转录组测序发现[9],糖尿病小鼠主动脉内皮细胞中的C1qa水平较野生型显著增高,这可能与糖尿病血管内皮细胞损伤存在相关性。因此本文通过链脲佐菌素(streptozocin, STZ)诱导糖尿病小鼠模型,利用Western Blot、荧光染色、细胞流式、离体微血管张力实验等,检测糖尿病小鼠主动脉内皮层C1qa的表达水平、活性氧(reactive oxygen species, ROS)水平及主动脉血管段内皮舒张功能。同时,通过分子模拟软件遴选出补体分子C1qa的食源性抑制剂,即五没食子酰葡萄糖(1,2,3,4,6-O-pentagalloylglucose, PGG),研究PGG对糖尿病血管内皮细胞损伤的影响,并探究潜在机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级C57BL6/J雄性小鼠40只,8周龄,体重20~25 g,浙江维通利华实验动物技术有限公司。动物实验严格遵守江南大学实验动物中心制定的标准文件,伦理审核已通过,编号为JN.NO20230330c0481015[095]。
1.1.2 主要试剂
STZ、增强型化学发光液(enhanced chemiluminescence,ECL),上海翊圣生物科技有限公司;柠檬酸、柠檬酸钠,国药集团化学试剂有限公司;DCFH-DA(2′, 7-dichlorofluorescein diacetate)活性氧试剂盒、BCA蛋白浓度测定试剂盒,碧云天生物技术有限公司;单克隆C1qa抗体、单克隆NOX2抗体,Abcam公司;多克隆NOX4抗体,美国Proteintech公司;内皮细胞培养基(endothelial cell medium, ECM),美国Sciencell公司;胶原酶Type Ⅰ A、C1qa补体蛋白、乙酰胆碱,美国Sigma公司;肾上腺素,英国Tocris bioscience公司;β-五没食子酰葡萄糖,上海麦克林生化科技股份有限公司。
1.1.3 仪器与设备
FORMA STERl-CYCLE i160细胞培养箱,美国Thermo Scientific公司;Zeiss LSM880倒置激光共聚焦显微镜,德国卡尔蔡司股份公司;Bio-Rad垂直电泳仪,南京康维达生物科技有限公司;Tanon-5200Multi全自动凝胶成像分析系统,上海天能科技有限公司;BSC-1004IIA2生物安全柜,苏州安泰空气技术有限公司;XMTD-8222水浴摇床,上海一恒科学仪器有限公司;DMT 620M血管张力测定仪,丹麦Danish Myo Technology公司;BD Reforest Cell Analyzer流式细胞分析仪,美国碧迪公司;2018 Discovery Studio分子模拟软件,美国BIOVIA公司。
1.2 分子模拟软件遴选活性分子
参照LIU等[10]的方法,并略做调整。PDB数据库中下载C1qa蛋白的晶体结构,导入至Discovery Studio分子模拟软件。对接前,须去除多余配体,保证C1qa蛋白结构完整,不含无效连接。蛋白对接过程在“Chemistry”工具栏进行,首先找到蛋白空隙,然后点击“Define Site”选项中的“Change Site Size”,使蛋白晶体所有的结合位点暴露,先后打开这些位点,将半径设置为10。最后点击快速对接选项“LibDock”,将“Dicking Preferences”设置为“User Specified”,同时“Max Hits to Save”改成10后,即可对接到本课题组构建的天然高分子化合物数据库,对C1qa所有潜在的结合位点进行匹配,完成后导出结果,并通过CAS号检索,汇总对应的物质和评分,整理至Excel。
1.3 糖尿病模型鼠构建
参照DING等[11]的方法,稍加修改,构建糖尿病小鼠模型。将SPF级C57BL6/J雄性小鼠进驻饲养间适应性饲养1周,同步记录初始空腹血糖值(fasting blood glucose, FBG)。饲养过程中,正常对照组(control,CTL)小鼠食用江苏协同生物辐照灭菌实验鼠生长繁殖饲料,产品货号:1010097。饲料主要营养成分包括碳水化合物、氨基酸、矿物质、维生素、粗脂肪等,碳水化合物是主要的供能物质,约占61%。而模型组小鼠提供南通特洛菲公司特制的45%高脂饲料,主要营养成分包括脂肪、蛋白质、碳水化合物,脂肪是最主要的供能物质,占45%。配制0.1 mol/L的柠檬酸-柠檬酸钠缓冲液作为STZ的溶剂,pH 4~4.5为宜。饲养1周后,测得小鼠FBG均值为(7.56±0.34) mmol/L。此时以50 mg/kg的STZ连续5 d对小鼠进行腹腔注射,整个过程需避光,10 min内完成注射为宜,对照组注射等体积柠檬酸缓冲液。每日记录小鼠体重与血糖数据,给药完成稳定24 h,测定小鼠FBG,若FBG>11.1 mmol/L,认定模型构建成功。
1.4 小鼠灌胃活性分子PGG
参照CHAI等[12]的方法,以0.5%(质量分数)羧甲基纤维素钠作溶剂,PGG剂量为20 mg/kg,灌胃糖尿病小鼠。对照组即对糖尿病小鼠灌胃等体积溶剂,连续21 d灌胃,每周记录1次FBG值,观察血糖值的变化情况。
1.5 小鼠主动脉内皮细胞的分离
参照ZHOU等[13]的方法,并稍加修改。生物安全柜提前紫外灭菌30 min,将所用到的ECM、pH=7.4的PBS等试剂同步放置到安全柜操作台上灭菌。首先用CO2将小鼠处死,注意无菌操作,打开小鼠胸腔,取小鼠胸主动脉,置于提前预冷的无菌PBS中。在生物安全柜中,将主动脉转移至无菌培养皿中,PBS清洗2次,去除血渍。洗净的主动脉转至含2 mL 2 mol/L胶原酶的无菌离心管中,充分剪碎混匀,37 ℃水浴振荡消化20 min,常温1 200 r/min离心5 min,观察到粉红色沉淀。安全柜中去除上清液,加入1 mL ECM重悬沉淀,均匀接种至6孔板中,于5% CO2、37 ℃恒温箱培养,2 h后更换新鲜ECM,继续培养至6孔板中的细胞密度不低于80%即可进行后续实验。
1.6 小鼠主动脉内皮细胞的鉴定
参照TAREK等[14]的方法,并稍加修改。如1.5节所述,6孔板中主动脉细胞密度到80%密度左右,PBS清洗后,用胰酶消化,接种到24孔板中的玻璃爬片,等待24 h让细胞充分生长。取出细胞后用PBS清洗,4%(质量分数)多聚甲醛室温固定30 min。固定完毕,PBS清洗2次,加入0.1%(体积分数)Triton X-100和5%(质量分数)牛血清白蛋白,常温通透封闭1 h,转至4 ℃过夜孵育CD31抗体(1∶200配制,体积比)。过夜后,二抗(AF-488)室温避光孵育2 h(1∶200配制,体积比)。最后1∶1 000(体积比)配制4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)定位细胞核,室温避光孵育10 min。PBS适当清洗后,将玻璃爬片放至共聚焦小皿中,倒置激光共聚焦显微镜下拍摄。
1.7 流式细胞仪检测主动脉内皮细胞ROS水平
参照CAO等[15]的方法,并稍加修改。6孔板中的小鼠主动脉内皮细胞长至80%密度及以上,加入10 μg/mL的C1qa补体蛋白,37 ℃恒温培养箱孵育30 min,对照组不处理。30 min后,PBS清洗1遍细胞,随即再用胰酶消化,无菌EP管收集细胞。无血清基本培养基与DCFH-DA活性氧试剂按照1 000∶1(体积比)的比例混合即得到工作液,1 mL工作液重悬细胞,37 ℃恒温培养箱孵育20 min,每5 min混匀1次。离心收集细胞,PBS清洗2次后弃上清液。1 mL PBS重悬,流式细胞仪进行检测,激发波长488 nm,细胞数目统一为104个,比较刺激前后ROS的生成水平。
1.8 倒置激光共聚焦检测内皮细胞ROS水平
参照CAO等[15]的方法,并稍加修改。无菌玻璃爬片提前放入24孔板,将长满细胞的6孔板用PBS清洗1遍,消化收集细胞,用适量ECM重悬,等体积加入孔板中的玻璃爬片,置于5% CO2、37 ℃恒温箱培养24 h。加入10 μg/mL的C1qa补体蛋白,37 ℃恒温培养箱孵育30 min,对照组不处理。用PBS按照1 000∶1(体积比)的比例配制DCFH-DA工作液,于37 ℃恒温培养箱染色15 min,激发波长488 nm处拍ROS荧光图。全过程避光操作,避免荧光猝灭。
1.9 细胞蛋白的提取
参照TAREK等[14]的方法,并稍加修改。待6孔板中的细胞长至80%及以上,对照组不做处理,实验组分别加入10 μg/mL C1qa补体蛋白、20 μmol/L的PGG共混10 μg/mL的C1qa在37 ℃恒温培养箱孵育30 min,再将6孔板置于冰盒。提前配制细胞裂解液,RIPA(radio immunoprecipitation assay)与苯甲基磺酰氟(phenylmethylsulfonyl fluorid,PMSF)的比例为100∶1(体积比),弃细胞培养液,PBS清洗后加入裂解液,刮板充分刮取细胞,收集在EP管中,4 ℃振荡裂解30 min,以12 000×g的转速离心15 min,吸取上清液即为蛋白溶液。BCA法测定蛋白浓度,用工作液稀释至适当的浓度,加入5×Loading Buffer,100 ℃金属浴10 min加热变性。
1.10 Western Blot实验
参照DING等[11]的方法,并稍加修改。配制10%的分离胶以及5%的浓缩胶,进行蛋白上样。上层浓缩胶参数65 V,35 min,下层分离胶参数115 V,70 min。100 V恒压转膜90 min,再用Tris缓冲盐溶液+吐温-20(Tris buffered saline with Tween-20, TBST)适当清洗以去除膜上残余的甲醇。50 g/L牛血清白蛋白封闭2 h后,4 ℃过夜孵育抗体。第2天,TBST洗膜3次,每次10 min以去除未结合的抗体,接着室温孵育相应属性的二抗,时间为2 h。最后ECL试剂在全自动凝胶成像仪进行发光成像。Image J软件统计条带灰度值。
1.11 离体微血管张力实验
参照ZHOU等[13]的方法,并稍加修改。小鼠用CO2处死,打开小鼠胸腔,取下小鼠胸主动脉。取好的主动脉放在含有Krebs溶液(pH值为7.4)的胶板上,并置于冰上,防止血管活性降低。在显微镜下剔除血管周围多余脂肪及结缔组织,剪成2 mm血管段固定于DMT血管槽内,通95% O2和5% CO2,37 ℃恒温。0 mN张力平衡血管20 min后,调整血管张力为3 mN平衡15~30 min。平衡结束换60 mmol/L K+溶液,刺激5 min后换回Krebs溶液,重复2~3次,用1 μmol/L Phe收缩血管,待血管张力稳定在某一数值左右,加入梯度乙酰胆碱后(10-9、10-8、10-7、10-6、10- 5 μmol/L),观察血管内皮细胞舒张情况。
1.12 统计分析方法
采用Prism 8.0软件对数据进行统计分析及图表制作。组间采用t检验及方差分析进行统计。P值低于0.05水平认为有显著差异,*代表P<0.05,**代表P<0.01,***代表P<0.001,****代表P<0.000 1。
2 结果与分析
2.1 糖尿病小鼠模型的构建
为探究糖尿病小鼠主动脉内皮损伤的机理,通过STZ构建糖尿病小鼠模型。实验流程如图1-a所示。以50 mg/kg的剂量腹腔注射STZ,结果显示,腹腔注射STZ后第6天,模型组平均FBG为(19.92±0.55) mmol/L,大于设定的11.1 mmol/L,模型构建成功。而对照组这一数值仅为(7.78±0.50) mmol/L,2组血糖值出现了显著差异(图1-b)。给药过程中,糖尿病组小鼠的体重较对照组也出现了显著降低(图1-c)。上述结果可能与STZ破坏胰岛细胞,导致模型组小鼠胰岛素分泌障碍,并伴随糖代谢等生理功能紊乱相关[11]。
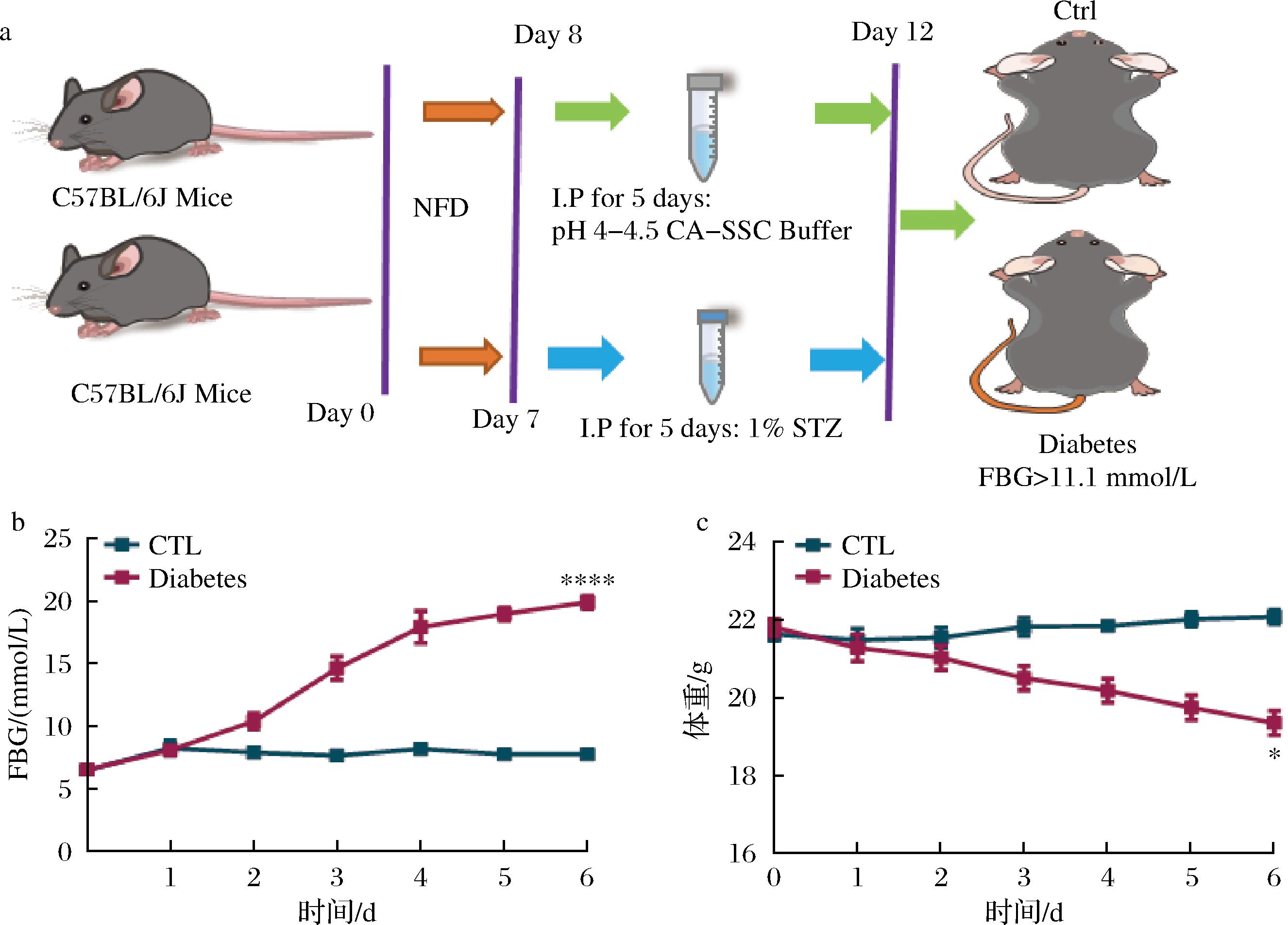
a-实验原理图;b-腹腔注射STZ后小鼠FBG变化(0~6 d);c-腹腔注射STZ后小鼠体重变化(0~6 d)
图1 糖尿病小鼠模型的构建
Fig.1 Construction of diabetic mice
注:CTL-正常对照组;Diabetes-糖尿病组(下同)。
2.2 补体分子C1qa在糖尿病小鼠中的表达水平检测
本实验室前期的小鼠主动脉内皮细胞表达谱测序数据也提示,C1qa的表达随着心血管疾病的发展而增加[16]。因此,本研究对糖尿病小鼠主动脉内皮中C1qa表达情况进行了验证。Western Blot数据显示(图2):与健康小鼠相比,糖尿病小鼠主动脉内皮细胞的C1qa表达显著增高。提示C1qa可能参与糖尿病小鼠主动脉内皮细胞病理过程。
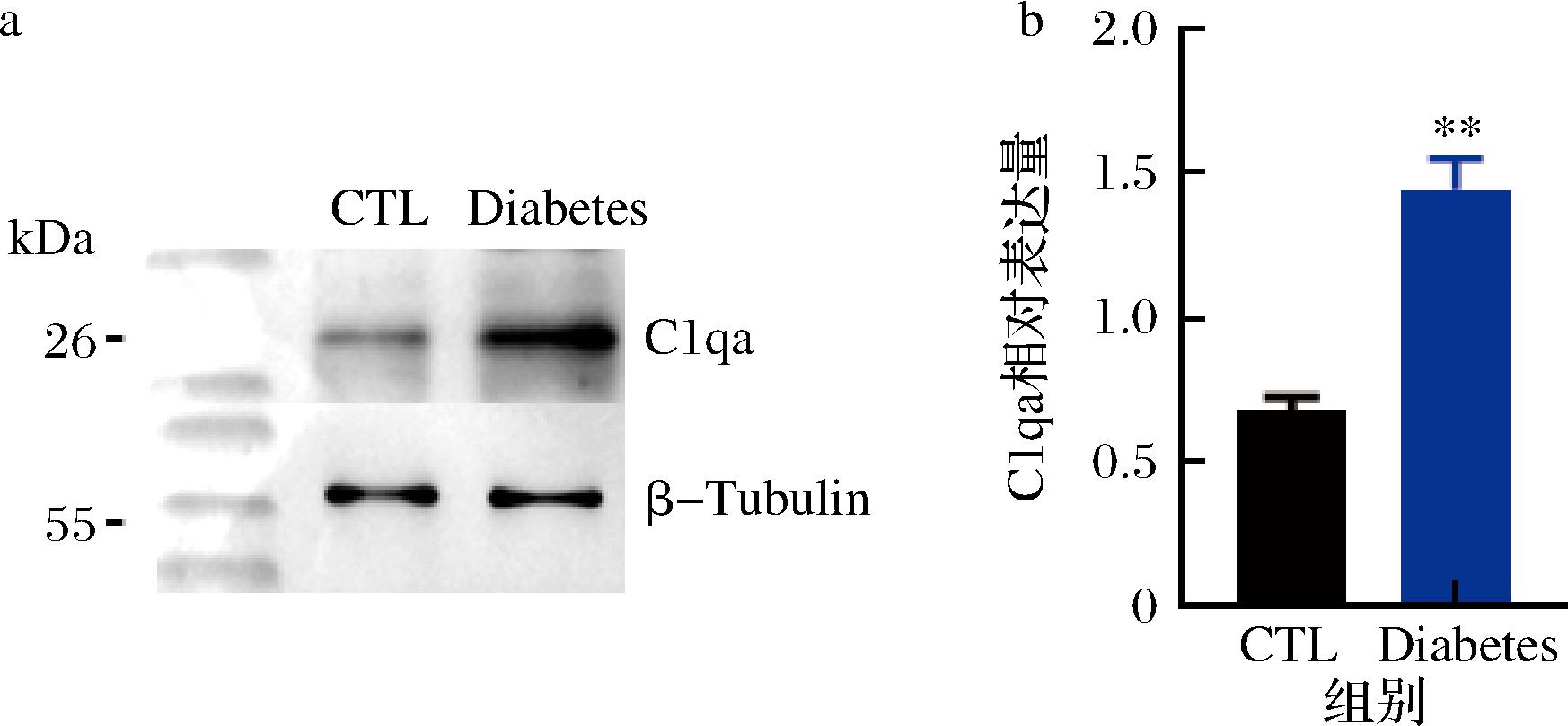
a-补体分子C1qa在正常及糖尿病小鼠主动脉内皮表达水平检测;b-C1qa相对表达量
图2 C1qa 在正常及糖尿病小鼠主动脉内皮层的表达水平
Fig.2 C1qa expression levels in endothelial cells of diabetic mice and normal mice
2.3 补体分子C1qa增强正常主动脉内皮细胞氧化应激
细胞流式结果显示,相较于空白组,正常组与C1qa组的内皮细胞中均有ROS生成,并且产生ROS的细胞数明显增多,ROS峰图的顶点上移,曲线向右偏移(图3-a)。不过,正常组小鼠主动脉内皮细胞产生ROS的细胞数约占总体细胞的(12.64±1.67)%,孵育C1qa后,这一比例显著上升到(50.27±2.92)%(图3-b)。同时,在ROS荧光染色实验中发现,糖尿病小鼠主动脉内皮细胞的ROS含量显著高于正常小鼠(图3-d)。

a-C1qa孵育前后主动脉内皮ROS的生成水平检测;b-ROS生成百分比;c-主动脉内皮细胞的鉴定;d-正常小鼠与糖尿病小鼠主动脉内皮ROS免疫荧光强度及统计图
图3 C1qa对小鼠主动脉内皮ROS生成的影响
Fig.3 Effect of C1qa on ROS production in aortic endothelial cell
上述结果提示,外源C1qa刺激会增加血管内皮细胞ROS的生成,而糖尿病小鼠主动脉内皮层C1qa的显著表达可能伴随着ROS分子过量合成,导致糖尿病内皮ROS水平显著升高。基础的ROS浓度与细胞功能密切相关,过量则会引起细胞内的大分子物质,如DNA、蛋白质的损害[17],还可能影响关键氧化酶通路及其受体的水平,造成糖尿病血管内皮损伤。
2.4 补体分子C1qa损伤主动脉血管段的舒张功能
利用离体微血管张力实验,比较了糖尿病小鼠主动脉、10 μg/mL的C1qa孵育前后的正常小鼠主动脉的血管舒张功能。结果发现(图4),正常小鼠主动脉的舒张功能显著优于糖尿病小鼠主动脉及孵育C1qa后的主动脉。这提示C1qa的激活不仅促使小鼠主动脉内皮细胞产生ROS,同时损伤了血管的内皮舒张功能。而糖尿病组小鼠的主动脉内皮舒张功能减弱最显著,可能是糖尿病血管内皮C1qa高水平表达,促使ROS分子过量生成,氧化应激加重血管内皮损伤。同时一些血管内皮源性松弛因子[18],如NO、内皮依赖性超极化因子等可能会被C1qa抑制,造成主动脉直径和张力自发调节受阻,进而导致内皮舒张减弱。

a-主动脉血管段内皮舒张踪迹图;b-血管舒张率
图4 C1qa对小鼠主动脉内皮舒张功能的影响
Fig.4 Effect of C1qa on aortic diastolic function
注:WT+C1qa-C1qa孵育组。
2.5 靶向补体分子C1qa的食源性抑制剂的遴选与功效验证
由2.3节结果可知,补体分子C1qa激活造成正常血管内皮细胞ROS过量生成,该过程会增加氧化应激,造成内皮细胞损伤[19]。根据C1qa的晶体结构进行分子对接模拟,三维图像结果显示,补体分子C1qa共有14个结合位点,预期有34 056种分子可能与这些位点匹配并结合。
其中, PGG与C1qa对接分数最高,提示该活性分子匹配度最佳(图5-a),对接模拟图像如图5-b所示。通过对PGG以往研究的文献调研,发现该物质主要存在于芍药等具有多酚特性的食物中,具有改善氧化应激、降低血糖等功效[20]。因此推测PGG可能通过靶向抑制C1qa,改善C1qa-ROS激活对血管内皮细胞的损伤效应,起到修复糖尿病内皮细胞功能障碍的作用。
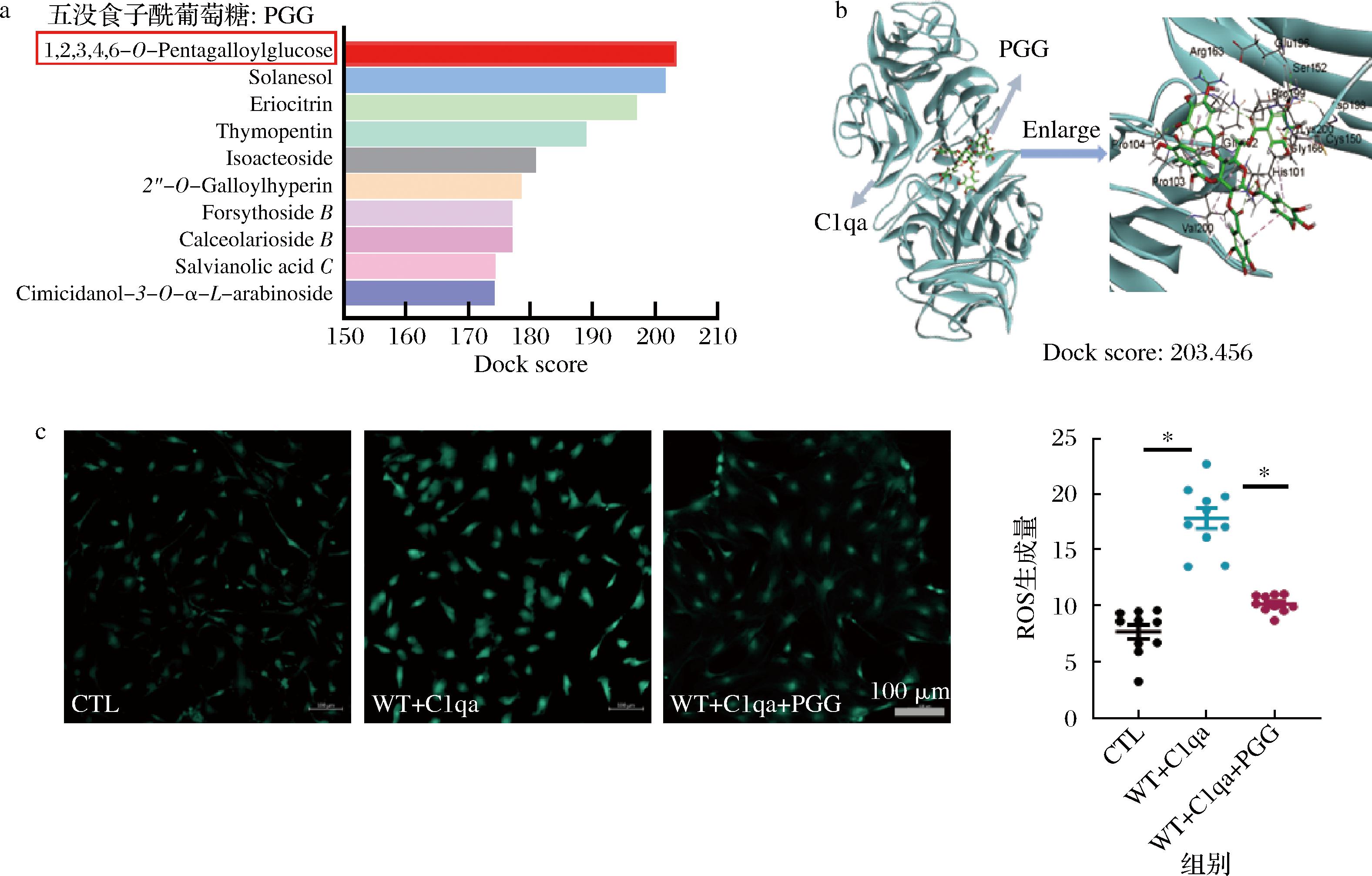
a-与C1qa结合度最佳的10种天然高分子化合物;b-C1qa与PGG对接的三维模拟图像;c-主动脉内皮ROS免疫荧光强度及统计图
图5 C1qa食源性抑制剂的遴选与功效验证
Fig.5 Selection and functional validation of C1qa foodborne inhibitors
注:CTL-正常小鼠主动脉内皮细胞;WT+C1qa-正常小鼠主动脉内皮细胞经过10 μg/mL C1qa孵育0.5 h;WT+C1qa+PGG-正常小鼠主动脉内皮细胞以10 μg/mL C1qa和20 μmol/L PGG共孵育0.5 h。
为了证实该假设,首先在主动脉内皮细胞中开展了实验。结果发现(图5-c),10 μg/mL的C1qa孵育后,小鼠主动脉内皮细胞的ROS荧光显著高于正常对照组;然而以20 μmol/L的PGG与10 μg/mL的C1qa共孵育健康小鼠的主动脉内皮细胞,发现ROS荧光水平显著下调。这表明,PGG可能通过与C1qa分子结合,减少血管内皮细胞ROS的生成,有望作为C1qa潜在的食源性抑制分子。
2.6 PGG降低糖尿病小鼠主动脉内皮细胞损伤
为了探究活性分子PGG对糖尿病小鼠血管内皮细胞损伤的影响,给予糖尿病小鼠20 mg/kg的PGG,在灌胃21 d后,发现对照糖尿病组平均FBG为(21.42±0.21) mmol/L,而经PGG灌胃后,平均FBG显著降低至(15.36±0.30) mmol/L,表明PGG具有一定降低血糖的功效(图6-a)。
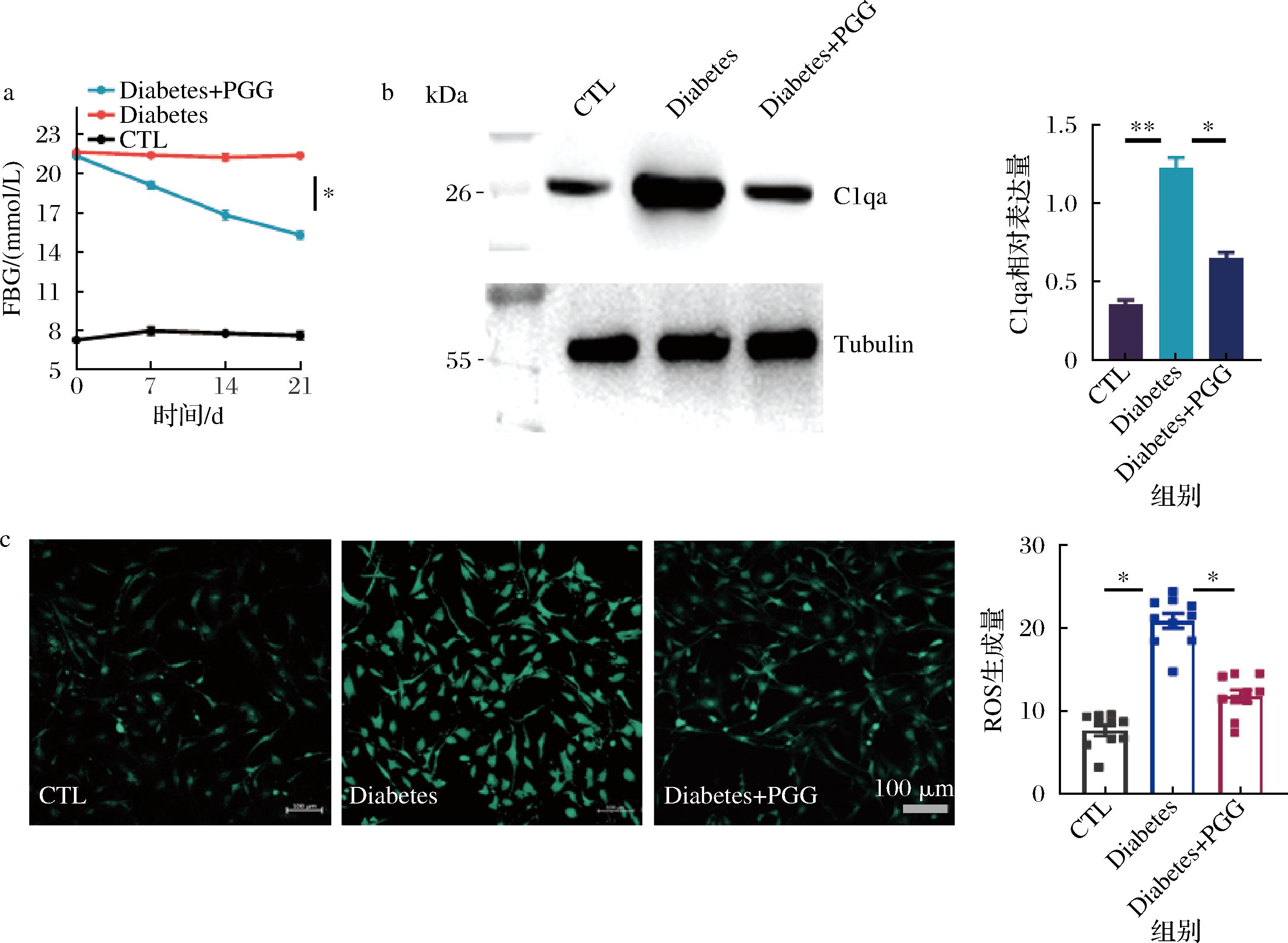
a-FBG;b-主动脉内皮层C1qa表达量变化及统计图;c-主动脉内皮ROS免疫荧光强度及统计图
图6 PGG对糖尿病小鼠主动脉内皮损伤的影响
Fig.6 Effect of PGG on endothelial damage in diabetic aortic
注:CTL-正常小鼠主动脉内皮细胞;Diabetes-糖尿病小鼠主动脉内皮细胞;Diabetes +PGG-连续灌胃21 d PGG的糖尿病小鼠主动脉内皮细胞,下同。
Western Blot结果显示,PGG灌胃后,糖尿病小鼠主动脉内皮细胞C1qa表达水平显著降低(图6-b),说明其可能修复了C1qa在糖尿病血管内皮细胞层的过量表达。除此之外,免疫荧光结果发现,PGG组小鼠血管内皮细胞的ROS荧光强度较糖尿病组降低了约(52.41±2.81)%,表明PGG可能参与调控了细胞氧化应激过程,进而减少了对机体的氧化损伤(图6-c)。
总而言之,活性分子PGG可以靶向抑制补体分子C1qa在糖尿病血管内皮层的激活,可能通过抑制ROS合成的关键酶及其受体的表达,进而降低主动脉内皮ROS的过量生成,减弱氧化应激,这与MUKAI等[21]的研究具有相似性。而PGG降低糖尿病内皮细胞中C1qa含量,可能是生成C1qa的经典途径中的免疫球蛋白G活性被降低[22],抗原-抗体复合体等经典途径的激活物质结合受阻的结果。
2.7 PGG降低糖尿病小鼠主动脉舒张障碍
离体微血管张力实验可通过测定小鼠的血管内皮依赖性舒张,揭示血管内皮受损与功能性障碍。与糖尿病组相比,PGG灌胃后疾病小鼠主动脉内皮依赖性舒张由(47.06±6.60)%升至(68.41±2.89)%,而正常健康小鼠这一数值为(83.16±2.89)%(图7)。结果提示,PGG有效缓解了糖尿病小鼠的主动脉舒张障碍。综合上述相关实验,糖尿病小鼠血管内皮层C1qa异常高表达,伴随大量ROS产出,进而氧化应激损伤主动脉内皮功能,降低血管内皮依赖性舒张。而PGG干预后,C1qa被抑制,血管内皮依赖性舒张提高。推测PGG可能通过增加血管内皮源性松弛因子[18]的释放,提高血管内皮舒张水平,修复血管内皮舒张障碍。
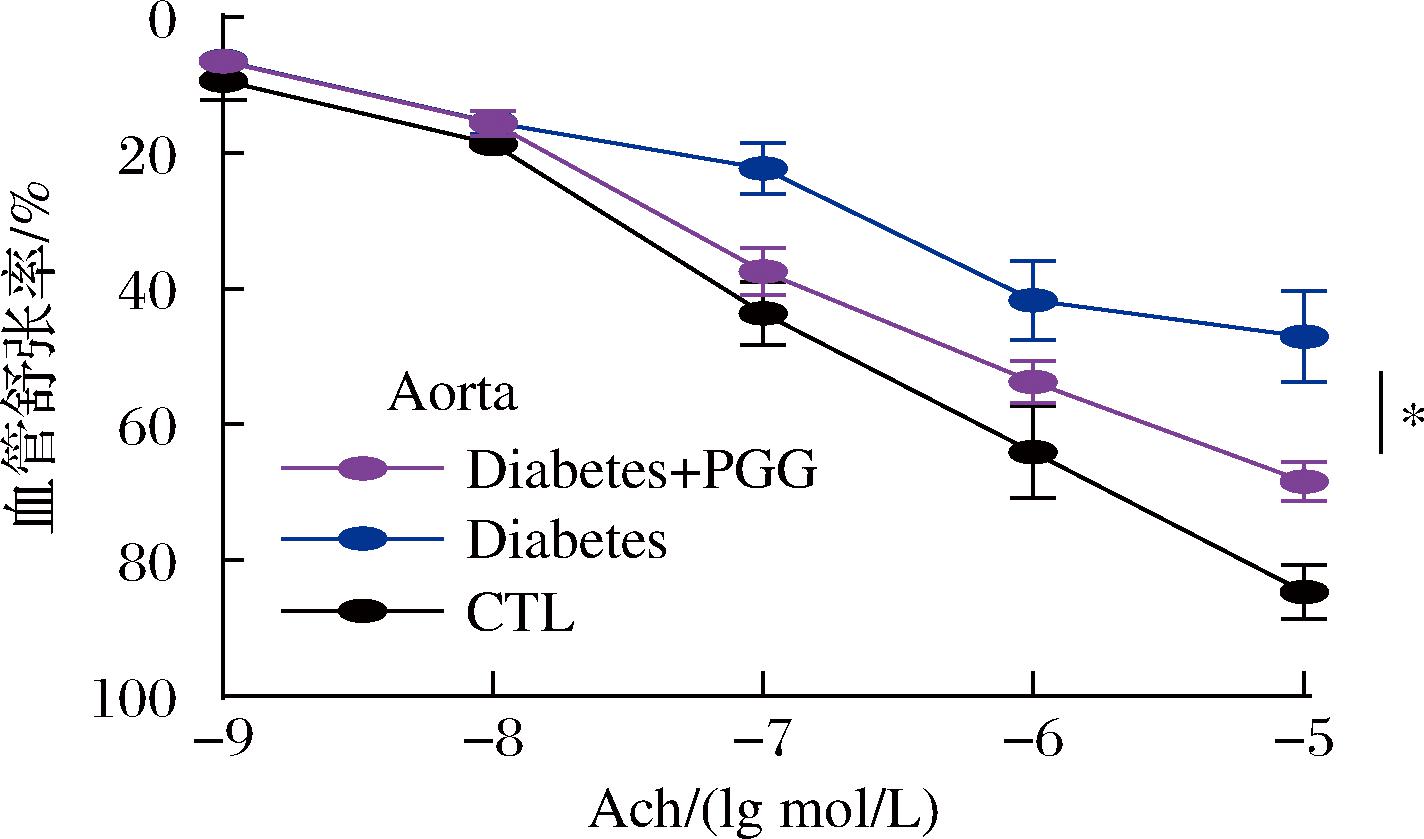
图7 PGG对糖尿病小鼠主动脉内皮舒张的影响
Fig.7 Effect of PGG on diabetic aortic diastole
2.8 PGG对糖尿病血管内皮细胞损伤的修复机制探究
通过Western Blot实验,观察NOX2和NOX4通路的表达水平。结果发现(图8),10 μg/mL的C1qa孵育后的主动脉内皮细胞NOX2与NOX4的表达水平显著上升,具有统计学意义。
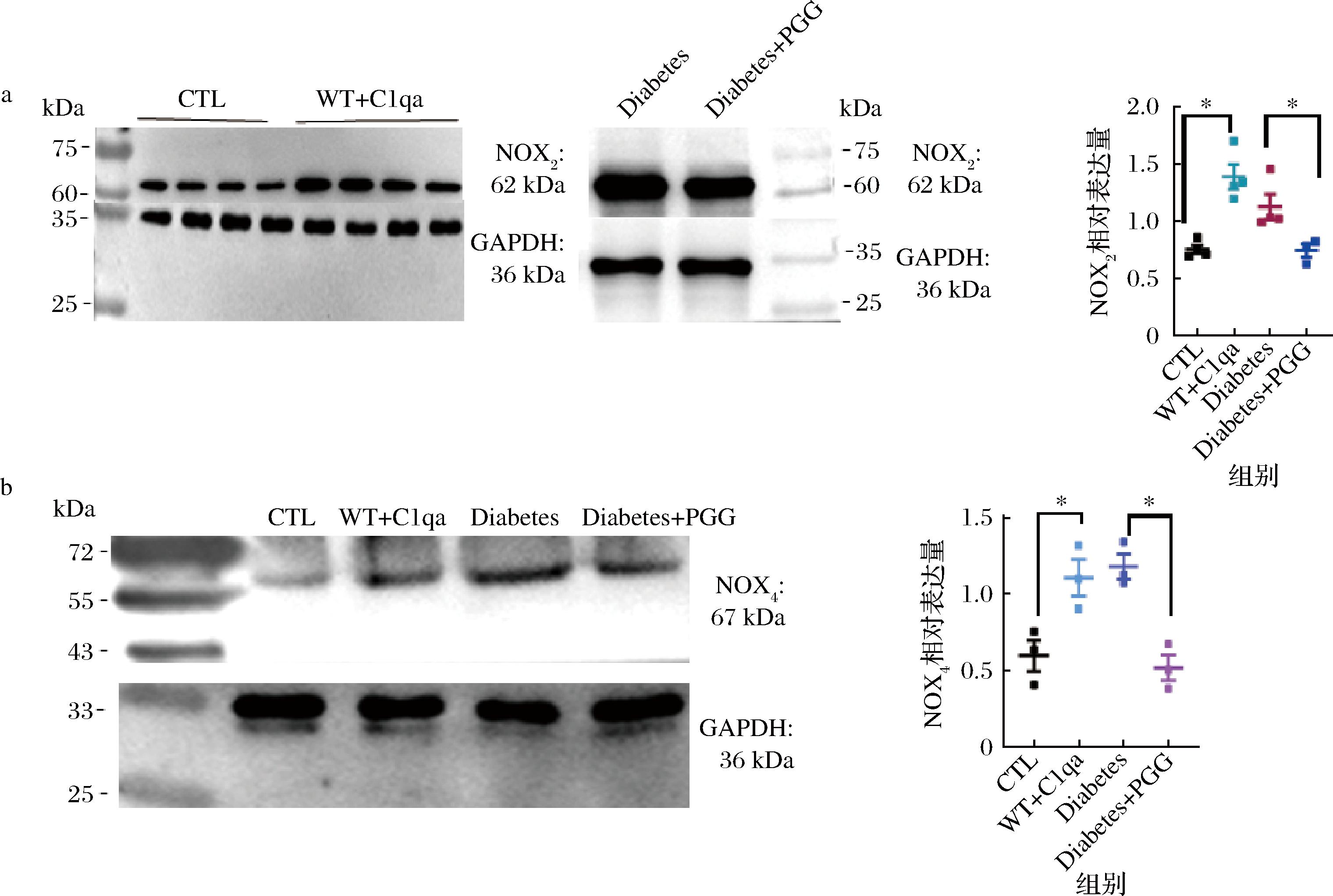
a-NOX2通路机制验证;b-NOX4通路机制验证
图8 PGG对糖尿病小鼠主动脉内皮ROS生成的影响机制
Fig.8 Mechanism of the PGG on endothelial ROS production in diabetic aorta
注:CTL-正常小鼠主动脉内皮细胞;WT+C1qa-正常小鼠主动脉内皮细胞经过10 μg/mL C1qa孵育0.5 h;Diabetes-糖尿病小鼠主动脉内皮细胞;Diabetes + PGG-PGG灌胃后的糖尿病小鼠主动脉内皮细胞。
灌胃PGG后,与糖尿病小鼠组相比,NOX2和NOX4水平显著下调,提示ROS生成的关键通路被抑制。以上结果说明,补体分子C1qa过度表达可能引发机体出现炎症反应,免疫应答增强[22],最终造成ROS自由基生成增多。而NOX2、NOX4的表达量提高,说明NOX2、NOX4通路可以被C1qa激活。PGG干预后,参与ROS生成的NOX2、NOX4表达降低,从而恢复内皮细胞氧化应激稳态[23]。
3 结论
本研究发现补体分子C1qa介导了糖尿病小鼠主动脉内皮损伤,引发血管内皮功能障碍。而活性分子PGG靶向作用于C1qa,抑制其表达并显著下调了NOX2和NOX4通路的表达,减少血管内皮ROS生成,降低糖尿病小鼠主动脉内皮细胞氧化应激水平,恢复血管内皮依赖性舒张,有利于修复糖尿病血管的内皮损伤,为日后相关药物的开发及糖尿病血管内皮细胞损伤的治疗提供了新的思路和方法。
值得一提的是,近年来糖尿病血管内皮细胞损伤的诱因及病变过程被学者广泛研究,然而由于组织结构的复杂性,以及相关生理功能和代谢环境差异[24],具体的机制研究仍不完善。另外,既往研究发现补体分子具有特殊的血管功能调节作用[5],但对心血管内皮细胞损伤的调控机制研究仍相对空白。因此,未来仍需要深入探究补体分子与血管内皮细胞病理性损伤的关联,以寻找修复血管损伤的潜在治疗靶标。通过筛选特异性结合的天然活性分子,实现相关疾病的靶向治疗。
[1] KNAPP M, TU X, WU R X.Vascular endothelial dysfunction, a major mediator in diabetic cardiomyopathy[J].Acta Pharmacologica Sinica, 2019, 40(1):1-8.
[2] KAUR R, KAUR M, SINGH J.Endothelial dysfunction and platelet hyperactivity in type 2 diabetes mellitus:Molecular insights and therapeutic strategies[J].Cardiovascular Diabetology, 2018, 17(1):121.
[3] MARZIANO C, GENET G, HIRSCHI K K.Vascular endothelial cell specification in health and disease[J].Angiogenesis, 2021, 24(2):213-236.
[4] DAIBER A, STEVEN S, WEBER A, et al.Targeting vascular (endothelial) dysfunction[J].British Journal of Pharmacology, 2017, 174(12):1591-1619.
[5] MARTIN-VENTURA J L, MARTINEZ-LOPEZ D, ROLDAN-MONTERO R, et al.Role of complement system in pathological remodeling of the vascular wall[J].Molecular Immunology, 2019, 114:207-215.
[6] KISHORE U, REID K B.C1q:Structure, function, and receptors[J].Immunopharmacology, 2000, 49(1-2):159-170.
[7] OGAWA T, SHICHINO S, UEHA S, et al.Complement protein C1q activates lung fibroblasts and exacerbates silica-induced pulmonary fibrosis in mice[J].Biochemical and Biophysical Research Communications.2022, 603:88-93.
[8] SUMIDA T, NAITO A T, NOMURA S, et al.Complement C1q-induced activation of β-catenin signalling causes hypertensive arterial remodelling[J].Nature Communications, 2015, 6:6241.
[9] 许醒, 蔡林峰, 张倩楠, 等.单细胞与空间转录组分析研究进展[J].分析测试学报, 2022, 41(9):1322-1334.XU X, CAI L F, ZHANG Q N, et al.Progress on single-cell and spatial transcriptome analysis[J].Journal of Instrumental Analysis, 2022, 41(9):1322-1334.
[10] LIU F Z, LI Y B, YANG Y, et al.Study on mechanism of matrine in treatment of COVID-19 combined with liver injury by network pharmacology and molecular docking technology[J].Drug Delivery, 2021, 28(1):325-342.
[11] DING S M, QIU H M, HUANG J J, et al.Activation of 20-HETE/PPARs involved in Reno-therapeutic effect of naringenin on diabetic nephropathy[J].Chemico-Biological Interactions, 2019, 307:116-124.
[12] CHAI Y B, LEE H J, SHAIK A A, et al.Penta-O-galloyl-beta-D-glucose induces G1 arrest and DNA replicative S-phase arrest independently of cyclin-dependent kinase inhibitor 1A, cyclin-dependent kinase inhibitor 1B and P53 in human breast cancer cells and is orally active against triple negative xenograft growth[J].Breast Cancer Research:BCR, 2010, 12(5):R67.
[13] ZHOU C X, TAN Y, XU B J, et al.3, 4′, 5-Trimethoxy-trans-stilbene alleviates endothelial dysfunction in diabetic and obese mice via activation of the AMPK/SIRT1/eNOS pathway[J].Antioxidants, 2022, 11(7):1286.
[14] TAREK B, BRUGGISSER J, CATTALANI F, et al.Platelet endothelial cell adhesion molecule 1 (CD31) is essential for Clostridium perfringens beta-toxin mediated cytotoxicity in human endothelial and monocytic cells[J].Toxins, 2021, 13(12):893.
[15] CAO J, JIANG X, PENG X.Forkhead box M1 inhibits endothelial cell apoptosis and cell-cycle arrest through ROS generation[J].International Journal of Clinical and Experimental Pathology, 2018, 11(10):4899-4907.
[16] HE D X, MAO A Q, ZHENG C B, et al.Aortic heterogeneity across segments and under high fat/salt/glucose conditions at the single-cell level[J].National Science Review, 2020, 7(5):881-896.
[17] SENONER T, DICHTL W.Oxidative stress in cardiovascular diseases:Still a therapeutic target?[J].Nutrients, 2019, 11(9):2090.
[18] GODO S, SHIMOKAWA H.Endothelial functions[J].Arteriosclerosis Thrombosis Vascular Biology, 2017, 37(9):108-114.
[19] MITTAL M, SIDDIQUI M R, TRAN K, et al.Reactive oxygen species in inflammation and tissue injury[J].Antioxidants &Redox Signaling, 2014, 20(7):1126-1167.
[20] SATHYANARAYANA A R, LU C K, LIAW C C, et al.1, 2, 3, 4, 6-Penta-O-galloyl-D-glucose interrupts the early adipocyte lifecycle and attenuates adiposity and hepatic steatosis in mice with diet-induced obesity[J].International Journal of Molecular Sciences, 2022, 23(7):4052.
[21] MUKAI E R, FUJIMOTO S, INAGAKI N.Role of reactive oxygen species in glucose metabolism disorder in diabetic pancreatic β-cells[J].Biomolecules, 2022, 12(9):1228.
[22] CLYNE A M.Endothelial response to glucose:Dysfunction, metabolism, and transport[J].Biochemical Society Transactions, 2021, 49(1):313-325.
[23] STURTZEL C.Endothelial Cells[M]//Advances in Experimental Medicine and Biology.Cham:Springer International Publishing, 2017:71-91.
[24] ZHENG D D, LIU J, PIAO H L, et al.ROS-triggered endothelial cell death mechanisms:Focus on pyroptosis, parthanatos, and ferroptosis[J].Frontiers in Immunology, 2022, 13:1039241.