苯丙酮尿症(phenylketonuria, PKU)是一种常染色体隐性遗传的苯丙氨酸代谢障碍疾病。该疾病是由于基因突变导致体内缺乏苯丙氨酸羟化酶[1],从而使苯丙氨酸代谢受阻。苯丙氨酸及其代谢物酮酸在患者血液和组织中不断累积,引发PKU症状的出现[2]。对于PKU患者来说,早期诊断和治疗至关重要。如果未能及时进行治疗,随着患儿成长,可能会出现自闭症、癫痫、运动障碍和智力障碍等多种症状[3-4]。目前,最主要的治疗方法是限制饮食中苯丙氨酸的摄入量。然而,长期限制蛋白质摄入可能会导致患者营养不良,更容易出现骨质疏松、厌食、脱发、嗜睡等一系列症状[5-6]。此外,人工合成的蛋白质替代品价格昂贵且口味差,这也导致了患者对该治疗方法的依从性较差[7]。
大肠埃希菌Nissle 1917(Escherichia coli Nissle 1917,EcN)是一种益生菌,能够定殖在人体肠道中对肠道黏膜进行保护和修复,同时也能调节肠道菌群的平衡,被广泛应用于治疗炎症性胃肠疾病,如克罗恩病和溃疡性结肠炎等[8-9],与此同时,EcN工程菌株不会在成年受试者的肠道中定殖[10]。近年来,科研人员利用基因编辑技术对EcN进行基因改造,使其在预防和治疗多种疾病方面具有更大的潜力[11-12]。苯丙氨酸氨裂解酶(phenylalanine ammonia-lyase, PAL)存在于许多植物、酵母菌、真菌和链霉菌中,能够催化L-苯丙氨酸脱氨生成反式肉桂酸[13],因此该酶在PKU的诊断和治疗中具有潜在作用。研究表明PAL的基因可以在大肠埃希菌中表达并降解苯丙氨酸[14-15]。大肠埃希菌苯丙氨酸特异性渗透酶(phenylalanine-specific permease, PheP)是一种高亲和力的苯丙氨酸转运蛋白,可以将苯丙氨酸摄入细菌内[16],pheP基因广泛存在于大肠埃希菌基因组中,包括EcN菌株(pheP基因编号CIW80_RS20650)。工程菌中PheP与PAL协同工作,促进苯丙氨酸的降解。Synlogic公司基于EcN菌株和PAL的基因开发了工程益生菌SYNB1618,通过给PAL的基因添加PfnrS启动子,使其适应哺乳动物肠道中的缺氧条件[17]。临床实验数据表明,每日3次给药2×1012 CFU益生菌SYNB1618,持续28 d时血液苯丙氨酸水平降低39.3%[18],说明持续补充足够剂量的工程益生菌可以有效降低血液苯丙氨酸水平。
口服工程益生菌治疗PKU的难题在于工程益生菌的活性是否足够高,是否能够降低患者血液苯丙氨酸浓度至健康人的水平。为了解决这一问题,本研究选择了EcN作为底盘菌株,并利用Red同源重组系统[19]导入经过优化设计的PAL的基因,使工程益生菌E.coli EcN-PAL能够高效降解肠道中食物来源的苯丙氨酸,此外也可以降解通过“肠循环的过程”从血液中到肠道的苯丙氨酸[20],PAL将苯丙氨酸转化为反式肉桂酸,反式肉桂酸被吸收后经肝脏转化为马尿酸并随尿液排出体外[17],从而降低血液中的苯丙氨酸含量。本研究从体内、体外2个方面对工程益生菌的功能进行了验证,证明了工程益生菌有应用于治疗PKU患者的可能性。
1 材料与方法
1.1 材料与仪器
E.coli Nissle 1917(EcN),艾礼生物科技有限公司;E.coli DH5α,上海昂羽生物技术有限公司;质粒pUC18-PAL,上海生工生物公司;质粒pCP20、pKD46、载体pCR-Blunt,实验室保存;载体pMD18-T,宝日医生物技术(北京)有限公司;氨苄青霉素(ampicillin, Amp)、卡那霉素(kanamycin, Kana)、氯霉素(chloramphenicol, Chlo),上海麦克林生化科技股份有限公司;质粒小提试剂盒、胶回收试剂盒,OMEGA公司;PKU模型小鼠,实验室繁育;SPF级ICR小鼠,北京斯贝福生物技术有限公司。
1260 Infinity Ⅱ液相色谱系统,美国安捷伦科技有限公司;Concept 400厌氧工作站,北京隆福佳生物科技有限公司;HN-60BS恒温培养箱,湖南力辰仪器科技有限公司;MQD-S3 NR恒温摇床,上海旻泉仪器有限公司;JY-SPCT核酸电泳仪,北京君意东方电泳设备有限公司;T-960型PCR仪,杭州晶格科学仪器有限公司;MiniGel 500凝胶成像系统,北京赛智创业科技有限公司;FSIVC-3318生物安全型独立送风隔离笼具,苏州市冯氏实验动物设备有限公司。
1.2 实验方法
1.2.1 基因敲入质粒pKMD-PAL的构建与验证
以来自Photorhabdus laumondii的stlA基因[21]为基础,优化设计表达PAL的DNA序列并委托上海生工生物合成,构建中间载体pUC18-PAL。以pUC18-PAL质粒为模板,利用表1中引物PAL-F和PAL-R通过PCR扩增基因片段;以EcN菌株基因组为模板,利用引物UP-F和UP-R扩增上游同源臂,利用引物Down-F和Down-R扩增下游同源臂;以pCR-Blunt质粒为模板,利用引物FRT-Kana-F和FRT-Kana-R扩增FRT-卡那霉素抗性片段;PCR产物经琼脂糖凝胶电泳,切胶后用回收PCR扩增片段。将回收的上游同源臂、下游同源臂、目标基因片段、FRT-卡那霉素抗性[22]与pMD18-T载体进行同源重组连接,热激转化导入DH5α感受态细胞,通过蓝白斑和抗生素抗性筛选转化子,提取质粒进行酶切验证和DNA测序验证,最后获得基因敲入质粒pKMD-PAL。
表1 本研究所用引物
Table 1 Primers used in this study

引物名称DNA序列(5′→3′)UP-FACCCGGGGATCCTCTAGAGATTTGAGCGTAACCA-CCAAAGUP-RTTTCTAGAGAATAGGAACTTCCTGTGAACTAAAC-CGAGGTPAL-FCTAGAAAGTATAGGAACTTCGTTGTTCTTATTGGT-GGTGTPAL-RGGAGGATGAGAACGGGCTTAAATGCGCTGTATAA-GTATGDOWN-FAAGCCGCGTTCTCATCCTCCDOWN-RGCGCCAGTTGCAGCACTTCCGCATGCCTGCAGGTC-GACGATAFRT-Kana-FCGGTTTAGTTCACAGGAAGTTCCTATTCTCTAGAA-AGTATAGGAACTTCGGCTATCTGGACAAGGGAAAACGCAAGCFRT-Kana-RCCATGGCCAAGTTGACCAGTGCCGTTGAAGTTCC-TATTCTCTAGAAAGTATAGGAACTTCGTTGTTCTTATTGGTYZ-FGGCTATCTGGACAAGGGAAYZ-RCTGTGGCGAGGGTATGAA
1.2.2 工程益生菌EcN-PAL的构建与验证
首先用限制性内切酶Hind Ⅲ和EcoR I处理pKMD-PAL质粒,琼脂糖凝胶电泳后切胶回收获得含同源臂、FRT-卡那霉素抗性基因和目标基因的DNA片段。参考文献[23]中RED同源重组方法,然后将上述DNA片段加入含pKD46质粒的EcN(pKD46)感受态细胞,混匀后放置于预冷的0.1 cm电转杯中,1.8 kV电压,5 ms进行电击转化。电击后迅速加入1 mL含有0.5%(体积分数)L-阿拉伯糖的SOB(super optimal broth)培养基,30 ℃复苏2 h后涂布于含Amp和Kana的LB固体平板,30 ℃培养过夜。然后挑取转化子进行PCR验证,验证的重组菌株经42 ℃培养消除pKD46质粒。最后通过电击转化将质粒pCP20导入上述重组菌株,在含Chlo的LB固体平板上30 ℃培养过夜,按照文献[23]方法消除卡那霉素抗性基因,PCR和DNA测序验证重组菌株,将验证正确的重组菌株命名E.coli EcN-PAL。
1.2.3 工程益生菌EcN-PAL对培养基中苯丙氨酸的降解能力检测
工程益生菌EcN-PAL与出发菌株EcN接种于LB培养基中,37 ℃,220 r/min过夜培养获得种子液。将活化的种子液以5%的接种量接种于添加0.5 g/L苯丙氨酸的LB培养基中,分别在有氧和乏氧环境37 ℃,220 r/min培养,在0、12、24、36、48 h吸取1 mL发酵液,13 000 r/min离心2 min沉淀菌体,上清液经0.22 μm滤膜过滤,滤液中苯丙氨酸含量采用HPLC检测。实验每个处理做3个重复。
1.2.4 工程益生菌EcN-PAL对小鼠血液中苯丙氨酸含量的影响分析
选取7只实验室繁育的PKU纯合雄鼠,通过PCR鉴定基因型,同时观察记录小鼠的临床特征。实验首先用普通维持饲料连续喂食PKU小鼠14 d,检测验证小鼠血液中苯丙氨酸浓度升高至发病水平。然后在继续喂食普通维持饲料的基础上,每日定时灌胃0.4 mL 1×109 CFU/mL的工程益生菌EcN-PAL。灌胃周期为14 d,每7 d剪取小鼠尾部采血,收集血液后按照文江平等[24]的方法检测血液中苯丙氨酸浓度。同时选用8只SPF级ICR小鼠,眼眶取血制备血清后,检测血液中苯丙氨酸浓度。
1.2.5 工程益生菌EcN-PAL的安全性评价
1.2.5.1 急性毒性试验
急性毒性试验参考GB 15193.3—2014《食品安全国家标准 急性经口毒性试验》进行。选取8周龄SPF级ICR小鼠16只,雌雄各半,分为对照组与实验组。对照组小鼠灌胃生理盐水,实验组小鼠灌胃EcN-PAL的生理盐水稀释液(1.0×1011 CFU/mL)。正常饮食,每日定时灌胃2次,每次0.4 mL/只,连续灌胃14 d。观察记录小鼠生长情况,在灌胃0、7、14 d时对实验小鼠进行称重,对小鼠存活数量、形态和小鼠体重进行分析。
1.2.5.2 28 d经口毒性试验
28 d经口毒性试验参考GB 15193.22—2014《食品安全国家标准 28天经口毒性试验》进行。选取8周龄SPF级ICR小鼠32只,雌雄各半,分为对照组、低剂量组、中剂量组和高剂量组。其中对照组小鼠灌胃生理盐水,实验组小鼠灌胃EcN-PAL的生理盐水稀释液(低剂量:1.0×107 CFU/mL,中剂量:1.0×109CFU/mL,高剂量:1.0×1011 CFU/mL)。正常饮食,每日定时灌胃1次,剂量为0.4 mL/只,连续灌胃28 d。在正常饮食情况下连续观察28 d,并记录小鼠的行为变化和死亡情况。观察期结束后称取小鼠体重,然后处死小鼠,称重小鼠脏器(心、肝、脾、肺、肾)并计算相对质量(脏/体比值),观察脏器表面有无异常组织或增生,解剖脏器后用无菌棉签擦拭切面后涂布于LB固体培养基上,37 ℃培养72 h,观察有无特征菌落生长[25]。
1.2.5.3 致畸试验
参考GB 15193.14—2015《食品安全国家标准 致畸试验》进行。选取8周龄性成熟的SPF级ICR小鼠64只,雌雄各半,喂食大小鼠营养繁殖饲料。雌雄小鼠随机合笼饲养,以观察到阴道栓为怀孕0.5 d[26]。将孕鼠分为对照组、低剂量组、中剂量组和高剂量组,每组8只,实验设计与28 d经口毒性喂养实验一致。小鼠在孕18 d时处死,检查胚胎外观有无异常,同时用茜素红染色后检查骨骼发育状态,用Davidson’s固定后检查内脏发育情况[27]。
1.2.6 检测苯丙氨酸的HPLC条件
1.2.6.1 培养基中苯丙氨酸检测的色谱条件
色谱柱为Nova-Pak C18柱(4 μm,60 Å,150 mm×3.9 mm,Waters公司),色谱条件:检测器为二极管阵列检测器(diode array detector,DAD),流动相为V(甲醇)∶V(水)=2∶98,流速0.5 mL/min,紫外检测波长210 nm,进样量20 μL,柱温30 ℃。用苯丙氨酸标准品制作标准曲线,通过标准曲线计算细菌培养液中苯丙氨酸含量。
1.2.6.2 血液中苯丙氨酸检测的色谱条件
色谱柱为Nova-Pak C18柱(4 μm,60 Å,150 mm×3.9 mm,Waters公司),色谱条件:检测器为DAD,流动相为V(乙腈)∶V(水)=6∶94,流速1 mL/min,紫外检测波长215 nm,进样量20 μL,柱温30 ℃。用苯丙氨酸标准品制作标准曲线,通过标准曲线计算小鼠血清中苯丙氨酸含量。
1.3 数据处理
使用GraphPad Prism 8软件对数据进行统计分析,体外降解实验为3次重复,PKU小鼠喂养试验为7个重复,小鼠安全性评价为8个重复。以ns、*、**、***符号分别表示组间数据不存在差异、存在差异(P<0.05)、存在显著差异(P<0.01)、存在极显著差异(P<0.001)。
2 结果与分析
2.1 工程益生菌EcN-PAL的构建与验证
以E.coli Nissle 1917(EcN)为出发菌株,为了构建胞内表达PAL的工程益生菌E.coli EcN-PAL,试验首先构建了基因敲入质粒pKMD-PAL,经Hind Ⅲ和EcoR I酶切处理和电泳验证,试验结果与预期一致(图1-a),然后将酶切电泳回收的DNA片段通过电转化导入含pKD46质粒的EcN(pKD46)菌株,根据RED同源重组系统方法[23]筛选获得消除抗性基因的重组菌株EcN-PAL。重组菌株用引物YZ-F、YZ-R经PCR验证存在目标片段,并经DNA测序证实与预期序列一致,而出发菌株EcN中无相应片段(图1-b),表明PAL的基因片段成功整合到EcN-PAL菌株的基因组上。
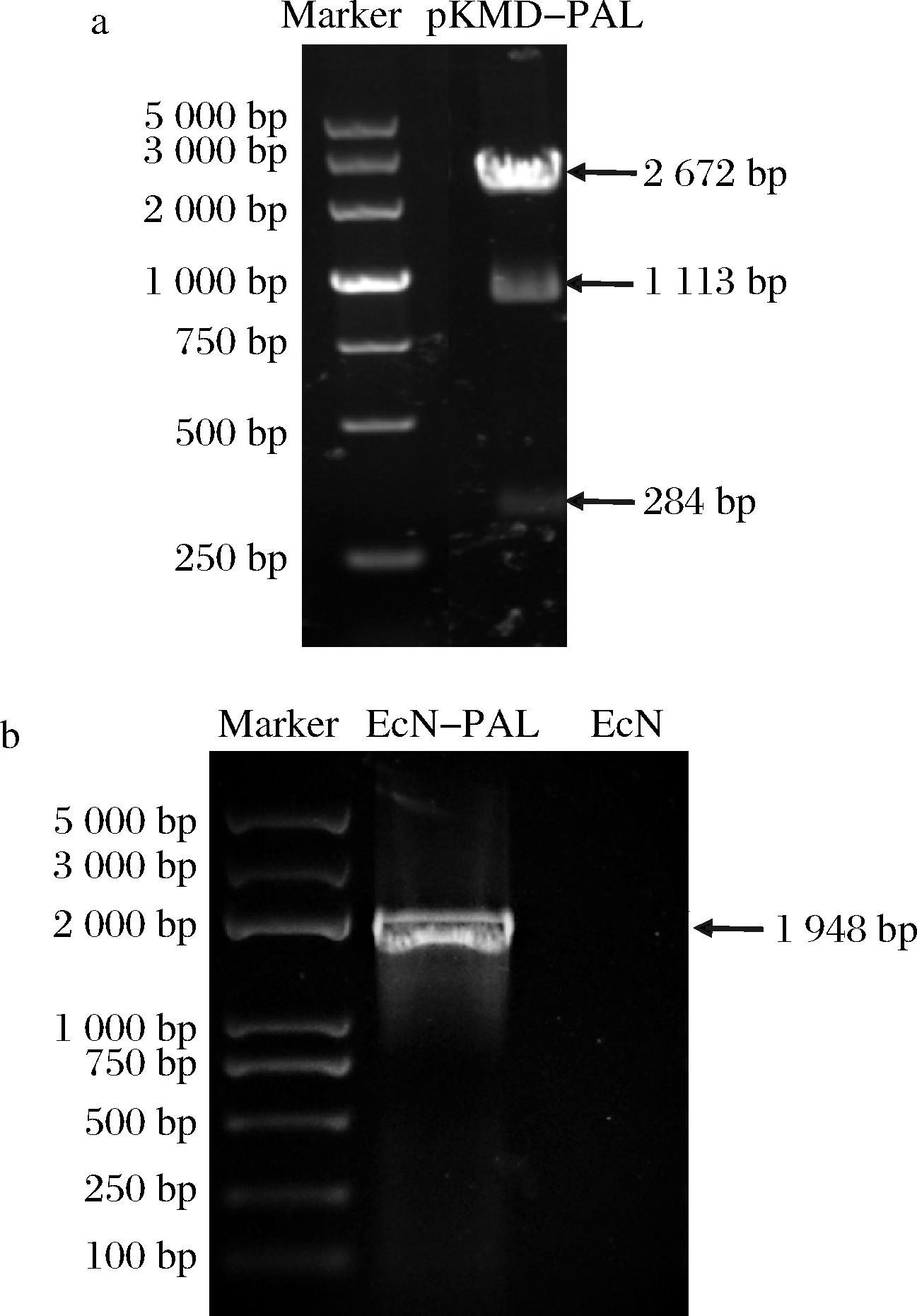
a-重组质粒pKMD-PAL的验证;b-工程益生菌EcN-PAL的验证
图1 重组质粒pKMD-PAL和工程益生菌EcN-PAL的验证
Fig.1 Verification of recombinant plasmid pKMD-PAL and recombination strain EcN-PAL by PCR analysis
2.2 工程益生菌EcN-PAL在培养条件下的苯丙氨酸降解能力分析
为检测工程益生菌EcN-PAL降解苯丙氨酸的能力,本研究在培养基中添加0.5 g/L苯丙氨酸,分别在有氧和乏氧条件下培养EcN-PAL菌株和出发菌株EcN,并用HPLC检测0、12、24、36、48 h培养基中苯丙氨酸浓度的变化。结果显示,工程益生菌EcN-PAL在好氧条件下培养36~48 h时,苯丙氨酸降解率明显高于出发菌株EcN,第48 h EcN-PAL菌株的苯丙氨酸降解率达到100%(图2-a)。EcN-PAL在乏氧条件下对苯丙氨酸具有相似的降解效果,在48 h内能够完全降解培养基中苯丙氨酸,且降解能力优于出发菌株EcN(图2-b)。文献中工程益生菌SYNB1618具有在好氧和乏氧条件下表达PAL和降解苯丙氨酸的活性[17],而本试验结果表明,EcN-PAL在好氧和乏氧条件下均能有效降解苯丙氨酸,提示其具有在消化道中降解来源食物的苯丙氨酸的潜力。
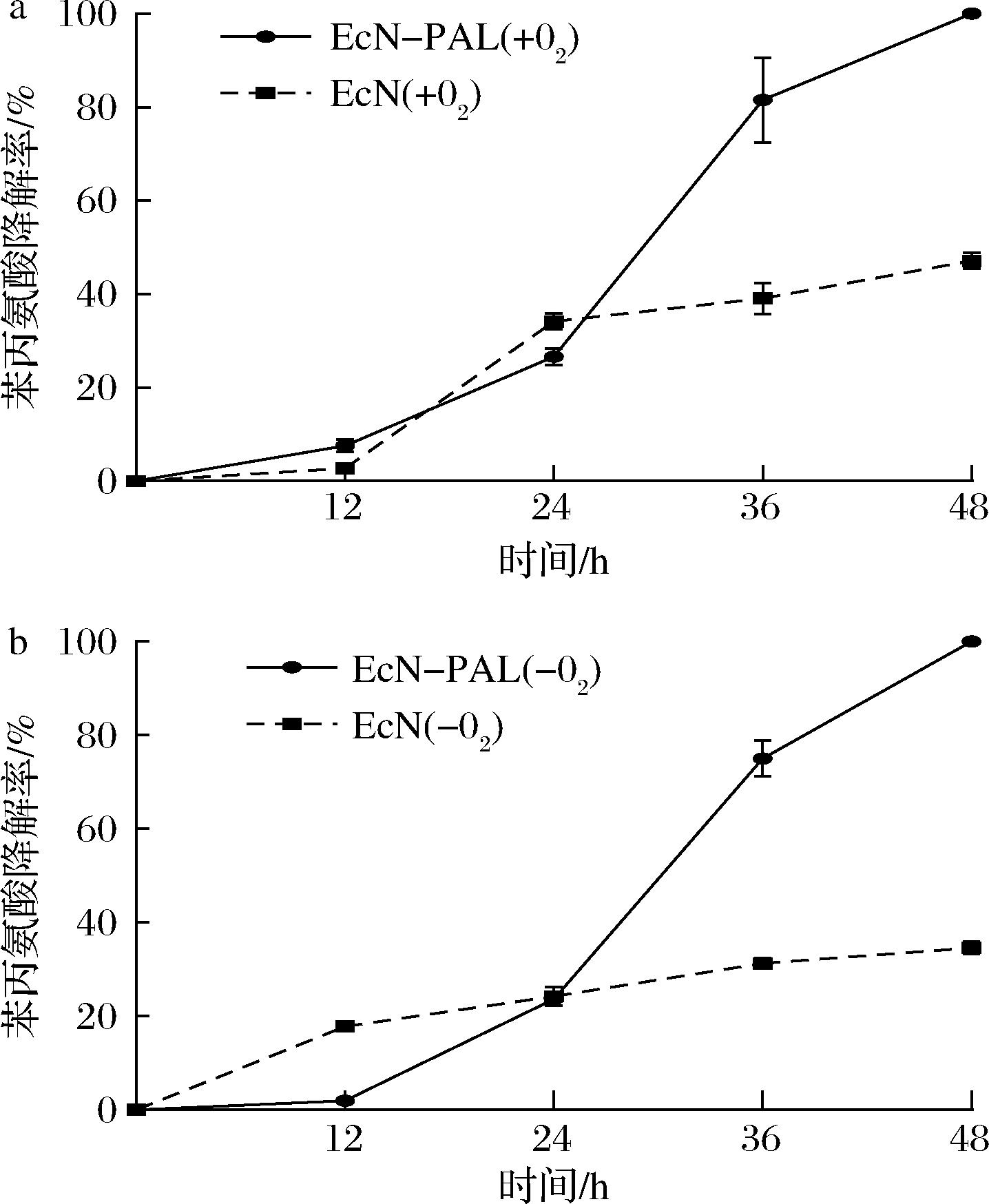
a-好氧条件;b-乏氧条件
图2 培养条件下EcN-PAL对苯丙氨酸降解率的影响
Fig.2 Effects of EcN-PAL on the degradation rate of phenylalanine under culture conditions
2.3 EcN-PAL菌株对PKU小鼠血液中苯丙氨酸含量的影响
研究表明EcN菌株不会在结肠中定殖[10],工程益生菌SYNB1618在48 h内从C57BL/6小鼠的胃肠道和粪便中全部清除[17],说明治疗过程中需要持续补充足够剂量的工程益生菌。本实验首先用普通维持饲料连续喂食PKU小鼠14 d,HPLC检测验证PKU小鼠血液中苯丙氨酸浓度,然后在继续喂食普通维持饲料的基础上,每日定时灌胃工程益生菌EcN-PAL,HPLC检测PKU小鼠血液中苯丙氨酸含量(图3)。结果显示,灌胃开始前(PKU-0 d)PKU小鼠血液苯丙氨酸平均浓度达到653.87 μmol/L,显著高于正常小鼠血液的苯丙氨酸浓度61.80 μmol/L,表明PKU小鼠处于发病状态。采用工程益生菌EcN-PAL灌胃7 d时(PKU-7 d),PKU小鼠血液苯丙氨酸平均浓度为152.10 μmol/L;灌胃至14 d时(PKU-14 d),PKU小鼠血液苯丙氨酸平均浓度降低至34.42 μmol/L,与正常小鼠血液中苯丙氨酸浓度相近,说明长期喂食工程益生菌EcN-PAL可以显著降低PKU小鼠血液中苯丙氨酸含量。Synlogic公司开发的治疗PKU的工程益生菌SYNB1618喂养试验显示,PKU小鼠血液苯丙氨酸浓度与对照组相比降低了38%[17]。本研究中构建的工程益生菌EcN-PAL喂养试验显示,PKU小鼠血液苯丙氨酸浓度降低了94%,降解效果优于工程益生菌SYNB1618。因此,工程益生菌EcN-PAL具有在小鼠体内降解食物中苯丙氨酸的能力。
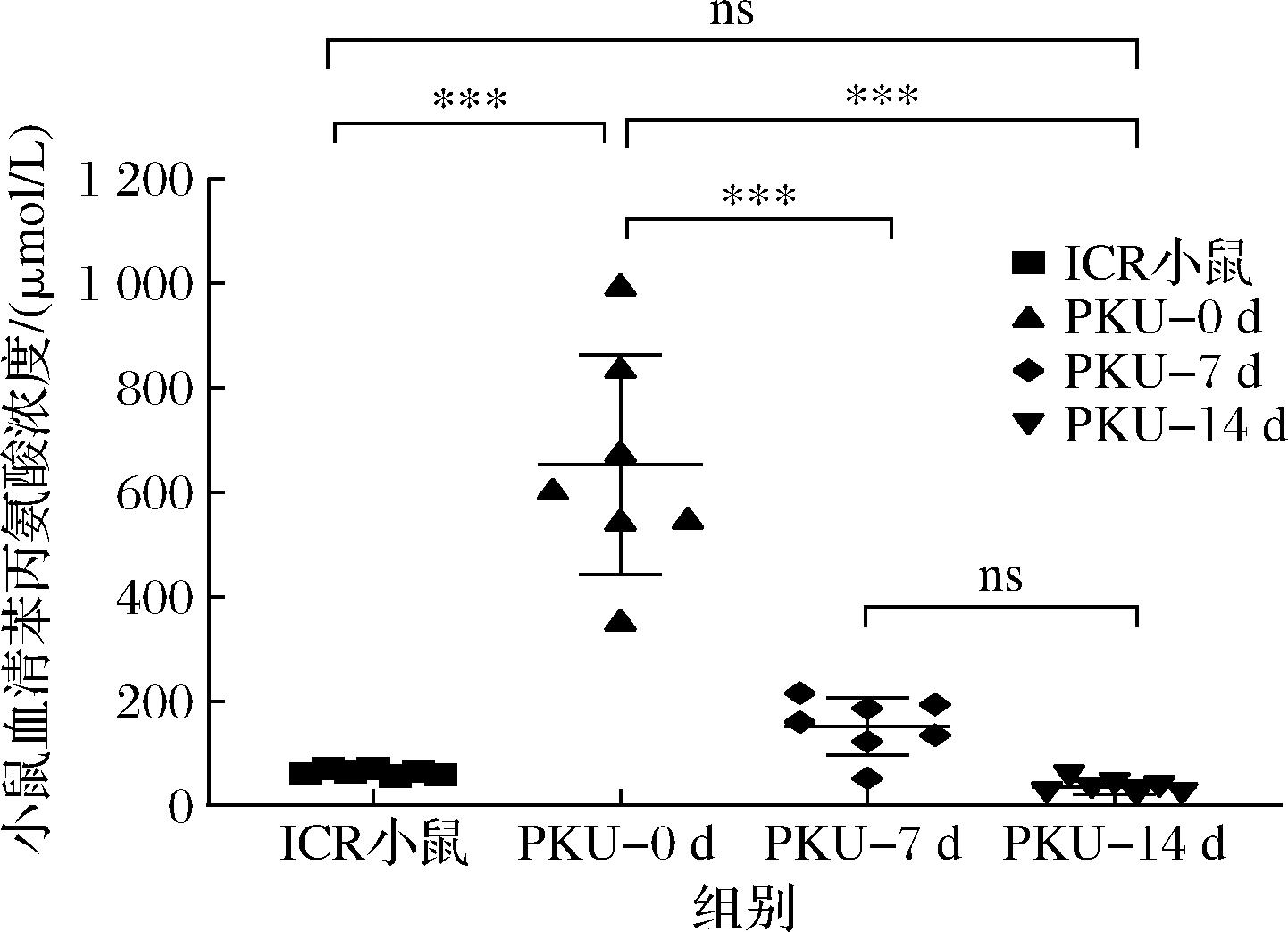
图3 PKU小鼠血液中苯丙氨酸含量的变化
Fig.3 Comparison of phenylalanine concentration in blood of mice
注: ns、*、**、***符号分别表示组间数据不存在差异、存在差异(P<0.05)、存在显著差异(P<0.01)、存在极显著差异(P<0.001)。
2.4 工程益生菌EcN-PAL的小鼠安全性评价
2.4.1 小鼠急性毒性试验结果
急性毒性试验采用1.0×1011 CFU/mL的工程益生菌EcN-PAL灌胃ICR小鼠(实验组),对照组为ICR小鼠灌胃等体积的生理盐水。试验期间各组小鼠均未出现死亡现象,未发现小鼠反常行为和身体异样。小鼠体重变化检测显示,实验组与对照组的小鼠体重无显著性差异(图4),说明工程益生菌EcN-PAL未对实验小鼠机体产生不良影响,无急性毒性表现。
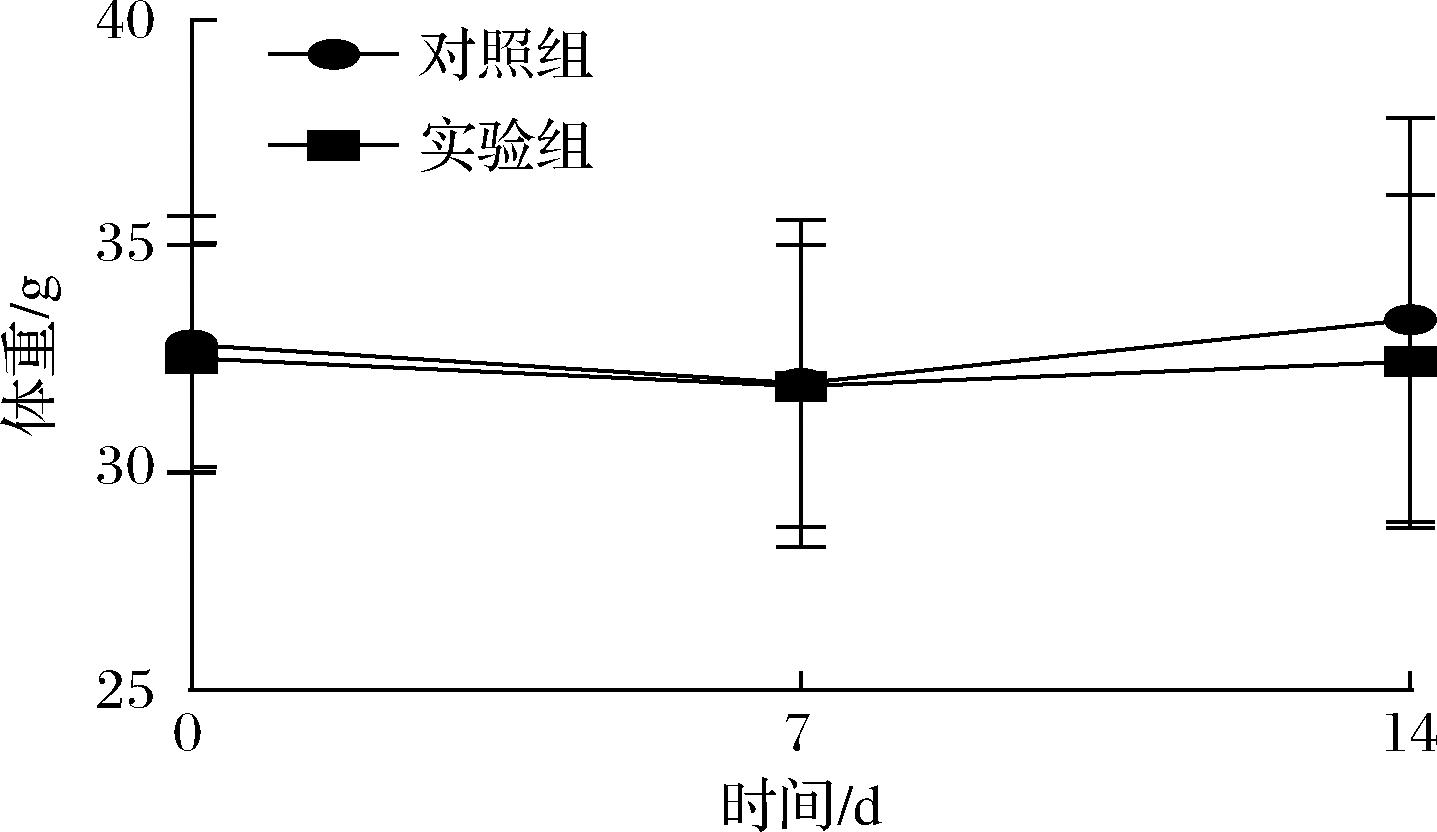
图4 急性毒性试验期间小鼠体重变化
Fig.4 Body weight changes of mice during acute toxicity test
2.4.2 小鼠28 d经口毒性试验结果
本试验按照对照组(生理盐水)、低剂量组(1.0×107 CFU/mL)、中剂量组(1.0×109 CFU/mL)、高剂量组(1.0×1011 CFU/mL)连续28 d固定时间对ICR小鼠灌胃,观察发现试验期间小鼠活动正常,精神状态良好,饮食、饮水正常,无腹泻血便,对外界刺激反应正常,鼠毛光洁白亮,皮肤无破损溃烂,无死亡小鼠。小鼠体重检测结果显示,各组小鼠间无显著性差异,体重均正常增长(图5),内脏质量检测显示,各组小鼠的脏器系数也无显著性差异(图6),进一步的解剖观察未发现内脏异常,细菌培养也未发现细菌移位现象。因此,28 d经口毒性试验结果表明,工程益生菌EcN-PAL小鼠机体各项数据未造成改变,无亚急性毒性表现。
图5 28 d经口毒性试验期间各组小鼠体重变化
Fig.5 Body weight changes of mice in each group during the 28-day oral toxicity test
图6 28 d经口毒性试验期间各组小鼠脏器系数对比
Fig.6 Comparison of organ coefficients of mice in each group during 28-day oral toxicity test
2.4.3 致畸试验结果
工程益生菌EcN-PAL喂养过程中,低剂量组、中剂量组、高剂量组孕鼠的精神状态均良好,活动正常。各处理组的胎鼠检测显示外观均无异常,未发现四肢缺失、多肢、五官缺失、肛门发育不全等情况。茜素红染液染色观察显示,胎鼠均未发现骨骼畸形变异情况。胎鼠解剖观察发现内脏发育正常,五官清晰,未见变异或缺失,大脑发育完好。致畸试验结果表明,在孕期大剂量摄入工程益生菌EcN-PAL未对小鼠胚胎形成和发育造成不良影响。综上,工程益生菌EcN-PAL的安全性评价结果与文献[28]报道中EcN的安全性一致,有望进一步用于临床试验。
3 结论
低苯丙氨酸饮食是目前临床治疗PKU的唯一方法,然而长期限制饮食,严重降低患者生活质量,导致患者依从性较差。本研究将大肠埃希菌EcN作为出发菌株,通过Red同源重组系统构建了一株表达苯丙氨酸裂解酶的工程益生菌EcN-PAL,PCR验证结果和DNA测序表明,PAL的基因成功整合到EcN-PAL菌株的基因组中。苯丙氨酸降解试验结果表明,EcN-PAL菌株在好氧条件和氧气不足条件下均能有效降解培养基中的苯丙氨酸。用工程益生菌EcN-PAL长期喂养PKU小鼠,可以将血液苯丙氨酸含量降低至正常水平,表明EcN-PAL可以在小鼠体内降解食物中苯丙氨酸,从而控制其血液中苯丙氨酸的浓度。小鼠安全性评价显示,工程益生菌EcN-PAL对小鼠无急性毒性、亚急性毒性和致畸作用,与出发菌株EcN的安全性一致。综上所述,工程益生菌EcN-PAL具有良好的苯丙氨酸降解效果,动物实验证实EcN-PAL菌株安全性高且可有效降低PKU小鼠血液中苯丙氨酸浓度,为后续用于PKU的治疗奠定基础。
[1] FLYDAL M I, MARTINEZ A.Phenylalanine hydroxylase:function, structure, and regulation[J].IUBMB Life, 2013, 65(4):341-349.
[2] ANIKSTER Y, HAACK T B, VILBOUX T, et al.Biallelic mutations in DNAJC12 cause hyperphenylalaninemia, dystonia, and intellectual disability[J].The American Journal of Human Genetics, 2017, 100(2):257-266.
[3] BLAU N, VAN SPRONSEN F J, LEVY H L.Phenylketonuria[J].The Lancet, 2010, 376(9750):1417-1427.
[4] ZOU C W, CHEN Y, LI H Y, et al.Engineered bacteria EcN-MT alleviate liver injury in cadmium-exposed mice via its probiotics characteristics and expressing of metallothionein[J].Frontiers in Pharmacology, 2022, 13:857869.
[5] LEVENTHAL D S, SOKOLOVSKA A, LI N, et al.Immunotherapy with engineered bacteria by targeting the STING pathway for anti-tumor immunity[J].Nature Communications, 2020, 11(1):2739.
[6] JIANG Y, SUN B B, QIAN F H, et al.Expression of phenylalanine ammonia lyase as an intracellularly free and extracellularly cell surface-immobilized enzyme on a gut microbe as a live biotherapeutic for phenylketonuria[J].Science China Life Sciences, 2023, 66(1):127-136.
[7] ENNS G M, KOCH R, BRUMM V, et al.Suboptimal outcomes in patients with PKU treated early with diet alone:Revisiting the evidence[J].Molecular Genetics and Metabolism, 2010, 101(2-3):99-109.
[8] SCALDAFERRI F, GERARDI V, MANGIOLA F, et al.Role and mechanisms of action of Escherichia coli Nissle 1917 in the maintenance of remission in ulcerative colitis patients:An update[J].World Journal of Gastroenterology, 2016, 22(24):5505.
[9] YAN X, LIU X Y, ZHANG D, et al.Construction of a sustainable 3-hydroxybutyrate-producing probiotic Escherichia coli for treatment of colitis[J].Cellular &Molecular Immunology, 2021, 18(10):2344-2357.
[10] KURTZ C, DENNEY W S, BLANKSTEIN L, et al.Translational development of microbiome-based therapeutics:Kinetics of E.coli Nissle and engineered strains in humans and nonhuman primates[J].Clinical and Translational Science, 2018, 11(2):200-207.
[11] SHAKIBA M, SANEIFARD H, ALAEI M R, et al.Clinical and paraclinical characteristics of non-classic phenylketonuria[J].Iranian Journal of Child Neurology, 2021, 15(3):131-138.
[12] NARDECCHIA F, MANTI F, DE LEO S, et al.Clinical characterization of tremor in patients with phenylketonuria[J].Molecular Genetics and Metabolism, 2019, 128(1-2):53-56.
[13] HODGINS D S.Yeast phenylalanine ammonia-lyase purification, properties, and the identification of catalytically essential dehydroalanine[J].Journal of Biological Chemistry, 1971, 246(9):2977-2985.
[14] ØRUM H, RASMUSSEN O F.Expression in E.coli of the gene encoding phenylalanine ammonia-lyase from Rhodosporidium toruloides[J].Applied Microbiology and Biotechnology, 1992, 36(6):745-748.
[15] GILBERT H J, CLARKE I N, GIBSON R K, et al.Molecular cloning of the phenylalanine ammonia lyase gene from Rhodosporidium toruloides in Escherichia coli K-12[J].Journal of Bacteriology, 1985, 161(1):314-320.
[16] PI J, WOOKEY P J, PITTARD A J.Cloning and sequencing of the pheP gene, which encodes the phenylalanine-specific transport system of Escherichia coli[J].Journal of Bacteriology, 1991, 173(12):3622-3629.
[17] ISABELLA V M, HA B N, CASTILLO M J, et al.Development of a synthetic live bacterial therapeutic for the human metabolic disease phenylketonuria[J].Nature Biotechnology, 2018, 36(9):857-864.
[18] CHARBONNEAU M R, DENNEY W S, HORVATH N G, et al.Development of a mechanistic model to predict synthetic biotic activity in healthy volunteers and patients with phenylketonuria[J].Communications Biology, 2021, 4(1):898.
[19] 张雪, 温廷益.Red重组系统用于大肠杆菌基因修饰研究进展[J].中国生物工程杂志, 2008, 28(12):89-93.ZHANG X,WEN T Y.Advances of red recombination system in Escherichia coli gene modification[J].China Biotechnology, 2008, 28(12):89-93.
[20] CHANG T M, BOURGET L, LISTER C.A new theory of enterorecirculation of amino acids and its use for depleting unwanted amino acids using oral enzyme-artificial cells, as in removing phenylalanine in phenylketonuria[J].Artificial Cells, Blood Substitutes, and Immobilization Biotechnology, 1995, 23(1):1-21.
[21] WILLIAMS J S, THOMAS M, CLARKE D J.The gene stlA encodes a phenylalanine ammonia-lyase that is involved in the production of a stilbene antibiotic in Photorhabdus luminescens TT01[J].Microbiology, 2005, 151(Pt 8):2543-2550.
[22] CHEREPANOV P P, WACKERNAGEL W.Gene disruption in Escherichia coli:TcR and KmR cassettes with the option of Flp-catalyzed excision of the antibiotic-resistance determinant[J].Gene, 1995, 158(1):9-14.
[23] DATSENKO K A, WANNER B L.One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products[J].Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(12):6640-6645.
[24] 文江平, 唐爱国.高效液相色谱法快速测定血清中的芳香族氨基酸[J].色谱, 2003, 21(2):154-157.WEN J P, TANG A G.Rapid analysis of aromatic amino acids in serum by high performance liquid chromatography[J].Chinese Journal of Chromatography, 2003, 21(2):154-157.
[25] 王楠, 田晗, 张文晓, 等.两株具有潜在益生作用的人源链球菌的安全性评价[J].食品与发酵工业, 2021, 47(5):12-16.WANG N, TIAN H, ZHANG W X, et al.Safety evaluation of two strains of human Streptococcus with potential probiotics[J].Food and Fermentation Industries, 2021, 47(5):12-16.
[26] 郑鹏, 田亚光, 黄贺.小鼠繁殖行为的观察与分析[J].黑龙江动物繁殖, 2013, 21(3):20-23.ZHENG P, TIAN Y G, HUANG H.Observation and analysis of reproductive behavior of mice[J].Heilongjiang Journal of Animal Reproduction, 2013, 21(3):20-23.
[27] CRIST BAL-LUNA J M, CORREA-BASURTO J, MENDOZA-FIGUEROA H L, et al.Anti-epileptic activity, toxicity and teratogenicity in CD1 mice of a novel valproic acid arylamide derivative, N-(2-hydroxyphenyl)-2-propylpentanamide[J].Toxicology and Applied Pharmacology, 2020, 399:115033.
BAL-LUNA J M, CORREA-BASURTO J, MENDOZA-FIGUEROA H L, et al.Anti-epileptic activity, toxicity and teratogenicity in CD1 mice of a novel valproic acid arylamide derivative, N-(2-hydroxyphenyl)-2-propylpentanamide[J].Toxicology and Applied Pharmacology, 2020, 399:115033.
[28] YU X L, LIN C S, YU J, et al.Bioengineered Escherichia coli Nissle 1917 for tumour-targeting therapy[J].Microbial Biotechnology, 2020, 13(3):629-636.