灰树花(Grifola frondosa)一种名贵的药食两用真菌,具有多种活性功能,如:抗氧化[1-2]、降血糖[3]、降血脂[4]、抗肿瘤[5],并且含有较为丰富的生物活性物质(灰树花多糖、多酚、甾醇类、萜类等)[6]。天麻(Rhizoma gastrodiae)作为林地中药资源,在贵州各地区广泛种植,因其富含天麻素(p-hydroxymethylphenyl-β-D-glucopyranoside, GA)、巴利森苷(parishin)等药理成分,是中国记录和应用最早的中药之一[7-8]。利用真菌发酵提高产品营养价值和改善风味口感由来已久。“茯砖茶”作为一种发酵茶饮品,利用真菌微生物冠突散囊菌俗称“金花”,其分泌的胞外酶催化多酚类氧化,儿茶素各组分发生氧化聚合,从而减少茯砖茶的苦涩味,增加发酵茶醇和的滋味,“菌花香”成为茯砖茶的特殊香味,对改善茯茶的滋味品质起到了积极作用。中国传统药食同源发酵产品“六神曲”、“红曲米”通过真菌发酵,改变了原料的药效,促进人体健康。课题组通过前期的实验探索,将已优化的苦荞、薏仁米等物质作为一种新型发酵基质,已验证其菌丝体可以正常生长代谢且天麻醇提物能够显著促进灰树花液态发酵菌丝体的生长和多糖产量以及提高灰树花胞外酶——漆酶的活力[9-10]。本试验将不同比例的天麻作为外源添加物参与灰树花的固态发酵,探究天麻对灰树花的生长代谢和其分泌的内切葡聚糖酶(endoglucanase,CMC)、外切葡聚糖酶(exoglucanase,CBH)、滤纸酶(filter paper enzyme,FPA)和淀粉酶活力的影响,旨在探索利用中药成分促进药食用真菌胞外酶的活力和活性成分的含量。采用灰树花菌丝体参与基质发酵,探究不同阶段灰树花参与药食同源谷物发酵对菌质中挥发性成分的种类和含量的变化规律,旨在通过灰树花发酵改变菌质感官风味[11]。通过天麻和灰树花的共发酵丰富了中药资源生物增效的途径[12],促进中药和食用菌资源的开发利用,为菌质产品开发成为健康食品或茶饮提供了参考。
1 材料与方法
1.1 材料与试剂
灰树花(Grifola frondosa,菌种编号:5.404),中国普通微生物菌种保藏管理中心;天麻,贵州省大方县;GA对照品、巴利森苷对照品、二水柠檬酸钠、无水柠檬酸、DNS试剂、羧甲基纤维素钠(sodium carboxymethyl cellulose,CMC-Na),北京索莱宝科技有限公司;滤纸、医用脱脂棉、淀粉,国药集团化学试剂有限公司;其余试剂均为市售分析纯。
斜面培养基为马铃薯葡萄糖琼脂培养基(potato glucose agar,PDA)。
1.2 仪器与设备
BXM-30R型立式灭菌锅、恒温培养箱,上海博讯实业有限公司医疗设备厂;SW-CJ-1D型净化工作台,苏州净化设备有限公司;TGL-20M型台式高速冷冻离心机,长沙迈佳森仪器设备有限公司;CTFD-12S型真空冷冻干燥机,青岛永合创信电子科技有限公司;Agilent 1100型高效液相色谱仪及检测器、Agilent 5TC-C18型色谱柱,美国Agilent公司;YB-250A超微粉碎机,永康市速锋工贸有限公司;SCIONSQ-456-GC气相色谱-质谱联用仪,美国布鲁克公司;50/30 μmCAR/DVB/PDMS固相微萃取纤维头,美国Supelco公司。
1.3 实验方法
1.3.1 菌丝体培养
从母种试管中挑取黄豆粒大小菌丝块接种于PDA培养皿中部,25 ℃恒温培养,至菌丝长满整个斜面,转置4 ℃保存。
1.3.2 发酵培养
培养基成分组成(g):苦荞粉4.5、苦荞皮1.5、薏仁米1.5、麸皮0.4、葡萄糖0.1。
天麻粉:天麻烘干,超微粉碎机打碎成天麻粉,过60目筛。分别按照培养基组分质量的0%、10%、20%、30%、40%、50%加入到发酵培养基中参与固态发酵。
将上述材料混匀加水,置于灭菌锅中灭菌(121 ℃、30 min),培养基降低到室温,从母种试管中挑取黄豆粒大小菌丝块接种于培养皿中部,放入恒温恒湿培养箱中静态培养,进行生长发酵12 d(25 ℃)。
1.3.3 发酵菌质的处理
发酵菌质在恒温恒湿培养箱中分别培养0、7、8、9、10、11、12 d和0、6、8、10、12 d后,将其真空冷冻干燥,经干燥的发酵物超微粉碎并过80目筛,收集粉末,置于-20 ℃条件下保存,作为实验材料。
1.4 分析方法
1.4.1 GA、巴利森苷含量的测定[13]
1.4.1.1 色谱条件
仪器:高效液相色谱紫外检测器;色谱柱:Agilent 5TC-C18型色谱柱(250 mm×4.6 mm,5 μm);洗脱程序:0~35 min(0%~30% B),35~40 min(30%~100% B),40~45 min(100%~3% B);流动相:0.1%的磷酸水(D)、乙腈(B);流速1 mL/min;检测波长221 nm;柱温30 ℃。
1.4.2 纤维素酶及淀粉酶活力测定
1.4.2.1 粗酶液的制备及酶活力测定
精确称取各实验组菌质粉末0.1 g,发酵12 d后,加冰水10 mL,25 ℃浸提1 h,150 r/min振荡,最后10 000 r/min离心10 min,收集上清液,4 ℃冰箱中保存,备用。
1.4.2.2 CMC活力的测定
参考文献[14]的测定方法。
1.4.2.3 FPA活力的测定
参考文献[15]的测定方法。
1.4.2.4 CBH活力的测定
参考文献[16]的测定方法。
1.4.2.5 淀粉酶活力的测定
在试管(1支空白管,3支样品管)中加入1.5 mL可溶性淀粉溶液(20 g/L),置于45 ℃水浴预热5 min,再加入0.5 mL稀释好的酶液(空白管不加),45 ℃水浴中保温30 min立即取出,显色过程参照1.4.2.2节。
酶活力单位(U/mL)定义:在测定条件下,每分钟水解底物生成1 μg葡萄糖所需的酶量。计算如公式(1)。
酶活力![]()
(1)
式中:S,样品平均吸光度在标曲上相对应的葡萄糖含量,mg;D,粗酶液的稀释倍数;1 000,mg与μg之间的换算系数;V,参与反应的粗酶液体积,mL;T,反应时间,min。
1.4.2.6 葡萄糖含量的测定
标准曲线的绘制:精确称取500 mg葡萄糖(105 ℃烘干至恒重),于500 mL容量瓶中,蒸馏水配制浓度为1 mg/mL的葡萄糖标准品。分别吸取0、0.2、0.4、0.6、0.8、1.0 mL的葡萄糖标准品溶液于具塞管中,加去离子水至2 mL,随后加入DNS试剂1.5 mL,混匀后沸水浴5 min,冷却至室温定容至25 mL,于520 nm处测定吸光度。以葡萄糖浓度为横坐标,吸光值为纵坐标绘制标准曲线。
还原糖含量以葡萄糖当量(dextrose equivalent, DE)表示。
样品的测定:按照标准曲线的方法进行测定,在520 nm处测定吸光度,代入标准方程计算其还原糖含量。
1.4.3 样品挥发性成分检测方法
1.4.3.1 待测样品的配制
取2.0 g样品置于20 mL顶空瓶中,将老化后的50/30 umCAR/PDMS/DVB萃取头插入样品瓶顶空,于60 ℃吸附30 min,取出后插入气相色谱进样口,于250 ℃解吸3 min,同时启动仪器采集数据。
将C6~C26的正构烷烃与样品在同样色谱条件下进行分析,通过仪器操作软件计算出各物质的保留指数(retention index, RI)。
1.4.3.2 GC-MS条件
柱升温程序:初始温度40 ℃,保持3 min,以10 ℃/min升至250 ℃,保持4 min,进样口温度250 ℃;载气流速1.0 mL/min;载气He;进样方式恒流;电子轰击离子源EI源;离子源温度200 ℃;接口温度250 ℃;电子能源70 eV;扫描范围m/z为50.0~500.0;灯丝发射电力1 mA;质谱图利用NIST谱库进行检索比对和CAS编码查询,并结合有关文献进行鉴定。
1.5 数据处理与分析
使用Origin 10软件作图,使用SPSS 19.0软件进行数据分析。实验数据以平均值±标准偏差表示(n=3),使用单因素方差分析(ANOVA)和配对T-检验进行显著性分析,P<0.05表示数据具有显著性差异。
2 结果与分析
2.1 天麻参与灰树花固态发酵对其生长及天麻主要成分GA、巴利森苷的影响
由表1可知,天麻添加量为40%,显著地促进灰树花的生长速度,达到0.86 cm/d,且菌丝生长致密,相较对照组提高4.9%,图1为固态发酵12 d菌质整体及截面图,结果表明天麻作为外源添加物能够促进灰树花的生长。表2为天麻素、巴利森苷标品标准曲线。由表3可知,当添加10%、20%、30%、40%、50%天麻时,发酵组能够完全降解GA(未检测到)且均能够提高巴利森苷的含量。并在50%天麻添加量时效果最为显著(P<0.05)。表明天麻参与灰树花固态发酵能够显著促进菌丝体的生长,且整个发酵体系存在着GA降解以及巴利森苷生成的生物转化过程,且2种成分的降解和转化均受天麻含量的影响。

a-菌质背面;b-菌质剖面;c-菌质正面
图1 固态发酵12 d菌质整体及截面图
Fig.1 Overall and cross-sectional views of fungal substance after 12 days of solid-state fermentation
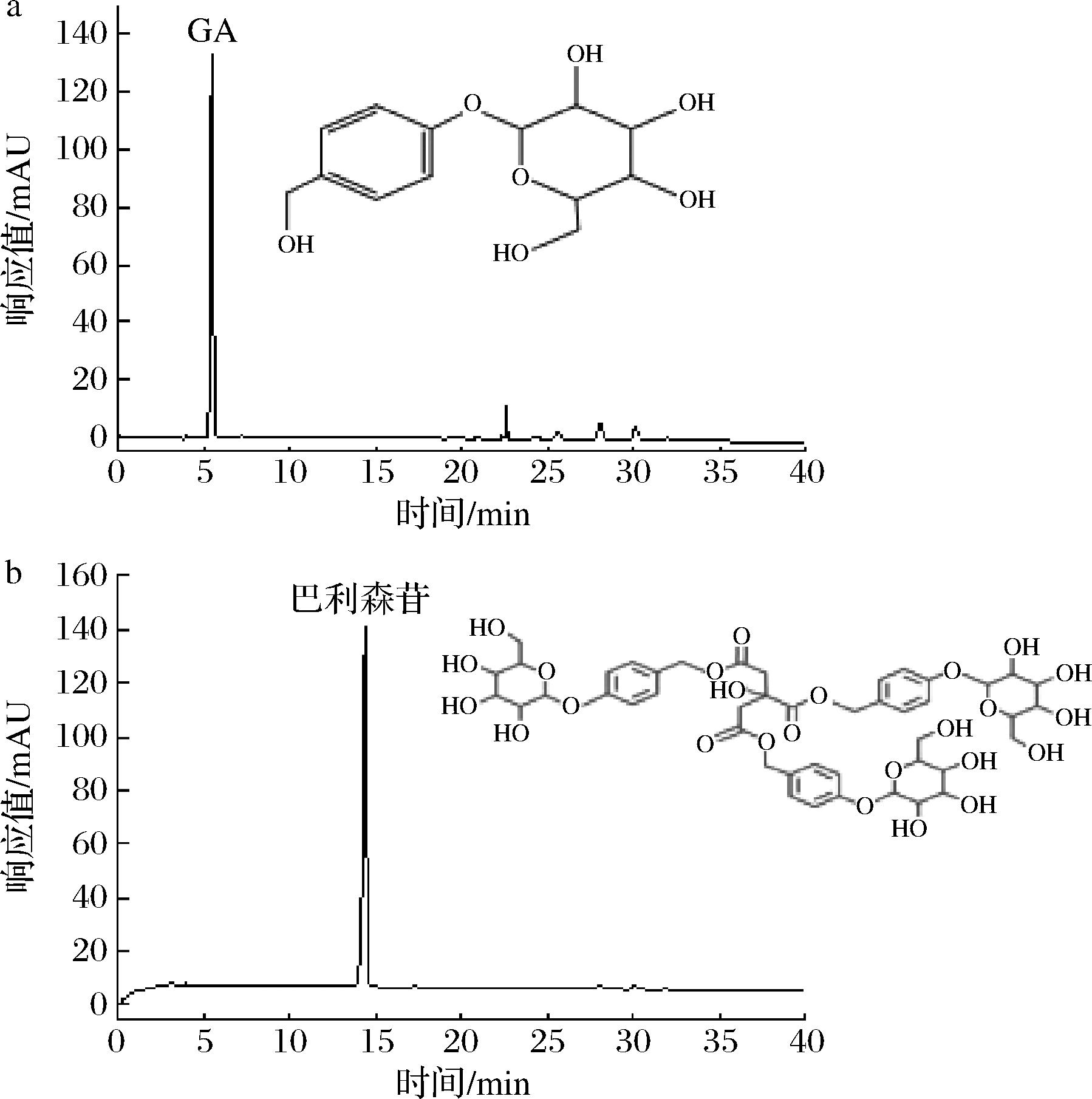
a-GA;b-巴利森苷
图2 GA、巴利森苷的标准对照品色谱图
Fig.2 Chromatograms of standard reference substances of GA and parishin
表1 不同天麻添加量对菌丝生长的影响
Table 1 The effect of different proportions ofR.gastrodiae on mycelial growth
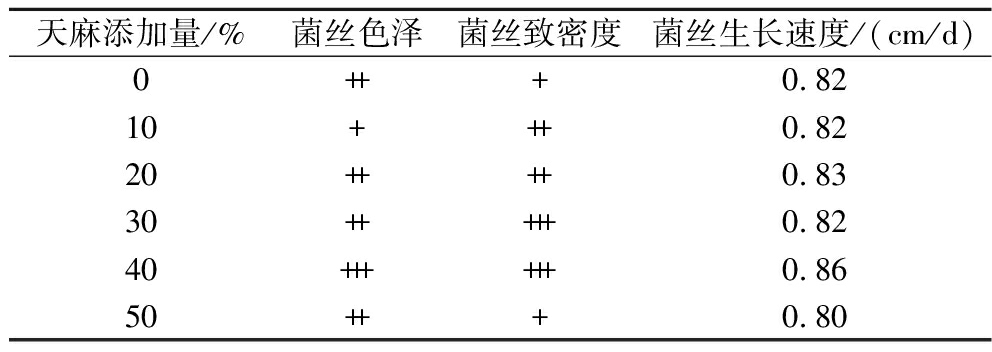
天麻添加量/%菌丝色泽菌丝致密度菌丝生长速度/(cm/d)0+++0.8210+++0.8220++++0.8330+++++0.8240++++++0.8650+++0.80
注:“+”:色泽微黄,菌丝稀疏;“++”:色泽米白,菌丝较为致密;“+++”:色泽纯白,菌丝旺盛。
表2 GA、巴利森苷标品标准曲线
Table 2 Standard curve of GA and parishin

标品标准方程式R2GAy=2 051 422.56x+7.321.00巴利森苷y=1 965 225.26x-7.361.00
表3 灰树花发酵对GA和巴利森苷的影响
Table 3 The influence of Grifola frondosa on the GA and parishin
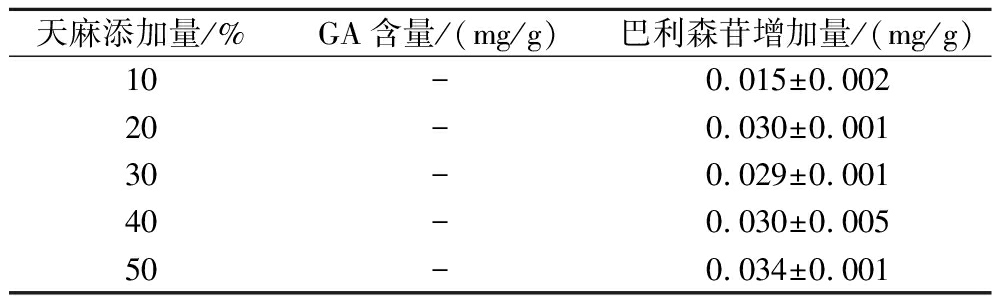
天麻添加量/%GA含量/(mg/g)巴利森苷增加量/(mg/g)10-0.015±0.00220-0.030±0.00130-0.029±0.00140-0.030±0.00550-0.034±0.001
注:“-”表示未检出。
2.2 不同天麻添加量对灰树花分泌纤维素酶及淀粉酶活力的影响
基质中的纤维素和淀粉在纤维素酶和淀粉酶的作用下水解成小分子葡萄糖、寡糖等,提供菌丝体生长所需碳源[17-18]。胞外酶的酶活力直接影响菌丝体分解代谢基质成分的能力。由图3可知,添加10%、20%、30%、40%、50%的天麻,4种酶的酶活力均提高。FPA、CBH、淀粉酶活力随着添加比例的升高而增大,且在天麻添加量为40%时3种酶的活力均达到了最大,分别为(28.67±1.15)、(37.67±2.52)和(38.00±2.00) U/mL,三者的酶活力分别为空白组(未添加天麻)的1.78倍、0.61倍和1.19倍(P<0.05)。天麻添加量为40%时,对FPA、CBH、淀粉酶的活力均具有显著促进作用,但当天麻添加量高于40%时,3种酶的酶活力却呈现降低趋势,原因可能为胞外酶的活力受到天麻成分的影响和各种酶的结构差异,且天麻成分对4种酶的酶活力影响不同。总体而言,当天麻添加量为40%时,对纤维素酶和淀粉酶活力具有显著促进作用。由图4可知,40%天麻添加量下,基质的还原糖生成量显著高于其他组别(P<0.05)。
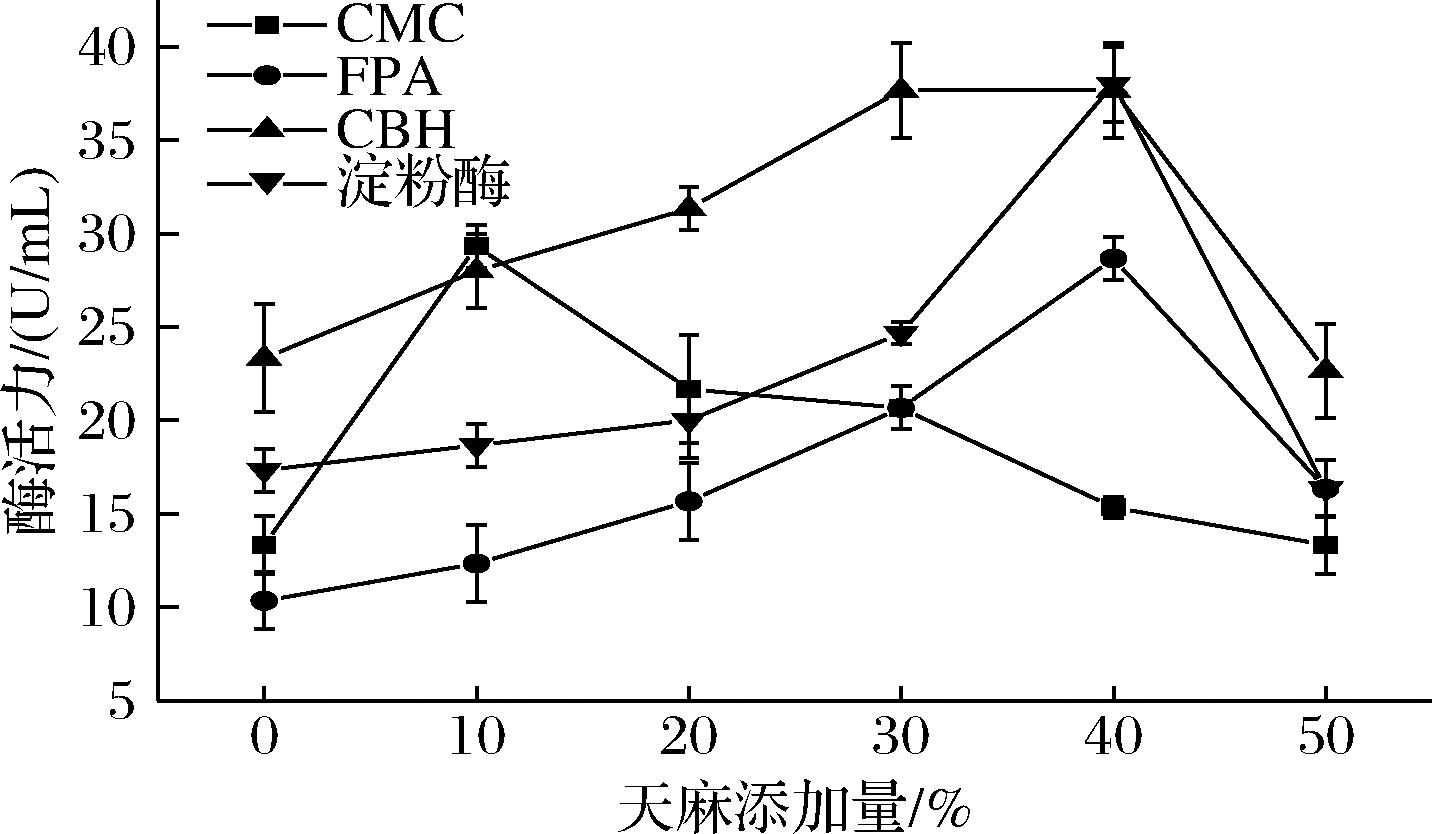
图3 不同天麻量对酶活力的影响
Fig.3 Effect of different amounts of R.gastrodiaeon enzyme activity
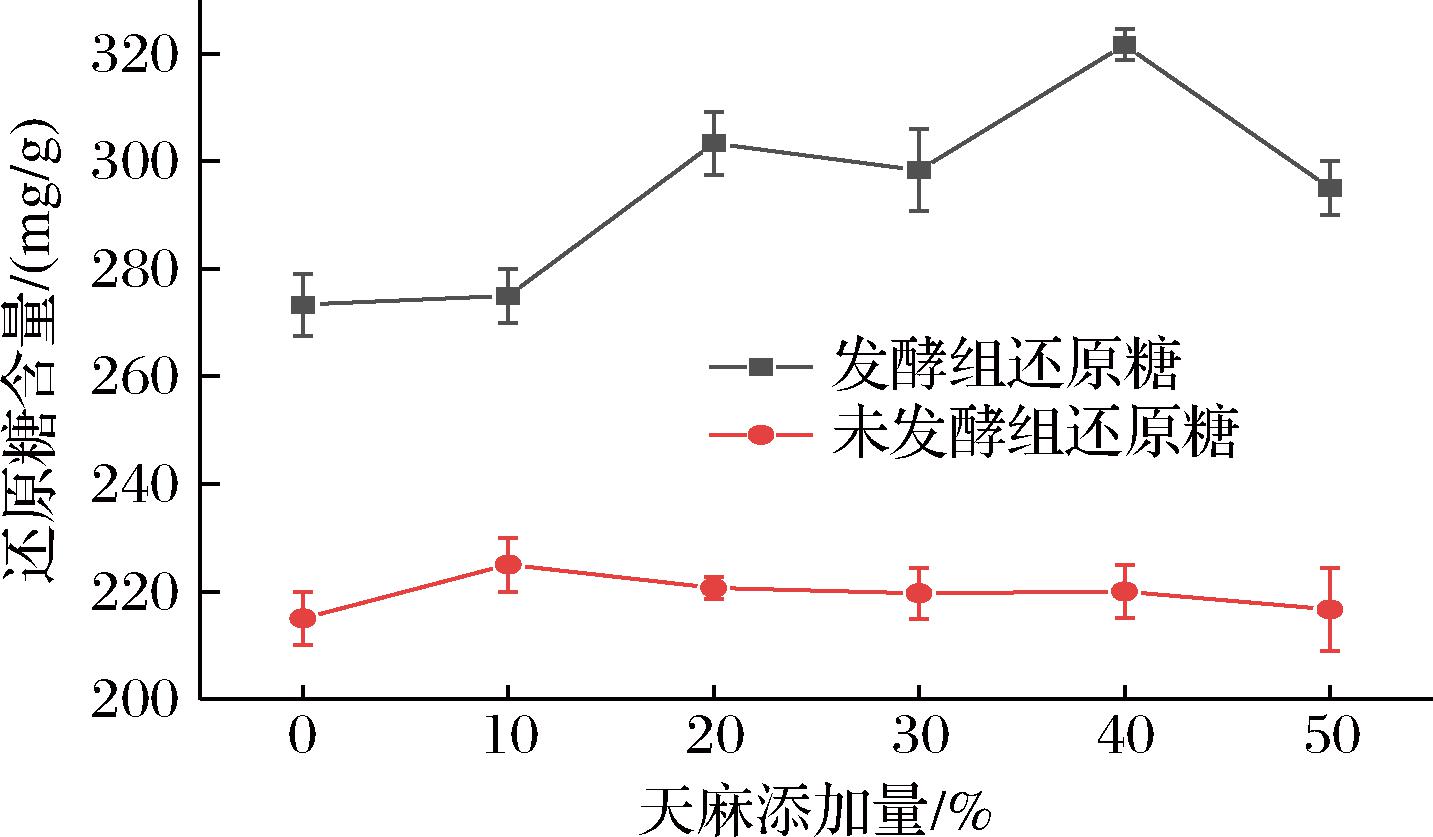
图4 不同天麻量对还原糖含量的影响
Fig.4 Effect of different amounts of R.gastrodiaeon reducing sugar content
由图5可知,发酵过程4种酶的酶活力存在不同的变化趋势。CMC的活力随着发酵时间的延长,在第7天达到最大酶活力(27.20±0.14) U/mL,7 d后其酶活力逐渐下降;FPA在第10天达到了最大酶活力(20.49±0.12) U/mL;CBH活力呈先上升后下降的趋势并在第9天达到了最大酶活力(81.30±0.26) U/mL;淀粉酶活力变化呈现与CBH相同的趋势,第9天达到最大酶活力(30.57±0.33) U/mL。通过对4种酶的酶活力变化趋势分析,并结合基质在发酵阶段还原糖含量的变化情况,研究发现,在灰树花发酵初始阶段,为满足生长所需碳源,纤维素酶和淀粉酶等相关胞外酶对基质进行酶解以提供可直接利用的碳源,在第9~10天达到最大酶活力,一方面随着时间的延长,基质中碳源充足,足以满足生长所需,碳源刺激酶活力降低,另一方面随着时间延长,酶结构受到外界因素(pH、CO2、离子)的干扰和破坏,从而导致酶活力降低[19]。结果表明,天麻作为外源添加物参与灰树花固态发酵,通过促进纤维素酶和淀粉酶活力提高碳源的生成速率以满足灰树花的生长代谢。
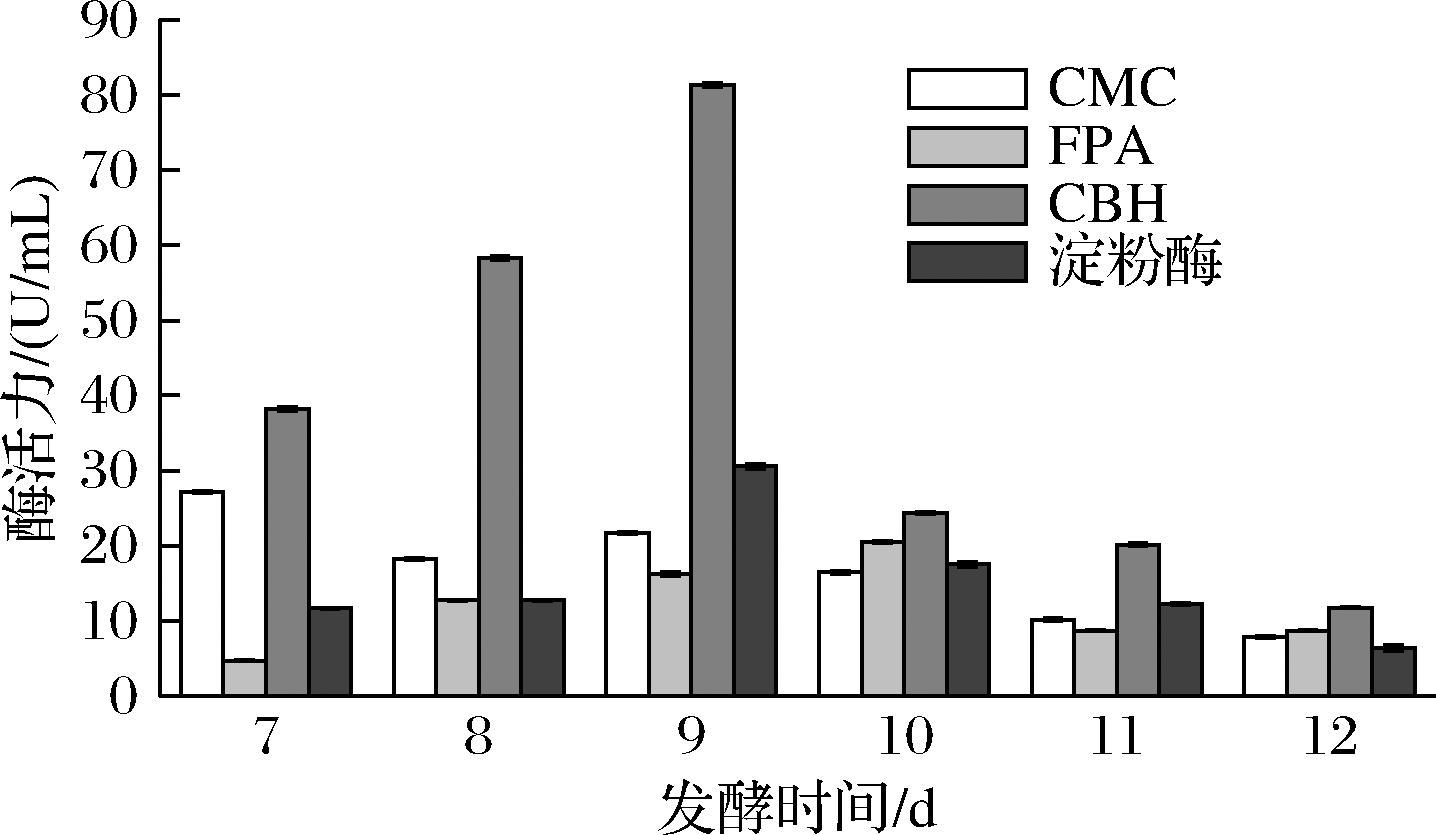
图5 发酵过程中4种酶酶活力变化情况
Fig.5 Changes in the activities of four enzymes during the fermentation process
2.3 不同发酵阶段菌质挥发性成分种类的变化趋势
发酵过程菌质中挥发性成分的种类具有很大的差异。由图6可知,发酵0 d(未发酵组)总挥发性成分种类共115种,随着发酵时间的延长,在分别发酵6、8、10、12 d后,挥发性成分的种类分别增加至123、116、143、130种,相较于发酵0 d组,挥发性成分的种类分别增加了8、1、28、15种,且在发酵第10天,挥发性成分的种类增加最多。随着发酵时间的延长,烷类种类逐渐减少,酯类、醛类和醇类种类逐渐增加。相较于未发酵组,以酯类、醛类和醇类为主的3种呈香成分(果香、花香、菇香、草香)[20]在发酵第12天分别增加了15、8和4种。研究表明,通过灰树花对培养基质的发酵,能够促进菌质风味化合物的产生,改善其风味品质。
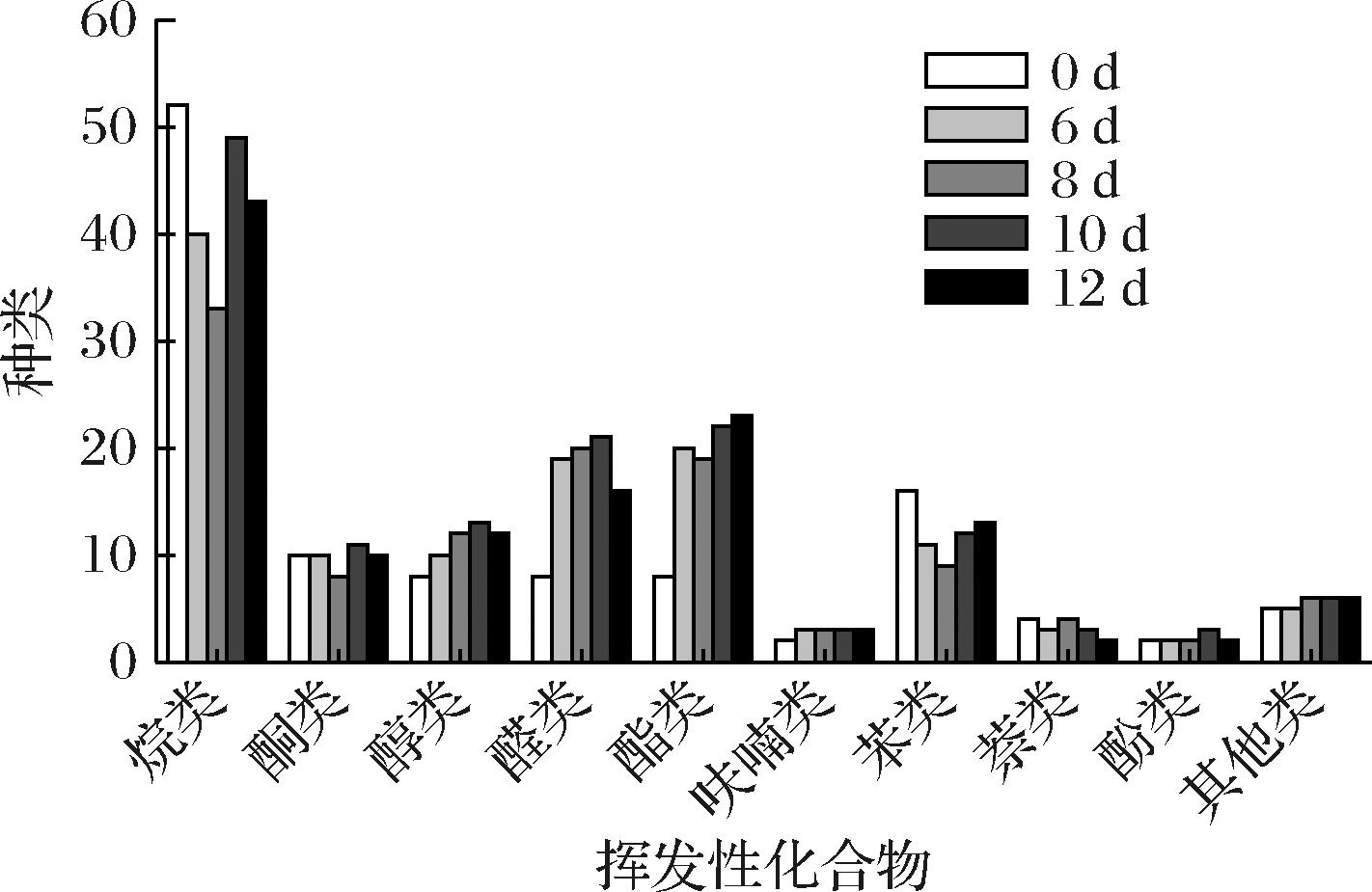
图6 不同发酵阶段挥发性化合物种类变化
Fig.6 Changes in the species of volatile compounds in different fermentation stages
2.4 不同发酵阶段菌质挥发性成分含量变化趋势
由图7可知,5个不同发酵阶段基质挥发性成分含量均在不断地变化。未发酵阶段,其主要挥发性成分为烷烃类(40.37%),其次为醛类(24.11%)、酮类(17.85%)、苯类(5.94%)、呋喃类(4.91%)、醇类(3.09%)和酯类(0.53%);发酵到12 d,含量最高则为醛类(26.83%),其次为酮类(25.38%)、醇类(25.35%)和酯类(3.71%)。在发酵过程中产生的己醛(苹果和番茄气味)、反式-2-己烯醛(绿叶清香和水果香气)、1-辛烯-3-醇(蘑菇和泥土味)、3-辛酮(果实香味)、3-辛醇(蘑菇、干酪、薄荷和药草类气味)、正辛醛(甜橙香气)、2-苯基乙醛(玉簪花香气)、2,6-二甲基-5-庚烯醛(甜瓜清香)、反-2-辛烯醛(呈脂肪和肉类香气并有黄瓜和鸡肉香)、正辛醇(有强烈的油脂气味和柑橘气息)、苯甲酸甲酯(花香和樱桃香味)、3,7-二甲基-1,6-辛二烯-3-醇乙酸酯(柠檬香气)、壬醛(玫瑰、柑橘香气)、辛酸(稀释后呈水果香气)、癸醛(柑橘香、蜡香、花香)、乙酸苯乙酯(玫瑰花香,类似苹果的果香)、肉桂酸甲酯(呈樱桃香气)等呈香物质的含量与发酵0 d(未发酵组)相比较,含量均显著提高,且以上挥发性成分对于改善发酵菌质的风味具有突出贡献。
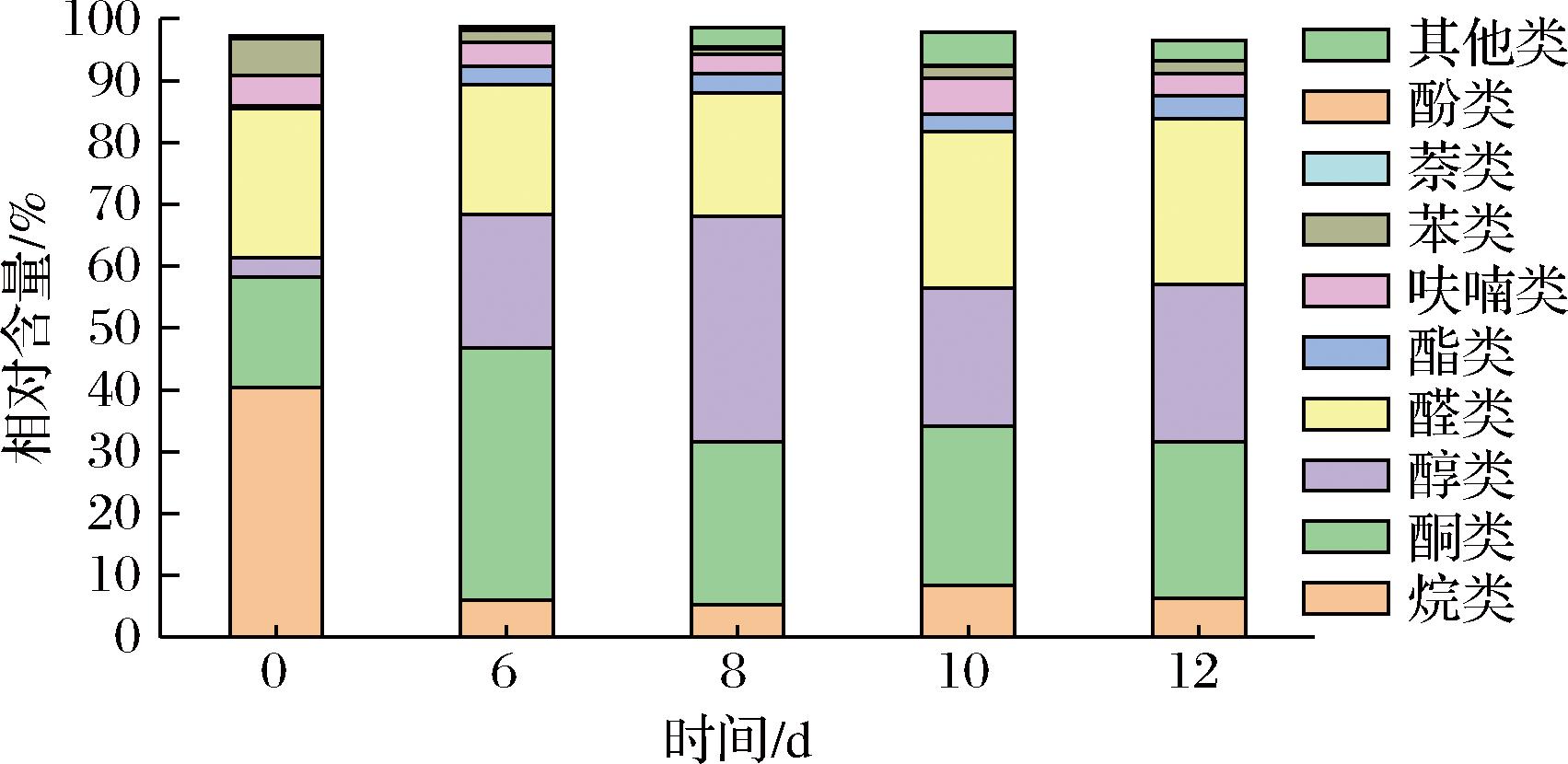
图7 不同发酵阶段挥发性化合物含量的变化
Fig.7 Changes in the content of volatile compounds in different fermentation stages
3 结论
中药天麻作为外源添加物参与灰树花固态发酵,在添加量为40%时,灰树花菌丝体生长速度达到0.86 cm/d,相比于对照组提高了4.9%。经由发酵作用能够显著提高巴利森苷含量,并且除CMC外,FPA、CBH、淀粉酶活力均达到了最大,三者的酶活力分别为空白组(未添加天麻)的1.78倍、0.61倍和1.19倍,验证了纤维素降解速率除了受到酶系组成之外,基质的物理结构和成分组成等同样对其产生影响。随着发酵的进行,4种胞外酶在第9~10天达到最大酶活力;其次,菌质挥发性成分的种类和含量均随发酵时间延长而呈现不同程度的改变,烷烃种类逐渐减少,酯类、醛类和醇类种类逐渐增加,并且以酯类、醛类和醇类为主的呈香成分相较于未发酵组,在发酵第12天分别增加了15、8、4种,并且在发酵过程中产生了多种对菌质风味起到积极作用的挥发性化合物。天麻参与发酵可以提高纤维素酶和淀粉酶的活力并提升菌质呈香物质的种类和含量,为菌质产品的开发提供有力支撑,开拓了中药资源与食用菌资源的利用方法和途径。
[1] ZHANG Z Q, LIU L P, LEI L, et al.Antioxidative and immunomodulatory activities of the exopolysaccharides from submerged culture of hen of the woods or Maitake culinary-medicinal mushroom, Grifola frondosa (agaricomycetes) by addition of rhizoma gastrodiae extract and its main components[J].International Journal of Medicinal Mushrooms, 2019, 21(8):825-839.
[2] LIU Z J, JIAO Y C, LU H Y, et al.Chemical characterization, antioxidant properties and anticancer activity of exopolysaccharides from Floccularia luteovirens[J].Carbohydrate Polymers, 2020, 229:115432.
[3] LU H Y, LOU H H, HU J J, et al.Macrofungi:A review of cultivation strategies, bioactivity, and application of mushrooms[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(5):2333-2356.
[4] GUO W L, DENG J C, PAN Y Y, et al.Hypoglycemic and hypolipidemic activities of Grifola frondosa polysaccharides and their relationships with the modulation of intestinal microflora in diabetic mice induced by high-fat diet and streptozotocin[J].International Journal of Biological Macromolecules, 2020, 153:1231-1240.
[5] HE X R, WANG X X, FANG J C, et al.Polysaccharides in Grifola frondosa mushroom and their health promoting properties:A review[J].International Journal of Biological Macromolecules, 2017, 101:910-921.
[6] YEH J Y, HSIEH L H, WU K T, et al.Antioxidant properties and antioxidant compounds of various extracts from the edible basidiomycete Grifola frondosa (Maitake)[J].Molecules, 2011, 16(4):3197-3211.
[7] 李旭, 徐天娇, 刘立琨, 等.天麻素联合异钩藤碱抑制MPP+诱导的PC12细胞凋亡的抗氧化机制[J].中国中药杂志, 2021, 46(2):420-425.LI X, XU T J, LIU L K, et al.Antioxidant mechanism of gastrodin combined with isorhynchophylline in inhibiting MPP+-induced apoptosis of PC12 cells[J].China Journal of Chinese Materia Medica, 2021, 46(2):420-425.
[8] 田孟华, 袁天军, 周瑞, 等.不同产地及变型天麻有效成分差异性分析[J].中成药, 2020, 42(7):1824-1829.TIAN M H, YUAN T J, ZHOU R, et al.Difference analysis of effective constituents in different growing areas and varieties of Gastrodia elata[J].Chinese Traditional Patent Medicine, 2020, 42(7):1824-1829.
[9] 朱俊杰, 吴天祥, 吴彩云, 等.对羟基苯甲醇对灰树花产胞外多糖的影响及其发酵动力学[J].食品科学, 2016, 37(19):123-127.ZHU J J, WU T X, WU C Y, et al.Effect of p-hydroxybenzyl alcohol on the biosynthesis of exopolysaccharide by submerged culture of Grifola frondosa and fermentation kinetics[J].Food Science, 2016, 37(19):123-127.
[10] 张宗启, 吴天祥, 刘力萍.灰树花多糖结构特点及其生物活性研究进展[J].中国酿造, 2018, 37(5):10-16.ZHANG Z Q, WU T X, LIU L P.Research progress on structural characteristics and bioactivities of the polysaccharides from Grifola frondosa[J].China Brewing, 2018, 37(5):10-16.
[11] 唐柯, 张小倩, 李记明, 等.威代尔冰葡萄酒发酵过程中香气动态变化规律[J].食品与发酵工业, 2021, 47(1):62-70.TANG K, ZHANG X Q, LI J M, et al.Dynamic changes of aroma during Vidal ice wine fermentation[J].Food and Fermentation Industries, 2021, 47(1):62-70.
[12] CHO K M, HONG S Y, MATH R K, et al.Biotransformation of phenolics (isoflavones, flavanols and phenolic acids) during the fermentation of cheonggukjang by Bacillus pumilus HY1[J].Food Chemistry, 2009, 114(2):413-419.
[13] 芦红云, 吴天祥, 钟敏, 等.天麻提取物及其3种主要成分对灰树花产胞外漆酶和菌丝体的影响[J].食品科学, 2018, 39(6):101-106.LU H Y, WU T X, ZHONG M, et al.Effect of rhizoma gastrodiae extract and its three main components on production of laccase and mycelial biomass by submerged fermentation of Grifola frondosa[J].Food Science, 2018, 39(6):101-106.
[14] 赵萍, 夏文旭, 郭健, 等.一株玉米秸秆纤维素分解菌株的分离鉴定及酶学性质[J].微生物学通报, 2016, 43(5):991-997.ZHAO P, XIA W X, GUO J, et al.Isolation, identification of a strain decomposing corn stalk and characterization of its cellulose[J].Microbiology China, 2016, 43(5):991-997.
[15] 黄春凯, 左小明, 王红蕾, 等.一株产纤维素酶菌株的分离、鉴定及产酶特性[J].微生物学通报, 2015, 42(4):646-653.HUANG C K, ZUO X M, WANG H L, et al.Isolation, identification and characterization of a cellulase-producing strain[J].Microbiology China, 2015, 42(4):646-653.
[16] 许玉林, 郑月霞, 叶冰莹, 等.一株纤维素降解真菌的筛选及鉴定[J].微生物学通报, 2013, 40(2):220-227.XU Y L, ZHENG Y X, YE B Y, et al.Isolation and identification of a cellulose degrading fungi[J].Microbiology China, 2013, 40(2):220-227.
[17] BHANJA T, KUMARI A, BANERJEE R.Enrichment of phenolics and free radical scavenging property of wheat koji prepared with two filamentous fungi[J].Bioresource Technology, 2009, 100(11):2861-2866.
[18] CAMASSOLA M, DILLON A J P.Biological pretreatment of sugar cane bagasse for the production of cellulases and xylanases by Penicillium echinulatum[J].Industrial Crops and Products, 2009, 29(2-3):642-647.
[19] 郭艳艳, 阮玲云, 冯宏昌, 等.不同营养条件下斑玉蕈菌丝生长及产酶特性[J].菌物学报, 2014, 33(3):697-705.GUO Y Y, RUAN L Y, FENG H C, et al.Characteristics of mycelial growth and enzyme production of Hypsizygus marmoreus under different nutritional conditions[J].Mycosystema, 2014, 33(3):697-705.
[20] 代晨曦, 张旺, 张丹丹, 等.赤霞珠葡萄酒苹果酸-乳酸发酵过程中香气成分动态变化[J].食品与生物技术学报, 2020, 39(8):99-105.DAI C X, ZHANG W, ZHANG D D, et al.Dynamic changes of aroma components in malolactic fermentation of cabernet sauvignon wine[J].Journal of Food Science and Biotechnology, 2020, 39(8):99-105.