近年来,有益微生物在现代农业中受到了特别关注。植物根际促生细菌(plant growth-promoting rhi-zobacteria,PGPR)用于减少农艺作物中的生物胁迫以应对作物种植中的挑战[1]。PGPR促生长特性包括通过钾和磷的溶解、固氮、铁载体的产生、吲哚乙酸(indole-3-acetic acid,IAA)的产生、1-氨基环丙烷-1-羧酸脱氨酶的活性、对植物病原体的拮抗等机制来增强植物对生物和非生物胁迫的耐受性[2]。PGPR是提高土壤肥力和促进作物生长的可持续替代方案[3]。其中,肠杆菌认为是作物种植过程中肥料的替代产品[4]。
IAA作为一种常见的促生长激素,在植株生长发育过程中起重要作用,也是贯穿植株生长发育的一类激素,其主要作用于植物细胞分裂、伸长、分化和种子萌发、根系发育以及营养生长等主要过程[5]。IAA对植物的影响与其浓度高低有极大关系,在生理功能上起着完全不同的作用[6]。传统IAA生产以化学合成法为主,具有高能耗、高污染和高成本等问题[7]。用微生物发酵法合成IAA,有生长迅速、发酵周期短和产量高等优势[8]。除了产物IAA能促进植株生长外,其他代谢产物对于抗病虫害也有一定作用[9]。
本研究通过对实验室已保藏产IAA烟草肠杆菌(Enterobacter tabaci)β7菌株发酵特性进行研究,确定其最佳发酵条件以期达到最大IAA产量,在此基础上研究不同添加剂(抑菌剂、保护剂、乳化剂)对菌剂活菌数和IAA保留率的保护作用,为微生物发酵产IAA和菌剂制备提供理论基础。
1 材料与方法
1.1 材料与仪器
1.1.1 试剂
烟草肠杆菌(Enterobacter tabaci)β7菌株:本实验室所保藏。蔗糖、海藻酸钠、甘油、吐温-80、吐温-60、吐温-20、山梨酸钾、鼠李糖、没食子酸丙酯、IAA标准品,上海麦克林生化科技有限公司;酵母粉,北京拜尔迪生物技术有限公司;MgSO4·7H2O,广东汕头市西陇化工厂;FeCl3,天津市风船化学试剂科技有限公司。
1.1.2 培养基
Luria-Bertani(LB)液体培养基(g/L):酵母粉5.0,蛋白胨10.0,NaCl 10.0。
LB半固体培养基(g/L):酵母粉5.0,蛋白胨10.0,NaCl 10.0,琼脂粉15。
发酵培养基(g/L):半乳糖2.5,酵母粉1.5,MgSO4·7H2O 0.05,K2HPO4 0.3,丙酮酸钠0.3。
L-色氨酸,溶于弱碱性溶液,0.22 μm微孔滤膜除菌后备用。
Salksowski比色液制备:15 mL 0.5 mol/L FeCl3溶液+300 mL浓硫酸+500 mL超纯水,现配现用。
1.1.3 仪器与设备
QYC-211摇床,上海福玛实验设备有限公司;DHP-9162恒温培养箱,太仓市科教器械厂;LDZX-50KBS立体压力蒸汽灭菌器,上海申安医疗器械厂;J6-MI冷冻离心机,美国Beckman公司;HW·SY11-K电热恒温水浴锅,北京市长风仪器仪表有限公司;UV-1500紫外可见分光光度计,上海美析仪器有限公司;SW-OJ-1F超净工作台,苏净集团苏州安泰空气技术有限公司;BIOTFCH-5BG高位灭菌发酵系统,上海保兴生物设备工程有限公司。
1.2 实验方法
1.2.1 β7菌株活化
将β7菌株以1%接种量接入到LB液体培养基中,避光培养12 h。取100 mL菌液稀释涂布到LB半固体培养基培养12 h,挑取单菌落到LB液体培养基,培养12 h后作为种子液。
1.2.2 β7菌株发酵条件优化
考察碳源种类(葡萄糖、阿拉伯糖、果糖、麦芽糖、乳糖、木糖、蔗糖、半乳糖、可溶性淀粉、玉米淀粉、甘露糖等)和浓度、氮源种类(酵母粉、蛋白胨、酪蛋白、大豆蛋白、玉米浆粉、尿素、硝酸铵、硫酸铵、麦芽提取物等)和浓度、色氨酸添加量和接种量对发酵产IAA的影响。选取单因素实验最佳碳源半乳糖、最佳氮源酵母粉、色氨酸及接种量为考察因素,以IAA产量为响应值,设计了4因素3水平Box-Behnken响应面分析实验,进一步优化发酵条件。
1.2.3 外源添加剂对β7菌株菌剂保藏效果的研究
选取蔗糖、海藻酸钠、甘油3种保护剂,吐温-80、吐温-60、吐温-20 3种乳化剂,山梨酸钾、鼠李糖、没食子酸丙酯3种抑菌剂,分别以2 g/L添加到发酵液中,摇床振荡10 min,避光4 ℃保藏,在6、12、18、24 d测定活菌数和IAA保留率,以β7发酵36 h菌液作为对照(CK)组,以确定最佳添加剂组合。
1.2.4 IAA定量分析
先配制好质量浓度为20 g/L IAA母液,然后梯度稀释至0、40、80、120、160、200 mg/L的标准溶液。取各梯度浓度IAA标准液3 mL,加入等体积Salksowski比色液,以空白培养基加入等体积Salksowski比色液为对照,40 ℃避光静置40 min,使用紫外-分光光度计在波长530 nm处测定吸光值。以IAA质量浓度为横坐标,OD530值为纵坐标绘制标准曲线。将培养12 h发酵液以10 000 r/min离心10 min,取上清液3 mL加入等体积Salksowski比色液,40 ℃避光静置40 min,测定OD530值,根据标准曲线计算单位体积发酵液中IAA含量[10]。
1.2.5 活菌率检测
参照GB 20287—2006 《农用微生物菌剂》的方法,采用平板计数法测定菌剂中有效活菌数。保藏菌剂通过梯度稀释,涂布到LB半固体培养基中,选取菌落数在20~100的平板进行计数,计算出有效活菌数。活菌率按公式(1)计算:
活菌率![]()
(1)
2 结果与分析
2.1 β7菌株产IAA发酵工艺研究
2.1.1 碳源种类及浓度对β7菌株产IAA的影响
碳源种类不同,微生物表现出不同的IAA代谢能力[11]。从图1可以看出,半乳糖作为碳源IAA产量最高为135.32 mg/L。半乳糖4 g/L时, IAA产量最高达到149.07 mg/L。半乳糖质量浓度>4 g/L,IAA产量随半乳糖浓度增加有所下降,可能是高质量浓度半乳糖使代谢受到一定抑制[12]。后续实验采用半乳糖作为碳源进行优化发酵。
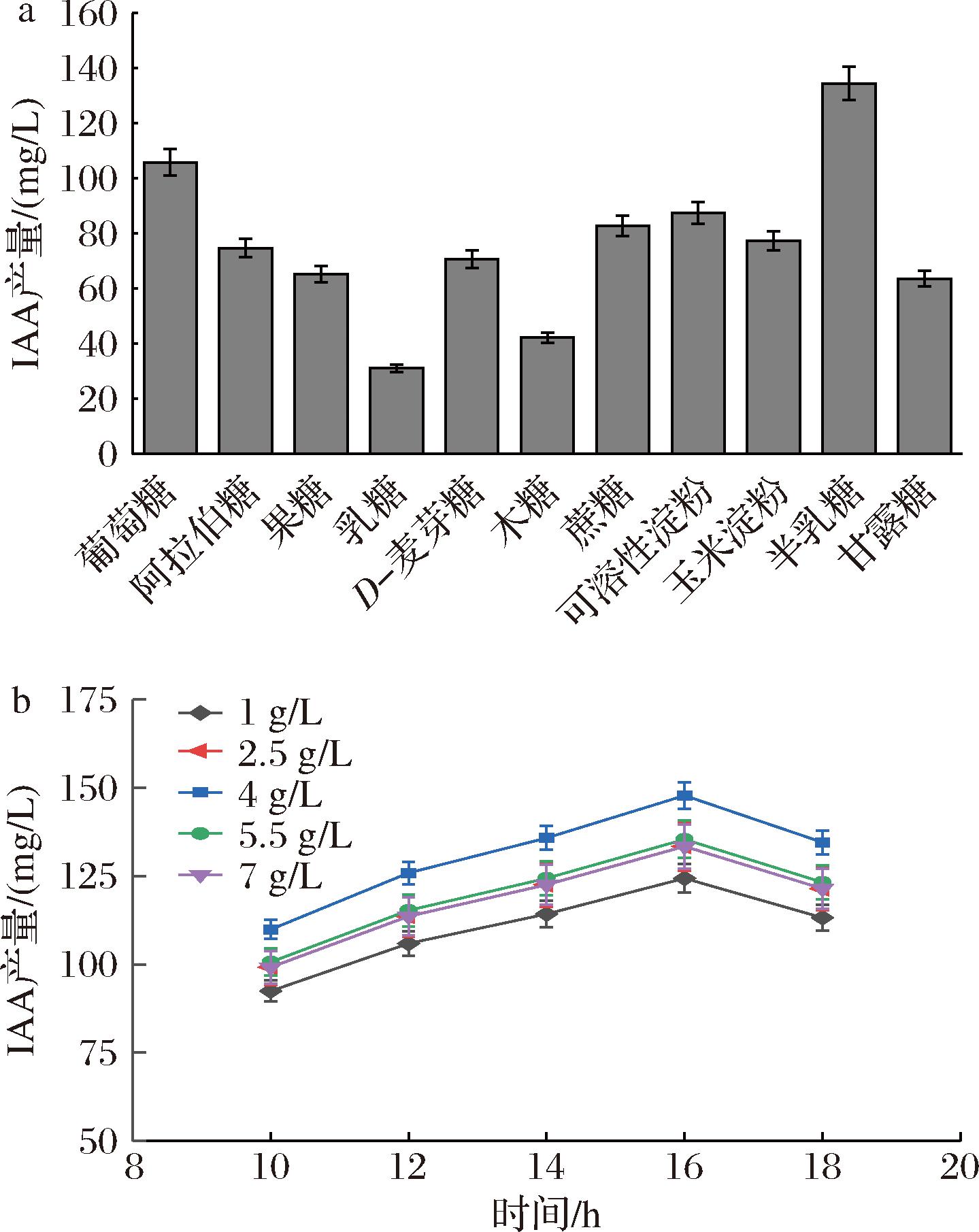
a-碳源种类;b-半乳糖添加量
图1 碳源种类及浓度对β7菌株产IAA的影响
Fig.1 Effect of different carbon source on IAA production by β7 strains
2.1.2 氮源种类及浓度对β7菌株产IAA的影响
发酵过程中,培养基中氮源对产物合成有积极作用[13]。由图2可知,酵母粉作为氮源IAA产量最高为139.56 mg/L。酵母粉2 g/L时,IAA产量最高为155.76 mg/L。酵母粉质量浓度>2 g/L,IAA产量随酵母粉浓度提高而降低,可能是因为高浓度酵母粉促进菌体生长并使养分过早耗尽,导致产物IAA合成受到抑制[14]。后续实验采用酵母粉作为氮源进行优化发酵。
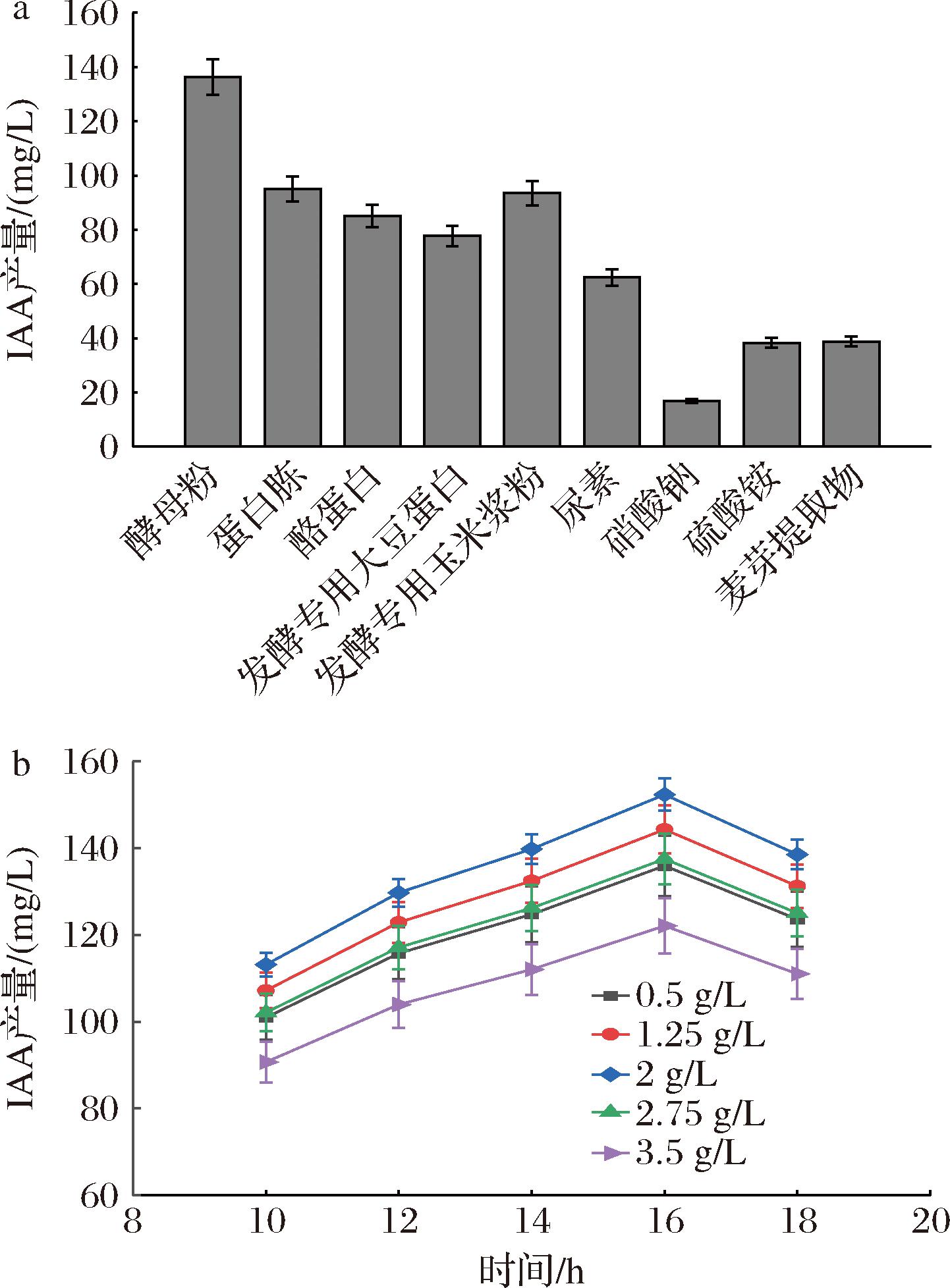
a-氮源种类;b-酵母粉添加量
图2 氮源种类及浓度对β7菌株产IAA的影响
Fig.2 Effects of different nitrogen sources on IAA production by β7 strains
2.1.3 色氨酸浓度对β7菌株产IAA的影响
色氨酸是合成IAA的主要前体物质[15],向培养基中添加色氨酸会提高IAA的产量[16],因此需要确定色氨酸浓度以提高IAA产量。由图3可知,色氨酸质量浓度<500 mg/L时,IAA产量随色氨酸浓度增加而提高。当色氨酸质量浓度500 mg/L时, IAA产量最高为229.38 mg/L。当色氨酸浓度超过500 mg/L时, IAA产量降低。前期研究发现,在一定范围内,IAA产量与色氨酸浓度成正比[17],不过合成 IAA 和色氨酸浓度并不完全呈正相关关系,高浓度色氨酸甚至会降低 IAA 产量[18]。
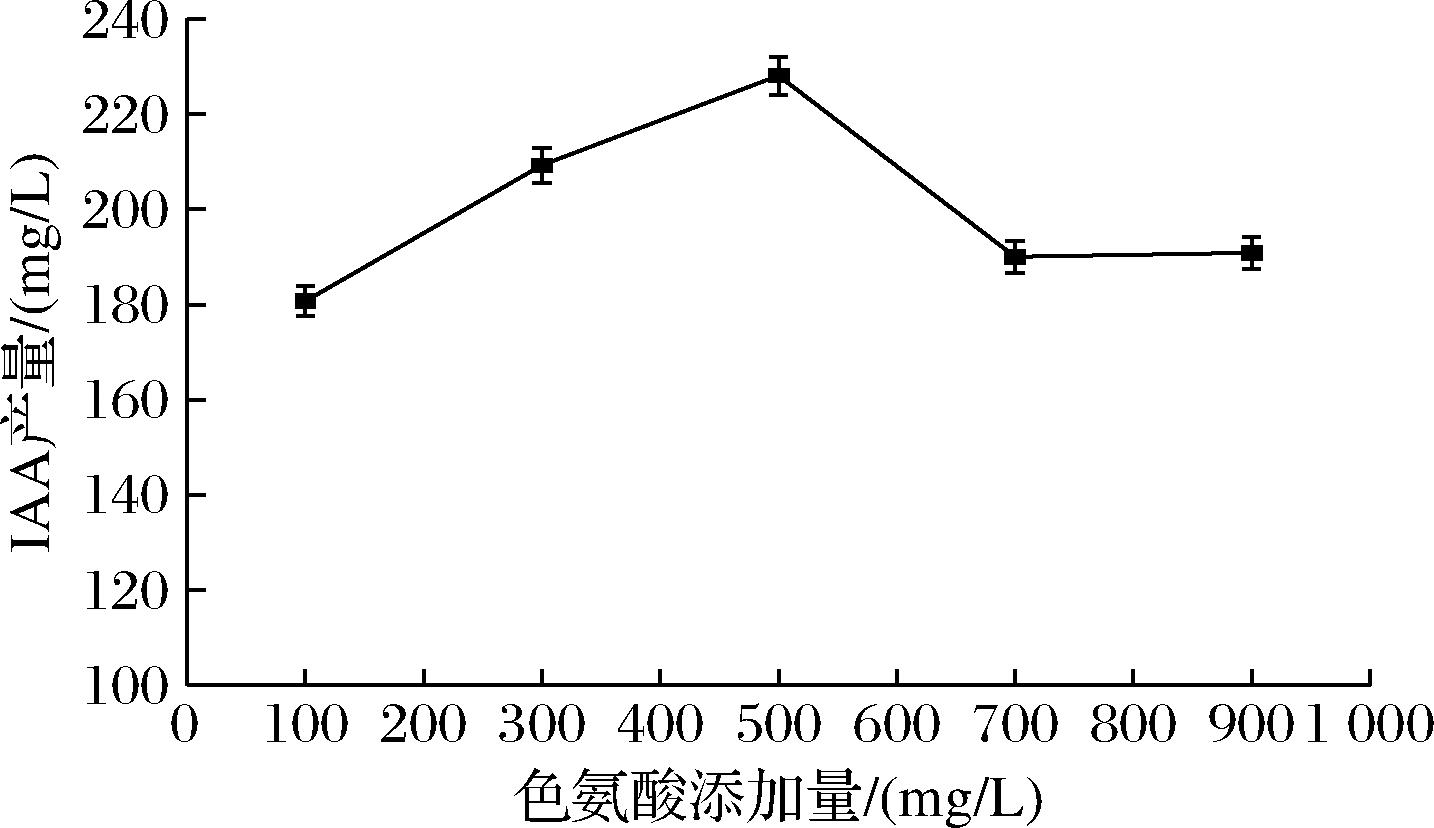
图3 色氨酸浓度对β7菌株产IAA的影响
Fig.3 Effect of tryptophan concentration on IAA production by β7 strains
2.1.4 接种量对β7菌株生长和产IAA特性影响
以1%、3%、5%、7%、9%接种量进行发酵产IAA实验,结果如图4所示。当接种量5%时,β7菌株产IAA最高达到243.96 mg/L。当接种量>5%时,IAA含量发生明显下降,可能是种子液浓度达到了一定阈值,造成培养基黏度增大,发酵液溶氧不足,从而不利于菌体代谢产IAA[19]。
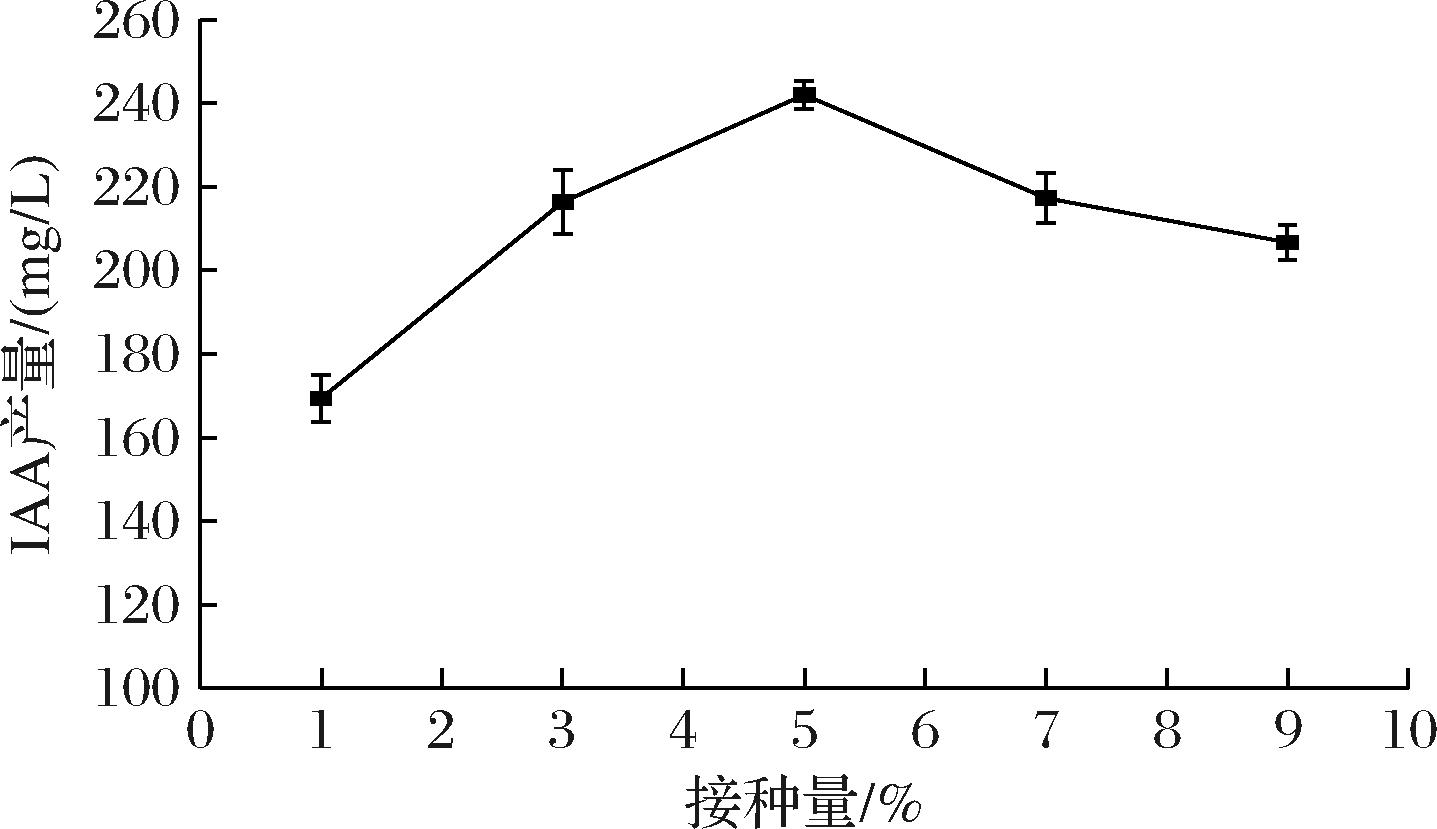
图4 接种量对β7菌株产IAA的影响
Fig.4 Effect of inoculum amount on IAA production by β7 strains
2.1.5 β7菌株产IAA发酵优化
通过单因素实验确定了碳源半乳糖、氮源酵母粉、底物色氨酸以及接种量,以这4个因素为考察因素,以IAA产量为响应值,设计了4因素3水平Box-Behnken响应面分析实验,进一步优化培养基组成。实验结果见表1。利用Design-Expert 10.0对单因素实验各因素进行多元回归拟合,得到回归方程:Y=-39.105 94+47.110 07A+70.359 65B+0.326 248C+20.711 89D-0.938 556AB+0.002 304AC-0.013 488AD-0.013 488BC+0.576 755BD-0.000 639CD-5.392 47A2-15.368 73B2-0.000 294C2-1.990 72D2。其中Y代表IAA含量,A、B、C和D分别代表半乳糖质量浓度(g/L)、酵母粉质量浓度(g/L)、色氨酸质量浓度(g/L)和接种量(%)。由表2可知,此模型决定系数R2=0.975 0,说明方程与实际情况拟合良好,能够正确反映IAA产量与因素水平的关系[20],建立的二次多元回归模型能用于产IAA发酵培养基优化理论预测[21]。
表1 响应面实验结果
Table 1 Results of response surface test
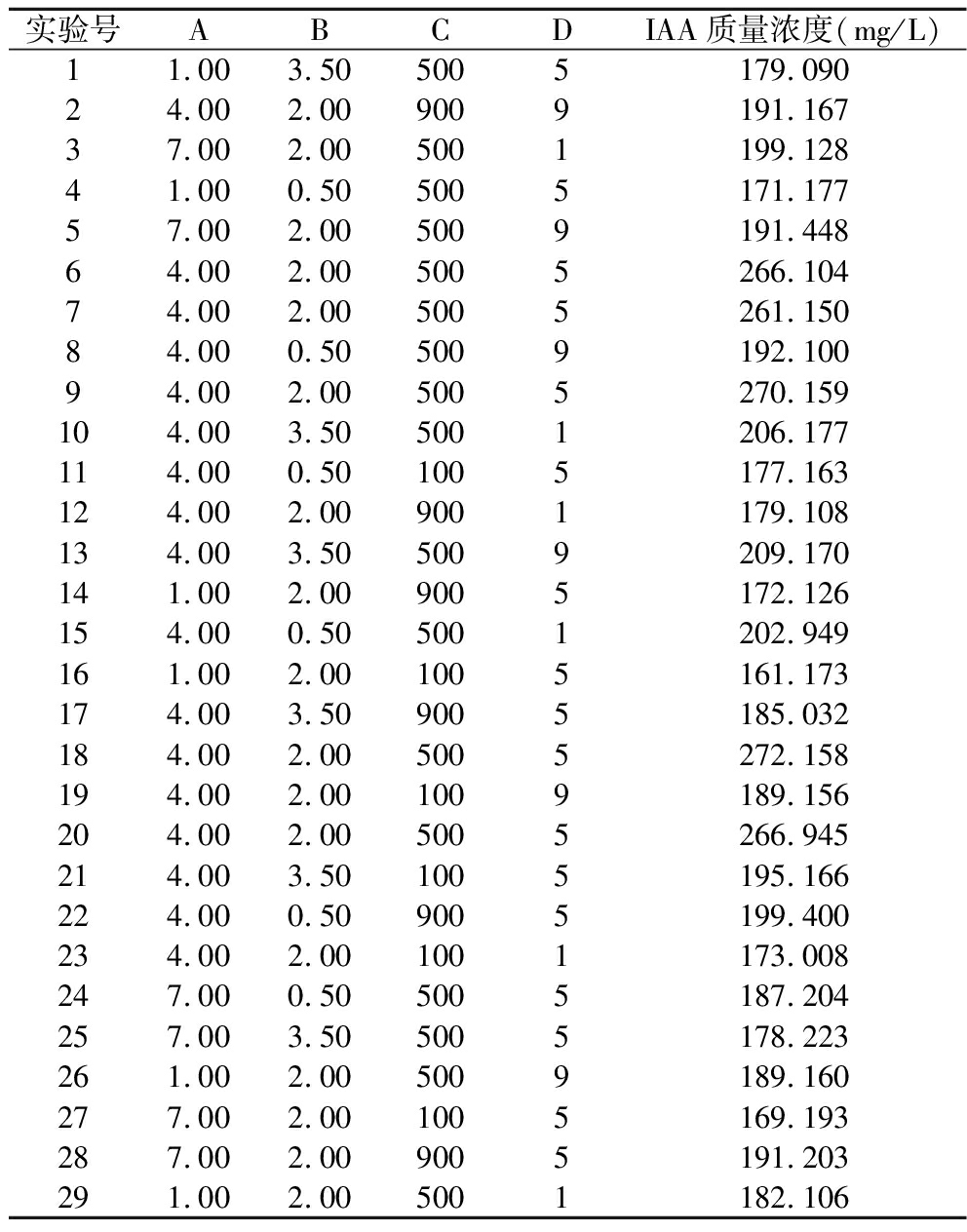
实验号ABCDIAA质量浓度(mg/L)11.003.505005179.09024.002.009009191.16737.002.005001199.12841.000.505005171.17757.002.005009191.44864.002.005005266.10474.002.005005261.15084.000.505009192.10094.002.005005270.159104.003.505001206.177114.000.501005177.163124.002.009001179.108134.003.505009209.170141.002.009005172.126154.000.505001202.949161.002.001005161.173174.003.509005185.032184.002.005005272.158194.002.001009189.156204.002.005005266.945214.003.501005195.166224.000.509005199.400234.002.001001173.008247.000.505005187.204257.003.505005178.223261.002.005009189.160277.002.001005169.193287.002.009005191.203291.002.005001182.106
表2 回归模型方差分析结果
Table 2 Variance analysis of regression model
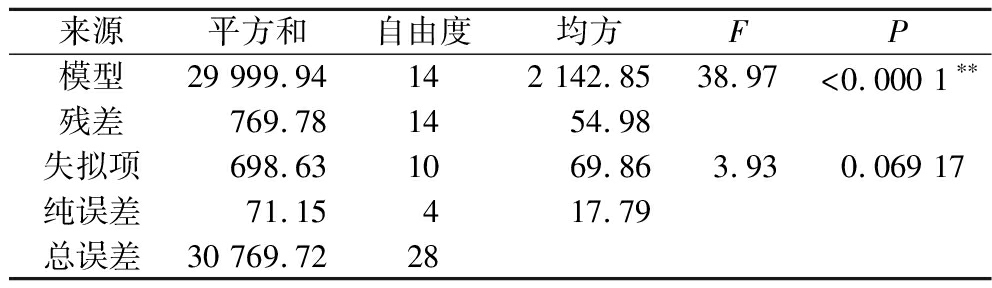
来源平方和自由度均方FP模型29 999.94142 142.8538.97<0.000 1∗∗残差769.781454.98失拟项698.631069.863.930.069 17纯误差71.15417.79总误差30 769.7228
注:*表示影响显著(P<0.05),**表示影响极显著(P<0.01)
预测产IAA最佳发酵培养基条件为半乳糖5.88 g/L、酵母粉1.97 g/L、色氨酸527 mg/L和接种量4.94%。采用修正优化培养基(半乳糖6 g/L,酵母粉2 g/L,色氨酸500 mg/L,接种量5%)进行3次验证实验,IAA产量从优化前的243.96 mg/L提高至276.96 mg/L。实际值与预测值接近,表明该模型合理可靠,能够比较真实地反映出各组成成分对IAA产量的影响[22]。
2.2 外源保护剂对β7菌剂保藏效果的研究
2.2.1 保护剂对β7菌剂保藏效果的研究
选取海藻酸钠、甘油、蔗糖作为保护剂,均以2 g/L添加量加入到β7菌剂中,避光4 ℃冷藏。从图5可看出,蔗糖和甘油作为保护剂,24 d时活菌率最高分别为87.62%和89.37%,相较CK组分别提高了56.17%和61.49%。24 d时甘油组IAA保留率最高为87.53%,可能是起到了补充微生物代谢所需碳源作用[23]。本研究旨在生产一种能促进植物生长发育菌剂,以IAA保留率作为主要指标,因此选择甘油作为β7菌剂的保护剂。
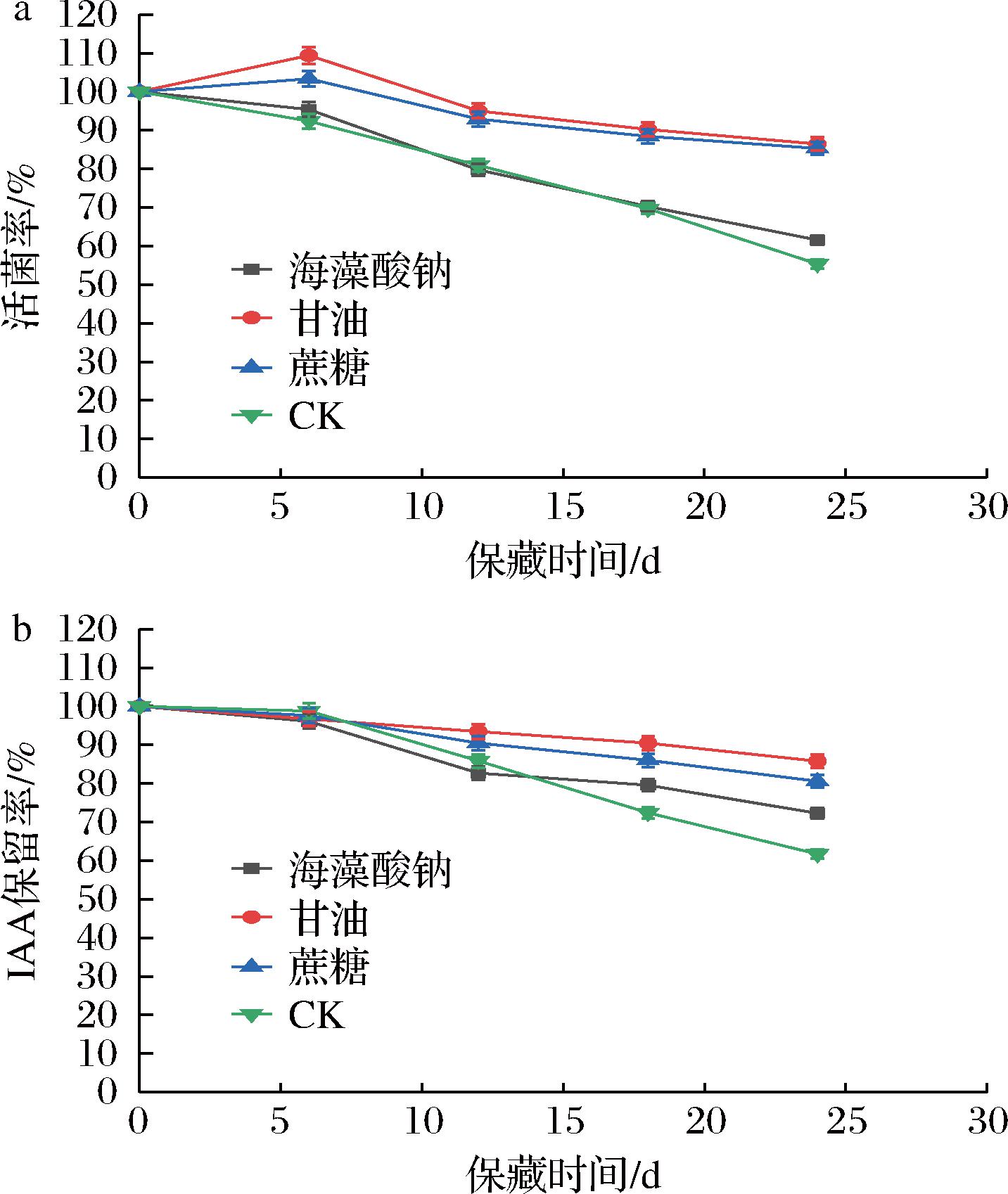
a-活菌率;b-IAA保留率
图5 保护剂对β7菌剂保藏效果的影响
Fig.5 Effect of protective agents on the preservation effect of β7 microbial agent
2.2.2 抑菌剂对β7菌剂保藏效果的研究
选取鼠李糖、没食子酸丙酯、山梨酸钾作为抑菌剂,均以2 g/L添加量加入到β7菌剂中,避光4 ℃冷藏。从图6可得,山梨酸钾和鼠李糖作为抑菌剂,24 d时活菌率较高分别为70.18%和72.30%。24 d时,山梨酸钾组IAA保留率最高为75.92%,相较于CK组提高了23.47%。选择山梨酸钾作为β7菌剂的抑菌剂。
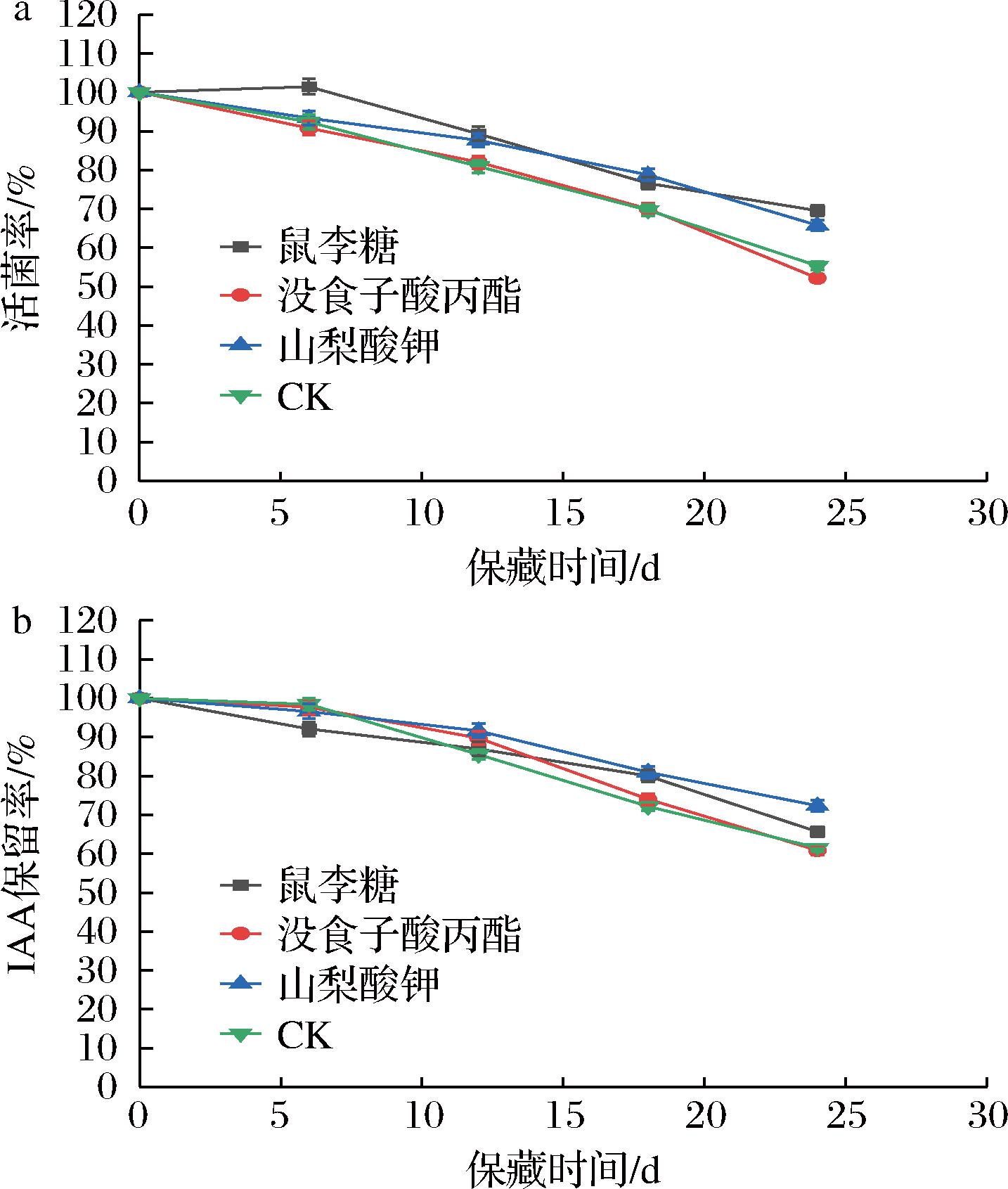
a-活菌率;b-IAA保留率
图6 抑菌剂对β7菌剂保藏效果的影响
Fig.6 Effect of bacteriostatic agents on the preservation effect of β7 microbial agents
2.2.3 乳化剂对β7菌剂保藏效果的研究
选取吐温-20、吐温-60、吐温-80作为β7菌剂乳化剂,均以0.2%(体积分数)添加量加入到β7菌剂中,避光4 ℃冷藏。从图7可得,吐温-60作为乳化剂,24 d时活菌率最高为77.59%,相较于CK组提高了40.68%;IAA保留率最高为76.28%,相较于CK组提高了24.03%。选择吐温-60作为β7菌剂的抑菌剂。
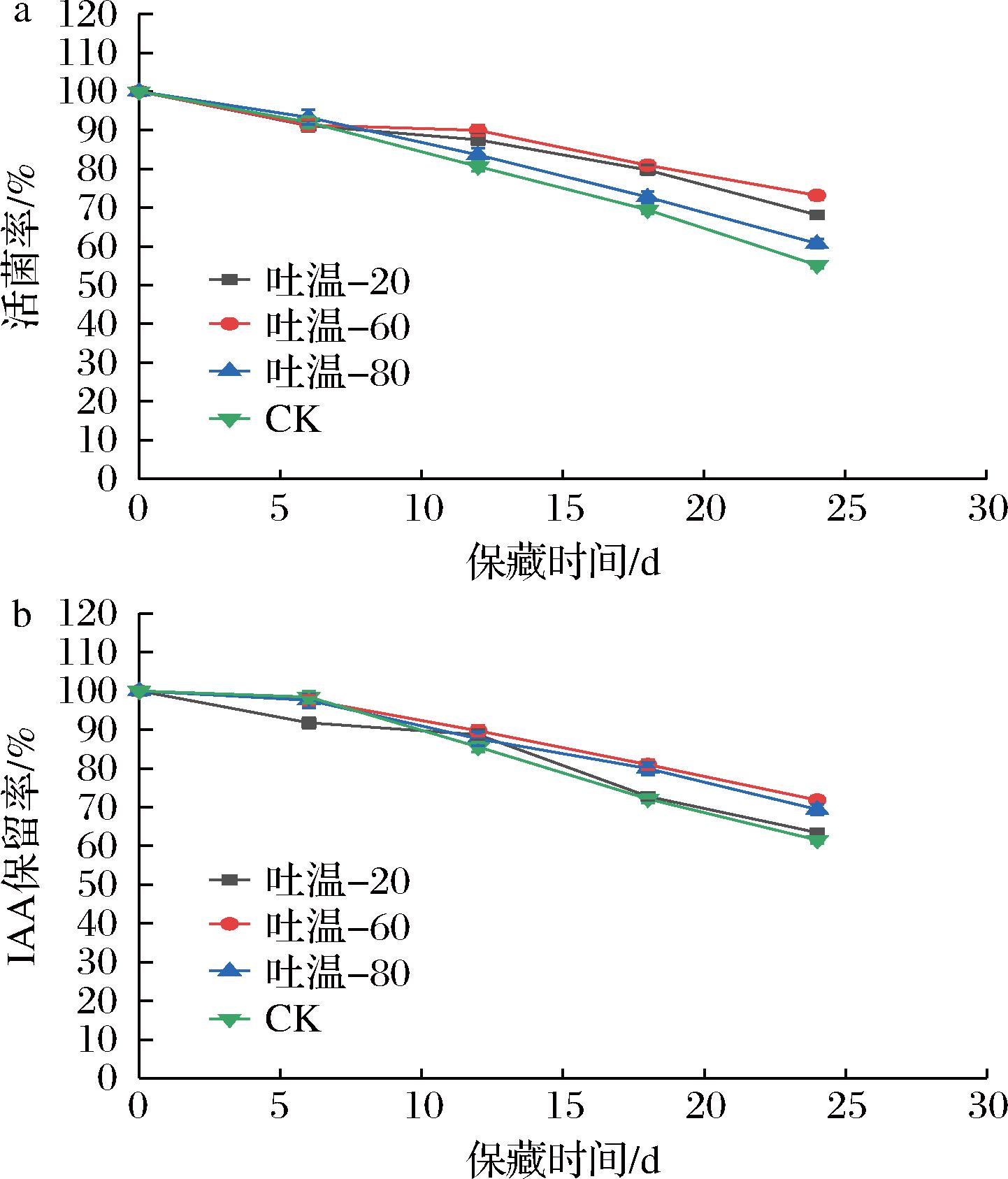
a-活菌率;b-IAA保留率
图7 乳化剂对β7菌剂保藏效果的影响
Fig.7 Effect of emulsifiers on the preservation effect of β7 microbial agent
2.2.4 复合添加剂对β7菌剂保藏效果的研究
将山梨酸钾、甘油、吐温-60混匀后作为复合添加剂加入到β7菌剂中,避光4 ℃冷藏。从图8可以看出,24 d时活菌率达到91.10%,相较于CK组提高了65.15%;IAA保留率为88.77%,相较于CK组提高了44.27%。由于3种添加剂相互协同作用,甘油作为微生物碳源补充,在0~12 d时活菌率高于初始活菌率。同单一添加剂相比,添加复合添加剂后β7菌剂在4 ℃保藏24 d后活菌率和IAA保留率均最高,且表现出更好的稳定性能。
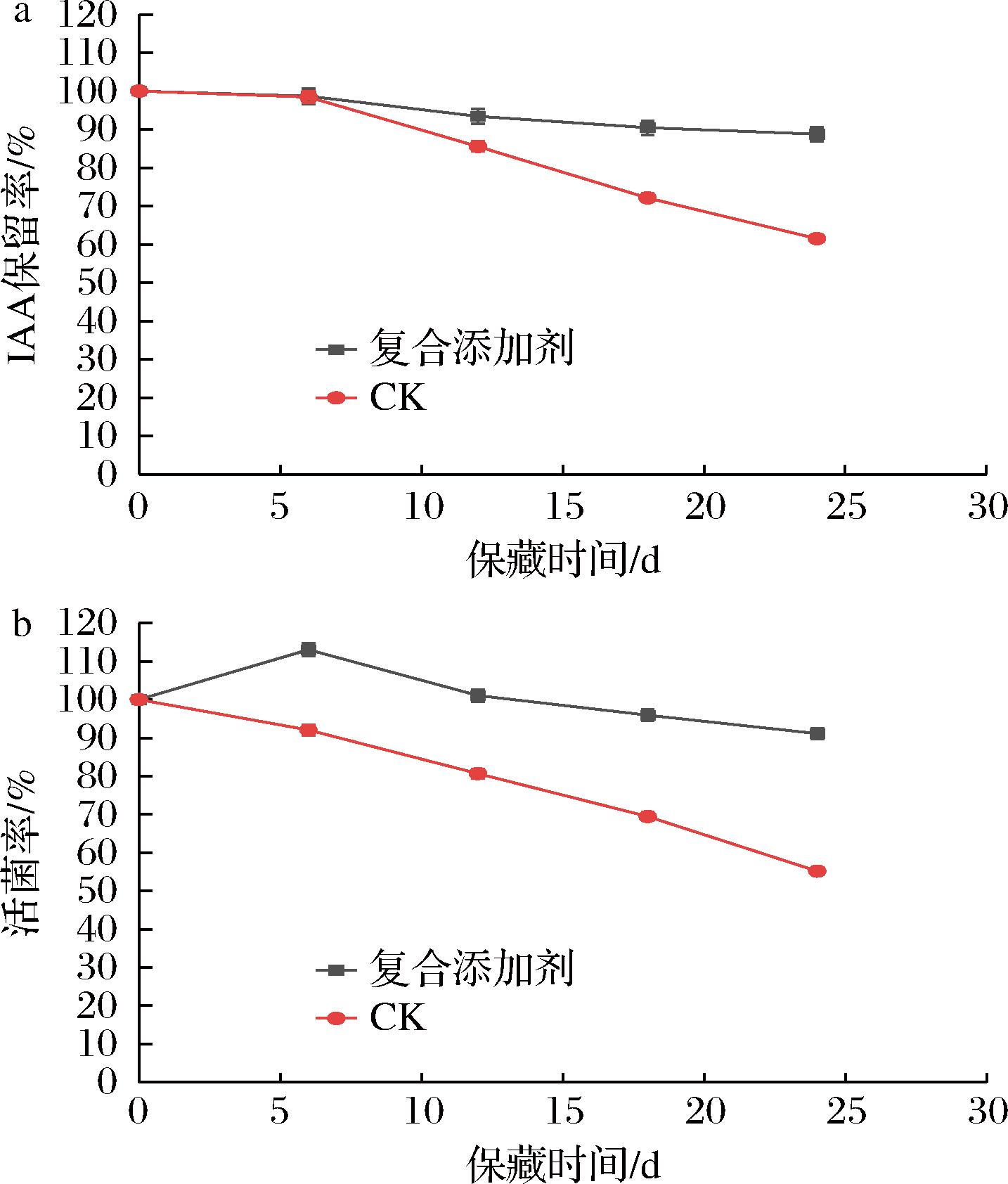
a-活菌率;b-IAA保留率
图8 复合添加剂对β7菌剂保藏效果的影响
Fig.8 Effect of compound additives on the preservation effect of β7 microbial agents
3 结论与讨论
本研究对一株具有产IAA能力的烟草肠杆菌(Enterobacter tabaci)β7菌株发酵条件进行了优化,确定了最佳发酵培养基组成为:碳源半乳糖6 g/L,氮源酵母粉2 g/L,色氨酸500 mg/L。接种量5%发酵16 h条件下,发酵液中IAA产量最高达到276.96 mg/L,较优化前提高了13.53%。在此条件下,为了制备β7菌剂用于促进植株生长发育,考察了不同添加剂,包括抑菌剂、保护剂和乳化剂等对避光低温保藏条件下菌剂的影响,确定最适添加剂为抑菌剂山梨酸钾、保护剂甘油、乳化剂吐温-60。添加外源复合添加剂制备菌剂在避光4 ℃保藏24 d后,活菌率相较于CK组提高了65.15%,IAA保留率提高了44.27%,表现出更好的稳定性能。研究结果为β7菌株发酵制备促植物生长菌剂提供了科学理论指导和数据支持。
[1] ORTEGA-ORTEGA Y, SARMIENTO-L PEZ L G, BAYL
PEZ L G, BAYL N-PALOMINO A, et al.Enterobacter sp.DBA51 produces ACC deaminase and promotes the growth of tomato (Solanum lycopersicum L.) and tobacco (Nicotiana tabacum L.) plants under greenhouse condition[J].Current Research in Microbial Sciences, 2024, 6:100207.
N-PALOMINO A, et al.Enterobacter sp.DBA51 produces ACC deaminase and promotes the growth of tomato (Solanum lycopersicum L.) and tobacco (Nicotiana tabacum L.) plants under greenhouse condition[J].Current Research in Microbial Sciences, 2024, 6:100207.
[2] BACKER R, ROKEM J S, ILANGUMARAN G, et al.Plant growth-promoting rhizobacteria:Context, mechanisms of action, and roadmap to commercialization of biostimulants for sustainable agriculture[J].Frontiers in Plant Science, 2018, 9:1473.
[3] SHARMA S, KULKARNI J, JHA B.Halotolerant rhizobacteria promote growth and enhance salinity tolerance in peanut[J].Frontiers in Microbiology, 2016, 7:1600.
[4] GHOSH A, PRAMANIK K, BHATTACHARYA S, et al.A potent cadmium bioaccumulating Enterobacter cloacae strain displays phytobeneficial property in Cd-exposed rice seedlings[J].Current Research in Microbial Sciences, 2021, 3:100101.
[5] DUCA D, LORV J, PATTEN C L, et al.Indole-3-acetic acid in plant-microbe interactions[J].Antonie Van Leeuwenhoek, 2014, 106(1):85-125.
[6] DADY E R, KLECZEWSKI N, UGARTE C M, et al.Plant variety, mycorrhization, and herbivory influence induced volatile emissions and plant growth characteristics in tomato[J].Journal of Chemical Ecology, 2023, 49(11-12):710-724.
[7] MYO E M, GE B B, MA J J, et al.Indole-3-acetic acid production by Streptomyces fradiae NKZ-259 and its formulation to enhance plant growth[J].BMC Microbiology, 2019, 19(1):155.
[8] SUDHA M, GOWRI R S, PRABHAVATHI P, et al.Production and optimization of indole acetic acid by indigenous micro flora using agro waste as substrate[J].Pakistan Journal of Biological Sciences:PJBS, 2012, 15(1):39-43.
[9] ETESAMI H, GLICK B R.Bacterial indole-3-acetic acid:A key regulator for plant growth, plant-microbe interactions, and agricultural adaptive resilience[J].Microbiological Research, 2024, 281:127602.
[10] 王威, THINZAR Toe, 张亚, 等.一株烟草肠杆菌(Enterobacter tabaci)S4菌株的鉴定及其效果测定[J].农业资源与环境学报, 2020, 37(3):407-412.WANG W, THINZAR T, ZHANG Y, et al.Identification and evaluation of Enterobacter tabaci strain S4[J].Journal of Agricultural Resources and Environment, 2020, 37(3):407-412.
[11] IWANICKI N S A, MASCARIN G M, MORENO S G, et al.Growth kinetic and nitrogen source optimization for liquid culture fermentation of Metarhizium robertsii blastospores and bioefficacy against the corn leafhopper Dalbulus maidis[J].World Journal of Microbiology &Biotechnology, 2020, 36(5):71.
[12] SHILTS T, ERTURK U, PATEL N J, et al.Physiological regulation of biosynthesis of phytohormone indole-3-acetic acid and other indole derivatives by the Citrus fungal pathogen Colletotrichum acutatum[J].Journal of Biological Sciences, 2005, 5(2):205-210.
[13] SU Q H, ZHANG Z C, LIU X C, et al.The transcriptome analysis on urea response mechanism in the process of ergosterol synthesis by Cordyceps cicadae[J].Scientific Reports, 2021, 11(1):10927.
[14] RAMYA P, SELVARAJ K, SUTHENDRAN K, et al.Optimization of alginate lyase production using Enterobacter tabaci RAU2C isolated from marine environment by RSM and ANFIS modelling[J].Aquaculture International, 2023, 31(6):3207-3237.
[15] WOODWARD A W, BARTEL B.Auxin:Regulation, action, and interaction[J].Annals of Botany, 2005, 95(5):707-735.
[16] APINE O A, JADHAV J P.Optimization of medium for indole-3-acetic acid production using Pantoea agglomerans strain PVM[J].Journal of Applied Microbiology, 2011, 110(5):1235-1244.
[17] SHAH R, CHAUDHARI K, PATEL P, et al.Isolation, characterization, and optimization of IAA-producing Providencia species(7MM11) and their effect on tomato (Lycopersicon esculentum) seedlings[J].Biocatalysis and Agricultural Biotechnology, 2020, 28:101732.
[18] SHOKRI D, EMTIAZI G.Indole-3-acetic acid (IAA) production in symbiotic and non-symbiotic nitrogen-fixing bacteria and its optimization by taguchi design[J].Current Microbiology, 2010, 61(3):217-225.
[19] DATTA C, BASU P S.Indole acetic acid production by a Rhizobium species from root nodules of a leguminous shrub, Cajanus cajan[J].Microbiological Research, 2000, 155(2):123-127.
[20] BENADJILA A, ZAMOUM M, AOUAR L, et al.Optimization of cultural conditions using response surface methodology and modeling of indole-3-acetic acid production by Saccharothrix texasensis MB15[J].Biocatalysis and Agricultural Biotechnology, 2022, 39:102271.
[21] YASIN A W, ERMIAS G A, MOHAMMED S B, et al.Optimization of soluble phosphate and IAA production using response surface methodology and ANN approach[J].Heliyon, 2022, 8(12):12224.
[22] ZHOU D K, YU W C, WU A B, et al.Optimization of preparation conditions of medium and highly substituted carboxymethyl inulin through response surface methodology[J].Carbohydrate Research, 2024, 536:109009.
[23] 曹琳, 邢亚阁, 苏菲烟, 等.真空冷冻喷雾干燥下川藏高原冰酒发酵菌剂复合保护剂的配方优化[J].食品工业科技, 2018, 39 (4):88-93.CAO L, XING Y G, SU F Y, et al.Optimization of composite protectant formulation for ice wine fermentation agents in Sichuan-tibet plateau by vacuum freeze spray drying[J].Science and Technology of Food Industry, 2018, 39 (4):88-93.