海带(Laminaria japonica)是多年生药食同源大型藻类,成本低廉且营养丰富,多糖作为海带中含量丰富且易提取的天然成分,具有清除自由基、降血糖、抑菌、抗癌等生物活性[1]。天然多糖生物活性相对较弱,常通过化学修饰的方法影响其生物活性[2]。其中,羧甲基化修饰方法因试剂易得、成本低、制备工艺简单、反应产生的物质低毒性或无毒等优点[3],是多糖化学结构修饰中常用的修饰方法[4]。羧甲基化修饰多糖具有溶解性、安全性、生物相容性好和稳定性高等优势,酸枣多糖[5]、红须腹菌多糖[6]、黑木耳多糖[7]等经羧甲基化后可分别用作膳食补充剂、免疫增强剂和辅助药物等[8],对于天然多糖在食品、医药领域的应用具有十分重要的意义。
课题组前期研究表明,广西北部湾海带多糖(Laminaria japonica polysaccharides,LJP)具有一定的自由基清除能力和降血糖活性[9-10]。羧甲基化修饰可以改变多糖结构进而影响其生物活性[11],但对自由基清除能力和降血糖活性的影响研究结果不一,如姚秋萍等[12]对油菜花粉多糖进行羧甲基化修饰,发现修饰后比修饰前的多糖对DPPH自由基、羟自由基(·OH)和超氧阴离子自由基![]() 的清除能力均有显著提高,但LIU等[13]则发现羧甲基化修饰显著降低了乌贼墨多糖对DPPH自由基和·OH的清除能力;李雪晖等[14]发现羧甲基化修饰后南瓜多糖的降血糖活性显著提高了11%,但王晓婷[15]发现蛹虫草多糖经羧甲基化修饰后降血糖活性反而降低了12%。羧甲基化修饰海带多糖影响自由基清除能力与降血糖活性的机理尚不明晰。
的清除能力均有显著提高,但LIU等[13]则发现羧甲基化修饰显著降低了乌贼墨多糖对DPPH自由基和·OH的清除能力;李雪晖等[14]发现羧甲基化修饰后南瓜多糖的降血糖活性显著提高了11%,但王晓婷[15]发现蛹虫草多糖经羧甲基化修饰后降血糖活性反而降低了12%。羧甲基化修饰海带多糖影响自由基清除能力与降血糖活性的机理尚不明晰。
本研究采用氢氧化钠-氯乙酸法制备羧甲基化海带多糖(carboxymethylated Laminaria japonica polysaccharide,CM-LJP),通过单因素试验和正交试验进行工艺条件优化,综合运用紫外光谱、傅里叶变换红外光谱、高碘酸氧化、刚果红实验对其进行结构表征,探究羧甲基化修饰对海带多糖自由基清除能力与降血糖活性的影响,以期为药食两用海带多糖的开发和利用提供理论依据与数据支撑。
1 材料与方法
1.1 材料与试剂
海带,广西北部湾海域(20°54′10″~21°40′30″ N,109°05′20″~109°11′35″ E),经大连海洋大学邢坤副教授鉴定为褐藻门海带属(Laminaria)。1,1-二苯基-2-三硝基苯肼、4-硝基苯-α-D-葡萄糖苷、α-葡萄糖苷酶,Sigma公司;中性蛋白酶,北京索莱宝科技有限公司;其他试剂,国药集团化学试剂有限公司,均为分析纯。
1.2 仪器与设备
AR224CN型精密电子天平,美国奥豪斯仪器(上海)有限公司;S.HH.W21.600-S型恒温水浴箱,上海跃进医疗器械有限公司;DF-Ⅱ型集热型磁力搅拌器,上海百典仪器设备有限公司;SCIENTZ-10 N型冷冻干燥机,宁波新芝生物科技股份有限公司;N-1300D-WB型旋转蒸发仪,上海爱朗仪器有限公司;GL-20M型高速冷冻离心机,上海卢湘仪离心机仪器有限公司;Multiskan GO型全波长扫描酶标仪,赛默飞世尔科技(中国)有限公司;MT-45型低速离心机,杭州米欧仪器有限公司;Nicolet IS10型傅里叶红外光谱仪,美国Thermo Electron公司;UV-2600型紫外可见分光光度计,株式会社岛津制作所。
1.3 实验方法
1.3.1 LJP的制备
参照冯书珍等[9]的方法。称取预处理后的海带样品20 g,95%(体积分数)乙醇浸泡过夜风干,加适量蒸馏水调节溶液pH值至7.0,微波(功率600 W)辅助提取90 s,提取液离心、浓缩、醇沉,静置过夜,干燥得海带粗多糖。称取海带粗多糖与中性蛋白酶按1∶0.5(质量比)混匀,50 ℃酶解反应2 h后沸水灭活5 min,重复多次,直至280 nm处无吸收峰,说明蛋白已除。超滤、浓缩、干燥得LJP。
1.3.2 CM-LJP的工艺优化
1.3.2.1 CM-LJP的制备
参照田数等[16]的方法稍作修改。称取0.3 g LJP,加入10 mL 15%(质量分数)NaOH溶液,在一定碱化温度下搅拌1 h。碱化完成后,加入一定量的氯乙酸,在一定温度下反应一定时间,待其冷却后,用冰乙酸调节溶液pH值至7.0,透析2 d冷冻干燥,即得CM-LJP。
1.3.2.2 单因素试验
称取0.3 g LJP,加入10 mL 15%的NaOH溶液,以取代度为参考指标,分别考察碱化温度(40、45、50、55、60 ℃)、反应温度(55、60、65、70、75 ℃)、反应时间(2.5、3.0、3.5、4.0、4.5 h)、LJP与氯乙酸质量比(1∶1、3∶5、3∶7、1∶3、3∶11)对LJP羧甲基化修饰的影响。具体见表1。
表1 单因素试验设计因素及水平
Table 1 Design factors and level of single factor test
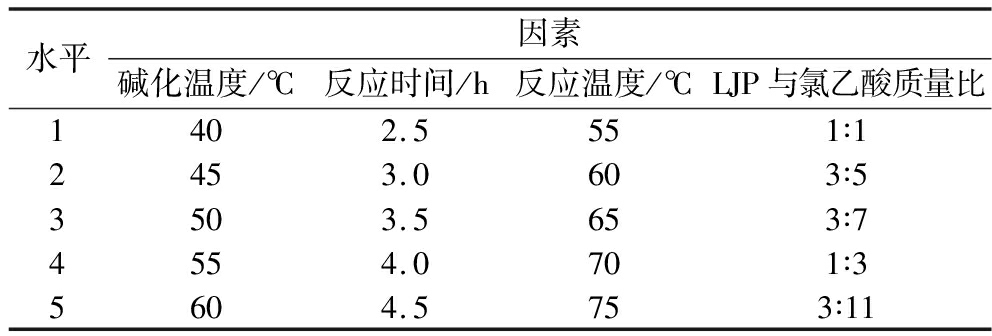
水平因素碱化温度/℃反应时间/h反应温度/℃LJP与氯乙酸质量比1402.5551∶12453.0603∶53503.5653∶74554.0701∶35604.5753∶11
1.3.2.3 正交试验设计
根据单因素试验所得结果,选取碱化温度(A)、反应时间(B)、反应温度(C)和LJP与氯乙酸质量比(D)作为正交试验因素,每个因素选择3个水平,采用L9(34)正交试验探索羧甲基化修饰LJP的最佳条件。具体见表2。
表2 正交试验因素水平
Table 2 Factors and levels in the orthogonal experiment
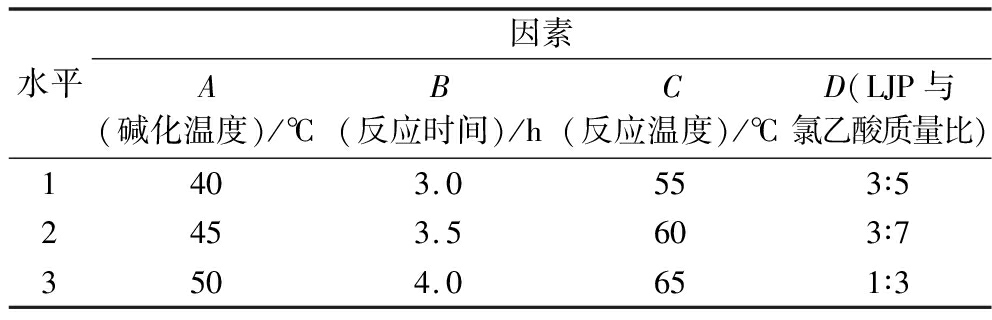
水平因素A(碱化温度)/℃B(反应时间)/hC(反应温度)/℃D(LJP与氯乙酸质量比)1403.0553∶52453.5603∶73504.0651∶3
1.3.3 取代度测定
取代度指平均每个失水葡萄糖单元上被反应试剂取代的羟基数目[17],参考赵鹏等[18]的方法稍作修改。称取0.01 g CM-LJP,加入10 mL 0.01 mol/L NaOH溶液,搅拌使其完全溶解,以酚酞作指示剂,用0.01 mol/L的HCl滴定,至红色褪去,记录终点时HCl的体积V。计算如公式(1)和公式(2)所示:
(1)
(2)
[:DS,取代度;A,羧甲基含量,%;m,CM-LJP质量,g;C1,NaOH浓度,mol/L;V1,NaOH体积,mL;C2,HCl浓度,mol/L;V2,样品滴定过程中消耗的HCl体积,mL。
1.3.4 CM-LJP的结构表征测定
1.3.4.1 紫外光谱分析
称取LJP和CM-LJP样品各10 mg,分别配制成1 mg/mL的样品溶液,置于比色皿中,用紫外分光光度计在190~400 nm进行扫描。
1.3.4.2 傅里叶变换红外光谱分析
称取LJP和CM-LJP样品,分别与KBr粉末按照1∶50的质量比充分混合压片后,在4 000~500 cm-1进行红外光谱扫描,分辨率为0.25 cm-1。
1.3.4.3 刚果红实验
参照刘贵珍等[19]的方法稍作修改。分别吸取1 mL 1 mg/mL的LJP和CM-LJP溶液于试管中,加入1 mL 50 mmol/L的刚果红溶液,依次加入0、0.1、0.2、0.3、0.4、0.5 mol/L的NaOH溶液,摇匀,室温反应30 min。去离子水作空白对照,用酶标仪扫描400~600 nm最大吸收波长。
1.3.4.4 高碘酸氧化实验
参照陈光静[20]的方法稍作修改。分别称取15 mg LJP、CM-LJP与15 mL 30 mmol/L的NaIO4标准液混匀。每隔6 h取0.1 mL稀释至25 mL后,在223 nm处测定吸光值,待其恒定时,根据标准曲线y=10.948x+0.017 7(R2=0.999),计算高碘酸用量。取2 mL氧化产物,以酚酞为指示剂,用0.01 mol/L的NaOH进行滴定,记录NaOH的消耗量,计算甲酸的生成量。
1.3.5 生物活性测定
1.3.5.1 自由基清除能力测定
参照冯书珍等[9]方法,分别测定LJP、CM-LJP对DPPH自由基![]() 的清除能力,并计算IC50值。反应体系中LJP和CM-LJP的质量浓度均分别为0.3、0.5、1、3、5 mg/mL,以相同质量浓度的维生素C为阳性对照组。清除率和IC50值的计算分别如公式(3)和公式(4)所示:
的清除能力,并计算IC50值。反应体系中LJP和CM-LJP的质量浓度均分别为0.3、0.5、1、3、5 mg/mL,以相同质量浓度的维生素C为阳性对照组。清除率和IC50值的计算分别如公式(3)和公式(4)所示:
清除率![]()
(3)
(4)
[:A1,样品组吸光值;A2,对照组吸光值;A,空白组吸光值;Xm,lg(最大浓度值);I,lg(最大浓度/相临浓度);P,清除率之和,%;Pm,最大清除率,%;Pn,最小清除率,%。
1.3.5.2 降血糖活性测定
参照冯学珍等[10]方法。分别取不同浓度LJP和CM-LJP溶液50 μL于酶标板中,设置药物对照组、空白对照组和空白反应组。加入50 μL pH 6.8的磷酸缓冲液于药物对照组,50 μL 0.45 U/mL的酶于药物反应组中,振荡30 s,37 ℃水浴10 min,加入100 μL的5 mmol/L PNPG,振荡30 s,37 ℃反应20 min,加入100 μL的0.2 mol/L Na2CO3终止反应,在405 nm处测定吸光值,IC50值的计算参考公式(4),α-葡萄糖苷酶的抑制率的计算如公式(5)所示:
酶活抑制率![]()
(5)
[:A1,药物反应组吸光值;A2,药物对照组吸光值;A3,空白反应组吸光值;A0,空白对照组吸光值。
1.4 数据处理
采用Microsoft Excel 2022、SPSS(SPSS 22.0)、Origin Pro 8.0和正交设计助手Ⅱ(V 3.1)对数据进行统计分析与绘图,并利用ANOVA和S-N-K多重比较进行显著性分析(P<0.05),结果以![]() 表示。
表示。
2 结果与分析
2.1 CM-LJP制备单因素试验
2.1.1 碱化温度对取代度的影响
如图1所示,取代度随着碱化温度的升高呈先升高后下降的趋势。随着碱化温度的升高,分子运动速度加快,分子间相互碰撞机率增加,促进醚化反应发生。在45 ℃时,取代度达到最大值0.266,当碱化温度>45 ℃时,取代度开始下降,这是由于高温下多糖结构会被破坏,反应空间逐渐缩小,不利于反应发生[21],取代度逐渐降低。因此,将碱化温度确定在40~50 ℃最合适。

图1 碱化温度对取代度的影响
Fig.1 Effect of alkalization temperature on degree of substitution
注:误差线表示均值±标准误差,不同英文字母表示数据间差异显著(P<0.05)(下同)。
2.1.2 反应时间对取代度的影响
随着反应时间的延长,反应活性中心增多,多糖与氯乙酸反应速率增加,取代度升高(图2)。当反应时间为3.5 h时,取代度达到最大值0.278,超过3.5 h,取代度急剧下降,这可能是因为反应时间过长会使反应中不稳定中间产物分解,使取代度下降[22]。因此,将反应时间确定在3.0~4.0 h最合适。
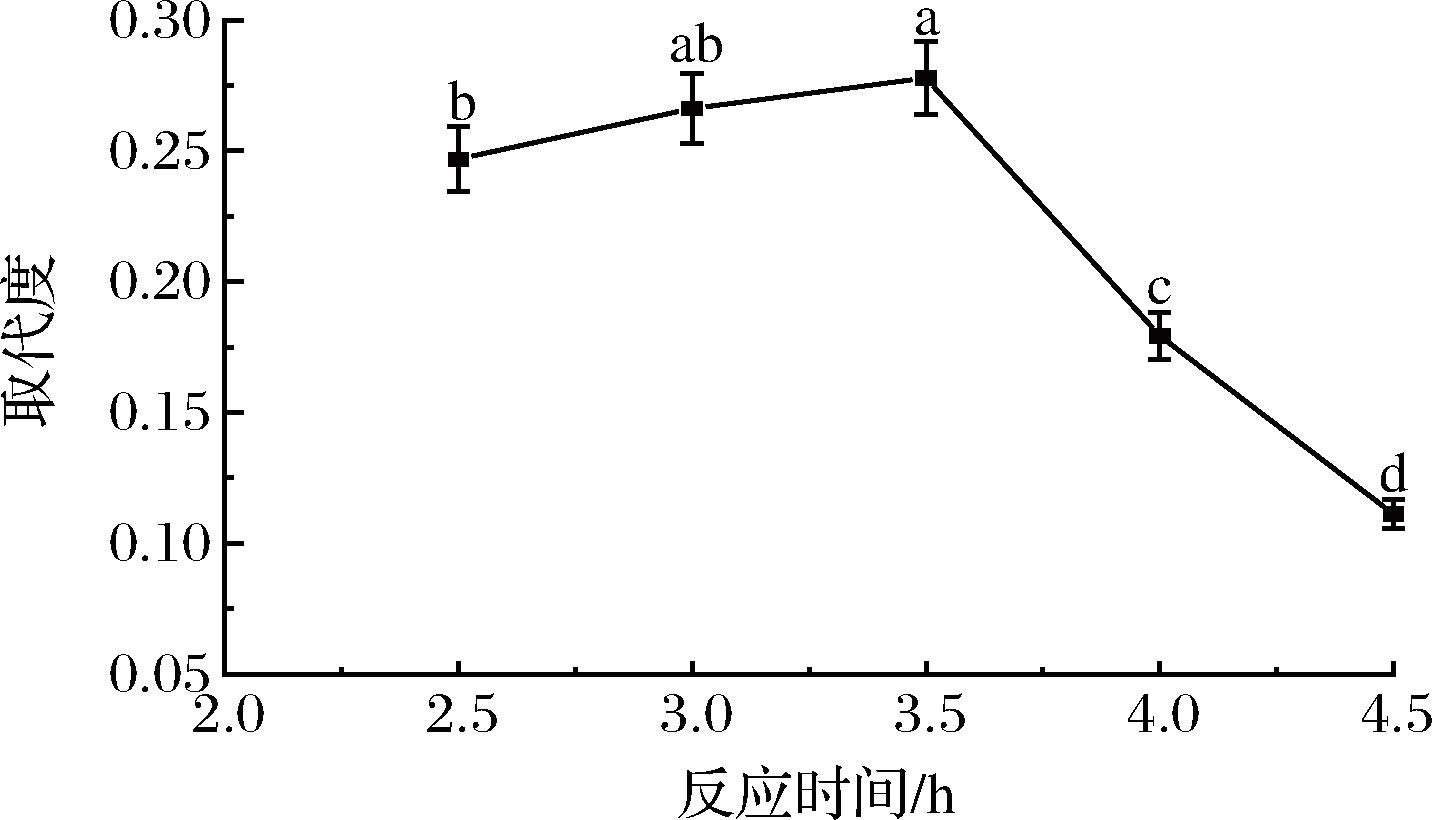
图2 反应时间对取代度的影响
Fig.2 Effect of reaction time on degree of substitution
2.1.3 反应温度对取代度的影响
取代度随着反应温度的升高呈先上升后下降的趋势(图3)。其中,反应温度升高,羧甲基化反应速率加快,取代度逐渐升高,在60 ℃时,取代度达到最大值0.286,当温度>60 ℃时,取代度逐渐降低,这可能是因为高温下多糖发生降解,使得已被取代的羧甲基再次裂解,不利于反应的进行,取代度逐渐降低[23]。因此,将反应温度确定在55~65 ℃最合适。
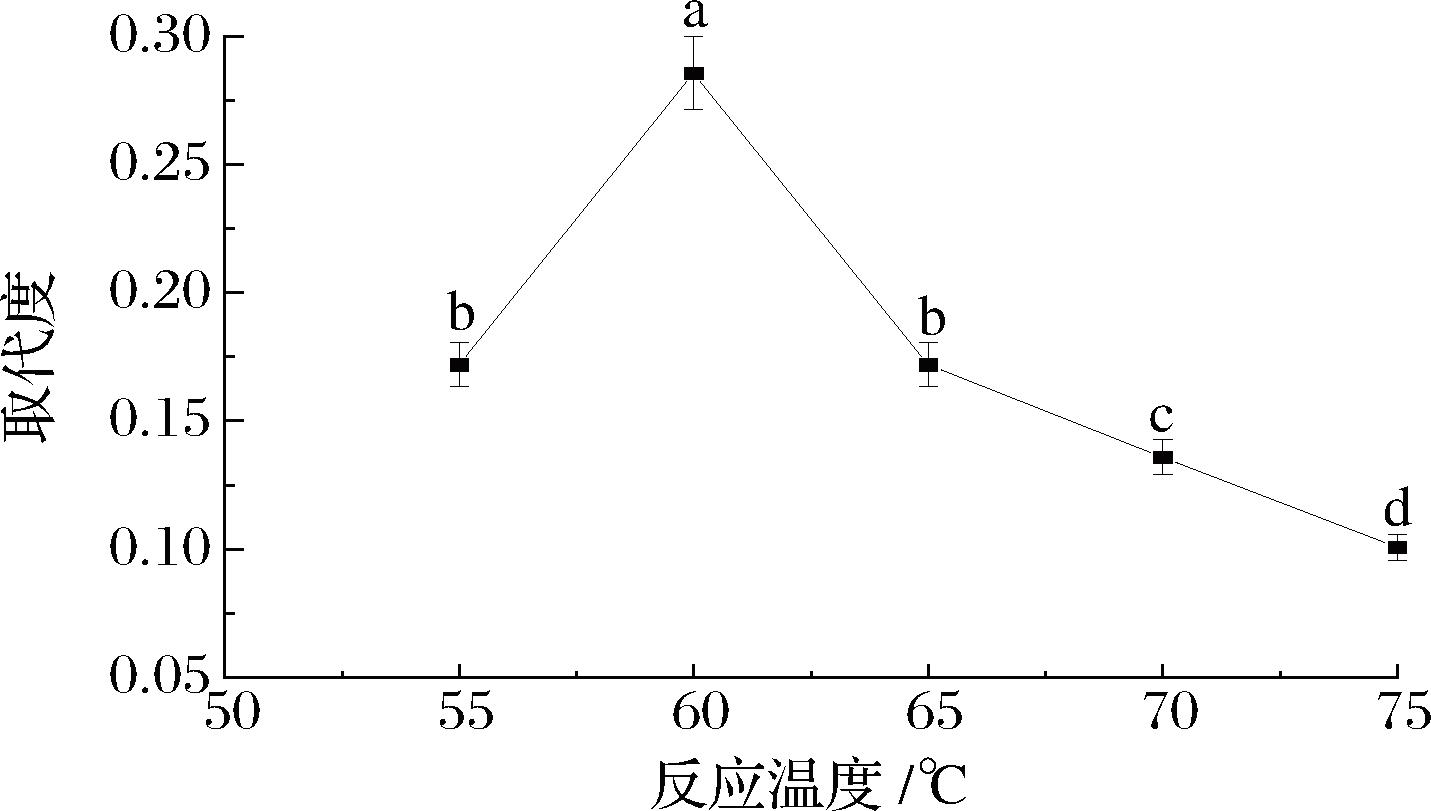
图3 反应温度对产物取代度的影响
Fig.3 Effect of reaction temperature on degree of substitution
2.1.4 LJP与氯乙酸质量比对取代度的影响
随着LJP与氯乙酸质量比的减小,取代度呈先上升后下降的趋势(图4),当LJP与氯乙酸质量比为3∶7时,取代度达到最大值0.286,超过3∶7,取代度逐渐下降。这可能是因为氯乙酸添加量增加,多糖羧甲基化反应机率增大,氯乙酸钠生成量增多,取代度相应升高;但加入过量的氯乙酸,氢氧化钠耗尽,使反应的pH下降,取代度逐渐降低[24]。因此,LJP与氯乙酸质量比确定在3∶5~3∶9最合适。
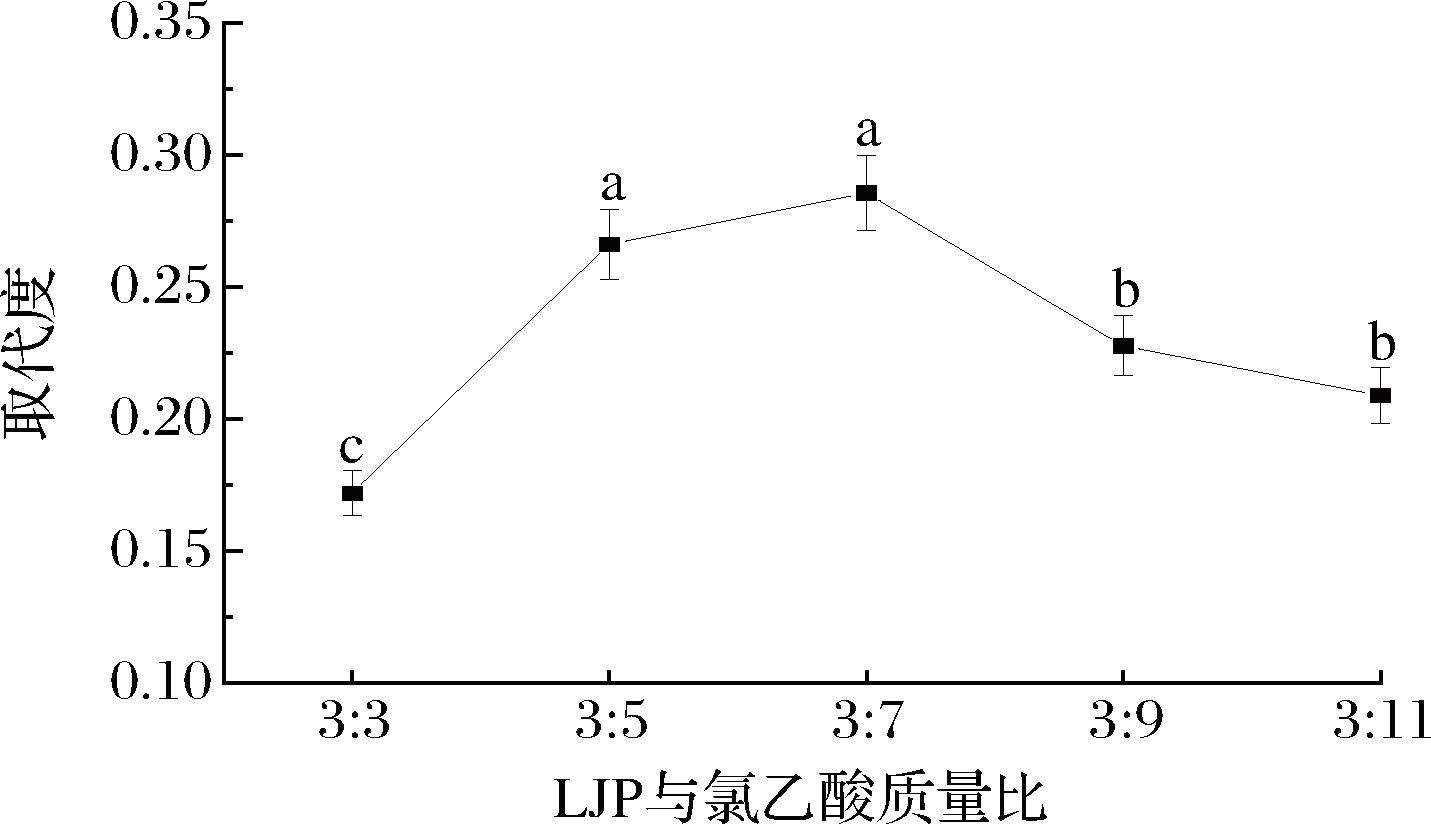
图4 LJP与氯乙酸质量比对取代度的影响
Fig.4 Effect of mass ratio of LJP to chloroacetic acid on degree of substitution
2.2 CM-LJP最佳工艺条件的确定
2.2.1 正交试验结果
如表3所示,影响CM-LJP取代度的因素依次为:碱化温度>反应温度>LJP与氯乙酸质量比>反应时间。方差分析结果表明(表4),碱化温度(A)、反应温度(C)均显著影响取代度(P<0.05),而反应时间(B)、LJP与氯乙酸质量比(D)对取代度的影响不显著(P>0.05)。CM-LJP最优条件组合为A3C3D2B3,即碱化温度50 ℃、反应时间4.0 h、反应温度65 ℃、LJP与氯乙酸质量比为3∶7。
表3 正交试验结果
Table 3 Orthogonal experiment results
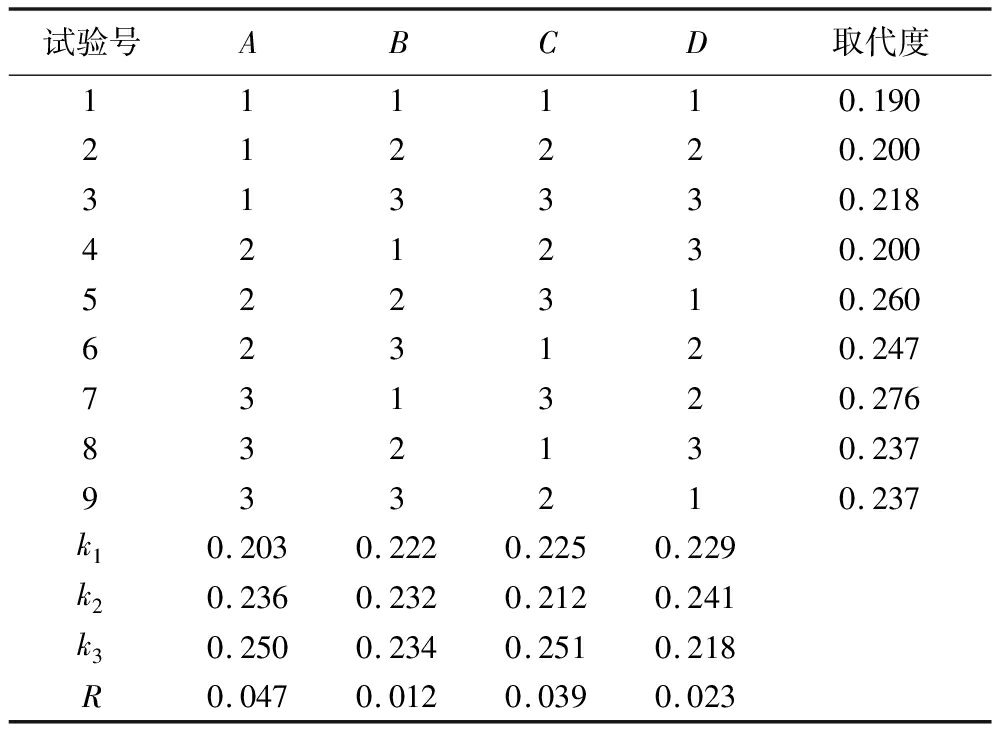
试验号ABCD取代度111110.190212220.200313330.218421230.200522310.260623120.247731320.276832130.237933210.237k10.2030.2220.2250.229k20.2360.2320.2120.241k30.2500.2340.2510.218R0.0470.0120.0390.023
表4 正交试验方差分析
Table 4 Analysis of variance for orthogonal experiments
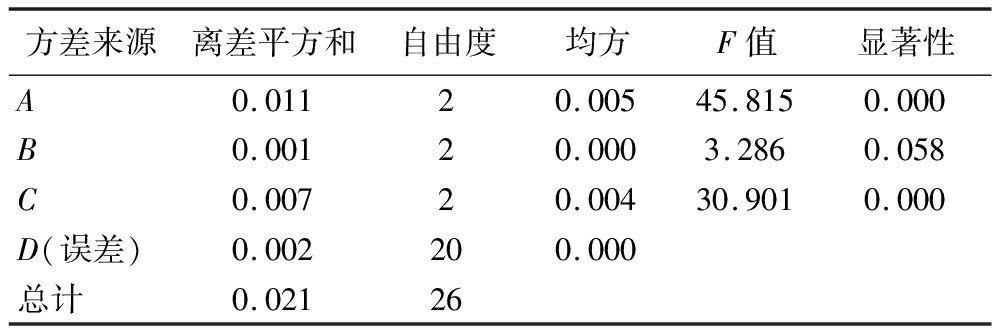
方差来源离差平方和自由度均方F值显著性A0.01120.00545.8150.000B0.00120.0003.2860.058C0.00720.00430.9010.000D(误差)0.002200.000总计0.02126
2.2.2 验证试验
称取LJP样品0.3 g,在CM-LJP最佳工艺条件下进行试验。按碱化温度50 ℃、反应时间4.0 h、反应温度65 ℃、LJP与氯乙酸质量比为3∶7,计算CM-LJP的取代度。结果表明,经3次验证试验,CM-LJP的平均取代度值为0.304,远高于其他组合的取代度,证实最佳优化条件合理可信。
2.3 LJP的结构表征
2.3.1 紫外光谱分析
由图5可知,LJP和CM-LJP溶液在260~280 nm处均未检测到明显的吸收峰,表明多糖中核酸和蛋白质均被去除,样品的分离纯化效果好。
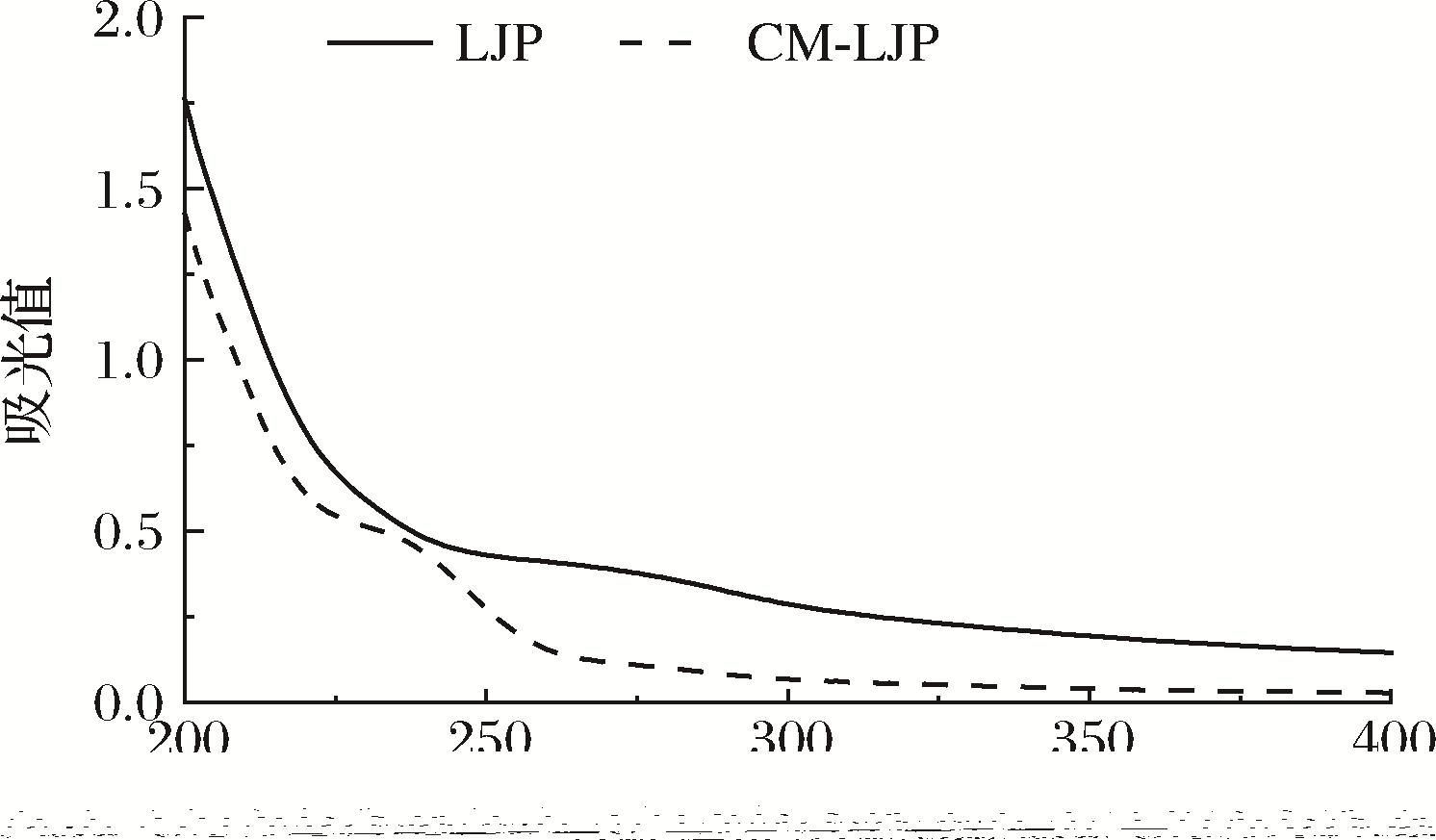
图5 紫外光谱图
Fig.5 Ultraviolet spectrogram
2.3.2 傅里叶变换红外光谱分析
如图6所示,LJP和CM-LJP在3 100~3 740 cm-1和2 800~3 000 cm-1是典型的多糖类物质的特征峰[25-26],1 060~1 200 cm-1是由C—O—H和C—O—C结构产生振动吸收引起的[27],1 000~1 050 cm-1是由—OH的变角振动引起的[28]。LJP在1 643 cm-1处的吸收峰是由于酯或羧基中C![]() O的拉伸振动引起,表明多糖中可能存在糖醛酸或乙酰基[29],1 417 cm-1处的吸收峰是由对称C—O拉伸振动引起的[30]。
O的拉伸振动引起,表明多糖中可能存在糖醛酸或乙酰基[29],1 417 cm-1处的吸收峰是由对称C—O拉伸振动引起的[30]。
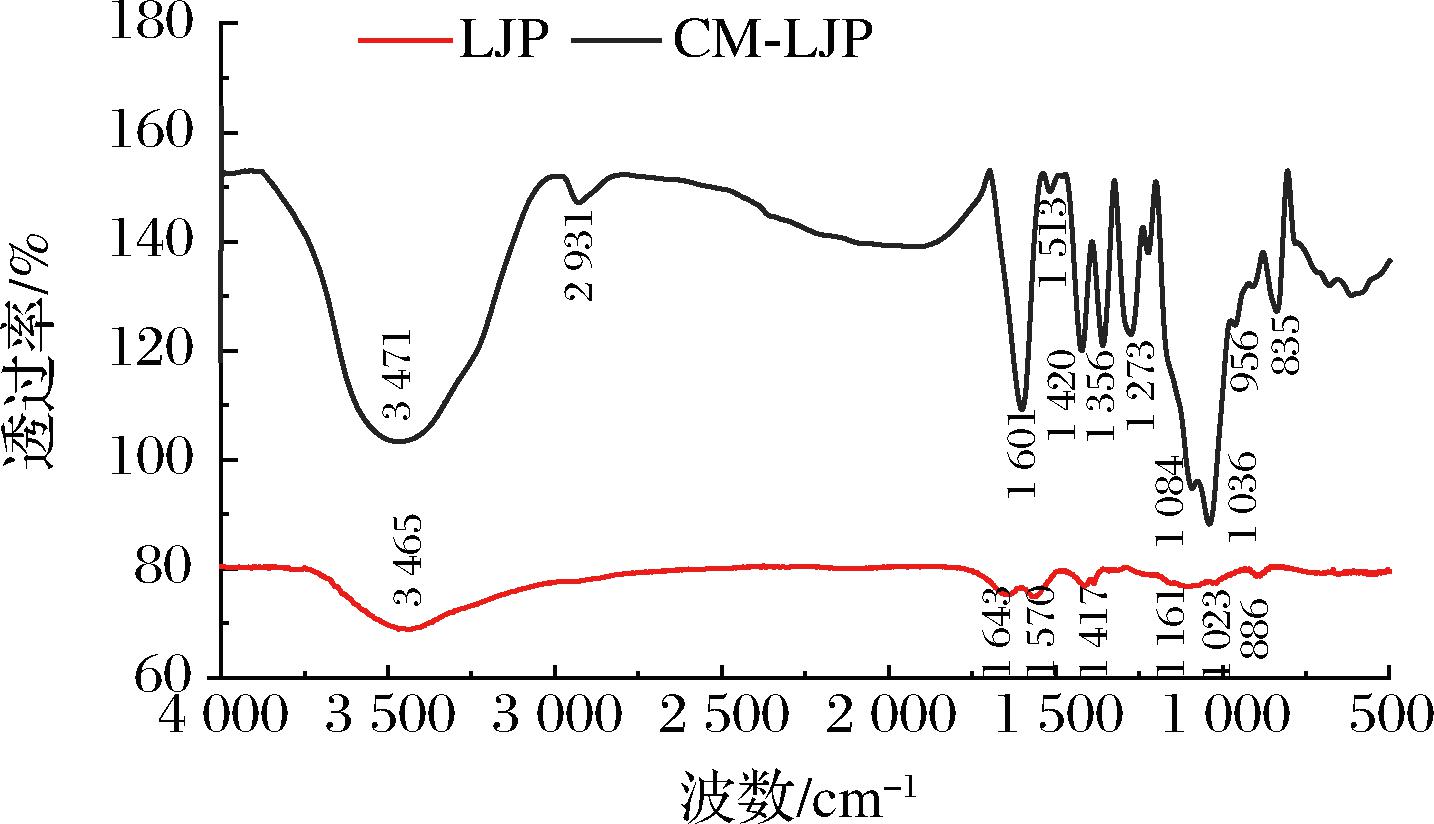
图6 傅里叶变换红外光谱图
Fig.6 Fourier transform infrared spectrogram
与LJP相比,CM-LJP在1 460~1 540 cm-1和1 540~1 700 cm-1处出现了新的吸收峰,即1 601 cm-1是由COO—的拉伸振动引起的,1 513 cm-1是羧基基团的特征吸收峰,表明海带多糖羧甲基化修饰成功[31]。956 cm-1和835 cm-1分别是α-吡喃糖和β-吡喃糖的吸收峰,表明CM-LJP为吡喃型多糖[32]。
2.3.3 刚果红实验结果
具有三股螺旋结构的多糖可与刚果红染料形成较为稳定的络合物[33],与刚果红相比,LJP与刚果红形成络合物的最大吸收波长发生明显红移(图7),表明LJP中存在三螺旋结构。CM-LJP与刚果红形成络合物的最大吸收波长未表现出明显的红移,表明CM-LJP中不存在三螺旋结构,推测可能是由于海带多糖修饰制备过程中温度较高,导致三螺旋结构解螺旋变成无规则线团[34]。
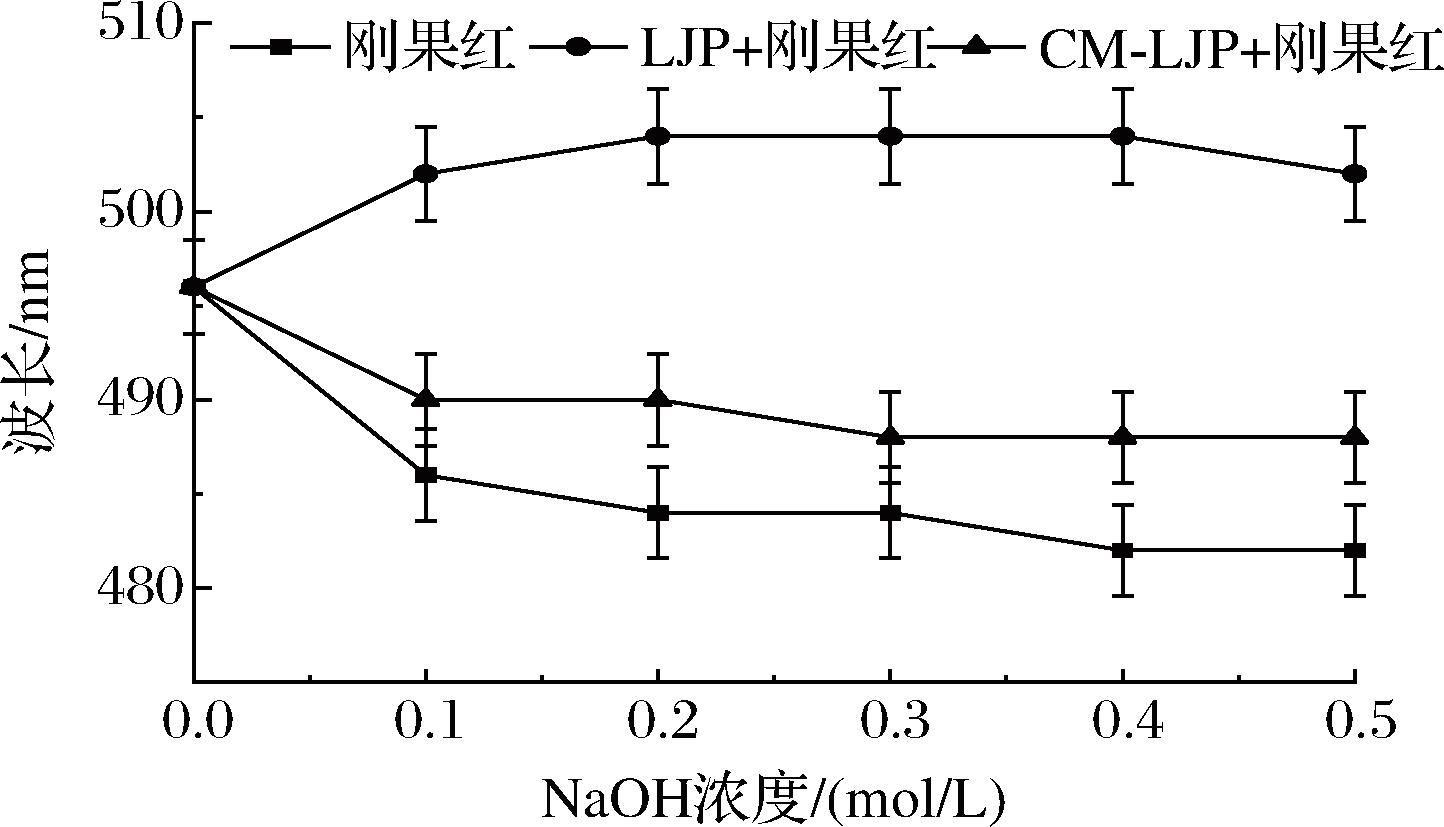
图7 LJP、CM-LJP在不同NaOH浓度下最大吸收波长变化
Fig.7 The maximum absorption wavelength of LJP and CM-LJP varies with different NaOH concentrations
2.3.4 高碘酸氧化实验结果
LJP和CM-LJP经高碘酸氧化30 h后,反应液的吸光值趋于稳定(表5),说明高碘酸氧化反应已完成。由图8的NaIO4标准曲线计算得,LJP消耗1.651 mmol高碘酸产生0.375 mmol甲酸,CM-LJP消耗0.422 mmol高碘酸产生0 mmol甲酸。表明LJP中存在既消耗高碘酸又生成甲酸的(1→6)糖苷键,高碘酸消耗量为甲酸生成量的2倍有余,推测LJP中存在只消耗高碘酸而不产生甲酸的(1→2、1→4)糖苷键,可能存在既不消耗高碘酸也不产生甲酸的(1→3)糖苷键,摩尔比为0.041∶0.049∶0.911,而CM-LJP中存在(1→2、1→4)糖苷键,可能存在(1→3)糖苷键,摩尔比为0.023∶0.977。
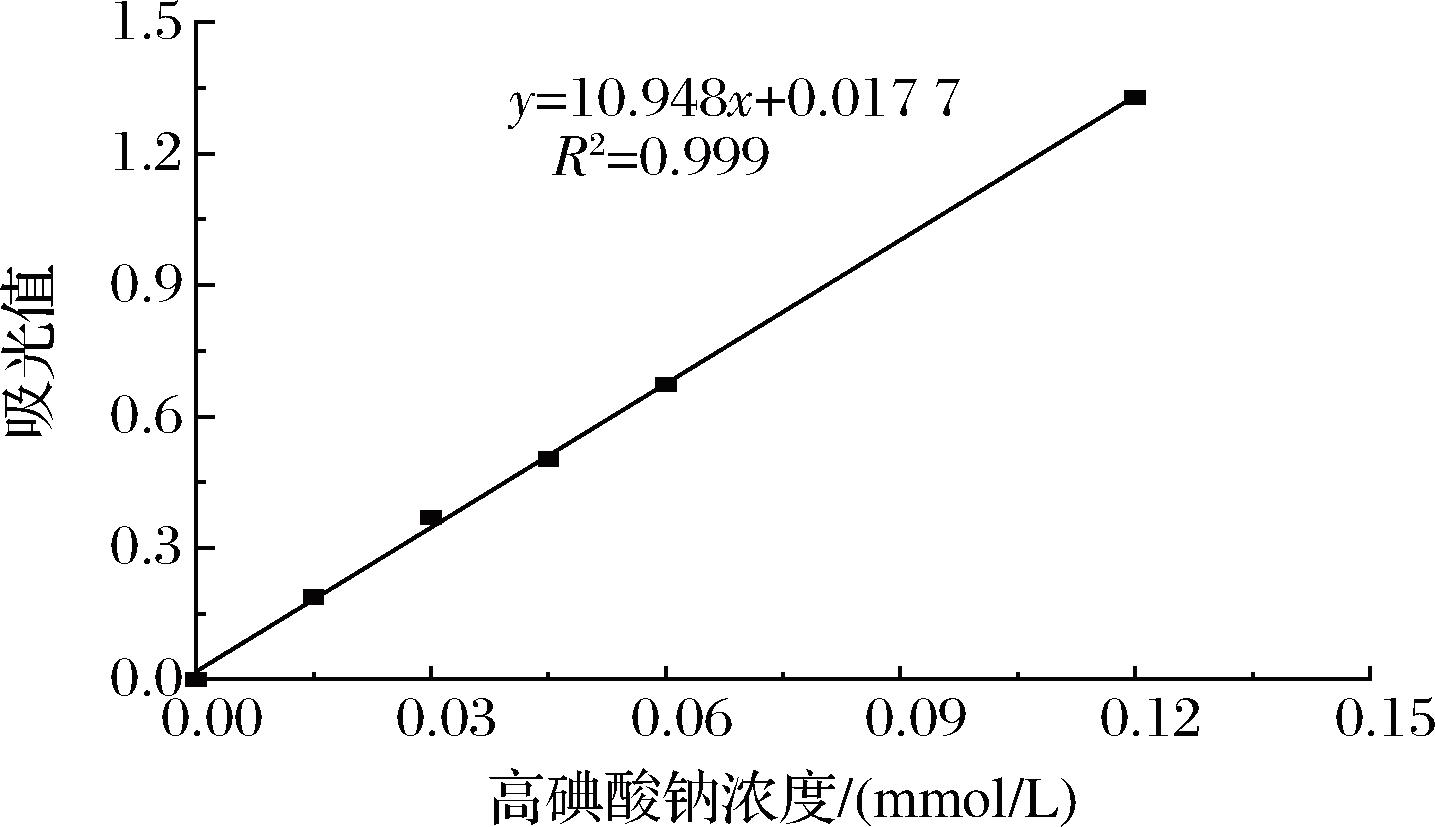
图8 LJP和CM-LJP的高碘酸钠标准曲线
Fig.8 Sodium periodate standard curves for LJP and CM-LJP
表5 LJP、CM-LJP稳定时的吸光度及有无甲酸产生
Fig.5 Absorbance and formic acid production when LJP and CM-LJP are stable
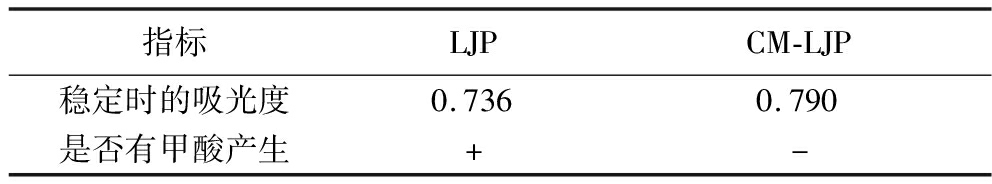
指标LJPCM-LJP稳定时的吸光度0.7360.790是否有甲酸产生+-
注:“+”表示是,“-”表示否。
2.4 羧甲基化修饰对LJP生物活性的影响
2.4.1 自由基清除能力
由图9可知,LJP、CM-LJP对DPPH自由基、·OH的清除能力较强,对![]() 的清除能力较弱,清除率均随多糖质量浓度的增加而增加。在0~5 mg/mL质量浓度内,CM-LJP对DPPH自由基
的清除能力较弱,清除率均随多糖质量浓度的增加而增加。在0~5 mg/mL质量浓度内,CM-LJP对DPPH自由基![]() 的清除率均高于LJP。当质量浓度为5 mg/mL时,CM-LJP对3种自由基的清除率分别为72.48%、71.27%、21.26%,IC50分别为(1.32±0.03)、(2.32±0.07)、(4.73±0.002) mg/mL。由表6可知,CM-LJP的IC50值均小于LJP(P<0.05),表明羧甲基化修饰能够显著提高LJP对自由基的清除能力。
的清除率均高于LJP。当质量浓度为5 mg/mL时,CM-LJP对3种自由基的清除率分别为72.48%、71.27%、21.26%,IC50分别为(1.32±0.03)、(2.32±0.07)、(4.73±0.002) mg/mL。由表6可知,CM-LJP的IC50值均小于LJP(P<0.05),表明羧甲基化修饰能够显著提高LJP对自由基的清除能力。
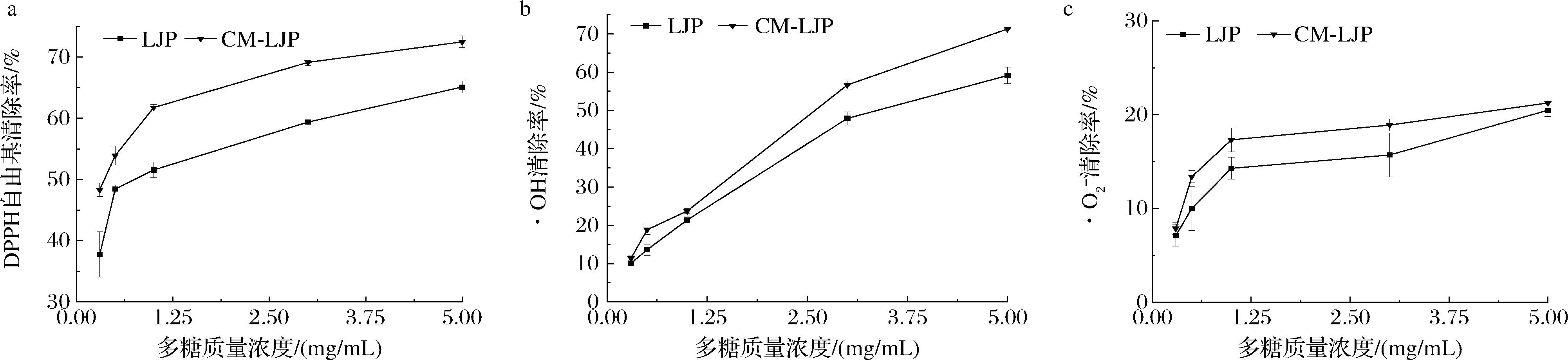
a-DPPH自由基清除率;b-·OH清除率;![]() 清除率
清除率
图9 LJP、CM-LJP的自由基清除能力
Fig.9 Free radical scavenging abilities of LJP and CM-LJP
表6 LJP、CM-LJP生物活性的半抑制浓度(IC50) 单位:mg/mL
Table 6 The IC50 of biological activity of LJP and CM-LJP
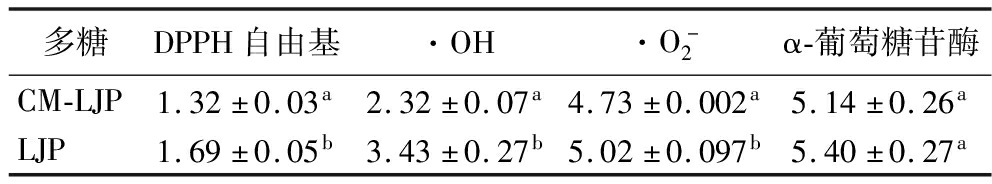
多糖DPPH自由基·OH·O-2α-葡萄糖苷酶CM-LJP1.32±0.03a2.32±0.07a4.73±0.002a5.14±0.26aLJP1.69±0.05b3.43±0.27b5.02±0.097b5.40±0.27a
注:不同字母表示LJP与CM-LJP的IC50间具有显著性差异(P<0.05)。
2.4.2 降血糖活性
LJP和CM-LJP对α-葡萄糖苷酶抑制活性呈明显的量效关系,抑制率随多糖质量浓度的增加而增加(图10)。当多糖质量浓度为20 mg/mL时,LJP与CM-LJP对α-葡萄糖苷酶的抑制率均达到最高,分别为18.3%、21.2%,IC50值分别为(5.40±0.27)、(5.14±0.26) mg/mL,表明CM-LJP的降血糖活性较LJP的降血糖活性无显著提高。
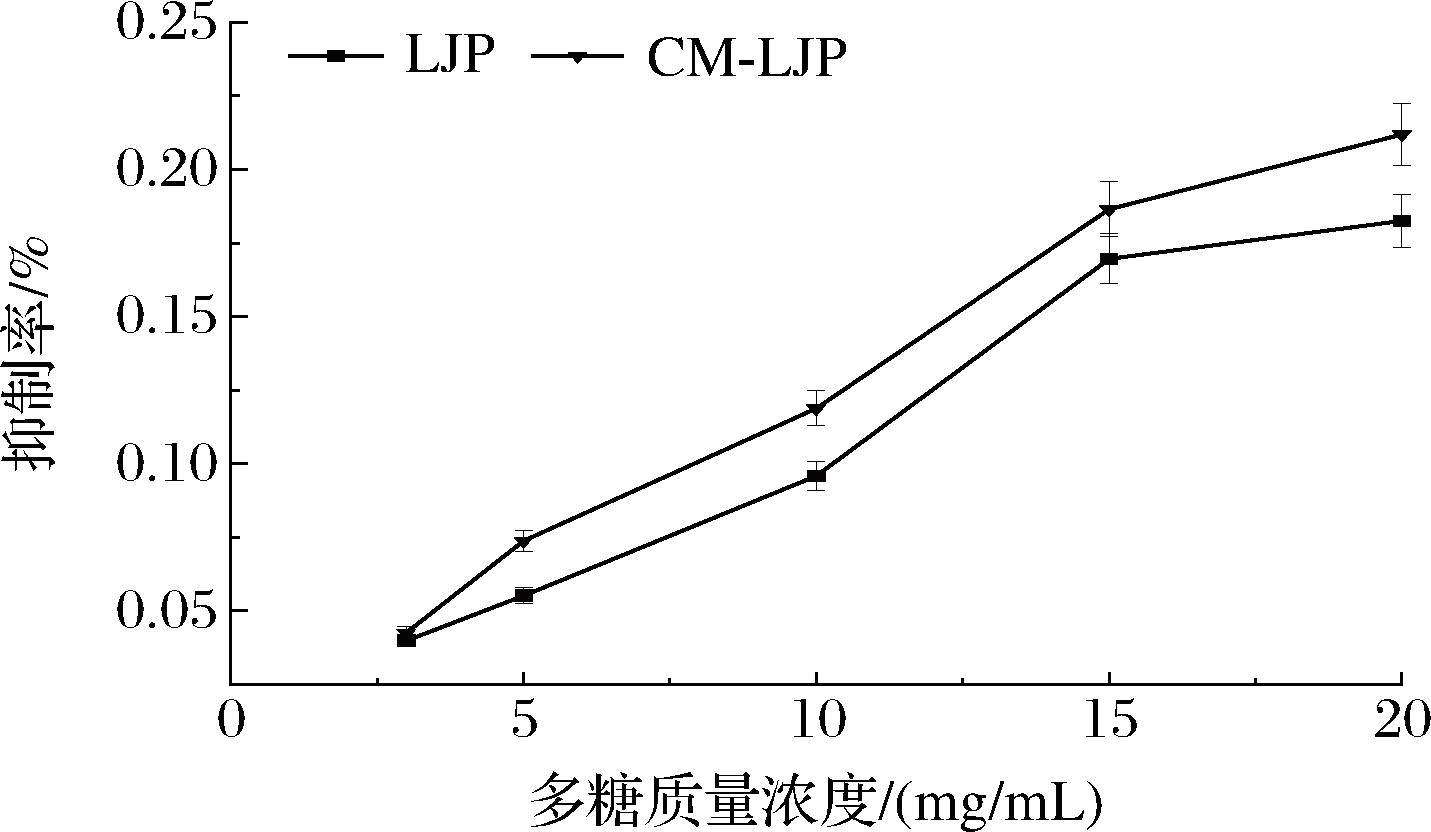
图10 LJP、CM-LJP对α-葡萄糖苷酶的抑制率
Fig.10 Inhibition rate of α-glucosidase by LJP and CM-LJP
3 结论
采用氢氧化钠-氯乙酸法对海带多糖进行羧甲基化修饰,影响羧甲基取代度的因素依次为:碱化温度>反应温度>海带多糖与氯乙酸质量比>反应时间。最佳工艺条件为碱化温度50 ℃、反应时间4.0 h、反应温度65 ℃、海带多糖与氯乙酸质量比为3∶7,该条件下,海带多糖羧甲基化的最高取代度为0.304。羧甲基化修饰后的海带多糖结构发生显著变化,引入羧基基团,三股螺旋结构消失,糖苷键主要连接方式由修饰前的(1→2、1→4)、(1→3)和(1→6)(摩尔比0.049∶0.911∶0.041)更改为(1→2、1→4)、(1→3)(摩尔比0.023∶0.977)。羧甲基化修饰对海带多糖自由基清除能力与降血糖活性影响不一,其中,DPPH自由基、·OH和![]() 的清除能力均显著高于修饰前,IC50值分别为(1.32±0.03)、(2.32±0.07)、(4.73±0.002) mg/mL,但降血糖活性在修饰前后无显著性差异,说明应用羧甲基化修饰促进海带多糖生物活性时应优先考虑其对自由基的清除能力。
的清除能力均显著高于修饰前,IC50值分别为(1.32±0.03)、(2.32±0.07)、(4.73±0.002) mg/mL,但降血糖活性在修饰前后无显著性差异,说明应用羧甲基化修饰促进海带多糖生物活性时应优先考虑其对自由基的清除能力。
[1] 林晓娟,苏志琛,陈继承.海带多糖的结构特征、生物活性及其应用[J].现代食品,2021(24):49-52.LIN X J,SU Z C,CHEN J C.Structural characteristics,bioactivity and application of Laminaria polysaccharide[J].Modern Food,2021(24):49-52.
[2] 张洋婷,韩丽琴,郗艳丽,等.红景天多糖羧甲基化修饰及其抗氧化活性[J].中国公共卫生,2017,32(10):1462-1465.ZHANG Y T,HAN L Q,CHI Y L,et al.Carboxymethylation and antioxidant activity of rhodiola polysaccharide[J].Chinese Journal of Public Health,2017,32(10):1462-1465.
[3] HUANG S Y,CHEN F,CHENG H,et al.Modification and application of polysaccharide from traditional Chinese medicine such as Dendrobium officinale[J].International Journal of Biological Macromolecules,2020,157:385-393.
[4] XIE L M,SHEN M Y,WANG Z J,et al.Structure,function and food applications of carboxymethylated polysaccharides:A comprehensive review[J].Trends in Food Science &Technology,2021,118:539-557.
[5] 陈栅,冯润芳,袁野,等.酸枣多糖羧甲基化修饰及活性研究[J].中国食品学报,2022,22(4):55-66.CHEN S,FENG R F,YUAN Y,et al.Studies on carboxy methylation modification and activity of wild jujube polysaccharide[J].Journal of Chinese Institute of Food Science and Technology,2022,22(4):55-66.
[6] 黄馨阅,丁慧敏,马士玄,等.红须腹菌多糖的提取、羧甲基化修饰及免疫活性研究[J].南京师大学报(自然科学版),2023,46(3):60-68.HUANG X Y,DING H M,MA S X,et al.Extraction,carboxymethylation modification and in vivo immunomodulatory effects of polysaccharides from Rhizopogon rubescens(tul.)tul[J].Journal of Nanjing Normal University (Natural Science Edition),2023,46(3):60-68.
[7] 赵迪.黑木耳多糖对炎性肠病的预防作用及其化学修饰[D].上海:华东理工大学,2021.ZHAO D.Preventive effect of auricularia auricula polysaccharide on inflammatory bowel disease and its chemical modification[D].Shanghai:East China University of Science and Technology,2021.
[8] 李文婧,张晨,李大鹏.化学修饰对多糖结构与生物活性影响的研究进展[J].食品研究与开发,2021,42(2):205-213.LI W J,ZHANG C,LI D P.Recent advances in understanding the effect of chemical modification on the structure and biological activities of polysaccharides[J].Food Research and Development,2021,42(2):205-213.
[9] 冯书珍,卢宇凤,刘南英,等.海藻多糖的单糖组成对体外抗氧化活性的影响[J].天然产物研究与开发,2019,31(1):116-121; 169.FENG S Z,LU Y F,LIU N Y,et al.Effect of monosaccharide composition on antioxidant activity of algal polysaccharides[J].Natural Product Research and Development,2019,31(1):116-121; 169.
[10] 冯学珍,覃慧逢,赵丽婷,等.食用海藻中α-葡萄糖苷酶抑制剂的筛选及抑制动力学[J].食品工业,2019,40(6):195-198.FENG X Z,QIN H F,ZHAO L T,et al.Screening of fraction with inhibiting activity against α-glucosidase from edible algal and its inhibition kinetic behaviors[J].The Food Industry,2019,40(6):195-198.
[11] 蒋建新,张乐平,徐伟,等.特色高分子多糖改性及应用研究进展[J].林业工程学报,2022,7(6):13-24.JIANG J X,ZHANG L P,XU W,et al.Advance on modification and application of characteristic macromolecular polysaccharides[J].Journal of Forestry Engineering,2022,7(6):13-24.
[12] 姚秋萍,卫亚丽,杨琼,等.油菜花粉多糖羧甲基化分子修饰及其抗氧化研究[J].食品研究与开发,2017,38(17):26-30.YAO Q P,WEI Y L,YANG Q,et al.Carboxymethylated modification and antioxidant activity of rape pollen polysaccharides[J].Food Research and Development,2017,38(17):26-30.
[13] LIU H Z,LI F P,LUO P.Effect of carboxymethylation and phosphorylation on the properties of polysaccharides from Sepia esculenta ink:Antioxidation and anticoagulation in vitro[J].Marine Drugs,2019,17(11):626.
[14] 李雪晖,罗心雨,王莹.羧甲基化南瓜多糖的制备及抗氧化、降血糖活性研究[J].食品与机械,2022,38(3):178-183; 246.LI X H,LUO X Y,WANG Y.Preparation of carboxymethylated pumpkin polysaccharide and its antioxidant and hypoglycemic activities[J].Food and Machinery,2022,38(3):178-183; 246.
[15] 王晓婷.蛹虫草多糖分子结构与α-葡萄糖苷酶抑制活性研究[D].天津:天津科技大学,2017.WANG X T.Study on molecular structure and α-glucosidase inhibitory activity of Cordyceps militaris polysaccharide[D].Tianjin:Tianjin University of Science &Technology,2017.
[16] 田数,邢雨晴,李力群,等.裙带菜多糖的提取、羧甲基化修饰及抗氧化活性研究[J].食品安全质量检测学报,2023,14(6):279-284.TIAN S,XING Y Q,LI L Q,et al.Extraction,carboxymethylation and antioxidant activity of Undaria pinnatifida polysaccharide[J].Journal of Food Safety and Quality,2023,14(6):279-284.
[17] 李昱辉,崔建明.干法制备中低取代度羧甲基淀粉[J].化工技术与开发,2022,51(11):17-20; 34.LI Y H,CUI J M.Dry preparation of medium and low degree of substitution carboxymethyl starch[J].Technology &Development of Chemical Industry,2022,51(11):17-20; 34.
[18] 赵鹏,张婷婷.响应面法优化金银花多糖羧甲基化工艺及抗氧化性研究[J].天然产物研究与开发,2015,27(1):114-119; 190.ZHAO P,ZHANG T T.Preparation of carboxymethyl Lonicera japonica polysaccharides and its antioxidant ability[J].Natural Product Research and Development,2015,27(1):114-119; 190.
[19] 刘贵珍,杨志伟.不同取代度羧甲基化罗汉果多糖的制备及生理活性研究[J].食品工业科技,2023,44(13):224-232.LIU G Z,YANG Z W.Preparation and physiological activity of carboxymethylated Siraitia grosvenorii polysaccharide with different degrees of substitution[J].Science and Technology of Food Industry,2023,44(13):224-232.
[20] 陈光静.方竹笋的加工废笋渣中多糖的分离纯化和结构解析及其生物活性研究[D].重庆:西南大学,2019.CHEN G J.Study on the separation,purification,structural analysis and biological activity of polysaccharides from waste bamboo shoot residue[D].Chongqing:Southwest University,2019.
[21] 江连洲,张巧智,关嘉琦,等.羧甲基化大豆水酶法膳食纤维的制备及其性能研究[J].农业机械学报,2017,48(10):330-337.JIANG L Z,ZHANG Q Z,GUAN J Q,et al.Preparation of dietary fiber from enzyme-assisted aqueous extraction of soybeans through carboxymethylation and its functional properties[J].Transactions of the Chinese Society for Agricultural Machinery,2017,48(10):330-337.
[22] 李霞,胡楠,赵启迪,等.肠浒苔多糖的羧甲基化修饰及其抗氧化活性研究[J].广西植物,2019,39(11):1519-1526.LI X,HU N,ZHAO Q D,et al.Carboxymethylation modification and antioxidant activity of Enteromorpha intestinalis polysaccharides[J].Guihaia,2019,39(11):1519-1526.
[23] 张银英,朱静祎,潘裕添,等.灵芝多糖羧甲基化修饰及抗氧化性研究[J].闽南师范大学学报(自然科学版),2022,35(1):100-108.ZHANG Y Y,ZHU J Y,PAN Y T,et al.Carboxymethylation and antioxidation of polysaccharide from Ganoderma lucidum[J].Journal of Minnan Normal University (Natural Science),2022,35(1):100-108.
[24] 陈义勇,张阳.杏鲍菇多糖羧甲基化修饰工艺及其抗氧化活性[J].食品与发酵工业,2016,42(7):119-127.CHEN Y Y,ZHANG Y.Carboxymethylation modification process and antioxidant activity of polysaccharides from Pleurotus eryngii[J].Food and Fermentation Industries,2016,42(7):119-127.
[25] 白家峰,姚延超,郑毅,等.罗汉果多糖的羧甲基化修饰及抗氧化性能影响研究[J].湖北农业科学,2021,60(15):107-111.BAI J F,YAO Y C,ZHENG Y,et al.Study on the effect of carboxymethylation of Siraitia grosvenorii polysaccharide on its antioxidant[J].Hubei Agricultural Sciences,2021,60(15):107-111.
[26] 许春平,姚延超,白家峰,等.枸杞多糖的羧甲基化修饰及抗氧化性能[J].河南科技大学学报(自然科学版),2021,42(3):85-89.XU C P,YAO Y C,BAI J F,et al.Carboxymethylation modification and antioxidant activities of Lycium barbarum polysaccharide[J].Journal of Henan University of Science and Technology (Natural Science),2021,42(3):85-89.
[27] LIN X M,LIU K S,YIN S,et al.A novel pectic polysaccharide of jujube pomace:Structural analysis and intracellular antioxidant activities[J].Antioxidants,2020,9(2):127.
[28] JI X L,HOU C Y,YAN Y Z,et al.Comparison of structural characterization and antioxidant activity of polysaccharides from jujube (Ziziphus jujuba Mill.) fruit[J].International Journal of Biological Macromolecules,2020,149:1008-1018.
[29] SUN L J,MENG Y H,SUN J J,et al.Characterization,antioxidant activities and hepatoprotective effects of polysaccharides from pre-pressing separation Fuji apple peel[J].CyTA-Journal of Food,2017,15(2):307-319.
[30] 符玉霞,郭欣,魏亚博,等.红枣多糖羧甲基化修饰及其抗氧化活性研究[J].食品工业科技,2022,43(17):104-113.FU Y X,GUO X,WEI Y B,et al.Study on carboxymethylation modification and antioxidant activity of polysaccharides from Zizyphus jujuba[J].Science and Technology of Food Industry,2022,43(17):104-113.
[31] 马永强,张一鹏,王鑫,等.黄精多糖羧甲基化修饰及其抗氧化活性研究[J].中国食品添加剂,2023,34(6):38-47.MA Y Q,ZHANG Y P,WANG X,et al.Carboxymethylation modification of Polygonatum polysaccharide and its antioxidant activity[J].China Food Additives,2023,34(6):38-47.
[32] 何培新,吴双双,郑凯,等.杨树桑黄胞外多糖的分子结构及抗氧化活性[J].食品与生物技术学报,2018,37(9):939-947.HE P X,WU S S,ZHENG K,et al.Molecular structure and antioxidant activity of polysaccharides from Phellinus vaninii Ljup[J].Journal of Food Science and Biotechnology,2018,37(9):939-947.
[33] 栾迪.莼菜体外胶多糖降血糖组分分离及其降血糖机理研究[D].杭州:浙江工业大学,2020.LUAN D.Isolation of hypoglycemic components from in vitro polysaccharide of water shield and its hypoglycemic mechanism[D].Hangzhou:Zhejiang University of Technology,2020.
[34] 刘青业,许小娟.三螺旋多糖的链结构与功能研究进展[J].功能高分子学报,2016,29(2):134-152.LIU Q Y,XU X J.Recent progress in chain conformation and function of triple helical polysaccharides[J].Journal of Functional Polymers,2016,29(2):134-152.