益生菌被定义为摄入一定数量时能够对宿主健康产生有益作用的活的微生物[1]。在加工、贮存和运输过程中,益生菌的存活是益生菌产品有效的必要条件。冷冻干燥是工业生产过程中保持益生菌活性的最常见和最有效的方法[2],但是在冷冻干燥过程中冷冻、低温、渗透、低压和干燥等不利条件会使益生菌的细胞膜破裂以及细胞内酶活力降低,从而导致细胞的活力下降甚至完全丧失[3-4]。为提高细胞对冷冻干燥的抗性,通常会在冷冻干燥之前加入保护剂以减轻冷冻干燥带来的损伤[5-6]。保护剂的种类有很多,根据其结构可分为糖类、醇类、盐类、甘油、维生素类以及氨基酸、肽和蛋白质类等[7],其中,糖类保护剂成为近年来国内外研究热点[8]。
真菌多糖为天然活性物质,具有抗氧化、抗衰老、抗肿瘤、免疫调节、器官保护等多种生物活性[9],在食品科学、医药学和生物学等领域受到国内外学者的高度关注[10]。据报道,滑菇多糖[11]、银耳多糖[12]和普鲁兰多糖[13]等真菌多糖具有作为益生菌冷冻保护剂的潜力,可有效提高益生菌冷冻干燥的存活率。茯苓多糖(Poria cocos polysaccharide,PCP)来源于多孔菌科茯苓的菌核,是一种天然活性物质,具有开发功能性食品添加剂和药物的前景[14]。层析法可有效将茯苓多糖中的中性多糖与带负电的酸性多糖相分离,以达到对茯苓粗多糖进行分离纯化的目的[15]。CHENG等[16]采用柱层析对茯苓多糖进行分离纯化,探究出茯苓多糖纯化组分能明显改善CCl4处理引起的肝组织损伤,缓解炎症。ZHANG等[17]研究发现经DEAE-52纤维素层析法获得的茯苓多糖纯化组分具有抗抑郁活性。茯苓多糖纯化组分对益生菌的冷冻干燥保护效果研究较少。
前期初步筛选验证出茯苓粗多糖与基础保护剂复配后对复合乳酸菌的冷冻干燥具有较好的保护作用,本研究将对茯苓粗多糖进行分离纯化,制备茯苓多糖组分(PCP-1),并对其进行结构表征,研究PCP-1对复合乳酸菌冷冻干燥的保护效果及作用机理,探究PCP-1结构与复合乳酸菌冻干保护效果之间可能的构效关系,为PCP-1作为复合乳酸菌冷冻干燥的保护剂提供理论依据。
1 材料与方法
1.1 材料与试剂
50%茯苓多糖,西安瑞尔丽生物工程有限公司;植物乳杆菌JYLP-002(Lactiplantibacillus plantarum JYLP-002)、干酪乳杆菌JYLC-374(Lactobacillus casei JYLC-374)、鼠李糖乳杆菌JYLR-005(Lactobacillus rhamnosus JYLR-005),郑州百益宝生物技术有限公司;木瓜蛋白酶、BCA蛋白浓度测定试剂盒,北京索莱宝科技有限公司;脱脂奶粉,恒天然商贸(上海)有限公司;低聚果糖、海藻糖,山东百龙创园生物科技股份有限公司;ATP酶试剂盒,南京建成生物工程研究所;乳酸脱氢酶、丙酮酸激酶活力检测试剂盒,北京索莱宝科技有限公司。
1.2 仪器与设备
SCIENTZ-10N冷冻干燥机,宁波新芝生物科技股份有限公司;高速冷冻离心机,上海力申科学仪器有限公司;UV-2600i紫外可见分光光度计、LC-10A高效液相色谱仪,日本岛津公司; ICS5000离子色谱仪,美国赛默飞世尔科技公司;Nova NanoSEM 450扫描电子显微镜,捷克FEI公司;SMP500-17805-2BF0酶标仪,上海闪普生物科技有限公司;IX73研究级倒置荧光显微镜,奥林巴斯公司。
1.3 实验方法
1.3.1 PCP-1的制备
将50%(质量分数)的茯苓粗多糖采用木瓜蛋白酶-Sevage法进行脱蛋白,透析,冷冻干燥后得到PCP[18]。配制10 mg/mL的PCP溶液,过滤,加样到平衡好的DEAE-52纤维素阴离子交换层析柱(2.6 cm×60 cm)中,依次用去离子水、0.1、0.3、0.5 mol/L的NaCl溶液梯度洗脱,采用苯酚-硫酸法对多糖含量进行跟踪检测,绘制洗脱曲线,收集水洗脱组分以获得PCP-1[19],并测定PCP-1的总糖含量[20]。
1.3.2 PCP-1结构表征
1.3.2.1 PCP-1紫外光谱分析
称取PCP-1用去离子水配制成5 mg/mL的溶液,用紫外分光光度计在200~600 nm波长内进行紫外扫描。
1.3.2.2 PCP-1分子质量测定
采用高效凝胶渗透色谱法(high performance gel permeation chromatography,HPGPC)测定PCP-1的分子质量[21]。PCP-1的分子质量根据从不同分子质量的葡聚糖标准品(Mw:5、11.6、23.8、48.6、80.9、148、273、409.8、667.8 kDa)和其色谱峰的保留时间获得的标准曲线来确定。
1.3.2.3 PCP-1单糖组成分析
精密称量5 mg PCP-1置于瓶中,用2 mL 3 mol/L的三氟乙酸(trifluoroacetic acid,TFA)在120 ℃下水解3 h,吸取酸水解溶液1 mL用氮气干燥,溶解于5 mL去离子水中,混匀,吸取20 μL加入980 μL去离子水,离心,取上清液用离子色谱仪进行分析。色谱条件参照叶美芝等[22]。
1.3.2.4 PCP-1红外光谱分析
称取1 mg PCP-1与100 mg干燥的溴化钾充分混匀、研磨并压制成薄片,在4 000~400 cm-1波数内进行傅里叶红外光谱扫描,记录光谱图[23]。
1.3.3 复合乳酸菌粉的制备
1.3.3.1 菌种培养
将植物乳杆菌JYLP-002、干酪乳杆菌JYLC-374、鼠李糖乳杆菌JYLR-005在MRS液体培养基中活化2代后,按照活菌数1∶1∶1的比例,共3%的接种量接种至MRS液体培养基中,在37 ℃下恒温培养。取共生培养至稳定期前期的JYLP-002、JYLC-374、JYLR-005混合菌液离心,取菌泥,无菌生理盐水洗涤2次后,用无菌水制成原体积1/10的菌悬液备用。
1.3.3.2 复合乳酸菌的真空冷冻干燥
将50 g/L的PCP、50 g/L的PCP-1分别与基础保护剂(50 g/L海藻糖、50 g/L低聚果糖和50 g/L脱脂奶粉)复配作为冻干保护剂,水、基础保护剂作为对照,灭菌后以2∶1的体积比与菌悬液混合,3 mL体系分装于西林瓶中,预冻24 h后进行冷冻干燥,得到冻干菌粉。
1.3.4 活菌数与存活率的测定
采用MRS平板菌落计数法测定乳酸菌粉冻干前后的活菌数量,将冻干前的菌液和冻干后的菌粉复溶至原体积后梯度稀释涂布,置于37 ℃培养箱中倒置培养48 h后计数,3次平行试验[24]。冻干存活率的计算如公式(1)所示:
冻干存活率![]()
(1)
[:NA为冻干后活菌数,lg CFU/mL;NB为冻干前活菌数,lg CFU/mL。
1.3.5 菌粉表观形态特征
将样品置于贴有导电胶的铝片表面,镀金,使用扫描电子显微镜在5 kV加速电压和10 000倍的图像放大率下进行表观形态研究[25]。
1.3.6 糖代谢关键酶活力测定
取冷冻干燥后的样品,生理盐水离心洗涤2次后重悬于3 mL的PBS缓冲液中,用超声波细胞破碎仪在冰浴中进行3 s∶9 s的100个循环,离心,取上清液置冰上待测。ATP酶、乳酸脱氢酶(lactic dehydrogenase,LDH)和丙酮酸激酶(pyruvate kinase,PK)活力测定均按照试剂盒步骤进行,比活力以每毫克蛋白质表示,使用BCA蛋白浓度测定试剂盒检测蛋白质含量。
1.3.7 细胞膜完整性的测定
将冷冻干燥后的样品用PBS缓冲液洗涤2次后重悬于2.55 mL PBS缓冲液中,加入0.3 mL二乙酸荧光素(fluorescein diacetate,FDA)溶液,混匀后再加入0.15 mL的碘化丙啶(propidium iodide,PI),将悬浮液摇匀,于室温下避光染色30 min。待染色结束后用PBS缓冲溶液漂洗并重悬,取5 μL于载玻片上,在荧光显微镜下拍照观察[26]。
1.4 数据处理
所有试验重复3次,数据表示为平均值±标准差。采用Origin 2021软件作图,SPSS 25.0软件用于显著性分析,R 2.15.3软件进行Pearson相关性分析,P<0.05为显著水平。
2 结果与分析
2.1 PCP-1的制备
PCP的DEAE-52柱层析洗脱结果如图1所示,共得到水洗脱峰和0.1 mol/L的NaCl洗脱峰2个洗脱峰,按洗脱曲线收集洗脱组分,经透析及冷冻干燥后得到水洗脱中性多糖PCP-1和盐洗脱酸性多糖PCP-2。其中PCP-1占比为(86.50±0.50)%,PCP-2占比仅为(1.07±0.19)%,存在一定损耗。因PCP-1得率较高,选择PCP-1进行后续试验。根据葡萄糖标准曲线:y=0.004 3x-0.000 7(R2=0.999 6),得出PCP-1的总糖含量为(96.21±0.39)%。
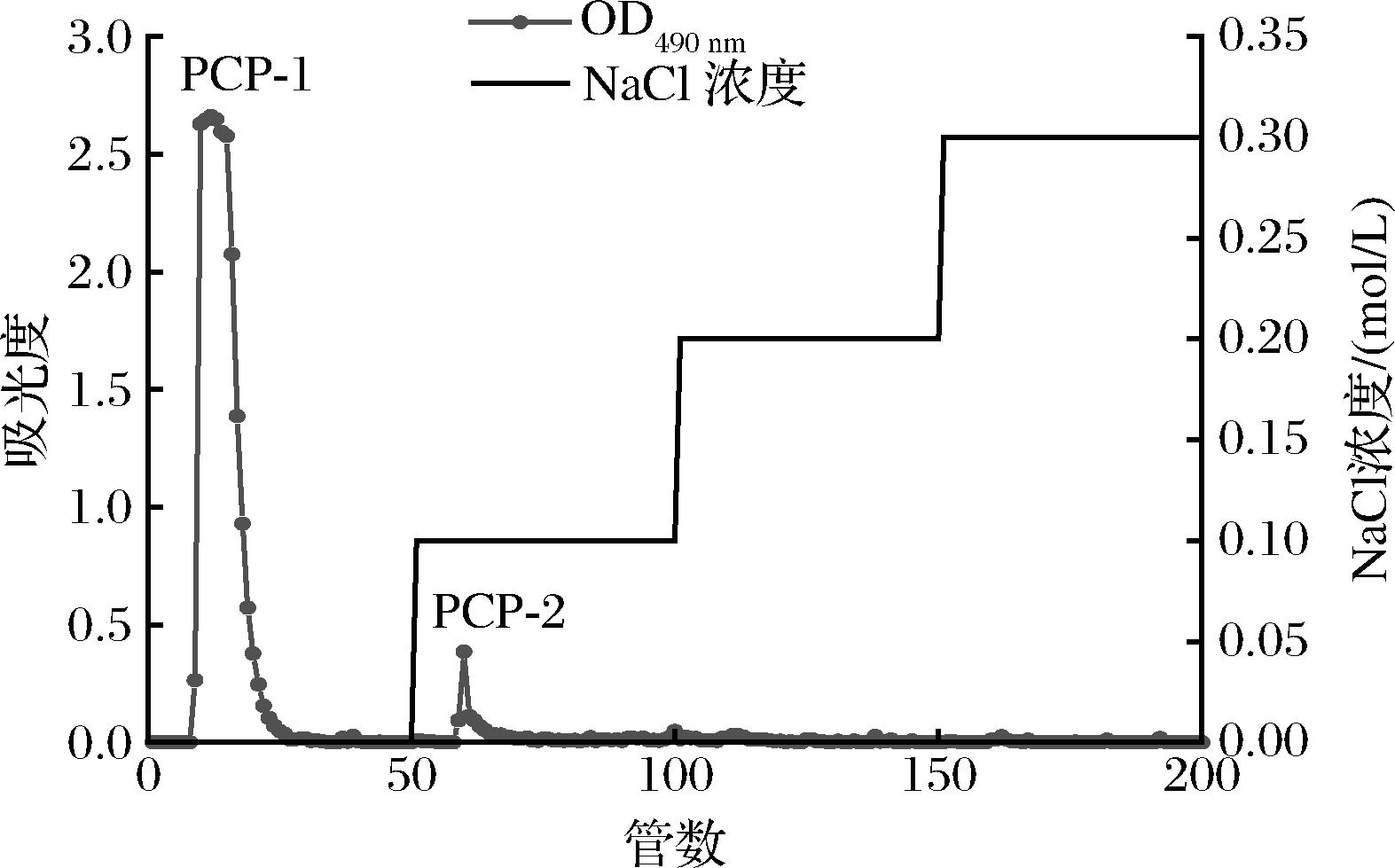
图1 PCP的洗脱曲线
Fig.1 Elution curve of PCP
2.2 PCP-1的结构分析
2.2.1 PCP-1紫外光谱分析
PCP-1的紫外光谱扫描结果如图2所示,其在260 nm和280 nm处没有明显吸收峰,表明PCP-1不含或几乎不含核酸和蛋白质。
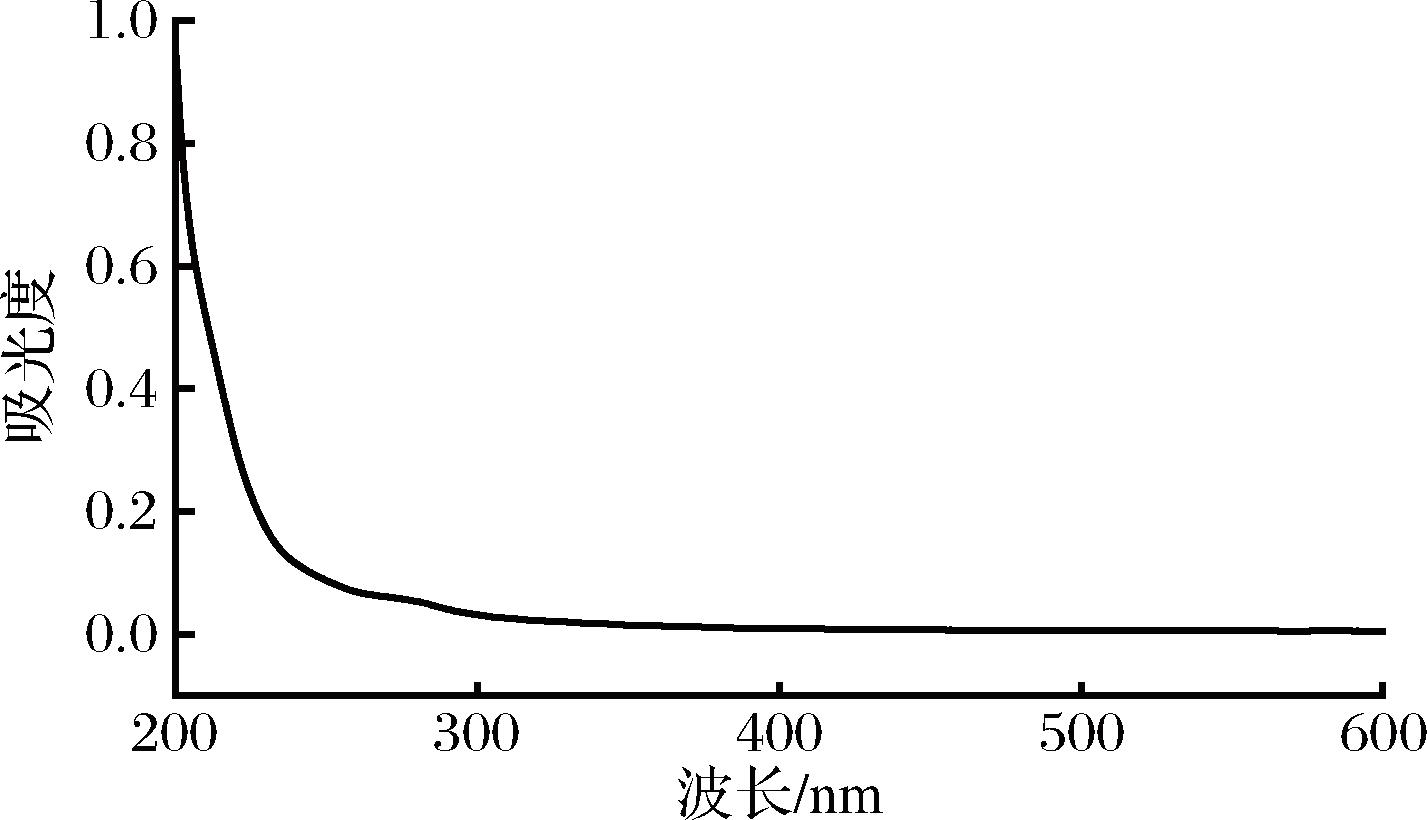
图2 PCP-1的紫外光谱扫描
Fig.2 UV spectrum scanning of PCP-1
2.2.2 PCP-1分子质量测定结果
葡聚糖标准品得到的重均分子质量(weight-average molecular weight,Mw)标准曲线为lg Mw=-0.192 6x+12.241(R2=0.996 5),数均分子质量(number-average molecular weight,Mn)标准曲线为lg Mn=-0.178 3x+11.506(R2=0.991 1)。PCP-1的分子质量测定结果如表1所示,PCP-1的保留时间为42.428 min,Mw和Mn分别为11 732 Da和8 731 Da。多分散系数(Mw/Mn)为1.34,表明PCP-1是一种相对均质的多糖。
表1 PCP-1的分子质量
Table 1 Molecular weight of PCP-1
样品保留时间/minMw/DaMn/Da多分散系数PCP-142.4281173287311.34
2.2.3 PCP-1单糖组成分析
如图3所示,与单糖标准品的保留时间相比,得出PCP-1主要由葡萄糖和葡萄糖醛酸组成,其摩尔比为0.989∶0.011。PCP-1的单糖组成与BIAN等[27]报道的通过酶解制备水溶性茯苓多糖(water soluble poria polysaccharide,WSP)的单糖组成相类似。
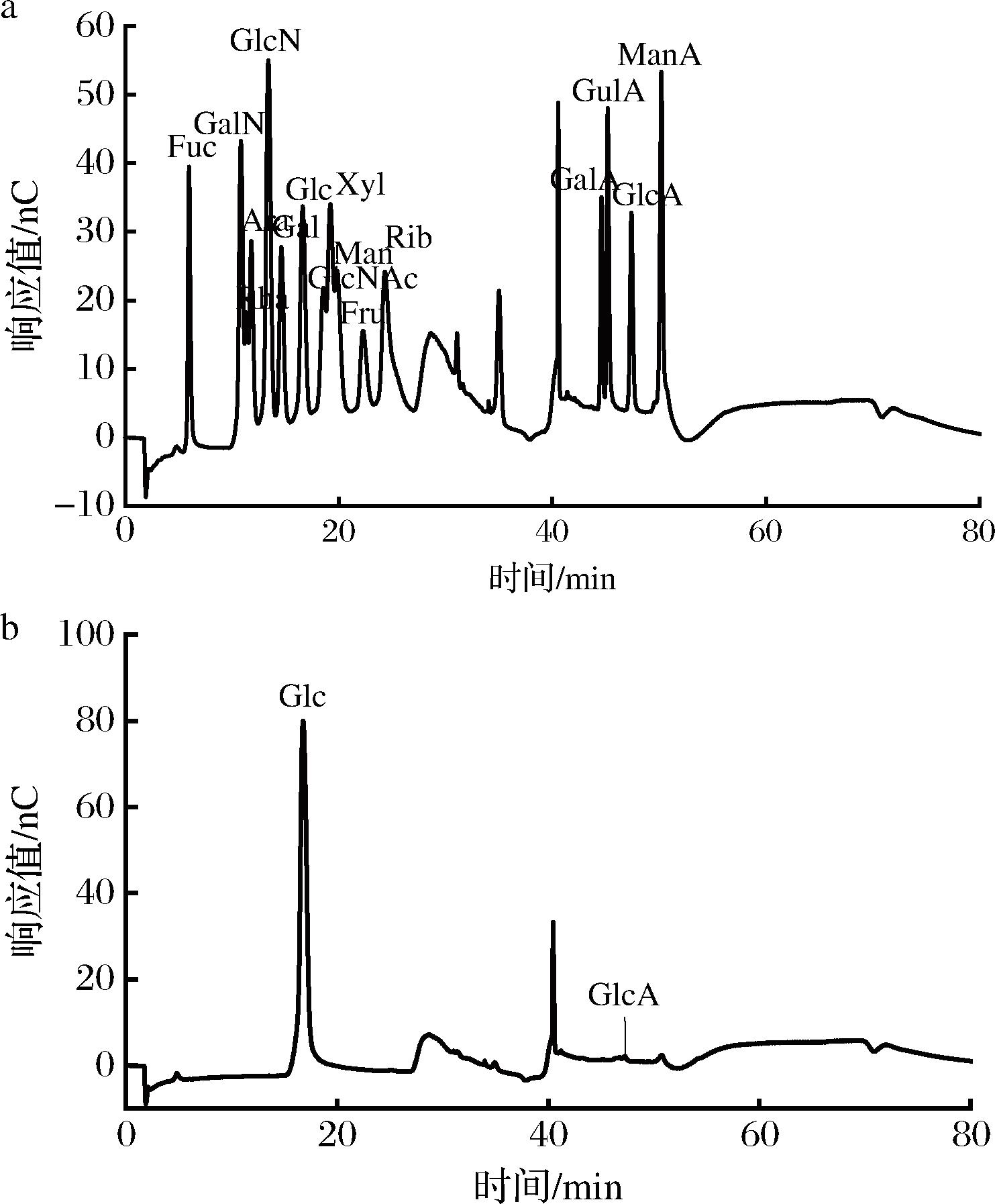
a-单糖标准品;b-PCP-1
图3 单糖标准品和PCP-1的离子色谱图
Fig.3 Ion chromatograms of monosaccharide standard and PCP-1
2.2.4 PCP-1红外光谱分析
如图4所示,PCP-1在3 394.72 cm-1处有宽而强的由羟基的O—H引起的伸缩振动峰,存在羟基;在2 929.86 cm-1处出现明显的吸收峰是由于烷基的C—H伸缩振动引起,为多糖的特征基团吸收峰;在1 646.99 cm-1处有—COOH的伸缩振动特征峰;在1 416.36 cm-1和1 362.31 cm-1附近有C—H键的变角振动峰;在1 153.30~1 030.78 cm-1处出现的吸收峰是吡喃糖环的C—O—C伸缩振动引起的;在926.28 cm-1和854.21 cm-1处观察到的特征吸收峰表明PCP-1同时含有α-糖苷键和β-糖苷键。
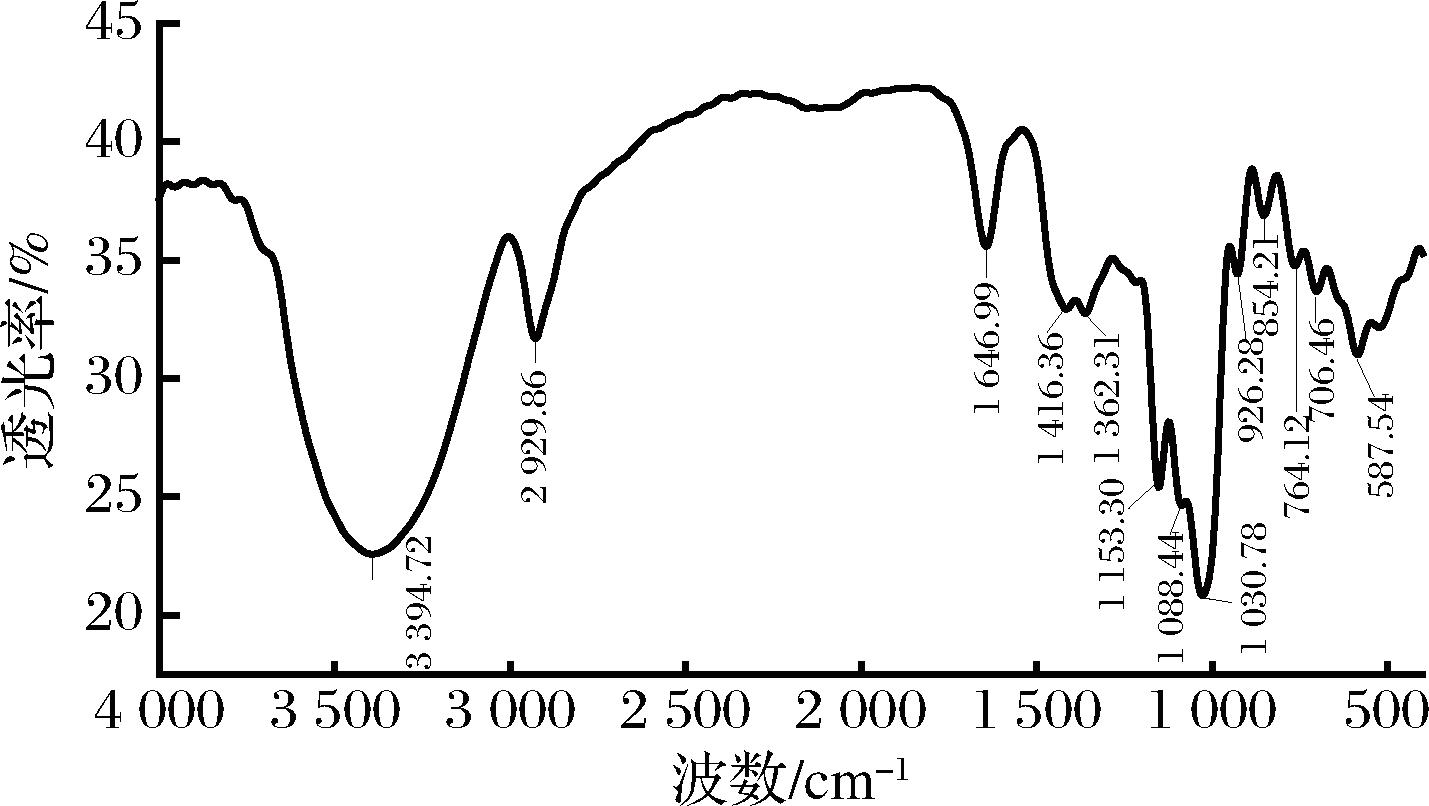
图4 PCP-1的红外光谱图
Fig.4 FTIR spectrum of PCP-1
2.3 PCP-1对复合乳酸菌活菌数及冷冻干燥存活率的影响
添加保护剂可以在很大程度上缓解冷冻干燥对细胞的损伤[28],如图5所示,在基础保护剂中加入茯苓多糖对复合乳酸菌的冷冻干燥保护效果优于未添加茯苓多糖的。其中,添加PCP-1作为复配保护剂的冻干乳酸菌粉的活菌数为(9.43±0.04) lg CFU/mL,存活率较只添加基础保护剂的复合乳酸菌粉增加了20.42%,较在基础保护剂中添加PCP的复合乳酸菌粉增加了11.29%。PCP-1中含有羟基,羟基可与蛋白质的极性集团结合形成氢键,代替蛋白质表面的水分子,使蛋白质表面形成一层假定的水化膜,避免氢键的联结位置暴露在周围环境中,防止蛋白质因冻干而变性,使其在低温冷冻和干燥失水的情况下仍保持结构的稳定性[29],PCP-1可能以此来提高复合乳酸菌的冻干存活率。
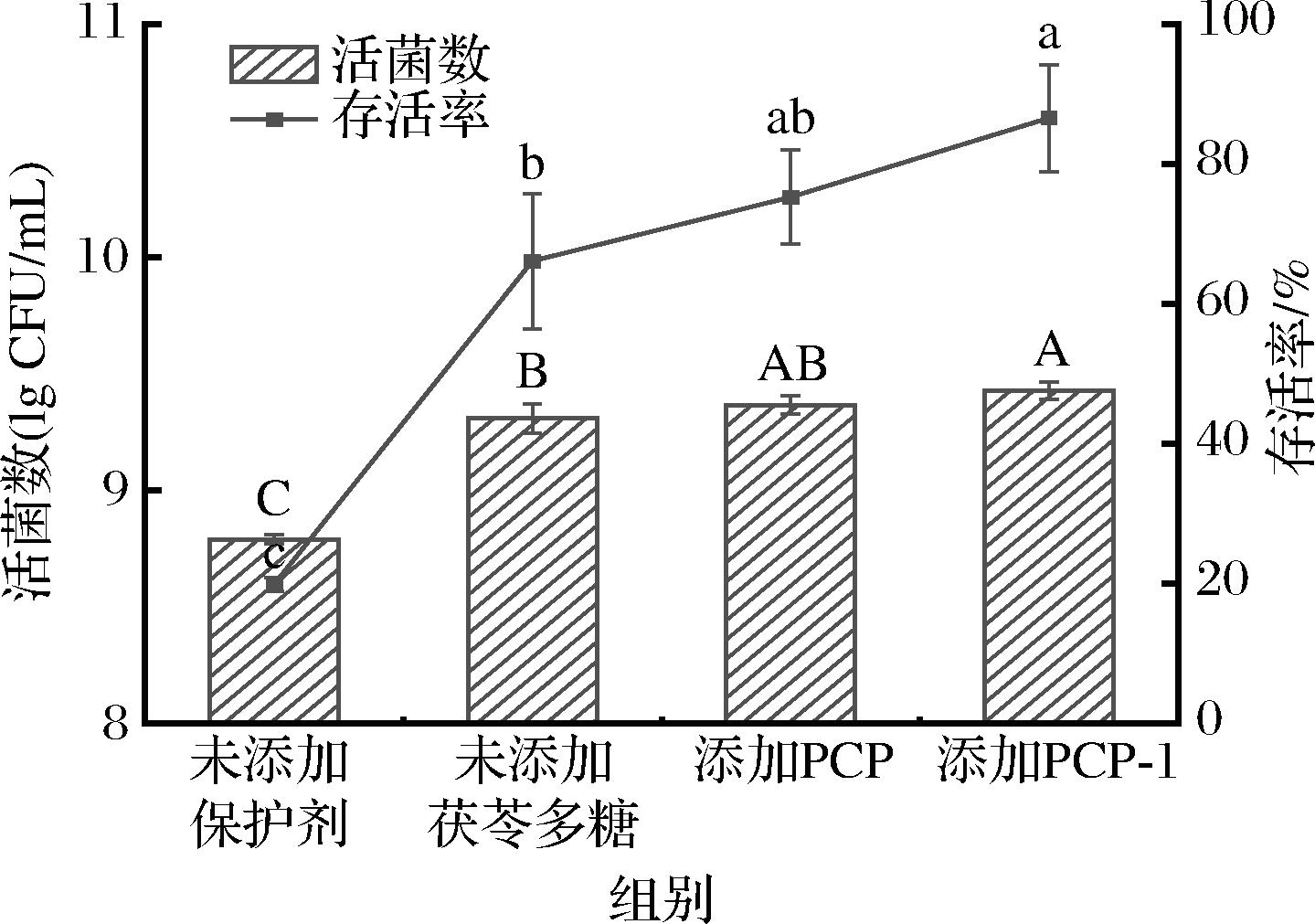
图5 不同保护剂对复合乳酸菌活菌数及冷冻干燥存活率的影响
Fig.5 Effects of different protective agents on the number of viable bacteria and the survival rate of freeze-drying of compound lactic acid bacteria
注:不同字母表示组间有显著差异(P<0.05),相同字母表示组间没有显著差异(下同)。
2.4 PCP-1对复合乳酸菌冷冻干燥保护作用机理
2.4.1 PCP-1对复合乳酸菌粉表观形态的影响
冷冻干燥制得的复合乳酸菌粉的扫描电子显微照片如图6所示,未添加保护剂(图6-a)的菌粉细胞之间相互堆积,紧密连接,部分细胞出现变形、破裂的现象;添加基础保护剂后(图6-b),保护剂可以覆盖保护分布在整个基质中的乳酸菌细胞;在基础保护剂中添加PCP后(图6-c),菌粉表面变得致密,但有碎片情况存在;在基础保护剂中添加PCP-1后(图6-d),乳酸菌粉具有更加均匀、光滑的表面,结构也更加致密,出现这种结果的原因可能是PCP-1能够更好地抑制冻干过程中冰晶的生成,降低菌粉表面的孔隙率,提高对复合乳酸菌的冻干保护效果[12]。

a-未添加保护剂菌粉;b-未添加茯苓多糖菌粉;c-添加PCP菌粉;d-添加PCP-1菌粉
图6 添加不同保护剂菌粉的扫描电镜图
Fig.6 Scanning electron microscopy images of bacterial powder with different protective agents
2.4.2 PCP-1对复合乳酸菌冷冻干燥关键酶活力的影响
ATP酶广泛分布于细胞膜系统,其活力对维持细胞正常生理功能至关重要[30]。乳酸脱氢酶(lactic dehydrogenase,LDH)是乳酸菌代谢的关键酶,可催化丙酮酸还原为乳酸,其活力反映了菌株的产酸能力[31]。丙酮酸激酶(pyruvate kinase,PK)是EMP代谢途径中的关键酶之一,其活力大小与乳酸菌的糖代谢速率有关[26]。PCP-1对复合乳酸菌的冷冻干燥关键酶活力如图7所示,在基础保护剂中加入PCP-1后,Na+-K+-ATP酶、Mg2+-ATP酶、Ca2+-ATP酶、LDH和PK的活力分别为(1.46±0.09)、(1.64±0.19)、(1.01±0.05)、(36.69±0.08)、(46.60±8.77) U/mg prot,其中Na+-K+-ATP酶和LDH较添加PCP冻干后的复合乳酸菌酶活力显著提高(P<0.05),分别增加了0.66、1.46 U/mg prot;但对PK活力影响不大,无显著差异(P>0.05)。

a-ATP酶活力;b-乳酸脱氢酶活力;c-丙酮酸激酶活力
图7 不同保护剂对复合乳酸菌ATP酶、乳酸脱氢酶和丙酮酸激酶活力的影响
Fig.7 Effects of different protectants on the activities of ATPase,LDH,and PK in compound lactic acid bacteria
2.4.3 PCP-1对细胞膜完整性的影响
细胞膜的完整性与细胞活动直接相关,如果其完整性被破坏,细胞的生理功能将不可避免地受到影响[32]。本研究中使用PI和FDA两种荧光染料评估细胞膜完整性的损伤程度,红色荧光代表细胞膜受损,绿色荧光则表示细胞膜完整。图8显示了加入不同保护剂冷冻干燥后的复合乳酸菌经PI和FDA双重染色后的荧光图像,在基础保护剂中添加PCP-1相较于添加PCP可以更大程度上保持细胞膜的完整性,提高复合乳酸菌的冷冻干燥存活率。
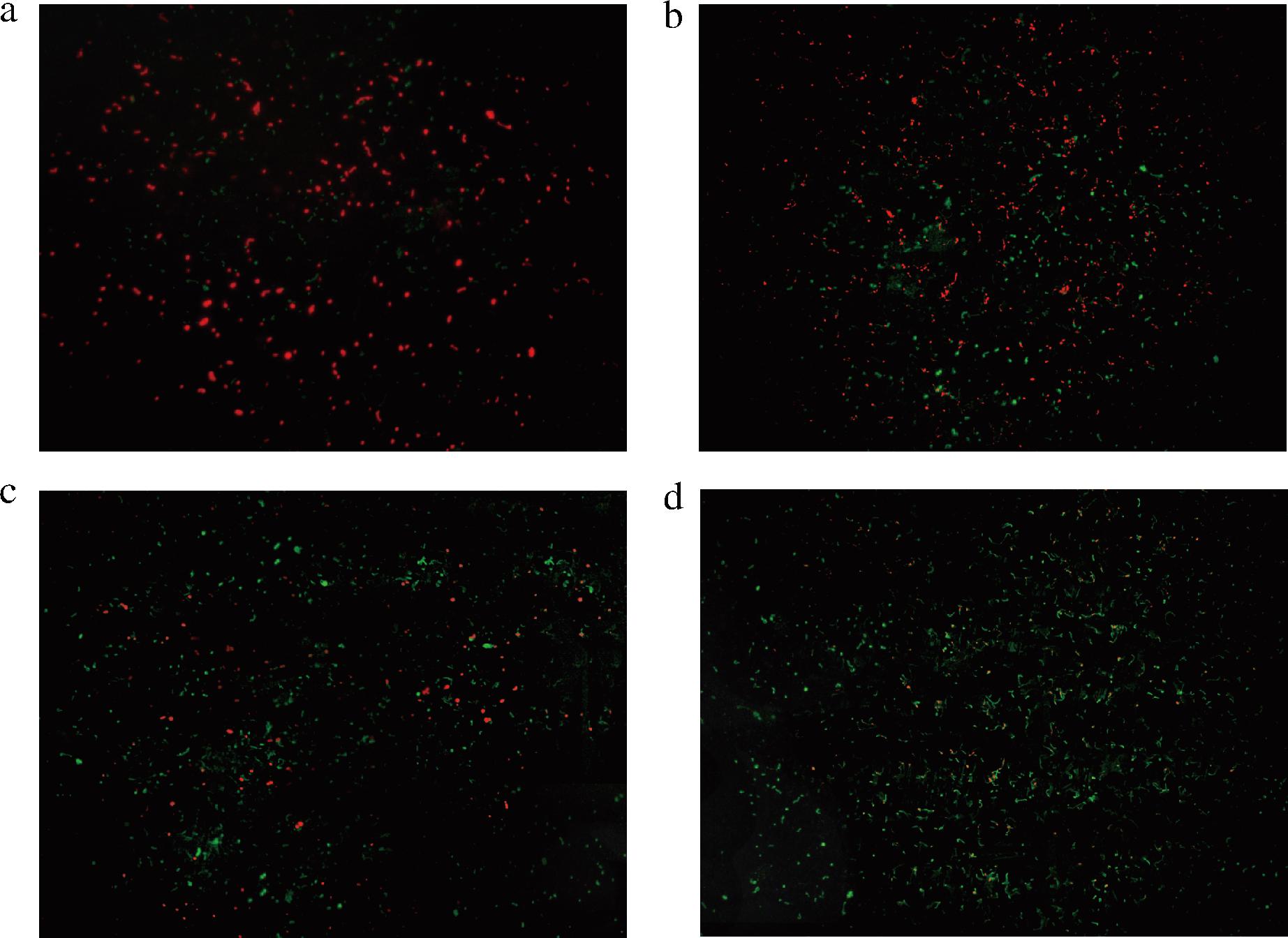
a-未添加保护剂菌粉;b-未添加茯苓多糖菌粉;c-添加PCP菌粉;d-添加PCP-1菌粉
图8 不同保护剂对复合乳酸菌细胞膜完整性的影响
Fig.8 Effects of different protective agents on cell membrane integrity of compound lactic acid bacteria
2.5 相关性分析
采用R 2.15.3软件进一步确定复合乳酸菌在添加PCP-1作为复配保护剂冷冻干燥后的存活率、活菌数与关键酶活力之间的相关性关系(图9)。添加PCP-1作为复配保护剂进行冷冻干燥后的复合乳酸菌的存活率与细胞中Na+-K+-ATP酶、Mg2+-ATP酶、Ca2+-ATP酶和乳酸脱氢酶活力呈显著的正相关关系,即复合乳酸菌在冷冻干燥后细胞的存活率越高,胞内的Na+-K+-ATP酶、Mg2+-ATP酶、Ca2+-ATP酶和乳酸脱氢酶活力损失越少。
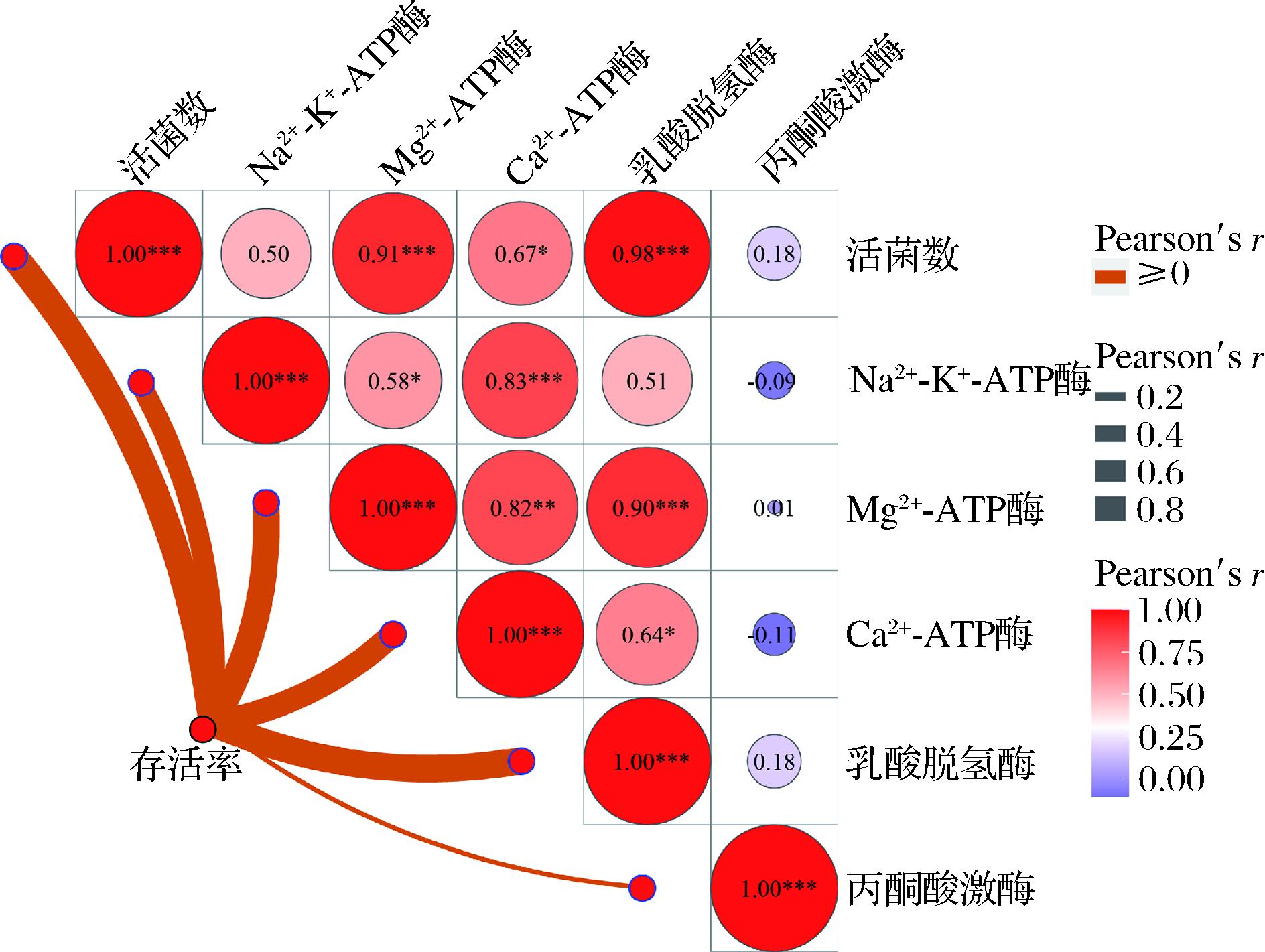
图9 相关性分析结果
Fig.9 Results of correlation analysis
注:*表示在P<0.05水平上显著,**、***表示在P<0.01水平上极显著。
3 结论
添加PCP-1作为复合乳酸菌冷冻干燥的复配保护剂,可使复合乳酸菌的冻干存活率提高,活菌数增加,菌粉表面更加致密,Na+-K+-ATP酶和LDH的活力显著增强,细胞膜的完整性得到较好的保持。PCP-1可能是通过羟基的存在形成氢键使蛋白质表面形成一层假定的水化膜,维持蛋白质结构的稳定性来降低复合乳酸菌的冻干损伤。因此,PCP-1可作为一种新的冷冻保护剂用于复合乳酸菌的冷冻干燥,下一步可从PCP-1对贮藏期间复合乳酸菌的稳定性及茯苓多糖复合乳酸菌粉的生物学功能性进行深入探索。
[1] SWANSON K S,GIBSON G R,HUTKINS R,et al.The international scientific association for probiotics and prebiotics (ISAPP) consensus statement on the definition and scope of synbiotics[J].Nature Reviews Gastroenterology &Hepatology,2020,17:687-701.
[2] KANDIL S,EL SODA M.Influence of freezing and freeze drying on intracellular enzymatic activity and autolytic properties of some lactic acid bacterial strains[J].Advances in Microbiology,2015,5(6):371-382.
[3] TYMCZYSZYN E E,SOSA N,GERBINO E,et al.Effect of physical properties on the stability of Lactobacillus bulgaricus in a freeze-dried galacto-oligosaccharides matrix[J].International Journal of Food Microbiology,2012,155(3):217-221.
[4] DA SILVA GUEDES J,PIMENTEL T C,DINIZ-SILVA H T,et al.Protective effects of β-glucan extracted from spent brewer yeast during freeze-drying,storage and exposure to simulated gastrointestinal conditions of probiotic Lactobacilli[J].LWT,2019,116:108496.
[5] ÜÇOK G,SERT D.Trial productions of freeze-dried Lactobacillus plantarum culture using dairy by-products as cryoprotectants:Viability and characterization of cultures[J].Food Bioscience,2022,46:101541.
[6] 寇佳祥,乔建军,朱宏吉,等.提高乳杆菌属冷冻干燥存活率研究进展[J].食品与发酵工业,2022,48(13):296-303.KOU J X,QIAO J J,ZHU H J,et al.Research progress on improving the survival rate of Lactobacillus in freeze-drying[J].Food and Fermentation Industries,2022,48(13):296-303.
[7] 于小青.植物乳杆菌在冷冻干燥过程中生理损伤及保护策略的研究[D].上海:上海理工大学,2019.YU X Q.Study on physiological damage and protection strategy of Lactobacillus plantarum during freeze-drying[D].Shanghai:University of Shanghai for Science &Technology,2019.
[8] 于焕.益生菌发酵工艺、冻干保护剂优化与活性研究[D].沈阳:辽宁大学,2017.YU H.Optimization of probiotic fermentation technology,freeze-drying protector and activity study[D].Shenyang:Liaoning University,2017.
[9] WANG W L,TAN J Q,NIMA L M,et al.Polysaccharides from fungi:A review on their extraction,purification,structural features,and biological activities[J].Food Chemistry:X,2022,15:100414.
[10] 许艺娴,周禹慧,马小清,等.提取方法对真菌多糖得率及结构特征影响研究进展[J].食品与发酵工业,2022,48(5):289-301.XU Y X,ZHOU Y H,MA X Q,et al.Research progress in the effect of extraction methods on the yield and structural characteristics of fungal polysaccharides[J].Food and Fermentation Industries,2022,48(5):289-301.
[11] LI H P,ZHAO P,ZHANG S H,et al.Protective effect of polysaccharides from Pholiota nameko on Lactobacillus casei ATCC 334 subjected to freeze-drying[J].LWT,2019,115:108463.
[12] 李兵兵,龙慧,伍恩慧,等.银耳多糖对冻干植物乳杆菌细胞膜及糖代谢酶的保护作用[J].现代食品科技,2021,37(11):85-95.LI B B,LONG H,WU E H,et al.Protective effects of polysaccharides extracted from Tremella on cell membrane and sugar metabolism enzymes of freeze-dried Lactobacillus plantarum[J].Modern Food Science and Technology,2021,37(11):85-95.
[13] 刘飞,张艳艳,张金华,等.普鲁兰多糖作为冻干保护剂对乳酸菌的影响[J].药物生物技术,2020,27(6):501-505.LIU F,ZHANG Y Y,ZHANG J H,et al.Effects of pullulan as cryoprotectant on lactic acid bacteria[J].Pharmaceutical Biotechnology,2020,27(6):501-505.
[14] XU T R,ZHANG H M,WANG S G,et al.A review on the advances in the extraction methods and structure elucidation of Poria cocos polysaccharide and its pharmacological activities and drug carrier applications[J].International Journal of Biological Macromolecules,2022,217:536-551.
[15] 孙明杰,张越,姚亮,等.茯苓多糖的分离纯化、组成及其抗氧化活性研究[J].安徽中医药大学学报,2022,41(1):86-91.SUN M J,ZHANG Y,YAO L,et al.Isolation,purification,composition and antioxidant activity of Poria cocos polysaccharides[J].Journal of Anhui University of Chinese Medicine,2022,41(1):86-91.
[16] CHENG Y,XIE Y,GE J C,et al.Structural characterization and hepatoprotective activity of a galactoglucan from Poria cocos[J].Carbohydrate Polymers,2021,263:117979.
[17] ZHANG W X,CHEN L,LI P,et al.Antidepressant and immunosuppressive activities of two polysaccharides from Poria cocos (Schw.) Wolf[J].International Journal of Biological Macromolecules,2018,120:1696-1704.
[18] 陈树俊,崔云.甘薯渣多糖提取、分离纯化及抗氧化活性研究[J].中国粮油学报,2020,35(10):56-62.CHEN S J,CUI Y.Extraction,purification and antioxidant activity of polysaccharides from sweet potato residue[J].Journal of the Chinese Cereals and Oils Association,2020,35(10):56-62.
[19] WANG Y L,HAN J,YUE Y,et al.Purification,structure identification and immune activity of a neutral polysaccharide from Cynanchum Auriculatum[J].International Journal of Biological Macromolecules,2023,237:124142.
[20] FAN H T,SUN M,LI J,et al.Structure characterization and immunomodulatory activity of a polysaccharide from Saposhnikoviae Radix[J].International Journal of Biological Macromolecules,2023,233:123502.
[21] LIU G R,KAMILIJIANG M,ABUDUWAILI A,et al.Isolation,structure elucidation,and biological activity of polysaccharides from Saussurea involucrata[J].International Journal of Biological Macromolecules,2022,222:154-166.
[22] 叶美芝,伍紫仪,吴金松,等.山药皮多糖的分离纯化、结构特征及体外抗氧化活性研究[J].食品工业科技,2023,44(19):78-85.YE M Z,WU Z Y,WU J S,et al.Study on separation,purification,structural characteristics and in vitro antioxidant activity of polysaccharides from Chinese yam peel[J].Science and Technology of Food Industry,2023,44(19):78-85.
[23] MA R J,CAO T Q,AN H X,et al.Extraction,purification,structure,and antioxidant activity of polysaccharide from Rhodiola rosea[J].Journal of Molecular Structure,2023,1283:135310.
[24] 李凤娟.植物乳杆菌WL-R-02冻干保护剂配方的优化[J].广东饲料,2022,31(4):34-37.LI F J.Optimization of formula of freeze-drying protective agent for Lactobacillus plantarum WL-R-02[J].Guangdong Feed,2022,31(4):34-37.
[25] KHODAEI D,HAMIDI-ESFAHANI Z,LACROIX M.Gelatin and low methoxyl pectin films containing probiotics:Film characterization and cell viability[J].Food Bioscience,2020,36(8):100660.
[26] WANG G Q,PU J,DONG C,et al.Effect of oleic acid on the viability of different freeze-dried Lactiplantibacillus plantarum strains[J].Journal of Dairy Science,2021,104(11):11457-11465.
[27] BIAN C,XIE N N,CHEN F S.Preparation of bioactive water-soluble pachyman hydrolyzed from sclerotial polysaccharides of Poria cocos by hydrolase[J].Polymer Journal,2010,42(3):256-260.
[28] 任艳,陈明,邵玉宇,等.真空冷冻干燥过程中保护剂对乳酸菌的保护机理[J].中国乳品工业,2013,41(9):41-45.REN Y,CHEN M,SHAO Y Y,et al.Influence of protectants on the survival of lactic acid bacteria during the vacuum freeze-drying process[J].China Dairy Industry,2013,41(9):41-45.
[29] 王岩,冯万宇,刘宇,等.保护剂在益生菌保藏过程中的应用[J].中国草食动物科学,2015,35(3):52-54;67.WANG Y,FENG W Y,LIU Y,et al.Application of protector in the preservation of probiotics[J].China Herbivore Science,2015,35(3):52-54;67.
[30] LI B K,TIAN F W,LIU X M,et al.Effects of cryoprotectants on viability of Lactobacillus reuteri CICC6226[J].Applied Microbiology and Biotechnology,2011,92(3):609-616.
[31] CHENG Z Y,YAN X,WU J Y,et al.Effects of freeze drying in complex lyoprotectants on the survival,and membrane fatty acid composition of Lactobacillus plantarum L1 and Lactobacillus fermentum L2[J].Cryobiology,2022,105:1-9.
[32] CHEN B Y,WANG X Y,LI P Z,et al.Exploring the protective effects of freeze-dried Lactobacillus rhamnosus under optimized cryoprotectants formulation[J].LWT,2023,173:114295.