蜡样芽孢杆菌(Bacillus cereus)是革兰氏阳性菌,广泛分布于自然界,是常见的食源性致病菌,能够通过粉尘、地面、器具表面等途径污染食物;同时,内生孢子的形成促使蜡样芽胞杆菌在干旱、高温、辐射及低pH值等不利环境下产生抗性[1],难以灭除。作为食源性疾病的病原体,蜡样芽胞杆菌能够引发呕吐或腹泻等症状,其致病性可能与大量分泌的细胞毒素有关[2],如强效肽毒素脑苷[3]引起的呕吐症状以及肠毒素引发的腹泻综合症,包括溶血素BL、非溶血性肠毒素和细胞毒素K[4]。香港《即食食品微生物含量指引》是我国出口腐乳的重要标准,规定了蜡样芽胞杆菌的可接受范围在105 CFU/g以内,而蜡样芽胞杆菌超标造成了多起商品召回事件,在一定程度上影响了腐乳的出口。控制腐乳中的蜡样芽胞杆菌数量具有重要的意义。
香芹酚(carvacrol,CL)是一种天然存在的酚类单萜化合物和半胱氨酸衍生物,是天然活性抑菌物质百里香精油和牛至精油的主要成分。GB 2760—2014《食品安全国家标准 食品添加剂使用标准》允许香芹酚作为香辛料使用。香芹酚具有广泛的生物活性,如抗氧化、防腐、免疫调节、抗菌活性等[5],不仅对真菌有良好的抗性[6],对大肠杆菌、沙门氏菌和蜡样芽孢杆菌等食源性病原体也表现出较强的抑菌活性[7]。香芹酚具有调味和抗菌特性,常在食品工业中用作天然食品防腐剂[8],但香芹酚从未应用于腐乳生产工业,发酵体系中高含量的盐分及酒精能够影响抑菌剂发挥功效,香芹酚的抑菌作用及其在发酵环境下对蜡样芽胞杆菌的控制效果值得探索。
1 材料和方法
1.1 材料与试剂
蜡样芽胞杆菌(CMCC 63303)、LB培养基、TSA培养基、PCA培养基、MYP培养基、多粘菌素B等,广东环凯微生物技术有限公司;蜡样芽胞杆菌(IAM 12605),分离自某腐乳厂腐乳样品;邻硝基苯-β-D-吡喃半乳糖苷(2-nitrophenyl β-D-galactopyranoside,ONPG)、香芹酚(99%),麦克林生化科技有限公司;2.5%(体积分数)戊二醛、PBS磷酸盐缓冲液,福州飞净生物科技有限公司;碱性磷酸酶(alkaline phosphatase,AKP)试剂盒,南京建成有限公司。
1.2 仪器与设备
721 N紫外分光光度计,上海仪电分析仪器有限公司;Regulus 8100型扫描电子显微镜,日立公司;LS-100LD型高温高压灭菌锅,江阴滨江医疗设备有限公司;DHP-600AB培养箱,天津市赛得利实验分析仪器制造厂;SW-CJ-2D型超净工作台,天津赛得利斯实验分析仪器制造厂;En Spire酶标仪,美国Perkinelmer公司。
1.3 实验方法
1.3.1 最小抑菌浓度(minimum inhibitory concentration,MIC)和最小杀菌浓度(minimum bactericidal concentration,MBC)测定
通过连续二倍稀释法[9]测定MIC和MBC。将香芹酚与细菌悬浮液(约106~108 CFU/mL)混合得到终质量浓度为5、2.5、1.25、0.625 0、0.312 5、0.156 25 mg/mL的培养体系,无菌液组为阳性对照,无香芹酚组为阴性对照。将培养体系转移到37 ℃下培养24 h,观察到清晰无浑浊的组对应浓度为MIC。同时,分别取100 μL无浑浊组的菌悬液涂布于LB琼脂平板,37 ℃培养24 h,无微生物生长组的最小浓度为MBC。
1.3.2 抑菌生长曲线及抑菌率测定
参考NING等[10]的方法,分别将CMCC 63303和IAM 12605培养至对数期,收集菌体制备为106 CFU/mL的菌悬液,加入不同浓度的香芹酚溶液,使其最终浓度为1/2 MIC和MIC,对照组加入等体积的95%(体积分数)乙醇的LB液体培养基,置于37 ℃培养箱培养,分别在0、2、4、8、12、24 h取样,测定OD600 nm值,绘制生长曲线。
通过测定OD600 nm值来计算抑菌稳定性。根据LUO等[11]的方法,以含有不同浓度香芹酚的培养体系为参比溶液,测定24 h后的OD600 nm值,根据公式(1)计算香芹酚对蜡样芽胞杆菌的抑菌率:
(1)
[:A0,n表示对照组初始OD值;At,n表示对照组在某时间的OD值;A0,s表示样品的初始OD值;At,s表示样品在某时间的OD值。
1.3.3 孢子悬液的制备
根据GUAN等[12]的方法制备孢子悬浮液。向TSA中加入0.05 g/mL MnSO4·H2O诱导芽孢生长,取100 μL培养至稳定期的蜡样芽胞杆菌溶液在TSA培养基中涂匀。样品放置于37 ℃下孵育7 d。通过孔雀石绿染料对芽孢染色,于显微镜下观察孢子形成情况,直到85%的细胞孢子化。向TSA平板上加入1~2 mL PBS溶液(0.01 mol/L,pH 7.0),并用无菌弯曲玻璃棒刮取孢子,收集5个平板上的孢子悬浮液合并至离心管中,80 ℃水浴10 min消除剩余的营养细胞。离心收集孢子沉淀,洗涤3次并重悬于PBS溶液中,转入4 ℃冰箱待用。
1.3.4 香芹酚对蜡样芽孢杆菌孢子萌发的影响
参考WANG等[13]的方法测定蜡样芽胞杆菌萌发率。调节孢子悬浮液的浓度为OD600 nm=0.1,向孢子悬浮液中加入香芹酚溶液使其最终浓度为1/2 MIC和MIC,不添加香芹酚的为对照组,37 ℃下孵育24 h。菌落计数法测定香芹酚处理后孢子的数量,计算孢子萌发率。如公式(2)所示:
萌发率![]()
(2)
[:Ax为实验组孢子数量;A0为对照组孢子数量。
1.3.5 细胞内容物的泄露
通过测定260 nm和280 nm处吸光度的变化来反映蜡样芽孢杆菌细胞内膜的破坏程度。参考KIM等[14]的方法制备2种蜡样芽孢杆菌的菌悬液,分别加入不同浓度的香芹酚使其最终浓度为MIC、1/2 MIC,对照组不加香芹酚,分别于1、2、3、4、6、8 h取样,离心后取上清液测定260 nm和280 nm处的吸收值。
1.3.6 半乳糖苷酶
半乳糖苷酶是一种细胞内酶,其泄露到细胞外可能与细胞外膜被破坏相关。参考ZHANG等[15]的方法,离心收集培养至稳定期的菌液,用PBS溶液洗涤2次并重悬至106 CFU/mL。菌悬液与ONPG混合,加入不同浓度的香芹酚溶液至1/2 MIC、MIC,对照组加入等体积的含95%乙醇的LB液体培养基。置于37 ℃下孵育,分别在0、30、60、120、240、360 min取样,测定OD420 nm值来反映溶液中β-D-半乳糖苷酶的含量随时间的变化情况。
1.3.7 碱性磷酸酶活力
参考DENG等[16]的方法收集培养至对数期的菌悬液,于8 000 r/min、4 ℃下离心5 min,用PBS溶液清洗2次后重悬。向悬浮液中添加香芹酚至1/2 MIC、MIC浓度,对照组不含香芹酚。将培养体系转移至37 ℃的培养箱中,分别于1、2、3、4、6、8 h取样,4 ℃下5 000 r/min离心10 min,取上清液,按照AKP试剂盒操作步骤测定AKP活力。
1.3.8 香芹酚对蜡样芽孢杆菌细胞形态的影响
参考ZHANG等[15]和张卯等[17]的方法,收集对数期的蜡样芽胞杆菌细胞(约106 CFU/mL),离心去除上清液,用PBS溶液清洗2遍,用1 mL含香芹酚的PBS溶液重悬菌体,不含香芹酚的为对照组,置于37 ℃下孵育10 h,离心后收集细菌,用PBS溶液清洗后,加入1 mL 2.5%(体积分数)戊二醛于4 ℃固定过夜。配制10%、30%、50%、70%、90%、100%(体积分数)梯度乙醇溶液,取固定后样品离心去除戊二醛,PBS溶液清洗后依次加入1 mL乙醇溶液脱水处理10 min,最后重悬于100%乙醇溶液中。扫描电子显微镜(scanning electron microscopy,SEM)载物台上贴导电胶,取5 μL菌液于盖玻片上晾干贴于导电胶上,喷金处理后观察细胞形态的变化。
1.3.9 香芹酚在腐乳后发酵中的应用
后发酵过程是腐乳风味形成的重要阶段,也是蜡样芽孢杆菌滋生的关键时期(图1)。将毛胚浸入130 g/L盐水制得盐胚,在盐胚的装瓶过程中,实验组添加香芹酚使其最终浓度为MIC,对照组为同批次正常生产的腐乳。从后发酵过程开始至白腐乳成熟的不同时间点取样(0、13、30、60、90 d),测定菌落总数、蜡样芽孢杆菌数及孢子数。
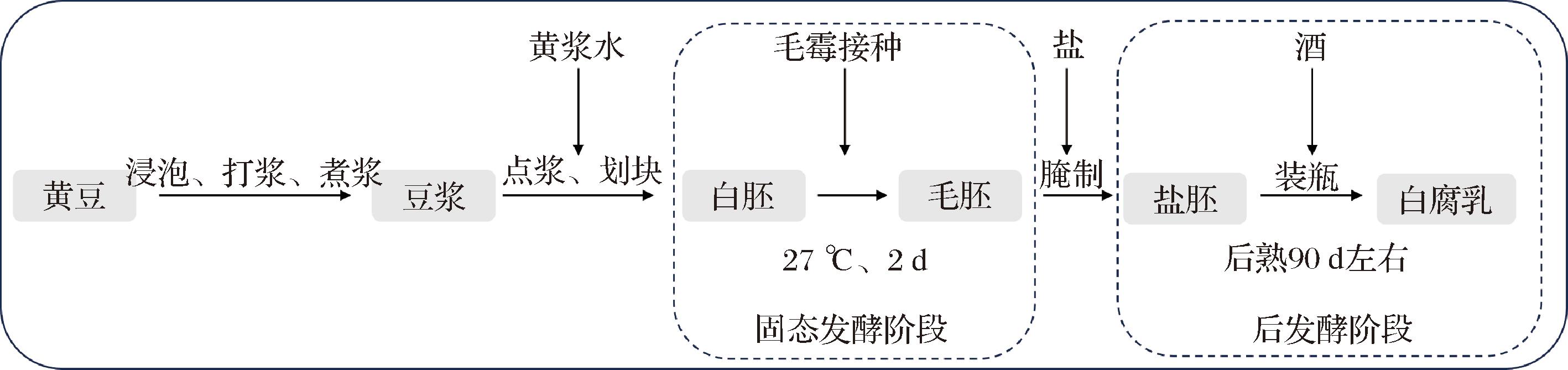
图1 白腐乳生产工艺流程图
Fig.1 Flow chart of white sufu production process
1.4 数据处理
实验重复3次。使用IBM SPSS Statistics 26软件和Origin 2018软件进行数据分析和制图。
2 结果与分析
2.1 MIC和MBC
通过观察实验现象,确定香芹酚对CMCC 63303和IAM 12605的MIC均为0.312 5 mg/mL,MBC为0.625 0 mg/mL。香芹酚的抑菌活性可能与其结构相关。香芹酚本身的羟基对于抗菌活性不是必需的[18],WANG等[19]认为酚羟基和单萜是酚类单萜类物质抗真菌活性的基本结构,而酚羟基的位置影响较小,同时香芹酚的酯类衍生物对植物病原真菌表现出更好的抗菌效果。
2.2 抑菌生长曲线及抑菌率
吸光度值与细菌培养液的浓度有关。如图2所示,CMCC 63303和IAM 12605的活菌浓度值随着时间的延长而增大,在培养8 h后进入稳定期。在1/2 MIC浓度下处理蜡样芽孢杆菌,2个实验组相对于各自的对照组(CK)增长缓慢,表明1/2 MIC浓度的香芹酚在一定程度能够抑制蜡样芽孢杆菌的生长,抑菌率(24 h)分别为72.27%和65.45%。MIC浓度的香芹酚处理24 h,抑菌率分别达到94.06%(图2-A)和94.07%(图2-B),表明2种蜡样芽孢杆菌的生长几乎完全被抑制。抑制率(24 h)情况见表1。
表1 抑菌率(24 h)
Table 1 Bacteriostatic rate (24 h)

菌株1/2MIC/%MIC/%CMCC6330372.2794.06IAM1260565.4594.07

A-CMCC 63303;B-IAM 12605
图2 香芹酚对蜡样芽孢杆菌的抑菌生长曲线
Fig.2 Inhibitory growth curve of CL against B.cereus
2.3 孢子萌发率
蜡样芽孢杆菌会形成孢子来抵御不利环境的影响。休眠孢子对高温、辐射、干燥和其他环境胁迫具有良好的耐受力,其结构中低透性的内膜和蛋白质包衣层能够建立和维持核心的低含水量[20]。但当孢子萌发时会丧失抗性,发芽的孢子和营养细胞一样易被抗生素杀死[21]。与CK组相比,1/2 MIC处理的CMCC 63303和IAM 12605 2种蜡样芽胞杆菌孢子萌发数量分别从8.2 lg CFU/mL下降到7.3 lg CFU/mL、从8.3 lg CFU/mL下降到5.7 lg CFU/mL,萌发率分别为10.5%、0.3%;MIC和2 MIC浓度处理后孢子数量显著下降,孢子萌发率几乎为0,说明MIC浓度已经能够抑制孢子萌发(图3)。综上所述,香芹酚具有良好的抑制孢子萌发的能力。
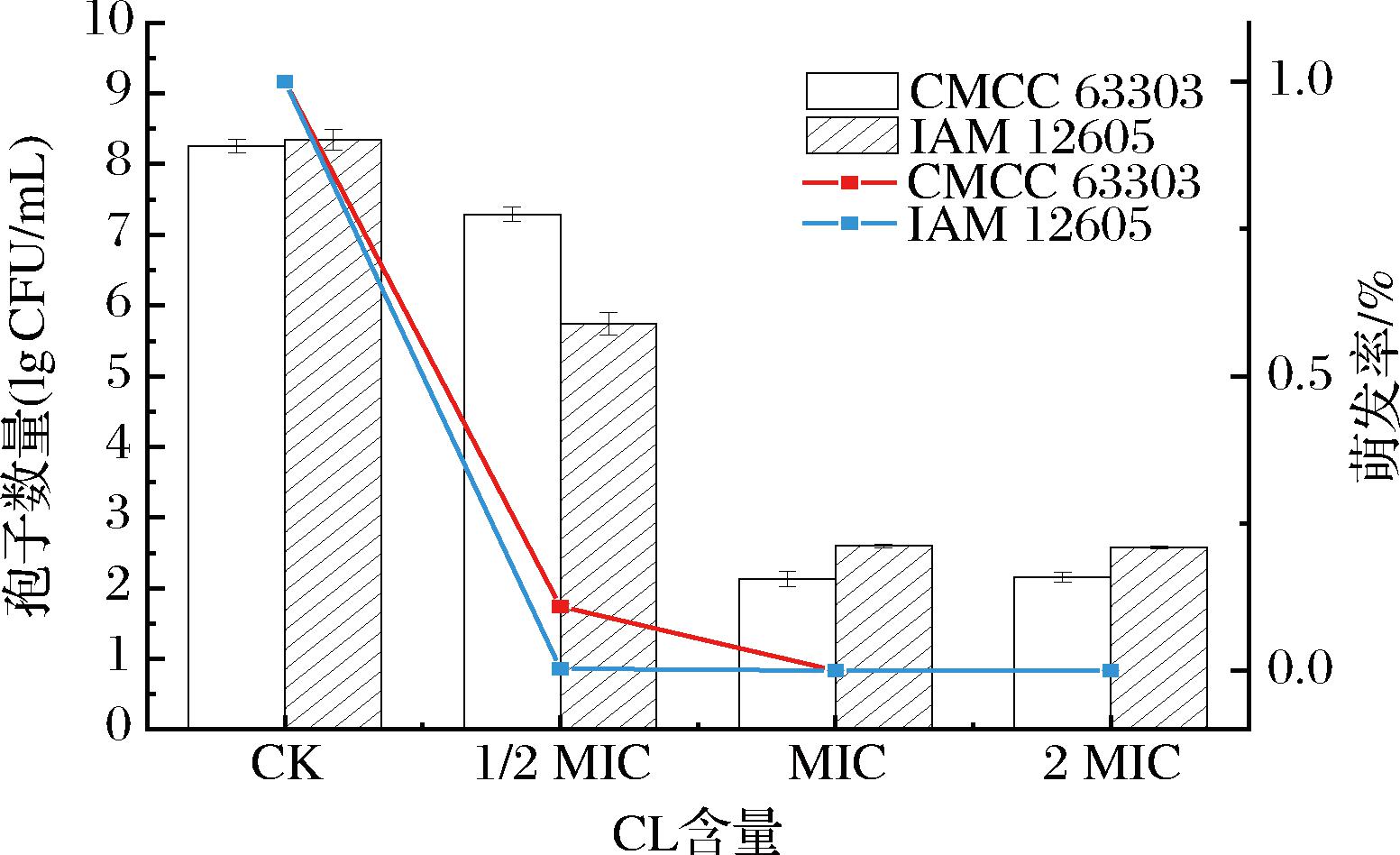
图3 香芹酚对蜡样芽胞杆菌孢子萌发的影响
Fig.3 Effect of CL on spore germination of B.cereus
2.4 细胞内容物泄露
细胞膜能够维持细胞的完整性、稳态和生理功能,在细胞的生存和功能调控中起着至关重要的作用。当细胞膜被破坏时,胞内的核酸和蛋白发生泄漏流出胞外,而核酸中的核酸碱基和蛋白质中的芳香氨基酸在260 nm和280 nm处有强烈吸收,因此,通过测定吸光度的变化来反映细胞膜的完整性。MIC组的吸收值随着香芹酚浓度和处理时间变化而变化。如图4所示,CMCC 63303和IAM 12605在8 h内细胞内容物的泄露情况表现出同样的趋势,处理的第8 h,CMCC 63303的OD260 nm和OD280 nm分别达到最大值0.277、0.272;IAM 12 605的OD260 nm和OD280 nm分别达到最大值0.269和0.226。综上所述,香芹酚能够破坏蜡样芽胞杆菌的细胞膜,使得胞内分子泄露。
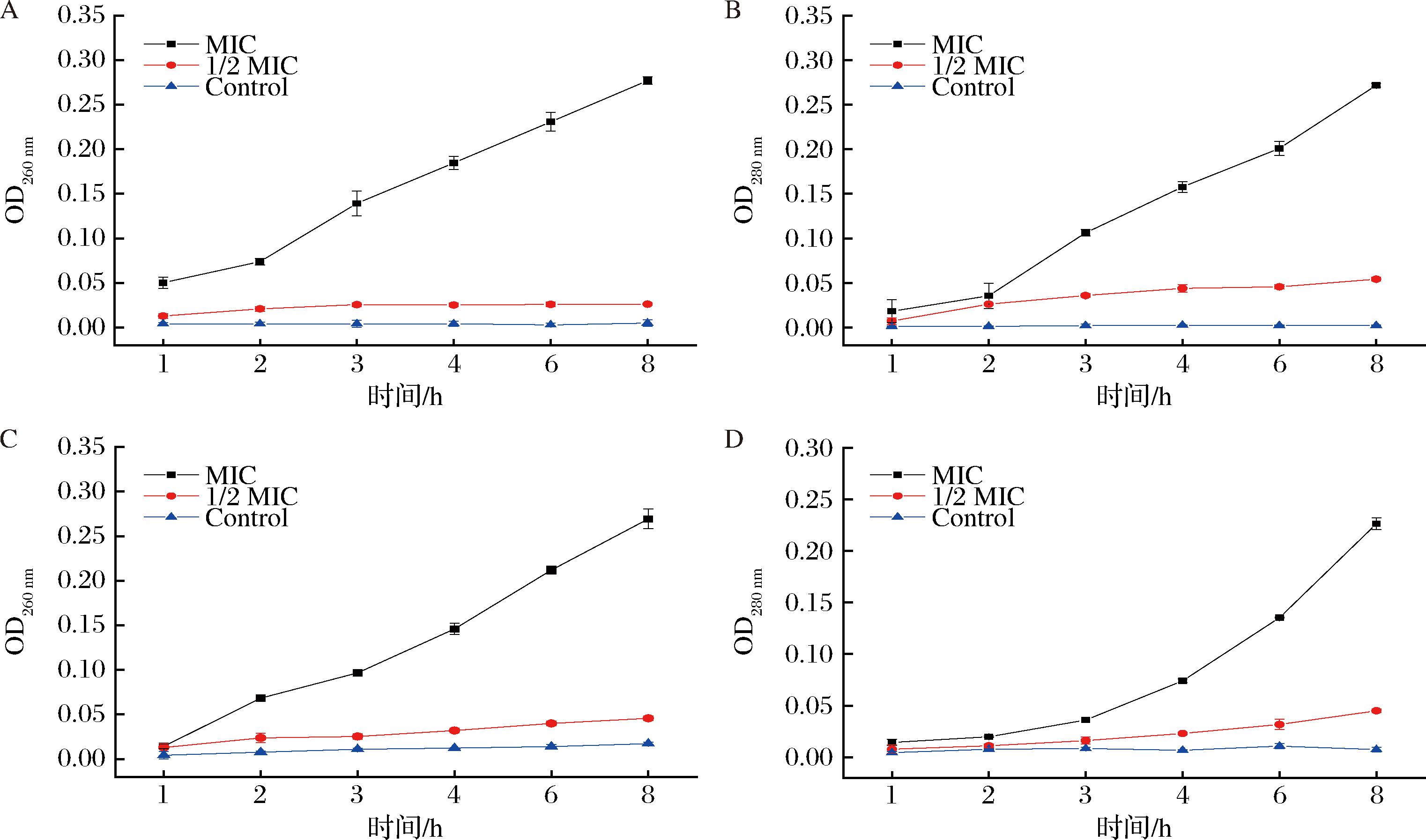
A、B-CMCC 63303;C、D-IAM 12605
图4 上清液中核酸和蛋白的泄露情况
Fig.4 Leakage of nucleic acid and protein in supernatant
2.5 半乳糖苷酶
渗透性探针ONPG是β-半乳糖苷酶的特定显色底物,常被用来检测细胞膜的完整性[22]。正常情况下,β-半乳糖苷酶广泛存在于各种细胞内部,当细胞膜受到损伤,β-半乳糖苷酶会流出胞外催化ONPG生成邻硝基苯酚(2-nitrophenol,ONP),该物质在420 nm处表现出强吸收[23]。如图5所示,MIC浓度和2 MIC浓度处理下的2种蜡样芽胞杆菌细胞膜通透性显著高于对照组,香芹酚处理1 h后OD值达到最高,这表明香芹酚与蜡样芽胞杆菌接触的前1 h对细胞膜有显著的破坏作用,2 MIC浓度处理下细胞膜破坏程度强于MIC组,表明香芹酚对细胞膜完整性的影响与浓度有关。
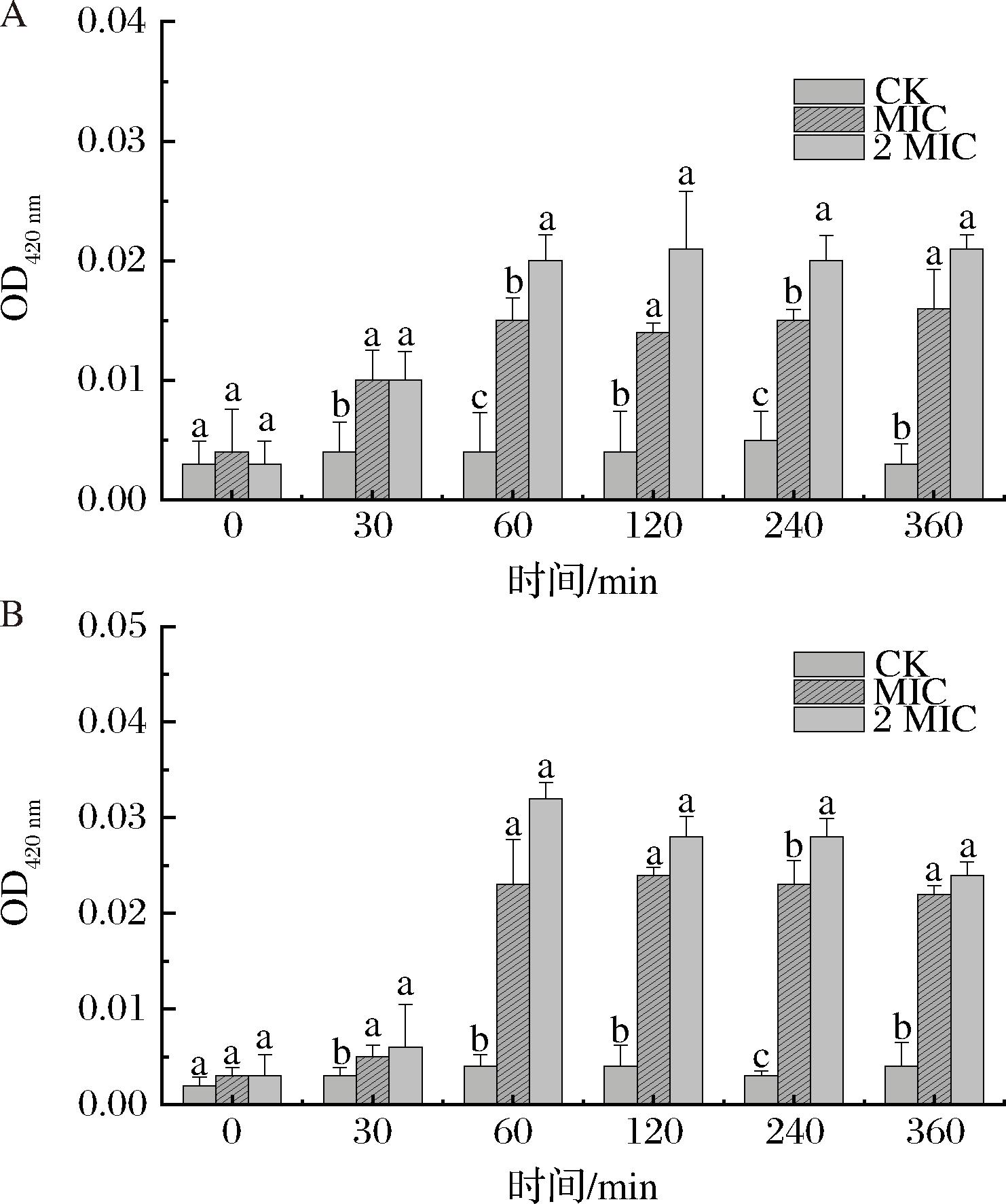
A-CMCC 63303;B-IAM 12605
图5 溶液中ONP含量的变化
Fig.5 Change of ONP content in solution
注:不同小写字母表示具有显著性差异(P<0.05)(下同)。
2.6 碱性磷酸酶活力
AKP存在于细胞膜和细胞壁之间,是一种非特异性磷酸单酯酶,当细胞壁受损时会泄露到胞外[24]。因此,可以通过细胞外AKP活力的变化来反映香芹酚对细胞壁通透性的影响。如图6所示,香芹酚处理后,CMCC 63303和IAM 12605的AKP水平在1 h内显著性增加,MIC组的CMCC 63303在6 h达到最大活力7.245 kU/100 mL,2 MIC组在8 h达到14.269 kU/100 mL。MIC组的IAM 12605在5 h时达到最大活力6.697 kU/100 mL,2 MIC组在8 h达到最大,为12.588 kU/100 mL。综上,香芹酚引起了蜡样芽胞杆菌细胞壁的破损,使其通透性增加,AKP泄露。
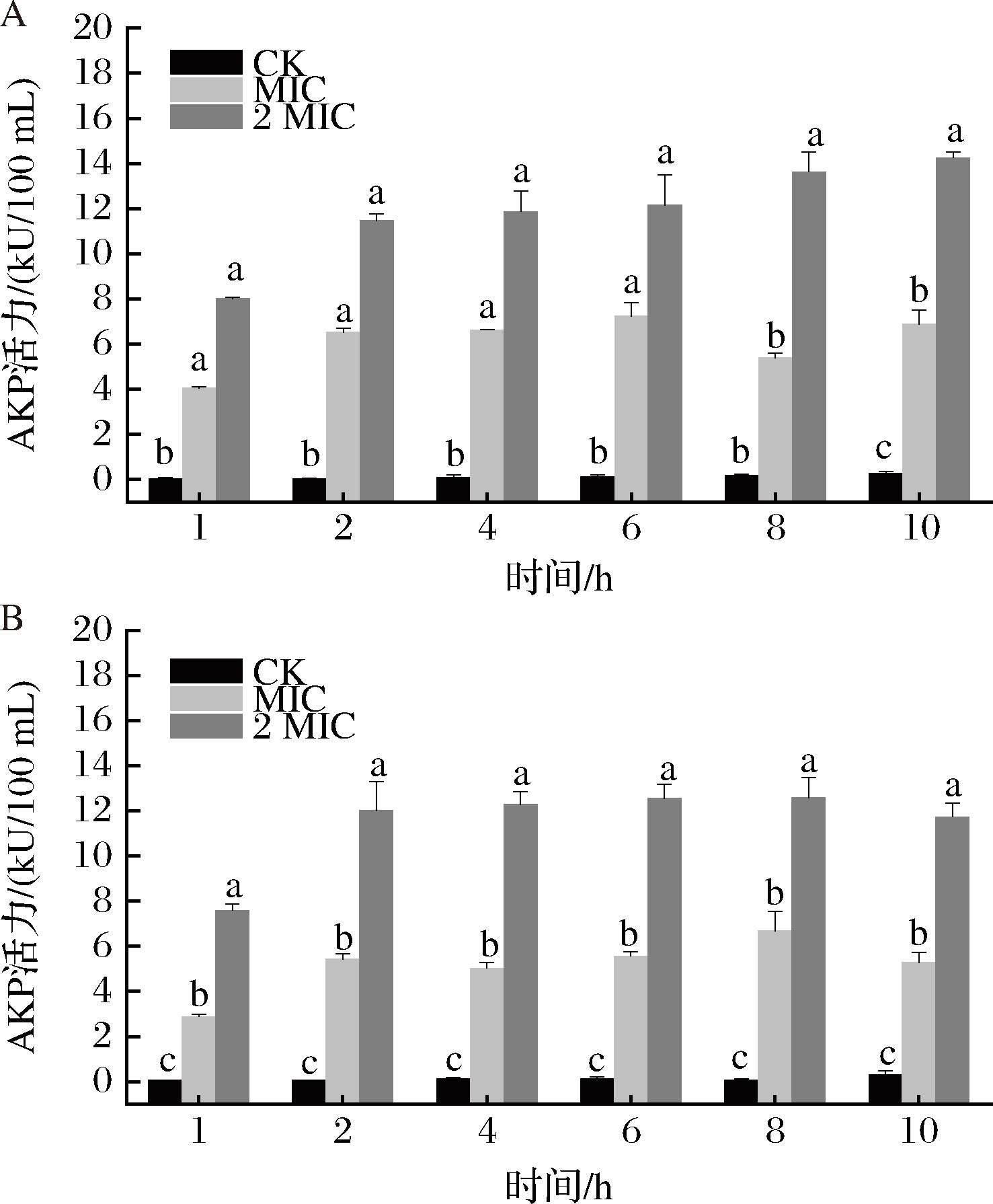
A-CMCC 63303;B-IAM 12605
图6 香芹酚对细胞上清液中AKP活力的影响
Fig.6 Effect of CL on AKP activity in cell supernatanton
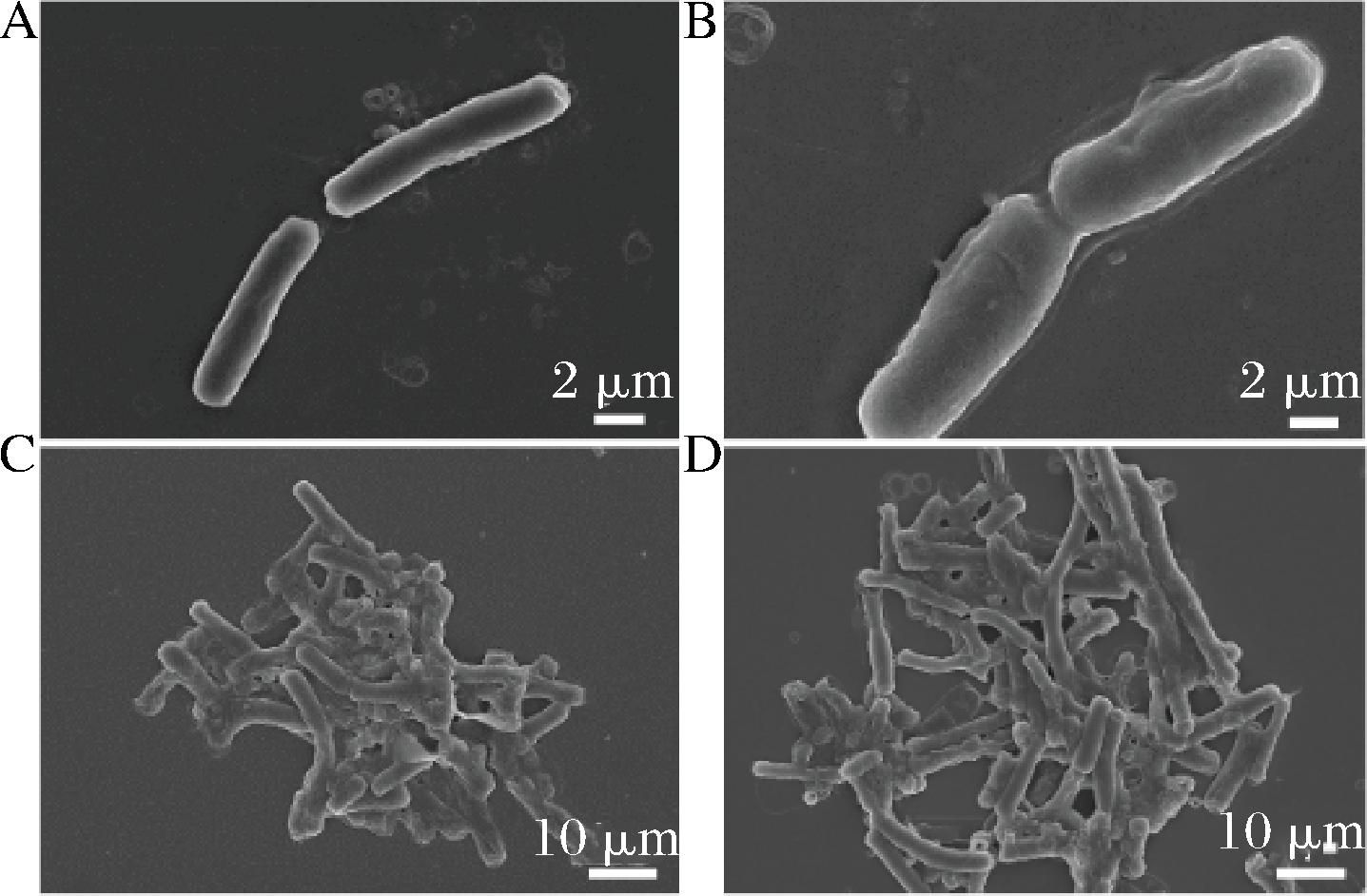
A-CMCC 63303 CK组;B-IAM 12605 CK组;C-CMCC 63303 MIC组;D-IAM 12605 MIC组
图7 蜡样芽胞杆菌的扫描电子显微镜图像
Fig.7 SEM images of B.cereus
2.7 香芹酚对蜡样芽孢杆菌细胞形态的影响
通过SEM观察细胞形态的变化。未处理组(图7-A和图7-B)蜡样芽胞杆菌菌体形态完整,边缘光滑,呈现圆润饱满的杆状;MIC组的蜡样芽孢杆菌(图7-C和图7-D)表现出严重的变形和破裂,细胞出现塌陷皱缩,细胞间相互黏连成片,表明其细胞膜严重受损。CRISTANI等[25]研究了4种单萜(百里酚、香芹酚、对半胱氨酸和γ-萜品烯)的抗菌功效,推测细胞死亡可能是由微生物质膜脂质部分的严重扰动引起的,这与其结构的亲脂性有关。WIJESUNDARA等[26]研究发现香芹酚通过破坏细菌膜和增加通透性表现出对化脓性链球菌的快速杀菌作用。结合细胞膜完整性实验和SEM实验结果分析,香芹酚可能通过破坏蜡样芽胞杆菌细胞结构的完整性,使得细胞渗透性增加,胞内物质流出,进而抑制和杀死细胞。
2.8 香芹酚在腐乳后发酵中的应用
如图8-A所示,菌落总数表现出先降低后稳定的趋势,而香芹酚处理组在90 d内能够显著降低菌落总数,发酵成熟时菌落总数从6.7 lg CFU/mL (0 d)降低至5.3 lg CFU/mL (90 d)。图8-B中处理组蜡样芽胞杆菌的数量在第15天显著下降,说明短期内香芹酚对蜡样芽胞杆菌表现出较强的抑制作用,15 d后基本保持稳定,表明香芹酚能够长期发挥抑菌作用。孢子数量与蜡样芽孢杆菌数量表现出相反的趋势,受到环境胁迫后蜡样芽孢杆菌数量减少,而孢子的数量增加。如图8-C所示,香芹酚处理组的腐乳短期内产生大量孢子,从3.6 lg CFU/mL (0 d)增加到4.1 lg CFU/mL (15 d),最高为4.2 lg CFU/mL (30 d),随后在香芹酚的长期作用下,孢子数量逐渐减低至3.4 lg CFU/mL (90 d),相比于对照组,孢子能够被抑制在较低水平。与对照组相比,成熟腐乳(90 d)的菌落总数、蜡样芽孢杆菌数量、孢子数分别减少了84.62%、47.37%、93.15%。综上,香芹酚对菌落总数、蜡样芽孢杆菌数量和孢子数量有显著的控制效果,有望作为腐乳生产中的抑菌剂使用。
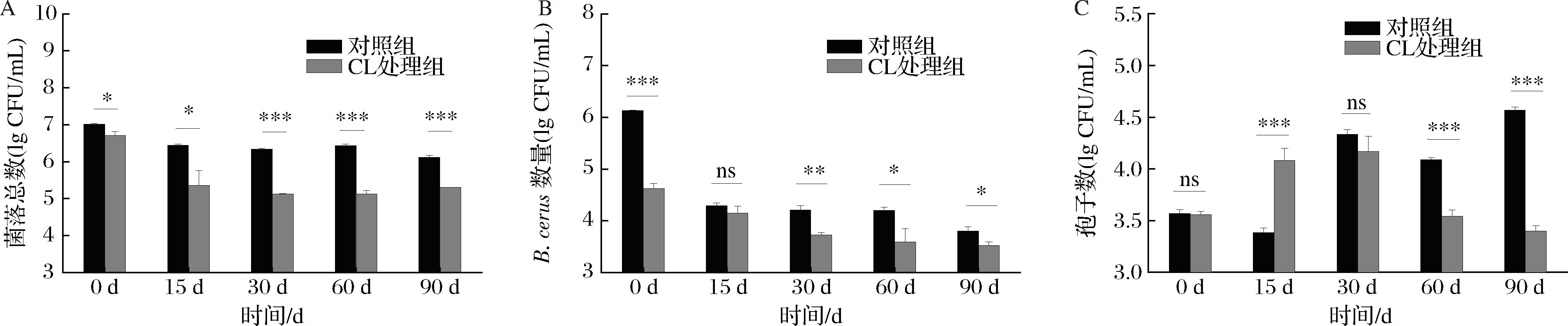
A-菌落总数;B-蜡样芽孢杆菌数量;C-孢子数量
图8 香芹酚对腐乳后发酵过程中菌落总数、蜡样芽孢杆菌数量和孢子数量的影响
Fig.8 Effects of CL on the total number of colonies,number of B.cereus and spores during the post-fermentation process of sufu
注:ns表示无显著性差异(P>0.05);*表示差异显著(P<0.05);**表示差异极显著(P<0.01);***表示差异非常显著(P<0.001)。
3 结论
本文研究了香芹酚对2种蜡样芽胞杆菌的体外抑菌效果和抑菌机理。实验结果显示,香芹酚对CMCC 63303和IAM 12605均有较强的抑菌效果,经过香芹酚处理的蜡样芽胞杆菌细胞膜完整性和通透性显著降低,胞内生物分子泄露,菌体形态发生显著的皱缩和破损,影响到蜡样芽胞杆菌的正常生长代谢,从而达到抑菌效果。同时,香芹酚能够显著抑制孢子的萌发,CMCC 63303和IAM 12605在体外抑制实验中整体趋势相同,这表明香芹酚对CMCC 63303和生产环境中纯化的IAM 12605均有较好的抑制效果,香芹酚有望运用于腐乳行业控制蜡样芽孢杆菌的生长,这对扩大香芹酚在腐乳加工中的应用提供了理论研究基础。
[1] JESSBERGER N,DIETRICH R,GRANUM P E,et al.The Bacillus cereus food infection as multifactorial process[J].Toxins,2020,12(11):701.
[2] MOSTAFA N F,ELKENANY R M,YOUNIS G.Characterization of Bacillus cereus isolated from contaminated foods with sequencing of virulence genes in Egypt[J].Brazilian Journal of Biology,2022,84:e257516.
[3] JOVANOVIC J,ORNELIS V F M,MADDER A,et al.Bacillus cereus food intoxication and toxicoinfection[J].Comprehensive Reviews in Food Science and Food Safety,2021,20(4):3719-3761.
[4] LIU X Y,HU Q,XU F,et al.Characterization of Bacillus cereus in dairy products in China[J].Toxins,2020,12(7):454.
[5] IMRAN M,ASLAM M,ALSAGABY S A,et al.Therapeutic application of carvacrol:A comprehensive review[J].Food Science &Nutrition,2022,10(11):3544-3561.
[6] LAZAREVIC J S,MARKOVIC A,SMELCEROVIC A,et al.Carvacrol derivatives as antifungal agents:Synthesis,antimicrobial activity and in silico studies on carvacryl esters[J].Acta Chimica Slovenica,2022,69(3):571-583.
[7] SHARIFI-RAD M,VARONI E M,IRITI M,et al.Carvacrol and human health:A comprehensive review[J].Phytotherapy Research:PRT,2018,32(9):1675-1687.
[8] M![]() CZKA W,TWARDAWSKA M,GRABARCZYK M,et al.Carvacrol-a natural phenolic compound with antimicrobial properties[J].Antibiotics,2023,12(5):824.
CZKA W,TWARDAWSKA M,GRABARCZYK M,et al.Carvacrol-a natural phenolic compound with antimicrobial properties[J].Antibiotics,2023,12(5):824.
[9] LI Q X,YU S N,HAN J Z,et al.Synergistic antibacterial activity and mechanism of action of nisin/carvacrol combination against Staphylococcus aureus and their application in the infecting pasteurized milk[J].Food Chemistry,2022,380:132009.
[10] NING Y W,MA M G,ZHANG Y J,et al.Antibacterial mechanism of sucrose laurate against Bacillus cereus by attacking multiple targets and its application in milk beverage[J].Food Research International,2022,154:111018.
[11] LUO C Y,ZENG Z L,GONG D M,et al.Evaluation of monolaurin from camphor tree seeds for controlling food spoilage fungi[J].Food Control,2014,46:488-494.
[12] GUAN P,CHANG Y T,LI S,et al.Transcriptome analysis reveals the molecular mechanism of cinnamaldehyde against Bacillus cereus spores in ready-to-eat beef[J].Food Research International,2023,163:112185.
[13] WANG S S,LIU S Y,HAO G,et al.Antimicrobial activity and mechanism of isothiocyanate from Moringa oleifera seeds against Bacillus cereus and Cronobacter sakazakii and its application in goat milk[J].Food Control,2022,139:109067.
[14] KIM S,LEE H,LEE S,et al.Antimicrobial action of oleanolic acid on Listeria monocytogenes,Enterococcus faecium,and Enterococcus faecalis[J].PLoS One,2015,10(3):e0118800.
[15] ZHANG Z H,WANG P P,CHEN M S,et al.Antibacterial activity of two new cassane diterpenoids from Caesaplinia pulcherrima against Bacillus cereus by damage to cell membrane[J].International Journal of Molecular Sciences,2023,24(5):4917.
[16] DENG H T,ZHU J Y,TONG Y Q,et al.Antibacterial characteristics and mechanisms of action of Aronia melanocarpa anthocyanins against Escherichia coli[J].LWT,2021,150:112018.
[17] 张卯,张业辉,李惠,等.香茅醛对金黄色葡萄球菌的抑制作用[J].现代食品科技,2023,39(1):120-126.ZHANG M,ZHANG Y H,LI H,et al.Antibacterial effect of citronellal against Staphylococcus aureus[J].Modern Food Science &Technology,2023,39(1):120-126.
[18] VELDHUIZEN E J A,TJEERDSMA-VAN BOKHOVEN J L M,ZWEIJTZER C,et al.Structural requirements for the antimicrobial activity of carvacrol[J].Journal of Agricultural and Food Chemistry,2006,54(5):1874-1879.
[19] WANG K B,JIANG S S,PU T,et al.Antifungal activity of phenolic monoterpenes and structure-related compounds against plant pathogenic fungi[J].Natural Product Research,2019,33(10):1423-1430.
[20] GAO X W,SWARGE B N,ROSEBOOM W,et al.Time-resolved proteomics of germinating spores of Bacillus cereus[J].International Journal of Molecular Sciences,2022,23(21):13614.
[21] CHRISTIE G,SETLOW P.Bacillus spore germination:Knowns,unknowns and what we need to learn[J].Cellular Signalling,2020,74:109729.
[22] HUANG Z,MANESS P C,BLAKE D M,et al.Bactericidal mode of titanium dioxide photocatalysis[J].Journal of Photochemistry and Photobiology A:Chemistry,2000,130(2-3):163-170.
[23] ZHANG M L,WANG Y L,ZENG G M,et al.Antibacterial activity and mechanism of piperazine polymer[J].Journal of Applied Polymer Science,2021,138(20):50451.
[24] WANG Q,PENG Y,CHAI L N,et al.Antimicrobial effect of sorbic acid-loaded chitosan/tripolyphosphate nanoparticles on Pseudomonas aeruginosa[J].International Journal of Biological Macromolecules,2023,226:1031-1040.
[25] CRISTANI M,D’ARRIGO M,MANDALARI G,et al.Interaction of four monoterpenes contained in essential oils with model membranes:Implications for their antibacterial activity[J].Journal of Agricultural and Food Chemistry,2007,55(15):6300-6308.
[26] WIJESUNDARA N M,LEE S F,CHENG Z Y,et al.Bactericidal activity of carvacrol against Streptococcus pyogenes involves alteration of membrane fluidity and integrity through interaction with membrane phospholipids[J].Pharmaceutics,2022,14(10):1992.