乳液是一种由连续相和分散相组成的体系。目前,有关乳液的研究渗透各行各业,在化妆品、食品以及医药等行业有着广泛应用。有大量研究表明,乳液体系分散均匀,相较于单独的油脂和蛋白有更好的消化特性,因此乳液在亲脂性生物活性物质的可食用输送体系方面有着巨大的潜力[1]。蛋白是一种天然的表面活性分子,能够吸附并稳定乳液油水界面,由于其契合人体所需的营养价值而作为食品中常用的乳化剂,其中植物蛋白[2]和乳蛋白[3]作为乳化剂的研究被大量报道。
近年来,已有许多研究表明,鱼类蛋白是非常具有潜力的乳化剂。GARC A-MORENO等[4]使用鱼蛋白水解物稳定的O/W乳液具有较好的物理稳定性以及氧化稳定性。罗非鱼是我国养殖淡水鱼中的重要鱼类,具有生长周期短,繁殖以及适应环境能力强等特点。在2022年,我国罗非鱼养殖产量高达173万t[5],但目前罗非鱼产业面临产品单一,深加工产品不足的困境。罗非鱼分离蛋白(tilapia protein isolate,TPI)分离于罗非鱼肉,相较于植物蛋白与乳蛋白,罗非鱼分离蛋白具有更加独特的氨基酸组成,人体更易消化,具有非常大的生产和加工价值。使用碱溶酸沉法提取TPI具有提取率高的特点,分离的TPI包括肌球蛋白、肌原纤维蛋白和肌浆蛋白。但是,TPI本身蛋白分子质量较大,溶解性和乳化性较差,由其制备的O/W乳液的稳定性很低。因此,研究改善TPI乳液稳定性,对丰富罗非鱼产品种类并提高其经济附加价值意义重大。
A-MORENO等[4]使用鱼蛋白水解物稳定的O/W乳液具有较好的物理稳定性以及氧化稳定性。罗非鱼是我国养殖淡水鱼中的重要鱼类,具有生长周期短,繁殖以及适应环境能力强等特点。在2022年,我国罗非鱼养殖产量高达173万t[5],但目前罗非鱼产业面临产品单一,深加工产品不足的困境。罗非鱼分离蛋白(tilapia protein isolate,TPI)分离于罗非鱼肉,相较于植物蛋白与乳蛋白,罗非鱼分离蛋白具有更加独特的氨基酸组成,人体更易消化,具有非常大的生产和加工价值。使用碱溶酸沉法提取TPI具有提取率高的特点,分离的TPI包括肌球蛋白、肌原纤维蛋白和肌浆蛋白。但是,TPI本身蛋白分子质量较大,溶解性和乳化性较差,由其制备的O/W乳液的稳定性很低。因此,研究改善TPI乳液稳定性,对丰富罗非鱼产品种类并提高其经济附加价值意义重大。
蛋白与多糖可通过共价作用和非共价作用形成复合物。共价复合物主要以化学键结合,而非共价复合物主要以静电相互作用、疏水相互作用及氢键作用维系体系的稳定。相比共价作用,非共价复合物具有制备简便、绿色、安全的优势。研究表明蛋白与多糖非共价复合可有效提高蛋白的乳化性,从而制备稳定性更高的乳液。ZHANG等[6]研究发现阴离子多糖的添加与豆科蛋白发生非共价相互作用并改善了乳液稳定性。卡拉胶是一种由红藻通过热碱分离提取制得的阴离子多糖,其结构主要由重复的D-半乳糖和3,6-脱水半乳糖单元组成,卡拉胶由于其生物可降解性,高保水和凝胶特性,可作为增稠剂和稳定剂广泛应用于食品工业。卡拉胶与其他蛋白相互作用的研究也常有报道,PERRECHIL等[7]发现酪蛋白酸钠与卡拉胶的静电复合物能够提高乳液在环境压力下的稳定性;YAN等[8]发现添加卡拉胶显著猪血浆蛋白的乳化性以及高内相乳液(high internal phase emulsions,HIPEs)的贮藏稳定性和热稳定性。但目前鱼类蛋白和卡拉胶相互作用的研究鲜有报道。因此,本研究以TPI为乳化剂,采用高压均质法制备乳液,探究添加不同浓度的卡拉胶对TPI乳液稳定性的影响。
1 材料与方法
1.1 材料与试剂
罗非鱼,湛江市霞山区民享菜市场;卡拉胶,上海瑞永生物科技有限公司;尼罗红(分析纯),Macklin公司;尼罗蓝(分析纯),Sigma公司;胃蛋白酶、胆盐、胰脂肪酶均为分析纯,上海源叶生物科技有限公司。本研究所使用的其他化学品和试剂均为分析纯级别。
1.2 仪器与设备
Avanti J-26 sxp高速冷冻离心机,美国贝克曼公司;AH-NANO超高压纳米均质机,加拿大ATS仪器公司;NanoBrook Omni激光粒度及Zeta电位仪,美国布鲁克海文仪器公司;FV300激光共聚焦扫描显微镜,日本奥林巴斯仪器公司。
1.3 实验方法
1.3.1 罗非鱼分离蛋白的提取
参考LI等[9]的方法,将新鲜罗非鱼背肉搅碎,与冰水按照质量比1∶9混合匀浆。用1 mol/L的NaOH将pH调节至11.0,磁力搅拌提取30 min(450 r/min)后离心(4 ℃,10 000 r/min,20 min)。上清液用8层纱布过滤,将滤液用1 mol/L的HCl调节pH至5.5后离心(4 ℃,10 000 r/min,20 min),取沉淀加适量冰水匀浆,调节pH至7.0,采用透析袋(8 000~14 000 Da)透析48 h后冷冻干燥得到TPI粉末备用。
1.3.2 罗非鱼蛋白-卡拉胶复合乳液的制备
参考陈艾霖等[10]的方法并稍作修改,取上述TPI粉末分散在冰蒸馏水中,以乳液最终体积计算浓度为10 g/L,在冰浴条件下搅拌1 h(450 r/min),分别加入质量浓度为0、1.0、1.5、2.0、2.5 mg/mL的卡拉胶,在冰浴下继续搅拌1 h,将不同比例的蛋白多糖复合溶液按照油水比1∶9(体积比)加入大豆油,在10 000 r/min下剪切2 min得到粗乳液,然后通过高压均质(60 MPa,4 ℃,5次循环)得到不同卡拉胶添加浓度的罗非鱼分离蛋白复合乳液。
1.3.3 粒径和Zeta电位测定
参考CAO等[11]的方法并稍作修改,用去离子水将新鲜乳液稀释500倍,用激光粒度及Zeta电位仪在25 ℃下测定样品的粒径、多分散性指数(polydispersity index,PDI)和Zeta电位。样品和去离子水的折射率分别设置为1.46和1.33。
1.3.4 乳析指数测定
参考SHI等[12]的方法并稍作修改,将经过高压均质的新鲜乳液立即转移至50 mL的玻璃瓶中(底径2.5 cm,高度6 cm),在4 ℃下贮藏28 d,期间拍照并记录乳液分层高度。乳析指数的计算如公式(1)所示:
(1)
[:IC为乳析指数;Hs为乳液下层清液高度;Ht为乳液总高度。
1.3.5 流变学特性的测定
参考吴彤等[13]的方法测定乳液的流变学特性并稍作修改,使用转子型号为C60 TiL,温度恒定为25 ℃,在0.1~100 s-1剪切速率范围内选择100个取样点记录乳液的表观黏度变化;在应力为1%,频率为0.1~10 Hz范围内扫描储能模量(G′)和耗能模量(G″)的变化。
1.3.6 界面蛋白吸附率测定
参考WANG等[14]的方法稍作修改测定乳液的蛋白吸附率(adsorption of protein,AP),取20 mL乳液离心(12 000×g,30 min),取下清液经0.45 μm滤膜过滤,以牛血清蛋白作为参照,蛋白浓度的计算如公式(2)所示:
(2)
[:C0为乳液初始蛋白浓度;Cs为清液中的蛋白浓度。
1.3.7 激光共聚焦扫描显微镜(laser confocal scanning microscope,CLSM)
取1 mL不同卡拉胶浓度的乳液与20 μL 1%的尼罗红和10 μL 1%的尼罗蓝溶液混合,避光静置反应15 min,然后取10 μL混合液于载玻片上,使用100×油镜观察。尼罗红和尼罗蓝染料分别对油脂和蛋白质染色,激发波长分别为488 nm和633 nm。
1.3.8 脂质消化测定
游离脂肪酸(free fatty acid,FFA)释放曲线可以反映乳液中脂质的消化程度和消化速率,参考GASA-FALCON等[15]的方法构建模拟胃-肠道2个阶段的消化过程。
胃消化阶段:将15 mL乳液与胃消化液(含2 mg/mL NaCl+7 mg/mL HCl+3.2 mg/mL胃蛋白酶)混合,用2 mol/L HCl或2 mol/L NaOH将混合液pH调至2.0,在37 ℃下振荡反应2 h。
肠消化阶段:用1 mol/L NaOH将模拟胃消化后的样品pH调至7.0,依次加入3.5 mL猪胆盐提取物和1.5 mL盐溶液(含10 mmol/L CaCl2和150 mmol/L NaCl),再次调pH至7.0,然后加入2.5 mL胰脂肪酶(用0.1 mol/L PBS溶液配制成质量浓度为75 mg/mL),37 ℃振荡反应2 h,每隔30 min用0.1 mol/L NaOH标准溶液滴定,调节pH至7.0。
肠消化阶段,根据每30 min滴定所消耗的NaOH体积计算乳液体系消化过程的FFA释放量,计算如公式(3)所示:
(3)
[:VNaOH为滴定FFA所消耗的NaOH体积,mL;CNaOH为NaOH标准溶液的浓度,mol/mL;M大豆油为大豆油的平均分子质量,g/mol;ω大豆油为初乳液中大豆油的质量,g。
1.4 数据分析
实验数据使用Origin 2023软件作图,数据间的显著性差异采用SPSS Statistics 25.0软件分析,所有实验均重复3次,数据间显著性水平设置为P<0.05。
2 结果与分析
2.1 粒径与Zeta电位分析
图1为不同卡拉胶质量浓度对TPI乳液的平均粒径和PDI以及Zeta电位的影响。由图1可知,在0~2.5 mg/mL的卡拉胶添加范围内,乳液的平均粒径呈先增大后减小的趋势;乳液的PDI呈现逐渐降低的趋势,在2.0 mg/mL卡拉胶处最小。乳液Zeta电位绝对值随着卡拉胶质量浓度增大而增大,且在2.0 mg/mL处趋于平缓,为35.62 mV。低质量浓度卡拉胶增加的液滴表面电荷不多,而卡拉胶分子与TPI复合过程存在一定的交联作用,使得乳液的粒径增大[16];随着卡拉胶质量浓度逐渐增大,Zeta电位绝对值增大,液滴表面所带净电荷增多,静电斥力增强,使乳液粒径逐渐减小。与TPI乳液相比,粒径减小趋势不大但体系分散更加均匀。因此,该结果表明,卡拉胶可以通过增强体系的静电斥力来提高乳液的物理稳定性。
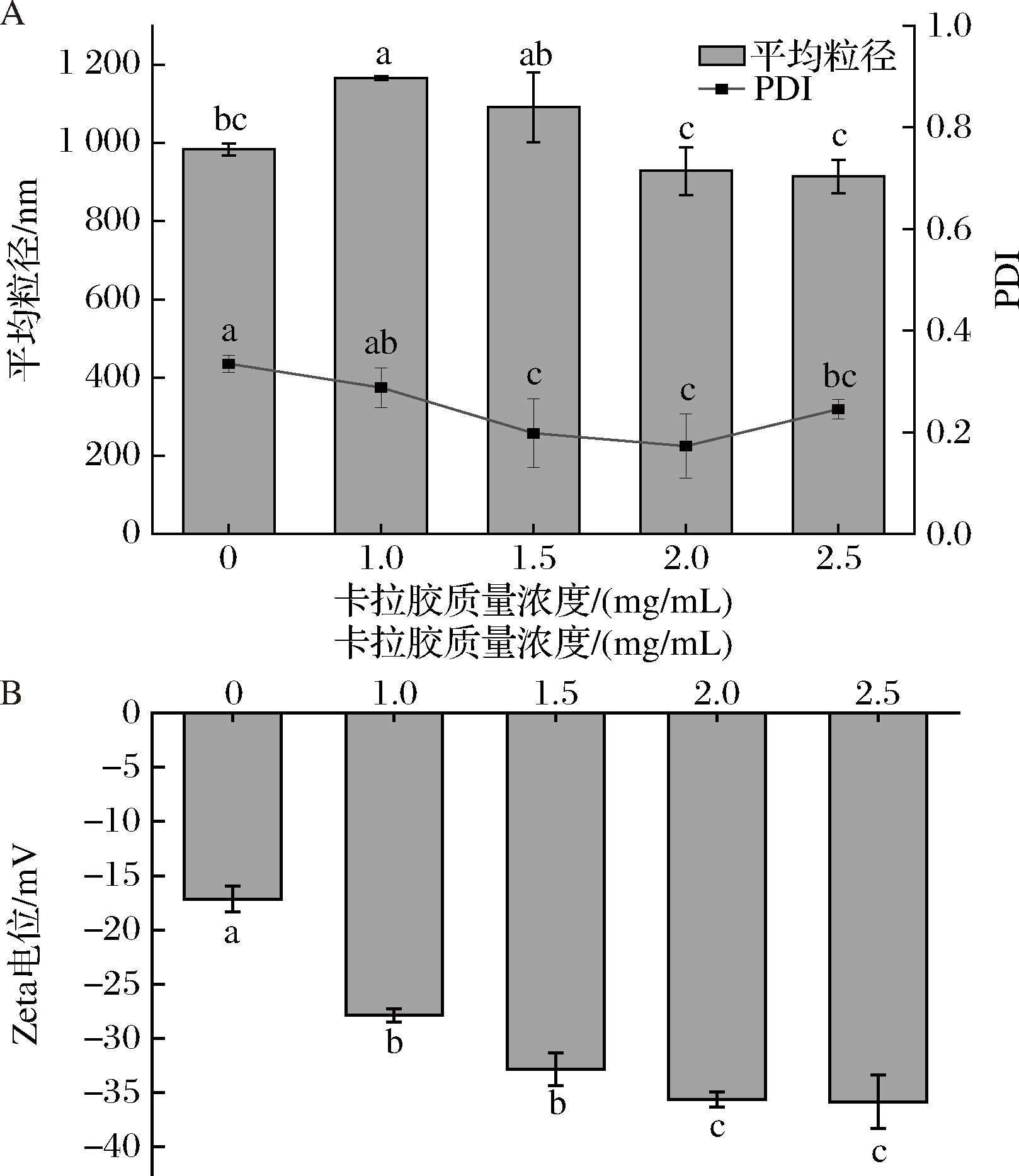
A-粒径、PDI;B-Zeta电位
图1 不同质量浓度卡拉胶下的TPI乳液粒径、PDI和Zeta电位
Fig.1 Particle size,PDI and Zeta potential of TPI emulsion at different carrageenan concentrations
注:同一指标,不同小写字母代表差异显著(P<0.05)。
2.2 乳析指数分析
图2为添加不同质量浓度卡拉胶对TPI乳液乳析指数的影响。由图2可知,TPI乳液在贮藏期内的第3天就出现了分层现象(图2-B),乳析指数为0.083(图2-A),且随着贮藏时间的延长而增加,在第7天后增加较为缓慢。TPI本身乳化性较差,在重力等的因素影响下易聚集和沉降,难以稳定覆盖在油水界面,导致油滴容易絮凝,乳液宏观稳定性较差。添加了不同质量浓度卡拉胶的乳液在28 d的贮藏期内均未出现明显分层现象,乳析指数几乎为0。BAI等[17]研究发现,多糖能够促进耗竭液滴的絮凝,卡拉胶是阴离子多糖,在油水界面与TPI的交联作用在一定程度上阻止了液滴絮凝;同时TPI-卡拉胶在油水界面携带大量净电荷,增大了乳液体系的静电斥力以及空间位阻[18],这提高了乳液的宏观稳定性。
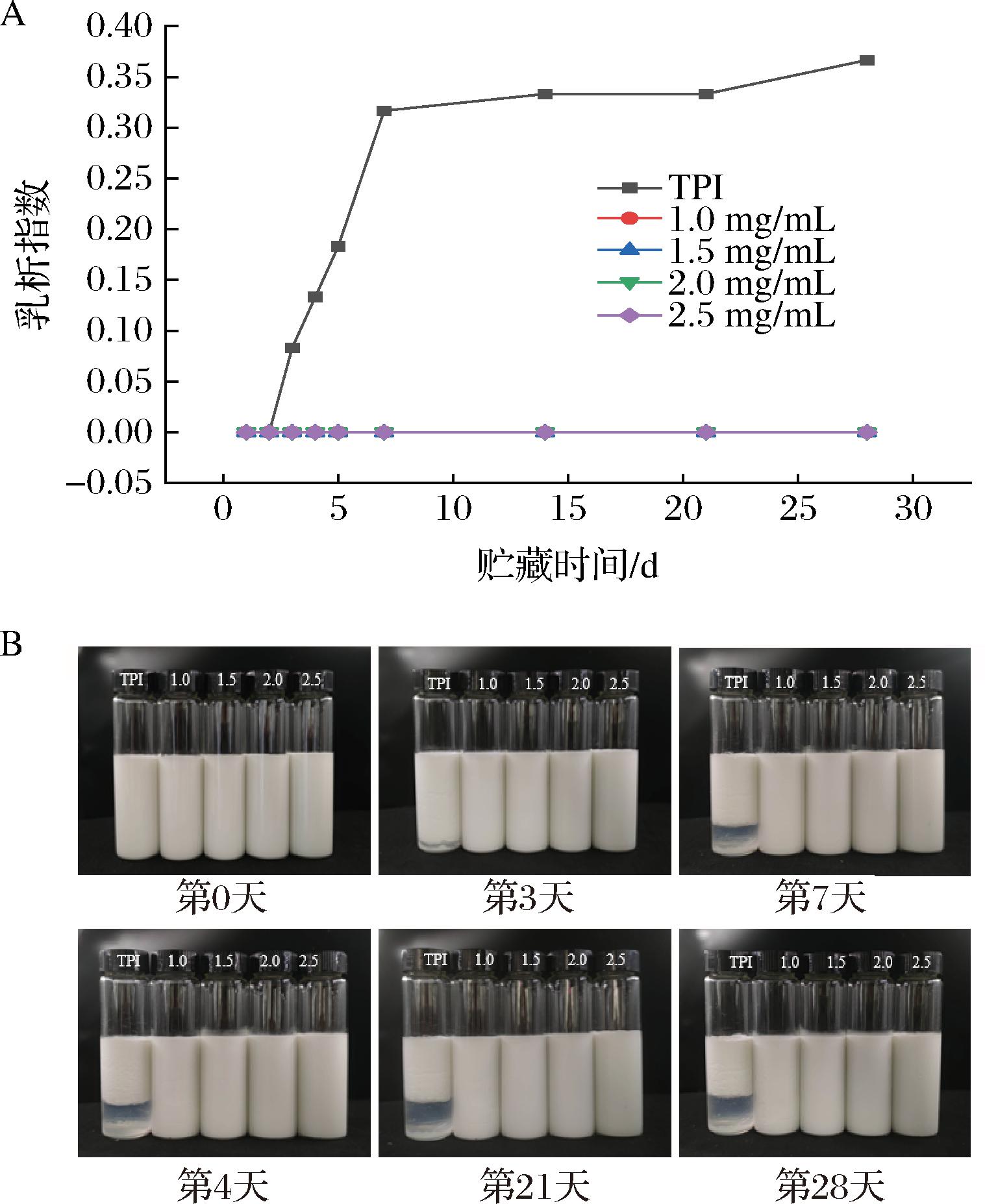
A-乳析指数;B-28 d贮藏期图像变化
图2 不同质量浓度卡拉胶对TPI乳液乳析指数的影响
Fig.2 Effect of different carrageenan concentration on the emulsion index of TPI emulsion
2.3 流变学性质分析
图3为不同质量浓度卡拉胶对TPI乳液表观黏度、G′、G″的影响。由图3-A可知,TPI乳液和TPI-卡拉胶乳液在0.1~100 s-1表观黏度随剪切速率增大而减小,表现出剪切稀释的现象,表明2种乳液均为非牛顿流体。乳液宏观稳定性与表观黏度一般呈正相关。TPI乳液的表观黏度为40 Pa·s,而添加不同质量浓度卡拉胶的乳液表观黏度远大于TPI乳液,接近80 Pa·s。这是可能是由于卡拉胶能够与TPI非共价交联形成网状结构,稳定油水界面,增大乳液体系的表观黏度,降低液滴流动性和碰撞频率,从而阻止液滴之间的絮凝聚集[19]。因此,卡拉胶也是食品工业中常用的稳定剂和增稠剂。由图3-B可知,TPI乳液和TPI-卡拉胶乳液在低应力下G′均大于G″,表明属于以弹性行为为主导乳液的凝胶结构。添加了卡拉胶的乳液G′与G″均大于TPI乳液,这与表观黏度结果相呼应,说明卡拉胶与TPI交联形成的网状结构能够强化乳液的凝胶结构。GHORBANI等[20]研究发现,酪蛋白酸钠与黄芪胶的复合物能够强化凝胶网状结构,这与本研究结果相似。综上所述,添加卡拉胶能极大地提高TPI乳液的流变学性质并提高其宏观稳定性。
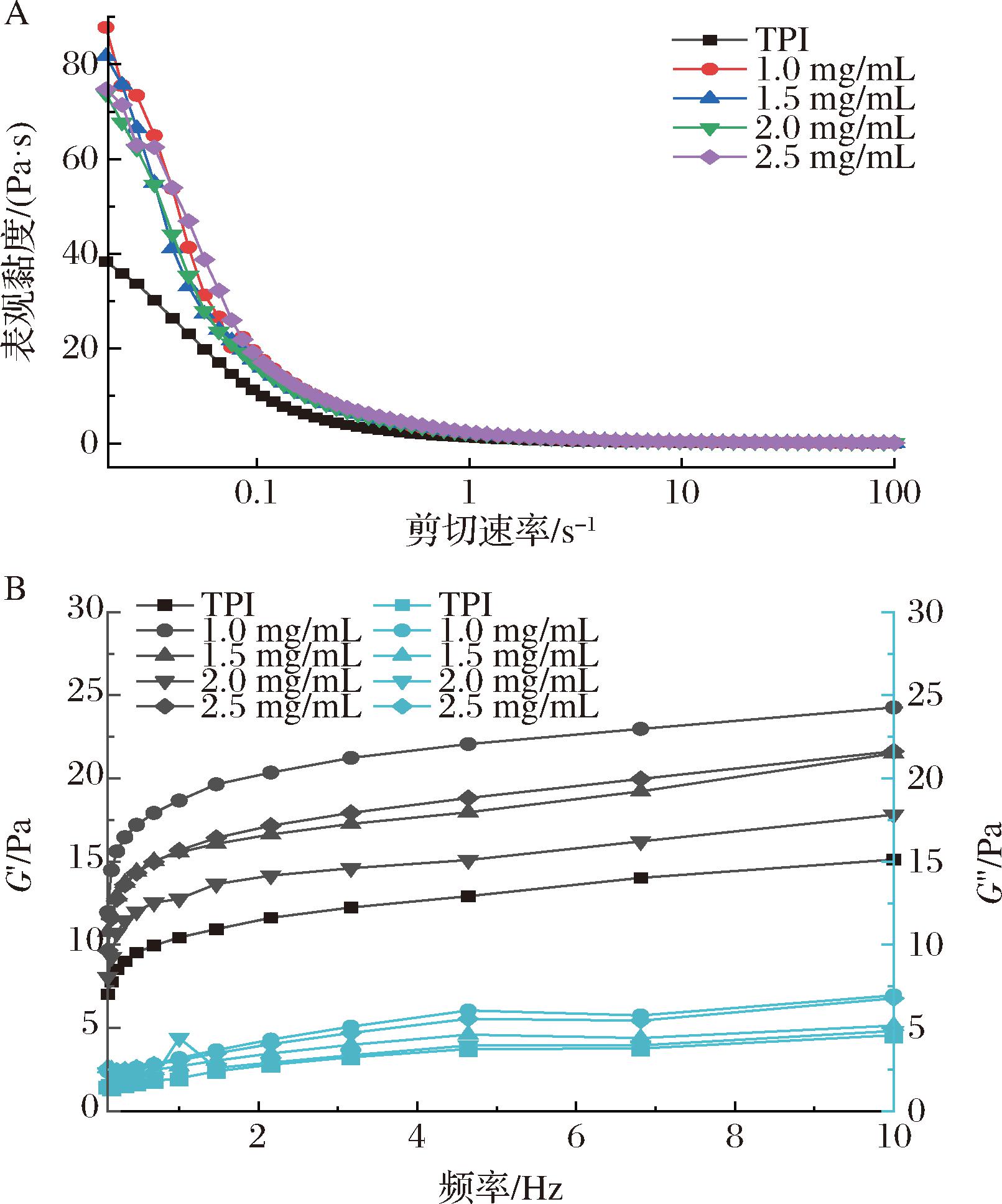
A-表观黏度;B-G′与G″
图3 不同质量浓度卡拉胶下TPI乳液表观黏度、G′与G″的变化
Fig.3 Apparent viscosity,storage modulus G′,and loss modulus G″ of TPI emulsion at different carrageenan concentrations
2.4 蛋白吸附率分析
图4为不同卡拉胶质量浓度对TPI乳液蛋白吸附率的影响。在油水界面吸附的蛋白会影响乳液液滴的絮凝聚集,当乳液油水界面能够被蛋白完全覆盖时,可有效地提高乳液的宏观稳定性。与TPI乳液相比,TPI-卡拉胶复合乳液的蛋白吸附率显著提高(P<0.05),且随着卡拉胶质量浓度的增大而增大,且在2.0 mg/mL处达到最大值(96.63%)。该结果与CAI等[21]实验结果一致,其研究发现黄原胶可通过增大静电斥力促进蛋白质持续吸附到油水界面上,形成具有弹性的界面膜。结合图1-B Zeta电位结果可知卡拉胶的添加增大了乳液静电斥力,因此与TPI的静电相互作用以及交联作用形成的界面膜能够使蛋白更加紧密地吸附在油水界面上,显著提高乳液的宏观稳定性。
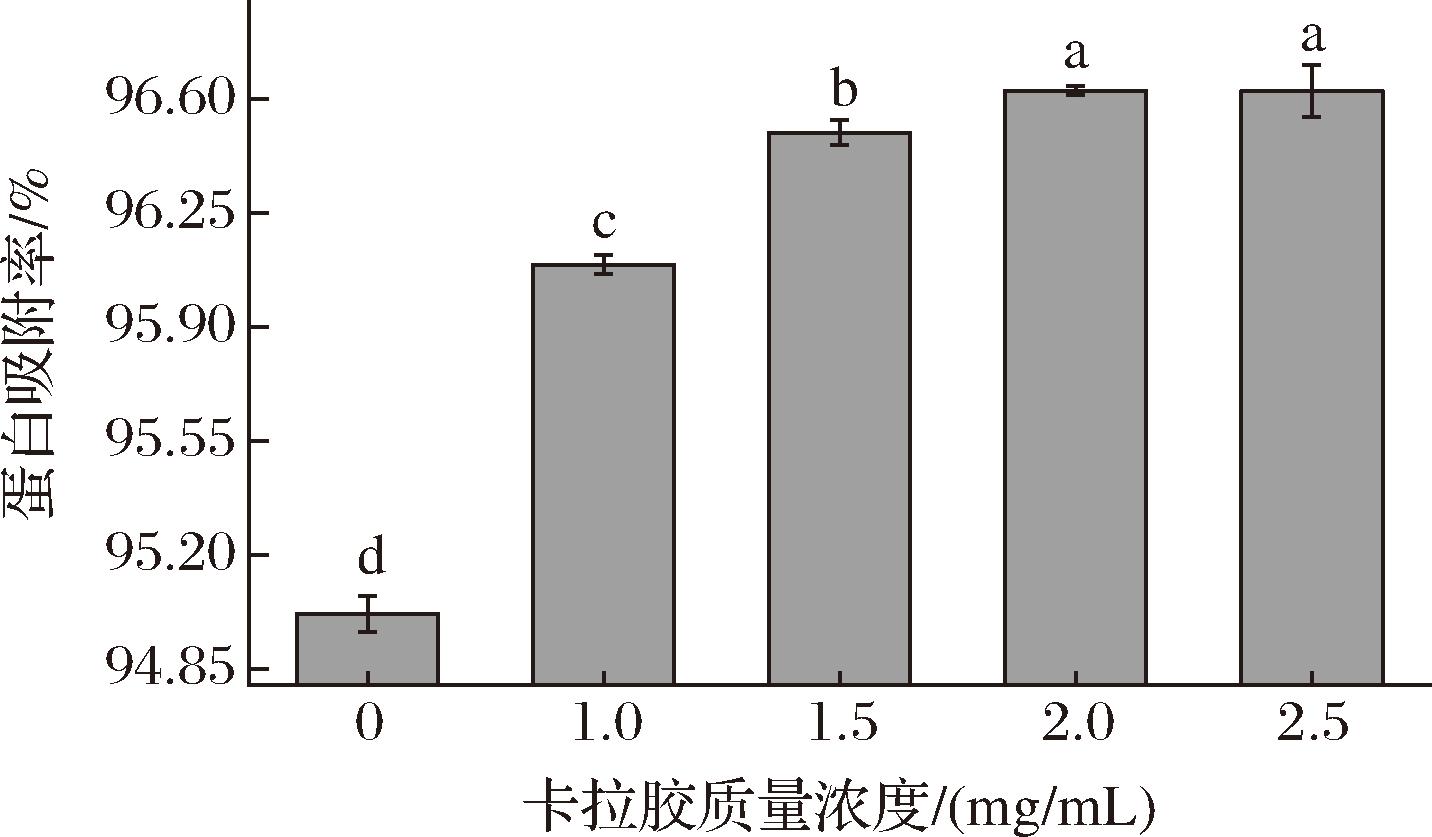
图4 不同质量浓度卡拉胶下的TPI乳液蛋白吸附率
Fig.4 Protein adsorption rate of TPI emulsion under different carrageenan concentrations
2.5 微观结构分析
图5为不同质量浓度卡拉胶对TPI乳液微观结构的影响。乳液的液滴大小、聚集分散程度等指标反映乳液的物理稳定程度,一般采用CLSM分析。乳液中的蛋白质和油脂分别被尼罗蓝和尼罗红染色。由图5可知,无卡拉胶添加的TPI乳液液滴呈球状聚集,且分散不均匀。TPI分子之间易聚集沉降,是导致乳液不稳定出现分层现象的主要原因[22],这与图2中TPI乳析指数及实物图结果相一致。据HU等[23]研究证实,通过添加多糖增大体系黏度,可形成小油滴以防止液滴聚集并提高蛋白乳液的物理稳定性。结合图5可知,质量浓度为1.0 mg/mL和1.5 mg/mL的TPI-卡拉胶复合乳液液滴尺寸较小且分散均匀,这可能是静电斥力增大所致。在1.0 mg/mL的乳液中可以观察到由卡拉胶与蛋白之间交联形成的较小界面膜。随着卡拉胶质量浓度增大,可以观察到界面膜的面积增大。这些界面膜在阻碍乳液液滴聚集絮凝方面起到关键作用。
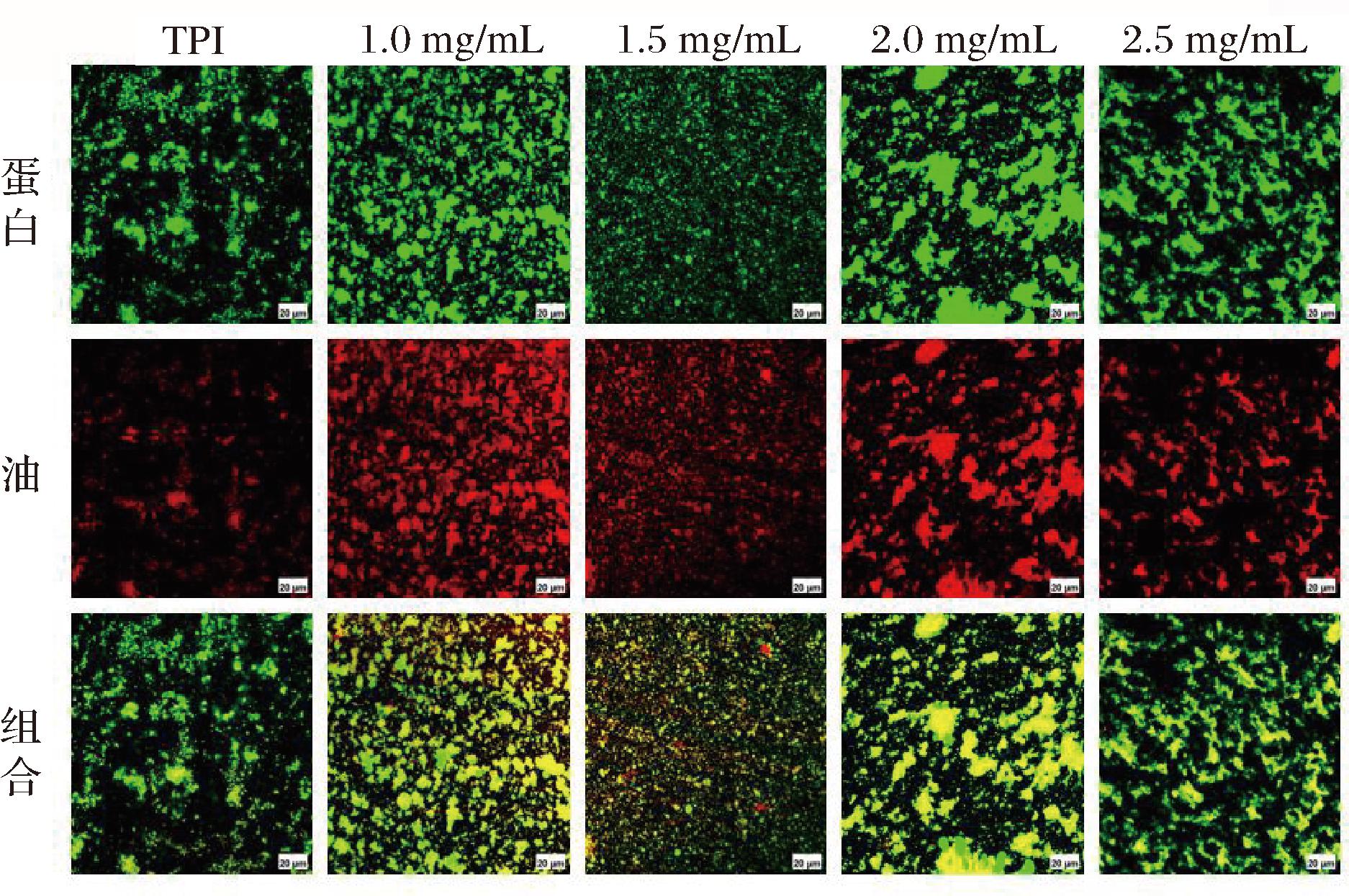
图5 不同质量浓度卡拉胶下TPI乳液的CLSM图
Fig.5 CLSM images of TPI emulsion at different carrageenan concentrations
2.6 脂质消化分析
图6为不同卡拉胶质量浓度对TPI乳液FFA释放量的影响。FFA释放曲线可以反映乳液中脂质的消化程度和消化速率。在120 min的肠消化过程中,不同乳液样品FFA释放率为60%~80%,而单独的大豆油的释放率则<20%,这是因为乳液分散更加均匀,表现出更好的脂质消化特性。TPI和1.0 mg/mL卡拉胶乳液在60 min内迅速释放近60%,后开始趋于平缓状态,这表明模拟肠消化的过程中,乳液中的油脂会被肠液胰酶迅速酶促分解,产生较多的FFA。而其他浓度卡拉胶乳液在120 min内均以稳定的增长率释放FFA。在肠消化阶段的前60 min内,1.5 mg/mL和2.0 mg/mL卡拉胶乳液的FFA释放速率是小于其他浓度组的,这说明在该卡拉胶的添加条件下,可以使TPI乳液达到延缓FFA释放的效果。结合表观黏度和微观结构结果来看,卡拉胶与TPI交联形成的复合物界面膜更多覆盖在油水界面,导致表观黏度增大,流动性降低和空间位阻提高,在一定程度上降低了脂肪酶与脂质接触面积,抑制了脂肪酶对脂质的水解,达到了延缓释放FFA的结果。据一些研究报道,延缓FFA释放能够对脂溶性生物活性物质起到一定的控释效果[24]。综上可知,添加卡拉胶可有效提高TPI乳液的消化稳定性,为后续研究乳液基脂溶性活性物质递送体系提供了理论依据。
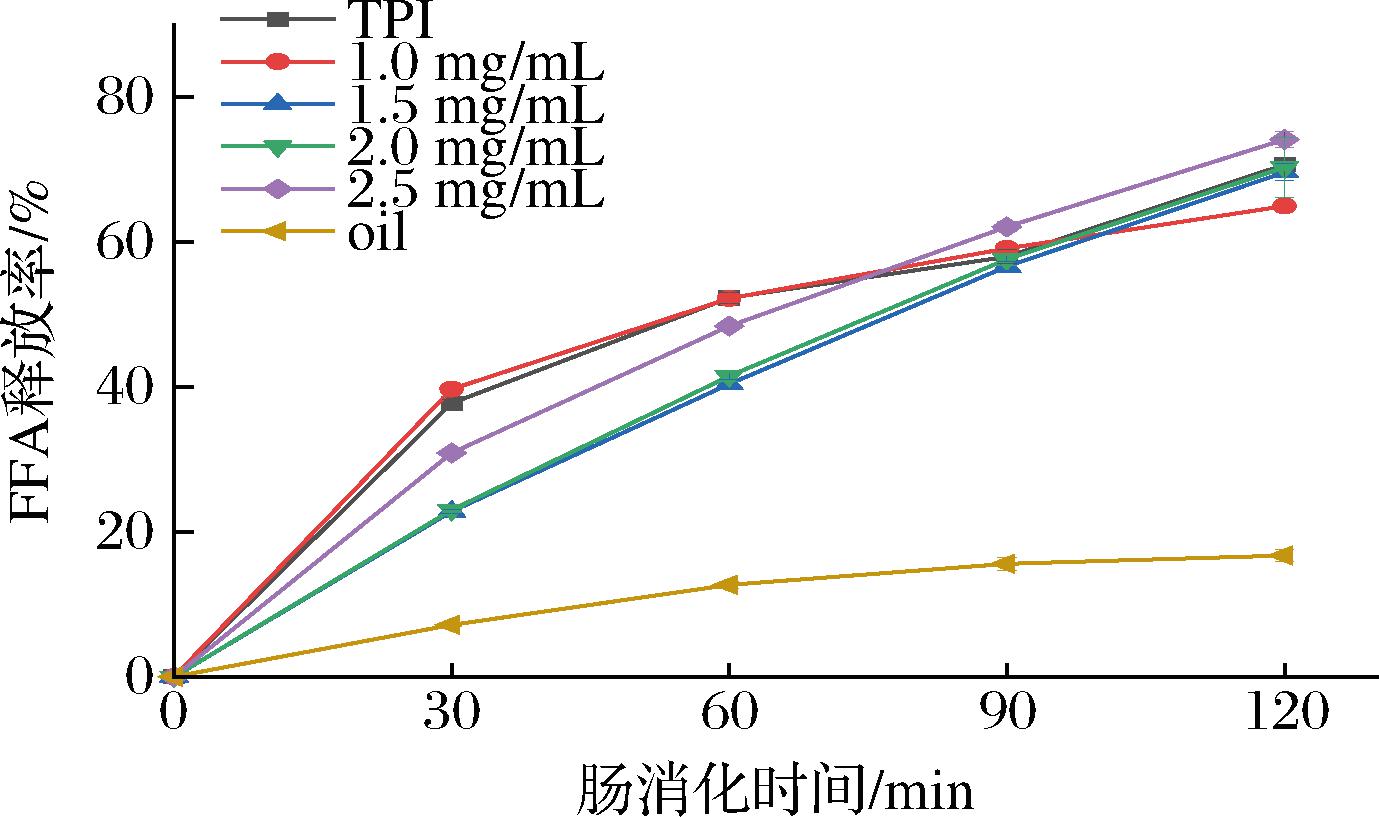
图6 不同质量浓度卡拉胶对TPI乳液FFA释放量的影响
Fig.6 Effect of different carrageenan concentrations on FFA release from TPI emulsion
3 结论
本研究探究不同卡拉胶浓度对TPI乳液稳定性的影响。结果表明,添加卡拉胶能够显著提高乳液的Zeta电位绝对值、表观黏度及弹性模量。TPI与卡拉胶分子通过静电相互作用形成高电荷的复合物,阻碍了乳液液滴之间的聚集絮凝,提高了乳液的贮藏稳定性。同时,卡拉胶可促进蛋白在油水界面的吸附,与蛋白交联形成致密的界面膜。界面膜的空间位阻效应可有效抑制模拟肠消化阶段的脂肪水解,致使FFA缓慢释放。因此,卡拉胶添加是提高TPI乳液物理稳定性及消化稳定性的有效措施。本研究将为稳态化TPI乳液的开发以及后续TPI乳液基脂溶性活性物质递送体系的构建提供理论基础。
[1] MCCLEMENTS D J,SALIVA-TRUJILLO L,ZHANG R J,et al.Boosting the bioavailability of hydrophobic nutrients,vitamins,and nutraceuticals in natural products using excipient emulsions[J].Food Research International,2016,88(Pt A):140-152.
[2] CHEN W Y,JU X R,ALUKO R E,et al.Rice bran protein-based nanoemulsion carrier for improving stability and bioavailability of quercetin[J].Food Hydrocolloids,2020,108:106042.
[3] ZANG Z H,CHOU S R,TIAN J L,et al.Effect of whey protein isolate on the stability and antioxidant capacity of blueberry anthocyanins:A mechanistic and in vitro simulation study[J].Food Chemistry,2021,336:127700.
[4] GARC A-MORENO P J,GUADIX A,GUADIX E M,et al.Physical and oxidative stability of fish oil-in-water emulsions stabilized with fish protein hydrolysates[J].Food Chemistry,2016,203:124-135.
A-MORENO P J,GUADIX A,GUADIX E M,et al.Physical and oxidative stability of fish oil-in-water emulsions stabilized with fish protein hydrolysates[J].Food Chemistry,2016,203:124-135.
[5] 董金和.《2013中国渔业统计年鉴》解读[J].中国水产,2013(7):19-20.DONG J H.Interpretation of China fishery statistical yearbook 2013[J].China Fisheries,2013(7):19-20.
[6] ZHANG L N,LIANG R W,LI L.The interaction between anionic polysaccharides and legume protein and their influence mechanism on emulsion stability[J].Food Hydrocolloids,2022,131:107814.
[7] PERRECHIL F A,CUNHA R L.Stabilization of multilayered emulsions by sodium caseinate and κ-carrageenan[J].Food Hydrocolloids,2013,30(2):606-613.
[8] YAN P,YUAN J L,KANG X,et al.Characteristics,formation mechanism and stability of high internal phase emulsions stabilized by porcine plasma protein (PPP)/carrageenan (CG) hybrid particles[J].Food Bioscience,2022,47:101751.
[9] TAN L,HONG P Z,YANG P,et al.Correlation between the water solubility and secondary structure of tilapia-soybean protein co-precipitates[J].Molecules,2019,24(23):4337.
[10] 陈艾霖,洪鹏志,宋春勇,等.热处理对负载叶黄素的罗非鱼分离蛋白乳液稳定性和体外消化的影响[J].食品与发酵工业,2021,47(16):173-180.CHEN A L,HONG P Z,SONG C Y,et al.Effect of heat treatment on stability and in vitro digestion of lutein loaded tilapia protein isolate[J].Food and Fermentation Industries,2021,47(16):173-180.
[11] CAO J,TONG X H,CHENG J J,et al.Impact of pH on the interaction between soy whey protein and gum arabic at oil-water interface:Structural,emulsifying,and rheological properties[J].Food Hydrocolloids,2023,139:108584.
[12] SHI T,LIU H,SONG T,et al.Use of L-arginine-assisted ultrasonic treatment to change the molecular and interfacial characteristics of fish myosin and enhance the physical stability of the emulsion[J].Food Chemistry,2021,342:128314.
[13] 吴彤,冯进,黄午阳,等.牛蒡果胶多糖/玉米醇溶蛋白复合颗粒稳定的Pickering乳液构建及对姜黄素的递送功效[J].食品科学,2023,44(14):37-46.WU T,FENG J,HUANG W Y,et al.Fabrication of Pickering emulsions stabilized by burdock RG-1 pectin/zein composite particles and their utilizations for the delivery of curcumin[J].Food Science,2023,44(14):37-46.
[14] WANG N Z,ZHAO X,JIANG Y Q,et al.Enhancing the stability of oil-in-water emulsions by non-covalent interaction between whey protein isolate and hyaluronic acid[J].International Journal of Biological Macromolecules,2023,225:1085-1095.
[15] GASA-FALCON A,ARRANZ E,ODRIOZOLA-SERRANO I,et al.Delivery of β-carotene to the in vitro intestinal barrier using nanoemulsions with lecithin or sodium caseinate as emulsifiers[J].LWT,2021,135:110059.
[16] SHEN K J,LONG J,LI X F,et al.Complexation of pea protein isolate with dextran sulphate and interfacial adsorption behaviour and O/W emulsion stability at acidic conditions[J].International Journal of Food Science &Technology,2021,57(4):2333-2345.
[17] BAI L,LIU F G,XU X F,et al.Impact of polysaccharide molecular characteristics on viscosity enhancement and depletion flocculation[J].Journal of Food Engineering,2017,207:35-45.
[18] YI J,GAN C,WEN Z,et al.Development of pea protein and high methoxyl pectin colloidal particles stabilized high internal phase pickering emulsions for β-carotene protection and delivery[J].Food Hydrocolloids,2021,113:106497.
[19] ZHONG W G,LI C Q,DIAO M X,et al.Characterization of interactions between whey protein isolate and hyaluronic acid in aqueous solution:Effects of pH and mixing ratio[J].Colloids and Surfaces B:Biointerfaces,2021,203:111758.
[20] GHORBANI GORJI S,GHORBANI GORJI E,MOHAMMADIFAR M A,et al.Complexation of sodium caseinate with gum tragacanth:Effect of various species and rheology of coacervates[J].International Journal of Biological Macromolecules,2014,67:503-511.
[21] CAI Y J,DENG X L,LIU T X,et al.Effect of xanthan gum on walnut protein/xanthan gum mixtures,interfacial adsorption,and emulsion properties[J].Food Hydrocolloids,2018,79:391-398.
[22] CHANG H J,LEE J H.Emulsification and oxidation stabilities of DAG-rich algae oil-in-water emulsions prepared with the selected emulsifiers[J].Journal of the Science of Food and Agriculture,2020,100(1):287-294.
[23] HU Y,LIANG H S,XU W,et al.Synergistic effects of small amounts of konjac glucomannan on functional properties of egg white protein[J].Food Hydrocolloids,2016,52:213-220.
[24] ZHANG R Y,BELWAL T,LI L,et al.Recent advances in polysaccharides stabilized emulsions for encapsulation and delivery of bioactive food ingredients:A review[J].Carbohydrate Polymers,2020,242:116388.