黄曲霉(Aspergillus flavus)作为腐生型好氧真菌,易污染花生、玉米、大豆、水稻、棉花、坚果、水果和蔬菜等[1],每年造成巨大经济损失。黄曲霉在霉变作物产生的黄曲霉毒素是全球食品安全控制中最主要的真菌毒素,其中黄曲霉毒素AFB1具有强致突变、致畸和致癌作用,严重危害人类健康。化学杀菌剂虽能有效防治黄曲霉污染,但长期过量使用导致的食品安全和环境污染问题日益突显[2]。因此,开发高效、环境友好的生物方法来防控黄曲霉污染迫在眉睫。
微生物种类多、分布广,能产生丰富、功能多样的生理活性物质,因此利用微生物防治黄曲霉污染近年来备受关注。据报道,很多微生物能抑制黄曲霉菌丝生长或黄曲霉毒素的生物合成,如乳酸菌[3]、芽孢杆菌[4]、链霉菌[5]、粪产碱菌[6]、假单胞菌[7]、肺炎克雷伯菌[8]、伯克霍尔德菌[9]和沙雷氏菌[10],其中芽孢杆菌对黄曲霉及黄曲霉毒素污染的生防研究较多。贝莱斯芽孢杆菌E2合成的脂肽通过破坏细胞膜的完整性和干扰核糖体代谢抑制黄曲霉生长和孢子萌发,同时脂肽处理导致黄曲霉毒素合成相关基因的表达下调[11]。玉米种子内生解淀粉芽孢杆菌B42-3发酵滤液、上清液及粗蛋白均能较好抑制黄曲霉菌丝生长与分生孢子萌发,且室内和田间对黄曲霉毒素污染的防治效果均达70%以上[12]。解淀粉芽孢杆菌WF2020与黄曲霉共培养不仅抑制黄曲霉生长,还能完全抑制AFB1的合成[13]。拮抗黄曲霉的芽孢杆菌多数来源于土壤,而药用植物内生芽孢杆菌抑制黄曲霉的研究却鲜有报道。
大花杓兰(Cypripedium macranthum)是一种兼具观赏价值和药用价值的多年生草本植物。高海拔、昼夜温差大的草甸或林缘生境,使其内生细菌的功能可能具有某些特殊性。内生细菌与药用植物协同进化,可能产生与宿主植物相同或相似的药用成分,使其成为开发生防菌的良好来源。鉴于大花杓兰内生细菌对黄曲霉的抑菌研究尚未见报道,本研究采用平板对峙法和发酵液抑菌法筛选对黄曲霉有良好拮抗作用的大花杓兰内生细菌;菌丝生长速率法探讨内生细菌发酵液中抑菌活性物质的稳定性;PCR扩增脂肽合成酶基因和多聚酮合酶基因;酸沉醇提制备脂肽粗提取物,牛津杯法测定其抑菌活性,旨在为将来分离鉴定抑菌物质、探究抑菌机理和研发拮抗黄曲霉的新型微生物菌剂提供理论依据。
1 材料与方法
1.1 细菌和真菌
大花杓兰内生细菌(表1)和黄曲霉(A.flavus)均保存于本研究室。
表1 本研究所用大花杓兰内生细菌
Table 1 Endophytic bacteria isolated from C.macranthum
分类地位菌株编号芽孢杆菌属(Bacillus)CmR-1m、CmR-1n、CmR-1p、CmR-2、CmR-2a、CmR-3a、CmR-4、CmR-4a、CmR-4b、CmR-4c变形杆菌属(Proteus)CmR-1a、CmR-8、CmR-11、CmR-14a、CmR-14b、CmR-15沙雷氏菌属(Serratia)CmR-2b、CmR-5a、CmR-5br、CmR-5bw、CmR-6a产碱杆菌属(Alcaligenes)CmR-7、CmR-9、CmR-10、CmR-12寡养单胞菌属(Stenotrophomonas)CmR-6c金黄杆菌属(Chryseobacterium)CmR-3绿芽孢杆菌属(Viridibacillus)CmR-1b类香味菌属(Myroides)CmR-13克雷伯氏菌属(Klebsiella)CmR-6b假单胞菌属(Pseudomonas)CmR-1c
1.2 培养基
LB液体培养基和LB固体培养基购自生工生物工程(上海)股份有限公司,按说明书配制。
即用型马铃薯葡萄糖固体(potato dextrose agar,PDA)培养基购自Coolaber公司,按说明书配制。
马铃薯葡萄糖液体(potato dextrose broth,PDB)培养基:称取200 g去皮马铃薯,切小块,加1 000 mL水,煮沸30 min,过滤,加15 g葡萄糖,补足水至1 000 mL。所有培养基均在121 ℃灭菌20 min。
1.3 实验方法
1.3.1 大花杓兰内生细菌和黄曲霉的活化
31株大花杓兰内生细菌分别划线接种于LB固体培养基,37 ℃培养18 h。接种黄曲霉菌饼于PDA培养基,28 ℃培养5 d。
1.3.2 拮抗黄曲霉内生细菌的初筛
采用5 mm无菌打孔器在黄曲霉菌落边缘取菌饼,接种菌饼至50 mL PDB培养基中,30 ℃ 180 r/min培养3 d,获得大小均匀的黄曲霉菌丝球。
平板对峙法:PDA平板中央接种1个黄曲霉菌丝球,距离菌丝球2 cm处接种内生细菌3处(处理组),未点种细菌的一处作为对照,30 ℃培养7 d。设置3个重复,参照刘端木等[14]的方法计算抑菌率,初步筛选对黄曲霉有较好拮抗作用的细菌。
1.3.3 拮抗黄曲霉内生细菌的复筛
初筛拮抗黄曲霉效果好的细菌分别于30 ℃和37 ℃在LB液体培养基中振荡培养24 h;发酵液经4 ℃高速离心、0.22 μm无菌针孔滤膜过滤,获得无菌发酵液。
菌丝生长速率法:将无菌发酵液10 mL与灭菌冷却至50 ℃的PDA培养基90 mL混匀制备的PDA平板作为处理组,而10 mL无菌水代替无菌发酵液制备的PDA平板作为对照组。接种大小均一的黄曲霉菌丝球至含/不含发酵液的PDA培养基中央,设置3个重复,30 ℃培养7 d。十字交叉法分别测量处理组和对照组的黄曲霉菌落直径,计算抑菌率,如公式(1)所示:
抑菌率![]()
(1)
[:D,对照组黄曲霉菌落直径,mm;D′,处理组黄曲霉菌落直径,mm。
1.3.4 CmR-1n无菌发酵液的抑菌研究
参照潘虹余等[15]的方法制备芽孢杆菌CmR-1n无菌发酵液。按1%接种量(体积分数)将CmR-1n(OD600值约为0.9)接种至LB液体培养基,分别于30 ℃和37 ℃培养48 h;CmR-1n培养物经4 ℃离心、0.22 μm无菌滤膜过滤,分别获得30 ℃培养48 h和37 ℃培养48 h的CmR-1n无菌发酵液。参照1.3.3节方法检测CmR-1n无菌发酵液对黄曲霉的抑菌活性。
1.3.5 CmR-1n无菌发酵液的抑菌稳定性测定
为探究温度、pH、紫外线和贮藏方式是否影响细菌发酵液对黄曲霉的抑菌效果,本研究将改变30 ℃培养48 h的CmR-1n无菌发酵液的处理条件。具体操作如下:
a)温度处理:CmR-1n无菌发酵液在不同温度下处理30 min。温度设置分别是低于室温的4 ℃、25 ℃(室温)、高于室温的37、60、80 ℃。
b)pH处理[16]:CmR-1n无菌发酵液的pH值为6.7;用1 mol/L盐酸将CmR-1n无菌发酵液的pH值分别调至1、3和5;用1 mol/L氢氧化钠将CmR-1n无菌发酵液的pH值分别调至9、11和13;放置24 h后,再调pH值至无菌发酵液的初始pH。
c)紫外线照射处理:CmR-1n无菌发酵液于30 W紫外灯、距离为30 cm的超净工作台进行紫外照射,时间设置为0 min(对照)和15~60 min[16]。
d)不同贮藏方式:CmR-1n无菌发酵液分别于-20、4、25 ℃贮藏14 d。
采用菌丝生长速率法测定各处理CmR-1n无菌发酵液对黄曲霉的抑菌活性,具体方法参照1.3.3节。
1.3.6 PCR扩增CmR-1n脂肽合成酶基因
细菌小量DNA提取试剂盒分离芽孢杆菌CmR-1n的DNA,参照文献[14]方法PCR扩增CmR-1n的16S rRNA序列。PCR产物经测序、Blastn比对后,同NCBI下载的部分芽孢杆菌的16S rRNA进行多序列比对分析,Mega 7.0构建系统发育树,初步确定CmR-1n的分类地位。
PCR扩增脂肽合成相关基因(Itu、Srf、NRPS、fenB和fenD)和聚酮合成酶基因PKSI。PCR扩增体系:2×A8 PCR Master Mix(12.5 μL)、正向引物和反向引物各1 μL、CmR-1n的DNA 1 μL、ddH2O 9.5 μL。PCR反应程序:94 ℃ 5 min;94 ℃不同温度30 s(Itu 61 ℃、Srf 52 ℃、NRPS 60 ℃、fenB 56 ℃、fenD 54 ℃和PKSI 60 ℃)、72 ℃不同时间(Itu 1 min、Srf 30 s、NRPS 1 min、fenB 1 min、fenD 1 min和PKSI 30 s),30个循环;72 ℃ 10 min。1%琼脂糖凝胶检测PCR产物,送生工生物工程(上海)股份有限公司测序;测序序列经拼接/不拼接、人工校对后,进行Blastn比对分析。
1.3.7 CmR-1n脂肽粗提物对黄曲霉的抑菌活性
脂肽粗提物的制备参照MA等[17]方法。30 ℃培养48 h的CmR-1n发酵上清液,6 mol/L HCl调至pH为2,4 ℃静置22 h;低温高速离心,甲醇多次抽提沉淀;合并的甲醇抽提液进行旋转蒸发除甲醇和真空冷冻干燥,获得CmR-1n脂肽粗提物粉末[17]。
100%甲醇溶解脂肽粗提物粉末,配制质量浓度为50 mg/mL。接种黄曲霉菌丝球在PDA平板中心,在距中心2 cm处放置牛津杯;分别加150 μL的CmR-1n脂肽粗提物甲醇液(处理组)和甲醇(对照组)于牛津杯内,设置3个重复。30 ℃培养5 d后,参照刘端木等[14]的方法计算抑菌率。
2 结果与分析
2.1 拮抗黄曲霉内生细菌的初筛
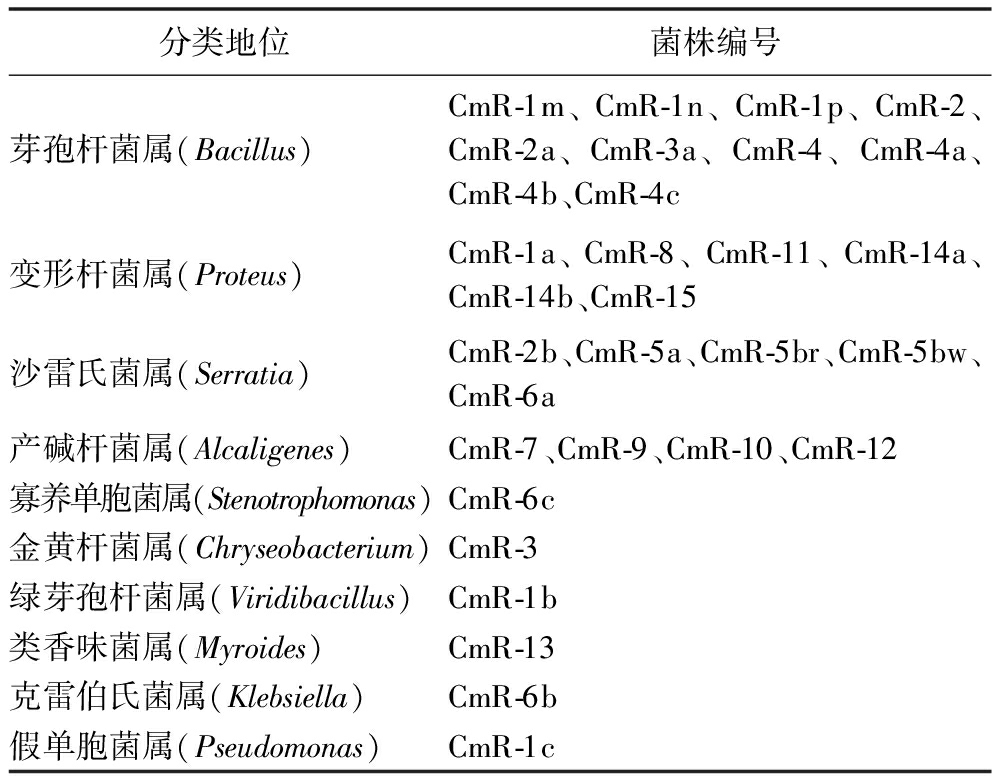
平板对峙法初筛结果显示,3株大花杓兰内生芽孢杆菌能较好地抑制黄曲霉菌丝生长,分别为CmR-1n、CmR-3a和CmR-4b(图1)。这3株芽孢杆菌对黄曲霉的抑菌率分别为57.88%、49.59%和57.37%。
A-CmR-1n对黄曲霉的拮抗;B-CmR-3a对黄曲霉的拮抗;C-CmR-4b对黄曲霉的拮抗
图1 芽孢杆菌对黄曲霉的拮抗活性
Fig.1 Antagonistic activity of Bacillus spp.against A.flavus
2.2 拮抗黄曲霉内生细菌的复筛
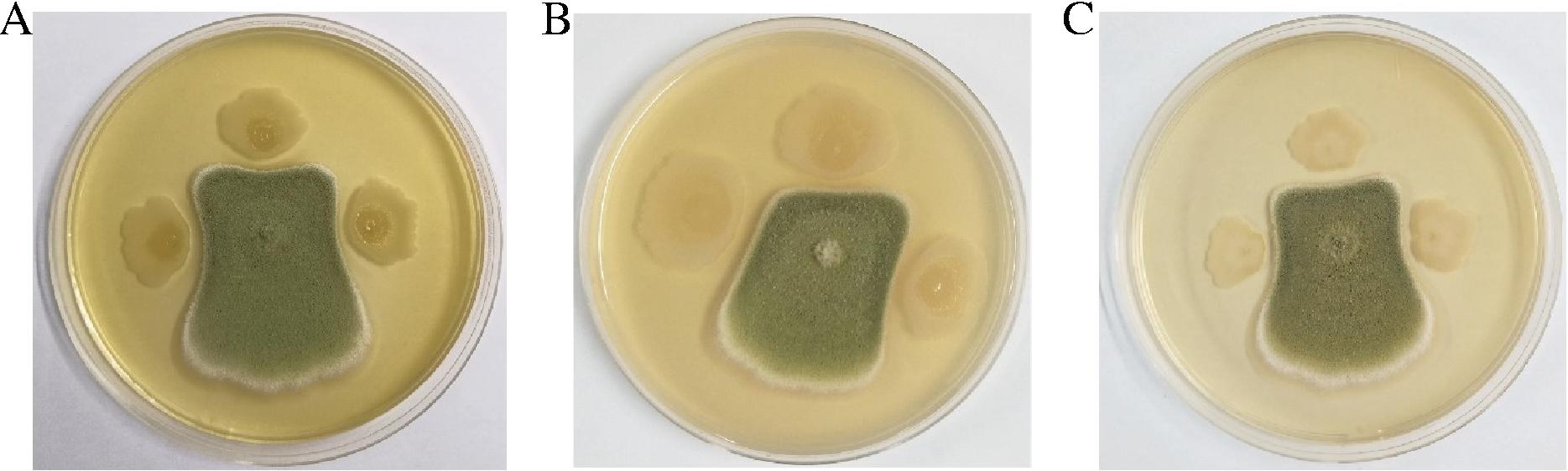
3株芽孢杆菌37 ℃培养24 h无菌发酵液对黄曲霉的抑菌效果均优于30 ℃培养24 h无菌发酵液。30 ℃培养24 h,CmR-1n无菌发酵液对黄曲霉的抑菌率为27.71%,显著高于CmR-3a和CmR-4b的抑菌率。37 ℃培养24 h,CmR-1n无菌发酵液对黄曲霉的抑菌率为41.54%,显著高于CmR-4b的抑菌率,而与CmR-3a的抑菌率(40.91%)差异不显著(图2)。图3结果显示,CmR-1n菌株30 ℃发酵48 h无菌发酵液对黄曲霉的抑菌率达63.31%,显著高于30 ℃培养24 h(27.71%)、37 ℃培养24 h(41.54%)和48 h(29.40%)的抑菌率。因此,采用30 ℃培养48 h的CmR-1n发酵液进行后续实验。
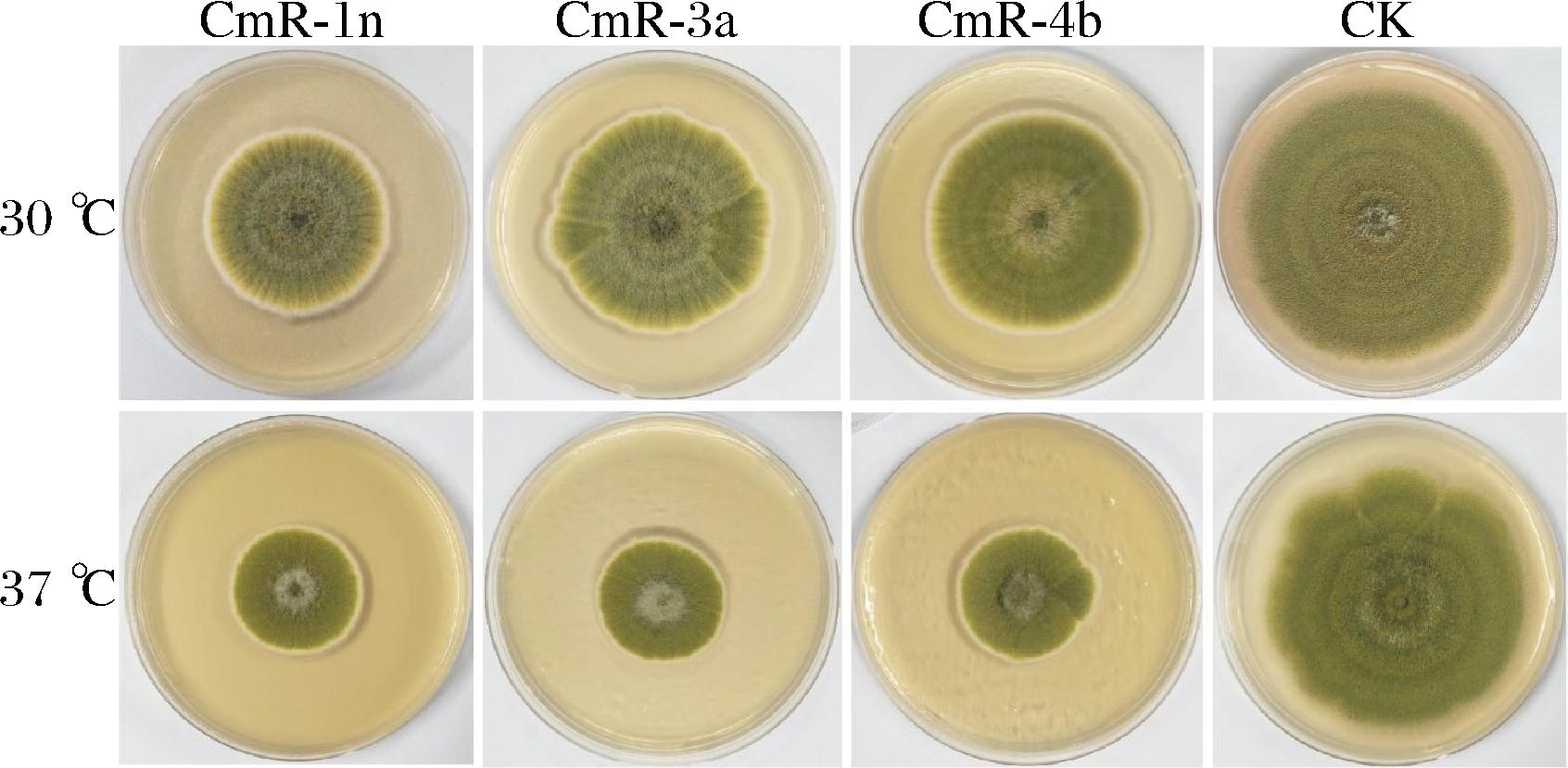
图2 芽孢杆菌24 h无菌发酵液对黄曲霉的抑菌活性
Fig.2 Antifungal activity of 24 h sterile fermentation broth of Bacillus spp.against A.flavus
A-含无菌水的PDA培养基;B-含30 ℃培养48 h无菌发酵液的PDA培养基;C-含37 ℃培养48 h无菌发酵液的PDA培养基
图3 CmR-1n无菌发酵液对黄曲霉的抑菌活性
Fig.3 Antifungal activity of CmR-1n sterile fermentation broth against A.flavus
2.3 CmR-1n无菌发酵液的抑菌稳定性分析
4、25、37、60 ℃处理的CmR-1n无菌发酵液对黄曲霉的抑菌率显著高于80 ℃处理的抑菌率(图4-A)。80 ℃处理30 min的CmR-1n无菌发酵液的抑菌率降为45.33%,但抑菌活性仍可以保持在75.00%水平,表明CmR-1n无菌发酵液具有较好的热稳定性。

A-温度对CmR-1n无菌发酵液抑菌活性的影响;B-pH对CmR-1n无菌发酵液抑菌活性的影响;C-UV照射时间对CmR-1n无菌发酵液抑菌活性的影响;D-贮藏温度对CmR-1n无菌发酵液抑菌活性的影响
图4 CmR-1n无菌发酵液的抑菌稳定性分析
Fig.4 Antifungal stability analysis of CmR-1n sterile fermentation broth against A.flavus
注:不同小写字母表示差异显著(P<0.05)。
与对照组(pH值6.7)相比,CmR-1n无菌发酵液过酸(pH<3)或过碱(pH 13)对黄曲霉的抑菌率均显著下降(图4-B)。pH 5无菌发酵液的抑菌率(61.02%)高于pH 6.7(55.34%)和pH 9(55.15%),但无显著性差异,表明CmR-1n无菌发酵液在pH 5~9对黄曲霉具有稳定的抑菌活性。
与UV照射0 min相比,UV照射15~30 min无菌发酵液的抑菌活性无显著差异,而UV照射45~60 min无菌发酵液的抑菌活性显著下降(图4-C)。UV照射45和60 min无菌发酵液仍可保持82.40%和86.65%的抑菌活性,表明CmR-1n无菌发酵液具有较好的抗紫外线稳定性。
-20、4、25 ℃贮藏14 d的CmR-1n无菌发酵液对黄曲霉的抑菌率分别为54.97%、57.29%和54.58%(图4-D),说明CmR-1n无菌发酵液具有良好的贮藏稳定性。
2.4 PCR扩增CmR-1n脂肽合成酶基因
图5展示了芽孢杆菌CmR-1n脂肽合成酶基因和多聚酮合酶基因的PCR结果。PKSI、Itu、fenB和fenD的PCR扩增条带与其理论值相一致,Srf扩增条带弱且含有非特异性扩增条带。除了PKSI,其他PCR扩增产物均测序成功。经序列拼接和人工校对后,获得1 907 bp良好的Itu序列;Blastn比对分析,发现Itu与贝莱斯芽孢杆菌(Accession NO.CP072310.1)基因组中ItuA和ItuB的部分核苷酸片段同源性为99.58%,覆盖率为100%。良好的Srf序列(655 bp)与解淀粉芽孢杆菌(Accession NO.KP453872.1)表面活性素合成酶(surfactin synthease)基因片段的同源性为100%,覆盖率为98.00%;获得1 314 bp良好的fenB序列,fenB与解淀粉芽孢杆菌(Accession NO.KF765803.1)fenB的同源性为99.77%,覆盖率为99.00%;获得1 251 bp良好的fenD序列,其与贝莱斯芽孢杆菌(Accession NO.CP021976.1)基因组中fenD的同源性为99.84%,覆盖率为100%。PCR扩增测序和Blastn分析表明,本研究扩增到的Itu、Srf、fenB、fenD确实为伊枯草菌素、表面活性素和丰原素的相关基因片段,推测芽孢杆菌CmR-1n具有合成这3种脂肽的潜力。
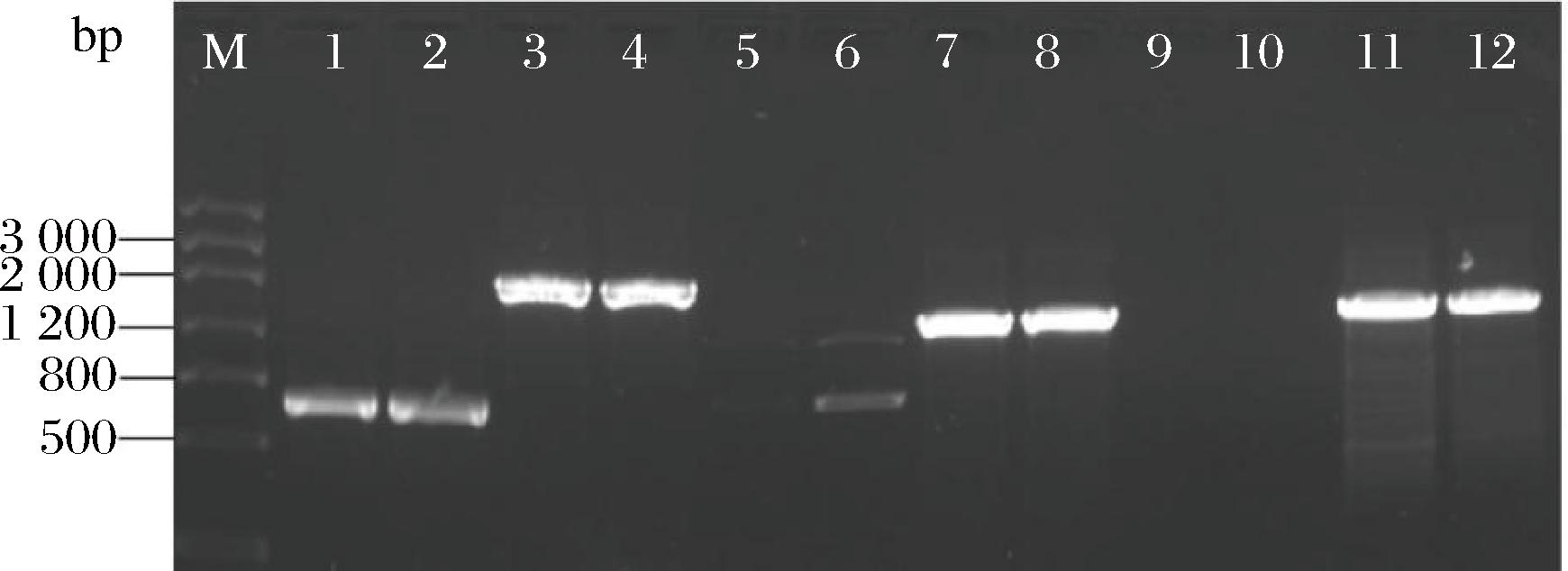
泳道M-DNA Marker Ⅲ;泳道1~2-PKSI扩增产物;泳道3~4-Itu扩增产物;泳道5~6-Srf扩增产物;泳道7~8-fenB扩增产物;泳道9~10-NRPS 扩增产物;泳道11~12-fenD扩增产物
图5 芽孢杆菌CmR-1n脂肽合成基因的PCR扩增
Fig.5 Amplification of lipopeptide related genes from Bacillus sp.CmR-1n
CmR-1n与解淀粉芽孢杆菌、暹罗芽孢杆菌和贝莱斯芽孢杆菌聚在同一进化枝,且CmR-1n与贝莱斯芽孢杆菌具有更近的亲缘关系(图6)。因此,结合CmR-1n的系统发育树及其部分脂肽基因(Itu和fenD)的序列分析,鉴定CmR-1n为贝莱斯芽孢杆菌。
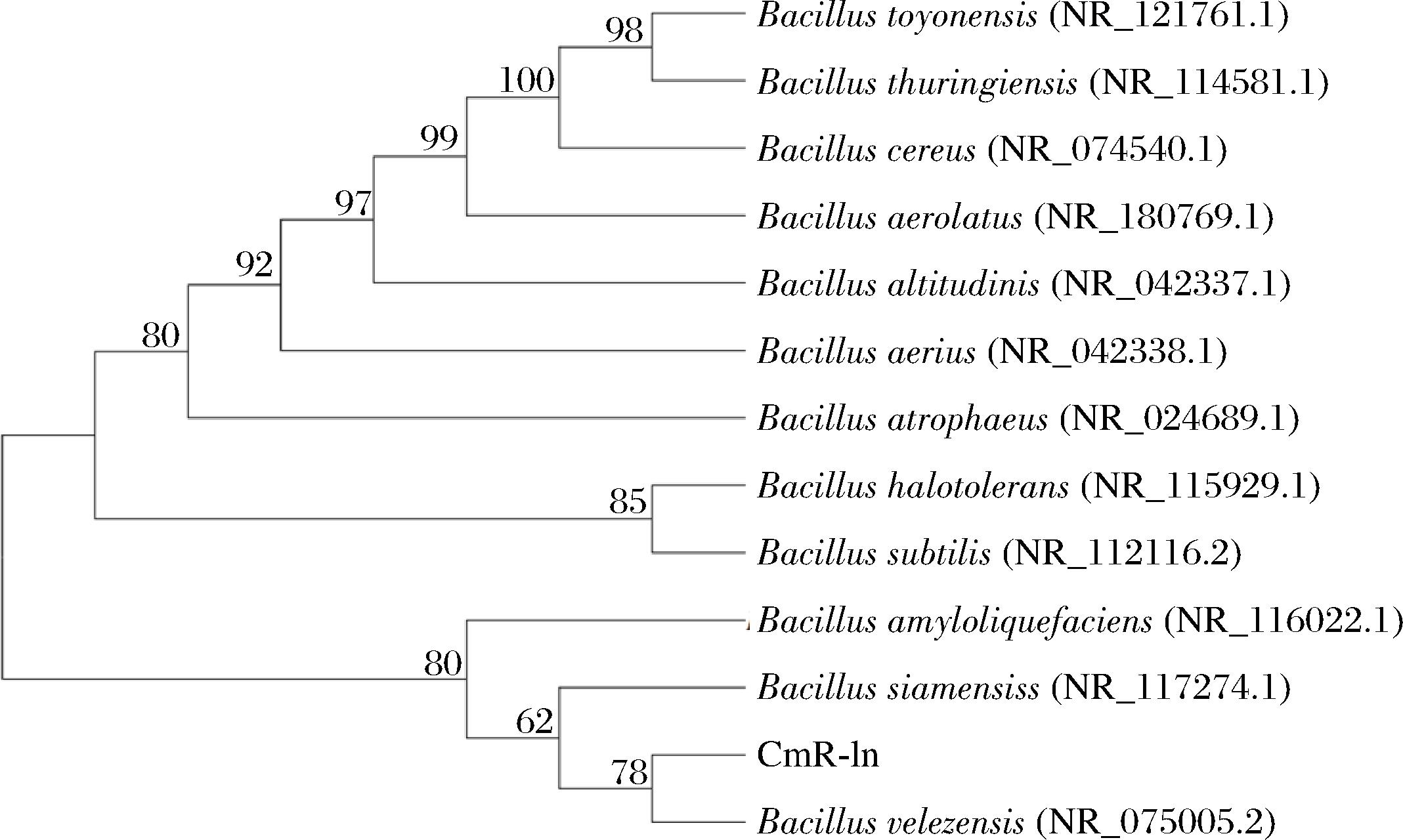
图6 CmR-1n基于16S rRNA序列的系统发育树
Fig.6 Phylogenetic tree of CmR-1n based on 16S rRNA sequences of Bacillus spp.
2.5 CmR-1n脂肽粗提物对黄曲霉的抑菌活性
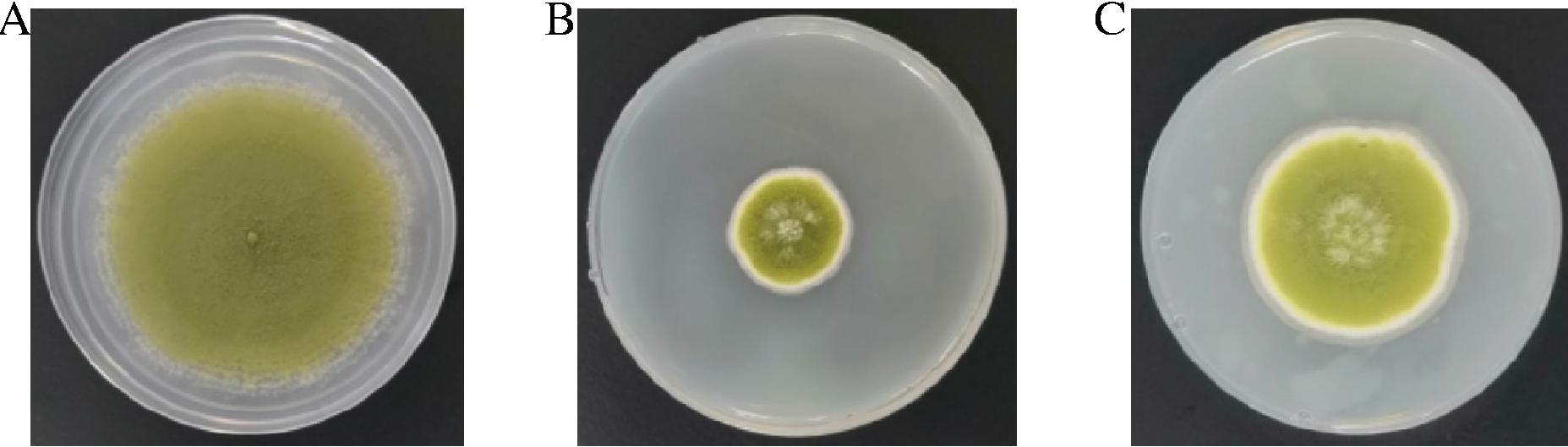
酸沉醇提制备CmR-1n脂肽粗提物,甲醇配制成50 g/L脂肽甲醇液,牛津杯法测定其对黄曲霉的抑菌活性。发现CmR-1n脂肽粗提物甲醇液对黄曲霉菌丝生长具有较好的抑制作用,抑菌率达62.58%(图7),推测CmR-1n发酵液中的脂肽可能是其抑制黄曲霉的主要活性物质。
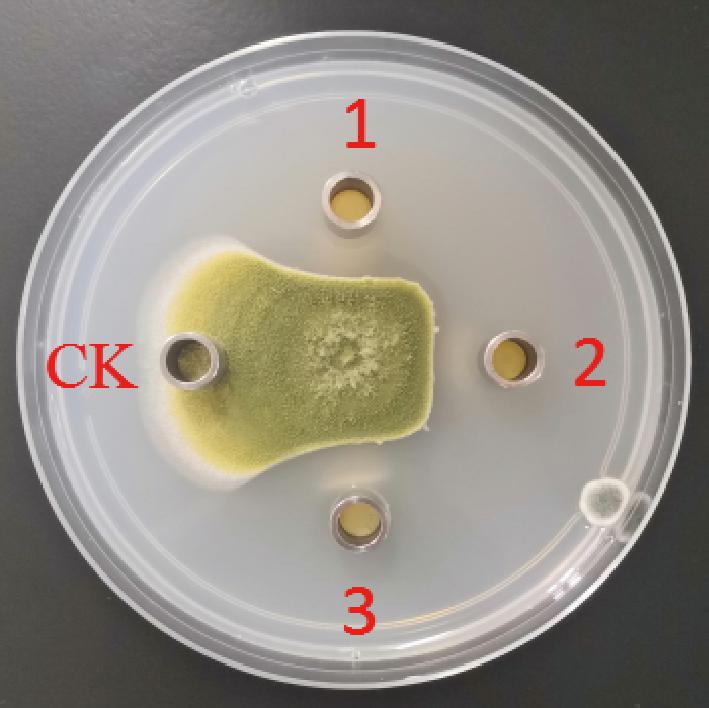
CK-150 μL甲醇;1~3-150 μL脂肽粗提物甲醇液
图7 脂肽粗提物甲醇液对黄曲霉的抑菌活性
Fig.7 Inhibition activity of crude lipopeptides against A.flavus
3 结论与讨论
黄曲霉易污染粮食、豆类及坚果,产生致癌的黄曲霉毒素,危害人类健康[18]。芽孢杆菌作为理想的生防菌,能抑制很多植物病原真菌的菌丝生长或孢子萌发[19]。本研究首次报道了药用植物大花杓兰内生贝莱斯芽孢杆菌CmR-1n对黄曲霉菌丝生长的抑制作用,平板拮抗率为57.88%。该研究结果与花生内生贝莱斯芽孢杆菌LDO2[4]、玉米种子内生解淀粉芽孢杆菌B42-3[12]能较好抑制黄曲霉菌菌丝生长的研究结果一致。CmR-1n菌株30 ℃发酵48 h的无菌发酵液对黄曲霉的抑菌效果(抑菌率63.31%)明显好于30 ℃发酵24 h(27.71%)和37 ℃发酵24 h(41.54%)的无菌发酵液,表明CmR-1n发酵液含有抑制黄曲霉生长的活性物质,且培养时间、培养温度均影响CmR-1n次级代谢产物的合成,进而影响其对黄曲霉的抑菌活性。
芽孢杆菌能产生多种抑菌活性物质,如抗菌蛋白、脂肽、挥发性有机物等[20-21]。表面活性素、伊枯草菌素和丰原素等脂肽作为芽孢杆菌的主要抑菌活性物质,具有抗菌活性强、安全性高、稳定性好等特点[22]。Bacillus subtilis合成的丰原素和表面活性素能抑制黄曲霉菌丝生长和降低开心果黄曲霉毒素AFB1含量[23]。Bacillus velezensis合成的丰原素和伊枯草菌素不仅抑制黄曲霉孢子萌发,还会引起菌丝畸形膨胀和细胞裂解;同时qRT-PCR揭示丰原素和伊枯草菌素处理还导致了黄曲霉毒素合成相关基因(aflflK,aflflR,veA,omtA)表达的下调[11]。B.subtilis E11对黄曲霉菌丝生长的抑菌率为64.27%,而对黄曲霉毒素AFB1的去除率达81.34%[24]。CmR-1n无菌发酵液能较好抑制黄曲霉菌丝生长,且具有良好的耐热性、耐酸碱性、耐紫外线性和贮藏稳定性。本研究结果与解淀粉芽孢杆菌HZM9发酵液[25]、枯草芽孢杆菌产生的多组分抗菌脂肽[26]和短小芽孢杆菌抗菌脂肽[27]具有良好稳定性相一致。PCR结果显示,CmR-1n基因组中含有Itu、Srf、fenB和fenD基因;体外试验证实CmR-1n脂肽粗提物甲醇液对黄曲霉菌丝生长的抑菌率达62.58%,表明CmR-1n有合成伊枯草菌素、表面活性素和丰原素的潜力,且脂肽可能为CmR-1n抑制黄曲霉菌丝生长的主要活性物质。CmR-1n能否真正合成上述3种脂肽组分,具体哪个组分对黄曲霉表现出抑菌活性,脂肽组分之间是否具有协同增效抑菌作用,这些问题有待深入研究。
地衣芽孢杆菌BL350-2合成的挥发性有机物对黄曲霉菌丝生长的抑菌率为88%,完全抑制黄曲霉分生孢子的萌发和黄曲霉毒素的积累[28]。固氮斯氏假单胞菌(Pseudomonas stutzeri)合成的挥发性有机物能抑制黄曲霉菌丝生长和分生孢子萌发[7]。链霉菌挥发性有机物不仅抑制黄曲霉菌丝生长、产孢及孢子萌发,还能抑制黄曲霉毒素AFB1的合成[29-30]。CmR-1n挥发性有机物能否抑制黄曲霉菌丝生长、产孢、孢子萌发及黄曲霉毒素的合成值得后续探究。本研究目前工作的完成,为将来分离鉴定抑菌活性物质、探究抑制黄曲霉的作用机制奠定理论基础,为进一步深入研发微生物菌剂用于黄曲霉污染的生物拮抗提供参考。
[1] RUSHING B R,SELIM M I.Aflatoxin B1:A review on metabolism,toxicity,occurrence in food,occupational exposure,and detoxification methods[J].Food and Chemical Toxicology,2019,124:81-100.
[2] ELAHI E,CUI W J,ZHANG H M,et al.Agricultural intensification and damages to human health in relation to agrochemicals:Application of artificial intelligence[J].Land Use Policy,2019,83:461-474.
[3] ZHAO S S,HAO X M,YANG F Y,et al.Antifungal activity of Lactobacillus plantarum ZZUA493 and its application to extend the shelf life of Chinese steamed buns[J].Foods,2022,11(2):195.
[4] CHEN L,SHI H,HENG J Y,et al.Antimicrobial,plant growth-promoting and genomic properties of the peanut endophyte Bacillus velezensis LDO2[J].Microbiological Research,2019,218:41-48.
[5] PRASERTSAN P,SAWAI B.Potential use of biofumigant from Streptomyces mycarofaciens for protection of maize seed contaminated by aflatoxin producing fungi[J].New Biotechnology,2018,44:S151.
[6] GONG A D,WU N N,KONG X W,et al.Inhibitory effect of volatiles emitted from Alcaligenes faecalis N1-4 on Aspergillus flavus and aflatoxins in storage[J].Frontiers in Microbiology,2019,10:1419.
[7] GONG A D,LEI Y Y,HE W J,et al.The inhibitory effect of Pseudomonas stutzeri YM6 on Aspergillus flavus growth and aflatoxins production by the production of volatile dimethyl trisulfide[J].Toxins,2022,14(11):788.
[8] NOGUEIRA M F,PEREIRA L,JENULL S,et al.Klebsiella pneumoniae prevents spore germination and hyphal development of Aspergillus species[J].Scientific Reports,2019,9(1):218.
[9] JIA J Y,FORD E,HOBBS S M,et al.Occidiofungin is the key metabolite for antifungal activity of the endophytic bacterium Burkholderia sp.MS455 against Aspergillus flavus[J].Phytopathology,2022,112(3):481-491.
[10] GONG A D,WANG G Z,SUN Y K,et al.Dual activity of Serratia marcescens Pt-3 in phosphate solubilizing and production of antifungal volatiles[J].BMC Microbiology,2022,22(1):26.
[11] LI S J,XU X G,ZHAO T Y,et al.Screening of Bacillus velezensis E2 and the inhibitory effect of its antifungal substances on Aspergillus flavus[J].Foods,2022,11(2):140.
[12] 姚彦坡,丁丹,张友青,等.玉米黄曲霉毒素污染生防菌筛选及菌株B42-3抗菌活性研究[J].中国粮油学报,2018,33(3):84-88.YAO Y P,DING D,ZHANG Y Q,et al.Screening of maize endophytic antagonists against Aspergillus flavus and activities research of antagonistic strain B42-3[J].Journal of the Chinese Cereals and Oils Association,2018,33(3):84-88.
[13] CHEN G J,FANG Q A,LIAO Z L,et al.Detoxification of aflatoxin B1 by a potential probiotic Bacillus amyloliquefaciens WF2020[J].Frontiers in Microbiology,2022,13:891091.
[14] 刘端木,吴怿,刘沄,等.一株产毒曲霉拮抗细菌的筛选、鉴定及抑菌活性研究[J].生物技术通报,2019,35(8):42-50.LIU D M,WU Y,LIU Y,et al.Screening,identification and antifungal properties of a bacterium with antagonistic activities against mycotoxin-producing Aspergillus spp.[J].Biotechnology Buttetin,2019,35(8):42-50.
[15] 潘虹余,金玮鋆,张晓蒙,等.解淀粉芽孢杆菌B15抑菌物质对葡萄灰霉病灰葡萄孢的抑菌机理[J].微生物学报,2018,58(7):1245-1254.PAN H Y,JIN Y J,ZHANG X M,et al.Inhibition of antifungal substances from Bacillus amyloquefaciens B15 against Botrytis Cinerea—the agent of “gray mold” of grape[J].Acta Microbiologica Sinica,2018,58(7):1245-1254.
[16] 杜宾,李娜,李燕.花椒内生细菌Y-6抗菌蛋白抑菌活性及稳定性研究[J].河南农业科学,2017,46(6):67-73.DU B,LI N,LI Y.Antagonistic activity and stability of antifungal protein of endophytic bacterium Y-6 from Zanthoxylum bungeanum against plant pathogenic fungi[J].Journal of Henan Agricultural Sciences,2017,46(6):67-73.
[17] MA Z W,ZHANG S Y,ZHANG S H,et al.Isolation and characterization of a new cyclic lipopeptide surfactin from a marine-derived Bacillus velezensis SH-B74[J].The Journal of Antibiotics,2020,73(12):863-867.
[18] MARCHESE S,POLO A,ARIANO A,et al.Aflatoxin B1 and M1:Biological properties and their involvement in cancer development[J].Toxins,2018,10(6):214.
[19] FIRA D,![]() T,et al.Biological control of plant pathogens by Bacillus species[J].Journal of Biotechnology,2018,285:44-55.
T,et al.Biological control of plant pathogens by Bacillus species[J].Journal of Biotechnology,2018,285:44-55.
[20] ZHU J X,TAN T M,SHEN A R,et al.Biocontrol potential of Bacillus subtilis IBFCBF-4 against Fusarium wilt of watermelon[J].Journal of Plant Pathology,2020,102(2):433-441.
[21] YOU W J,GE C H,JIANG Z C,et al.Screening of a broad-spectrum antagonist Bacillus siamensis,and its possible mechanisms to control postharvest disease in tropical fruits[J].Biological Control,2021,157:104584.
[22] LAIRD M,PICCOLI D,WESELOWSKI B,et al.Surfactin-producing Bacillus velezensis 1B-23 and Bacillus sp.1D-12 protect tomato against bacterial canker caused by Clavibacter michiganensis subsp.Michiganensis[J].Journal of Plant Pathology,2020,102(2):451-458.
[23] FARZANEH M,SHI Z Q,AHMADZADEH M,et al.Inhibition of the Aspergillus flavus growth and aflatoxin B1 contamination on pistachio nut by fengycin and surfactin-producing Bacillus subtilis UTBSP1[J].The Plant Pathology Journal,2016,32(3):209-215.
[24] YUAN S L,WU Y J,JIN J,et al.Biocontrol capabilities of Bacillus subtilis E11 against Aspergillus flavus in vitro and for dried red chili (Capsicum annuum L.)[J].Toxins,2023,15(5):308.
[25] 胡忠亮,郑催云,田兴一,等.解淀粉芽孢杆菌HZM9菌株发酵液的抑菌谱及稳定性测定[J].南京林业大学学报(自然科学版),2017,41(3):65-70.HU Z L,ZHENG C Y,TIAN X Y,et al.Determination of the inhibitory spectrum and stability of culture filtrate from Bacillus amyloliquefaciens HZM9[J].Journal of Nanjing Forestry University (Natural Sciences Edition),2017,41(3):65-70.
[26] 孙力军,王雅玲,刘唤明,等.抗菌豆豉发酵菌株的筛选及其脂肽组分鉴定和特性研究[J].中国生物工程杂志,2013,33(7):50-56.SUN L J,WANG Y L,LIU H M,et al.Identification of antimicrobial lipopetides component produced by isolate from Douchi and its antimicrobial properties[J].China Biotechnology,2013,33(7):50-56.
[27] 丁飞鸿,耿云龙,樊士德,等.抑制食源性致病菌脂肽的分离鉴定及生物学特性分析[J].食品与发酵工业,2022,48(6):195-203.DING F H,GENG Y L,FAN S D,et al.Isolation and identification of lipopeptides from Bacillus pumilus inhibiting foodborne pathogens and analysis of its biological characteristics[J].Food and Fermentation Industries,2022,48(6):195-203.
[28] HASSAN Z U,AL THANI R,ALNAIMI H,et al.Investigation and application of Bacillus licheniformis volatile compounds for the biological control of toxigenic Aspergillus and Penicillium spp.[J].ACS Omega,2019,4(17):17186-17193.
[29] YANG M G,LU L F,PANG J,et al.Biocontrol activity of volatile organic compounds from Streptomyces alboflavus TD-1 against Aspergillus flavus growth and aflatoxin production[J].Journal of Microbiology,2019,57(5):396-404.
[30] BOUKAEW S,PRASERTSAN P.Efficacy of volatile compounds from Streptomyces philanthi RL-1-178 as a biofumigant for controlling growth and aflatoxin production of the two aflatoxin-producing fungi on stored soybean seeds[J].Journal of Applied Microbiology,2020,129(3):652-664.