急性肾损伤(acute kidney injury,AKI)是一种常见的临床综合征,特征是肾功能突然下降或丧失。AKI的诊断依赖于肾小球滤过率下降、血清肌酐或胱抑素C升高或少尿[1]。全球每年AKI患病人数约为1 330万,在我国同期住院患者中发病率达0.3%~3.0%,死亡率达14%~42%[2],是全球需要关注的公共健康问题之一。因此,早期防治AKI以获得安全有效的治疗措施具有重要意义。
顺铂(cisplatin,CP)是一种铂类化疗药物,常用于各类癌症治疗。顺铂主要通过肾小球滤过和肾小管排泄,而肾脏是排异生物素的主要器官,当肾细胞暴露于高剂量的代谢物中便会导致肾毒性[3],而化学药物引起的肾毒性是AKI发生的主要原因。
顺铂过量致AKI的发病机制是多因素的,包括氧化应激、炎症、细胞凋亡等。转录因子NF-E2(nuclear factor erythroid 2-related factor 2,Nrf2)是细胞保护蛋白表达的主要调节剂,由抗氧化响应元件(antioxidant response element,AREs)驱动,在调节机体细胞氧化还原稳态中起决定性作用。血红素氧合酶-1(heme oxygenase-1,HO-1)是Nrf2的下游靶基因之一,在Nrf2介导的抗氧化过程中被认为是一个关键的媒介分子[4]。Nrf2/HO-1通路也是机体中重要的抗氧化系统之一。
驼乳(camel milk,CM)是干旱和半干旱地区必不可少的食物来源,是喂养成人和婴儿以及生产酸奶、奶酪、奶油和黄油等许多乳制品的最佳替代品之一[5]。其含有丰富的免疫球蛋白、乳铁蛋白及各种生长因子;也含有人体所必需的氨基酸、多种维生素、矿物质等。驼乳不仅能够给人体提供较高的营养价值,也可调节人体代谢,提高机体免疫力[6]。研究表明,驼乳能有效预防糖尿病[7],辅助治疗皮肤疾病[8]、脂肪肝[9]、急性呼吸窘迫综合征[10]、胃溃疡、肠胃炎、癌症等多种疾病[11]。ESLAMI等[12]总结出低脂乳制品可以预防慢性肾病和肾功能的下降,其中驼乳具有抗氧化、调节脂质代谢和糖代谢的作用。本研究基于顺铂诱导AKI的发病机制,研究驼乳是否通过调控Nrf2/HO-1通路来减轻顺铂的肾毒性,进而预防顺铂引起的氧化应激与炎症反应。
1 材料与方法
1.1 材料与试剂
驼乳采自阿拉善右旗一牧场。离心(4 000 r/min,30 min)去除上层乳脂,65 ℃水浴加热30 min再真空冷冻干燥后,放置于-20 ℃密封保存并备用。
SPF(specific pathogen free)级雄性C57BL/6小鼠[许可证号:SCXK(京)2019—0010],体重18~22 g,斯贝福(北京)生物技术有限公司;小鼠血尿素氮(blood urea nitrogen,BUN)、血清肌酐(serum creatinine,Cre)、中性粒细胞明胶酶相关载脂蛋白(neutrophil gelatinase associated lipocalin,NGAL)、氧化指标超氧化物歧化酶(superoxide dismutase,SOD)、肾损伤分子-1(kidney injury molecule 1,Kim-1)、谷胱甘肽(glutathione,GSH)、丙二醛(malondialdehyde,MDA)、活性氧(reactive oxygen species,ROS)、TNF-α、IL-1β,IL-6 ELISA试剂盒,上海酶联生物科技有限公司;TUNEL试剂盒,瑞士Roche公司;cDNA试剂盒与qPCR SYBR Green Mix试剂盒,Takara公司。
1.2 仪器与设备
LightCycler 96实时荧光定量仪,瑞士Roche公司;Applied Biosystems PCR仪,美国赛默飞世尔科技公司;PiLot2-4LD真空冷冻干燥机,博医康(北京)仪器有限公司;5810R高速冷冻离心机,德国Eppendorf艾本德公司;Elx808Bio Tack酶标仪,美国伯腾仪器有限公司。
1.3 实验方法
1.3.1 分组及AKI模型的建立
在鼠笼饲养(individual ventilaion cage,IVC)动物实验系统内进行饲喂C57BL/6雄性小鼠[n=40,6~8周龄,体重(20±2) g],室温[(23±2) ℃],昼夜循环12 h,相对湿度50%~60%。首先对小鼠适应性饲喂1周,期间随意饮水和进食标准饲料(按照美国NRC标准生产的、符合标准规定的卫生和营养素要求的饲料:LAD 2 000A饲料)。随后对小鼠进行编号并称重,随机分为5组,正常对照组(NC,n=8),模型组(Mo,n=8),驼乳治疗组(CM,n=8),牛乳治疗组(BM,n=8)和阳性对照组(NT,n=8)。NC组与Mo组灌胃灭菌蒸馏水,CM组灌胃脱脂驼乳粉溶液(4.5 g/kg bw),BM组灌胃脱脂牛乳粉溶液(4.5 g/kg bw),NT组灌胃尿毒清颗粒(4.16 g/kg bw)。灌胃体积为0.2 mL,每日1次,连续灌胃2周,每3天记录1次体重(1、4、7、10、14 d)。第14天除NC组外各组均腹腔注射15 mg/kg顺铂,诱导AKI模型(图1),72 h后记录小鼠体重(d17),禁食不禁水6 h后,对小鼠实施安乐死。采集血样进行血清分离,并立即收集肾脏组织,称量肾脏重量,其中1个肾放入4%多聚甲醛中保存,另一个肾在-80 ℃下冷冻保存。
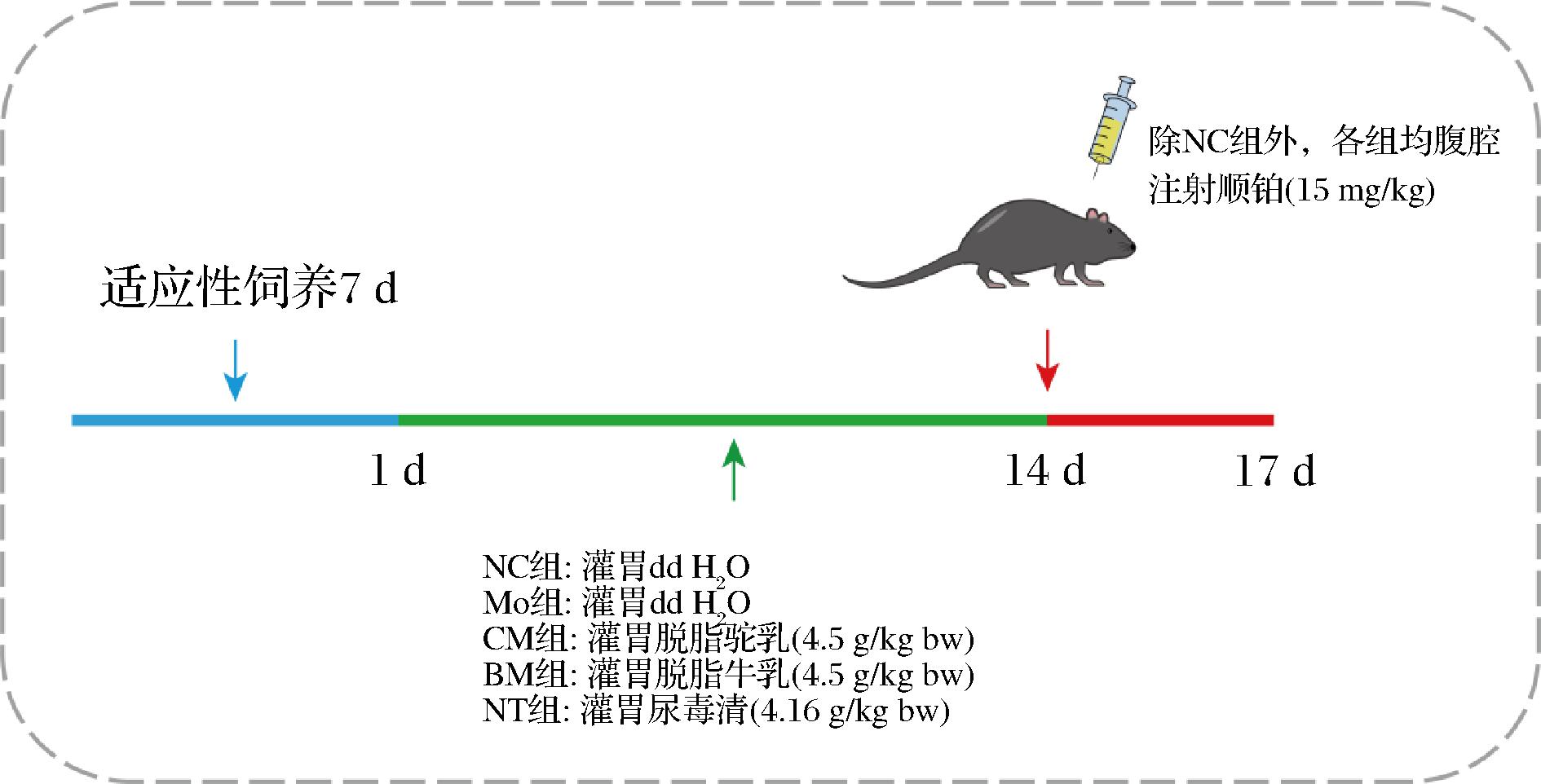
图1 动物分组模型图
Fig.1 Animal grouping model diagram
1.3.2 指标检测
1.3.2.1 小鼠肾毒性标志物含量的检测
取约0.1 g肾组织置于匀浆仪上冰浴匀浆(2.90 m/s,时间30 s,3次),并进行离心(4 ℃,3 000 r/min,20 min)制备肾组织匀浆液,取上清液分装备用。新鲜血液常温下静置25 min,离心分离血清(4 ℃,3 000 r/min,30 min),备用。按照ELISA试剂盒说明书操作,检测并计算小鼠血清中BUN与Cre、肾脏组织中NGAL、Kim-1的含量。
1.3.2.2 小鼠血清氧化指标的测定
取分装后的血清,按照ELISA试剂盒说明书测定血清中氧化指标SOD、GSH、MDA和ROS的含量。
1.3.2.3 小鼠肾脏组织炎性指标的测定
取分装后的肾脏上清液,按照ELISA试剂盒说明书测定促炎因子TNF-α、IL-1β和IL-6含量。
1.3.3 肾脏组织病理学
参考ZHAO等[13]的染色方法,取出小鼠肾脏组织立即放入4%多聚甲醛中,固定后石蜡包埋,乙醇脱水,切片3 μm。苏木精-伊红(hematoxylin-eosin staining,HE)染色可用来观察肾组织病理学改变,更能直观看出驼乳对肾脏的预防保护作用。HE切片检查肾小管损伤的征象,如肾小管扩张、间质水肿、细胞坏死和空泡化等。
1.3.4 TUNEL染色
小鼠肾脏在4%多聚甲醛中固定过夜,乙醇脱水,石蜡包埋,脱蜡至水,柠檬酸微波修复,37 ℃孵育1 h荧光tunel孵育液;经PBS清洗后,进行DAPI染核,甘油明胶封片,最后进行镜检。光学显微镜下,正常细胞核呈蓝光,凋亡细胞核呈绿光,并且与蓝光重合,采集分析肾脏的相关部位,计算肾脏细胞凋亡率。
1.3.5 实时荧光定量PCR(quantitative real-time polymerase chain reaction,qPCR)
首先对肾脏样品进行称重和研磨,采用Trizol法提取总RNA,再利用Takara反转录试剂盒获取cDNA。使用SYBR Green Mix试剂盒在Light Cycler 96实时荧光定量仪上进行qPCR检测小鼠肾组织中Nrf2、HO-1、IL-6、IL-1β、TNF-α的mRNA表达量。通过2-ΔΔCt法[11]计算mRNA表达。
1.4 统计学分析
采用SPSS 26统计软件对血清及肾脏生化指标数据进行统计学分析,方法采用单因素方差(one way ANOVA)进行统计;Pearson或Speraman行相关性分析。P<0.05为统计学上有显著差异。统计学计算得出的图、表采用Graphpad Prism 8软件制作。
2 结果与分析
2.1 驼乳预防急性肾损伤对小鼠体重及肾体指数的影响
如图2-A所示,与对照组相比,摄入顺铂后各组小鼠体重骤降,而CM组体重显著高于Mo组(P<0.05),表明通过驼乳预处理能缓解顺铂诱导小鼠AKI后小鼠体重迅速下降这一现象。如图2-B所示,Mo组小鼠肾体指数与NC组存在显著差异(P<0.05),CM组与Mo组相比有显著差异(P<0.05),说明驼乳的干预能改善急性肾损伤小鼠肾体指数。

A-体重;B-肾体指数(肾脏重量/体重);C-BUN;D-Cre;E-Kim-1;F-NGAL
图2 驼乳对小鼠体重、肾体指数及肾毒性标志物的影响
Fig.2 Effects of camel milk on body weight,renal body index and renal toxicity markers in mice
注:不同字母表示组间有显著性差异(P<0.05)(下同)。
2.2 驼乳预防急性肾损伤对小鼠肾毒性标志物的影响
血清中的BUN和Cre是评价机体肾功能的重要指标,其中BUN是机体代谢的主要产物,肾功能不全时其水平会升高,可作为早期鉴定肾损伤的标志性指标;Cre能较准确反映肾小球的滤过功能,在肾损伤时水平呈上升趋势。图2-C、图2-D显示,与NC组相比,Mo组血清BUN、Cre含量显著上升(P<0.05);与Mo组相比,CM、BM和NT组血清BUN、Cre含量均显著下降(P<0.05)。因此表明驼乳干预能改善顺铂引起的肾损伤。
NGAL可以在肾脏的中性粒细胞和上皮细胞中表达,若发生肾损伤,NGAL合成分泌水平会显著增加[11];Kim-1是一种1型跨膜蛋白,会在去分化近端小管细胞中表达,若肾脏出现局部缺血或毒性损伤,其表达水平会上升[11]。图2-E、图2-F显示,与NC组相比,Mo组肾脏Kim-1与NGAL水平显著升高(P<0.05);与Mo组相比,CM与NT组Kim-1与NGAL含量显著下降(P<0.05)。综上所述,在顺铂刺激下肾脏组织中Kim-1和NGAL的含量升高,这在一定程度上反映出小鼠肾脏产生了严重的肾小管损伤。然而通过驼乳干预能明显降低肾脏中Kim-1和NGAL的含量,从而改善小鼠肾脏组织的损伤。
2.3 驼乳预防急性肾损伤对小鼠血清氧化指标的影响
SOD、GSH是肾脏中重要的抗氧化酶,可显示肾脏抗氧化能力的强弱。MDA是脂质氧化的产物,能促进ROS的产生,可间接反映抗氧化能力。ROS过量会引发肾细胞的氧化应激,进而引起炎症反应。如图3-A、图3-B所示,与NC组相比,Mo组血清SOD、GSH含量均显著下降(P<0.05);与Mo组相比,CM组SOD与GSH含量均升高,其升高趋势与NT阳性对照组相近。图3-C、图3-D显示,与NC组相比,Mo组血清MDA、ROS含量显著升高(P<0.05);与Mo组相比,CM组血清MDA和ROS含量显著下降(P<0.05)。由此表明,驼乳干预会增加顺铂诱导的抗氧化酶物质含量,即增加抗氧化能力,同时降低顺铂诱导的氧化物和氧化产物含量上升,缓解氧化损伤。
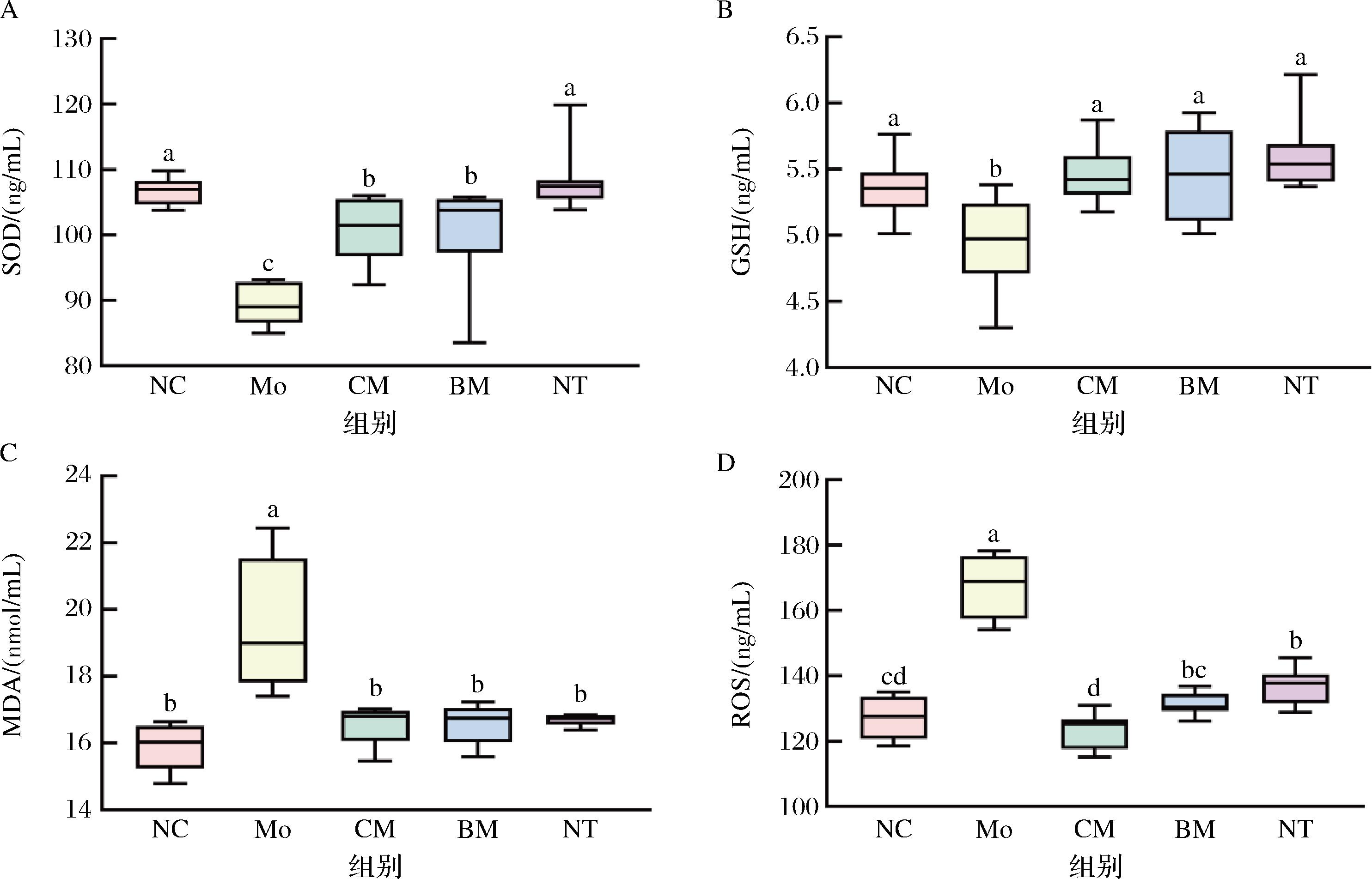
A-SOD;B-GSH;C-MDA;D-ROS
图3 驼乳对小鼠肾脏氧化指标的影响
Fig.3 Effect of camel milk on oxidative indices in mice kidney
2.4 驼乳预防急性肾损伤对小鼠肾脏组织炎症指标的影响
肾组织受损导致炎性细胞浸入,并释放出TNF-α、IL-1β、IL-6等促炎因子,促使白细胞渗入,从而加重肾损伤。如图4所示,与NC组相比,Mo组肾脏TNF-α、IL-6含量明显增加(P<0.05),IL-1β含量升高但没有显著性差异。与Mo组相比,CM组肾脏IL-6、IL-1β、TNF-α含量显著降低(P<0.05)。结果表明,驼乳干预能降低肾脏中促炎细胞因子的含量抑制肾脏炎症反应。
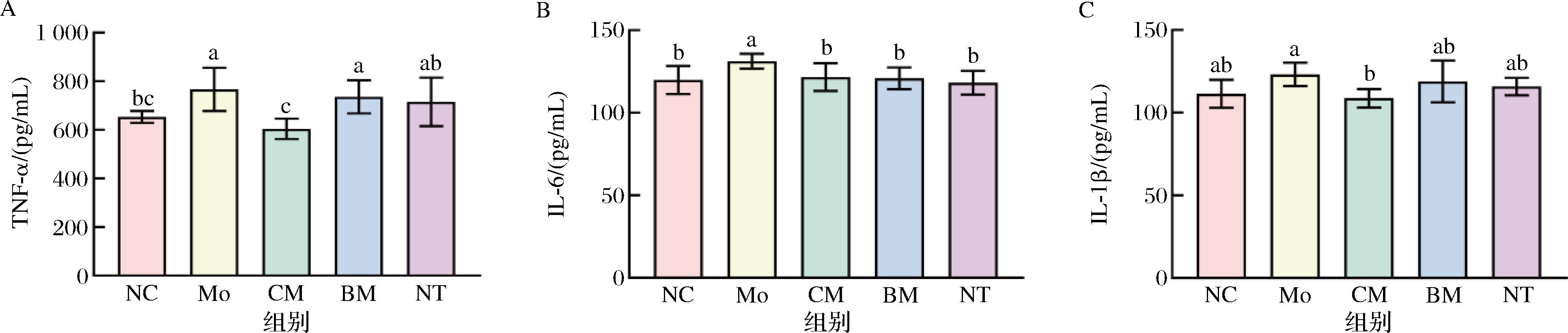
A-TNF-α;B-IL-6;C-IL-1β
图4 驼乳对肾脏炎症指标的影响
Fig.4 Effect of camel milk on renal inflammatory indices
2.5 HE染色
如图5所示,NC组小鼠肾小球与肾小管结构清晰完整,形态结构未见异常。与NC组相比,Mo组小鼠肾脏组织呈现明显的病理性改变,主要表现为肾小球收缩畸形,肾小管扩张和坏死,出现蛋白质沉淀,肾间质有炎性细胞浸润。驼乳干预的小鼠肾组织切片显示出肾小管上皮细胞坏死减少、无明显炎性浸润。BM组小鼠肾脏组织出现肾小球收缩与畸变,CM组效果与NT组相似,肾小球恢复正常,炎性细胞减少,但NT组小鼠肾组织内出现蛋白管型,极可能由于肾脏受损,药物与肾脏内的蛋白质结合形成较多蛋白样物质沉积。结果表明,驼乳干预能减轻小鼠肾组织病理损伤并得到显著改善。
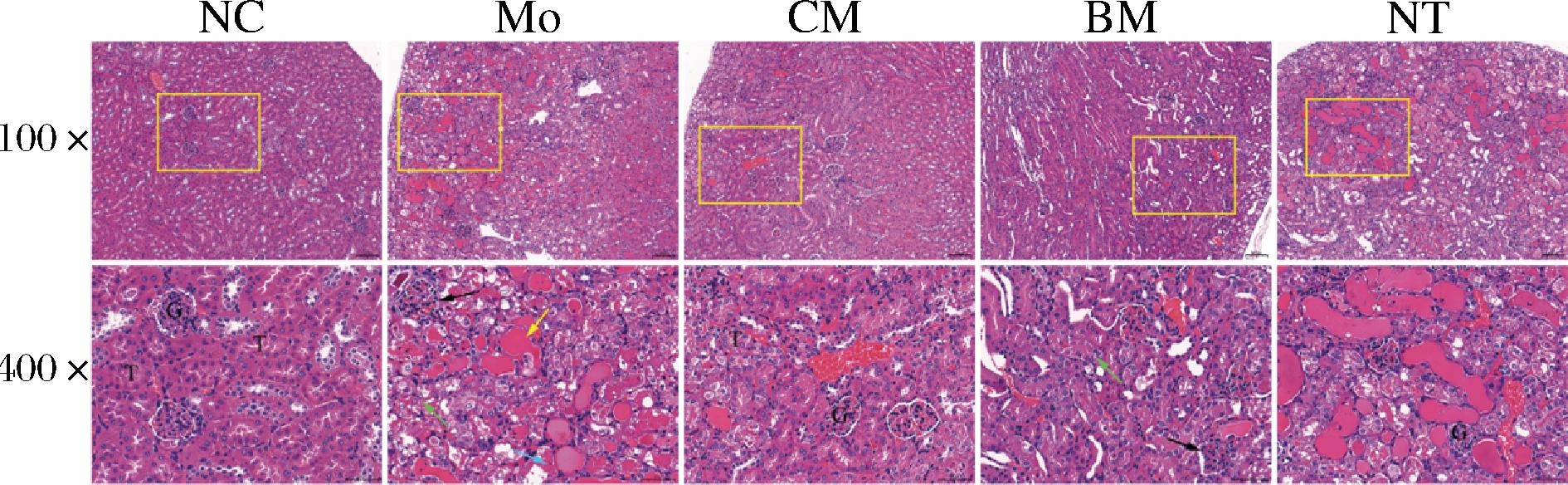
图5 不同处理组肾脏的病理组织变化
Fig.5 Pathological changes of kidney in different treatment groups
注:正常的肾小球(G)和肾小管(T);肾小球收缩和畸形(黑色箭头);肾小管扩张坏死(绿色箭头);出现蛋白样物质沉积(黄色箭头);间质内炎细胞浸润(蓝色箭头),H&E,比例尺=50 μm。
2.6 TUNEL染色
肾脏细胞凋亡是顺铂导致肾损伤的重要机制。将5组小鼠的肾脏标本进行TUNEL染色。如图6所示,结合TUNEL染色图与细胞凋亡率统计图发现NC组肾脏组织中有极少量TUNEL标记的亮绿色荧光,说明细胞基本无凋亡情况。Mo组中能观察到大量凋亡细胞,表明顺铂导致肾组织中细胞凋亡增加。与Mo组相比,驼乳干预后,CM组TUNEL阳性荧光的凋亡细胞显著降低,表明驼乳可以减轻顺铂引起的急性肾损伤。NT组与CM组效果相似。
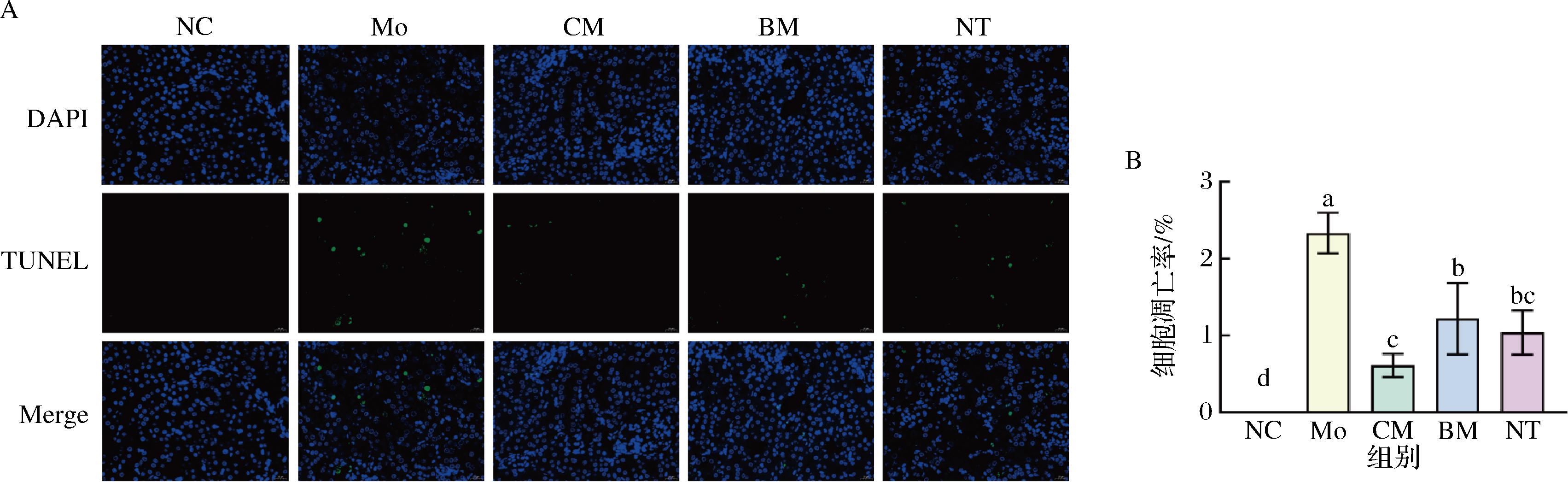
A-TUNEL染色(其中DAPI-荧光染料标记细胞核;TUNEL-TUNEL染料标记凋亡细胞核;Merge-混合光);B-细胞凋亡率
图6 小鼠肾脏组织内TUNEL染色代表性显微图片(400×)、细胞凋亡率
Fig.6 Typical micrograph of TUNEL staining in mouse kidney tissue (400×) and apoptosis rate
2.7 qPCR结果分析
为了探究驼乳对顺铂诱导的急性肾损伤的预防作用是否与Nrf2/HO-1通路有关,选取小鼠肾组织中Nrf2、HO-1、IL-6、IL-1β、TNF-α 5个炎症相关的mRNA水平进行qPCR测定,结果如表1所示。与NC组相比,Mo组的IL-6、IL-1β、TNF-α的mRNA表达量显著上升(P<0.05),Nrf2、HO-1的mRNA表达量显著降低。与Mo组相比,CM组的IL-6、IL-1β、TNF-α mRNA表达量显著降低(P<0.05),而Nrf2、HO-1的mRNA表达量显著升高(P<0.05)。由此说明驼乳干预通过影响Nrf2/HO-1通路上的基因,可缓解顺铂诱导AKI的炎症反应。
表1 小鼠肾组织中Nrf2、HO-1、IL-6、IL-1β、TNF-α mRNA表达水平比较
Table 1 Comparison of Nrf2,HO-1,IL-6,IL-1β,and TNF-α mRNA expression levels in mouse kidney
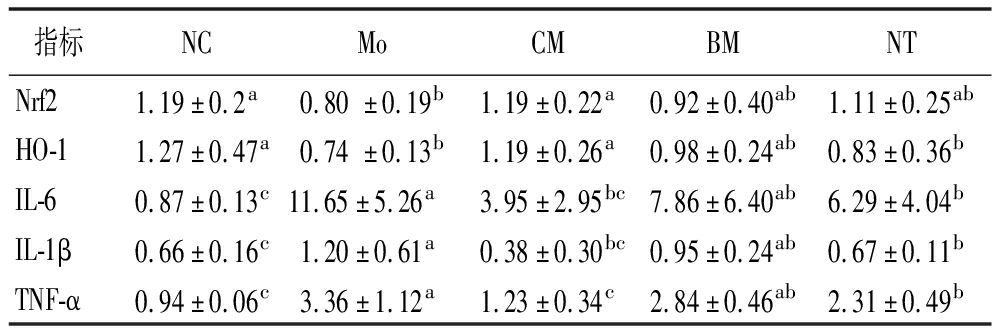
指标NCMoCMBMNTNrf21.19±0.2a0.80±0.19b1.19±0.22a0.92±0.40ab1.11±0.25abHO-11.27±0.47a0.74±0.13b1.19±0.26a0.98±0.24ab0.83±0.36bIL-60.87±0.13c11.65±5.26a3.95±2.95bc7.86±6.40ab6.29±4.04bIL-1β0.66±0.16c1.20±0.61a0.38±0.30bc0.95±0.24ab0.67±0.11bTNF-α0.94±0.06c3.36±1.12a1.23±0.34c2.84±0.46ab2.31±0.49b
注:同一行不同字母表示组间有显著性差异(P<0.05)。
2.8 各指标与qPCR基因表达的相关性分析
通过对血清指标(SOD、GSH、ROS、MDA)、肾脏指标(BUN、Cre、NGAL、Kim-1)、炎症因子(TNF-α、IL-1β、IL-6)与qPCR基因(IL-6、IL-1β、TNF-α、Nrf2、HO-1)表达数据进行相关性分析,确定是否存在基因表达与相应指标之间的关联,从而揭示以上基因是否与肾脏功能障碍相关,并提供关于肾脏疾病机制的线索。如图7所示,血清MDA、ROS、GSH与qPCR IL-6、IL-1β、TNF-α、Nrf2呈正相关性(r=0.887、0.676、0.771、0.142;r=0.761、0.758、0.808、0.055;r=0.313、0.303、0.156、0.833),而SOD与qPCR IL-6、IL-1β、TNF-α呈负相关性(r=-0.169、-0.032、-0.237),与qPCR Nrf2、HO-1呈正相关性(r=0.656、0.521)。肾脏指标、炎症因子均与qPCR IL-6、IL-1β、TNF-α呈正相关性(P<0.05),IL-6、IL-1β与qPCR Nrf2、HO-1呈正相关性(P<0.05),BUN与qPCR Nrf2、HO-1呈负相关性(P<0.05)。以上说明这些基因表达与肾脏细胞损伤和肾功能障碍有关,在肾脏中存在炎症和免疫反应,并对BUN、Cre、NGAL、Kim-1等指标产生影响。
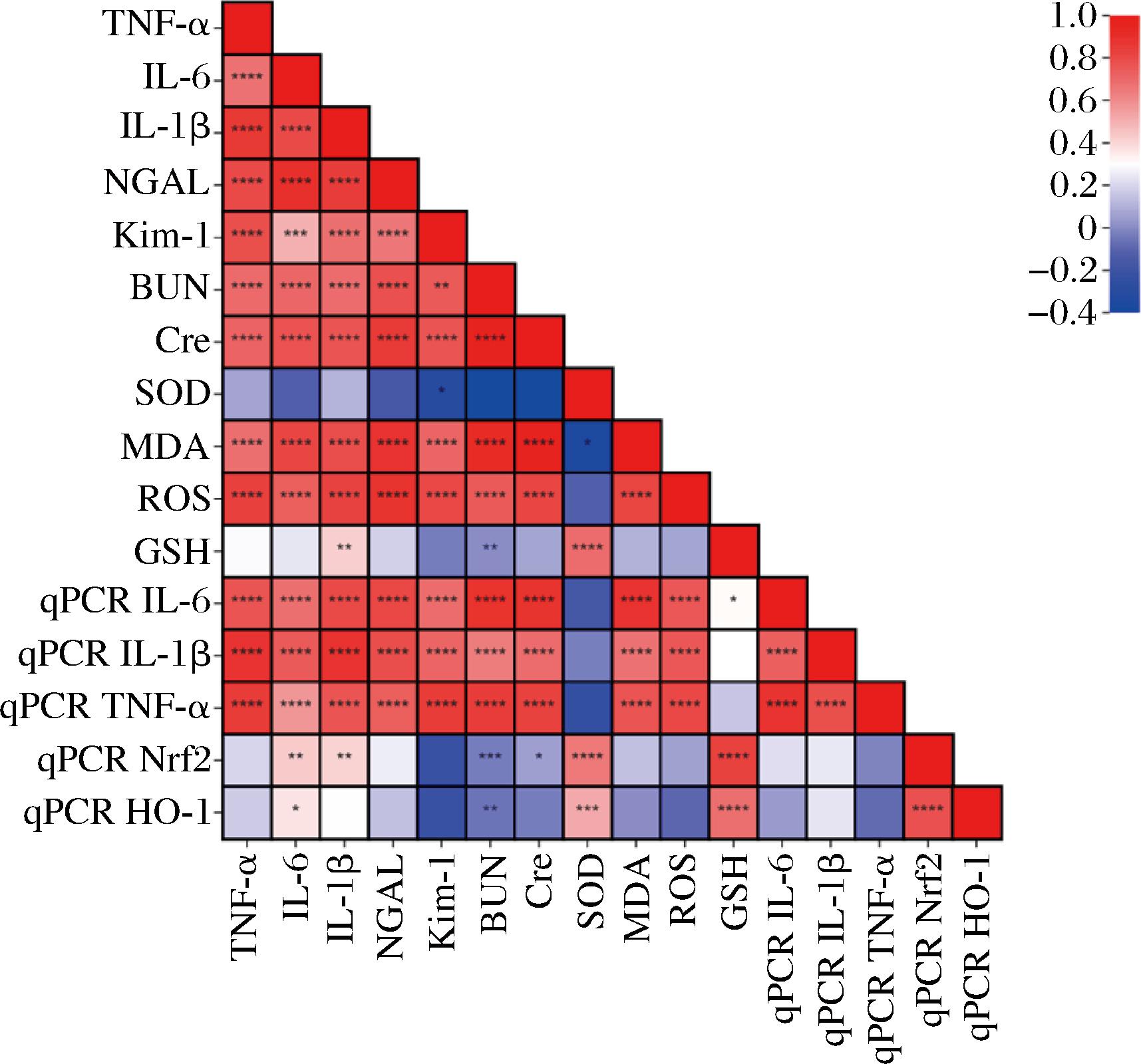
图7 血清、肾脏指标与qPCR基因表达量的相关性热图
Fig.7 Heat map of correlation between serum and kidney indexes and qPCR gene expression
3 结论与讨论
AKI在全球的发病率逐年升高,也是慢性肾脏疾病和慢性肾功能衰竭的重要诱因,其中因药物引发肾毒性是AKI的主要病因之一。本研究结果显示,Mo组小鼠肾脏NGAL、血清BUN与Cre含量显著高于NC组,且Mo组肾脏染色切片可明显观察到肾小球收缩畸形,肾小管扩张、坏死,肾间质伴有炎性浸润等现象,参考PRASAD等[17]、ZHANG等[18]的顺铂致AKI小鼠模型的建立与诊断方法,成功建立了小鼠AKI模型。与Mo组相比,驼乳干预使血清BUN、Cre与肾脏NGAL、Kim-1含量显著降低,组织病理学损伤有一定程度的改善,由此说明驼乳干预能够改善顺铂诱导的AKI小鼠肾功能障碍与组织病理学损伤。
在各种病理条件下,氧化应激与AKI的发生和发展密不可分。氧化应激是由于ROS的产生或抗氧化能力的降低而引起的,后者降低主要由Nrf2所致。有研究表明,在应激条件下,Nrf2被有效激活以触发内源性抗氧化防御系统,并通过调节多种抗氧化剂和II期解毒酶来调节ROS的产生和生物代谢[19]。顺铂的过量摄入会抑制Nrf2/HO-1通路的表达,使Nrf2驱动的HO-1转录下调,导致MDA与ROS水平增加,激活IκBα磷酸化从而促进细胞氧化应激并促进磷酸化核转录因子κB(NF-κB)活化[20],进而增加TNF-α、IL-1β、IL-6等促炎因子的产生,从而导致肾损伤。
本试验结果显示,Mo组SOD和GSH含量显著下降,MDA与ROS含量显著上升,表示Mo组小鼠体内发生了严重的氧化应激症状,这与符贻武等[21]试验结果一致。驼乳干预后,小鼠SOD和GSH含量均显著上调,MDA与ROS含量显著下降,这一结果说明驼乳提前干预会增强小鼠抗氧化能力,降低氧化产物含量上升,从而缓解氧化应激导致的肾损伤。同时,驼乳干预能上调顺铂诱导AKI小鼠肾组织中Nrf2、HO-1 mRNA表达量,下调IL-6、IL-1β、TNF-α的mRNA表达量,由此说明驼乳的干预可能激活了Nrf2/HO-1通路上抗氧化损伤功能,进一步影响该途径的炎性因子,可达到预防及辅助治疗AKI炎症的效果。本次试验中,Mo组肾组织中TNF-α、IL-1β、IL-6含量显著上升,这与YUAN等[22]的试验结果一致,说明该组小鼠机体内发生了炎症反应。而驼乳干预显著降低了顺铂诱导AKI小鼠的TNF-α、IL-1β、IL-6等促炎因子的含量,结合以上试验表明驼乳干预在Nrf2/HO-1通路上降低了小鼠炎症反应,进而缓解AKI。
在以往动物实验中,HAMED等[23]发现发酵驼乳能有效地抑制四氯化碳(CCl4)诱导的氧化应激,有助于预防肾脏损伤。ARAB等[24]研究发现驼乳干预可改善环孢霉素诱导的大鼠肾毒性,达到抑制氧化应激的作用。ARAB等[25]研究发现驼乳的摄入通过减弱p38/ERK/JNK MAPK和NF-κB通路,来抑制环孢霉素引发的肾脏炎症。ARAB等[26]研究结果首次明确了驼乳通过清除ROS、抑制MAPKs和NF-κB以及激活PI3K/Akt/eNOS通路方式对肾起保护作用。驼乳干预减轻顺铂所致的氧化应激与炎症反应,这归因于其丰富的营养物质,具体是哪种物质发挥作用还需要进一步试验进行验证。
本研究首先对小鼠进行2周驼乳干预,再腹腔注射顺铂建立AKI模型。通过检测血清与肾脏生化指标分析驼乳对小鼠急性肾损伤的预防作用,对肾脏组织进行HE染色、TUNEL染色,分别观察其病理学与肾脏细胞凋亡情况,再对小鼠进行qPCR测定进一步探索驼乳在Nrf2/HO-1通路中的护肾作用机制。通过驼乳干预小鼠可有效降低小鼠肾毒性标志物BUN、Cre、Kim-1和NGAL的含量,显著增加血清中SOD与GSH含量;降低MDA与ROS水平,并抑制促炎因子IL-6、IL-1β、TNF-α的上升。最后通过qPCR分析得出驼乳的干预能激活Nrf2/HO-1通路上抗氧化损伤功能,降低了小鼠炎症反应,达到预防及辅助治疗AKI的效果。
[1] LAMEIRE N,VAN BIESEN W,VANHOLDER R.Acute kidney injury[J].The Lancet,2008,372(9653):1863-1865.
[2] 庞浩文,安宁,杨陈,等.Th17细胞及IL-17在急性肾损伤中作用的研究进展[J].临床肾脏病杂志,2021,21(11):944-950.PANG H W,AN N,YANG C,et al.Research advances in functional roles of Th17 and IL-17 in acute kidney injury[J].Journal of Clinical Nephrology,2021,21(11):944-950.
[3] HAMED H,GARGOURI M,BOULILA S,et al.Fermented camel milk prevents carbon tetrachloride induced acute injury in kidney of mice[J].The Journal of Dairy Research,2018,85(2):251-256.
[4] 于冬冬,王永欣,庄语,等.基于Nrf2-HO-1信号通路的针灸改善顺铂肾损伤小鼠的作用机制研究[J].时珍国医国药,2022,33(11):2794-2797.YU D D,WANG Y X,ZHUANG Y,et al.Mechanism of acupuncture based on Nrf2/HO-1 signaling pathway in improving cisplatin induced renal injury in mice[J].Lishizhen Medicine and Materia Medica Research,2022,33(11):2794-2797.
[5] BAKRY I A,YANG L,FARAG M A,et al.A comprehensive review of the composition,nutritional value,and functional properties of camel milk fat[J].Foods,2021,10(9):2158.
[6] 蔡树东,黄浩,阿里甫·努肉力,等.骆驼乳对疾病辅助治疗作用研究进展[J].中国草食动物科学,2019,39(6):52-55.CAI S D,HUANG H,ALIFU·N R L,et al.Research progress of camel milk in adjuvant treatment of diseases[J].China Herbivore Science,2019,39(6):52-55.
[7] AQIB A I,FAKHAR-E-ALAM KULYAR M,ASHFAQ K,et al.Camel milk insuline:Pathophysiological and molecular repository[J].Trends in Food Science &Technology,2019,88:497-504.
[8] JILO K,TEGEGNE D.Chemical composition and medicinal values of camel milk[J].International Journal of Research Studies in Biosciences,2016,4(4):13-25.
[9] KORISH A A,ARAFAH M M.Camel milk ameliorates steatohepatitis,insulin resistance and lipid peroxidation in experimental non-alcoholic fatty liver disease[J].BMC Complementary and Alternative Medicine,2013,13:264.
[10] ZHU W W,KONG G Q,MA M M,et al.Short communication:Camel milk ameliorates inflammatory responses and oxidative stress and downregulates mitogen-activated protein kinase signaling pathways in lipopolysaccharide-induced acute respiratory distress syndrome in rats[J].Journal of Dairy Science,2016,99(1):53-56.
[11] 冯梦雅,崔莉,刘健康,等.骆驼乳的营养价值及在预防疾病中的应用与作用机制研究进展[J].食品科学,2022,43(11):392-401.FENG M Y,CUI LL,LIU J K,et al.Progress in understanding the nutritional value of camel milk and its application and mechanism of action in preventing diseases[J].Food Science,2022,43(11):392-401.
[12] ESLAMI O,SHIDFAR F.Dairy products and chronic kidney disease:protective or harmful? A systematic review of prospective cohort studies[J].Nutrition,2018,55:21-28.
[13] ZHAO W,LI J,LI Y,et al.Preventive Effect of collagen peptides from Acaudina molpadioides on acute kidney injury through attenuation of oxidative stress and inflammation[J].Oxidative Medicine and Cellular Longevity,2022,2022:10.
[14] 刘晓云.精氨酸对绵羊小肠上皮细胞氧化损伤、凋亡和屏障功能的影响机制研究[D].扬州:扬州大学,2023.LIU X Y.Effects of arginine on oxidative injury,apoptosis and barrier function of ovine intestinal epithelial cells[D].Yangzhou:Yangzhou University,2023.
[15] 马威,李小全,王跃玲,等.NGAL和KIM-1检测对脓毒症所致急性肾损伤的诊断价值[J].湖北民族大学学报(医学版),2021,38(3):91-93.MA W,LI X Q,WANG Y L,et al.Diagnostic value of NGAL and KIM-1 in sepsis induced acute kidney injury[J].Journal of Hubei University (Medical Edition),2021,38(3):91-93.
[16] 毕海燕,刘静,侯衍豹,等.肾毒性生物标志物的研究进展及其意义[J].药物评价研究,2019,42(1):204-211.BI H Y,LIU J,HOU Y B,et al.Research progress and significance of biomarkers of nephrotoxicity[J].Drug Evaluation Research,2019,42(1):204-211.
[17] PRASAD J R.Acute kidney injury:Diagnosis and management[J].Indian journal of pediatrics,2020,87(8):600-607.
[18] ZHANG J,LUAN Z L,HUO X K,et al.Direct targeting of sEH with alisol B alleviated the apoptosis,inflammation,and oxidative stress in cisplatin-induced acute kidney injury[J].International Journal of Biological Sciences,2023,19(1):294-310.
[19] MA P,ZHANG S,SU X L,et al.Protective effects of icariin on cisplatin-induced acute renal injury in mice[J].American Journal of Translational Research,2015,7(10):2105-2014.
[20] YU C,DONG H,WANG Q,et al.Danshensu attenuates cisplatin-induced nephrotoxicity through activation of Nrf2 pathway and inhibition of NF-κB[J].Biomedicine &Pharmacotherapy,2021,142:111995.
[21] 符贻武,吴志凯,李佩璇,等.β-胡萝卜素对脂多糖诱导小鼠急性肾损伤的保护作用及机制[J].中国药学杂志,2023,58(4):331-337.FU Y W,WU Z K,LI P X,et al.Effects and mechanism of β-carotene on LPS-induced acute kidney injury of mice[J].Chinese Pharmaceutical Journal,2023,58(4):331-337.
[22] YUAN L,YANG J C,LI Y,et al.Matrine alleviates cisplatin-induced acute kidney injury by inhibiting mitochondrial dysfunction and inflammation via SIRT3/OPA1 pathway[J].Journal of Cellular and Molecular Medicine,2022,26(13):3702-3715.
[23] HAMED H,GARGOURI M,BOULILA S,et al.Fermented camel milk prevents carbon tetrachloride induced acute injury in kidney of mice[J].Journal of Dairy Research,2018,85(2):251-256.
[24] ARAB H H,EID A H,GAD A M,et al.Inhibition of oxidative stress and apoptosis by camel milk mitigates cyclosporine-induced nephrotoxicity:Targeting Nrf2/HO-1 and AKT/eNOS/NO pathways[J].Food Science &Nutrition,2021,9(6):3177-3190.
[25] ARAB H H,ASHOUR A M,ALQARNI A M,et al.Camel milk mitigates cyclosporine-induced renal damage in rats:Targeting p38/ERK/JNK MAPKs,NF-κB,and matrix metalloproteinases[J].Biology,2021,10(5):442.
[26] ARAB H H,SALAMA S A,MAGHRABI I A.Camel milk ameliorates 5-fluorouracil-induced renal injury in rats:Targeting MAPKs,NF-κB and PI3K/Akt/eNOS pathways[J].Cellular Physiology and Biochemistry,2018,46(4):1628-1642.