西番莲(Passiflora edulis Sims)俗称百香果、鸡蛋果、藤桃、受难果、巴西果等,原产南美洲热带地区,在我国广泛栽培于广西、江西、四川、云南等地,全球种植最多的品种包括黄色西番莲和紫色西番莲等[1]。西番莲除了作为水果被人食用以外,还具有医药保健功能,如活血止痛、滋阴补肾、生津止渴等[2]。西番莲果皮作为西番莲加工过程的副产物被废弃,既造成了环境的污染,也造成了极大的资源浪费[3]。从农业食品副产物中回收具有生物活性的化合物是食品科学的一个新兴趋势,这在很大程度上有助于食品加工产生副产物的价值化[4]。西番莲果皮约占整个西番莲质量的51%,富含多糖、黄酮、生物碱、多酚和色素等成分[5]。以西番莲果皮为原料提取多糖,不但可以扩大多糖物质的来源,还可以提高西番莲的附加值。
近年来研究表明,西番莲果皮多糖具有抗氧化[6]、改善肠道健康[7]、降血糖[8]、抗炎[9]、抑菌[10]和益生元[11]等生物活性。目前,西番莲果皮多糖的实验室提取方法有微波辅助法[12]、碱提取法[7]、超声辅助法[13]和热水提取法[14]等。酶辅助提取法是建立在水提法的基础上,通过使用生物酶(如纤维素酶)从植物组织中提取多糖的方法,多糖内嵌蛋白质形成细胞外基质,生物酶可水解植物细胞壁释放多糖和蛋白质,提高多糖提取速率[15]。ZHU等[16]利用复合酶于50 ℃条件下提取粗绿茶多糖30 min,提取率比热水浸提法高4.52%。CHEN等[17]用不同的提取工艺对竹笋多糖的益生潜力做比较,结果表明,超声提取和酶促提取是提高竹笋多糖益生潜力的有效方法。
目前,尚未见关于酶法提取西番莲果皮多糖的工艺及生物活性等的研究报道,课题组已有关于西番莲果皮多糖的传统水浴提取法及微波辅助提取法的研究,西番莲果皮中果胶含量为12.5%[14],因此本研究选用果胶酶提取西番莲果皮中的多糖,L9(34)正交试验优化酶法提取西番莲果皮多糖的工艺,并对酶法提取的西番莲果皮多糖的抗氧化活性和其对4种益生菌的增殖作用进行初步探究,以期为提高西番莲的综合利用价值以及为酶法提取西番莲果皮多糖提供一定的技术参考。
1 材料与方法
1.1 材料与试剂
紫色西番莲,桂林万禾农产品有限公司;果胶酶(酶活力≥30 U/mg),酷尔生物;植物乳杆菌、德氏乳杆菌保加利亚亚种、短乳杆菌和嗜热链球菌,广东省微生物菌种保藏中心,菌种编号依次为GIM1.191、GIM1.155、GIM1.773和GIM1.540;MRS培养基、无葡萄糖的MRS培养基,上海博微生物科技有限公司;苯酚、氢氧化钠,罗恩试剂;无水葡萄糖、浓硫酸、盐酸、磷酸二氢钠,西陇科学股份有限公司;磷酸氢二钠,成都市科龙化工试剂厂;铁氰化钾,上海麦克林生化科技股份有限公司;三氯化铁、1.1-二苯基-2-苦基肼、低聚果糖,上海源叶生物科技有限公司;抗坏血酸,上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
800Y高速多功能粉碎机,永康市铂欧五金制品有限公司;PHS-25pH计,上海越平科学仪器(苏州)制造有限公司;ALPHA1-2 LD冷冻干燥机,德国Martin Christ公司;YK722PC紫外可见分光光度计,北京瑞利分析仪器有限公司;LRH-250-Z振荡培养箱,韶关市泰宏医疗器械有限公司;YSQ-LS-303Ⅱ立式压力蒸汽灭菌锅,上海申安医疗器械厂;iMARK酶标仪,北京京科瑞达科技有限公司。
1.3 实验方法
1.3.1 多糖提取
1.3.1.1 西番莲样品预处理
新鲜的紫色西番莲果皮洗净,剪成块状,75%(体积分数)乙醇溶液按1∶20(g∶mL)于75 ℃下醇提2 h,共3次,收集残渣,于50 ℃下烘干。按料液比1∶16(g∶mL)将干燥的残渣用煎药机于100 ℃下煎煮2 h,共3次,收集残渣,洗净,于50 ℃下烘干,干燥后的西番莲果皮粉碎,过50目筛备用。
1.3.1.2 酶法提取西番莲果皮多糖
精确称取过50目筛的西番莲果皮干粉2 g,按照1∶25(g∶mL)料液比加入蒸馏水50 mL,通过添加0.5 mol/mL HCl溶液及0.5 mol/mL NaOH溶液将悬浮液调节到一定pH,10 min后,再次调整pH值,获得稳定的pH值后,加一定的酶在一定温度下提取一定时间,100 ℃煮沸10 min使果胶酶失活,冷却至室温,抽滤取滤液,滤液定容至50 mL,得西番莲果皮多糖提取液,浓缩至约10 mL,冷冻干燥得酶提西番莲果皮多糖。
1.3.2 多糖得率测定
采用苯酚-硫酸法[18]测定糖含量。分别吸取0、0.2、0.4、0.6、0.8、1 mL葡萄糖标准溶液(准确称取10 mg的无水葡萄糖,用少量蒸馏水溶解,定容至100 mL 容量瓶)加入各试管,并用蒸馏水补至1 mL,每个浓度重复3个平行,分别加入0.5 mL的6%苯酚溶液及2.5 mL浓硫酸,振荡均匀,放至室温,于490 nm测吸光度值。以葡萄糖浓度为横坐标,A490值为纵坐标,作标准曲线。回归方程为y=14.607x+0.063 3,R2=0.998 7。
取1 mL西番莲果皮多糖粗酶提取液,蒸馏水稀释50倍,取稀释后的样液1 mL。按上述标准曲线添加顺序和操作加入多糖样品和试剂,于490 nm测吸光度值,对比标准曲线求出糖含量,计算出酶法提取西番莲果皮粗多糖的得率,如公式(1)所示:
(1)
[:Y为酶法提取西番莲果皮粗多糖的得率,%;x为葡萄糖标准曲线上对应浓度,mg/mL;V1为吸取的样液体积,mL;V2为粗酶提取液定容后的总体积,mL;N为稀释倍数;m为西番莲果皮干粉质量,mg。
1.3.3 单因素试验设计
固定料液比为1∶25(g∶mL),在果胶酶加酶量为5 mg/mL,pH值为4,提取温度为50 ℃,提取时间为2 h的条件下,分别考察加酶量(3、4、5、6、7 mg/mL)、pH值(3、3.5、4、4.5、5)、提取温度(30、40、50、60、70 ℃)和提取时间(1、1.5、2、2.5、3 h)等对酶提西番莲果皮多糖得率的影响。按1.3.1.2节及1.3.2节操作,通过统计软件分析确定酶添加量、pH值、提取温度和提取时间这4个因素的试验水平。
1.3.4 正交试验设计
在单因素试验基础上,依据表1进行正交试验,按1.3.1.2节及1.3.2节操作,计算酶提西番莲果皮多糖的得率,分析确定酶法提取西番莲果皮多糖的最佳条件。
表1 正交试验因素水平表
Table 1 Orthogonal test factor level table
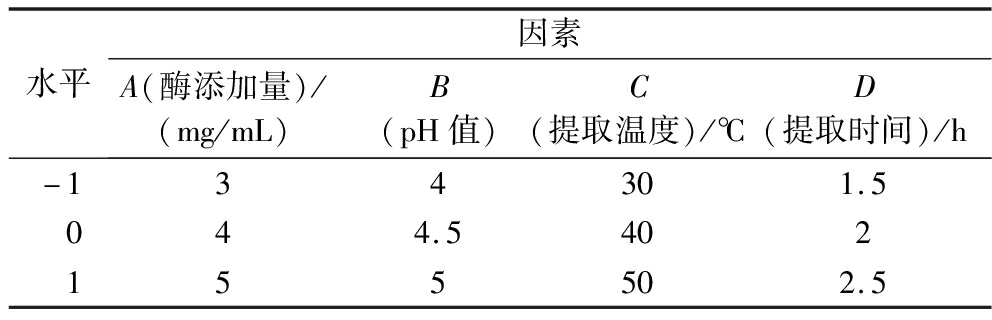
水平因素A(酶添加量)/(mg/mL)B(pH值)C(提取温度)/℃D(提取时间)/h-134301.5044.5402155502.5
1.3.5 红外光谱扫描
采用傅里叶变换红外光谱仪进行测定。称取西番莲果皮多糖10 mg,KBr与西番莲果皮多糖质量比100∶1,研磨干燥后,用KBr压片法测其红外光谱,扫描波普为400~4 000 cm-1。
1.3.6 紫外光谱扫描
配制质量浓度为0.25 mg/mL的西番莲果皮多糖溶液,用紫外分光光度计对多糖样液进行扫描,扫描范围为200~400 nm,观察280 nm处有无蛋白质的特征吸收峰。
1.3.7 酶提西番莲果皮多糖的抗氧化能力测定
1.3.7.1 DPPH自由基清除率测定
实验方法参考李霞等[19]。
1.3.7.2 羟自由基清除率测定
实验方法参考CHAI等[20]。
1.3.7.3 还原能力测定
实验方法参考李霞等[19]。
1.3.8 体外益生菌培养
1.3.8.1 菌种活化
配制50 mL MRS培养基,移至锥形瓶中,121 ℃灭菌20 min,在超净工作台上将甘油保存的菌种接种于液体培养基中,在37 ℃恒温培养箱中培养48 h。然后配制MRS琼脂培养基,使用平板划线法将活化过的菌种接种于平板,37 ℃培养至形成明显的菌落,挑取长势较好的单一菌落再接种至MRS液体培养基,37 ℃培养12 h后用于生长曲线测定。
1.3.8.2 生长曲线的测定
实验方法参考杨可等[21],具体步骤如下。取100 μL活化好的植物乳杆菌、短乳杆菌、德氏乳杆菌和嗜热链球菌(细菌浓度为109CFU/mL)接种至200 μL 2%加不同碳源(FOS、西番莲果皮多糖)的不含葡萄糖的MRS培养基中,每组3个重复,不含葡萄糖的MRS培养基作空白对照。将接种好的培养基转移至37 ℃恒温培养箱培养,在接种后的24 h内,每隔2 h测定OD570nm值,在30、36 h测定OD570nm值。
1.4 数据处理
采用Origin 2018 64 Bit和正交设计助手Ⅱ V3.1软件对实验数据进行作图和统计分析。
2 结果与分析
2.1 单因素试验
2.1.1 酶添加量
由图1-A可知,随着果胶酶添加量的增加,酶提西番莲果皮多糖的得率呈先增大后降低的趋势。当果胶酶用量为4 mg/mL时,多糖得率达到最大值(13.49±0.08)%,继续增加果胶酶用量,多糖得率逐渐下降。这可能是因为当果胶酶用量达到一定程度时,果胶酶的酶解程度已趋于最大化,此时,酶添加量再增加,会造成酶之间出现竞争底物的现象,从而抑制果胶酶的催化作用,致使多糖的得率下降[22]。因此,果胶酶添加量选择在3、4、5 mg/mL上进行正交设计。

A-果胶酶添加量;B-pH值;C-提取温度;D-提取时间
图1 各因素对西番莲果皮多糖得率的影响
Fig.1 Effect of various factors on yield of P.edulis peel polysaccharide
2.1.2 pH值
由图1-B可知,pH值在3~4.5内增加,酶提西番莲果皮多糖的得率逐渐增大,在pH值为4.5时,得率达到峰值(14.26±0.09)%,随后pH值继续增加,多糖得率略有降低。原因可能是在pH值为4.5时,果胶酶的空间结构较为稳固,pH值低于或高于4.5时,果胶酶的空间结构遭到不同程度的破坏,从而引起酶构象和酶活力的相应变化,导致多糖得率下降[23]。因此,pH值选取4、4.5、5进行正交设计。
2.1.3 提取温度
由图1-C可知,随着提取温度的上升,酶提西番莲果皮多糖的得率先升高后逐渐降低。当提取温度为40 ℃时,酶提西番莲果皮多糖的得率达到最大值(13.43±0.06)%,继续升高提取温度,酶提西番莲果皮多糖的得率下降。这是由于酶的活性受提取温度影响较大,适当的提高提取温度对增强多糖的溶出传质动力起促进作用,从而提高酶提西番莲果皮多糖的得率,但当提取温度高于果胶酶提取西番莲果皮多糖的最适温度时,酶活性降低或者部分酶失活,从而降低了得率[24]。因此,提取温度选择30、40、50 ℃进行正交设计。
2.1.4 提取时间
由图1-D可知,提取时间为2 h时,得率达到峰值(12.96±0.09)%。因此,提取时间选取1.5、2、2.5 h进行正交设计。
2.2 正交试验结果分析
通过表2极差分析可知,影响酶法提取西番莲莲果皮多糖的得率的因素主次顺序为A>B>D>C,因此,酶法辅助提取西番莲果皮多糖的最优工艺组合为A3B2D2C2,即果胶酶添加量5 mg/mL、pH值4.5、提取时间2 h、提取温度40 ℃,此条件下做3组重复实验,计算得酶法提取西番莲果皮多糖的得率为15.83%,比正交试验的最高值(15.01±0.15)%高,表明工艺优化成功。李霞[7]等用传统水浴提取法和微波辅助提取法分别提取西番莲果皮多糖,得率分别为(9.17±0.36)%和(14.12±0.42)%,酶法辅助提取西番莲果皮多糖的得率较传统水浴提取法和微波辅助提取法明显更高,是传统水浴提取法的1.7倍。
表2 正交试验设计和结果
Table 2 Orthogonal experimental design and results
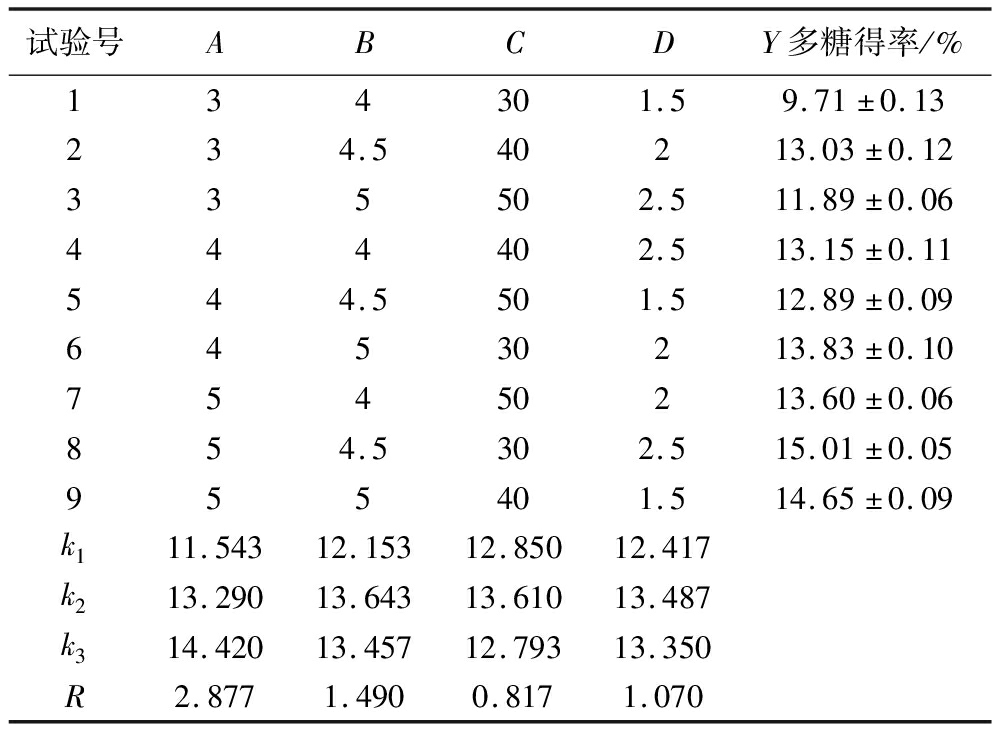
试验号ABCDY多糖得率/%134301.59.71±0.13234.540213.03±0.12335502.511.89±0.06444402.513.15±0.11544.5501.512.89±0.0964530213.83±0.1075450213.60±0.06854.5302.515.01±0.05955401.514.65±0.09k111.54312.15312.85012.417k213.29013.64313.61013.487k314.42013.45712.79313.350R2.8771.4900.8171.070
2.3 红外光谱分析结果
傅立叶变换红外光谱是分析多糖中官能团类型和振动的有效方法。成分的结构特征可以从光谱中推断出来[25]。由图2可以看出,提取物具有多糖的一般吸收特征峰,3 437 cm-1处为糖结构中—OH的O—H的伸缩振动,2 954 cm-1处为糖结构中C—H的伸缩振动[26],1 594、1 359 cm-1处分别对应酯基或羧基中C![]() O和CO—的伸缩振动,这表明提取物中含有糖醛酸[27],1 069、775、631 cm-1的吸收峰表明存在吡喃糖残基[28],870 cm-1附近的吸收峰为β-D糖苷键构型或甘露糖的吸收峰[29]。傅里叶变换红外光谱表明,提取物符合多糖的基本特征。
O和CO—的伸缩振动,这表明提取物中含有糖醛酸[27],1 069、775、631 cm-1的吸收峰表明存在吡喃糖残基[28],870 cm-1附近的吸收峰为β-D糖苷键构型或甘露糖的吸收峰[29]。傅里叶变换红外光谱表明,提取物符合多糖的基本特征。

图2 傅里叶变换红外光谱图
Fig.2 Fourier transform infrared spectrogram
2.4 紫外光谱分析结果
由图3可知,西番莲果皮多糖在280 nm处存在小吸收峰,说明多糖样品中含少量蛋白质。

图3 紫外吸收光谱图
Fig.3 Ultraviolet absorption spectrum
2.5 酶提西番莲果皮多糖抗氧化活性
2.5.1 DPPH自由基清除效果
酶提西番莲果皮多糖对DPPH自由基的清除能力如图4所示。整体而言,酶提西番莲果皮多糖对DPPH自由基的清除率随着浓度的升高而上升,多糖质量浓度为3.2 mg/mL时,对DPPH自由基的清除率为(71.09±2.67)%。李霞等[12]通过微波辅助法提取西番莲果皮多糖,多糖质量浓度为1.0 mg/mL时,对DPPH自由基的清除率为74.02%。
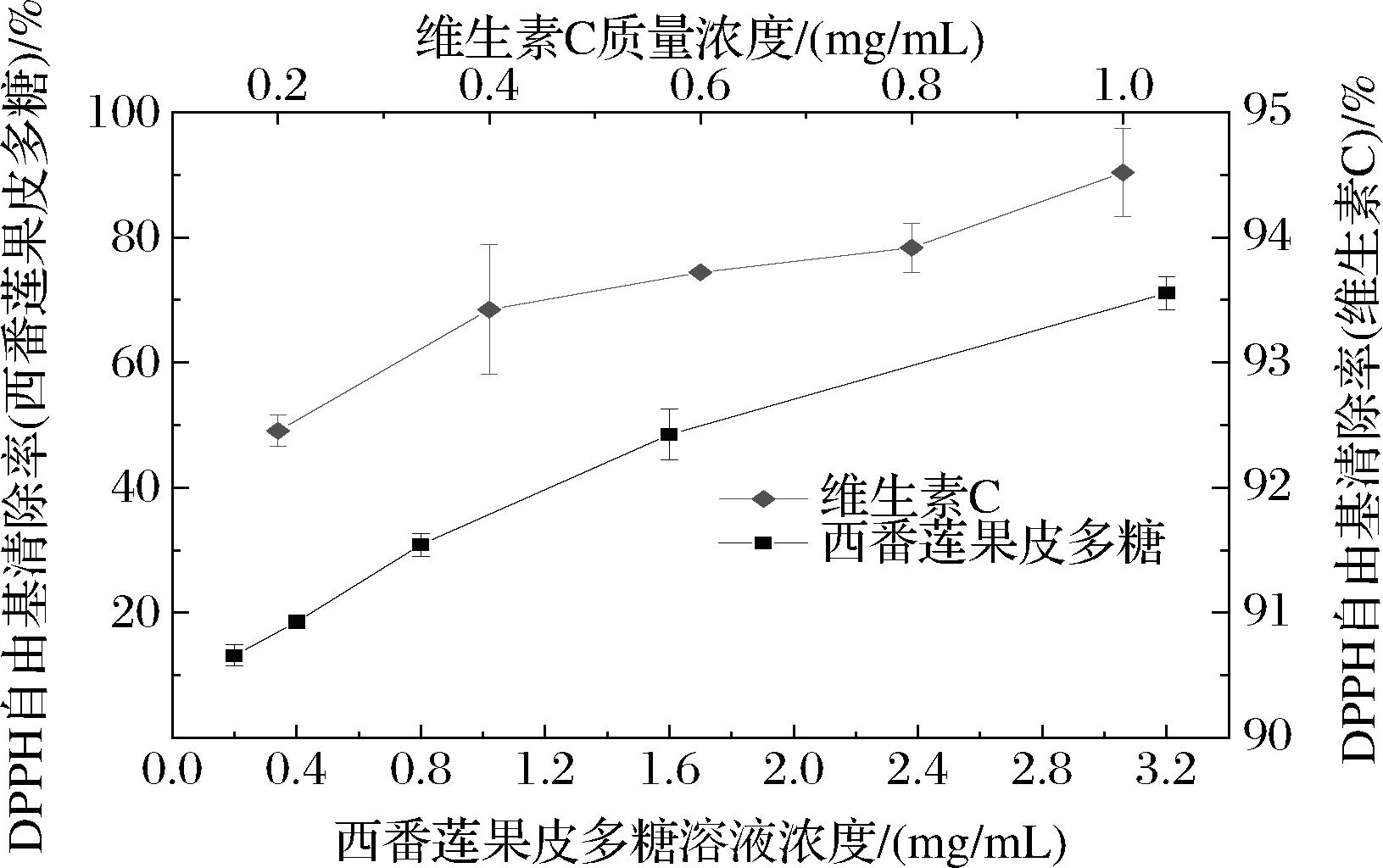
图4 西番莲果皮多糖对DPPH自由基的清除作用
Fig.4 Scavenging effect of P.edulis peel polysaccharide on DPPH free radicals
2.5.2 羟自由基清除效果
酶提西番莲果皮多糖对羟自由基的清除能力如图5所示。整体而言,酶提西番莲果皮多糖对羟自由基的清除率随着浓度的升高而上升,多糖质量浓度为3.2 mg/mL时,对羟自由基的清除率为(26.78±1.63)%。李霞等[12]通过微波辅助法提取西番莲果皮多糖,多糖质量浓度达到1.0 mg/mL时,对羟自由基清除率为14.41%。
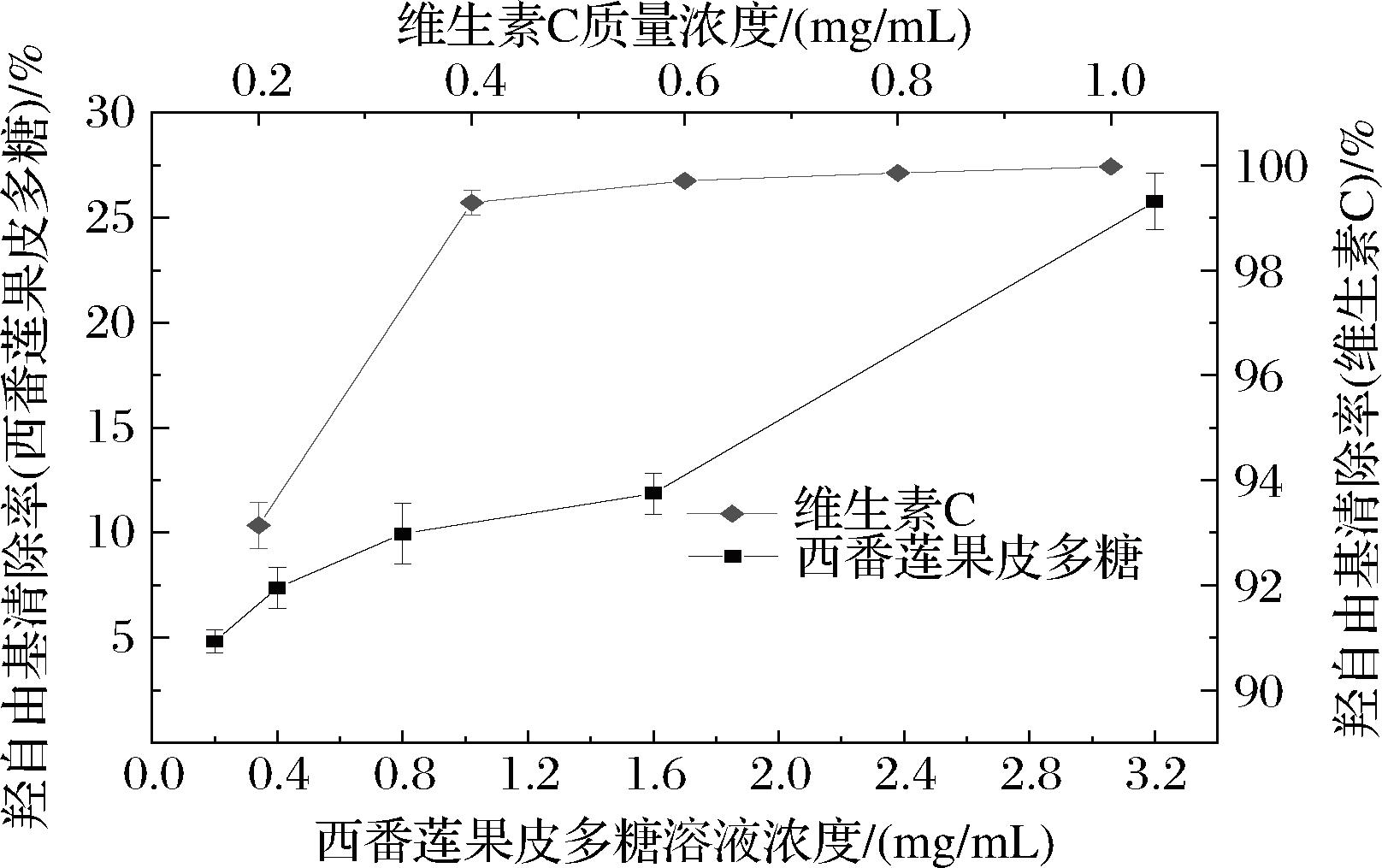
图5 西番莲果皮多糖对羟自由基的清除作用
Fig.5 Scavenging effect of P.edulis peel polysaccharide on hydroxyl radical
2.5.3 还原能力
如图6所示,酶提西番莲果皮多糖的还原能力随着浓度的升高而上升,维生素C的还原能力显著优于酶提西番莲果皮多糖,当多糖质量浓度为3.2 mg/mL时,吸光度值为0.45±0.03。表明酶提西番莲果皮多糖对Fe3+有较好的还原能力。
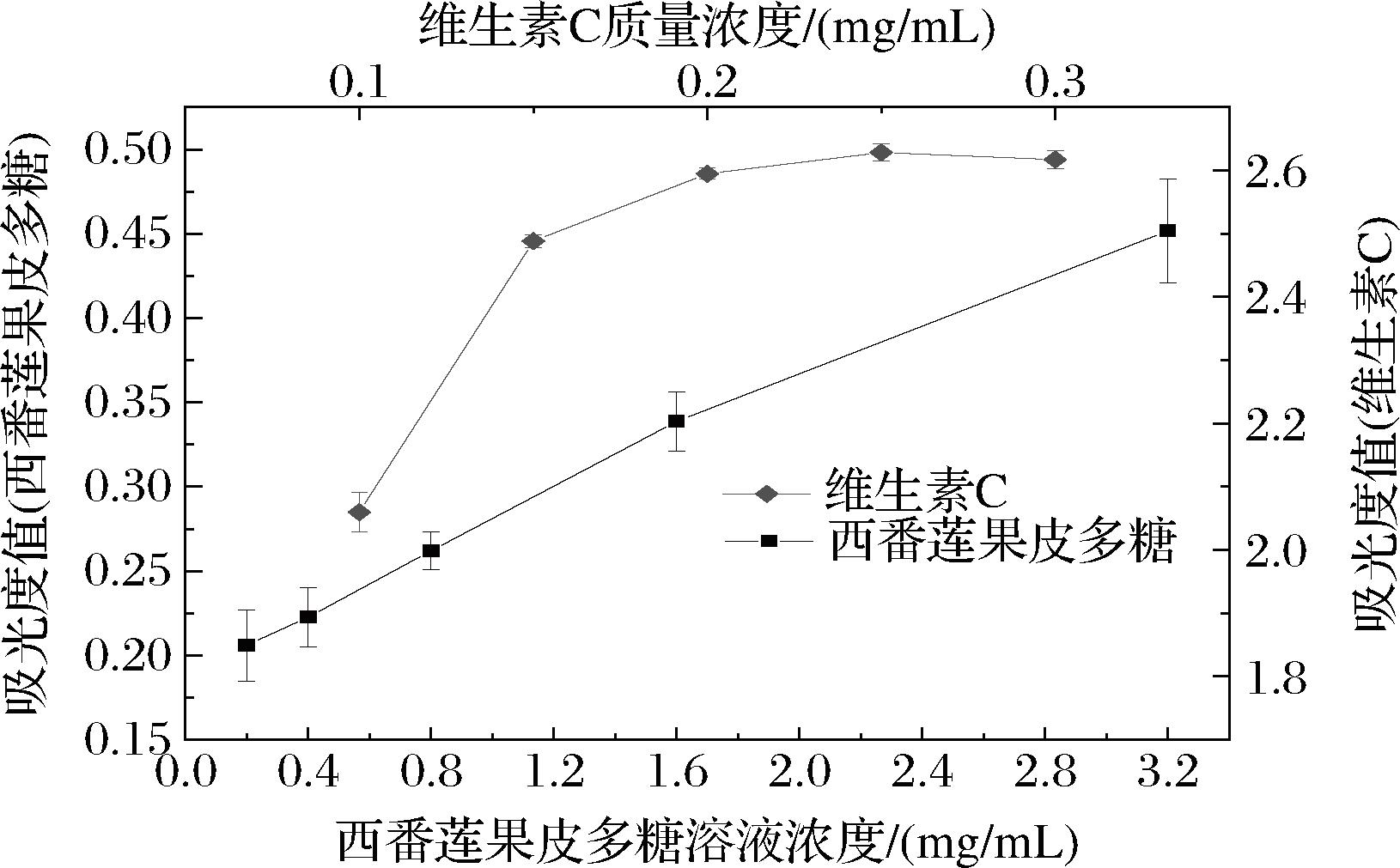
图6 西番莲果皮多糖的还原能力
Fig.6 Eduction ability of P.edulis peel polysaccharide
2.6 酶提西番莲果皮多糖的益生菌增值作用
西番莲果皮多糖对德氏乳杆菌保加利亚亚种、植物乳杆菌、嗜热链球菌、短乳杆菌生长曲线的影响如图7所示。对上述4种菌在西番莲果皮多糖作碳源培养基上的生长曲线作拟合曲线,分别为:y=0.000 1x3-0.006 8x2+0.123 9x+1.289 7(R2=0.906 3)、y=0.000 1x3-0.008 6x2+0.159 9x+1.142 8(R2=0.924 8)、y=0.000 1x3-0.007 5x2+0.139 5x+1.032 9(R2=0.919 6)和y=0.000 1x3-0.006 9x2+0.125 1x+1.285 1(R2=0.908 6)。计算得上述4种菌在西番莲果皮多糖作碳源培养基上的最大生长速率分别为:0.123 9、0.159 9、0.139 5和0.125 1。以OD570nm大小代表实验菌体的生长状况,如图7-A、图7-B和图7-D所示,德氏乳杆菌保加利亚亚种、植物乳杆菌和短乳杆菌在西番莲果皮多糖培养基中的生长趋势相近,生长期均约处在0~10 h;而在FOS培养基中,3种菌的生长期分别约在0~16 h、0~12 h、0~14 h。如图7-C所示,嗜热链球菌在西番莲果皮多糖和FOS培养基中的生长期约在0~8 h和0~14 h。整体而言,4种菌在西番莲果皮多糖培养基中生长期比在FOS培养基中的短;生长期排序为:德氏乳杆菌保加利亚亚种>短乳杆菌>植物乳杆菌>嗜热链球菌,最大生长速率排序为:植物乳杆菌>嗜热链球菌>短乳杆菌>德氏乳杆菌保加利亚亚种。
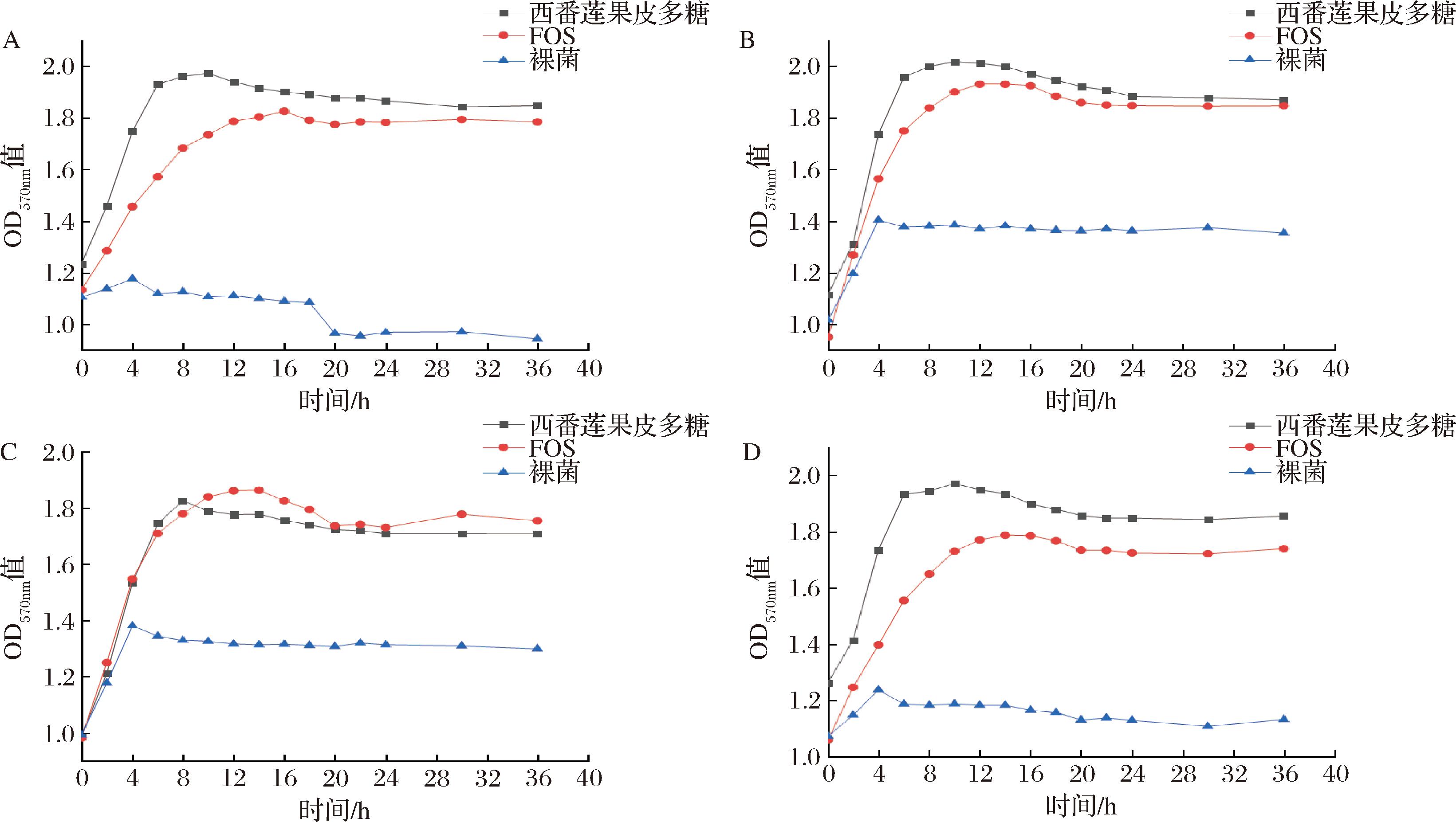
A-德氏乳杆菌保加利亚亚种;B-植物乳杆菌;C-嗜热链球菌;D-短乳杆菌
图7 四种菌的生长曲线
Fig.7 Growth curves of the four species
3 结论
经优化确定了果胶酶辅助提取西番莲果皮多糖的最佳条件:果胶酶添加量5 mg/mL,pH 4.5,提取温度40 ℃,提取时间2 h,此条件下西番莲果皮多糖的得率为(15.83±0.07)%,得率是传统水浴提取法的1.7倍,高于微波辅助提取法的得率(14.12±0.42)%。通过体外抗氧化实验充分证明了酶法提取番莲果皮多糖具有一定的抗氧化活性。在一定浓度范围内,酶提西番莲果皮多糖与还原能力及DPPH自由基和羟自由基清除率存在一定计量依赖关系。多糖溶液质量浓度为3.2 mg/mL时,DPPH自由基清除率、羟自由基清除率和还原能力分别为(71.09±2.67)%、(26.78±1.63)%和0.45±0.03。通过体外益生作用实验表明:酶提西番莲果皮多糖对4种菌均有一定的益生作用,4种菌在西番莲果皮多糖培养基中生长期排序为:德氏乳杆菌保加利亚亚种>短乳杆菌>植物乳杆菌>嗜热链球菌。由此可见,酶提西番莲果皮多糖具有得率较高、抗氧化能力较强、有一定益生作用的特点,不仅提高了西番莲果皮的综合利用价值,还可以让西番莲果皮多糖作为功能成分在食品进一步应用与发展。
[1] FONSECA A M A,GERALDI M V,JUNIOR M R M,et al.Purple passion fruit (Passiflora edulis f.edulis):A comprehensive review on the nutritional value,phytochemical profile and associated health effects[J].Food Research International,2022,160:111665.
[2] 赵兴蕊,陈玲玲,王洪云,等.西番莲属植物资源的研究概况[J].云南化工,2021,48(4):17-19;23.ZHAO X R,CHEN L L,WANG H Y,et al.A survey on the plant resources of passionflower[J].Yunnan Chemical Technology,2021,48(4):17-19;23.
[3] 刘纯友,殷朝敏,黄永春,等.百香果皮多糖的分离纯化、结构特性及生物活性研究进展[J].食品工业科技,2018,39(8):335-340;351.LIU C Y,YIN C M,HUANG Y C,et al.Progress in extraction,separation and purification,structural characteristics and bioactivities of polysaccharides of Passiflora edulis peel[J].Science and Technology of Food Industry,2018,39(8):335-340;351.
[4] C0RR A R C G,PERALTA R M,HAMINIUK C W I,et al.The past decade findings related with nutritional composition,bioactive molecules and biotechnological applications of Passiflora spp.(passion fruit)[J].Trends in Food Science &Technology,2016,58:79-95.
A R C G,PERALTA R M,HAMINIUK C W I,et al.The past decade findings related with nutritional composition,bioactive molecules and biotechnological applications of Passiflora spp.(passion fruit)[J].Trends in Food Science &Technology,2016,58:79-95.
[5] 陈玲玲,赵兴蕊,王洪云,等.西番莲属植物化学成分的研究进展[J].云南化工,2021,48(10):1-3.CHEN L L,ZHAO X R,WANG H Y,et al.Research progress on chemical constituents of Passiflora[J].Yunnan Chemical Technology,2021,48(10):1-3.
[6] XIONG F,LI X,ZHENG L H,et al.Characterization and antioxidant activities of polysaccharides from Passiflora edulis Sims peel under different degradation methods[J].Carbohydrate Polymers,2019,218:46-52.
[7] 李霞,陈海鸥,尚一帆,等.西番莲果皮多糖改善肠道功能及降血糖活性[J].桂林理工大学学报,2021,41(4):864-868.LI X,CHEN H O,SHANG Y F,et al.Improvement of intestine function and hypoglycemic activity in polysaccharide from Passiflora edulis Sims peel[J].Journal of Guilin University of Technology,2021,41(4):864-868.
[8] GUAN Y,SUN H F,CHEN H Y,et al.Physicochemical characterization and the hypoglycemia effects of polysaccharide isolated from Passiflora edulis Sims peel[J].Food &Function,2021,12(9):4221-4230.
[9] TENG H,HE Z G,LI X Y,et al.Chemical structure,antioxidant and anti-inflammatory activities of two novel pectin polysaccharides from purple passion fruit (Passiflora edulia Sims) peel[J].Journal of Molecular Structure,2022,1264:133309.
[10] 张帅,程昊.百香果壳粗多糖的提取及其抑菌性检测[J].中国食品添加剂,2018(11):182-187.ZHANG S,CHENG H.Extraction and antimicrobial activities detection of crude polysaccharides from passion fruit husk[J].China Food Additives,2018(11):182-187.
[11] SUN Y J,GUAN Y,KHOO H E,et al.In vitro assessment of chemical and pre-biotic properties of carboxymethylated polysaccharides from Passiflora edulis peel,xylan,and citrus pectin[J].Frontiers in Nutrition,2021,8:778563.
[12] 李霞,熊峰,覃献杏,等.西番莲果皮多糖微波辅助提取工艺优化及其体外抗氧化性[J].食品工业科技,2018,39(15):141-146.LI X,XIONG F,QIN X X,et al.Optimization of microwave-assisted extraction process of polysaccharide from Passiflora edulis Sims peel and evaluation of antioxidant activity in vitro[J].Science and Technology of Food Industry,2018,39(15):141-146.
[13] 滕浩,曾媚,王敬涵,等.西番莲果皮多糖的提取、结构鉴定及流变性分析[J].食品科技,2021,7(10):189-193.TENG H,ZENG M,WANG J H,et al.Extraction,structural identification and rheological analysis of polysaccharide from Passiflora edulis Sims peel[J].Food Science and Technology,2021,7(10):189-193.
[14] 文良娟,毛慧君,张元春,等.西番莲果皮成分分析及其抗氧化活性的研究[J].食品科学,2008,29(11):54-58.WEN L J,MAO H J,ZHANG Y C,et al.Study on compositions and antioxidant activity of Passiflora edulis rind[J].Food Science,2008,29(11):54-58.
[15] 贾朋贺,刘红,杨定国,等.植物多糖的提取、修饰及其糖代谢作用[J].食品研究与开发,2022,8(5):210-216.JIA P H,LIU H,YANG D G,et al.Extraction,modification and glucose metabolism of plant polysaccharides[J].Food Research and Development,2022,8(5):210-216.
[16] ZHU J X,CHEN Z Y,ZHOU H,et al.Effects of extraction methods on physicochemical properties and hypoglycemic activities of polysaccharides from coarse green tea[J].Glycoconjugate Journal,2020,37(2):241-250.
[17] CHEN G J,CHEN X H,YANG B,et al.New insight into bamboo shoot (Chimonobambusa quadrangularis) polysaccharides:Impact of extraction processes on its prebiotic activity[J].Food Hydrocolloids,2019,95:367-377.
[18] 姚欣,孙宁云,陈鑫,等.山竹壳多糖提取工艺优化及其生物活性研究[J].食品研究与开发,2022,43(15):101-108.YAO X,SUN N Y,CHEN X,et al.Optimization of the extraction of mangosteen (Garcinia mangostana) pericarp polysaccharides and determination of their biological activities[J].Food Research and Development,2022,43(15):101-108.
[19] 李霞,胡楠,陈齐琳,等.西番莲叶多糖提取工艺的优化及其体外抗氧化活性研究[J].中国调味品,2020,45(10):153-157;162.LI X,HU N,CHEN Q L,et al.Study on optimization of extraction process of polysaccharides from Passiflora edulis L.leaves and their antioxidant activity in vitro[J].China Condiment,2020,45(10):153-157;162.
[20] CHAI Y Y,KAN L B,ZHAO M.Enzymatic extraction optimization,anti-HBV and antioxidant activities of polysaccharides from Viscum coloratum (Kom.) Nakai[J].International Journal of Biological Macromolecules,2019,134:588-594.
[21] 杨可,李霞,李海鹏,等.西番莲果皮多糖锌的结构表征和益生元作用[J].食品工业科技,2023,44(17):27-34.YANG K,LI X,LI H P,et al.Structural characterization and prebiotic effects of Passiflora edulis Sims peel polysaccharide-zinc[J].Science and Technology of Food Industry,2023,44(17):27-34.
[22] 吴金松,陈光静,马志伟,等.酶法辅助提取甘蔗渣中水溶性多糖的工艺优化[J].中国调味品,2019,44(2):70-74;79.WU J S,CHEN G J,MA Z W,et al.Optimization of enzymatic assisted extraction of water-soluble polysaccharides from bagasse[J].China Condiment,2019,44(2):70-74;79.
[23] 丁霄霄,李凤伟,商曰玲,等.灵芝多糖的复合酶法提取工艺优化[J].食品研究与开发,2020,41(5):34-39;53.DING X X,LI F W,SHANG Y L,et al.Optimization of extraction technology of Ganoderma lucidum polysaccharide by enzyme complex[J].Food Research and Development,2020,41(5):34-39;53.
[24] 韩艳丽,凡军民,李静,等.果胶酶-微波法提取茶树花多糖的工艺[J].江苏农业科学,2017,45(2):166-168.HAN Y L,FAN J M,LI J,et al.Extraction of tea flower polysaccharide by pectinase-microwave method[J].Jiangsu Agricultural Sciences,2017,45(2):166-168.
[25] ZHAO Z W,WANG L,RUAN Y,et al.Physicochemical properties and biological activities of polysaccharides from the peel of Dioscorea opposita Thunb.extracted by four different methods[J].Food Science and Human Wellness,2023,12(1):130-139.
[26] 江飞凤,谭晓辉,胡鹏刚,等.超声-微波协同提取柚子皮多糖工艺优化及单糖组成、结构和抗氧化活性分析[J].食品与发酵工业,2021,47(2):196-204.JIANG F F,TAN X H,HU P G,et al.Optimization of ultrasonic-microwave extraction process of pomelo peel polysaccharide and analysis of monosaccharide composition,structure and antioxidant activity[J].Food and Fermentation Industries,2021,47(2):196-204.
[27] 景永帅,马云凤,李明松,等.植物多糖结构解析方法研究进展[J].食品工业科技,2022,43(3):411-421.JING Y S,MA Y F,LI M S,et al.Research progress in analytical methods for structures of phytogenic polysaccharides[J].Science and Technology of Food Industry,2022,43(3):411-421.
[28] 赵小亮,吕友晶,李苗苗,等.杜梨(Pyrus betulifolia Bge.)多糖提取工艺及其清除自由基活性[J].食品与生物技术学报,2012,31(3):276-282.ZHAO X L,LYU Y J,LI M M,et al.Extracting technology and free radical scavenging activity of polysaccharide from Pyrus betulifolia Bge.fruits[J].Journal of Food Science and Biotechnology,2012,31(3):276-282.
[29] 冯燕茹,刘玮,杨继国.不同分子量羧甲基茯苓多糖的制备及其抗氧化活性的研究[J].中国食品添加剂,2019,30(3):67-74.FENG Y R,LIU W,YANG J G.Preparation of carboxymethylated pachyman with different molecular weight and study on its antioxidative activity[J].China Food Additives,2019,30(3):67-74.